1.本发明属于化合物合成技术领域,具体涉及一种手性二氢色酮-2-羧酸类化合物及其衍生物的制备方法。
背景技术:
2.二氢色酮类化合物及其衍生物广泛存在于天然产物及药物活性分子中,具有抗肿瘤、抗菌、抗糖尿病、抗氧化、抗炎、神经保护作用等广泛的药理活性。此外,该类化合物还可通过其上羰基丰富的化学反应,如还原成醇得到色原醇、还原为亚甲基得到苯并吡喃骨架、与羟胺成肟等,以及骨架上取代基衍生的系列反应,构筑结构新颖的化合物分子,为创新药物研究提供化学实体,在有机合成领域和药物化学研究中均具有重要价值。下式列出了一些代表性的生物活性二氢色酮类及由其衍生的天然产物及药物分子。
3.硫代二氢色酮、二氢喹啉酮类化合物是二氢色酮的类似物,它们虽然在天然产物中含量较二氢色酮类化合物少,但也已被报道具有广泛的药理活性,甚至相较二氢色酮类化合物活性更高。
4.目前,尽管已有大量二氢色酮合成的相关报道,但是其中立体选择性的例子还相对局限。在已有合成手性二氢色酮类化合物的方法中,由c2或/和c3取代的色酮类化合物经不对称催化氢化反应得到光学纯二氢色酮是最为直接高效的方法。过渡金属催化的不对称催化氢化反应具有原子经济性高、绿色环保、操作简便等优势,在学术界和工业界占据着重要的地位。2013年,glorius等人报道了手性钌氮杂卡宾络合物(ru-nhc)催化的c2取代色酮类化合物的不对称还原,在该催化体系下,色酮类化合物被完全还原成色原醇类化合物,然后通过pcc选择性氧化仲醇得到c2位光学纯的二氢色酮类化合物。该方法底物适用性广泛、产率高、对映选择性高达91% ee。
5.同年,metz课题组报道了一种手性金属配合物催化的动力学拆分制备光学纯二氢
色酮类化合物的方法。以铑(iii)/双胺配合物作为催化剂,在甲酸和三乙胺存在下,通过不对称氢转移反应得到二氢色酮和色原醇。他们还利用该催化体系高效合成了一种具有药理活性的异戊二烯基二氢色酮。
6.2017年,汪君课题组实现了铜配合物硅氢催化剂催化c2取代色酮类化合物的不对称还原反应得到系列手性二氢色酮类化合物,该反应选用硅氢作氢源,且采用非贵金属催化剂,对环境影响较小,具有一定优势。此外,该催化体系在硫代二氢色酮的合成中,也取得了较为出色的反应结果。但是所用催化剂量较高(高达20 mol%),限制了其工业化应用。
7.2018年,张万斌课题组采用自主研发的ruphox-ru配合物催化剂,催化c2取代色酮的不对称还原,以高达99%的化学收率,》20:1的非对映选择性及99%的立体选择性得到手性色原醇,在pcc存在下氧化得到手性二氢色酮类化合物。此外,他们还通过控制实验表明该反应经历了c=c和c=o双键的连续氢化过程。
8.上述催化体系都取得了优异的催化效果,但也存在一定的问题,比如glorius和张万斌课题组报道的催化体系对色酮类化合物的还原不具有官能团选择性,都直接得到手性色原醇,需要再经过氧化反应才能得到二氢色酮类化合物。此外,已报道的不对称还原的例子中,c2位取代基均主要为烷基或芳基,只有汪君课题组开发的催化体系尝试了两例c2位酯基取代的色酮类化合物的还原。但事实上,c2位活性官能团(如羧基、酯基、氰基等)的引入,有利于该类手性二氢色酮骨架的进一步衍生与丰富,以更广泛地用于有机合成和创新药物研究中。因此,针对现有催化体系存在的上述两方面的问题,本发明报道的催化体系具有明显的优势。
技术实现要素:
9.为了克服上述现有技术的不足,本发明的目的在于提供一种手性二氢色酮-2-羧酸类化合物及其衍生物的制备方法和应用。
10.为达到此目的,本发明采用以下技术方案:一种手性二氢色酮-2-羧酸类化合物及其衍生物的制备方法,在手性金属配合物催化剂催化下i所示原料发生不对称催化氢化反应得到ii所示手性二氢色酮-2-羧酸类化合物及其衍生物,反应式如下:其中,x是o、s、nh或n-r’, r’为仲胺保护基;r1为氢、c1-c6烷基、c1-c6烷氧基、c1-c6全氟烷基、卤素、苯基、苄基、萘基、酯基、杂环取代基、氨基或胺基中的任意一种或至少两种的组合;r2为羟基、烷氧基、芳氧基或胺基; r3为c1-c8烷基、苯基、苄基、萘基、杂环取代基;*标注位置表示手性碳原子,n为0-4的整数。
11.通过手性金属催化剂催化的不对称氢化反应,经过一步反应得到ii所示手性二氢色酮-2-羧酸类化合物及其衍生物,解决了现有催化体系中先过还原得到色原醇再氧化得到二氢色酮的问题,同时,该催化体系能够兼容活性官能团,有效拓宽了色酮类反应底物,
促进手性二氢色酮类化合物库的构建和进一步丰富。并且该催化体系还具有催化效率高(高达10000转换数)及选择性突出(高达100%化学选择性,99%ee的立体选择性)等优势。
12.优选地,所述衍生物为手性硫代二氢色酮类化合物和/或手性二氢喹啉酮类化合物。
13.优选地,所述r’为苄氧羰基、叔丁氧羰基、笏甲氧羰基、烯丙氧羰基、三甲基硅乙氧羰基、甲氧羰基、乙氧羰基、对甲苯磺酰基、三氟乙酰基、邻硝基苯磺酰基、对邻硝基苯磺酰基、特戊酰基、苯甲酰基三苯甲基、2, 4-二甲氧基苄基、对甲氧基苄基或苄基中的任意一种。
14.优选地,所述卤素为氟、氯、溴及碘。
15.在本发明中,如i和ii中所示,r1为苯环上的取代基,其个数为n,n为0-4的整数,即n可以为0、1、2、3、4。所述的r1为氢、c1-c6烷基、c1-c6烷氧基、c1-c6全氟烷基、卤素、苯基、苄基、萘基、酯基、杂环取代基、氨基或胺基中的任意一种或至少两种的组合,其中所述的组合是指在苯环上取代的多个基团(最多4个),这些基团可以相同也可以不同,如苯环上有两个位置被上述取代基所取代时,n=2,r1可以选择上述基团中的一种或者两种,如为甲基和苯基。
16.本发明中,所述c1-c6的烷基为碳原子数为1-6的烷基,具体可以为甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基、己基等。
17.本发明中,所述c1-c6烷氧基为碳原子数1-6的烷氧基,具体可以为甲氧基、乙氧基、丙氧基、丁氧基等。
18.本发明中,所述c1-c6全氟烷基为碳原子数为1-6的全氟烷基,如三氟甲基和五氟乙基等。
19.本发明中,所述酯基为甲酯基、乙酯基、丙酯基等。
20.本发明中,所述的杂环取代基为含有o、s或n的基团,优选呋喃基、噻吩基、吡啶基、吡咯基等。
21.优选地,所述手性金属催化剂的制备方法为由金属盐与手性配体原位络合形成。
22.优选地,所述金属盐为rh(nbd)2bf4、rh(nbd)2sbf6、rh(nbd)2barf、rh(cod)2bf4、rh(cod)2sbf6、rh(cod)2barf、[rh(nbd)cl]2、[rh(cod)cl]2、(caac-cy)rh(cod)cl、[ir(cod)cl]2、[ir(nbd)cl]2、[ir(cod)(och3)]2、ru(pph3)4cl2中的任意一种。
[0023]
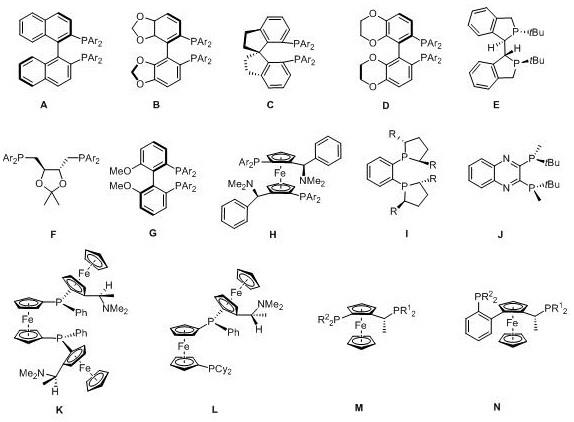
优选地,所述手性配体为具有如a-n所示结构的配体或与a-n所示结构的配体中任意一种具有相反构型的配体:
其中,a-h中,ar为苯基、4-甲基苯基、3,5-二甲基苯基、2,4,6-三甲基苯基、3,5-二(三氟甲基)苯基、4-甲氧基-3,5-二甲基苯基、4-甲氧基-3,5-二叔丁基苯基;i中r为甲基、乙基、异丙基、苯基或苄基;m-n中r1和r2为叔丁基、环己基、苯基、2-甲基苯基、2-呋喃基、3,5-二甲基苯基、1-萘基、4-甲氧基-3,5-二甲基苯基、4-三氟甲基苯基、3,5-二三氟甲基苯基。
t
bu表示叔丁基,me表示甲基,cy表示环己基,ph表示苯基。
[0024]
优选地,所述手性配体为具有如h、k-n所示结构的配体。
[0025]
优选地,手性金属配合物催化中所含金属盐与手性配体的摩尔比为1:1.1~1:5,如1:1.1、1:1.2、1:1.5、1:2、1:2.5、1:3、1:4或1:5。
[0026]
优选地,手性金属催化剂络合反应温度为0℃~60℃,如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃或60℃。
[0027]
优选地,手性金属催化剂络合时间为0.5~12小时,如0.5小时、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时或12小时。
[0028]
优选地,所述金属盐与手性配体的络合在有机溶剂中进行,所述有机溶剂为二氯甲烷、1,2-二氯乙烷、甲醇、乙醇、异丙醇、叔丁醇、三氟乙醇、六氟异丙醇、甲苯、正己烷、四氯化碳、四氢呋喃、1,4-二氧六环、乙酸乙酯、丙酮,优选二氯甲烷或甲醇。
[0029]
优选地,发生不对称催化氢化反应时,所述手性金属配合物催化剂与i所示原料的物质量之比为0.0001:1~0.02:1,如0.0001:1、0.000125:1、0.0002:1、0.00025:1、0.0003:1、0.001:1、0.002:1、0.01:1或0.02:1。
[0030]
优选地,所述不对称催化氢化反应的温度为0℃~100℃,如0℃、5℃、10℃、20℃、25℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃或100℃。
[0031]
优选地,所述不对称催化氢化反应的氢气压力为5~100 atm,如5atm、10atm、
20atm、30atm、40atm、50atm、60atm、70atm、80atm、90atm、100atm。
[0032]
优选地,所述不对称催化氢化反应的时间为0.5~48小时,如0.5小时、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、15小时、18小时、24小时、36小时或48小时。
[0033]
优选地,所述不对称催化氢化反应结束后,浓缩有机溶剂,分离得到手性二氢色酮-2-羧酸类化合物及其衍生物。
[0034]
优选地,所述分离方法为柱层析、薄层层析或重结晶;优选地,所述柱层析使用的洗脱液为石油醚、乙酸乙酯和甲酸的混合液体。
[0035]
优选地,石油醚和乙酸乙酯的体积比为5:1~80:1,如5:1、10:1、20:1、30:1、40:1、50:1、60:1、70:1或80:1,在每个配比下,根据总体积加入2%甲酸。
[0036]
本发明所述手性二氢色酮-2-羧酸类化合物及其衍生物的制备方法具体包括以下步骤:(1)金属盐与手性配体反应形成手性金属配合物催化剂;(2)在步骤(1)制备得到的手性金属催化剂催化下i所示原料发生不对称催化氢化反应得到ii所示手性二氢色酮-2-羧酸类化合物及其衍生物,反应式如下:其中,x是o、s、nh或n-r’, r’为仲胺保护基;r1为氢、c1-c6烷基、c1-c6烷氧基、c1-c6全氟烷基、卤素、苯基、苄基、萘基、酯基、杂环取代基、氨基或胺基中的任意一种或至少两种的组合;r2为羟基、烷氧基、芳氧基或胺基; r3为c1-c8烷基、苯基、苄基、萘基、杂环取代基;*标注位置表示手性碳原子,n为0-4的整数。
[0037]
本发明提供了如上述制备方法制备得到的手性二氢色酮-2-羧酸类化合物及其衍生物,由本发明方法得到的手性二氢色酮-2-羧酸类化合物及其衍生物化学收率高、光学纯度高。
[0038]
本发明提供了如上所述的手性二氢色酮-2-羧酸类化合物及其衍生物在天然产物及药物活性中间体制备中的应用。
[0039]
相比于现有技术,本发明具有以下优势:本发明中,通过手性金属催化剂催化的不对称氢化反应,经过一步反应得到手性二氢色酮-2-羧酸类化合物及其衍生物,催化效率高(高达10000 转换数)、选择性突出(高达100%化学选择性,99% ee的立体选择性)。同时,该催化体系能够兼容活性官能团,有效拓宽了色酮类反应底物,制备得到的手性二氢色酮-2-羧酸类化合物及其衍生物用途广泛,具有良好的应用前景。
具体实施方式
[0040]
下面通过具体实施方式进一步说明本发明的技术方案。所述实施例仅供帮助理解本发明,不应视作对本发明的限制。
[0041]
下面实验操作中,对空气或水分敏感的化合物参与的所有反应都是在氩气氛围下,在干燥的反应釜或手套箱中进行的。除非另有说明,所有的试剂和溶剂均从商业供应商处购买而无需进一步纯化,无水溶剂采用注射器转移。
[0042]
化合物的1h nmr, 13
c nmr光谱采用bruker advance ii (400 mhz)测定,以氘代氯仿或氘代二甲基亚砜为溶剂,四甲基硅烷(tms)作为内标,数据表示成:多样性(s=单峰,d=二重峰,t=三重峰,m=多重峰)。对映体过量值通过在agilent 1200系列高效液相色谱中采用手性柱进行测定。
[0043]
实施例1本实例中,制备4-氧代-二氢色酮-2-羧酸,其结构式如下:制备方法包括以下步骤:取一支干燥的5ml氢化反应安剖瓶,装入磁力搅拌子,在手套箱中称取0.75 mg, 0.002 mmol rh(nbd)2bf4和1.38 mg, 0.0022 mmol的josiphos(式m所示结构),加入上述反应瓶中,加入1 ml无水四氢呋喃,搅拌30分钟后,向反应瓶中一次性加入38mg 4-氧代-4h-色酮-2-羧酸,再将此氢化反应瓶置于氢化反应釜,转移出手套箱。氢气交换3~5次后充入氢气至压力为20 atm,在室温下搅拌18小时。在通风橱里释放反应釜中的氢气后,打开反应釜,取出氢化反应瓶,旋蒸除去溶剂,得到氢化反应产物粗品,柱层析分离,采用200-300目硅胶,流动相的体积比为石油醚:乙酸乙酯:甲酸=30:1:0.5。
[0044]
产物为白色固体(收率97%),光学纯度为99%ee。
[0045]
结构表征数据如下:1h nmr (400 mhz, dmso-d6) δ 13.38 (s, 1h), 7.52 (s, 1h), 7.41 (d, j = 8.4 hz, 1h), 7.00 (d, j = 8.4 hz, 1h), 5.27 (dd, j = 7.3, 5.4 hz, 1h), 3.07 (dd, j = 17.0, 5.2 hz, 1h), 2.94 (dd, j = 17.0, 7.5 hz, 1h), 2.27 (s, 3h); 13
c nmr (100 mhz, dmso-d6) δ 189.89, 170.43, 158.07, 137.20, 130.60, 125.61, 120.27, 117.78, 74.47, 19.88.实施例2本实施例中,制备7-叔丁基-4-氧代-二氢色酮-2-羧酸,其结构式为:制备方法包括以下步骤:取一支干燥的5ml氢化反应安剖瓶,装入磁力搅拌子,在手套箱中称取0.46 mg, 0.002 mmol [rh(nbd)cl]2和1.80mg, 0.0022 mmol mandyphos(式h所示结构),加入上述
反应瓶中,加入2 ml无水二氯甲烷,搅拌1小时后,向反应瓶中一次性加入49mg 7-叔丁基-4-氧代-4h-色酮-2-羧酸,再将此氢化反应瓶置于氢化反应釜,转移出手套箱。氢气交换3~5次后充入氢气至压力为30 atm,在室温下搅拌48小时。在通风橱里释放反应釜中的氢气后,打开反应釜,取出氢化反应瓶,旋蒸除去溶剂,柱层析分离纯化,采用200-300目硅胶,流动相的体积比为石油醚:乙酸乙酯:甲酸=20:1:0.5。
[0046]
产物为类白色固体(收率93%),光学纯度为98%ee。
[0047]
结构表征数据如下:1h nmr (400 mhz, dmso-d6) δ 13.41 (s, 1h), 7.66 (d, j = 8.3 hz, 1h), 7.14 (d, j = 8.3 hz, 1h), 7.05 (d, j = 1.2 hz, 1h), 5.29 (dd, j = 7.8, 5.2 hz, 1h), 3.03 (dd, j = 16.9, 5.1 hz, 1h), 2.93 (dd, j = 16.9, 8.0 hz, 1h), 1.28 (s, 9h); 13
c nmr (100 mhz, dmso-d6) δ 189.43, 170.37, 160.16, 159.94, 125.86, 119.16, 118.33, 114.22, 74.52, 35.06, 30.53.实施例3本实施例中,制备6-氟-4-氧代-二氢色酮-2-羧酸,结构式为:制备方法包括以下步骤:取一支干燥的5ml氢化反应安剖瓶,装入磁力搅拌子,在手套箱中称取0.34 mg, 0.001 mmol [ir(cod)cl]2和1.50mg, 0.002 mmol chenphos(式l所示结构),加入上述反应瓶中,加入1 ml无水甲醇,搅拌1小时后,向反应瓶中一次性加入63mg 6-氟-4-氧代-二氢色酮-2-羧酸,再将此氢化反应瓶置于氢化反应釜,转移出手套箱。氢气交换3~5次后充入氢气至压力为50 atm,在室温下搅拌36小时。在通风橱里释放反应釜中的氢气后,打开反应釜,取出氢化反应瓶,旋蒸除去溶剂,柱层析分离纯化,采用200-300目硅胶,流动相的体积比为石油醚:乙酸乙酯:甲酸=15:1:0.5。
[0048]
产物为白色固体(收率95%),光学纯度为99%ee。
[0049]
结构表征数据如下:1h nmr (400 mhz, dmso-d6) δ 13.50 (s, 1h), 7.49 (td, j = 8.6, 3.2 hz, 1h), 7.43 (dd, j = 8.4, 3.1 hz, 1h), 7.19 (dd, j = 9.0, 4.3 hz, 1h), 5.34 (dd, j = 7.4, 5.3 hz, 1h), 3.13 (dd, j = 17.1, 5.2 hz, 1h), 2.99 (dd, j = 17.1, 7.5 hz, 1h); 13
c nmr (100 mhz, dmso-d6) δ 189.31, 170.22, 157.79, 156.42, 155.41, 123.91, 123.66, 121.11, 120.17, 110.99, 110.76, 74.67; 19
f nmr (100 mhz, dmso-d6) δ-121.35.实施例4本实施例中,制备6,8-二氯-4-氧代-二氢色酮-2-羧酸,结构式为:
40.46.19
f nmr (100 mhz, dmso-d6) δ
ꢀ‑
116.24.实施例6本实施例中,制备4-氧代-二氢色酮-2-羧酸乙酯,结构式为:制备方法包括以下步骤:取一支干燥的5ml氢化反应安剖瓶,装入磁力搅拌子,在手套箱中称取1.04 mg, 0.002 mmol rh(nbd)2sbf6和1.83 mg, 0.003 mmol的(r)-segphos(式b所示结构),加入上述反应瓶中,加入2 ml无水乙醇,搅拌1小时后,向反应瓶中一次性加入44mg 4-氧代-色酮-2-羧酸乙酯,再将此氢化反应瓶置于氢化反应釜,转移出手套箱。氢气交换3~5次后充入氢气至压力为50 atm,在室温下搅拌24小时。在通风橱里释放反应釜中的氢气后,打开反应釜,取出氢化反应瓶,旋蒸除去溶剂,得到氢化反应产物粗品,柱层析分离纯化,采用200-300目硅胶,流动相的体积比为石油醚:乙酸乙酯=10:1。
[0054]
产物为白色固体(收率85%),光学纯度为98%ee。
[0055]
结构表征数据如下:1h nmr (400 mhz, cdcl3) δ7.85 (d, j = 7.8 hz, 1h), 7.51 (dd, j = 11.0, 4.0 hz, 1h), 7.06 (dd, j = 16.5, 8.1 hz, 2h), 5.11 (dd, j = 8.4, 5.9 hz, 1h), 3.81 (s, 3h), 3.09-2.98 (m, 2h).本发明通过上述实施例说明本发明的详细方法,但并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围内。
