一种chst2-slc9a9-as2融合基因及其应用和检测试剂盒
技术领域
1.本发明涉及生物医学技术领域,尤其涉及一种急性淋巴细胞白血病融合基因及其应用和检测试剂盒。
背景技术:
2.急性淋巴细胞白血病(all)是b或t系淋巴祖细胞恶性增殖引起的、最常见血液恶性肿瘤之一。患者由于正常外周血细胞缺乏,以发烧、反复感染、皮肤/粘膜出血,骨痛和关节痛为临床特征,纵隔肿块和中枢神经系统也常受累。儿童all患者化疗缓解率可达到80-90%,但成人all预后很差,总生存率为35%~55%,在60岁以上的成年人仅为30%。
3.为评估复发风险及预测临床预后,监测微小残留病变(mrd)是临床常用监测方法之一。其中白血病特异性融合基因的实时荧光定量聚合酶链反应(quantitative real-time pcr)分析是监测mrd的方法之一,且敏感性比流式细胞术高。并且随着分子遗传诊断学的迅速发展,目前在all中已经有bcr-abl,bcl11b-tlx3,stil-tal1,nup214-abl1等融合基因被报道,但仍然有很大比例的all患者缺乏分子标志,从而为临床诊断和治疗预后带来很大困难。因此发现并监测与all相关的新融合基因对于病情诊断、治疗方案制定、疗效评价、预后评估及病变复发具有重要的临床意义。
4.chst2(arbohydrate sulfotransferase 2)基因编码磺基转移酶蛋白,可催化非还原性n-乙酰氨基葡萄糖残基的硫酸化,参与炎症部位的淋巴细胞归巢作用。slc9a9-as2基因即slc9a9(sodium/hydrogen exchanger 9)的反义rna2,目前已知slc9a9基因在维持细胞器的离子平衡过程中发挥重要作用,其反义rna2是一种lncrna,目前对其功能的研究尚不深入,可能参与slc9a9基因的表达调控。上述两个基因在all患者里形成了一种新融合基因chst2-slc9a9-as2,迄今未见文献报道。
技术实现要素:
5.本发明的第一个目的在于,提供一种急性淋巴细胞白血病融合基因chst2-slc9a9-as2。
6.本发明的第二个目的在于,提供融合基因chst2-slc9a9-as2在制备急性淋巴细胞白血病诊断和/或监测制剂或试剂盒中的应用。
7.本发明的第三个目的在于,提供一种急性淋巴细胞白血病诊断和/或监测试剂盒。
8.本发明第四个目的在于,提供一种非疾病诊断目的的检测chst2-slc9a9-as2融合基因的方法。
9.为了实现上述第一个目的,本发明提供了一种chst2-slc9a9-as2融合基因,所述融合基因序列如seq id no.1所示。
10.为了实现上述第二个目的,本发明提供了chst2-slc9a9-as2融合基因在制备急性淋巴细胞白血病诊断和/或监测制剂或试剂盒中的应用。部分急性淋巴细胞白血病患者携带融合基因chst2-slc9a9-as2,其可以作为患者特异性的分子标志物,并应用于临床诊断、
定期监测患者的微小残留病变。
11.为了实现上述第三个目的,本发明提供了一种急性淋巴细胞白血病诊断和/或监测试剂盒,所述试剂盒含有检测chst2-slc9a9-as2融合基因或检测其表达产物的试剂。
12.作为一个优选方案,所述试剂盒包括上游引物、下游引物、taqman探针、内参、pcr反应缓冲液、阳性对照和阴性对照;
13.所述上游引物的核苷酸序列如seq id no.2所示;
14.所述下游引物的核苷酸序列如seq id no.3所示;
15.所述taqman探针的核苷酸序列如seq id no.4所示。
16.作为一个优选方案,所述taqman探针的5’端标记有fam基团,所述探针的3’端标记有tamra基团。当待测样品中不存在目标dna分子时fam的荧光被tamra淬灭,不发出荧光;当待测样品中存在目标dna分子时,探针与目标dna分子结合,随后靠taq酶的5'
→3’
双链外切酶活性降解探针而释放荧光基团fam,发出荧光。
17.作为一个优选方案,所述内参中包含内参上游引物,内参下游引物和内参探针;
18.所述内参上游引物的核苷酸序列如seq id no.5所示;
19.所述内参下游引物的核苷酸序列如seq id no.6所示;
20.所述内参探针的核苷酸序列如seq id no.7所示。
21.内参基因abl的探针5’端可以标记有fam基团,探针的3’端可以标记有tamra基团,fam基团为报告基团,tamra为淬灭基团。
22.pcr反应缓冲液为本领域常用缓冲液,一般包括cdna第一链合成试剂tianscriptⅱrt kit(tiangen公司)和实时荧光pcr混合液(pro taq hs premix probe qpcr kit,acurrate biology公司,ag11704),其主要成分包含dna聚合酶、mg
2+
、dntp、逆转录酶、dtt。
23.所述阳性对照包含有带有chst2-slc9a9-as2融合基因的质粒标准品和带有abl基因的质粒。所述阴性对照包含去离子水和10例健康骨髓供者的cdna。
24.为了实现上述第四个目的,本发明提供了一种非疾病诊断目的的检测chst2-slc9a9-as2融合基因的方法,包括以下步骤:
25.(1)提取人血液样本中的总rna,将rna反转为cdna作为待测样品;
26.(2)配置pcr反应液,再分别加入待测样品,阳性对照和阴性对照;
27.(3)实时荧光pcr仪上检测,反应条件:95℃预变性1min;95℃15s,58℃35s,反应40个循环,荧光信号于60℃时采集;
28.其中所述pcr反应液包括上游引物、下游引物、taqman探针、内参、pcr反应缓冲液、阳性对照和阴性对照,所述上游引物的核苷酸序列如seq id no.2所示;所述下游引物的核苷酸序列如seq id no.3所示;所述taqman探针的核苷酸序列如seq id no.4所示。
29.检测实验结果成立的条件为:若无目的基因扩增信号曲线,内参、阳性对照以及阴性对照检测均正常时,结果为阴性;若有目的基因扩增信号曲线,内参、阳性对照以及阴性对照检测均正常时,结果为阳性。若内参、阳性对照以及阴性对照出现异常,则需查明原因,做出调整后重新检测。
30.本发明发现并验证了部分急性淋巴细胞白血病携带融合基因chst2-slc9a9-as2,继之开发了一款实时荧光pcr和taqman探针技术相结合的融合基因检测、定量试剂盒。实时荧光pcr其结果用ct值表示,具有特异度好,灵敏度高,操作简单,结果更直观等优点,是目
前微量融合基因检测的首选方法,因此本试剂盒采用taqman探针实时荧光pcr检测chst2-slc9a9-as2融合基因,对患者mrd进行监测。
31.本发明的优点在于,(1)应用生物信息学技术筛选鉴定到急性淋巴细胞白血病患者携带的融合基因chst2-slc9a9-as2,证明其是至今未见报道的新融合基因,并可以作为患者的分子标志物应用于临床诊断、选择合适的治疗方案、定期监测患者mrd。
32.(2)本发明涉及的chst2-slc9a9-as2融合基因检测试剂盒具有如下优势:
①
准确性高:同时使用探针和引物双重控制,特异性好、假阳性低。
②
特异性强:使用特异性探针识别融合基因序列。
③
全程监控:实时监测全程扩增信号。
④
安全简便:操作简单安全,自动化程度高而且防止污染。
⑤
快速:完成检测时间为120min。
33.(3)本发明采用实时荧光pcr技术结合taqman探针,检测受测者体内chst2-slc9a9-as2融合基因和内参基因abl的表达情况,能把低丰度的基因信号从复杂背景中分辨出来的,对于患者诊断、调整治疗方案、评价治疗效果、预测预后、预防临床复发的监测中具有非常大的应用潜力。
附图说明
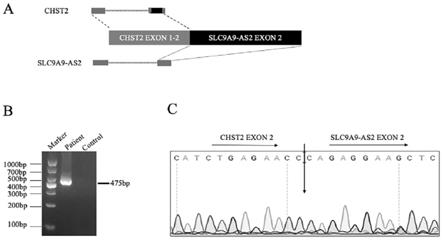
34.图1为chst2-slc9a9-as2融合基因结构图及pcr,sanger验证。a:3q24区域的translocation导致chst2-slc9a9-as2融合基因发生的图形化展示;b:融合基因在患者初发以及对照样本中的pcr验证;c:携带融合基因患者pcr验证产物的sanger测序结果图,确认了chst2外显子2与slc9a9-as2外显子2的融合。
35.图2为chst2-slc9a9-as2融合基因的质粒标准品构建结果。a:融合基因标准品质粒pgem t-easy-chst2-slc9a9-as2图谱;b:标准品质粒sanger测序结果。
36.图3为使用本发明所述试剂盒检测chst2-slc9a9-as2的结果图例。a:chst2-slc9a9-as2标准曲线,阳性样本以及阴性对照;b:chst2-slc9a9-as2阳性患者随治疗,chst2-slc9a9-as2在mrna水平的变化。
具体实施方式
37.以下,结合具体实施方式对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。
38.实施例1.急性淋巴细胞白血病患者携带chst2-slc9a9-as2新融合基因
39.(1)应用生物信息学技术筛选出急性淋巴细胞白血病患者的融合基因以及文献中均未有过报道的chst2-slc9a9-as2新融合基因。
40.(2)chst2-slc9a9-as2新融合基因由chst2基因的第1-2外显子与slc9a9-as2的第2外显子拼接形成,具体的碱基序列如seq id no.1所示。
41.(3)分别应用pcr、并对pcr产物进行sanger测序,我们确认该例急性淋巴细胞白血病患者携带chst2-slc9a9-as2新融合基因,验证结果见图1。图1为chst2-slc9a9-as2融合基因结构图及pcr,sanger验证。a:3q24区域的translocation导致chst2-slc9a9-as2融合基因发生的图形化展示;b:融合基因在患者初发以及对照样本中的pcr验证;c:携带融合基因患者pcr验证产物的sanger测序结果图,确认了chst2外显子2与slc9a9-as2外显子2的融合。
42.(4)选取合适的质粒,并将一段包含融合breakpoint的序列克隆到质粒中,从中挑选出阳性克隆进行pcr扩增和sanger测序,验证转入到质粒中序列的正确性,从而得到标准品。图2为chst2-slc9a9-as2融合基因的质粒标准品构建结果。a:融合基因标准品质粒pgem t-easy-chst2-slc9a9-as2图谱;b:标准品质粒sanger测序结果。
43.(5)设计了检测内参/目的基因用引物、探针,采用实时荧光pcr技术,检测内参基因abl、chst2-slc9a9-as2融合基因的表达情况。试剂盒通过调整内参/目的基因的引物探针比例,以及pcr反应条件,使扩增效率和速率均达到最佳。
44.实施例2.试剂盒的制备
45.1、特异性的引物和探针的设计
46.根据基因序列(abl1基因序列、chst2基因序列、slc9a9-as2基因序列均来自于美国国家生物技术信息中心核酸数据库,abl1基因entrez gene id25,基因参考序列nm_005157.5;chst2基因entrez gene id 9435,基因参考序列enst00000309575.5;slc9a9-as2基因entrez gene id 106480356,基因参考序列enst00000490153.1)设计特异性探针和引物。
47.2、试剂盒组分配制
48.cdna第一链合成试剂:tianscriptⅱrt kit(tiangen公司),检测体系pcr反应液:pro taq hs premix probe qpcr kit(acurrate biology,ag11704),其主要成分包含dna聚合酶、mg
2+
、dntp、逆转录酶、dtt。
49.引物和探针:包括检测chst2-slc9a9-as2融合基因和内参abl引物以及与引物相对应的探针,具体如下:
50.chst2-slc9a9-as2-f:acacggtatgtggaggtg(seq id no.2);
51.chst2-slc9a9-as2-r:ggctgttccatgtttgtc(seq id no.3);
52.chst2-slc9a9-as2-probe:fam-aagcagcgaagtttcatctgagaaccca-tamra(seq id no.4);
53.abl1-f:ctaaaggtgaaaagctccg(seq id no.5);
54.abl1-r:gactgttgactggcgtgat(seq id no.6);
55.abl1-probe:fam-ccatttttggtttgggcttcacaccatt-tamra(seq id no.7)。
56.阳性对照品:包含有带有chst2-slc9a9-as2融合基因的质粒标准品和带有abl基因的质粒;阴性对照品:去离子水和10例健康骨髓供者的cdna。
57.实施例3.本试剂盒检测all患者标本的操作流程
58.1、取送检的all患者抗凝血标本,抽提血液中的总rna:在洁净的1.5ml的离心管中加入1ml红细胞裂解液,取抗凝血0.5ml混匀。室温静置10min;5000rpm离心5min,弃上清,收集底部的细胞;再次加入0.5ml红细胞裂解液,5000rpm离心5min,弃上清,收集底部的细胞;向细胞中加入1ml trizol,反复吹打直至沉淀完全溶解,室温静置5min;加入0.2ml氯仿,震荡均匀;14000rpm 4℃离心10min,吸取上清层转移至另一新的离心管中;加入等体积的异丙醇,上下充分混匀,室温静置10min;14000rpm 4℃离心10min,弃上清,加入75%乙醇1ml,轻轻上下颠倒洗涤管壁;14000rpm 4℃离心5min,弃乙醇;室温干燥10-15min,加入20μl rnase-free水溶解沉淀。
59.2、参考tiangen公司的tianscriptⅱrt kit试剂盒说明书,将rna反转为cdna。
60.3、试剂配置:按检测人份数配置检测体系pcr反应液各xμl,x=23μl反应液
×
(n份标本+1份阳性对照+1份阴性对照+1份空白对照),每人份23μl分装。
61.4、加样:加入检测体系pcr反应液中2μl cdna;阳性对照和阴性对照直接加2μl阳性对照品和阴性对照品;空白对照加2μl生理盐水或不加任何物质。
62.5、检测:检测在实时荧光pcr仪上进行,可用仪器包括abi7300,7500(美国applied biosystems公司)等。反应条件:95℃预变性1min;95℃15s,58℃35s,反应40个循环,荧光信号于60℃时采集。
63.6、结果判断:若无目的基因扩增信号曲线,内参、阳性对照以及阴性对照检测均正常时,结果为阴性;若有目的基因扩增信号曲线,内参、阳性对照以及阴性对照检测均正常时,结果为阳性。若内参、阳性对照以及阴性对照出现异常,则需查明原因,做出调整后重新检测。
64.7、chst2-slc9a9-as2可以作为急性淋巴细胞白血病患者特异性的分子标志物:我们应用上述构建的检测试剂盒,对一例chst2-slc9a9-as2阳性患者临床治疗的4个时间节点样本进行了mrd监测。图3为使用本发明所述试剂盒检测chst2-slc9a9-as2的结果图例。a:chst2-slc9a9-as2标准曲线,阳性样本以及阴性对照;b:chst2-slc9a9-as2阳性患者随治疗,chst2-slc9a9-as2在mrna水平的变化。我们发现,该患者在初发(20.2.21)时chst2-slc9a9-as2表达水平较高,随后在化疗一段时间后,患者较前病情稍缓解,chst2-slc9a9-as2表达水平较前下降(20.5.12),但很快患者再次复查细胞学和流式显示原始细胞增多,倾向患者再次复发,同时chst2-slc9a9-as2表达量又升高(20.9.8),此时给予供者淋巴细胞输注,监测chst2-slc9a9-as2表达量再次降低(20.9.22),说明chst2-slc9a9-as2表达与疾病进展趋势一致,但始终有分子残留故仍需实时监测警惕复发风险。上述结果表明,chst2-slc9a9-as2可以作为患者新的分子标志物用来监测mrd,并且证明该试剂盒的准确可靠。
65.综上结果表明,本试剂盒可高通量、快速、准确地检测样本,同时具有良好的特异性和可重复性,可有效避免假阳性和假阴性结果。以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
