一种手性2,2
’‑
联吡啶配体及其制备方法和应用
技术领域
1.本发明属于精细化工技术领域,涉及一种手性2,2
’‑
联吡啶配体及其制备方法和应用。
背景技术:
2.分子的构建是一个艰难的艺术,但确是化学的核心,包括生物医药和材料科学在内的许多研究领域和行业都依赖于此。其中,手性分子的构建是化学工作者长期以来要攻克的目标。首先,手性与生命现象息息相关,在探索生命起源和运行的奥秘、进化的机制,以及研发与生命相关的药物、农药和生物检测试剂、仿生材料等方面都离不开手性科学的发展。伴随着材料科学领域的发展,还有手性的材料在分子机器、非线性光学、三维显示和信息存储与传输中均显示出了独特的价值。无论是面向科技应用还是生命健康,高效精准制备手性物质始终是最重要的一环。
3.过渡金属催化反应、酶催化反应和有机小分子催化反应是构建手性分子的三种方式,而过渡金属催化是其中研究和应用最广泛地一类。配体是金属配合物的重要组成部分,对中心金属的电子结构、配合物的空间结构及其理化性质具有关键性的调控作用。
4.然而,目前所广泛使用的手性配体大多依赖于天然分子提供的手性骨架,人工设计的配体骨架大多合成困难,原料昂贵且应用面窄。特别是对于手性2,2-联吡啶型配体更是发展缓慢。因此,设计一种易于合成且原材料较为廉价的2,2-联吡啶型配体骨架有着深远的意义。
技术实现要素:
5.针对现有技术中存在的问题,本发明提供一种手性2,2
’‑
联吡啶配体及其制备方法和应用,所述配体的合成原料成本低,简单易得且所述配体合成方便。
6.本发明是通过以下技术方案来实现:
7.一种手性2,2
’‑
联吡啶配体,其结构式如式(1)或式(1’)所示:
[0008][0009]
其中,r为芳基或烷基。
[0010]
所述的手性2,2
’‑
联吡啶配体的制备方法,包括以下步骤:
[0011]
(1)将2-环戊烯-1-酮在液溴作用下溴化后,与丙二酸二乙酯反应得到一对对映异构体;
[0012]
(2)将得到的对映异构体与(r)-叔丁基亚磺酰胺以及钛酸四乙酯反应,然后将产
物进行分离提纯,得到亚磺酰亚胺,随后使用盐酸进行水解得到式(2)和/或式(2’)所示的手性酮;
[0013][0014]
(3)将式(2)所示的手性酮与羟胺置于乙醇中反应,得到式(3)所示的肟;
[0015]
或者,将式(2’)所示的手性酮与羟胺置于乙醇中反应,得到式(3’)所示的肟;
[0016][0017]
(4)将式(3)所示的肟加入甲苯中,再加入铁粉、乙酸酐和乙酸,反应得到式(4)所示的酰胺;
[0018]
或者,将式(3’)所示的肟加入甲苯中,再加入铁粉、乙酸酐和乙酸,反应得到式(4’)所示的酰胺;
[0019][0020]
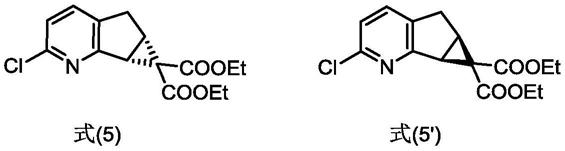
(5)将式(4)所示的酰胺溶解于n,n-二甲基甲酰胺中,然后滴加三氯氧磷,反应得到式(5)所示的氯吡啶衍生物;
[0021]
或者,将式(4’)所示的酰胺溶解于n,n-二甲基甲酰胺中,然后滴加三氯氧磷,反应得到式(5’)所示的氯吡啶衍生物;
[0022][0023]
(6)将式(5)所示的氯吡啶衍生物溶解于四氢呋喃,然后在低温条件下滴加到dibal-h的甲苯溶液中,反应得到式(6)所示的二醇衍生物;
[0024]
或者,将式(5’)所示的氯吡啶衍生物溶解于四氢呋喃,然后在低温条件下滴加到dibal-h的甲苯溶液中,反应得到式(6’)所示的二醇衍生物;
[0025][0026]
(7)将式(6)得到的二醇与对甲苯磺酸、二氯化锡、分子筛、甲基缩酮在1,2-二氯乙烷在回流条件下反应,得到式(7)所示的缩酮衍生物;
[0027]
或者,将式(6’)得到的二醇与对甲苯磺酸、二氯化锡、分子筛、甲基缩酮在1,2-二氯乙烷在回流条件下反应,得到式(7’)所示的缩酮衍生物。
[0028][0029]
(8)取锰粉、六水合氯化镍和三苯基膦,加入n,n-二甲基甲酰胺中,加热搅拌1个小时,然后加入溶解于n,n-二甲基甲酰胺中的式(7)或式(7’)所示的氯吡啶衍生物,反应得到手性2,2
’‑
联吡啶配体。
[0030]
优选的,步骤(1)具体过程为:在氮气保护下,将2-环戊烯-1-酮以及液溴在二氯甲烷中于0℃至室温下反应4-8小时得到2-溴-2-环戊烯-1-酮,将2-溴-2-环戊烯-1-酮与丙二酸二乙酯在1,2-二氯乙烷溶剂中,碱催化下,加热至90℃反应12-24小时后,过滤后使用柱层析分离得到一对对映异构体。
[0031]
优选的,步骤(3)具体过程为:将式(2)或式(2’)所示的手性酮与羟胺置于乙醇溶液中加热回流搅拌18-24小时,然后水洗后使用二氯甲烷进行萃取,所得有机相使用无水硫酸钠干燥后除去溶剂,得到式(3)或式(3’)所示的肟。
[0032]
优选的,步骤(4)具体过程为:将式(3)或式(3’)所示的肟加入甲苯中,冷却到0℃后加入铁粉,再加入乙酸酐和乙酸的混合物,升至室温进行反应,搅拌18-24个小时后将铁粉滤掉,并加入氯化铵水溶液,再使用乙酸乙酯进行萃取后进行硅胶柱层析分离,得到(4)或式(4’)所示酰胺。
[0033]
优选的,步骤(5)具体过程为:将(4)或式(4’)所示酰胺溶解于n,n-二甲基甲酰胺中,然后在冰浴下滴加三氯氧磷,在80-100℃温度下搅拌18-24小时后,将混合物使用柱层析分离,得到式(5)或式(5’)所示的氯吡啶衍生物。
[0034]
所述的手性2,2
’‑
联吡啶配体作为催化剂配体在制备手性二芳基甲醇中的应用。
[0035]
优选的,包括:
[0036]
在氩气条件下,将二溴化镍乙二醇二甲醚络合物、手性2,2
’‑
联吡啶配体和2-甲基四氢呋喃在室温下搅拌混合,然后加入锌粉以及四苯基四氟硼酸钠后继续在室温下搅拌混合;向反应体系中加入醛和芳基卤化物,将所得反应混合物置于-30-0℃下搅拌反应;反应结束后,除去溶剂;所得反应粗产品分离提纯得到手性二芳基甲醇。
[0037]
所述的手性2,2
’‑
联吡啶配体作为催化剂配体在制备手性自偶联二芳基化合物中的应用。
[0038]
优选的,包括:
[0039]
在氩气条件下,将二氯化镍三苯基膦络合物、手性2,2
’‑
联吡啶配体和n,n-二甲基乙酰胺加热搅拌混合,再加入锰粉以及芳基氯化物,将所得反应混合物置于60-80℃下搅拌反应;反应结束后,除去溶剂,将所得反应粗产品分离提纯得到手性联芳基化合物。
[0040]
与现有技术相比,本发明具有以下有益的技术效果:
[0041]
本发明所述手性2,2
’‑
联吡啶配体的原料成本低,简单易得且合成方便。在合成配体过程中可以随意调控配体的取代基团,以达到调控配体的电性以及空间位阻条件,可使得本发明的配体根据不同的反应来使用不同基团,以达到适用性广的需求。本发明的配体已经用于制备手性二芳基甲醇以及手性自偶联二芳基化合物,验证了配体的有效性以及适用性。在制备手性二芳基甲醇以及自偶联二芳基中的应用,采用廉价金属镍作为催化剂时产物的产率和对映选择性均能保持较高的水平。
[0042]
本发明所述手性2,2
’‑
联吡啶配体的原料成本低,简单易得且合成方便。
[0043]
采用本发明的配体制备手性二芳基甲醇,能够采用廉价的芳基醛和芳基卤化物为原料,催化剂为廉价金属镍,产物立体选择性好,产率高,易于纯化。
[0044]
采用本发明的配体制备手性自偶联二芳基产物,能够采用廉价的芳基氯化物为原料,催化剂为廉价金属镍,产物立体选择性好,产率高,易于纯化。
附图说明
[0045]
图1为本发明实施例1中的手性2,2
’‑
联吡啶配体式(1)r为苯基取代的1h nmr图谱。
[0046]
图2为本发明实施例2中的手性2,2
’‑
联吡啶配体式(1’)r为甲基取代的1h nmr图谱。
具体实施方式
[0047]
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
[0048]
一类具有不同取代基的手性2,2
’‑
联吡啶配体,其结构式如式(1)或式(1’)所示:
[0049][0050]
其中,r为芳基或烷基。
[0051]
一类具有不同取代基的手性2,2
’‑
联吡啶配体制备的方法,包括以下步骤:
[0052]
第一步:在氮气保护下,将液溴溶解于二氯甲烷后在冰水浴条件下滴加到2-环戊烯-1-酮的二氯甲烷溶液中,反应2-5小时后加入三乙胺。反应后经水洗,二氯甲烷萃取,合并有机相并用无水硫酸镁干燥、过滤、减压蒸干溶剂,得到的粗产品经过一步提纯后得到2-溴-2-环戊烯-1-酮。在碱、相转移催化剂的催化下,2-溴-2-环戊烯-1-酮与丙二酸二乙酯在1,2-二氯乙烷中反应得到一对对映异构体。
[0053]
第二步:将得到的对映异构体与(r)-叔丁基亚磺酰胺以及一定量的钛酸四乙酯在90℃1,2-二氯乙烷中搅拌过夜,然后使用硅胶层析柱将产物进行分离提纯,得到光学纯的亚磺酰亚胺。随后使用盐酸水溶液进行水解分别能得到式(2)和/或式(2’)所示的手性酮。
[0054][0055]
第三步:将式(2)或式(2’)所示的手性酮与过量的羟胺置于乙醇溶液里回流搅拌18-24小时,然后水洗后使用二氯甲烷进行萃取。有机相使用无水硫酸钠干燥后除去溶剂,得到酮转变为式(3)或式(3’)所示的肟。
[0056][0057]
第四步:将式(3)或式(3’)所示的肟加入适量甲苯中。然后将甲苯溶液冷却到0℃后加入过量铁粉。然后往溶液中缓慢加入适当的乙酸酐和乙酸的混合物并升至室温。反应18-24个小时后将铁粉滤掉,并往滤液加入适量氯化铵水溶液,接下来使用乙酸乙酯进行萃取后进行硅胶柱层析分离,得到相应的式(4)或式(4’)所示的酰胺产物。
[0058][0059]
第五步:将式(4)或式(4’)所示的酰胺溶解于n,n-二甲基甲酰胺中。然后在冰浴下往里滴加三氯氧磷。在80-100℃温度下搅拌18-24小时后,将混合物使用柱层析分离得到式(5)或式(5’)所示的重要中间体氯吡啶衍生物。
[0060][0061]
第六步:将式(5)或式(5’)所示的氯吡啶衍生物溶解于四氢呋喃,然后在-20℃到0℃下滴加到二异丁基氢化铝(dibal-h)的甲苯溶液中,后搅拌2-4小时,淬灭后使用二氯甲烷萃取,收集有机相并浓缩后使用丙酮重结晶后得到式(6)或式(6’)所示的二醇衍生物。
[0062][0063]
第七步:将式(6)或式(6’)得到的二醇与对甲苯磺酸、二氯化锡、分子筛、不同取代基的甲基缩酮在1,2-二氯乙烷在90℃回流条件下反应4-8小时,反应结束有进行硅胶柱层析分离得到不同取代基保护的缩酮衍生物式(7)或式(7’)。
[0064][0065]
第八步:取锰粉、二氯化镍三苯基膦络合物,加入n,n-二甲基甲酰胺中,加热搅拌1个小时,恢复室温后加入溶解于n,n-二甲基甲酰胺中的式(7)或式(7’)所示的氯吡啶衍生物,后再加热到60℃搅拌12-18小时,经过硅胶柱层析分离后得到不同取代基的手性2,2
’‑
联吡啶配体式(1)或式(1’)。
[0066][0067]
上述手性2,2
’‑
联吡啶配体作为催化剂配体在制备二芳基甲醇中的应用,包含以下步骤:
[0068]
在氩气条件下,加入二溴化镍乙二醇二甲醚络合物、式(1)或式(1’)的手性2,2
’‑
联吡啶配体和2-甲基四氢呋喃在室温下搅拌1小时,加入锌粉以及四苯基四氟硼酸钠后继续在室温下搅拌1小时。充分搅拌后,向反应体系中依次加入醛和芳基卤化物,并将反应混合物置于-30-0℃下搅拌24-48小时。反应结束后,反应混合物升至室温后减压蒸馏除去2-甲基四氢呋喃。反应粗产品通过硅胶柱层析分离得到手性二芳基甲醇产物。
[0069]
所述手性二芳基甲醇化合物的结构如式(8)所示:
[0070][0071]
其中,r1表示芳环、取代芳环或萘环,r2表示芳环、取代芳环或萘环。
[0072]
上述手性2,2
’‑
联吡啶配体作为催化剂配体在制备手性自偶联二芳基产物的应用,包含以下步骤:
[0073]
在氩气条件下,加入二氯化镍三苯基膦络合物、式(1)或式(1’)的手性2,2
’‑
联吡啶配体和n,n-二甲基乙酰胺在60℃下搅拌1小时,加入锰粉以及芳基氯化物,并将反应混合物置于60-80℃下搅拌24-48小时。反应结束后,反应混合物恢复至室温后,使用二氯甲烷和水进行萃取除去n,n-二甲基乙酰胺,再使用旋蒸除去二氯甲烷。反应粗产品通过硅胶柱层
析分离得到手性自偶联二芳基产物。
[0074]
所述手性自偶联二芳基化合物的结构如式(9)所示:
[0075][0076]
其中,r3表示芳环、取代芳环或萘环。
[0077]
实施例1
[0078]
手性2,2
’‑
联吡啶配体的合成:
[0079]
1.1
[0080][0081]
将2-环戊烯-1-酮溶于60ml二氯甲烷(dcm)中,0℃下将br2(液溴水封保存,需吸取最底下的液溴)溶于60ml dcm中,通过恒压滴液漏斗加入体系(滴加,控制体系温度<5℃)。约30min滴加完成,0℃下保持10min。将et3n溶于60ml dcm中,通过恒压滴液漏斗快速滴加入体系(约10min),加完后,体系室温搅拌4h,反应结束后加入饱和氯化铵水溶液(20ml)淬灭反应,然后每次用50-60ml dcm萃取3次合并有机相并用无水硫酸钠干燥、过滤、减压浓缩,得到的粗产品用柱层析分离纯化后得到2-溴-2-环戊烯-1-酮。
[0082]
1.2
[0083][0084]
取2-溴-2-环戊烯-1-酮(240mmol,1.0equiv),39g丙二酸二乙酯(480mmol,2.0equiv),15.6g四己基溴化铵(36mmol,15mol%)和200g碳酸钾(1440mmol,6.0equiv)加入240ml 1,2-二氯乙烷中。反应混合物在90℃下搅拌20小时,冷却至室温后过滤并旋蒸出去溶剂。反应粗产品通过硅胶柱层析分离一组混合对映异构体产物(1r,5s)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯以及(1s,5r)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯。
[0085]
1.3
[0086][0087]
取上述对映异构体(3.9g,15mmol)以及(r)-(+)-叔丁基亚磺酰胺(1.81g,15mmol)和钛酸四乙酯(6.8g,30mmol)在二氯乙烷(75ml)中于90℃反应20个小时。待物料降至室温后加入饱和氯化铵水溶液(20ml)淬灭反应然后每次用20-30ml乙酸乙酯萃取3次,合并有机
相并用无水硫酸钠干燥、过滤、减压浓缩,得到的粗产品用柱层析分离纯化后能分别得到光学纯的亚磺酰亚胺中间体。将中间体用盐酸水溶液(20ml)水解后分别能得到(1r,5s)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯以及(1s,5r)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯。
[0088]
1.4
[0089][0090]
取(1s,5r)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯(3.6g,15mmol)溶解于20ml乙醇中,再加入羟胺(1.5g,45mmol)后加热至80℃回流搅拌过夜。体系降至室温后加入20ml水后每次用20-30ml二氯甲烷萃取3次,合并有机相并用无水硫酸钠干燥、过滤、减压浓缩,得到粗产品(1s,5r)-2-异亚硝基二环[3.1.0]己烷-6,6-二乙酸乙酯。
[0091]
1.5
[0092][0093]
将上一步得到的(1s,5r)-2-异亚硝基二环[3.1.0]己烷-6,6-二乙酸乙酯(2.5g,10mmol)溶解于甲苯(20ml)并加入铁粉(3.35g,60mmol)后冷却至0℃。然后将乙酸酐(3.1g,30mmol)和乙酸(1.8g,30mmol)的混合物缓慢加入到体系中并且恢复至室温。搅拌18-24个小时后加入饱和氯化铵水溶液(20ml)淬灭反应然后每次用20-30ml乙酸乙酯萃取3次,合并有机相并用无水硫酸钠干燥、过滤、减压浓缩,得到的粗产品用柱层析分离纯化后得到(1s,5r)-2-乙酰氨基二环[3.1.0]-2-烯-己烷-6,6-二乙酸乙酯。
[0094]
1.6
[0095][0096]
取上一步得到的(1s,5r)-2-乙酰氨基二环[3.1.0]-2-烯-己烷-6,6-二乙酸乙酯(11.2g,40mmol)以及n,n-二甲基甲酰胺(17.5g,240mmol)加入到圆底烧瓶中,置换氮气后滴加三氯氧磷(42g,280mmol)。滴加完成后加热至100℃搅拌24个小时。冷却至室温后直接用柱层析分离纯化后得到氯吡啶二酯衍生物式(5)。
[0097]
1.7
[0098][0099]
取上一步得到的氯吡啶二酯衍生物式(5)(4.8g,15.8mmol)溶于80ml四氢呋喃并
在0℃下充分搅拌。二异丁基氢化铝(1.5m甲苯溶液,63ml,95mmol)加32ml四氢呋喃稀释至1m,随后缓慢滴加至反应溶液中。滴加完毕后,反应混合物缓慢升至室温并继续搅拌2小时。反应完成后,在冰水浴冷却下缓慢滴加蒸馏水淬灭,使用二氯甲烷萃取,随后合并有机相并旋蒸除去溶剂。反应粗产品通过硅胶柱层析得到氯吡啶二醇衍生物式(6)。
[0100]
1.8
[0101][0102]
在此步骤以苯基为取代基为实例。取上一步得到的氯吡啶二醇衍生物式(6)(450mg,2mmol),二苯甲酮二甲基缩酮(3.0equiv),对甲苯磺酸(5mol%),氯化亚锡(5mol%)和分子筛(400mg,200mg/mmol),加入干燥的1,2-二氯乙烷(1.0m)。反应混合物在100℃下搅拌24小时。反应完成后,反应混合物过滤收集滤液,减压蒸馏除去溶剂。反应粗产品通过硅胶柱层析分离氯吡啶衍生物式(7-ph)。
[0103]
1.9
[0104][0105]
取锰粉(440mg,8mmol)、二氯化镍三苯基膦络合物(131mg,0.2mmol)加入n,n-二甲基甲酰胺(15ml)后加热至70℃搅拌2个小时。观察颜色变为绿色后将氯吡啶衍生物式(7-ph)(778mg,2mmol)溶解于n,n-二甲基甲酰胺(3ml),并将氯吡啶衍生物式(7-ph)溶液滴加到上述反应体系里,然后搅拌36个小时。反应结束后过滤,合并有机相并用无水硫酸钠干燥、过滤、减压浓缩,得到的粗产品用柱层析分离纯化后得到r基团为苯基的式(1)的手性2,2
’‑
联吡啶配体ph-sbpy。制备得到的手性2,2
’‑
联吡啶配体ph-sbpy的1h nmr图谱如图1所示。
[0106]
实施例2
[0107]
手性2,2
’‑
联吡啶配体的合成:
[0108]
2.1
[0109][0110]
将实施例1中1.1反应时间缩短为2小时,其他条件相同,反应得到结果相同。
[0111]
2.2
[0112][0113]
将实施例1中1.2反应搅拌时间缩短为12小时,其他条件相同,反应得到结果相同。
[0114]
2.3
[0115][0116]
将实施例1中1.3反应搅拌时间缩短为12小时,其他条件相同,反应得到结果相同。
[0117]
2.4
[0118][0119]
将实施例1中1.4反应中(1s,5r)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯替换为(1r,5s)-2-氧代二环[3.1.0]己烷-6,6-二乙酸乙酯,反应时间缩短为6小时,其余条件相同,得到的粗产品(1r,5s)-2-异亚硝基二环[3.1.0]己烷-6,6-二乙酸乙酯。
[0120]
2.5
[0121][0122]
将实施例1中1.5反应中的(1s,5r)-2-异亚硝基二环[3.1.0]己烷-6,6-二乙酸乙酯替换为2.4步骤得到的(1r,5s)-2-异亚硝基二环[3.1.0]己烷-6,6-二乙酸乙酯,其余条件相同,得到(1r,5s)-2-乙酰氨基二环[3.1.0]-2-烯-己烷-6,6-二乙酸乙酯。
[0123]
2.6
[0124][0125]
取上一步得到的(1r,5s)-2-乙酰氨基二环[3.1.0]-2-烯-己烷-6,6-二乙酸乙酯(11.2g,40mmol)以及n,n-二甲基甲酰胺(17.5g,240mmol)加入到圆底烧瓶中,置换氮气后滴加三氯氧磷(42g,280mmol)。滴加完成后加热至100℃搅拌16个小时。冷却至室温后直接
用柱层析分离纯化后得到氯吡啶二酯衍生物式(5’)。
[0126]
2.7
[0127][0128]
取上一步得到的氯吡啶二酯衍生物式(5’)(4.8g,15.8mmol)溶于80ml四氢呋喃并在0℃下充分搅拌。二异丁基氢化铝(1.5m甲苯溶液,63ml,95mmol)加32ml四氢呋喃稀释至1m,随后缓慢滴加至反应溶液中。滴加完毕后,反应混合物缓慢升至室温并继续搅拌2小时。反应完成后,在冰水浴冷却下缓慢滴加蒸馏水淬灭,使用二氯甲烷萃取,随后合并有机相并减压蒸馏除去溶剂。反应粗产品通过硅胶柱层析分离得到氯吡啶二醇衍生物式(6’)。
[0129]
2.8
[0130][0131]
在此步骤以甲基为取代基为实例。取上一步得到的氯吡啶二醇衍生物式(6’)(450mg,2mmol),2,2-二甲氧基丙烷(3.0equiv),对甲苯磺酸(5mol%),氯化亚锡(5mol%)和分子筛(400mg,200mg/mmol),加入干燥的1,2-二氯乙烷(1.0m)。反应混合物在100℃下搅拌24小时。反应完成后,反应混合物过滤收集滤液,减压蒸馏除去溶剂。反应粗产品通过硅胶柱层析分离氯吡啶衍生物式(7
’‑
me)。
[0132]
2.9
[0133][0134]
取锰粉(440mg,8mmol)、二氯化镍三苯基膦络合物(131mg,0.2mmol)加入n,n-二甲基甲酰胺(15ml)后加热至70℃搅拌2个小时。观察颜色变为绿色后将氯吡啶衍生物式(7
’‑
me)(531mg,2mmol)溶解于n,n-二甲基甲酰胺(3ml),并将氯吡啶衍生物式(7-ph)溶液滴加到上述反应体系里,然后搅拌36个小时。反应结束后过滤,合并有机相并用无水硫酸钠干燥、过滤、减压浓缩,得到的粗产品用柱层析分离纯化后得到r基团为甲基的式(1’)的手性2,2
’‑
联吡啶配体me-sbpy。制备得到的手性2,2
’‑
联吡啶配体me-sbpy的1h nmr图谱如图2所示。
[0135]
下面通过实施例进一步阐述本发明的应用,并不因此将本发明应用限制在所述的实施范围之中。
[0136]
手性二芳基甲醇的制备
[0137]
制备实例1
[0138]
本实例为制备(s)-(4-甲氧基苯基)-苯基甲醇,具体包括以下步骤:氩气条件下,二溴化镍乙二醇二甲醚络合物(7.0mg,0.02mmol,10mol%),ph-sbpy(17.0mg,0.024mmol,12mol%)和2-甲基四氢呋喃(0.5ml)混合,并在33℃下搅拌1小时。四丁基四苯基硼酸铵(28.0mg,0.05mmol,25mol%)和锌粉(19.6mg,0.3mmol,1.5equiv)在氮气流的保护下加入反应溶液中并继续在33℃下搅拌1小时。充分搅拌后,反应体系呈深蓝绿色混合物。随后,向反应体系中依次加入苯甲醛(0.2mmol,1.0equiv),4-碘苯甲醚(0.5mmol,2.5equiv),1,4-二氧六环(0.5ml)和二氯甲烷(0.1ml),并将反应混合物置于-30℃下搅拌24小时。反应结束后用旋转蒸发仪除去溶剂,用硅胶柱层析方法(使用200-300目规格的硅胶,硅胶与待纯化物质量比为50-100:1,洗脱剂为石油醚和乙酸乙酯,体积比为5-10:1)纯化产品,得到((s)-(4-甲氧基苯基)-苯基甲醇(88%产率,91%ee)。1h nmr(400mhz,cdcl3)δ7.21
–
7.39(m,2h),6.85(d,j=8.4hz,2h),5.79(s,1h),3.78(s,3h),2.25(s,1h).
13
c nmr(100mhz,cdcl3)δ159.0,144.0,136.2,128.5,127.9,127.4,126.4,113.9,75.8,55.3.
[0139]
制备实例2
[0140]
用4-甲基苯甲醛代替制备实例1中的苯甲醛,其他条件相同,反应得到(s)-(4-甲氧基苯基)-(4甲基苯基)-甲醇(92%产率,88%ee)。1h nmr(400mhz,cdcl3)δ7.28-7.23(m,4h),7.14(d,j=8.0hz,2h),6.85(d,j=8.4hz,2h),5.76(d,j=1.6hz,1h),3.78(s,3h),2.32(s,3h),2.18(d,j=3.2hz,1h).
13
c nmr(100mhz,cdcl3)δ159.0,141.2,137.1,136.4,129.2,127.8,126.4,113.8,75.7,55.3,21.1.
[0141]
制备实例3
[0142]
用4-叔丁基碘苯代替制备实例1中的4-碘苯甲醚,其他条件相同,反应得到(s)-(4-叔丁基苯基)-苯基甲醇(91%产率,88%ee)。1h nmr(400mhz,cdcl3)δ7.51
–
7.08(m,9h),5.72(s,1h),2.21(s,1h),1.22(s,9h).
13
c nmr(100mhz,cdcl3)δ150.5,143.9,140.9,128.5,127.5,126.5,126.3,125.5,76.1,34.5,31.4.
[0143]
制备实例4
[0144]
用2-甲氧基碘苯代替制备实例1中的4-碘苯甲醚,其他条件相同,反应得到(s)-(2甲基苯基)-苯基甲醇(77%产率,84%ee)。1h nmr(400mhz,cdcl3)δ7.39(d,j=7.6hz,2h),7.32(t,j=7.6hz,2h),7.29
–
7.19(m,3h),6.94(t,j=7.6hz,1h),6.89(d,j=8.0hz,1h),6.05(d,j=5.2hz,1h),3.81(s,3h),3.06(d,j=5.6hz,1h).
13
c nmr(100mhz,cdcl3)δ156.8,143.2,131.9,128.8,128.2,127.9,127.2,126.6,120.8,110.8,72.3,55.4.
[0145]
手性联芳基产物的制备
[0146]
制备实例5
[0147]
本实例为制备(s)-5,5',6,6'-四甲氧基-[1,1'-联苯]-2,2'-二甲醛,具体包括以下步骤:氩气条件下,2-氯-3,4-二甲氧基苯甲醛(0.1mmol,1.0equiv),nicl2(pph3)2(6.5mg,0.01mmol,10mol%),ph-sbpy(11.6mg,0.01mmol,10mol%),锌粉(3.1mg,0.2mmol,2.0equiv)和tbai(18.5mg,0.05mmol,0.5equiv)混合。加入干燥的nmp后将其置于45℃油浴中加热搅拌16小时,反应结束后用旋转蒸发仪除去溶剂,用硅胶柱层析方法(使用200-300目规格的硅胶,硅胶与待纯化物质量比为50-100:1,洗脱剂为石油醚和乙酸乙酯,体积比为5-10:1)纯化产品,得到(s)-5,5',6,6'-四甲氧基-[1,1'-联苯]-2,2'-二甲醛(92%产率,91%ee)。1h nmr(400mhz,cdcl3)δ9.55(s,2h),7.84(d,j=8.6hz,2h),7.12(d,j=8.6hz,
2h),4.00(s,6h),3.60(s,6h).
13
c nmr(100mhz,cdcl3)δ190.1,157.7,146.7,131.5,128.6,126.1,112.1,60.6,56.1.
[0148]
制备实例6
[0149]
用1-氯-2-萘甲醛代替制备实例5中的2-氯-3,4-二甲氧基苯甲醛,其他条件相同,反应到(r)-[1,1'-联萘]-2,2'-二甲醛(81%产率,86%ee)。1h nmr(400mhz,cdcl3)δ9.62(s,2h),8.21(d,j=8.6hz,2h),8.13(d,j=8.7hz,2h),8.02(d,j=8.2hz,2h),7.64(t,j=7.5hz,2h),7.38(t,j=7.7hz,2h),7.24(d,j=8.5hz,2h).
13
c nmr(100mhz,cdcl3)δ191.2,139.8,136.1,133.6,133.4,129.9,129.6,128.7,128.1,127.4,122.5.
[0150]
制备实例7
[0151]
用1-氯-6-环丙基-2-萘甲醛代替制备实例5中的2-氯-3,4-二甲氧基苯甲醛,其他条件相同,反应到(r)-6,6
’‑
二环丙基-[1,1'-联萘]-2,2'-二甲醛(91%产率,92%ee)。1h nmr(400mhz,cdcl3)δ9.56(s,2h),8.14(d,j=8.7hz,2h),7.99(d,j=8.7hz,2h),7.66(d,j=1.4hz,2h),7.11(d,j=8.8hz,2h),7.04
–
7.01(m,2h),2.09
–
2.02(m,2h),1.12
–
1.05(m,4h),0.85
–
0.79(m,4h).
13
c nmr(100mhz,cdcl3)δ191.3,146.4,140.0,136.3,132.5,131.9,129.0,127.5,126.4,124.3,122.6,16.0,10.3,10.2.
[0152]
通过本发明制备方法获得的手性二芳基甲醇和手性联芳基产物,产率及立体选择性都取得较高的结果。产物可用于合成药物/农药的中间体,该制备方法可用于制备很多上述类似产物,有工业应用价值。
