gga-mir-146a-5p的抑制物在制备抗j亚群禽白血病病毒感染药物中的应用
技术领域
1.本发明涉及病毒学和分子生物学领域,具体涉及gga-mir-146a-5p的抑制物在制备抗j亚群禽白血病病毒感染药物中的应用。
背景技术:
2.j亚群禽白血病病毒(avian leukosis virus subgroup j,alv-j),是致癌性逆转录病毒,于1988年由英国科学家payne及其同事等发现并分离。据报道alv-j是一外源性白血病病毒与内源性e亚群病毒囊膜基因的重组体,在鸡群中可以通过垂直传播和水平传播。我国于1999年首次分离到alv-j,近年来alv-j的宿主范围逐步扩大可以感染我国各品系鸡群,并造成严重危害,已成为我国各种类型鸡群中危害最严重的alv流行亚群。近年来,甚至在其他禽类体内也检测到了alv-j阳性感染。由于alv-j导致鸡的免疫抑制、生长迟缓及多种肿瘤,其传播率也远高于其他alv亚群,并且动物机体对该病毒表现出免疫耐受,并且目前尚无有效疫苗和药物对其进行防治,从而使其控制和根除变得更加困难,因此需要开发针对alv-j防治的新措施。
3.microrna(mirna)是一种非编码rna,长度约为21-23个核苷酸左右,通过直接结合mrna并影响翻译效率或mrna丰度来控制蛋白水平。mirna依靠其成熟体发挥作用。mirna的成熟需要多个步骤,首先在聚合酶的作用下先转录为pri-microrna,大多数mirna的转录是由rna聚合酶ⅱ所介导的。pri-microrna通过两次剪切形成成熟体的mirna。当mirna与靶mrna几乎完全互补时可以导致靶mrna的降解,此现象常见于植物;而在动物中,mirna与靶mrna互补程度较低,可以在不影响靶mrna的表达下抑制翻译。有大量研究表明,mirna参与了动植物各种的生理病理过程,包括发育的调节、细胞的增殖分化与免疫活动的调节、病毒感染的发生发展等几乎所有生命活动。
4.病毒侵入机体后,mirna在病毒与宿主的互作过程中发挥着重要的调节作用。病毒与宿主都可以编码mirna,病毒所编码的mirna有利于帮助病毒规避宿主的免疫反应,而宿主所编码mirna的则对病毒的入侵有着促进或抑制的作用。由于目前尚无有效疫苗和药物对alv-j进行防治,因此开发一种可以有效抑制alv-j复制的mirna抑制物具有潜在的临床应用价值。
技术实现要素:
5.本发明的发明人针对现有技术存在的空白之处,提供了一种gga-mir-146a-5p的抑制物在制备抗alv-j病毒感染药物中的应用,该抑制物为gga-mir-146a-5p的互补序列,其核苷酸序列如seq id no:1所示,该抑制物可以阻断alv-j在细胞中的复制与增殖,可作为alv-j复制抑制剂应用,还可以制备成试剂盒和药物等配合净化应用。为抗alv-j的研究提供了新的思路和理论基础。
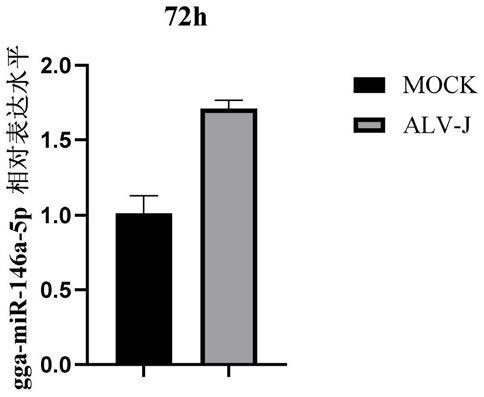
6.发明人首先研究了alv-j感染df-1后细胞中gga-mir-146a-5p的表达情况,结果显
146a-5pmimics在蛋白水平促进alv-j的复制。
具体实施方式
20.为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定,下述实施例中所使用的实验方法如无特殊说明,均为常规方法或直接交由基因公司完成;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
21.实施例1 alv-j感染显著上调df-1细胞中gga-mir-146a-5p的表达
22.(1)alv-j感染df-1细胞
23.将生长良好的df-1细胞从细胞瓶中消化下来以1
×
105均匀的铺板,当细胞生长到汇合度达70%时,将alv-j(毒株nx0101 genbank accession number dq115805.1,本领域常用毒株)病毒液置于冰上融化,用[moi]=1的alv-j感染细胞,同时设未接毒的对照(mock)组,病毒感作1.5h后弃掉病毒液,补充含1%fbs的dmem维持液维持细胞的生长,于37℃5%co2条件下培养,于接毒后72h收集细胞。
[0024]
(2)总rna提取,mirna第一链cdna的合成及荧光定量pcr
[0025]
使用trnzol试剂(购自北京tiangen公司)提取总rna,对于df-1细胞直接在培养板中加入trnzol universal试剂裂解细胞,对于组织取50mg组织加入1ml trnzol universal试剂,用匀浆仪进行匀浆处理。使用mircute增强型mirna cdna第一链合成试剂盒(购自北京tiangen公司)进行mirna反转录,每20ml体系中加入1ng rna;反转录程序为42℃60min,95℃3min。将反转录得到的cdna作为模板,使用mirna增强型mirna荧光定量检测试剂盒(sybr green)(购自北京tiangen公司)通过qpcr检测gga-mir-146a-5p的相对表达量,按照试剂盒说明书配置反应体系和设定反应程序。
[0026]
实验中的每个样品均设置3个重复,以u6为内参基因,其中u6的上游引物序列见seq id no:3(ctcgcttcggcagcaca),下游引物序列见seq id no:4(aacgcttcacgaatttgcgt);gga-mir-146a-5p上游引物序列见seq id no:5(gtgagaactgaattccatgggtt),下游引物为试剂盒中通用下游引物,用2-δδct
法比较相对表达水平,结果如图1所示alv-j感染显著上调了df-1细胞中gga-mir-146a-5p的表达。
[0027]
为了进一步研究gga-mir-146a-5p模拟物和抑制物与alv-j复制的关系,接下来的实施例将对gga-mir-146a-5p模拟物和抑制物与alv-j复制的关系进行研究。
[0028]
实施例2 gga-mir-146a-5p抑制物和模拟物对alv-j复制的影响
[0029]
为了检测gga-mir-146a-5p模拟物转染是否会影响alv-j的复制,我们合成了gga-mir-146a-5p的模拟物(mimics)和抑制物(inhibitor),
[0030]
gga-mir-146a-5p抑制物(inhibitor),其核苷酸序列如seq id no:1所示(aacccauggaauucaguucuca,由吉玛公司合成),
[0031]
gga-mir-146a-5p模拟物(mimics),其核苷酸序列如seq id no:2所示(ugagaacugaauuccauggguu,由吉玛公司合成);
[0032]
df-1细胞转染inhibitor或mimics 24h后接种alv-j,病毒感染48h后,收集细胞,提取细胞的蛋白质和rna,通过western blot及qrt-pcr的方法分别从蛋白和rna的水平检测alv-j的表达量。
[0033]
(1)gga-mir-146a-5p抑制物和模拟物转染
[0034]
gga-mir-146a-5p抑制物和模拟物转染前一天,将生长良好的df-1细胞从细胞瓶中消化下来并通过细胞计数板对细胞悬液进行计数,以每孔1
×
105均匀的铺板,当细胞的汇合度达到70%时进行转染。按照lipofectamine 3000(购自美国invitrogen公司)的转染方法,将gga-mir-146a-5p抑制剂或模拟物与lipofectamine 3000共同孵育制备混合液,将混合液加入细胞含10%fbs(胎牛血清,购自美国gibico公司)的dmem培养基(高糖型,购自美国hyclone公司)中,37℃5%co2条件下培养24h。
[0035]
(2)alv-j感染
[0036]
将alv-j(毒株nx0101 genbank accession number dq115805.1)病毒液置于冰上融化,df-1细胞转染24h后,用[moi]=1的alv-j感染细胞,感染48h后收集细胞,使用trizol试剂(购自美国invitrogen公司)提取细胞总rna。
[0037]
(3)alv-j rna定量检测
[0038]
rna的反转录步骤依据fastking gdna dispelling rt supermix试剂盒(购自北京tiangen公司)说明书进行,每20ml体系中加入1ng rna;反转录程序为42℃15min,95℃3min。将反转录得到的cdna作为模板,使用real-time pcr试剂盒(购自takara公司)通过qpcr检测alv-j病毒载量。按照试剂盒说明书配置反应体系和设定反应程序。
[0039]
实验中的每个样品均设置3个重复,以gapdh为内参基因,用2-δδct
法比较相对表达水平。gapdh的上游引物序列见seq id no:6(gaacatcatcccagcgtcca),下游引物序列见seq id no:7(cggcaggtcaggtcaacaac);alv-j gp85上游引物序上游引物序列见seq id no:8(tgcgtgcgtggttattatttc),下游引物序列见seq id no:9(aatggtgaggtcgctgactgt)。
[0040]
(4)alv-j蛋白定量检测
[0041]
利用western blot方法检测各组细胞内alv-j囊膜蛋白gp85的表达水平,内参基因选择β-actin,具体步骤如下:
[0042]
对于细胞样品:细胞用预冷的pbs洗涤三次,在ripa解液中加入pmsf,使得其终浓度为1mm。在冰上用裂解液裂解细胞约5min,用移液器反复吹打,充分裂解后收集到ep管中;4℃,12000
×
g离心5min,取上清,bca法测量蛋白浓度。蛋白变性:取适量的蛋白样品,加入5
×
的sds蛋白质上样缓冲液,混匀后于100℃水浴中变性5min;
[0043]
配制合适浓度的分离胶与浓缩胶,在电泳槽中加入足量1
×
的电泳缓冲液;每孔加入蛋白样品20g;蛋白marker加入10l;接通电源,浓缩胶处使用80v电压电泳30min,待染料进入分离胶与浓缩胶的分界线时,调整电压将至110v电泳1.5h左右,至溴酚蓝指示剂至分离胶的底部,关闭电源;
[0044]
电泳结束后撬开玻璃板,取下凝胶。根据目的蛋白大小,切取适宜的胶块。将pvdf膜剪至如凝胶大小并在在甲醇中活化约1min,然后置于电转缓冲液中浸泡约5min;按三明治法安装转印装置:即负极夹-海绵垫-三层滤纸-凝胶-pvdf膜-三层滤纸-海绵垫-正极夹,确保凝胶与pvdf膜之间没有气泡;将转印装置置于转移槽,使用快速转膜液(购自新赛美公司)400ma恒流转膜30min,将蛋白转至pvdf膜上。
[0045]
转膜结束后取下pvdf膜,tbst缓冲液漂洗5min,使用含5%脱脂奶粉的tbst溶液37℃封闭2h;封闭结束后,tbst缓冲液洗涤3次,每次10min。用特异性单克隆抗体4℃孵育过夜,tbst缓冲液洗涤3次,每次10min。加入hrp标记的羊抗鼠igg二抗,37℃孵育1h,tbst缓冲
液洗涤3次。
[0046]
曝光显色:避光条件下配制适量显影液,a液:b液=1:1,用显影液覆盖整张膜,在ecl化学发光显影仪中检测蛋白信号。
[0047]
结果如下:与转染inhibitor阴性对照组相比在df-1细胞中转染gga-mir-146a-5pinhibitor后可以在rna水平显著抑制alv-j的复制(如图2所示),同时在蛋白水平也显著抑制了alv-j的复制(如图3所示)。与转染mimics阴性对照组相比在df-1细胞中转染gga-mir-146a-5p mimics后可以在rna水平显著促进alv-j的复制(如图4所示),同时在蛋白水平也显著促进了alv-j的复制(如图5所示)。说明gga-mir-146a-5p抑制物(inhibitor)有抑制alv-j复制的功能,可作为alv-j复制抑制剂应用,还可以制备成试剂盒和药物等配合净化应用,为抗alv-j的研究提供了新的思路和理论基础。
