1.本发明涉及生物农药领域,具体涉及一株兼具拮抗大蒜根腐病病原菌和促生功能的真菌。
背景技术:
2.大蒜是百合科葱属多年生草本植物,是全国人民喜爱的香辛类蔬菜之一,同时也是我国重要的经济作物。随着对大蒜需求量的不断增加,大蒜的种植面积和连续种植年限不断攀升,导致连作障碍又称土壤衰颓(soil sickness),表现为大蒜根腐病的爆发,给农业生产、生态环境和食品安全带来诸多严重问题。研究发现,我国大蒜根腐病病原菌主要包括尖孢镰刀菌(fusarium oxysporum)、层出镰刀菌(fusarium proliferatum)、芬芳镰刀菌(fusarium redolens)、腐霉属(phthium)等多种病原菌;研究还发现,连续种植大蒜或者葱属其他作物会引起大蒜病原菌的积累,易发生多种病原菌的复合侵染。申请人团队通过对我国出口大蒜主产区大蒜根腐病病原菌的收集评价,除了发现常见大蒜根腐病病原菌外,还首次发现角担菌属(ceratobasidium)菌株ds54-3(y.s.yin,j.j.li,f.b.zhang,s.q.zhang and m.gao.first report of ceratobasidium sp.causing root rot of garlic in china.plant disease,2020 104(2):569)以下简称角担菌,和土栖棘壳孢菌(setophoma terrestris)菌株h5(zhang,f.b.,zheng,h.l.,cui,w.g.,zhang,m.q.,yin,y.s.,cui,m.,&gao,m.first report of setophoma terrestris causing pink root of garlic in china.plant disease.2019,103(3),584-584),可以引起大蒜根腐病和大蒜红根腐病,这是在我国首次发现的大蒜根腐病病原真菌,对这2种大蒜病原真菌的防控效果未见报道。
3.近年来,利用生物防治技术来防治土传病害成为国内外研究的热点,生防真菌中研究应用较多的是木霉菌属真菌、丛枝菌根真菌、非致病尖孢镰刀菌等。生物防治是利用一些有益微生物对土壤中的特定病原菌的寄生或产生有害物质或通过竞争营养和空间等途径来减少病原菌的数量和根系的感染,这种以菌治菌的拮抗方法可以避免传统农业防治和化学防治等方法带来的危害,是减少病害发生的一种良好的防治方法。
技术实现要素:
4.本发明所要解决的技术问题是如何抑制大蒜根腐病病原菌并促进大蒜生长。
5.为解决以上技术问题,本发明提供了一株talaromyces liani,该菌株对多种大蒜根腐病病原菌,如尖孢镰刀菌(fusarium oxysporum)、芬芳镰刀菌(fusarium redolens)、角担菌(ceratobasidium sp.)、腐皮镰刀菌(fusarium solani)和土栖棘壳孢菌(setophoma terrestris),均具有抑制作用;同时该菌株还具有促生功能。
6.本发明所提供的talaromyces liani,其菌株号为ds59-19f,其在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为cgmcc no.23222。
7.talaromyces liani ds59-19f具有seq id no.7所示its-rdna序列、seq id no.8
所示rpb2基因序列,以及seq id no.9所示cam基因序列。
8.talaromyces liani ds59-19f的培养物也属于本发明的保护范围。
9.本发明所提供的talaromyces liani ds59-19f的培养物,是将talaromyces liani ds59-19f在真菌培养基中培养得到的物质(培养容器内的所有物质)。
10.上述培养物中,所述物质包括talaromyces liani ds59-19f(菌体自身)和talaromyces liani ds59-19f的代谢物。
11.术语“代谢物”是指微生物新陈代谢过程中产生的初级代谢产物和/或次级代谢产物。初级代谢是指微生物从外界吸收各种营养物质,通过分解代谢和合成代谢,生成维持生命活动的物质和能量的过程。初级代谢的产物即为初级代谢产物,如单糖或单糖衍生物、核苷酸、维生素、氨基酸、脂肪酸等单体以及由它们组成的各种大分子聚合物,如蛋白质、核酸、多糖、脂质等。次级代谢是指微生物在一定的生长时期,以初级代谢产物为前体,合成一些对微生物的生命活动无明确功能的物质的过程。次级代谢的产物即为次级代谢产物,大多是分子结构比较复杂的化合物。根据其作用,可将其分为抗生素、激素、生物碱、毒素等类型。
12.上述培养物中,所述真菌培养基可为固体培养基或液体培养基。
13.术语“培养物”是指经人工接种和培养后,长有微生物群体的液体或固体培养基的统称。即通过将微生物进行生长和/或扩增而获得的产物,其可以是微生物的生物学纯培养物,也可以含有一定量的培养基、代谢物或培养过程中产生的其他成分。术语“培养物”还包括通过将微生物传代而获得的传代培养物,其可以是某一代的培养物,也可以是若干代的混合物。
14.在本发明的具体实施方式中,所述真菌培养基具体为pd培养基或pda培养基。
15.为解决以上技术问题,本发明提供了菌剂。
16.本发明所提供的菌剂为含有talaromyces liani ds59-19f、talaromyces liani ds59-19f的代谢物和/或talaromyces liani ds59-19f的培养物。
17.上述菌剂中,所述菌剂可为病原菌抑制剂、病害抑制剂、促进植物生长的菌剂和/或提高植物产量的菌剂。
18.上述菌剂中,所述病原菌抑制剂可对大蒜根腐病病原菌具有抑制作用;所述病害可为大蒜根腐病。
19.上述菌剂中,所述病原菌抑制剂可对如下大蒜根腐病病原菌中的全部或部分具有抑制作用:尖孢镰刀菌(fusarium oxysporum)、芬芳镰刀菌(fusarium redolens)、角担菌(ceratobasidium sp.)、腐皮镰刀菌(fusarium solani)和土栖棘壳孢菌(setophoma terrestris)。
20.在本发明的具体实施方式中,所述尖孢镰刀菌(fusarium oxysporum)具体为尖孢镰刀菌(fusarium oxysporum)ds51-1f;所述芬芳镰刀菌(fusarium redolens)具体为芬芳镰刀菌(fusarium redolens)ds51-8f;所述角担菌(ceratobasidium sp.)具体为角担菌(ceratobasidium sp.)ds54-3;所述腐皮镰刀菌(fusarium solani)具体为腐皮镰刀菌(fusarium solani)h9;所述土栖棘壳孢菌(setophoma terrestris)具体为土栖棘壳孢菌(setophoma terrestris)h5。
21.上述菌剂中,所述菌剂的活性成分可为talaromyces liani ds59-19f、
liani ds59-19f。实验证明:该菌株可以拮抗3种常见大蒜根腐病原菌具有明显抑制效果;同时对在我国首次发现的大蒜根腐病病原菌角担菌(ceratobasidium sp.)和土栖棘壳孢菌(setophoma terrestris)也具有明显的拮抗效果。对尖孢镰刀菌(fusarium oxysporum)ds51-1f的抑菌率达到72.81%,对芬芳镰刀菌(fusarium redolens)ds51-8f的抑菌率达到71.69%、对腐皮镰刀菌(fusarium solani)h9的抑菌率达到78.81%,对角担菌(ceratobasidium sp.)ds54-3的抑菌率达到66.67%、对土栖棘壳孢菌(setophoma terrestris)h5的抑菌率达到75.00%。由于目前大蒜根腐病为多种病原菌的复合侵染,该菌株在作为生物农药防治大蒜根腐病方面具有广阔的应用前景。
45.通过温室栽培试验,发现接种活性菌剂——talaromyces liani ds59-19f菌丝悬浮液的大蒜幼苗与接种等量清水的大蒜幼苗有显著性差异,结果表明,talaromyces liani ds59-19f可以显著增加大蒜植株茎高、茎粗及鲜重等指标,具有促进大蒜幼苗生长从而提高大蒜产量的潜在开发能力。
46.保藏说明
47.分类命名:talaromyces liani;
48.参椐的生物材料:ds59-19f;
49.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心;
50.保藏机构简称:cgmcc;
51.地址:北京市朝阳区北辰西路1号院3号;
52.保藏日期:2021年8月30日;
53.保藏中心登记入册编号:cgmcc no.23222。
附图说明
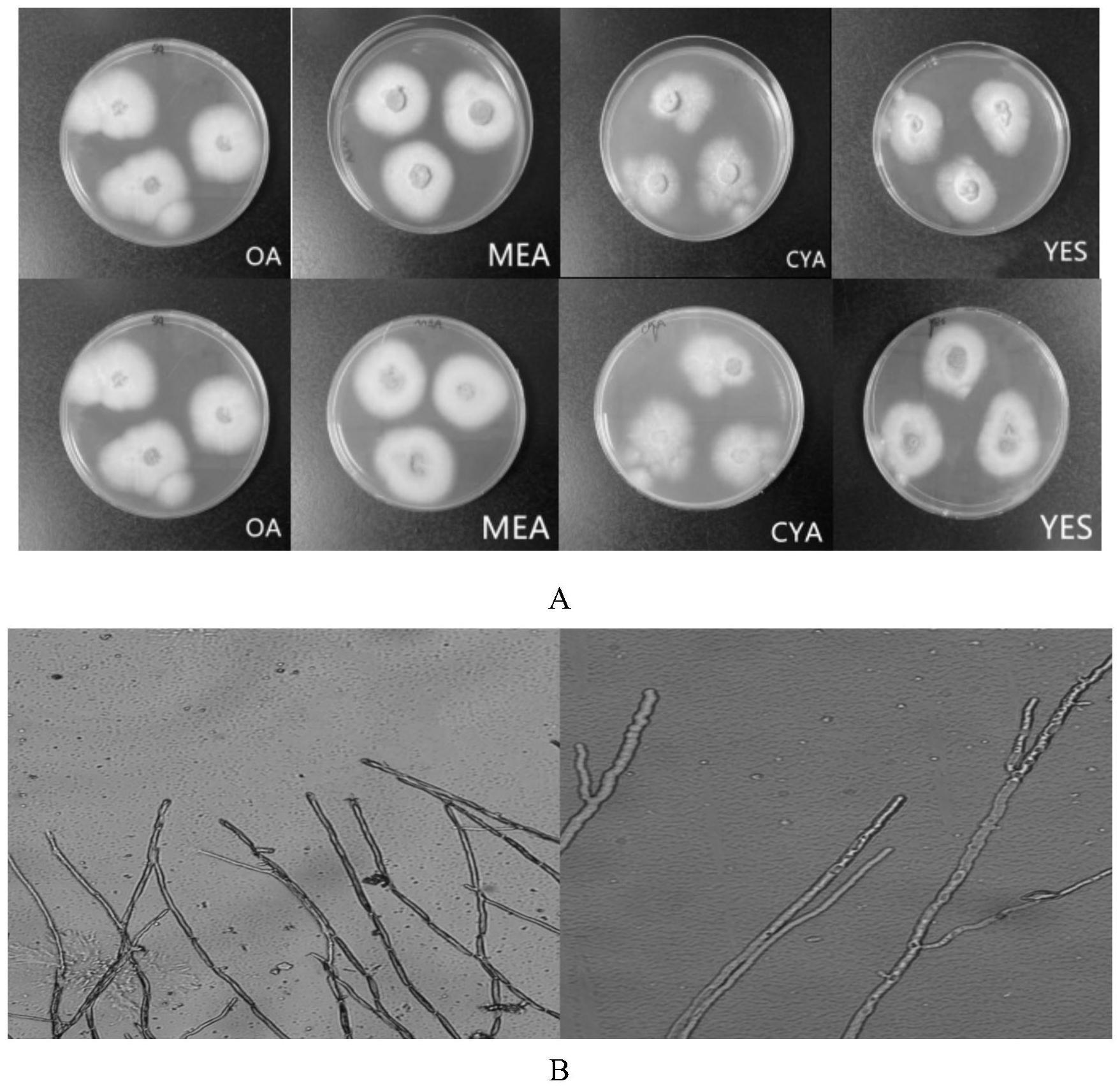
54.图1为菌株ds59-19f的菌落形态观察。a为分别在oa、mea、cya和yes培养基上培养3d后的菌落形态。b为光学显微镜观察图。
55.图2为基于its、rpb2以及cam基因构建分离株ds59-19f的系统发育树图。
56.图3为talaromyces liani ds59-19f与多种大蒜病原真菌对峙试验效果图。a中病原菌为尖孢镰刀菌(fusarium oxysporum)ds51-1f;b中病原菌为芬芳镰刀菌(fusarium redolens)ds51-8f;c中病原菌为角担菌(ceratobasidium sp.)ds54-3;d中病原菌为腐皮镰刀菌(fusarium solani)h9;e中病原菌为土栖棘壳孢菌(setophoma terrestris)h5。
57.图4为拮抗真菌talaromyces liani ds59-19f的温室水培防控效果图。左侧为病原菌土栖棘壳孢菌(setophoma terrestris)h5对照(即处理2);中间为同时接大蒜根腐病病原菌土栖棘壳孢菌(setophoma terrestris)h5和拮抗菌talaromyces liani ds59-19f(即处理3);右侧为清水对照(即处理1)。
58.图5为talaromyces liani ds59-19f的温室栽培促生验证图。a为接种15d效果图(左侧为阴性对照;中间为阳性对照;右侧为talaromyces liani ds59-19f。b为接种40d的盆栽效果图(左侧为阴性对照;中间为talaromyces liani ds59-19f;右侧为阳性对照),可以看出阴性对照植株已倒伏。c为阳性对照菌哈茨木霉accc 30371与不加菌剂的阴性对照的对比图(接种40d)(左侧为阳性对照;右侧为阴性对照)。d为talaromyces liani ds59-19f与不加菌剂的阴性对照的对比图(接种40d)(左侧为talaromyces liani ds59-19f;右
侧为阴性对照)。
具体实施方式
59.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
60.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
61.下述实施例中所用的培养基如下:
62.pd培养基:马铃薯200g切块,煮熟后过滤留液体,葡萄糖20g,加蒸馏水定容至1l,115℃灭菌25min,ph自然。
63.pda培养基:马铃薯200g切块,煮熟后过滤留液体,葡萄糖20g,琼脂18g,加蒸馏水定容至1l,115℃灭菌25min,ph自然。
64.土壤浸提液培养基:土壤过筛(50目)200g,琼脂18g,1%孟加拉红1ml,使用蒸馏水定容至1l,ph7.0左右。临用时每100ml培养基中加入0.1ml的1%链霉素。
65.oa培养基:燕麦片30g,琼脂粉18g,加蒸馏水定容至1l,115℃灭菌30min,ph自然。
66.mea培养基:麦芽浸粉20g,蛋白胨10g,葡萄糖20g,琼脂20g,加蒸馏水定容至1l,115℃灭菌30min,ph自然。
67.cya培养基:硝酸钠3.0g;氯化钾0.5g;硫酸镁0.5g;硫酸亚铁0.01g;酵母膏5.0g;蔗糖30.0g;加蒸馏水定容至1l,115℃灭菌30min,ph自然。
68.yes培养基:酵母浸粉20g,蔗糖150g,mgso4·
7h2o 0.5g,琼脂20g,加蒸馏水定容至1l,115℃灭菌30min,ph自然。
69.实施例1、talaromyces liani ds59-19f的分离纯化与鉴定
70.一、菌株ds59-19f的分离纯化
71.在100ml无菌水中加入10g土壤样品(采自中国出口大蒜主产区山东省济宁市金乡县多个大蒜种植地35.19
°
n,116.38
°
e、35.21
°
n,116.49
°
e、35.19
°
n,116.23
°
e、35.03
°
n,116.18
°
e),振荡培养30min制成混浊液。吸取1ml上述混浊液加入盛有9ml无菌水中的试管中充分混匀(此时稀释度记为10-1
),然后从此试管中吸取1ml加入到另一盛有9ml无菌水的试管中混合均匀,以此类推制成10-2
、10-3
、10-4
、10-5
不同稀释度的菌悬液。将各稀释度取0.1ml均匀涂布在pda固体培养基和土壤浸提液培养基平板上,每种浓度做3个平行,28℃恒温静置培养2-3天。待菌落形成后,在pda培养基平板或土壤浸提液培养基平板上进行多轮菌种纯化,致菌株完全纯化,总培养周期大于三周。
72.从健康大蒜土壤样品中分离纯化真菌共计42株,其中土壤浸提液培养基上分离为18株,pda培养基上分离得到24株。将上述土壤真菌在pda斜面4℃冰箱中暂存,同时在30%甘油管中各接5份保藏于超低温冰箱内。
73.采用五点对峙法,初步筛选上述分离的42株对多种大蒜病原真菌的拮抗能力,结果显示编号为ds59-19f的菌株对多种大蒜根腐病病原菌均具有较好的拮抗效果(详见实施例2),因此取编号为ds59-19f的菌株进行下述鉴定。
74.二、菌株ds59-19f的鉴定
75.1、形态学鉴定
76.在菌株ds59-19f已经纯化的菌落边缘处取直径大小相同的菌饼,置于培养基(oa、mea、cya和yes培养基)中心,观察菌株的生长速率及在培养过程中的生长状况、菌落颜色、菌丝形态特征等性状。
77.结果表明,上述步骤一分离并纯化得到的ds59-19f在28℃培养7d后,菌落呈圆形,表面黄色、边缘规则,背面橙红色,表面粗糙且有凸起,菌丝向四周延伸。镜检未发现孢子(见图1)。
78.2、分子生物学鉴定
79.dna提取:刮取适量菌株ds59-19f的菌丝放入无菌离心管中,在-80℃放置30min以上,开始进行dna提取前,在每管离心管中放入钢珠1颗,通过冻融细胞破碎仪以50/60hz的频率振荡3min,取出后按照真菌基因组提取试剂盒(北京擎科生物科技有限公司)操作步骤依次进行,dna收集在新的离心管并利用超微量分光光度计测定浓度,达到合格的dna可进行pcr扩增。
80.pcr扩增:its-rdna区段对于一部分真菌相对保守,不足以支持一些菌株的鉴定结果确定到种,因此一些种属需要多基因综合鉴定。在本实例中除了对its进行鉴定外,还对cam及rpb2两种基因进行了鉴定,引物序列如下:
81.its-f:5
’‑
tccgtaggtgaacctgcgg-3’(seq id no.1);
82.its-r:5
’‑
tcctccgcttattgatatgc-3’(seq id no.2);
83.cam-f:5
’‑
gccgactctttgacygargar-3’(seq id no.3);
84.cam-r:5
’‑
tttytgcatcatragytggac-3’(seq id no.4);
85.rpb2-f:5
’‑
gaygaymgwgatcayttygg-3’(seq id no.5);
86.rpb2-r:5
’‑
cccatrgcttgyttrcccat-3’(seq id no.6)。
87.在上述引物中,y为t或c;r为g或a;m为a或c;w为a或t。
88.pcr反应体系:上下游引物各1μl,taq pcr starmix(with loading dye)12.5μl,菌株dna模板3μl,ddh2o 7.5μl,总体系25μl。
89.its基因pcr扩增程序:94℃4min,94℃30s,53℃40s,72℃1min(30个循环),72℃10min。
90.rpb2基因pcr扩增程序:94℃2min,94℃1min,50℃2min,72℃3min(35个循环),72℃7min。
91.cam基因pcr扩增程序:94℃1min,94℃1min,62℃30s,72℃90s(42个循环),72℃10min。
92.pcr产物检测与测序:配制浓度为1%的琼脂糖凝胶,在首位或末位胶孔中加入dna marker 1μl,其他胶孔中加入pcr产物2μl,在120v电压下,电泳20min,并在凝胶成像系统下观察条带情况,进行图像采集。
93.样品扩增成功后,将其送至公司(上海生工生物工程股份有限公司进行测序,菌株ds59-19f的its-rdna的序列如seq id no.7所示、rpb2基因如seq id no.8所示、cam基因如seq id no.9所示。将菌株ds59-19f的its-rdna、rpb2基因和cam基因序列在ncbi blast(https://blast.ncbi.nlm.nih.gov/blast.cg)比对,下载模式菌株的相关序列,利用
mega7.0软件进行序列进化分析,使用邻接法(neighbour-joining methods,n-j)构建系统发育树,确定菌株的分类地位。
94.结果表明,菌株ds59-19f与talaromyces liani cbs 225.66聚在同一个分支上,亲缘关系达到98%,同时两株菌与talaromyces brevis cbs 141833聚在一个大分支上(见图2)。
95.通过上述形态学和分子生物学鉴定,菌株ds59-19f鉴定为talaromyces liani,该菌株已于2021年8月30日保藏于中国普通微生物菌种保藏管理中心(china general microbiological culture collection center,简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.23222。
96.实施例2、talaromyces liani ds59-19f平板对峙验证实验
97.采用五点对峙法,初步筛选实施例1步骤一分离得到的42株真菌对多种大蒜病原真菌真菌的拮抗能力,包括:尖孢镰刀菌(fusarium oxysporum)ds51-1f、芬芳镰刀菌(fusarium redolens)ds51-8f、角担菌(ceratobasidium sp.)ds54-3、腐皮镰刀菌(fusarium solani)h9和土栖棘壳孢菌(setophoma terrestris)h5。其中,大蒜根腐病病原菌角担菌(ceratobasidium sp.)ds54-3(记载于“y.s.yin,j.j.li,f.b.zhang,s.q.zhang and m.gao.first report of ceratobasidium sp.causing root rot of garlic in china.plant disease,2020 104(2):569”一文,公众可从申请人处获得,仅可用于重复本发明实验使用,不得他用)和大蒜红根腐病病原菌土栖棘壳孢菌(setophoma terrestris)h5(记载于“zhang,f.b.,zheng,h.l.,cui,w.g.,zhang,m.q.,yin,y.s.,cui,m.,&gao,m.first report of setophoma terrestris causing pink root of garlic in china.plant disease.2019,103(3),584-584”一文,公众可从申请人处获得,仅可用于重复本发明实验使用,不得他用)为申请人所在团队在我国大蒜中首次发现的病原真菌,对这2种大蒜病原菌的防控效果未见报道。腐皮镰刀菌(fusarium solani)h9记载于“汪甜等.我国大蒜主产区大蒜根腐病病原真菌的分离及致病性初步研究.中国土壤与肥料,2020-12-08”一文,公众可从申请人处获得,仅可用于重复本发明实验使用,不得他用。结果显示:talaromyces liani ds59-19f对多种大蒜根腐病病原菌均具有较好的拮抗效果。
98.采用两点对峙法,进一步研究talaromyces liani ds59-19f对多种大蒜病原真菌,包括尖孢镰刀菌(fusarium oxysporum)ds51-1f、芬芳镰刀菌(fusarium redolens)ds51-8f、角担菌(ceratobasidium sp.)ds54-3、腐皮镰刀菌(fusarium solani)h9和土栖棘壳孢菌(setophoma terrestris)h5的拮抗能力,并计算抑菌率。选用pda平板,在距离平板中心2cm的位置做上两个圆点标记,取talaromyces liani ds59-19f的一个菌饼接种在其中一点上,另一个点接种大蒜病原真菌的一个菌饼。针对每种大蒜病原菌真菌均设置对照组(选用pda平板,在距离平板中心2cm的位置做上两个圆点标记,其中一点接种大蒜病原真菌的一个菌饼,另一点上不接种拮抗菌)。每种大蒜病原菌真菌设置3个重复。在培养箱中28℃培养7天后,观察实验结果,拍照记录实验数据,测定其抑菌半径,计算抑菌率。
99.抑菌率(%)=(对照病原菌菌落直径-对峙病原菌菌落直径)/对照病原菌菌落直径
×
100%。
100.结果显示,talaromyces liani ds59-19f对尖孢镰刀菌(fusarium oxysporum)ds51-1f的抑菌率达到72.81%,对芬芳镰刀菌(fusarium redolens)ds51-8f的抑菌率达到
71.69%、对角担菌(ceratobasidium sp.)ds54-3的抑菌率达到66.67%、对腐皮镰刀菌(fusarium solani)h9的抑菌率达到78.81%,对土栖棘壳孢菌(setophoma terrestris)h5的抑菌率达到75.00%,具体平板对峙情况见图3。
101.实施例3、talaromyces liani ds59-19f温室水培防效验证
102.大蒜红根腐病病原菌株选择国内首次报道的大蒜红根腐病病原真菌土栖棘壳孢菌(setophoma terrestris)h5。将纯化好的大蒜红根腐病病原菌土栖棘壳孢菌(setophoma terrestris)h5和拮抗菌talaromyces liani ds59-19f的菌饼分别打入pd液体培养基,放入摇床并以180r/min的速度震荡,28℃恒温培养7天。
103.在装有600ml自来水的烧杯中,挑取无伤、生长情况良好、大小一致的健康大蒜经酒精表面杀菌后放在浮漂上,使根部没于自来水中。按时加水,使水量保持稳定。大蒜生长至幼苗期时,进行实验处理,选择病原菌最佳致病的孢子液浓度(1
×
108cfu/ml),拮抗菌孢子浓度与病原菌调至一致(1
×
108cfu/ml),待拮抗菌在定殖7d后采用伤根灌注法接种病原菌,接种时用无菌刀片划伤根部后每株用菌液灌根,以浇灌清水作对照。处理1:清水对照;处理2:接大蒜根腐病病原菌土栖棘壳孢菌(setophoma terrestris)h5的对照;处理3:同时接大蒜根腐病病原菌土栖棘壳孢菌(setophoma terrestris)h5和拮抗菌talaromyces liani ds59-19f。每组处理设置5个重复,共15个烧杯进行,定期观察大蒜感病与生长情况。大蒜苗期根部病害分级标准如下:
104.病害分级0级:
105.地上部表现:叶片鲜绿无病态特征。根部表现:蒜盘发根茂盛,无病态特征。
106.病害分级1级:
107.地上部表现:只有1片叶出现稍微褪绿,不多于25%萎蔫,茎基部稍软。根部表现:大体生长良好,水浸状病斑覆盖面积小于15%,蒜盘发根数无明显减少。
108.病害分级3级:
109.地上部表现:1-2片叶黄化,不多于25%以上75%以下的植株萎蔫,茎基部有水浸状出现。根部表现:水浸状病斑发生面积大于等于15%且小于50%,根短且发根减少。
110.病害分级5级:
111.地上部表现:叶片有2-3片变黄,植株矮小且有75%以上萎蔫,茎基部软且呈褐色水浸状。根部表现:水浸状病斑发生面积大于50%,根短且脆易断,蒜盘呈淡褐色且发根量明显减少。
112.病害分级7级:
113.地上部表现:叶片全部变枯黄,植株全部萎蔫矮小,茎基部腐烂严重。根部表现:水渍状病斑覆盖整个根系,蒜盘不发根。
114.发病计算公式为:
115.病情指数=(∑〖(发病级数
×
病株数)〗)/(调查总数
×
最高级数)
×
100(张博,2008,山东省大蒜腐霉根腐病初步研究.新疆农业大学)。
116.防治效果=(对照发病指数-处理发病指数)/对照发病指数
×
100%(张博,2008,山东省大蒜腐霉根腐病初步研究.新疆农业大学)。
117.结果显示,单接病原菌在接种7d左右开始大蒜出现感病症状,最初表现为长势渐弱、发根量少或不发根,地上部叶片逐渐萎蔫渐有枯黄,最终根部表现出腐烂状由根尖部向
根基部推移,且根部腐烂部位先由红色变为无色中空状态,表现出与土栖棘壳孢菌(setophoma terrestris)h5致病性测定现象一致的大蒜红根腐病症状,病情指数高达88.6%;接入拮抗真菌talaromyces liani ds59-19f的处理,较病原菌对照组有明显的防控效果,相对清水对照组虽有长势差异但大部分植株根部表现健康,病情指数为36.2%,多数呈现3级病症,而对照多5级及以上,防控效果达到59.1%,温室水培效果图见图4。
118.实施例4、talaromyces liani ds59-19f温室栽培促生验证
119.将talaromyces liani ds59-19f和阳性对照工厂化菌哈茨木霉accc 30371(来自中国农业微生物菌种保藏管理中心)分别接入pd培养基,置于摇床培养,180r/min,28℃,5d。使用pd培养基配制talaromyces liani ds59-19f菌丝悬浮液浓度为1
×
108cfu/ml备用。将大蒜消毒后种植于营养基质中,每盆3颗,放置在温室,每日浇水,不使用肥料。待大蒜幼苗长至10cm左右时,将制备好的菌丝悬浮液浇灌于大蒜周边,每盆50ml,以浇灌清水为阴性对照。种植40天后,观察现象并测量指标。
120.实验初期,接种talaromyces liani ds59-19f与阴性对照组无明显差异,15天以后,不加菌剂的阴性对照组逐渐出现垂叶现象,后期出现叶黄、枯叶现象,浇灌工厂化菌哈茨木霉accc 30371阳性对照组未明显出现枯叶现象,但是植株相对矮小,后期出现垂叶现象。具体表现如图5。经实际测量,接种talaromyces liani ds59-19f的植株在株高、茎粗和株鲜重指标上均明显高于阴性对照组(p《0.05),这表明真菌talaromyces liani ds59-19f在温室栽培阶段对大蒜幼苗具有明显促生效果,具体数据如下:
121.阴性对照组:
122.株鲜重(g):4.22
±
0.51。株高(cm):45.33
±
3.03。茎粗(cm):0.55
±
0.05。
123.阳性对照组:
124.株鲜重(g):8.01
±
0.83。株高(cm):54.54
±
2.36。茎粗(cm):0.65
±
0.04。
125.talaromyces liani ds59-19f组:
126.株鲜重(g):8.07
±
0.96。株高(cm):57.25
±
2.29。茎粗(cm):0.66
±
0.55。
127.上述各组中株高、茎粗和株鲜重的数值表示为“平均值
±
标准差”。
128.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
