使用索引和条形码在阵列上识别配体的方法和组合物
1.相关申请
2.本技术要求2019年10月1日提交的名称为“methods and compositions for sequencing nucleic acids on an array”的美国临时申请62/909,014和2019年9月20日提交的名称为“methods and compositions for high-throughput genotyping on arrays using indexes and barcodes”的美国临时申请62/903,108的优先权,这些美国临时申请各自全文以引用方式并入。
技术领域
3.本文提供的一些实施方案包括用于在阵列上检测靶配体的方法和组合物。在一些实施方案中,捕获探针特异性结合到来自样本的靶配体,确定阵列中包含该捕获探针的珠的位置,并且对该珠进行解码以识别该捕获探针和该样本。在一些实施方案中,条形码指示附接于珠的捕获探针;并且索引指示珠亚群。一些实施方案涉及在珠阵列上对几个不同核酸样本的靶多核苷酸进行测序。
背景技术:
4.生物样本中存在的特定核酸序列的检测已被用作例如鉴定和分类微生物、诊断传染病、检测和表征遗传异常、鉴定与癌症相关联的遗传变化、研究对疾病的遗传易感性,以及测量对各种类型的治疗的反应的方法。用于检测生物样本中的特定核酸序列的常用技术是核酸测序。
5.核酸测序方法已从maxam和gilbert所使用的化学降解方法以及sanger所使用的链延长方法得到了显著发展。现在使用了允许在单个芯片上并行处理数千个核酸的若干测序方法。一些平台包括基于珠的形式和微阵列形式,其中二氧化硅珠用探针官能化,这取决于此类形式在包括测序、基因分型、基因表达谱分析在内的应用中的应用。
6.在当前基于珠的阵列上对不同样本进行基因分型的方法需要垫片将珠芯片的不同区域物理地细分成多个扇区(sector)。然后将各个样本装载到由垫片创建的每个离散区段中。然而,此类方法可能以相对较低的样本数量输入使用,但当每个珠芯片的样本密度从每个珠芯片24个样本增加到每个珠芯片96、384、1536个或更多个样本时,这些方法被证明是费力的或难以管理的。
技术实现要素:
7.一些实施方案包括一种在阵列上对靶核酸进行测序的方法,其包括:(a)获得第一珠群体和第二珠群体,其中:所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点;(b)获得第一多个多核苷酸和第二多个多核苷酸,其中:所述第一多个多核苷酸包含第一靶核酸,其中所述多个第一多核苷酸在溶液中,并且所述第二多个多核苷酸
包含第二靶核酸,其中所述多个第二多核苷酸处于溶液中;(c)使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠;(d)将所述杂交的第一珠和所述杂交的第二珠随机分布在阵列上;(e)通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置;以及(f)使所述第一捕获探针和所述第二捕获探针延伸以获得所述第一靶核酸和所述第二靶核酸的核酸序列数据。
8.在一些实施方案中,所述第一多个多核苷酸包含第一索引和邻近所述第一索引的索引引物结合位点;并且所述第二多个多核苷酸包含第二靶核酸、第二索引和邻近所述第二索引的索引引物结合位点。
9.在一些实施方案中,所述第一多个多核苷酸或所述第二多个多核苷酸是通过用多个转座体对核酸样本进行片段标签化获得的。在一些实施方案中,所述多个转座体包含所述第一索引或所述第二索引。一些实施方案还包括向所述片段标签化的核酸样本添加衔接子,其中所述衔接子包含所述第一索引或所述第二索引。一些实施方案还包括用包含所述第一索引或所述第二索引的引物扩增所述片段标签化的核酸样本。
10.在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸将与所述第一索引和所述第二索引互补以及与所述第一索引引物结合位点和所述第二索引引物结合位点互补的序列掺入所延伸的捕获探针中。
11.在一些实施方案中,所述第一珠群体包含第一索引和邻近所述第一索引的索引引物结合位点,并且所述第二珠群体包含第二索引和邻近所述第二索引的索引引物结合位点。在一些实施方案中,所述第一珠群体的寡核苷酸包含所述第一索引;并且所述第二珠群体的寡核苷酸包含所述第二索引。在一些实施方案中,所述第一索引指示所述第一靶核酸的来源,并且所述第二索引指示所述第二靶核酸的来源。在一些实施方案中,所述第一索引彼此相同,并且所述第二索引彼此相同。
12.一些实施方案还包括对所述第一索引和所述第二索引进行测序。在一些实施方案中,对所述第一索引和所述第二索引进行测序包括使与所述索引引物结合位点杂交的引物延伸。在一些实施方案中,所述索引结合引物位点是相同的。
13.在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自不同的核酸样本。在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自基因组dna。
14.在一些实施方案中,所述第一条形码和所述第二条形码指示所述第一捕获探针或所述第二捕获探针的核酸序列。在一些实施方案中,所述第一条形码彼此不同,并且所述第二条形码彼此不同。在一些实施方案中,对所述第一条形码和所述第二条形码进行测序包括使与所述条形码引物结合位点杂交的引物延伸。在一些实施方案中,所述条形码引物结合位点是相同的。
15.在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括聚合酶延伸。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括向捕获探针添加单个核苷酸。一些实施方案还包括将基因座特异性寡核苷酸连接到所延伸的捕获探针。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括将基因座特异性寡核苷酸连接到所述捕获探针。
16.在一些实施方案中,步骤(c)在溶液中进行。
17.在一些实施方案中,所述阵列位于流通池的表面上。在一些实施方案中,所述第一珠和所述第二珠适于附接于所述阵列。在一些实施方案中,所述第一珠和所述第二珠包含生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,所述第一珠和所述第二珠是有磁性的。
18.一些实施方案包括一种在阵列上对靶核酸进行测序的方法,包括:(a)获得第一珠群体和第二珠群体,其中:所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点;(b)获得第一多个多核苷酸和第二多个多核苷酸,其中:所述第一多个多核苷酸包含第一靶核酸、第一索引和邻近所述第一索引的索引引物结合位点,其中所述多个第一多核苷酸在溶液中,并且所述第二多个多核苷酸包含第二靶核酸、第二索引和邻近所述第二索引的第二引物结合位点,其中所述多个第二多核苷酸处于溶液中;(c)使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠;(d)将所述杂交的第一珠和所述杂交的第二珠随机分布在阵列上;(e)通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置;(f)使所述第一捕获探针和所述第二捕获探针延伸以获得所述第一靶核酸和所述第二靶核酸的核酸序列数据;以及(g)通过对所述第一索引和所述第二索引进行测序来确定所述第一靶核酸和所述第二靶核酸的核酸序列数据的来源。
19.在一些实施方案中,所述第一多个多核苷酸包含第一索引和邻近所述第一索引的索引引物结合位点;并且所述第二多个多核苷酸包含第二靶核酸、第二索引和邻近所述第二索引的索引引物结合位点。
20.在一些实施方案中,所述第一多个多核苷酸或所述第二多个多核苷酸是通过用多个转座体对核酸样本进行片段标签化获得的。在一些实施方案中,所述多个转座体包含所述第一索引或所述第二索引。一些实施方案还包括向所述片段标签化的核酸样本添加衔接子,其中所述衔接子包含所述第一索引或所述第二索引。一些实施方案还包括用包含所述第一索引或所述第二索引的引物扩增所述片段标签化的核酸样本。
21.在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸将与所述第一索引和所述第二索引以及所述第一索引引物结合位点和所述第二索引引物结合位点互补的序列掺入所延伸的捕获探针中。
22.一些实施方案还包括一种在阵列上对靶核酸进行测序的方法,包括:(a)获得第一珠群体和第二珠群体,其中:所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点以及第一索引和邻近所述第一索引的索引引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点以及第二索引和邻近所述第二索引的索引引物结合位点;(b)获得第一多个多核苷酸和第二多个多核苷酸,其中:所述第一多个多核苷酸包含第一靶核酸,其中所述多个第一多核苷酸在溶液中,并且所述第二多个多核苷酸包含第二靶核酸,其中所述多个第二多核苷酸处于溶液中;(c)使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠;(d)将所述杂交的第一珠和所述杂交的第二珠随
机分布在阵列上;(e)通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置;以及(f)使所述第一捕获探针和所述第二捕获探针延伸以获得所述第一靶核酸和所述第二靶核酸的核酸序列数据。
23.在一些实施方案中,所述第一珠群体的寡核苷酸包含所述第一索引;并且所述第二珠群体的寡核苷酸包含所述第二索引。在一些实施方案中,所述第一索引指示所述第一靶核酸的来源,并且所述第二索引指示所述第二靶核酸的来源。在一些实施方案中,所述第一索引彼此相同,并且所述第二索引彼此相同。
24.一些实施方案还包括对所述第一索引和所述第二索引进行测序。在一些实施方案中,对所述第一索引和所述第二索引进行测序包括使与所述索引引物结合位点杂交的引物延伸。在一些实施方案中,所述索引结合引物位点是相同的。
25.在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自不同的核酸样本。在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自基因组dna。
26.在一些实施方案中,所述第一条形码和所述第二条形码指示所述第一捕获探针或所述第二捕获探针的核酸序列。在一些实施方案中,所述第一条形码彼此不同,并且所述第二条形码彼此不同。在一些实施方案中,对所述第一条形码和所述第二条形码进行测序包括使与所述条形码引物结合位点杂交的引物延伸。在一些实施方案中,所述条形码引物结合位点是相同的。
27.在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括聚合酶延伸。在一些实施方案中,所述第一捕获探针和所述第二捕获探针包括向捕获探针添加单个核苷酸。一些实施方案还包括将基因座特异性寡核苷酸连接到所延伸的捕获探针。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括将基因座特异性寡核苷酸连接到所述捕获探针。
28.在一些实施方案中,步骤(c)在溶液中进行。
29.在一些实施方案中,流通池包括所述阵列。在一些实施方案中,所述阵列包括多个孔。在一些实施方案中,所述第一珠和所述第二珠适于附接于所述阵列。在一些实施方案中,所述第一珠和所述第二珠包含生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,所述第一珠和所述第二珠是有磁性的。
30.一些实施方案包括一种试剂盒,包含:多个珠群体,所述多个珠群体包含附接于所述珠的寡核苷酸,所述寡核苷酸包含索引、邻近所述索引的索引引物结合位点、捕获探针、条形码和邻近所述条形码的条形码引物结合位点,其中所述索引在所述珠群体之间是不同的。在一些实施方案中,所述索引引物结合位点在所述多个群体中是相同的。在一些实施方案中,所述条形码指示所述捕获探针的核酸序列。在一些实施方案中,所述条形码在珠群体中是不同的。在一些实施方案中,所述条形码引物结合位点在所述多个群体中是相同的。一些实施方案还包括选自以下的试剂:基因座特异性寡核苷酸;用于对核酸样本进行片段标签化的转座体;包含索引和索引引物结合位点的转座体;包含索引和索引引物结合位点的衔接子;能够与索引引物结合位点或其互补序列杂交的引物;以及能够与条形码引物结合位点或其互补序列杂交的引物。一些实施方案还包括流通池。
31.一些实施方案包括一种制备索引珠群体的方法,包括:(a)获得珠群体,其中每个珠包含衔接子、捕获探针和包含条形码以及条形码引物结合位点的第一多核苷酸;(b)获得
多个索引多核苷酸,其中每个索引多核苷酸包含索引和索引引物结合位点;以及(c)将所述多个索引多核苷酸经由所述衔接子附接于所述珠群体,从而获得索引珠群体。
32.在一些实施方案中,(c)包括通过聚合酶延伸使所述衔接子延伸。
33.在一些实施方案中,每个索引多核苷酸包含衔接子结合位点,并且所述附接包括使所述衔接子结合位点与所述衔接子杂交。
34.在一些实施方案中,(c)包括将所述索引多核苷酸连接到所述衔接子。
35.在一些实施方案中,所述附接包括使夹板式(splint)多核苷酸与所述衔接子以及所述索引多核苷酸杂交。
36.在一些实施方案中,(c)包括将所述多个索引多核苷酸经由化学反应性部分附接于所述珠群体的衔接子。在一些实施方案中,所述附接包括点击化学反应。
37.在一些实施方案中,所述珠群体的所述第一多核苷酸包含彼此不同的捕获探针。
38.在一些实施方案中,每个索引多核苷酸的所述索引是相同的。
39.在一些实施方案中,所述第一多核苷酸包含所述捕获探针。
40.一些实施方案还包括使所述索引珠群体与包含靶核酸的多个核酸接触。
41.一些实施方案还包括将与包含靶核酸的多个核酸接触的所述索引珠群体与另外的索引珠群体混合,其中所述另外的索引珠群体包含索引多核苷酸,所述索引多核苷酸包含同与多个核酸接触的所述索引珠群体的索引不同的索引。
42.在一些实施方案中,所述捕获探针包含蛋白质。
43.在一些实施方案中,所述方法在流通池上进行。
44.一些实施方案包括一种用于检测靶配体的方法,包括:(a)获得珠群体,其中每个珠包含捕获探针、包含条形码的第一多核苷酸和条形码引物结合位点;(b)获得索引多核苷酸,所述索引多核苷酸包含索引、索引引物结合位点和能够与所述条形码引物结合位点结合的衔接子;(c)将靶配体与捕获探针特异性结合;(d)使所述索引多核苷酸经由所述衔接子与所述第一多核苷酸杂交;(e)在阵列上检测所述靶配体;以及(f)确定所述第一多核苷酸的所述索引和所述条形码。
45.在一些实施方案中,(e)包括将所述珠群体分布在阵列上。
46.在一些实施方案中,(f)包括使索引引物与所述索引引物结合位点杂交,并确定所述索引的序列。
47.在一些实施方案中,使所述索引多核苷酸与所述第一多核苷酸去杂交;使条形码引物与所述条形码引物结合位点杂交;以及使所述条形码引物延伸以确定所述条形码的序列。
48.在一些实施方案中,所述索引多核苷酸还包含位于所述衔接子与所述索引之间的可切割接头,并且(f)包括:(i)切割所述可切割接头;以及(ii)使所述衔接子延伸以确定所述条形码的序列。
49.在一些实施方案中,所述捕获探针包含蛋白质。
50.在一些实施方案中,所述靶配体包含靶核酸。在一些实施方案中,所述第一多核苷酸包含所述捕获探针。在一些实施方案中,(e)包括使与所述靶核酸杂交的所述第一多核苷酸延伸。在一些实施方案中,所述延伸包括添加可检测的双脱氧核苷酸。
51.在一些实施方案中,所述方法在流通池上进行。
52.一些实施方案包括一种用于检测靶配体的方法,包括:(a)获得珠群体,其中每个珠包含捕获探针、包含条形码的第一多核苷酸和条形码引物结合位点以及第二多核苷酸;(b)获得索引多核苷酸,所述索引多核苷酸包含索引、索引引物结合位点和衔接子;(c)将靶配体与捕获探针特异性结合;(d)使所述索引多核苷酸经由所述衔接子附接于所述第二多核苷酸;(e)在阵列上检测所述靶配体;以及(f)确定所述第一多核苷酸的所述索引和所述条形码。
53.在一些实施方案中,所述第二多核苷酸包含条形码和条形码引物结合位点。
54.在一些实施方案中,(d)包括将反应性部分添加到所述第二多核苷酸中,其中所述衔接子能够附接于所述反应性部分。在一些实施方案中,所述添加反应性部分包括点击化学反应。
55.在一些实施方案中,(e)包括将所述珠群体分布在阵列上。
56.在一些实施方案中,(f)包括使索引引物与所述索引引物结合位点杂交,并确定所述索引的序列。
57.在一些实施方案中,(f)包括使条形码引物与所述条形码引物结合位点杂交,并确定所述条形码的序列。
58.在一些实施方案中,所述捕获探针包含蛋白质。
59.在一些实施方案中,所述靶配体包含靶核酸。在一些实施方案中,所述第一多核苷酸包含所述捕获探针。在一些实施方案中,(e)包括使与所述靶核酸杂交的所述第一多核苷酸延伸。在一些实施方案中,所述延伸包括添加可检测的双脱氧核苷酸。
60.在一些实施方案中,所述方法在流通池上进行。
61.一些实施方案包括一种检测阵列上的靶配体的方法,包括:(a)获得第一珠群体和第二珠群体,其中每个珠包含:捕获探针,其中所述捕获探针能够与靶配体特异性结合,编码条形码和条形码引物结合位点的核酸,其中所述条形码指示所述捕获探针,以及编码索引和索引引物结合位点的核酸,其中所述索引指示来自所述第一群体或所述第二群体的所述珠的来源,以及(b)使所述第一珠群体与包含第一靶配体的第一样本接触,其中所述第一靶配体与所述第一珠群体的捕获探针特异性结合,并由此获得靶结合的第一珠群体;(c)使所述第二珠群体与包含第二靶配体的第二样本接触,其中所述第二靶配体与所述第二珠群体的捕获探针特异性结合,并由此获得靶结合的第二珠群体;(d)将所述靶结合的第一珠群体和所述靶结合的第二珠群体随机分布在阵列上;(e)检测包含所述阵列上的所述第一靶配体和所述第二靶配体的所述珠的位置;以及(f)确定包含所述阵列上的所述第一靶配体和所述第二靶配体的珠的所述索引和所述条形码的序列。
62.在一些实施方案中,所述捕获探针包含多核苷酸。在一些实施方案中,所述靶配体包含核酸。在一些实施方案中,检测包含所述阵列上的所述第一靶配体和所述第二靶配体的所述珠的位置包括通过聚合酶延伸或通过连接使所述捕获探针延伸。
63.在一些实施方案中,所述捕获探针包含蛋白质。
64.在一些实施方案中,步骤(e)在步骤(f)之后进行。
65.在一些实施方案中,所述第一珠群体的条形码包括彼此不同的条形码,并且所述第二珠群体的条形码包括彼此不同的条形码。
66.在一些实施方案中,所述第一珠群体的索引彼此相同,并且所述第二珠群体的索
引彼此相同。
67.在一些实施方案中,所述阵列位于流通池的表面上。在一些实施方案中,所述第一珠群体和所述第二珠群体适于附接于所述阵列。在一些实施方案中,所述第一珠群体和所述第二珠群体包含生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,所述第一珠群体和所述第二珠群体是有磁性的。
附图说明
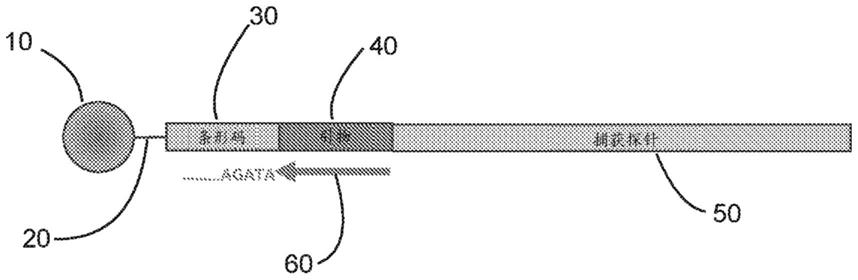
68.图1示出了包含条形码、引物结合位点和经由5’接头附接于珠的捕获探针的多核苷酸的示例性实施方案。
69.图2示出了包含捕获探针、条形码和引物结合位点的多核苷酸的示例性实施方案,该引物结合位点经由5’接头附接于珠,并且在捕获探针和条形码之间具有可切割接头。
70.图3示出了包含条形码、引物结合位点和经由3’接头附接于珠的捕获探针的多核苷酸的示例性实施方案。
71.图4示出了包含间隔区、条形码、引物结合位点和经由5’接头附接于珠的捕获探针的多核苷酸的示例性实施方案。
72.图5a示出了珠的示例性实施方案,该珠具有包含条形码、条形码引物结合位点和捕获探针的附接的第一多核苷酸,并且具有包含索引和索引引物结合位点的附接的第二多核苷酸。
73.图5b示出了包含与附接于珠的捕获探针杂交的单核苷酸多态性(snp)的靶核酸的示例性实施方案。
74.图5c示出了用可检测标记延伸的捕获探针的示例性实施方案。
75.图5d示出了与条形码引物结合位点杂交的条形码引物以及该条形码引物的延伸的示例性实施方案。
76.图5e示出了与索引引物结合位点杂交的索引引物以及该索引引物的延伸的示例性实施方案。
77.图6a示出了以下项的示例性实施方案:珠,该珠包含单个多核苷酸,该单个多核苷酸包含捕获探针(左图);珠,该珠包含:核酸捕获探针、包含指示该捕获探针的条形码的多核苷酸、以及包含将一个珠亚群与另一珠亚群区分开来的索引的多核苷酸(中间图);和珠,该珠包含:包含抗体或该抗体的抗原结合片段的捕获探针、包含指示该捕获探针的条形码的多核苷酸、以及包含将一个珠亚群与另一珠亚群区分开来的索引的多核苷酸(右图)。
78.图6b示出了以下项的示例性实施方案:珠,该珠包含与靶核酸杂交的第一捕获探针和第二捕获探针,其中第一捕获探针包含可切割接头(左图);以及珠,该珠包含蛋白质捕获探针,该蛋白质捕获探针瞬时结合基板以生成包含可检测标记的信号(右图)。
79.图6c示出了双探针测定的示例性实施方案,其中靶核酸与珠上的第一捕获探针和第二捕获探针杂交,第一捕获探针连接到第二捕获探针,并且可切割接头被切割以生成包含延伸的第一捕获探针的珠,该延伸的第一捕获探针包含可检测标记。
80.图7a是固定在流通池上的珠池的照片。
81.图7b是某些分组(bin)中某些珠类型的重复数的条形图。
82.图7c是平均c强度对平均t强度的图。平均c强度是来自一对核苷酸中的标记胞嘧
啶的荧光强度,平均t强度是来自一对核苷酸中的标记胸腺嘧啶的荧光强度。
83.图8是代表性样本的某些分组中某些珠类型的数量的直方图。
84.图9示出了用于在阵列上对靶核酸进行测序的工作流的实施方案,其中包含靶核苷酸的多核苷酸还包括索引。
85.图10示出了用于在阵列上对靶核酸进行测序的工作流的实施方案,其中珠包括索引。
86.图11示出了用于制备索引珠群体的工作流以及在多孔板中使用索引珠的实施方案,每个孔含有不同样本。
87.图12a是珠的示意图,该珠具有附接于该珠的第一多核苷酸和第二多核苷酸。第一多核苷酸包含代码,诸如条形码;引物a,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸包含索引。第二多核苷酸经由间隔区和接头x-y附接于珠。
88.图12a是珠的示意图,该珠具有附接于该珠的第一多核苷酸和第二多核苷酸。第一多核苷酸包含代码,诸如条形码;引物a,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸包含索引;和引物b,诸如索引引物结合位点。第二多核苷酸经由与第二多核苷酸和衔接子杂交的夹板附接于珠。第二多核苷酸可连接到衔接子。
89.图12c是珠的示意图,该珠具有附接于该珠的第一多核苷酸和第二多核苷酸。第一多核苷酸包含代码,诸如条形码;引物a,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸包含索引;引物b,诸如索引引物结合位点;和衔接子结合位点。第二多核苷酸经由与附接于珠的衔接子杂交附接于珠。可将衔接子延伸以掺入索引的互补序列;引物b。
90.图13a是珠的示意图,该珠具有附接于该珠的第一多核苷酸。第一多核苷酸包含代码,诸如条形码;引物,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸显示为包含索引;引物2,诸如索引引物结合位点;间隔区,该间隔区可包括任选的可切割位点,诸如尿苷切割位点;和衔接子,该衔接子与条形码引物结合位点杂交。
91.图13b示出了用于在阵列上检测靶核酸的工作流的实施方案,其中索引多核苷酸与附接于珠的第一多核苷酸杂交。
92.图14是珠的示意图,该珠具有附接于该珠的第一多核苷酸和第二多核苷酸。第一多核苷酸包含代码,诸如条形码;引物a,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸包含索引和索引引物结合位点的重复。
93.图15a示出了用于在阵列上检测靶核酸的工作流的实施方案,其中索引多核苷酸经由反应性基团附接于珠。
94.图15b示出了用于在阵列上检测靶核酸的工作流的实施方案,并且是图15a的工作流的延续。
具体实施方式
95.本文提供的一些实施方案包括用于在阵列上检测靶配体的方法和组合物。在一些实施方案中,靶配体可包括核酸、蛋白质或其他抗原。在一些实施方案中,捕获探针特异性结合到来自样本的靶配体,确定阵列中包含该捕获探针的珠的位置,并且对该珠进行解码以识别该捕获探针和该样本。在一些实施方案中,条形码指示附接于珠的捕获探针;并且索引指示珠亚群。在一些实施方案中,该条形码和该索引通过测序来确定。一些实施方案还包
括双探针测定,其中在靶核酸的存在下将附接于珠的第一捕获探针和第二捕获探针连接在一起,从珠切割连接产物的末端,并且在阵列上检测和解码包含延伸的捕获探针的珠。
96.本文提供的一些实施方案涉及阵列上的高通量基因分型。一些实施方案涉及解码微特征在阵列中的位置。在一些实施方案中,微特征包括具有条形码和索引的多核苷酸。一些实施方案包括对条形码和索引进行测序,以识别多核苷酸在阵列中的位置。对于本文公开的方法和组合物可能有用的某些方面公开于wo 2020/086746中,该专利全文以引用方式并入。
97.通过杂交解码包括识别捕获探针在随机分布的捕获探针阵列中的位置。该方法通常涉及使标记的杂交探针与捕获探针的一个或多个部分杂交、对杂交事件成像以及移除杂交探针的若干连续循环。通过杂交解码需专用试剂、专用流体设备和专用检测器。在一些实施方案中,通过杂交解码可花费长达8小时的7-8个连续循环。
98.本文提供的实施方案包括含有引物结合位点和条形码的多核苷酸的随机分布阵列。在一些实施方案中,可使用高通量测序系统容易地对条形码进行测序以解码阵列。一些实施方案可显著减少在没有额外试剂、杂交探针或专用解码设备的情况下解码阵列所花费的时间。
99.一些实施方案包括使用下一代测序(ngs)技术和基于珠的微阵列。一些此类实施方案提供了高性能、低成本和高通量的基因分型测定,这种测定可在通用ngs测序平台上运行,对基板和试剂进行微小的修改。
100.在一些多路复用(multiplex)方法中,可通过保持每个样本物理分离来并行处理来自不同来源的多个核酸样本。本文提供的一些实施方案包括核酸索引方法,该方法通过经由相关珠上的索引来索引每个样本,消除对在所有步骤中隔开各个样本的物理屏障的需要。在一些实施方案中,索引解复用(de-multiplex)通过测序执行,并且可使用标准的边合成边测序(sbs)化学在用户现场执行。此外,通过采用可使用标准平台和sbs化学在客户现场实现的通过测序解码(dbs)方法,减少了由于珠阵列的内部解码引起的成本、空间和时间限制。
101.一些实施方案包括含有图5a所示的珠的索引富集珠池。在一些此类实施方案中,珠包含:第一多核苷酸,该第一多核苷酸包含基因座特异性捕获探针、用于阵列上相关探针的位置识别的条形码和用于条形码的sbs读取的条形码引物结合位点;以及第二多核苷酸,该第二多核苷酸包含用于样本多路复用的索引和用于索引的sbs读取的索引引物结合位点。
102.在一些实施方案中,珠池复杂度由捕获探针的数量或丛(plexity,n)以及由所支持的样本数量(s)限定。因此,支持丛n和s个样本的珠池将由s
×
n个独特的珠类型组成。在一些实施方案中,捕获探针和/或索引引物包括额外的3
′
正交封闭剂,以避免在sbs期间对两种寡核苷酸之一的干扰。
103.一些实施方案包括进行基因分型测定,其中含有s个孔的多孔板装载有s个珠池,每个珠池具有独特的样本索引,其中每个孔含有n种独特的珠类型。在从样本生成核酸文库后,用包括随机引物扩增、随后酶促片段化和纯化的步骤处理核酸样本,将每个样本文库添加到索引孔中,并允许其与捕获探针杂交。在杂交完成后,通过添加包含荧光核苷酸和适当聚合酶的掺入混合物来执行单碱基延伸测定以探测感兴趣的snp。在掺入结束时,将板中的
所有珠捕获样本合并并装载到流通池中。流通池可以是普通的或有图案的,并且表面被适当地改性以支持珠在所需密度下的固定。在一些实施方案中,在珠固定时,执行snp读出,该snp读出包括单个扫描循环以读取来源于snp位点处的荧光掺入的信号。该循环可包括仪器上的sbs循环。还进行条形码读出,包括12-20个sbs循环(取决于珠池的多重性)来识别捕获探针和流通池内特定珠的位置。在一些实施方案中,该步骤可被经过所识别的snp的另外测序循环替换。还进行样本索引读出,包括6-12个sbs循环来读取样本索引。在一些实施方案中,整个流通池测定可包括少于约30个sbs循环,并且可在少于4小时内执行。
104.一些实施方案涉及在阵列上对靶多核苷酸进行测序的方法和组合物。一些实施方案涉及在珠阵列上对几个不同核酸样本的靶多核苷酸进行测序。在一些此类实施方案中,索引序列与来自核酸样本的靶核酸相关联。
105.在本发明的一个实施方案中,垫片不用于细分基因阵列的各个区域。相反,将索引序列添加到样本中以区分与珠杂交的样本并支持高度多重性样本池化。在一些实施方案中,可将索引添加到珠池或样本中。
106.实施方案涉及从许多不同核酸样本制备多核苷酸文库,并且确定每个核酸样本的靶核酸中某些特征(诸如单核苷酸多态性、插入、缺失)的存在。在阵列上并行询问多核苷酸文库的靶核酸的某些特征的存在。
107.在一些实施方案中,每个核酸样本与不同的索引序列相关联,使得来源于核酸样本的多核苷酸的文库包括相同的索引。通过使靶核酸与附接于珠的捕获探针选择性地杂交、使捕获探针延伸以及检测捕获探针在阵列上的延伸来在多核苷酸的文库中鉴定靶核酸。每个捕获探针可包括条形码,并且因此捕获探针可通过在阵列上对与捕获探针相关联的条形码进行测序来鉴定。在一些此类实施方案中,附接于珠的寡核苷酸包括捕获探针和条形码。
108.在一些实施方案中,可在阵列上对与多核苷酸相关联的索引进行测序。使捕获探针延伸的信号在阵列上的位置、条形码的序列和索引的序列可鉴定来自特定核酸样本的靶核酸中某个特征(诸如单核苷酸多态性、插入、缺失)的存在。在一些实施方案中,可在单个阵列上测试许多不同的核酸样本。
109.如本文所用,“阵列”可指不同微特征的群体,诸如包含多核苷酸的微特征,该微特征与表面相关联或附接,使得不同的微特征可根据相对位置彼此区分。阵列的单个特征可包括微特征的单个拷贝,或者该微特征的多个拷贝可作为阵列的单个特征处的微特征的群体而存在。每个特征处的微特征的群体通常是同质的,具有单个种类的微特征。因此,单个核酸序列的多个拷贝可存在于一个特征处,例如,存在于具有相同序列的多个核酸分子上。
110.在一些实施方案中,微特征的异质群体可存在于一个特征处。因此,一个特征可以但不必仅包括单个微特征种类,而是可包括多个不同的微特征种类,诸如具有不同序列的核酸的混合物。阵列的相邻特征可为彼此离散的,因为它们不重叠。因此,特征可彼此邻近或由缺口隔开。在特征间隔开的实施方案中,相邻位点可隔开例如小于100μm、50μm、10μm、5μm、1μm、0.5μm、100nm、50nm、10nm、5nm、1nm、0.5nm、100pm、50pm、1pm的距离或在前述距离中任两个距离的范围内的任何距离。阵列上特征的布局也可根据相邻特征之间的中心至中心距离来理解。可用于本发明的阵列可具有中心至中心间距小于约100μm、50μm、10μm、5μm、1μm、0.5μm、100nm、50nm、10nm、5nm、1nm、0.5nm、100pm、50pm、1pm或在前述距离中任两个距离
的范围内的任何距离的相邻特征。
111.在一些实施方案中,上文和本文其他地方所述的距离值可表示阵列的相邻特征之间的平均距离。因此,除非有相反的明确说明,例如通过距离构成阵列的所有相邻特征之间的阈值距离的明确说明,否则并非所有相邻特征都需要落入指定范围内。实施方案可与具有各种密度中的任一种密度的特征的阵列一起使用。某些实施方案的密度的示例范围包括约10,000,000个特征/cm2至约2,000,000,000个特征/cm2;约100,000,000个特征/cm2至约1,000,000,000个特征/cm2;约100,000个特征/cm2至约10,000,000个特征/cm2;约1,000,000个特征/cm2至约5,000,000个特征/cm2;约10,000个特征/cm2至约100,000个特征/cm2;约20,000个特征/cm2至约50,000个特征/cm2;约1,000个特征/cm2至约5,000个特征/cm2,或在前述密度中任两个密度的范围内的任何密度。
112.如本文所用,“表面”可指可与试剂、珠或分析物接触的基板或支撑结构的一部分。表面可为基本上平坦的或平面的。另选地,表面可为圆形的或轮廓状的。可包括在表面上的示例性轮廓为孔、凹陷、柱、脊、通道等。可用作基板或支撑结构的示例性材料包括:玻璃,诸如改性的或官能化的玻璃;塑料,诸如丙烯酸、聚苯乙烯或苯乙烯与另一种材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯或特氟隆;多糖或交联多糖,诸如琼脂糖或琼脂糖凝胶;尼龙;硝化纤维;树脂;二氧化硅或基于二氧化硅的材料,包括硅和改性硅;碳纤维;金属;无机玻璃;光纤束,或多种其他聚合物。单一材料或几种不同材料的混合物可形成可用于本发明的表面。在一些实施方案中,表面包括孔。在一些实施方案中,支撑结构可包括一个或多个层。示例性支撑结构可包括芯片、膜、多孔板和流通池。
113.如本文所用,“珠”可指由刚性或半刚性材料制成的小主体。主体可具有例如以球形、椭圆形、微球形或其他公认的颗粒形状为特征的形状,无论是具有规则的尺寸还是不规则的尺寸。可用于珠的示例性材料包括:玻璃,诸如改性的或官能化的玻璃;塑料,诸如丙烯酸、聚苯乙烯或苯乙烯与另一种材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯或特氟隆;多糖或交联多糖,诸如琼脂糖或琼脂糖凝胶;尼龙;硝化纤维;树脂;二氧化硅或基于二氧化硅的材料,包括硅和改性硅;碳纤维;金属;无机玻璃;或多种其他聚合物。示例性珠包括可控孔玻璃珠、顺磁性珠、氧化钍溶胶、琼脂糖珠、纳米晶体和本领域已知的其他珠。珠可由生物或非生物材料制成。由于在本文所述方法的各个步骤中使用磁体容易操纵磁珠,所以磁珠是特别有用的。用于某些实施方案中的珠可具有约0.1μm至约100μm,约0.1nm至约500nm的直径、宽度或长度。在一些实施方案中,用于某些实施方案中的珠可具有小于约100μm、50μm、10μm、5μm、1μm、0.5μm、100nm、50nm、10nm、5nm、1nm、0.5nm、100pm、50pm、1pm的直径、宽度或长度,或在前述直径、宽度或长度中任两个直径、宽度或长度的范围内的任何直径、宽度或长度。珠尺寸可被选择为具有减小的尺寸,从而获得每单位面积更多的特征,同时保持足够的信号(每个特征的模板拷贝)以便分析特征。
114.在一些实施方案中,多核苷酸可附接于珠。在一些实施方案中,珠可分布到基板表面上的孔内。可用于某些实施方案中的示例性珠阵列包括随机排序的beadarray技术(illumina公司(san diego ca))。此类珠阵列公开于:michael等人,anal chem,第70卷,第1242-1248页(1998年);walt,science,第287卷,第451-452页(2000年);fan等人,cold spring harb symp quant biol,第68卷,第69-78页(2003年);gunderson等人,第37卷,第549-554页(2005年);bibikova等人,am j pathol,第165卷,第1799-1807页(2004年);fan
等人,genome res,第14卷,第878-885页(2004年);kuhn等人,genome res,第14卷,第2347-2356页(2004年);yeakley等人,第20卷,第353-358页(2002年);以及bibikova等人,genome res,第16卷,第383-393页(2006年),这些文献中的每一篇均全文以引用方式并入。
115.如本文所用,“多核苷酸”和“核酸”可互换使用,并且可指任何长度的核苷酸的聚合形式,即核糖核苷酸或脱氧核糖核苷酸。因此,该术语包括单链、双链或多链dna或rna。术语多核苷酸还指双链分子和单链分子两者。多核苷酸的示例包括基因或基因片段、基因组dna、基因组dna片段、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、非编码rna(ncrna)诸如piwi相互作用rna(pirna)、小干扰rna(sirna)和长非编码rna(lncrna)、小发夹(shrna)、小核rna(snrna)、微rna(mirna)、小核仁rna(snorna)和病毒rna、核酶、cdna、重组多核苷酸、支链多核苷酸、质粒、载体、任何序列的分离dna、任何序列的分离rna、核酸探针、引物或前述任一项的扩增拷贝。多核苷酸可包含经修饰的核苷酸,诸如甲基化的核苷酸和核苷酸类似物,包括具有非天然碱基的核苷酸、具有经修饰的天然碱基诸如氮杂或去氮杂嘌呤的核苷酸。多核苷酸可由以下四个核苷酸碱基的特定序列构成:腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)和胸腺嘧啶(t)。当多核苷酸是rna时,尿嘧啶(u)也可例如作为胸腺嘧啶的天然替代物存在。尿嘧啶也可用于dna。因此,术语“序列”是指多核苷酸或任何核酸分子(包括天然碱基和非天然碱基)的字母表示。
116.如本文所用,“靶核酸”或其语法等同形式可指期望测序、分析和/或进一步操纵的核酸分子或序列。在一些实施方案中,靶核酸可附接于阵列。在一些实施方案中,可将捕获探针附接于阵列,并且该阵列随后用于检测与探针相互作用的样本中的靶核酸。就这一点而言,应当理解,在一些实施方案中,术语“靶”和“探针”可在核酸检测方法方面互换使用。
117.如本文所用,“捕获探针”可指具有足够的互补性以特异性杂交至靶核酸的多核苷酸。捕获探针可用作用于将靶核酸与混合物中的其他核酸和/或组分分离的亲和结合分子。在一些实施方案中,靶核酸可通过介入分子由捕获探针特异性结合。介入分子的示例包括接头、衔接子和其他具有足够互补性以特异性杂交至靶序列和捕获探针两者的桥接核酸。
118.如本文所用,“杂交”、“使
…
杂交”或其语法等同形式可指其中一种或多种多核苷酸反应形成复合物的反应,该复合物至少部分地经由核苷酸残基的碱基之间的氢键形成。氢键可通过watson-crick碱基配对、hoogstein结合或以任何其他序列特异性方式出现。复合物可具有形成双链体结构的两条链、形成多链复合物的三条或更多条链、单条自杂交链或它们的任何组合。除了氢键之外,这些链还可通过力交联或以其他方式接合。
119.如本文所用,“使
…
延伸”、“延伸”或其任何语法等同形式可指通过延伸酶诸如聚合酶向引物、多核苷酸或其他核酸分子添加dntp。例如,在本文所公开的一些方法中,所得的延伸引物包括rna的序列信息。虽然一些实施方案被论述为使用聚合酶诸如dna聚合酶或逆转录酶进行延伸,但延伸也可以本领域熟知的任何其他方式进行。例如,可通过将随机寡核苷酸的短片段连接在一起来进行延伸,该随机寡核苷酸诸如已杂交至感兴趣的链的寡核苷酸。
120.如本文所用,“连接”、“将
…
连接”或其其他语法等同形式可指通过磷酸二酯键接合两条核苷酸链。此类反应可由连接酶催化。连接酶是指通过atp或类似的三磷酸酯的水解来催化该反应的一类酶。
121.通过测序解码
122.本文提供的方法和组合物的一些实施方案包括使用高通量测序来解码阵列的微特征的位置。在一些实施方案中,阵列的微特征包括多核苷酸。在一些实施方案中,多核苷酸可随机分布在基板的表面上。在一些实施方案中,多核苷酸可包含引物结合位点和条形码。在一些实施方案中,多核苷酸可包含捕获探针、引物结合位点和条形码。
123.解码多核苷酸在阵列中的位置的一些实施方案可包括(a)获得基板,所述基板具有分布在基板的表面上的多核苷酸阵列,其中每个多核苷酸包含条形码和引物结合位点;(b)使多个引物与所述引物结合位点杂交;以及(c)通过使杂交的引物延伸来确定条形码的序列。在一些此类实施方案中,每个条形码的序列可指示多核苷酸在阵列中的位置。例如,在一些实施方案中,可用多核苷酸制备阵列,其中条形码已知与某些捕获探针相关联,使得识别阵列上条形码的位置可指示相关联的捕获探针的位置。在此类实施方案中,每个多核苷酸可通过共同元件与捕获探针相关联。例如,多核苷酸和捕获探针可各自结合到相同的微特征诸如珠。在更多此类实施方案中,每个多核苷酸可包含捕获探针。
124.在一些实施方案中,条形码可包括可用于识别阵列内的多核苷酸的核酸序列。该条形码可包括与其他条形码可区分的独特核苷酸序列。该条形码还可通过条形码的序列,也可通过条形码在多核苷酸内的位置,例如通过引物结合位点的5’位置,与多核苷酸和靶核酸中的其他核苷酸序列区分开来。例如,在一些实施方案中,条形码的序列可在多个核酸中存在不止一次,然而,位于引物结合位点5’处的条形码可被检测到。条形码可具有足以成为群体中的多个条形码内和/或被分析或询问的多个多核苷酸和靶核酸内的独特核苷酸序列的任何期望序列长度。在一些实施方案中,条形码是在约6-30个核苷酸范围内的多核苷酸内的核酸或区域。条形码可为例如6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸或更长。例如,条形码可为35、40、45或50个核苷酸或更长。用于一些实施方案的合适的条形码公开于美国专利8,053,192,该专利全文以引用方式并入。在一些实施方案中,条形码可将阵列中的一个多核苷酸与另一个多核苷酸区分开来,使得每个条形码不同于另一个条形码。在一些实施方案中,条形码可将阵列中多核苷酸的一个群体与多核苷酸的另一个群体区分开来,使得一组条形码不同于另一组条形码。对于本文提供的方法和组合物有用的一些方面公开于u.s.20180334711a1和u.s.20190085384a1中,这些专利各自全文以引用方式并入。在一些实施方案中,条形码可包括独特分子标识符(umi)。
125.在一些实施方案中,引物结合位点可以是条形码的3’,使得与引物结合位点杂交的引物可被延伸以提供条形码的互补序列。例如,引物可被延伸以获得条形码的序列。在一些实施方案中,引物结合位点可直接邻近多核苷酸中的条形码。在一些实施方案中,多核苷酸的群体中的每个引物结合位点可具有相同的序列。在一些实施方案中,多核苷酸的一个亚群可包括具有第一序列的引物结合位点,并且多核苷酸的另一亚群可包括具有第二序列的引物结合位点。在一些实施方案中,使不同引物与多个不同引物结合位点杂交可以是同时的、顺序的或迭代的。
126.一些实施方案包括含有捕获探针的多核苷酸。在一些实施方案中,捕获探针可包括能够与靶核酸杂交的序列。在一些实施方案中,多核苷酸的群体可包括彼此不同的捕获探针。在一些实施方案中,每个捕获探针可彼此不同。在一些实施方案中,捕获探针可彼此相似,例如它们可具有相似的序列和/或具有相似长度的相似序列。在一些实施方案中,捕
获探针可与另一个捕获探针相差少于20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3或2个核苷酸的数量,其中核苷酸的数量可为捕获探针中的连续核苷酸、非连续核苷酸、插入核苷酸或缺失核苷酸。在一些实施方案中,捕获探针可与另一个捕获探针相差单个核苷酸。在一些实施方案中,引物结合位点和条形码可以是捕获探针的5’。在一些实施方案中,引物结合位点和条形码可以是捕获探针的3’。
127.一些实施方案包括含有可切割接头的多核苷酸。在一些此类实施方案中,可将可切割接头定位成使得切割接头可将捕获探针与引物结合位点和条形码分离。在一些实施方案中,可切割接头可位于捕获探针、引物结合位点和条形码之间的多核苷酸内。在一些实施方案中,可切割接头可移除包含引物结合位点和连接到捕获探针的条形码的多核苷酸。例如,多核苷酸和捕获探针均可与珠结合。可切割接头的切割可从珠中移除包含引物结合位点和条形码的多核苷酸。
128.在一些实施方案中,可切割接头可具有对应于至少2、3、5、10、15、20、25、30、50、100、500个核苷酸的长度,或在前述长度的任两个长度的范围内的长度。在一些实施方案中,可切割接头易于被试剂诸如光、碱、酸和/或酶诸如序列特异性限制酶或蛋白酶切割。可切割接头可包括一定的核苷酸序列,诸如酶的识别位点,并且/或者可包括易于用试剂切割的某些经修饰的核苷酸。在一些实施方案中,可切割接头可包括尿嘧啶,其可被外源碱基切割剂诸如dna糖基化酶(udg)切割。在一些实施方案中,可切割接头可包括8-羟基鸟嘌呤,其可被8-羟基鸟嘌呤dna糖基化酶(fpg蛋白)切割。可切割接头的更多示例公开于美国专利申请公布2005/0181394中,该专利全文以引用方式并入。
129.在一些实施方案中,多核苷酸附接于基板。在一些实施方案中,基板可包括珠。可通过在多核苷酸的5’端或3’端处或附近与基板表面的单点共价附接,将多核苷酸固定到基板上,诸如珠或其他表面上。在一些实施方案中,多核苷酸可包含附接于基板的间隔区。在一些实施方案中,间隔区可具有对应于至少2、3、5、10、15、20、25、30、50、100、500个核苷酸的长度,或在前述长度的任两个长度的范围内的长度。本领域已知的任何合适的共价附接方式均可用于此目的。所选择的附接化学将取决于固体载体的性质,以及对其应用的任何衍生化或官能化。多核苷酸可包含可为非核苷酸化学修饰的部分,以促进附接。在一些实施方案中,多核苷酸可包含例如位于5’端的含硫亲核试剂,诸如硫代磷酸酯或硫代磷酸盐。就固体承载的聚丙烯酰胺水凝胶而言,该亲核试剂将与水凝胶中存在的溴乙酰胺基团结合。将多核苷酸附接于固体载体的示例性方式是经由5’硫代磷酸酯附接于由聚合的丙烯酰胺和n-(5-溴乙酰氨基戊基)丙烯酰胺(brapa)构成的水凝胶,其公开于美国专利8,168,388中,该专利全文以引用方式并入。
130.在一些实施方案中,阵列中多核苷酸的位置可通过对多核苷酸的条形码进行测序来解码。例如,条形码序列可与阵列上的位点相关联,并且该位点可与特定捕获探针相关联。一些实施方案包括下一代测序(ngs),其可指允许克隆扩增分子和单个核酸分子的大规模平行测序的测序方法。ngs的示例包括边连接边测序和使用可逆染料终止子的边合成边测序(sbs)。在sbs中,监测核酸引物沿核酸模板的延伸,以确定模板中核苷酸的序列。基础化学过程可以是聚合。在特定的基于聚合酶的sbs实施方案中,以依赖于模板的方式添加荧光标记的核苷酸以使引物延伸,使得对添加至引物的核苷酸的顺序和类型的检测可用于确定模板的序列。
131.可对一个或多个扩增的核酸进行sbs或涉及在循环中重复递送试剂的其他检测技术。例如,为了启动第一sbs循环,可使一个或多个标记的核苷酸、dna聚合酶等流入/流过容纳有一个或多个扩增核酸分子的水凝胶珠。可以检测其中引物延伸引起标记核苷酸掺入的那些位点。任选地,核苷酸还可以包括一旦将核苷酸添加到引物就终止进一步的引物延伸的可逆终止属性。例如,可以将具有可逆终止子部分的核苷酸类似物添加到引物,使得随后的延伸直到递送解封闭剂以除去该部分才发生。因此,对于使用可逆终止的实施方案,可在检测发生之前或之后将解封闭试剂递送到流通池。洗涤可以在各个递送步骤之间进行。然后可重复该循环n次以将引物延伸n个核苷酸,从而检测长度为n的序列。
132.一些sbs实施方案包括检测在核苷酸掺入延伸产物时释放的质子。例如,基于对释放的质子的检测的测序可使用电检测器和可商购获得的相关技术。此类测序系统的示例是焦磷酸测序,诸如可从454life sciences(roche的子公司)商购获得的平台;使用γ-磷酸标记的核苷酸的测序,诸如可从pacific biosciences商购获得的平台;以及使用质子检测的测序,诸如可从life technologies的ion torrent子公司商购获得的平台。一些实施方案包括焦磷酸测序,该焦磷酸测序描述于美国专利申请公布2005/0130173和2006/0134633以及美国专利4,971,903;6,258,568和6,210,891中,这些专利各自全文以引用方式并入。一些实施方案包括连接法测序,该边连接边测序公开于美国专利5,599,675;和美国专利5,750,341中,这些专利中的每一篇均全文以引用方式并入。
133.一些实施方案可利用涉及dna聚合酶活性的实时监测的方法。例如,核苷酸掺入可通过带有荧光团的聚合酶与γ-磷酸标记的核苷酸之间的荧光共振能量转移(fret)相互作用来检测,或者用零模式波导(zmw)来检测。另一种可用的测序技术是纳米孔测序。在一些纳米孔实施方案中,靶核酸或从靶核酸除去的单独核苷酸穿过纳米孔。当核酸或核苷酸穿过纳米孔时,可通过测量孔的电导率的波动来识别每种核苷酸类型。
134.如图1所示,在一些实施方案中,阵列的微特征可包括经由5’接头20附接于珠10的多核苷酸。多核苷酸可包含条形码30、引物结合位点40和捕获探针50。引物60可与引物结合位点杂交并被延伸以获得条形码的序列,从而解码阵列中微特征的位置。在一些实施方案中,捕获探针可与靶核酸杂交,并且捕获探针可例如通过聚合酶或通过连接酶延伸。在一些实施方案中,捕获探针可参与桥式扩增。桥式扩增的方法公开于美国专利7,985,565和7,115,400,这些专利各自全文以引用方式并入。
135.如图2所示,在一些实施方案中,阵列的微特征可包括多核苷酸,该多核苷酸包含捕获探针50、条形码30和引物结合位点40,其中该多核苷酸经由5’接头20附接于珠10。在一些实施方案中,多核苷酸可包含捕获探针和条形码之间的可切割接头70。在一些实施方案中,引物60可与引物结合位点杂交,并确定条形码的序列,从而解码芯片中微特征的位置。在一些实施方案中,可切割多核苷酸,并且从包括珠和捕获探针的微特征移除条形码和引物结合位点。一些此类实施方案在使靶核酸与捕获探针杂交之前提供解码阵列。在一些实施方案中,靶核酸可在阵列中的解码位置处与捕获探针杂交。在一些实施方案中,杂交的捕获探针可例如通过聚合酶或通过连接酶延伸。在一些实施方案中,捕获探针可参与桥式扩增。
136.如图3所示,在一些实施方案中,阵列的微特征可包括多核苷酸,该多核苷酸包含条形码30、引物结合位点40和经由3’接头25附接于珠10的捕获探针50。在一些实施方案中,
引物结合位点可邻接附接于珠的接头。一些实施方案可包括在测定中使用此类微特征来筛选和开发某些聚合酶。例如,与附接于具有间隔区的珠的引物位点相比,可针对附接于没有间隔区的珠的引物位点筛选聚合酶的活性。在一些实施方案中,靶核酸可与捕获探针杂交。在一些实施方案中,杂交的靶核酸例如通过聚合酶或通过连接酶延伸。
137.如图4所示,阵列的微特征的实施方案可包括多核苷酸,该多核苷酸包含间隔区80、条形码30、引物结合位点40和经由5’接头20附接于珠10的捕获探针50。
138.对多个靶核酸进行测序
139.一些实施方案包括对多个靶核酸进行测序。在一些实施方案中,靶核酸可来源于不同来源,诸如不同受试者,例如来自不同受试者的基因组dna。在一些实施方案中,不同的靶核酸可与不同的索引相关联,使得索引可识别靶核酸的特定群体,诸如来源于单一来源的群体。
140.一些实施方案包括获得至少第一珠亚群和第二珠亚群,其中每个珠包含:包含捕获探针、指示相同珠的该捕获探针的条形码和该条形码的条形码引物结合位点3’的第一多核苷酸、以及包含索引和该索引的索引引物结合位点3’的第二多核苷酸,其中第一亚群的索引不同于第二亚群的索引。
141.在一些实施方案中,第一珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。
142.在一些实施方案中,第一珠亚群和/或第二亚群的捕获探针各自包含彼此不同的核苷酸序列。例如,第一亚群的捕获探针可彼此不同;并且/或者第一亚群的捕获探针可彼此不同。在一些实施方案中,第一珠亚群的捕获探针各自包括具有与第二珠亚群的捕获探针相同的核苷酸序列的捕获探针。在一些实施方案中,捕获探针可包含能够与单核苷酸多态性(snp)或其互补序列杂交的核苷酸序列。在一些实施方案中,条形码引物结合位点包含相同的核苷酸序列。
143.一些实施方案还包括使第一靶核酸与第一珠亚群的捕获探针杂交,以及使第二靶核酸与第二珠亚群的捕获探针杂交。在一些此类实施方案中,使第一靶核酸与第一珠亚群的捕获探针杂交和使第二靶核酸与第二珠亚群的捕获探针杂交在不同的位置进行。例如,不同的位置包括不同的反应体积,诸如不同的孔,诸如多壁板中的不同孔。例如,在96孔板中,96个不同珠亚群可与96个不同的靶核酸杂交,其中每个不同珠亚群与不同孔中的不同靶核酸杂交。
144.在一些实施方案中,包含杂交的捕获探针和靶核酸的不同珠亚群分布在基板诸如平面基板上。在一些实施方案中,分布的珠亚群构成阵列。在一些实施方案中,基板包括多个离散位点。在一些实施方案中,基板包括多个孔。在一些实施方案中,基板包括多个通道。在一些实施方案中,流通池包括基板。
145.在一些实施方案中,将包含杂交的捕获探针和靶核酸的不同珠亚群在分布于基板上之前进行组合。在一些实施方案中,将包含杂交的捕获探针和靶核酸的不同珠亚群按顺序分布在基板上。例如,将包含杂交的捕获探针和靶核酸的第一珠亚群分布在基板上,然后将包含杂交的捕获探针和靶核酸的第二珠亚群分布在基板上。
146.在一些实施方案中,使杂交的捕获探针延伸。在一些实施方案中,在将包含杂交的
捕获探针和靶核酸的不同珠亚群分布在基板上之前延伸杂交的捕获探针。在一些实施方案中,在将包含杂交的捕获探针和靶核酸的珠分布在基板上之后延伸杂交的捕获探针。在一些实施方案中,使杂交的捕获探针延伸可包括聚合酶延伸。在一些实施方案中,使杂交的捕获探针延伸可包括基于连接酶的延伸,诸如在存在连接酶的情况下将延伸探针连接到捕获探针。在一些实施方案中,延伸步骤可向延伸的捕获探针添加可检测标记。在一些实施方案中,可检测标记可包括荧光标记。
147.一些实施方案包括解码基板上的珠。一些实施方案包括通过识别延伸的捕获探针、条形码和索引在基板上的位置来解码珠。在一些实施方案中,基板上某个位置处特定条形码的存在指示该位置处的特定捕获探针。
148.在一些实施方案中,基板上某个位置处某个索引的存在指示靶核酸的某个亚群的靶核酸与基板上的该位置相关联。在一些实施方案中,基板上某个位置处延伸的捕获探针的存在指示靶核酸的该亚群中某个靶核酸的存在。
149.在一些实施方案中,条形码的种类、索引的种类和表面上单个位置处延伸的捕获探针的存在指示靶核酸的特定亚群中特定靶核酸的存在。
150.在一些实施方案中,解码基板上的珠包括检测杂交的捕获探针或延伸的捕获探针的位置。在一些实施方案中,检测杂交的捕获探针或延伸的捕获探针的位置包括用可检测标记使杂交的捕获探针延伸。在一些实施方案中,检测杂交的捕获探针或延伸的捕获探针的位置包括边合成边测序的至少一个循环。
151.在一些实施方案中,解码基板上的珠包括解码包含延伸的捕获探针的珠的索引的位置。一些实施方案包括使多个索引引物与索引引物位点杂交,并使杂交的索引引物延伸。在一些实施方案中,使杂交的索引引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码珠的索引的位置包括对基板上的索引进行测序。
152.在一些实施方案中,解码基板上的珠包括解码包含延伸的捕获探针的珠的条形码的位置。一些实施方案包括使多个条形码引物与条形码引物位点杂交,并使杂交的条形码引物延伸。在一些实施方案中,解码基板上的珠包括使杂交的条形码引物延伸,而使杂交的条形码引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码基板上的珠包括解码珠的条形码的位置,而解码珠的条形码的位置包括对基板上的条形码进行测序。
153.在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少100、200、300、400或500个或更多个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少5000个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50,000个包含不同核苷酸序列的捕获探针。
154.一些实施方案包括至少10个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少100个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少1000个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少10,000个不同珠亚群,每个亚群包含不同于另一亚群的索引。
155.一些实施方案的各方面在图5a至图5e中示出。如图5a所示,珠亚群包括这样的珠,该珠具有包含条形码、条形码引物结合位点和捕获探针的附接的第一多核苷酸,并且具有包含索引和索引引物结合位点的附接的第二多核苷酸。不同珠亚群可包括不同的索引。不
同珠亚群(具有特定索引的每个亚群)可分布到96孔板的孔中,使得每个孔包含单个珠亚群。
156.如图5b所示,来自靶核酸群体的靶核酸与捕获探针杂交,其中该靶核酸包含snp。在一些实施方案中,将靶核酸的亚群添加到包含珠亚群的每个孔中。靶核酸的每个亚群可来源于不同的来源,诸如不同的受试者。例如,靶核酸的亚群可通过由核酸的单一来源(诸如来自受试者的单个核酸样本)制备核酸文库来获得。在一些实施方案中,靶核酸不需要待测序的衔接子。
157.如图5c所示,可延伸杂交至包含snp的靶核酸的捕获探针。在一些实施方案中,可通过添加掺入混合物来进行延伸,该掺入混合物包括荧光核苷酸和合适的聚合酶。在一些实施方案中,该延伸为单碱基延伸。
158.在一些实施方案中,将所有珠组合并分布在流通池的表面上。流通池可具有图案化的表面,并且该表面可被改性以支持珠在所需密度下的固定。
159.在一些实施方案中,执行snp读出。在一些实施方案中,执行扫描循环以读取来自捕获探针的snp位点处的掺入的信号。在一些实施方案中,该循环可包括边合成边测序的至少一个循环。在一些实施方案中,延伸的捕获探针的3
′
端被切割并封闭。
160.如图5d所示,条形码引物与条形码引物结合位点杂交,并且使该条形码引物延伸。在一些实施方案中,条形码引物的延伸包括条形码读出。在一些实施方案中,该延伸可包括边合成边测序的至少一个循环。在一些实施方案中,边合成边测序的循环数可取决于珠亚群中不同条形码的数量。在一些实施方案中,延伸可包括12-20个边合成边测序循环。在一些实施方案中,延伸识别捕获探针和特定珠在流通池内的位置。
161.如图5e所示,索引引物与索引引物结合位点杂交,并且使该索引引物延伸。在一些实施方案中,索引引物的延伸包括索引读出。在一些实施方案中,该延伸可包括边合成边测序的至少一个循环。在一些实施方案中,边合成边测序的循环数可取决于珠的多个亚群中不同索引的数量。在一些实施方案中,延伸可包括6-12个边合成边测序循环。
162.某些检测靶配体的方法
163.一些实施方案包括检测靶配体的方法。在一些实施方案中,靶配体可包括核酸、蛋白质或其他抗原。在一些实施方案中,靶配体获自不同的来源,例如获自不同的样本、不同的个体受试者或不同的受试者群体。
164.在一些实施方案中,检测靶配体的方法可包括获得珠群体,其中每个珠包含特异性结合到靶配体的捕获探针。例如,捕获探针可包括核酸、抗体或抗体的抗原结合片段。在一些实施方案中,珠包含第一多核苷酸,该第一多核苷酸包含指示相同珠的捕获探针的条形码和该条形码的条形码引物结合位点3’。在一些实施方案中,每个珠还包括第二多核苷酸,该第二多核苷酸包含索引和该索引的索引引物结合位点3’。在一些实施方案中,珠群体包括第一珠亚群和第二珠亚群。在一些实施方案中,第一珠亚群的索引不同于第二珠亚群的索引。例如,第一珠亚群的索引可用于从第二珠亚群的索引中识别第一珠亚群。
165.一些实施方案包括使第一靶配体与第一珠亚群的捕获探针接触,以及使第二靶配体与第二珠亚群的捕获探针接触。例如,第一靶配体可获自配体的第一样本,并且第二靶配体可获自配体的第二样本。一些实施方案还包括将包含特异性结合的第一靶配体和第二靶配体的第一珠亚群和第二珠亚群分布在基板上。一些实施方案还包括检测与分布在基板上
的第一靶配体和第二靶配体特异性结合的捕获探针。一些实施方案还包括解码包含所检测的捕获探针的珠在基板上的位置。
166.在一些实施方案中,捕获探针包含核酸,并且靶配体包含核酸。在一些实施方案中,第一多核苷酸包含捕获探针。在其他实施方案中,捕获探针不同于第一多核苷酸。在一些实施方案中,珠亚群的捕获探针包含彼此不同的核苷酸序列。在一些实施方案中,不同珠亚群可包括相同或不同的捕获探针。在一些实施方案中,捕获探针包含能够与单核苷酸多态性(snp)或其互补序列杂交的核苷酸序列。
167.在一些此类实施方案中,检测特异性结合到靶配体的捕获探针包括使特异性结合到靶配体的捕获探针延伸。在一些实施方案中,延伸可包括聚合酶延伸和/或连接酶延伸。在一些实施方案中,延伸包括可检测的核苷酸,诸如荧光标记的核苷酸。在一些实施方案中,延伸包括捕获探针的单核苷酸延伸。在一些实施方案中,延伸包括用多个核苷酸延伸捕获探针。
168.在一些此类实施方案中,捕获探针包含抗体或其抗原结合片段。在一些实施方案中,珠亚群的捕获探针特异性结合到彼此不同的靶配体。在一些实施方案中,不同珠亚群可包括相同或不同的捕获探针。在一些此类实施方案中,珠亚群的不同捕获探针特异性结合到相同的靶配体。
169.在一些实施方案中,检测特异性结合到靶配体的捕获探针包括免疫测定。例如,使特异性结合到捕获探针的靶配体与第二抗体或其抗原结合片段接触,其中第二抗体或其抗原结合片段包含可检测标记,诸如荧光标记。
170.在一些实施方案中,条形码引物结合位点包含相同的核苷酸序列。
171.在一些实施方案中,珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且可将一个珠亚群与另一珠亚群区分开来。例如,第一珠亚群的索引的核苷酸序列和第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。
172.在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。
173.在一些实施方案中,使第一靶配体与第一珠亚群的捕获探针接触和使第二靶配体与第二珠亚群的捕获探针接触在不同的位置进行。例如,不同的位置可包括不同的反应体积,诸如在微量滴定板的不同孔中的不同体积。
174.一些实施方案还包括,在将第一珠亚群和第二珠亚群分布在基板上之前,组合第一珠亚群和第二珠亚群。在其他实施方案中,在将第二珠亚群分布在基板上之前,将第一珠亚群分布在基板上。在一些实施方案中,在检测特异性结合到配体的捕获探针之前,将珠亚群分布在基板上。
175.在一些实施方案中,检测特异性结合到靶配体的捕获探针还可包括确定特异性结合到靶配体的捕获探针在基板上的位置。
176.在一些实施方案中,解码所检测的捕获探针的位置包括解码包含所检测的捕获探针的珠的索引的位置。一些实施方案还包括使多个索引引物与索引引物位点杂交,并使杂交的索引引物延伸。在一些实施方案中,使杂交的索引引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码珠的索引的位置包括对基板上的索引进行测序。
177.在一些实施方案中,解码所检测的捕获探针的位置包括解码包含所检测的捕获探针的珠的条形码的位置。一些此类实施方案包括使多个条形码引物与条形码引物位点杂
交,并使杂交的条形码引物延伸。在一些实施方案中,使杂交的条形码引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码珠的条形码的位置包括对基板上的条形码进行测序。
178.在一些实施方案中,基板包括多个离散位点。在一些实施方案中,基板包括多个孔。在一些实施方案中,基板包括多个通道。在一些实施方案中,流通池包括基板。在一些实施方案中,分布的第一珠亚群和第二珠亚群构成阵列。
179.在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50、100、500、1000或5000个彼此不同的捕获探针,或在前述数量的任两个数量之间的任何数量的捕获探针。一些实施方案还包括至少5、10、20、50、100、200、500、1000个不同珠亚群,每个亚群包含不同于另一亚群的索引,或在前述数量的任两个数量之间的任何数量的不同珠亚群。
180.图6a的左图中示出了包括珠200的实施方案,其中多核苷酸210附接于该珠。该多核苷酸包含与靶核酸220杂交的捕获探针。该捕获探针用包含可检测标记230的核苷酸延伸。在一些实施方案中,该多核苷酸可包含指示该捕获探针的条形码,以及可用于对条形码进行测序和识别的条形码引物结合位点。在一些实施方案中,该多核苷酸还可包含指示来自另一珠亚群的珠亚群索引,以及可用于对索引进行测序和识别的索引引物结合位点。在一些实施方案中,珠可以阵列形式分布在基板上并被解码。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。
181.图6a的中间图中示出了包括珠200的实施方案,其中捕获探针240附接于该珠。该捕获探针与靶核酸220杂交。第一多核苷酸260也附接于该珠,该第一多核苷酸包含指示捕获探针的条形码,以及可用于对条形码进行测序和识别的条形码引物结合位点。第二多核苷酸250也附接于该珠,该第二多核苷酸包含指示来自另一珠亚群的珠亚群索引。该捕获探针用包含可检测标记230的核苷酸延伸。在一些实施方案中,珠可以阵列形式分布在基板上并被解码。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。
182.图6a的右图中示出了包括珠200的实施方案,其中捕获探针270附接于该珠,其中该捕获探针是抗体或抗体的抗原结合片段。该捕获探针特异性结合到配体280。该配体还与包含可检测标记230的第二抗体290结合。第一多核苷酸260也附接于该珠,该第一多核苷酸包含指示捕获探针的条形码,以及可用于对条形码进行测序和识别的条形码引物结合位点。第二多核苷酸250也附接于该珠,该第二多核苷酸包含指示来自另一珠亚群的珠亚群索引。在一些实施方案中,珠可以阵列形式分布在基板上并被解码。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。
183.图6b的右图中示出了包括珠200的实施方案,其中包含蛋白质的捕获探针330附接于该珠。在一些实施方案中,珠可以阵列形式分布在基板上。针对蛋白质的基板340接触蛋白质以生成包含可检测标记230的信号。可确定信号在阵列上的位置。在一些实施方案中,珠可包括也附接于该珠的第一多核苷酸,该第一多核苷酸包含指示捕获探针的条形码,以及可用于对条形码进行测序和识别的条形码引物结合位点。在一些实施方案中,珠可包括也附接于该珠的第二多核苷酸,该第二多核苷酸包含指示来自另一珠亚群的珠亚群索引。
在一些实施方案中,在阵列上对珠进行解码。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。
184.一些实施方案包括在阵列上检测靶配体的方法,包括:(a)获得第一珠群体和第二珠群体,其中每个珠包含:捕获探针,其中所述捕获探针能够与靶配体特异性结合,编码条形码和条形码引物结合位点的核酸,其中所述条形码指示所述捕获探针,以及编码索引和索引引物结合位点的核酸,其中所述索引指示来自所述第一群体或所述第二群体的所述珠的来源;以及(b)使所述第一珠群体与包含第一靶配体的第一样本接触,其中所述第一靶配体与所述第一珠群体的捕获探针特异性结合,并由此获得靶结合的第一珠群体;(c)使所述第二珠群体与包含第二靶配体的第二样本接触,其中所述第二靶配体与所述第二珠群体的捕获探针特异性结合,并由此获得靶结合的第二珠群体;(d)将所述靶结合的第一珠群体和所述靶结合的第二珠群体随机分布在阵列上;(e)检测包含所述第一靶配体和所述第二靶配体的所述珠在所述阵列上的位置;以及(f)确定在所述阵列上的包含所述第一靶配体和所述第二靶配体的珠的所述索引和所述条形码的序列。在一些实施方案中,所述捕获探针包含多核苷酸。在一些实施方案中,所述靶配体包含核酸。在一些实施方案中,检测包含所述第一靶配体和所述第二靶配体的所述珠在所述阵列上的位置包括通过聚合酶延伸或通过连接使所述捕获探针延伸。在一些实施方案中,所述捕获探针包含蛋白质。在一些实施方案中,步骤(e)在步骤(f)之后进行。在一些实施方案中,所述第一珠群体的条形码包括彼此不同的条形码,并且所述第二珠群体的条形码包括彼此不同的条形码。在一些实施方案中,所述第一珠群体的索引彼此相同,并且所述第二珠群体的索引彼此相同。在一些实施方案中,所述阵列位于流通池的表面上。在一些实施方案中,所述第一珠群体和所述第二珠群体适于附接于所述阵列。在一些实施方案中,所述第一珠群体和所述第二珠群体包含生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,所述第一珠群体和所述第二珠群体是有磁性的。
185.靶核酸的测序和分析
186.一些实施方案包括靶核酸的测序和/或分析。一些实施方案包括根据本文提供的方法解码多核苷酸在阵列中的位置;使靶核酸与捕获探针杂交;使该捕获探针延伸;以及检测在阵列上的某个位置处与靶核酸杂交的捕获探针的延伸。在一些实施方案中,在使靶核酸与多核苷酸杂交之前,可解码多核苷酸在阵列上的位置。在一些实施方案中,在检测到与靶核酸杂交的捕获探针的延伸之后,可解码多核苷酸在阵列上的位置。在一些此类实施方案中,每个多核苷酸可通过共同元件与捕获探针相关联。例如,多核苷酸和捕获探针可各自结合到相同的微特征诸如珠。在更多此类实施方案中,每个多核苷酸可包含捕获探针。
187.一些实施方案包括捕获探针的单碱基延伸(sbe)。在一些实施方案中,sbe可用于检测靶核酸中的等位基因、突变或其他特征。简而言之,sbe利用在接近或邻近检测位置的位置处与靶基因组片段杂交的捕获探针,该检测位置指示特定基因座。聚合酶可用于用标记有检测标记的核苷酸类似物使捕获探针的3’端延伸。基于酶的保真度,仅当核苷酸与靶核酸中的检测位置互补时,才将该核苷酸掺入捕获探针中。如果需要,可将核苷酸衍生化,使得使用封闭基团(包括可逆的封闭基团)不会发生进一步的延伸,因此仅添加单个核苷酸。可例如在阵列中的特定位置处检测延伸的捕获探针中标记的核苷酸的存在,并且识别所添加的核苷酸以确定基因座或等位基因的种类。sbe可在已知条件下进行,诸如在美国专
利9,441,267和us 9,045,796中所述的那些,这些专利中的每一篇均全文以引用方式并入。
188.一些实施方案包括等位基因特异性引物延伸(aspe)。在一些实施方案中,aspe可包括在其3’端核苷酸组成不同的捕获探针的延伸。aspe方法可使用含有可切割接头的核苷或核苷酸进行,使得可在检测到探针之后移除标记。这允许进一步使用探针或验证检测到的信号是由于现在已被移除的标记。简而言之,aspe可通过使靶核酸与捕获探针杂交来进行,该捕获探针具有与检测位置互补的3’序列部分和与邻近检测位置的序列互补的5’部分。捕获探针的3’部分的模板指导修饰,例如通过聚合酶添加标记的核苷酸,产生标记的延伸产物,但仅在模板包括靶序列的情况下。然后可检测这种标记的引物延伸产物的存在,例如,基于其在阵列中的位置来指示特定等位基因的存在。在一些实施方案中,aspe可用多个捕获探针进行,所述多个捕获探针具有相似的5’端,使得它们在靶核酸中的相同检测位置附近退火,但具有不同的3’端,使得聚合酶仅修饰具有与检测位置互补的3’端的捕获探针。具有与特定检测位置互补的3’端碱基的捕获探针被称为该位置的完全匹配(pm)探针,而具有3’端错配碱基并且不能在aspe反应中延伸的捕获探针是该位置的错配(mm)探针。可检测pm探针中标记的核苷酸的存在,并确定捕获探针的3’序列以识别在检测位置处的特定等位基因。
189.一些实施方案包括用于解码多核苷酸在阵列中的位置的方法。一些此类方法包括:(a)获得基板,所述基板具有分布在基板的表面上的多核苷酸阵列,其中每个多核苷酸包含条形码的引物结合位点3’,其中每个多核苷酸连接到捕获探针;(b)使多个引物与所述引物结合位点杂交;以及(c)通过使所杂交的引物延伸来确定条形码的序列,其中每个条形码的序列指示多核苷酸在阵列中的位置。在一些实施方案中,每个多核苷酸经由珠连接到捕获探针。在一些实施方案中,每个多核苷酸包含捕获探针。在一些实施方案中,捕获探针为引物结合位点的3’。在一些实施方案中,捕获探针为条形码的5’。在一些实施方案中,捕获探针包含与另一个捕获探针不同的序列。在一些实施方案中,捕获探针与另一个捕获探针相差少于5个不同的核苷酸。在一些实施方案中,每个捕获探针包含不同的序列。在一些实施方案中,多核苷酸随机分布在基板的表面上。在一些实施方案中,条形码包含与另一个条形码不同的序列。在一些实施方案中,每个条形码包含不同的序列。在一些实施方案中,每个引物结合位点包含相同的序列。在一些实施方案中,多核苷酸附接于珠。在一些实施方案中,珠分布在孔中。在一些实施方案中,每个多核苷酸包含可切割接头。在一些实施方案中,可切割接头适于从引物结合位点和条形码移除捕获探针。在一些实施方案中,基板包括孔。在一些实施方案中,每个多核苷酸包含间隔区。在一些实施方案中,间隔区附接于基板。在一些实施方案中,间隔区附接于珠。一些实施方案还包括使靶核酸与捕获探针杂交。在一些实施方案中,使靶核酸与捕获探针杂交在测定条形码的序列之后进行。在一些实施方案中,使靶核酸与捕获探针杂交在测定条形码的序列之前进行。一些实施方案还包括使杂交的靶核酸或多核苷酸延伸。在一些实施方案中,延伸包括连接。一些实施方案还包括扩增靶核酸。
190.一些实施方案包括对靶核酸进行测序的方法。一些此类方法(a)根据前述方法中的任一种方法解码多核苷酸在阵列中的位置;(b)使靶核酸与捕获探针杂交;(c)使与靶核酸杂交的捕获探针延伸;以及(d)检测所延伸的捕获探针的位置。在一些实施方案中,(d)检测所延伸的捕获探针的位置在(a)解码多核苷酸在阵列中的位置之前进行。在一些实施方
案中,捕获探针由连接酶延伸。在一些实施方案中,捕获探针由聚合酶延伸。在一些实施方案中,捕获探针通过添加单个核苷酸来延伸。一些实施方案还包括在使靶核酸与捕获探针杂交之前从捕获探针切割引物结合位点和条形码。一些实施方案还包括在使靶核酸与捕获探针杂交之后从捕获探针切割引物结合位点和条形码。
191.一些实施方案包括在阵列上对来源于不同生物来源的靶多核苷酸进行测序。在一些此类实施方案中,可由核酸样本制备包含靶核酸的多核苷酸。多核苷酸样本的示例包括来自个体的基因组dna样本、cdna样本、rna样本和扩增子。多核苷酸可包括靶核酸、索引和邻近索引的索引引物结合位点。索引可用于指示靶核酸的来源作为某个核酸样本。例如,由不同核酸样本制备的多核苷酸可包括不同的索引。每个索引可具有设计来结合特定扩增引物的位置。该索引引物结合位点可用于通过使与索引引物结合位点杂交的引物延伸来对索引进行序列。在一些实施方案中,索引是在约3-30个连续核苷酸范围内的多核苷酸内的核酸或区域。索引可为例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸或更长。对于本文提供的方法和组合物有用的一些方面公开于u.s.20180334711a1和u.s.20190085384a1中,这些专利各自全文以引用方式并入。在一些实施方案中,条形码或索引可包括独特分子标识符(umi)。
192.多核苷酸可通过多种方法制备。在一些实施方案中,包含靶核酸的核酸样本可用转座体片段标签化以获得具有含有来自转座体的序列的末端的核酸片段。在一些实施方案中,转座体可包括索引和索引引物结合位点,使得片段标签化将索引和索引引物结合位点添加到核酸片段。例如,包含靶核酸的输入核酸可与多个转座体接触。转座体可将输入核酸片段化并将衔接子附接于核酸片段的末端。片段标签化反应的示例公开于美国专利9,040,256中,该专利全文以引用方式并入。
193.在一些实施方案中,可通过将衔接子添加到包含靶核酸的核酸片段末端来制备包含索引的多核苷酸,衔接子可包括索引和索引引物结合位点。在一些实施方案中,可通过扩增包含靶核酸的核酸片段来制备包含索引的多核苷酸,其中引物包含索引和索引引物结合位点,使得扩增产物包括索引和索引引物结合位点。
194.在一些实施方案中,多核苷酸的靶核酸与捕获探针杂交。在一些实施方案中,捕获探针附接于珠。在一些实施方案中,寡核苷酸包含捕获探针。寡核苷酸可包括捕获探针、条形码和条形码引物结合位点。在一些实施方案中,可通过使与引物结合位点杂交的引物延伸来对条形码进行测序。在一些实施方案中,条形码可包括可用于识别阵列内的多核苷酸诸如捕获探针的核酸序列。该条形码可包括与其他条形码可区分的独特核苷酸序列。该条形码还可通过条形码的序列,也可通过条形码在多核苷酸内的位置,例如通过邻近条形码引物结合位点的位置,与多核苷酸和靶核酸中的其他核苷酸序列区分开来。例如,在一些实施方案中,条形码的序列可在多个核酸中存在不止一次,然而,邻近条形码引物结合位点的条形码可被检测到。条形码可具有足以成为群体中的多个条形码内和/或被分析或询问的多个多核苷酸和靶核酸内的独特核苷酸序列的任何期望序列长度。在一些实施方案中,条形码是在约6-30个连续核苷酸范围内的多核苷酸内的核酸或区域。条形码可为例如6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸或更长。用于一些实施方案的合适的条形码公开于美国专利8,053,192,该专利全文以引用方式并入。在一些实施方案中,条形码可将阵列中的一个多核苷酸与另一个多核苷酸区分开来,
使得每个条形码不同于另一个条形码。在一些实施方案中,条形码可用于识别珠在阵列中的位置。在一些实施方案中,条可用于识别捕获探针。
195.在一些实施方案中,多核苷酸的靶核酸与捕获探针杂交以获得杂交的珠。在一些实施方案中,杂交的珠可包括含有条形码、条形码引物结合位点和捕获探针的寡核苷酸,捕获探针可与多核苷酸的靶核酸杂交,并且多核苷酸可包括索引和索引引物结合位点。杂交的珠可随机分布在阵列上。
196.在一些实施方案中,可通过使捕获探针延伸来获得靶核酸的序列信息。在一些实施方案中,可将捕获探针延伸以包括与靶核酸互补的序列。在一些此类实施方案中,该延伸可包括聚合酶延伸。在一些实施方案中,该延伸为单碱基延伸(sbe)。在一些实施方案中,sbe可用于检测靶核酸中的等位基因、突变或其他特征。
197.在一些实施方案中,捕获探针可通过连接延伸。例如,基因座特异性寡核苷酸可在邻近捕获探针与靶核酸杂交的位点的位置处与靶核酸杂交,然后可将基因座特异性寡核苷酸连接到捕获探针。在一些实施方案中,可将捕获探针延伸,使得延伸的捕获探针掺入与多核苷酸的索引和索引引物结合位点互补的序列。
198.在一些实施方案中,对索引进行测序以确定附接于阵列上的珠的靶核酸的来源。在一些实施方案中,对条形码进行测序以解码珠在阵列上的位置。在一些实施方案中,对条形码进行测序以识别附接于阵列上的珠的捕获探针。
199.在一些实施方案中,所述阵列位于流通池的表面上。在一些实施方案中,所述珠适于附接于所述阵列。例如,所述珠可包括试剂诸如生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,珠和阵列是有磁性的。
200.一些实施方案包括由不同的核酸样本制备多个多核苷酸,使每个多个多核苷酸与包含捕获探针的珠群体杂交以获得杂交的珠,并且将杂交的珠随机分布在阵列上。示例性实施方案包括获得第一珠群体和第二珠群体,其中所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点。获得第一多个多核苷酸和第二多个多核苷酸,其中所述第一多个多核苷酸包含第一靶核酸,其中所述多个第一多核苷酸在溶液中,并且所述第二多个多核苷酸包含第二靶核酸,其中所述多个第二多核苷酸处于溶液中。使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠。将在阵列上的杂交的第一珠和杂交的第二珠随机分布在阵列上。通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置,以确定每组靶核酸结合了哪些珠。通过使第一捕获探针和第二捕获探针延伸来获得第一靶核酸和第二靶核酸的核酸序列数据。
201.在一些实施方案中,如本文所述对多核苷酸进行索引。例如,获得第一珠群体和第二珠群体,其中所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点。获得第一多个多核苷酸和第二多个多核苷酸,其中所述第一多个多核苷酸包含第一靶核酸、第一索引和邻近所述第一索引的索引引物结合位点,其中所述多个第一多核苷酸在
溶液中,并且所述第二多个多核苷酸包含第二靶核酸、第二索引和邻近所述第二索引的第二引物结合位点,其中所述多个第二多核苷酸处于溶液中。使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠。将杂交的第一珠和杂交的第二珠随机分布在阵列上。通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置。使所述第一捕获探针和所述第二捕获探针延伸以获得所述第一靶核酸和所述第二靶核酸的核酸序列数据。通过对所述第一索引和所述第二索引进行测序来确定所述第一靶核酸和所述第二靶核酸的核酸序列数据的来源。
202.在一些实施方案中,所述第一多个多核苷酸包含第一索引和邻近所述第一索引的索引引物结合位点;并且所述第二多个多核苷酸包含第二靶核酸、第二索引和邻近所述第二索引的索引引物结合位点。在一些实施方案中,所述第一多个多核苷酸或所述第二多个多核苷酸是通过用多个转座体对核酸样本进行片段标签化获得的。在一些实施方案中,所述多个转座体包含所述第一索引或所述第二索引。一些实施方案还包括向所述片段标签化的核酸样本添加衔接子,其中所述衔接子包含所述第一索引或所述第二索引。一些实施方案还包括用包含所述第一索引或所述第二索引的引物扩增所述片段标签化的核酸样本。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸将与所述第一索引和所述第二索引以及所述第一索引引物结合位点和所述第二索引引物结合位点互补的序列掺入所延伸的捕获探针中。
203.在一些实施方案中,可对珠进行索引。例如,珠可包括核酸,该核酸包含索引和索引引物结合位点。在一些实施方案中,附接于珠的寡核苷酸可包括条形码、条形码引物结合位点、索引、索引引物结合位点。例如,第一珠群体可包含第一索引和邻近所述第一索引的索引引物结合位点,并且第二珠群体可包含第二索引和邻近所述第二索引的索引引物结合位点。在一些实施方案中,所述第一珠群体的寡核苷酸包含所述第一索引;并且所述第二珠群体的寡核苷酸包含所述第二索引。
204.在一些实施方案中,获得第一珠群体和第二珠群体,其中所述第一珠群体包含寡核苷酸,所述寡核苷酸包含第一捕获探针、第一条形码和邻近所述第一条形码的条形码引物结合位点以及第一索引和邻近所述第一索引的索引引物结合位点,并且所述第二珠群体包含寡核苷酸,所述寡核苷酸包含第二捕获探针、第二条形码和邻近所述第二条形码的条形码引物结合位点以及第二索引和邻近所述第二索引的索引引物结合位点。获得第一多个多核苷酸和第二多个多核苷酸,其中所述第一多个多核苷酸包含第一靶核酸,其中所述多个第一多核苷酸处于溶液中,并且所述第二多个多核苷酸包含第二靶核酸,其中所述多个第二多核苷酸处于溶液中。使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠。将杂交的第一珠和杂交的第二珠随机分布在阵列上。通过对所述第一条形码和所述第二条形码进行测序来解码所述第一珠和所述第二珠在所述阵列上的位置。使所述第一捕获探针和所述第二捕获探针延伸以获得所述第一靶核酸和所述第二靶核酸的核酸序列数据。在一些实施方案中,所述第一珠群体的寡核苷酸包含所述第一索引;并且所述第二珠群体的寡核苷酸包含所述第二索引。
205.在一些实施方案中,所述第一索引指示所述第一靶核酸的来源,并且所述第二索
引指示所述第二靶核酸的来源。在一些实施方案中,所述第一索引彼此相同,并且所述第二索引彼此相同。一些实施方案还包括对所述第一索引和所述第二索引进行测序。在一些实施方案中,所述第一索引和所述第二索引包括使与所述索引引物结合位点杂交的引物延伸。在一些实施方案中,所述索引结合引物位点是相同的。在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自不同的核酸样本。在一些实施方案中,所述第一靶核酸和所述第二靶核酸获自基因组dna。
206.在一些实施方案中,所述第一条形码和所述第二条形码指示所述第一捕获探针或所述第二捕获探针的核酸序列。在一些实施方案中,所述第一条形码彼此不同,并且所述第二条形码彼此不同。在一些实施方案中,对所述第一条形码和所述第二条形码进行测序包括使与所述条形码引物结合位点杂交的引物延伸。在一些实施方案中,所述条形码引物结合位点是相同的。
207.在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括聚合酶延伸。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括向捕获探针添加单个核苷酸。一些实施方案还包括将基因座特异性寡核苷酸连接到所延伸的捕获探针。在一些实施方案中,使所述第一捕获探针和所述第二捕获探针延伸包括将基因座特异性寡核苷酸连接到所述捕获探针。
208.在一些实施方案中,使所述第一靶核酸与所述第一捕获探针杂交以获得杂交的第一珠,并且使所述第二靶核酸与所述第二捕获探针杂交以获得杂交的第二珠在溶液中进行。
209.在一些实施方案中,流通池包括所述阵列。在一些实施方案中,所述阵列包括多个孔,其中每个孔包含一个或多个珠。在一些实施方案中,所述第一珠和所述第二珠适于附接于所述阵列。在一些实施方案中,所述第一珠和所述第二珠包含生物素、链霉亲和素或其衍生物;并且所述阵列包含生物素、链霉亲和素或其衍生物。在一些实施方案中,珠和阵列是有磁性的。
210.图9示出了对阵列上的靶核酸进行测序的示例性实施方案,其中包含靶核苷酸的多核苷酸还包括索引。包含含有单核苷酸多态性(星形)的靶核酸的dna样本经历片段标签化,其中dna样本被片段化,并且扩增引物结合位点被添加到片段的每个末端。通过pcr扩增片段,其中引物与扩增引物结合位点结合并且包括样本索引和索引读段引物结合位点。将样本索引和索引读段引物序列掺入扩增产物。通过将寡核苷酸附接于珠来制备珠。寡核苷酸包含接头、解码序列(也称为条形码序列)、解码读段引物结合位点和捕获探针。组合扩增的产物和珠。使靶核酸与捕获探针杂交。杂交可在溶液中或在阵列上发生。将杂交的珠随机分布在阵列上。将捕获探针用完全功能性核苷酸(ffn)延伸,并且检测延伸。将延伸的捕获探针进一步延伸以掺入与样本索引和索引读段引物结合位点互补的序列。包含靶核酸的链从延伸的捕获探针中解离。通过使与索引读段引物结合位点杂交的引物延伸对所延伸的捕获探针的样本索引进行测序。通过使与解码读段引物结合位点杂交的引物延伸对所延伸的捕获探针的解码序列进行测序。靶核酸的来源从样本索引的序列中识别。对珠进行解码,并且从解码序列中识别捕获探针。
211.图10示出了对阵列上的靶核酸进行测序的另一个示例性实施方案,其中珠包括索引。通过附接捕获探针寡核苷酸和样本索引探针寡核苷酸来制备珠。捕获探针寡核苷酸包
括接头、解码序列、解码读段引物结合位点和捕获探针。样本索引探针寡核苷酸包括接头、样本索引和索引读段引物结合位点。将珠与包含靶核酸的片段化核酸(诸如含有感兴趣的单核苷酸多态性的核酸(星形))组合。使靶核酸在溶液中或在阵列上与捕获探针杂交。捕获探针用ffn延伸。检测延伸。靶核酸从所延伸的捕获探针解离。通过使与索引读段引物结合位点杂交的引物延伸对样本索引进行测序。通过使与解码读段引物结合位点杂交的引物延伸对所延伸的捕获探针的解码序列进行测序。靶核酸的来源从样本索引的序列中识别。对珠进行解码,并且从解码序列中识别捕获探针。
212.某些双探针方法
213.一些实施方案包括用第一捕获探针和第二捕获探针检测靶核酸。在一些实施方案中,靶核酸包含能够与第一捕获探针杂交的第一部分和能够与第二捕获探针杂交的第二部分。在一些实施方案中,获得珠群体,其中每个珠包含第一捕获探针和第二捕获探针。在一些实施方案中,两个捕获探针中的一个捕获探针经由可切割接头附接于珠。在一些实施方案中,捕获探针中的一个捕获探针包含可检测标记,诸如荧光标记。在一些实施方案中,靶核酸与捕获探针杂交以生成包含单链缺口的双链核酸。该缺口被填充,并且可切割接头被切割。检测延伸的捕获探针。在一些实施方案中,捕获探针中的一个捕获探针包含可检测标记,诸如荧光标记。在一些实施方案中,在缺口填充期间将可检测标记掺入延伸的捕获探针中。
214.在一些实施方案中,第二捕获探针经由可切割接头附接于珠,并且第二捕获探针包含可检测标记,诸如荧光标记。可切割接头的示例包括可通过化学方式、通过酶诸如核酸内切酶以及通过某些频率的光切割的接头。在一些实施方案中,每个珠还包括第一多核苷酸,该第一多核苷酸包含指示第一或第二捕获探针的条形码和该条形码的条形码引物结合位点3’。在一些实施方案中,第一捕获探针包含第一多核苷酸。在一些实施方案中,第一捕获探针不同于第一多核苷酸。
215.在一些实施方案中,将第一捕获探针的末端连接到第二捕获探针的末端。在一些实施方案中,通过以下方式将第一捕获探针连接到第二捕获探针:使靶核酸与珠群体的珠的第一捕获探针和第二捕获探针杂交,以生成包含在第一捕获探针和第二捕获探针之间的单链缺口的双链核酸,以及填充第一捕获探针和第二捕获探针之间的该缺口。在一些实施方案中,可用聚合酶和/或连接酶进行缺口填充。在一些实施方案中,切割可切割接头以生成包括第一捕获探针的珠,该第一捕获探针包含可检测标记。在一些实施方案中,将珠群体分布在基板上。在一些实施方案中,在可切割接头被切割后,将珠群体分布在基板上。在一些实施方案中,在可切割接头被切割之前,或在将第一捕获探针连接到第二捕获探针之前,将珠群体分布在基板上。在一些实施方案中,确定包含第一捕获探针的珠在基板上的位置,该第一捕获探针包含可检测标记。
216.在一些实施方案中,解码包含具有可检测标记的第一捕获探针的珠在基板上的位置包括解码包含具有可检测标记的第一捕获探针的珠的条形码在基板上的位置。一些此类实施方案可包括使条形码引物与条形码引物位点杂交,并使杂交的条形码引物延伸。在一些实施方案中,使杂交的条形码引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码珠的条形码的位置包括对基板上的条形码进行测序。
217.在一些实施方案中,每个珠包含第二多核苷酸,该第二多核苷酸包含指示靶核酸
来源的索引和该索引的索引引物结合位点3’。
218.在一些实施方案中,该珠群体包括第一珠亚群和第二珠亚群,每个珠包含第二多核苷酸,该第二多核苷酸包含索引和该索引的索引引物结合位点3’,其中第一亚群的索引不同于第二亚群的索引。在一些实施方案中,第一珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。
219.在一些实施方案中,使用第一珠亚群的连接或切割步骤在与使用第二珠亚群的连接或切割步骤不同的位置处进行。在一些实施方案中,不同的位置包括不同的反应体积。在一些实施方案中,不同的位置包括不同的孔。
220.一些实施方案还包括,在将珠群体分布在基板上之前,组合第一珠亚群和第二珠亚群。在其他实施方案中,在将第二珠亚群分布在基板上之前,将第一珠亚群分布在基板上。
221.在一些实施方案中,解码包含具有可检测标记的第一捕获探针的珠在基板上的位置包括确定包括所检测的捕获探针的珠的索引的位置。一些此类实施方案包括使多个索引引物与索引引物位点杂交,并使杂交的索引引物延伸。在一些实施方案中,使杂交的索引引物延伸包括边合成边测序的至少一个循环。在一些实施方案中,解码珠的索引的位置包括对基板上的索引进行测序。
222.在一些实施方案中,基板包括多个离散位点。在一些实施方案中,基板包括多个孔。在一些实施方案中,基板包括多个通道。在一些实施方案中,流通池包括基板。在一些实施方案中,分布的珠群体构成阵列。
223.图6b的左图中示出了一个实施方案,其中珠200包括经由可切割接头310附接于该珠的第一捕获探针300。第二捕获探针320附接于该珠。将来自某个样本的靶核酸220与第一捕获探针和第二捕获探针杂交,并且使第一捕获探针延伸以用包含可检测标记230的核苷酸填充第一捕获探针和第二捕获探针之间的缺口。在缺口被填充后,移除靶核酸,并且切割可切割接头以生成延伸的第二捕获探针,该延伸的第二捕获探针包含附接于珠的可检测标记。该珠可以阵列形式分布在基板上并被解码。未示出包含指示附接于珠的样本的索引的多核苷酸和包含指示第一捕获探针或第二捕获探针的条形码的多核苷酸。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。
224.图6c示出了一个实施方案,其中第一捕获探针经由其5
′
端附接于珠200。第二捕获探针360经由其3
′
端和可切割接头310附接于珠。第二捕获探针包含可检测标记230。靶核酸220与第一捕获探针和第二捕获探针杂交,第一捕获探针延伸并连接到第二捕获探针。在一些实施方案中,靶核酸可包括结构变异(sv)。可切割接头被切割以生成延伸的第一捕获探针,该延伸的第一捕获探针包含可检测标记并附接于珠。该珠可以阵列形式分布在基板上并被解码。未示出包含指示附接于珠的样本的索引的多核苷酸和包含指示第一捕获探针或第二捕获探针的条形码的多核苷酸。解码可包括确定可检测标记在阵列上的位置;确定附接于阵列上的珠的条形码;并且/或者确定附接于阵列上的珠的索引。在不存在靶核酸的情况下,从珠切割第二捕获探针和可检测标记。
225.用于制备和使用索引珠的某些方法
226.一些实施方案包括制备索引珠。一些此类实施方案可包括提供索引多核苷酸群体,其中每个索引多核苷酸包含索引、索引引物结合位点和锚定序列(anchor)/衔接子。在一些实施方案中,锚定序列/衔接子能够与附接于珠的衔接子结合位点结合或杂交。
227.一些实施方案包括一种制备索引珠群体的方法,包括:(a)获得珠群体,其中每个珠包含衔接子、捕获探针和包含条形码以及条形码引物结合位点的第一多核苷酸;(b)获得多个索引多核苷酸,其中每个索引多核苷酸包含索引和索引引物结合位点;以及(c)将所述多个索引多核苷酸经由所述衔接子附接于所述珠群体,从而获得索引珠群体。在一些实施方案中,(c)包括通过聚合酶延伸使所述衔接子延伸。在一些实施方案中,每个索引多核苷酸包含衔接子结合位点,并且所述附接包括使所述衔接子结合位点与所述衔接子杂交。在一些实施方案中,(c)包括将所述索引多核苷酸连接到所述衔接子。在一些实施方案中,所述附接包括使夹板多核苷酸与所述衔接子和所述索引多核苷酸杂交。在一些实施方案中,(c)包括将所述多个索引多核苷酸经由化学反应性部分附接于所述珠群体的衔接子。在一些实施方案中,所述珠群体的所述第一多核苷酸包含彼此不同的捕获探针。在一些实施方案中,每个索引多核苷酸的所述索引是相同的。对于用于通过化学连接将多核苷酸彼此接合的方法和组合物有用的方面公开于u.s.20180127816中,该专利全文以引用方式并入。
228.一些实施方案还包括使所述索引珠群体与包含靶核酸的多个核酸接触。一些实施方案还包括将与包含靶核酸的多个核酸接触的所述索引珠群体与另外的索引珠群体混合,其中所述另外的索引珠群体包含索引多核苷酸,所述索引多核苷酸包含同与多个核酸接触的所述索引珠群体的索引不同的索引。
229.在一些实施方案中,所述第一多核苷酸包含所述捕获探针。一些实施方案还包括使所述索引珠群体与包含靶核酸的多个核酸接触。一些实施方案还包括将与包含靶核酸的多个核酸接触的所述索引珠群体与另外的索引珠群体混合,其中所述另外的索引珠群体包含索引多核苷酸,所述索引多核苷酸包含同与多个核酸接触的所述索引珠群体的索引不同的索引。
230.在一些实施方案中,所述捕获探针包含蛋白质。
231.在一些实施方案中,所述方法在流通池上进行。
232.图11示出了用于制备索引珠的示例性实施方案。索引多核苷酸包含锚定序列或衔接子、索引和索引引物结合位点。制备多个索引多核苷酸群体并将其分布到多孔板的孔中。每个孔可含有包含相同索引的索引多核苷酸群体。例如,第一孔可含有包含第一索引的索引多核苷酸群体,并且第二孔可含有包含第二索引的索引多核苷酸群体。可将多个珠分布在孔中。每个珠可包括包含捕获探针的第一多核苷酸以及第二多核苷酸,该第二多核苷酸包含索引锚定序列,诸如能够结合索引多核苷酸的锚定序列或衔接子的结合位点。将单个珠池添加到每个孔中。单个珠池可包括珠群体,其中捕获探针彼此不同。含有相同索引的单个珠池可与单个样本一起使用,使得样本的操纵的核酸的后续产物来源可经由识别相关的索引而被识别为从单个样本产生。如图11所示,可将单个索引珠池添加到多孔板中的单个孔中,其中每个孔含有单个样本。
233.索引多核苷酸的索引可通过几种不同的方法掺入珠。在一些实施方案中,索引多核苷酸经由锚定序列和第二多核苷酸与珠杂交,并且将第二多核苷酸延伸,从而将索引多核苷酸的索引的互补序列掺入附接于珠的延伸的第二多核苷酸。在一些实施方案中,索引
多核苷酸和第二多核苷酸连接在一起。在一些实施方案中,索引多核苷酸经由化学或酶促方法附接于与珠附接的多核苷酸。在一些实施方案中,索引多核苷酸与附接于珠的多核苷酸杂交,并且在阵列上确定杂交的索引多核苷酸的索引。
234.一些实施方案包括通过化学或酶促方法向珠添加索引。图12a示出了通过化学或酶促方法向珠添加索引的示例性实施方案,该图示出了包含第一多核苷酸和第二多核苷酸的珠。第一多核苷酸包含探针,诸如捕获探针;代码,诸如条形码;和引物a,诸如可用于确定条形码的序列的条形码引物结合位点。第二多核苷酸包含索引;和引物b,诸如可用于确定索引的序列的索引引物结合位点。第二多核苷酸可经由间隔区附接于珠和将第二多核苷酸连接到间隔区的部分x-y。在一些实施方案中,捕获探针可包括序列引物结合位点。在一些实施方案中,可将封闭基团添加到索引多核苷酸中。在一些实施方案中,索引引物结合位点也可以是具有可逆封闭的3’末端的发夹结构。
235.一些实施方案包括通过使附接于珠的衔接子延伸来向珠添加索引。在一些实施方案中,可通过连接或通过聚合酶延伸来使附接于珠的衔接子延伸。图12b示出了通过连接法延伸的示例性实施方案,该图示出了包含第一多核苷酸和第二多核苷酸的珠。第一多核苷酸包含探针,诸如捕获探针;代码,诸如条形码;和引物a,诸如可用于确定条形码的序列的条形码引物结合位点。第二多核苷酸包含衔接子,该衔接子可通过连接到包含索引的第三多核苷酸和使用第四多核苷酸的引物b来延伸,该第四多核苷酸包含能够与第二多核苷酸和第三多核苷酸两者杂交的夹板。在一些实施方案中,捕获探针可包括序列引物结合位点。在一些实施方案中,可将封闭基团添加到索引多核苷酸中。在一些实施方案中,索引引物结合位点也可以是具有可逆封闭的3’末端的发夹结构。
236.图12c示出了通过聚合酶延伸来延伸的示例性实施方案,该图示出了包含第一多核苷酸和第二多核苷酸的珠。第一多核苷酸包含探针、引物a和代码。第二多核苷酸包含衔接子。第三多核苷酸诸如索引多核苷酸包含能够结合衔接子的衔接子结合位点、索引和引物b。第三多核苷酸与第二多核苷酸杂交,使得第二多核苷酸通过聚合酶延伸来延伸以将索引掺入延伸的衔接子。在一些实施方案中,捕获探针可包括序列引物结合位点。在一些实施方案中,可将封闭基团添加到索引多核苷酸中。在一些实施方案中,索引引物结合位点也可以是具有可逆封闭的3’末端的发夹结构。
237.一些实施方案包括使用与附接于珠的第一多核苷酸杂交的索引多核苷酸。一些实施方案包括用于检测靶配体的方法,包括:(a)获得珠群体,其中每个珠包含捕获探针、包含条形码的第一多核苷酸和条形码引物结合位点;(b)获得索引多核苷酸,所述索引多核苷酸包含索引、索引引物结合位点和能够与所述条形码引物结合位点结合的衔接子;(c)将靶配体与捕获探针特异性结合;(d)使所述索引多核苷酸经由所述衔接子与所述第一多核苷酸杂交;(e)检测阵列上的所述靶配体;以及(f)确定所述第一多核苷酸的所述索引和所述条形码。在一些实施方案中,(e)包括将所述珠群体分布在阵列上。在一些实施方案中,(f)包括使索引引物与所述索引引物结合位点杂交,并确定所述索引的序列。在一些实施方案中,使所述索引多核苷酸与所述第一多核苷酸去杂交;使条形码引物与所述条形码引物结合位点杂交;以及使所述条形码引物延伸以确定所述条形码的序列。在一些实施方案中,所述索引多核苷酸还包含位于所述衔接子与所述索引之间的可切割接头,并且(f)包括:(i)切割所述可切割接头;以及(ii)使所述衔接子延伸以确定所述条形码的序列。在一些实施方案
中,所述捕获探针包含蛋白质。在一些实施方案中,所述靶配体包含靶核酸。在一些实施方案中,所述第一多核苷酸包含所述捕获探针。在一些实施方案中,(e)包括使与所述靶核酸杂交的所述第一多核苷酸延伸。在一些实施方案中,所述延伸包括添加可检测的双脱氧核苷酸。在一些实施方案中,所述方法在流通池上进行。
238.图13a和图13b中示出了使用与附接于珠的第一多核苷酸杂交的索引多核苷酸的示例性实施方案。图13a示出了包含第一多核苷酸的珠。第一多核苷酸包含探针,诸如捕获探针;引物,诸如引物结合位点;和代码,诸如条形码。索引多核苷酸包含索引;引物2,诸如索引引物结合位点;间隔区,诸如可切割间隔区;和能够与第一多核苷酸的引物结合位点杂交的衔接子。如图11所示,可用索引多核苷酸制备珠池。图13b第一图示出了包含第一多核苷酸的珠,其中靶核酸经由捕获探针与第一多核苷酸杂交,并且索引多核苷酸经由引物结合位点与第一多核苷酸杂交。图13b第二图示出了具有可在珠阵列上检测到的单个荧光双脱氧核苷酸(星形)的延伸的第一多核苷酸。可确定索引和条形码。图13b第三图示出了荧光双脱氧核苷酸已从延伸的第一多核苷酸中移除。可将索引引物与索引引物结合位点杂交并延伸,并且确定索引的序列。图13b第四图示出了靶核酸已从第一多核苷酸去杂交。索引多核苷酸在可切割接头处切割,并且衔接子现在对应于与可延伸的引物结合位点杂交的条形码引物,并且确定条形码的序列。
239.一些实施方案包括使用包含多个索引序列和索引引物结合位点的索引多核苷酸。在一些此类实施方案中,当对索引进行测序时,多个索引序列可在阵列上的位置处产生增加的信号。图14示出了示例性实施方案。图14示出了包含第一多核苷酸和第二多核苷酸的珠。第一多核苷酸包含:代码,诸如条形码;引物a,诸如条形码引物结合位点;和探针,诸如捕获探针。第二多核苷酸包含索引和索引引物结合位点的重复。在一些实施方案中,这些重复改善具有少量固定化索引的珠上的信号强度。在一些实施方案中,这些重复可限制引物占据的表面积的量而不会减少信号。
240.一些实施方案包括将索引多核苷酸酶促添加到珠中。在一些实施方案中,索引多核苷酸可通过使经由反应性基团附接于珠的多核苷酸延伸来附接于珠。在一些实施方案中,索引多核苷酸可在将珠池与其他珠池混合之前(例如在将混合物装载到阵列上之前)附接于珠。一些实施方案包括一种用于检测靶配体的方法,包括:(a)获得珠群体,其中每个珠包含捕获探针、包含条形码和条形码引物结合位点的第一多核苷酸以及第二多核苷酸;(b)获得索引多核苷酸,所述索引多核苷酸包含索引、索引引物结合位点和衔接子;(c)将靶配体与捕获探针特异性结合;(d)使所述索引多核苷酸经由所述衔接子附接于所述第二多核苷酸;(e)检测阵列上的所述靶配体;以及(f)确定所述第一多核苷酸的所述索引和所述条形码。在一些实施方案中,所述第二多核苷酸包含条形码和条形码引物结合位点。在一些实施方案中,(d)包括将反应性部分添加到所述第二多核苷酸中,其中所述衔接子能够附接于所述反应性部分。对于用于将反应性部分添加到多核苷酸的方法和组合物的有用的方面公开于u.s.20180127816中,该专利全文以引用方式并入。在一些实施方案中,(e)包括将珠群体分布在阵列上。在一些实施方案中,(f)包括使索引引物与所述索引引物结合位点杂交,并确定所述索引的序列。在一些实施方案中,(f)包括使条形码引物与所述条形码引物结合位点杂交,并确定所述条形码的序列。在一些实施方案中,所述捕获探针包含蛋白质。在一些实施方案中,所述靶配体包含靶核酸。在一些实施方案中,所述第一多核苷酸包含所述捕
获探针。在一些实施方案中,(e)包括使与所述靶核酸杂交的所述第一多核苷酸延伸。在一些实施方案中,所述延伸包括添加可检测的双脱氧核苷酸。在一些实施方案中,所述方法在流通池上进行。
241.图15a和图15b中示出了将索引多核苷酸酶促添加到珠的示例性实施方案。图15a和图15b示出了靶核酸经由第一多核苷酸的捕获探针与珠的杂交,经由第二多核苷酸将索引多核苷酸添加到珠中,并且确定条形码和附接于珠的索引。图15a第一图示出了包含第一多核苷酸和第二多核苷酸的珠。第一多核苷酸包含:代码,诸如条形码;引物,诸如条形码引物结合位点;和探针,诸如捕获探针。图15a第二图示出了靶核酸与捕获探针的杂交。图15a第三图示出了具有荧光双脱氧核苷酸(星形)的第一多核苷酸的单碱基延伸(sbe)。图15a第四图示出了将反应性基团(三角形)添加到第二多核苷酸,诸如反应性双脱氧核苷酸。添加可包括使用末端脱氧核苷酸转移酶(tdt)。图15b第一图示出了经由反应性基团和衔接子将包含索引、索引引物结合位点和衔接子的索引多核苷酸添加到第二多核苷酸。可将珠装载到阵列上,可从荧光双脱氧核苷酸确定珠的位置,并且可移除荧光双脱氧核苷酸。图15b第二图示出了索引引物与索引引物结合位点的杂交以确定索引的序列。索引引物和靶核酸可被去杂交。图15b第三图示出了条形码引物与条形码引物结合位点的杂交以确定条形码的序列。
242.间隔区
243.此处提供的一些实施方案包括使用间隔区。间隔区可包括具有长度大于或等于1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、200、500个连续核苷酸的多核苷酸,或在前述数字的任两个数字的范围内的长度。在一些实施方案中,间隔区可位于两个多核苷酸元件之间,以通过减小空间位阻来增加某些过程的效率。例如,间隔区可用于增加酶促过程的效率,诸如使用底物诸如附接于珠的多核苷酸的聚合酶、连接酶和/或末端转移酶。在一些实施方案中,间隔区可位于包括以下的任何两个元件之间:珠,诸如多核苷酸与珠的附接末端、索引、索引引物结合位点、条形码、条形码引物结合位点和捕获探针。
244.试剂盒和系统
245.一些实施方案包括用于解码微特征(诸如阵列上的多核苷酸)的试剂盒和系统。一些此类试剂盒和系统可包括基板诸如芯片,或具有随机分布在基板表面上的多核苷酸阵列的流体池(fluidic cell)。多核苷酸可包含条形码的引物结合位点3’。在一些此类实施方案中,每个多核苷酸可包含捕获探针。在更多此类实施方案中,每个多核苷酸可通过共同元件与捕获探针相关联。例如,多核苷酸和捕获探针可各自结合到相同的微特征诸如珠。一些实施方案包括检测器,该检测器适于检测来自与阵列中的多核苷酸杂交的试剂的信号;此类试剂可包括测序试剂,诸如包含可检测标记的核苷酸。一些实施方案包括检测器,该检测器适于检测可由将核苷酸掺入多核苷酸(诸如焦磷酸盐)或氢离子变化引起的信号。
246.一些实施方案包括含有至少第一珠亚群和第二珠亚群的试剂盒或系统。在一些实施方案中,亚群的每个珠可包括第一多核苷酸,该第一多核苷酸包含捕获探针、指示相同珠的捕获探针的条形码和该条形码的条形码引物结合位点3’。在一些实施方案中,亚群的每个珠还可包括第二多核苷酸,该第二多核苷酸包含索引和该索引的索引引物结合位点3’。在一些实施方案中,珠亚群的索引可指示该特定珠亚群。在一些实施方案中,第一亚群的索引不同于第二亚群的索引。在本文提供的试剂盒和系统的一些实施方案中,第一体积包括
第一珠亚群,并且第二体积包括第二珠亚群。
247.在一些实施方案中,第一珠亚群和第二珠亚群的捕获探针各自包含彼此不同的核苷酸序列。在一些实施方案中,第一珠亚群和第二珠亚群的不同捕获探针包含相同的核苷酸序列。在一些实施方案中,捕获探针包含能够与单核苷酸多态性(snp)或其互补序列杂交的核苷酸序列。
248.在一些实施方案中,条形码引物结合位点包含相同的核苷酸序列。一些实施方案还包括能够与条形码引物位点杂交的多个条形码引物。
249.在一些实施方案中,第一珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。一些实施方案还包括能够与索引引物位点杂交的多个索引引物。
250.在一些实施方案中,基板包括多个离散位点。在一些实施方案中,基板包括多个孔。在一些实施方案中,基板包括多个通道。在一些实施方案中,流通池包括基板。在一些实施方案中,该基板适于使得第一珠亚群和第二珠亚群的组合在该基板的表面上形成珠阵列,并且该阵列能够在多个边合成边测序循环中进行测序。
251.在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少500个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少5000个包含不同核苷酸序列的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50000个包含不同核苷酸序列的捕获探针。
252.一些实施方案包括至少10个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少100个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少1000个不同珠亚群,每个亚群包含不同于另一亚群的索引。一些实施方案包括至少10000个不同珠亚群,每个亚群包含不同于另一亚群的索引。
253.一些实施方案包括试剂盒,该试剂盒包括:随机分布在基板表面上的多核苷酸阵列,其中每个多核苷酸包含条形码的引物结合位点3’并连接到捕获探针,其中每个多核苷酸包含不同的条形码并连接到不同的捕获探针。在一些实施方案中,每个多核苷酸经由珠连接到捕获探针。在一些实施方案中,每个多核苷酸包含捕获探针。在一些实施方案中,基板是平面的。在一些实施方案中,基板包括孔。在一些实施方案中,多核苷酸附接于珠。在一些实施方案中,珠分布在孔中。在一些实施方案中,流通池包括阵列。
254.一些实施方案包括含有第一珠亚群和第二珠亚群的试剂盒和系统。在一些实施方案中,每个珠包含特异性结合到靶配体的捕获探针。靶配体的示例包括核酸、蛋白质或其他抗原。捕获探针的示例包括核酸、抗体和抗体的抗原结合片段。在一些实施方案中,每个珠包含第一多核苷酸,该第一多核苷酸包含指示相同珠的捕获探针的条形码和该条形码的条形码引物结合位点3’。在一些实施方案中,每个珠包含第二多核苷酸,该第二多核苷酸包含索引和该索引的索引引物结合位点3’。在一些此类实施方案中,第一亚群的索引不同于第二亚群的索引。例如,第一珠亚群的索引可用于将第一珠亚群与第二珠亚群区分开来。在一些实施方案中,第一珠亚群与第二珠亚群分开。例如,第一体积包括第一珠亚群,并且第二体积包括第二珠亚群。
255.在一些实施方案中,捕获探针包含核酸,并且靶配体包含靶核酸。在一些此类实施方案中,第一多核苷酸包含捕获探针。在一些实施方案中,捕获探针包含能够与单核苷酸多态性(snp)或其互补序列杂交的核苷酸序列。
256.在一些实施方案中,捕获探针包含抗体或抗体的抗原结合片段。
257.在一些实施方案中,第一珠亚群和第二珠亚群的捕获探针各自特异性结合到彼此不同的靶配体。例如,第一珠亚群的捕获探针各自特异性结合到彼此不同的靶配体;并且第二珠亚群的捕获探针各自特异性结合到彼此不同的靶配体。在一些实施方案中,第一珠亚群和第二珠亚群的不同捕获探针特异性结合到相同的靶配体。例如,第一珠亚群的一组不同的捕获探针与第一珠亚群的一组不同的捕获探针特异性结合到相同的靶配体。
258.在一些实施方案中,条形码引物结合位点包含相同的核苷酸序列。一些实施方案还包括能够与条形码引物位点杂交的多个条形码引物。
259.在一些实施方案中,第一珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且/或者第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。一些实施方案还包括能够与索引引物位点杂交的多个索引引物。
260.在一些实施方案中,基板包括多个离散位点。在一些实施方案中,基板包括多个孔。在一些实施方案中,基板包括多个通道。在一些实施方案中,流通池包括基板。在一些实施方案中,该基板适于使得第一珠亚群和第二珠亚群的组合在该基板的表面上形成珠阵列,并且该阵列能够在多个边合成边测序循环中进行测序。
261.在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50、100、500、1000或5000个彼此不同的捕获探针,或在前述数量的任两个数量之间的任何数量的捕获探针。一些实施方案还包括至少5、10、20、50、100、200、500、1000个不同珠亚群,每个亚群包含不同于另一亚群的索引,或在前述数量的任两个数量之间的任何数量的不同珠亚群。
262.一些实施方案包括试剂盒,该试剂盒包括:第一珠亚群和第二珠亚群,其中每个珠包含:特异性结合到靶配体的捕获探针、包含指示捕获探针的条形码和该条形码的条形码引物结合位点3’的第一多核苷酸、以及包含索引和该索引的索引引物结合位点3’的第二多核苷酸,其中第一亚群的索引不同于第二亚群的索引,其中第一体积包括第一珠亚群,并且第二体积包括第二珠亚群。在一些实施方案中,捕获探针包含核酸,并且靶配体包含靶核酸。在一些实施方案中,第一多核苷酸包含捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群的捕获探针各自包含彼此不同的核苷酸序列。在一些实施方案中,第一珠亚群和第二珠亚群的不同捕获探针包含相同的核苷酸序列。在一些实施方案中,捕获探针包含抗体或其抗原结合片段。在一些实施方案中,第一珠亚群和第二珠亚群的捕获探针各自特异性结合到彼此不同的靶配体。在一些实施方案中,第一珠亚群和第二珠亚群的不同捕获探针特异性结合到相同的靶配体。在一些实施方案中,条形码引物结合位点包含相同的核苷酸序列。一些实施方案还包括能够与条形码引物位点杂交的多个条形码引物。在一些实施方案中,第一珠亚群的索引的核苷酸序列包含相同的核苷酸序列,并且第二珠亚群的索引的核苷酸序列包含相同的核苷酸序列。在一些实施方案中,索引引物结合位点的核苷酸序列包含相同的核苷酸序列。一些实施方案还包括能够与索引引物位点杂交的多个索引引物。在一些实施方案中,流通池包括基板。在一些实施方案中,该基板适于使得第一珠亚群
和第二珠亚群的组合在该基板的表面上形成珠阵列,并且该阵列能够在多个边合成边测序循环中进行测序。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少50个彼此不同的捕获探针。在一些实施方案中,第一珠亚群和第二珠亚群各自包含至少500个彼此不同的捕获探针。一些实施方案还包括至少10个不同珠亚群,每个亚群包含不同于另一亚群的索引。
263.本文提供的试剂盒和系统的更多实施方案可包括多个珠群体,所述多个珠群体包含附接于所述珠的寡核苷酸,所述寡核苷酸包含索引、邻近所述索引的索引引物结合位点、捕获探针、条形码和邻近所述条形码的条形码引物结合位点,其中所述索引在所述珠群体之间是不同的。在一些实施方案中,所述索引引物结合位点在所述多个群体中是相同的。在一些实施方案中,所述条形码指示所述捕获探针的核酸序列。在一些实施方案中,所述条形码在珠群体中是不同的。在一些实施方案中,所述条形码引物结合位点在所述多个群体中是相同的。在一些实施方案中,所述珠包含生物素、链霉亲和素或其衍生物。在一些实施方案中,所述珠是有磁性的。
264.一些实施方案还包括选自以下的试剂:基因座特异性寡核苷酸;用于对核酸样本进行片段标签化的转座体;包含索引和索引引物结合位点的转座体;包含索引和索引引物结合位点的衔接子;能够与索引引物结合位点或其互补序列杂交的引物;以及/或能够与条形码引物结合位点或其互补序列杂交的引物。一些实施方案还包括阵列,诸如流通池表面上的阵列。一些实施方案包括检测器,该检测器适于检测来自与阵列中的多核苷酸杂交的试剂的信号;此类试剂可包括测序试剂,诸如包含可检测标记的核苷酸。一些实施方案包括检测器,该检测器适于检测可由将核苷酸掺入多核苷酸(诸如焦磷酸盐)或氢离子变化引起的信号。
265.实施例
266.实施例1:通过测序解码阵列
267.合成多个多核苷酸,每个多核苷酸从5’至3’依次包含:间隔区、独特条形码、引物结合位点和独特捕获探针。条形码和捕获探针的序列是已知的;对于每个多核苷酸而言,引物结合位点的序列是相同的。每个多核苷酸附接于珠。珠随机分布到芯片的孔中。通过将引物与引物结合位点杂交、延伸该引物并检测条形码的序列来解码珠阵列。该条形码的位置识别相关联的捕获探针的位置。
268.实施例2:通过测序解码阵列上的条形码
269.制备由人基因组dna制备的核酸文库。制备珠亚群。将第一多核苷酸和第二多核苷酸附接于每个珠。第一多核苷酸包括捕获探针、条形码引物结合位点和指示该捕获探针的条形码。第二多核苷酸包括索引和索引引物结合位点。
270.将包含18816种不同代码/探针类型的珠池加载到hiseq流通池上(图7a)。固定后,使用sbs化学对20个核苷酸长的代码测序,并通过将代码序列与一系列珠类型进行比对来确定每个珠的种类。图7b是某些室(bins)中某些珠类型的重复数的直方图,并且示出了使用基于测序的解码过程识别了97.5%的预期内容物,并且绝大多数珠类型以足以进行基因分型研究的水平存在。
271.实施例3:使用ffn检测在hiseq上进行基因分型的性能
272.为了展示使用ffn检测在hiseq上进行基因分型的性能,将寡核苷酸靶dna与缀合
至探针寡核苷酸的珠的悬浮液杂交。将珠加载到hiseq流通池上。使用荧光核苷酸将与靶dna结合的探针延伸单个碱基。对加载了珠的流通池进行成像,以获得基因分型珠强度。使用sbs化学切割荧光核苷酸并对珠进行解码。比对解码和基因分型读取以测量测定性能。根据预期的基因型对各个点着色。图7c是c强度对t强度的图,其中每个点是给定珠类型的所有重复的平均值,并且根据预期的基因型着色,并显示用荧光核苷酸的单碱基探针延伸使得能够进行准确的基因分型。
273.实施例4:用10,368丛(plex)珠池多路复用12个样本
274.该实施例展示了在单个流通池上解多路复用多个样本,并且具体地,展示了使用10,368丛珠池多路复用12个样本的能力。将单个珠池分别与12个不同的索引序列杂交。杂交后,将样本合并并加载到hiseq流通池中。然后进行两次单独的读取,一次基于杂交索引识别样本,另一次读取基于解码读取识别珠类型。图8是代表性样本的某些分组中某些珠类型的数量的直方图,并显示大多数珠类型以足以进行给定样本的基因分型实验的水平存在。图7中的表汇总了同时合并和加载的12个索引样本中解多路复用和解码珠的一致性,这表明样本表示是一致的,并且大多数探针都存在于所有样本中。
275.实施例5:大型平行snp基因分型
276.这是在单个测序运行中对384个样本进行基因分型的示例性工作流程。在384孔板中制备包含包括目的单核苷酸多态性(snp)的靶核酸的多核苷酸。每个孔含有来自不同受试者的dna。用使dna片段化的转座体将dna片段标签化,并将扩增引物结合位点添加到片段的每个末端。用包括索引和索引引物结合位点的引物扩增片段以获得扩增片段,其中每个扩增片段的至少一个末端包括索引和索引引物结合位点。每个孔的索引不同,使得来源于某个孔的多核苷酸可通过某个索引来识别。所制备的多核苷酸包括索引、索引引物结合位点和靶核酸。
277.将珠群体添加到每个孔中。珠群体包括附接于珠的寡核苷酸。寡核苷酸包括条形码、条形码引物结合位点和捕获探针。捕获探针的长度为50个核苷酸并且对特定靶核酸具有特异性。条形码可用于识别捕获探针。珠群体包括不同的捕获探针。靶核酸与每个孔中的溶液中的捕获探针杂交以获得杂交的珠。将来自每个孔的杂交的珠合并在一起并加载到流通池上的珠阵列上。将杂交的珠随机分布在阵列上。
278.在阵列上,捕获探针通过单个核苷酸延伸以识别snp。通过使与索引引物结合位点杂交的引物延伸来对索引进行测序以识别靶核酸的来源。通过使与索引引物结合位点杂交的引物延伸来对条形码进行测序,以解码珠在阵列上的位置。识别特定的snp并且与来自特定受试者的特定dna样本相关联。
279.如本文所用,术语“包含”与“包括”、“含有”或“特征在于”同义,并且是包括性的或开放式的,并且不排除另外的未列举的要素或方法步骤。
280.以上描述公开了本发明的几种方法和材料。本发明易于在方法和材料上进行修改,以及在制造方法和装置上进行改变。考虑到本公开或本文公开的本发明的实践,这种修改对于本领域技术人员来说将变得显而易见。因此,并非意图将本发明限制于本文所公开的具体实施方案,而是其涵盖了落入本发明的真实范围和精神内的所有修改形式和替代形式。
281.本文引用的所有参考文献,包括但不限于公开和未公开的申请、专利和参考文献,
均全文以引用方式并入本文,并且据此成为本说明书的一部分。就以引用方式并入的出版物和专利或专利申请与说明书中包含的公开内容相矛盾的程度而言,本说明书旨在取代和/或优先于任何此类矛盾的材料。
