1.本发明涉及生物活性肽技术领域,具体涉及一种核桃肽及其制备方法和应用。
背景技术:
2.核桃,又称胡桃,羌桃,为胡桃科植物。与扁桃、腰果、榛子并称为世界著名的“四大干果”。核桃仁含有丰富的营养素,每百克含脂肪较多,蛋白质15~20克,碳水化合物10克;并含有人体必需的钙、磷、铁等多种微量元素和矿物质,以及胡萝卜素、核黄素等多种维生素,深受人们喜爱。
3.核桃粕是核桃榨油时的副产物,目前仅被用作饲料或肥料,这使得核桃粕中的营养物质没有得到充分利用,特别是其中的生物活性物质被忽视。高营养价值的核桃粕的利用率不高导致产品增值较低。近几十年,生物活性肽的发展为核桃粕的精深加工带来了新思路。核桃粕蛋白酶解物具有较多的生物活性,多肽多样的生物活性功能和良好的加工特性使其逐渐成为研究的热点。
4.记忆力下降作为一种临床症状在很多神经退行性疾病中都有表现,目前研究较多的有阿尔兹海默病、血管性痴呆、帕金森症、铝中毒、癫痫等。记忆力下降作为神经退行性疾病发生发展过程中显著的特征而广受关注。神经退行性疾病的成因有很多,包括β-淀粉样肽(aβ)的积淀、胆碱功能系统功能紊乱、谷氨酸含量过高、线粒体作用紊乱、氧化应激及炎症释放等。由此可见,对神经退行性疾病中记忆能力的调控趋势是多方位多靶点的。因此,开发具有预防、改善记忆力下降及认知功能退化的活性物质成为科学工作者的重点。
5.核桃蛋白是一种包含18种氨基酸且8种必需氨基酸种类齐全、含量合理的优质植物蛋白。其中谷氨酸(glu)、精氨酸(arg)和天冬氨酸(asp)对于维持人体神经系统具有重要的作用。核桃肽中起神经保护、辅助改善记忆作用的多肽序列结构尚未有大量的研究。现有的核桃肽提取工艺存在成本高、浪费大,不利于工业化的问题,并且酶解过程常采用各种蛋白酶一起参与整个酶解过程,忽略了蛋白酶之间的差异性,从而存在酶解效果不理想,制备得到的核桃肽质量不高的问题。
技术实现要素:
6.为了解决现有技术中存在的问题,本发明的目的在于提供一种核桃肽,所得核桃肽对中枢神经具有保护功效,可以有效改善实验动物空间记忆力和学习探索能力。
7.本发明的目的还在于提供了上述核桃肽的制备方法和应用。
8.为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种核桃肽,所述核桃肽为单链多肽,结构序列为geereergld。
9.优选的,所述肽链分子量为1189.186da。
10.本发明还提供了上述核桃肽的制备方法,包括以下步骤:(1)核桃粕浆用纤维素酶和果胶酶进行酶解,灭酶后过滤干燥,得到核桃蛋白;(2)制备核桃蛋白浆,将核桃蛋白浆在50~60℃保温,调节ph后依次用碱性蛋白酶、
木瓜蛋白酶进行酶解,得到核桃蛋白酶解液;(3)所述核桃蛋白酶解液中加入活性炭保温、过滤、干燥,得核桃肽混合物;(4)将核桃肽混合物制备成溶液,采用高效液相色谱分离纯化得到核桃肽geereergld。
11.优选的,所述步骤(1)中纤维素酶的添加量为1200~1800u/ml,果胶酶的添加量为400~600u/ml,核桃粕浆液在ph值6~7、温度为50~55℃下酶解3~5 h。
12.优选的,所述步骤(2)中碱性蛋白酶酶解4.5~5.5 h后,加入木瓜蛋白酶继续酶解3.5~4.5 h;碱性蛋白酶的添加量为450~550u/ml,木瓜蛋白酶的添加量为200~300u/ml,碱性蛋白酶和木瓜蛋白酶的酶解ph值为8~8.5、温度为50~60℃。
13.优选的,所述步骤(4)中核桃肽混合物配制得到浓度为0.8~1.2 mg/ml的水溶液。
14.优选的,所述步骤(4)中采用高效液相色谱进行两次分离纯化,以流动相a:水+0.1%三氟乙酸,流动相b:乙腈+0.1%三氟乙酸进行梯度洗脱得到核桃肽geereergld。
15.优选的,第一次高效液相色谱条件如下:采用规格为550mm
×
40μm,20μm的制备型液相色谱柱流速14~15ml/min;洗脱程序为0~5min 5%b,5~15min 5%b~25%b,15~45min 25%~55%b;收集21~24min的洗脱流份。
16.优选的,第二次高效液相色谱条件如下:采用规格为250mm
×
4.6mm,5μm的agilent plus c18色谱柱;流速0.4~0.5ml/min;洗脱程序为0~10min 5%b,10~25min 80%b,25~30min 5%b;收集20~24min的洗脱流份。
17.本发明还提供了上述核桃肽在制备神经保护和/或记忆力改善产品中的应用。
18.与现有技术相比,本发明的技术方案的有益效果如下:本发明制备得到的核桃肽具有较高的抗氧化活性,对h2o2诱导的pc12细胞具有明显的保护作用,可以抑制细胞凋亡;同时,本发明制备得到的核桃肽对中枢神经具有保护功效,可以改善学习和记忆能力。
19.本发明核桃肽的制备方法简单,成本低、浪费少,可用于工业化生产。
附图说明
20.图1为核桃肽序列结构;图2为样品处理后斑马鱼中枢神经凋亡细胞典型图;图3为核桃肽t2对实验动物体重(g)的影响;图4为核桃肽t2对实验动物脏器系数(%)的影响;图5为核桃肽t2对矿场实验中的中心区域访问次数的影响;图6为核桃肽t2对矿场实验中总运动距离的影响;图7为核桃肽t2对矿场实验中时间的影响;图8为矿场实验动物活动路线示意图;图9为核桃肽t2对新物体识别实验中次数认知指数的影响;图10为核桃肽t2对新物体识别实验中运动距离认知指数的影响;图11为核桃肽t2对新物体识别实验中时间认知指数的影响;图12为新物体识别实验动物活动路线示意图;图13为核桃肽t2对t迷宫实验中新异臂的移动距离占总移动距离比例的影响;
图14为核桃肽t2对t迷宫实验中停留时间的影响;图15为t迷宫实验动物活动路线示意图;图16为核桃肽t2对实验动物morris水迷宫中游泳速度的影响;图17为核桃肽t2对实验动物morris水迷宫中穿越平台次数的影响;图18为核桃肽t2对实验动物morris水迷宫中逃避潜伏期的影响;图19为核桃肽t2对实验动物morris水迷宫中游泳距离的影响;图20为核桃肽t2各实验动物morris水迷宫第三天典型运动轨迹;图21为核桃肽t2各实验动物morris水迷宫第四天典型运动轨迹;图22为核桃肽t2对实验动物大脑海马组织的影响;图23为核桃肽t2对实验动物血清生化指标的影响;图24为核桃肽t2对实验动物脑组织生化指标的影响。
具体实施方式
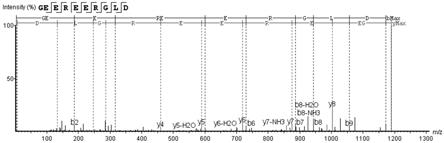
21.本发明提供了一种核桃肽,鉴定其结构为geereergld的单链多肽,分子量为1189.186da,序列结构见图1。
22.本发明所述核桃肽是从脱脂核桃粕中酶解、分离、纯化得到的,具有较高的抗氧化活性,对h2o2诱导的pc12细胞具有明显的保护作用,可以抑制细胞凋亡;同时,本发明制备得到的核桃肽对中枢神经具有保护功效,可以改善学习和记忆能力。
23.本发明还提供了上述核桃肽的制备方法,包括以下步骤:(1)核桃粕浆用纤维素酶和果胶酶进行酶解,灭酶后过滤干燥,得到核桃蛋白;(2)制备核桃蛋白浆,将核桃蛋白浆在50~60℃保温,调节ph后依次用碱性蛋白酶、木瓜蛋白酶进行酶解,得到核桃蛋白酶解液;(3)所述核桃蛋白酶解液中加入活性炭保温、过滤、干燥,得核桃肽混合物;(4)制备核桃肽混合物溶液,并采用高效液相法进行分离纯化得核桃肽。
24.在本发明中,所述核桃粕是由核桃脱壳,冷榨去油后得到的脱脂核桃粕,蛋白含量为45~56%,优选为50~55%,对脱脂核桃粕的具体来源不作限定。
25.本发明将脱脂核桃粕和水按料液比1:8~12 g/ml混合得到核桃粕浆液,所述料液比优选为1:9~11 g/ml,更优选为1:10 g/ml。本发明所述水优选为去离子水。
26.本发明将核桃粕浆液ph值调节至6~7,并升温至50~55℃。优选的,所述ph值为6.5~6.8,所述温度为52~54℃。本发明对具体使用的ph调节剂不作限定,采用常规酸碱ph调节剂即可,作为一种可选的实施方式,本发明采用浓度为10mol/l的hcl调节核桃粕浆液ph。本发明对具体的升温方式不作限定。本发明通过调节核桃粕浆液的ph和温度,可提高纤维素酶和果胶酶的活性。
27.本发明在核桃粕浆液中添加纤维素酶和果胶酶进行酶解反应,所述反应时间为3~5h,优选为4h。本发明中纤维素酶的添加量为1200~1800u/ml,优选为1500~1600u/ml;果胶酶的添加量为400~600u/ml,优选为500~550u/ml。本发明通过同时添加纤维素酶和果胶酶对核桃粕进行双酶解反应,复合提取核桃蛋白,可以有效提高核桃蛋白的提取效率。本发明对纤维素酶和果胶酶的具体来源不作限定。
28.本发明将核桃粕浆液酶解产物于100~110℃下灭酶处理8~10min。
29.本发明对灭酶后的核桃粕浆液酶解产物进行过滤干燥。作为一种可选的实施方式,本发明利用板框压滤机对酶解产物进行过滤,收集滤饼;将滤饼于管束干燥机中干燥,得到核桃蛋白。本发明对具体的过滤干燥方式不作限定。本发明制备得到的核桃蛋白中蛋白质的含量可达82~89%。
30.本发明将上述制备得到的核桃肽蛋白与水按料液比1:18~22g/ml混合得到核桃蛋白浆,所述料液比优选为1:19~21g/ml,更进一步优选为1:20g/ml。本发明所述水优选为去离子水,得到的核桃肽蛋白浆底物浓度约为5%。
31.本发明将核桃蛋白浆ph值调节至8.8~9.2,优选的,所述ph值为8.9~9.0。本发明对具体使用的ph调节剂不作限定,采用常规酸碱ph调节剂即可。作为一种可选的实施方式,本发明采用浓度为9~10mol/l的naoh溶液调节核桃蛋白浆ph至9.0。本发明发现该ph值条件下的核桃蛋白的溶解性更好。
32.本发明对核桃蛋白浆进行均质处理。作为一种可选的实施方式,本发明将核桃蛋白浆于胶体磨(5000~6000转/分钟,过滤网50~60目)中处理10~15min,然后利用高压均质机(6~7kpa)处理5~10min。本发明对具体的均质处理方式不作限定。本发明通过均质处理,可以保证浆液颗粒粒径一致,浆液质地细腻、不分层,有利于提高浆液的稳定性。
33.本发明将均质后的核桃蛋白浆液进行搅拌处理,并升温至50~60℃,保温1~2h。所述升温温度优选为55~58℃,所述保温时间优选为1.5h。本发明通过升温并保温处理,有利于核桃蛋白浆液的脱色脱味。
34.本发明对保温处理后的核桃蛋白浆液再次进行ph调节,所述ph值调节为8~8.5,优选为8.2~8.4。本发明对具体使用的ph调节剂不作限定,采用常规酸碱ph调节剂即可。作为一种可选的实施方式,本发明采用浓度为0.5~1mol/l的hcl溶液调节核桃蛋白浆ph至8.5。本发明在ph调节过程中保持温度恒定(50~60℃)。本发明通过调节核桃蛋白浆液的ph和温度,可提高后续酶解过程中的碱性蛋白酶和木瓜蛋白酶的活性。
35.本发明在核桃蛋白浆液中先添加碱性蛋白酶进行酶解反应,所述反应时间为4.5~5.5 h,优选为5 h。本发明中碱性蛋白酶的添加量为450~550u/ml,优选为480~520u/ml。本发明对碱性蛋白酶的具体来源不作限定。
36.本发明在碱性蛋白酶酶解反应结束后,继续添加木瓜蛋白酶进行酶解反应,所述反应时间为3.5~4.5 h,优选为4 h。本发明中木瓜蛋白酶的添加量为200~300u/ml,优选为250~280u/ml。本发明对木瓜蛋白酶的具体来源不作限定。
37.本发明将核桃蛋白浆液酶解产物升温至100~110℃,保持5~7min,对产物中的蛋白酶进行灭活。
38.本发明将灭酶后的核桃蛋白浆酶解产物降温至45~55℃,加入活性炭保温5~7 h,进行脱味、脱色处理。所述温度优选为50℃;所述活性炭的添加量为7~9 wt%,优选为8 wt%;所述保温时间优选为6 h。
39.本发明对核桃蛋白浆酶解产物进行过滤、干燥处理,得到核桃肽混合物。作为一种可选的实施方式,本发明将脱苦后的核桃蛋白浆酶解产物过28000~ 30000da陶瓷膜,然后再过1~1.2kd有机膜,所得滤液进行喷雾干燥,得到核桃肽混合物。本发明对具体的过滤、干燥方式不作限定。
40.本发明将上述制备得到的核桃肽制备核桃肽混合物溶液,所述核桃肽混合物溶液
的制备方法为:用超纯水配制浓度为0.8~1.2 mg/ml的溶液,所述溶液浓度优选为1 mg/ml。
41.本发明采用高效液相法对上述制备得到的核桃肽混合物溶液进行分离纯化,采用高效液相色谱进行两次分离纯化得到所述核桃肽geereergld。在本发明的两次高效液相色谱分离过程中,均采用流动相a:水+0.1%三氟乙酸,流动相b:乙腈+0.1%三氟乙酸进行梯度洗脱。
42.本发明先对核桃肽混合物溶液进行第一次分离纯化,色谱条件为:液相色谱柱(550mm*40μm,20μm),流速14~15ml/min,采用流动相a(水+0.1%三氟乙酸),流动相b(乙腈+0.1%三氟乙酸)进行梯度洗脱,洗脱程序为0~5min 5%b,5~15min 5%b~25%b,15~45min 25%~55%b。
43.本发明将21~24min得到的流份进行第二次分离纯化,色谱条件为:色谱柱(agilent plus c18 250mm*4.6mm,5μm),流速0.4~0.5ml/min,采用流动相a(水+0.1%三氟乙酸),流动相b(乙腈+0.1%三氟乙酸)进行梯度洗脱,洗脱程序为0~10min 5%b,10~25min 80%b,25~30min 5%b。本发明在第二次洗脱20~24 min得到的流份即为所述核桃肽流份。
44.本发明对上述制备得到的核桃肽流份进行冷冻干燥,得到核桃肽geereergld。本发明对具体的干燥方式不作限定。
45.本发明还提供了上述核桃肽在制备神经保护和/或记忆力改善药物中的应用。本发明制备得到的核桃肽具有较高的抗氧化活性,对h2o2诱导的pc12细胞具有明显的保护作用,可以抑制细胞凋亡;同时,本发明制备得到的核桃肽对中枢神经具有保护功效,可以改善学习和记忆能力,可应用于神经保护和/或记忆力改善药品的制备。
46.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
47.注:本发明附图中,“*”表示与正常组比较p<0.05,“**”表示与正常组比较p<0.01,“***”表示与正常组比较p<0.001,“****”表示与正常组比较p<0.0001;“#”表示与模型组比较p<0.05,“##”表示与模型组比较p<0.01,“###”表示与模型组比较p<0.001,“####”表示与模型组比较p<0.0001;“&”表示与阳性对照组比较p<0.05,“&&”表示与阳性对照组比较p<0.01,“&&&”表示与阳性对照组比较p<0.001。
48.实施例1(1)双酶复合提取核桃蛋白:取1200kg脱脂核桃粕,与去离子水按照1:10g/ml混合,调节ph至6.5,升温至54℃,添加纤维素酶(1500u/ml)和果胶酶(500u/ml),酶解4h,100℃灭酶10min,利用板框压滤机,收集滤饼,利用管束干燥机将滤饼干燥,即为核桃蛋白。
49.(2)核桃肽生产工艺:a.取核桃蛋白500kg,加入去离子水10000l进行调浆。
50.b.将步骤a的核桃蛋白溶液搅拌均匀,利用浓度为10mol/l的naoh调ph至9.0,然后采用胶体磨(6000转/分钟,过滤网60目)进行处理10min,再利用高压均质机(7kpa)进行处理6min。
51.c.将高压均质后的匀浆液进行投料,进行搅拌处理,并升温至55℃,保温1小时。
52.d.将步骤c的溶液用浓度为1mol/l的hcl调ph至8.5,并始终保持温度恒定。
53.e.将步骤d中的溶液加入碱性蛋白酶(500u/ml),酶解5小时后再加入木瓜蛋白酶(250u/ml),继续酶解4h。
54.f.将步骤e中的溶液升温至110℃,保持5min,对蛋白酶进行灭活。
55.g.将步骤f的灭酶溶液降温至50℃,加入8%的活性炭(40kg),保温6小时后过30000da陶瓷膜,然后过1kd有机膜,喷雾干燥,得到核桃肽混合物。
56.h.在步骤g得到的核桃肽混合物中加入适量超纯水,制备得到浓度为1mg/mll的核桃肽混合物溶液。
57.i.采用高效液相法对核桃肽混合物溶液进行分离纯化。
58.第一次分离纯化:色谱条件:制备型液相色谱柱(550mm*40μm,20μm),流速为15ml/min,流动相a(水+0.1%三氟乙酸),流动相b(乙腈+0.1%三氟乙酸)进行梯度洗脱,洗脱程序为0~5min 5%b,5~15min 5%b~25%b,15~45min 25%~55%b。得到15个组分:0~3min得流份1;3~6min得流份2;6~9min得流份3;9~12min得流份4;12~15min得流份5;15~18min得流份6;18~21min得流份7;21~24min得流份8;24~27min得流份9;27~30min得流份10;30~33min得流份11;33~36min得流份12;36~39min得流份13;39~42min得流份14;42~45min得流份15。
59.第二次分离纯化:对第一次分离纯化得到的流份8进一步进行液相分析。
60.检测条件为:色谱柱:agilent plus c18 250mm*4.6mm,5μm流动相:a:水+三氟乙酸(0.1%);b:乙腈+三氟乙酸(0.1%)洗脱程序为0~10min 5%b,10~25min 80%b,25~30min 5%b。
61.检测波长:214 nm;流速:0.5 ml/ min;检测时间:30 min;进样体积:10μl;柱温:室温。
62.对流份8进一步分离共得到4个流份,12~16min得流份8-1;16~20min得流份8-2;20~24min得流份8-3;24~28min得流份8-4。
63.j.对核桃肽流份8-3进行冷冻干燥,即得核桃肽。
64.实施例2本实施例与实施例1的区别仅在于:步骤(1)中脱脂核桃粕与去离子水按照1:11g/ml混合。
65.实施例3本实施例与实施例1的区别仅在于:步骤(1)中添加纤维素酶(1600 u/ml)和果胶酶(550u/ml),酶解5h。
66.实施例4本实施例与实施例1的区别仅在于:步骤a中加入核桃蛋白500kg,加入去离子水10000l进行调浆。
67.实施例5本实施例与实施例1的区别仅在于:步骤e中添加碱性蛋白酶(450u/ml),酶解5小时后再加入木瓜蛋白酶(260u/ml),继续酶解4h。
68.实施例6本实施例与实施例1的区别仅在于:步骤g中加入9%的活性炭。
69.实施例7
1、对第一次分离纯化得到的各流份进行抗氧化性评价收集步骤第一次分离纯化得到的液相色谱仪的洗脱液,并将15个流份冷冻干燥,分别配制得到10mg/ml的样品溶液,进行抗氧化性评价。
70.(1)不同组分dpph自由基清除率测定将100μl的0.2mmol/l dpph溶液和100μl 10mg/ml的样品溶液混合,室温反应30min,然后在517nm处测定吸光度a1;将100μl 10mg/ml的样品溶液在517nm处测定吸光度a2;100μl的0.2mmol/l dpph溶液在517nm处测定吸光度a0。计算公式如下:(2)不同组分羟自由基清除率测定羟自由基清除率测定原理是利用h2o2和fe
2+
混合产生
·
oh,在体系中加入水杨酸捕捉
·
oh显色。依次在试管中加入100μl 10mg/ml的样品溶液,5mmol/l水杨酸乙醇溶液200μl,5mmol/lfeso4溶液200μl,涡旋振荡,37℃反应1h,然后取200μl反应液在510nm处测定吸光度。计算公式如下:式中:ac为空白组吸光度;ab为对照组吸光度;aa为试验组吸光度。
71.对各组分dpph自由基清除率和羟自由基清除率测定结果如表1所示:表1 不同流份的抗氧化性评价
流份dpph自由基清除率(%)
·
oh自由基清除率(%)流份dpph自由基清除率(%)
·
oh自由基清除率(%)流份11.210.92流份962.158.2流份29.366.79流份1053.549.1流份316.312.6流份1139.333.9流份428.120.9流份1226.619.1流份539.831.1流份1319.311.2流份651.245.3流份149.15.2流份763.556.5流份153.262.15流份871.665.5
ꢀꢀꢀ
由表1可知,流份8的dpph自由基清除率和羟自由基清除率最高,具有较高的抗氧化活性。
72.2、对第二次分离纯化得到的各流份对h2o2诱导的pc12细胞的保护作用进行探究。
73.(1) pc12细胞培养将pc12细胞采用rmpi-1640完全培养基(含有10%胎牛血清、100u/ml青霉素和链霉素)培养条件为37℃,5%co2培养箱中进行培养,选择生长状态较好的3~7代细胞进行试验。
74.(2) 核桃肽对h2o2诱导的pc12细胞的保护作用取对数生长期的pc12细胞,调整细胞密度4
×
105个/ml,按照4
×
104个/孔接种于96孔培养板上,设置空白对照组(未经任何处理)、模型组(0.5mm的h2o2处理)、核桃肽样品组(0.5mm的h2o2处理,给予核桃肽4个流份处理),于37℃、5%co2恒温培养箱培养24h,用pbs轻轻洗涤1次,孵育24h后,每孔加入10μl 5mg/ml mtt溶液,继续培养4h,洗弃培养基,每孔加入100μl dmso,震荡10min至蓝紫色甲瓒晶体完全溶解后,用酶标仪测定od
490
值。
75.根据公式计算各流份的细胞存活率,结果见表2。
76.表2 不同组别细胞存活率不同流份流份8-1流份8-2流份8-3流份8-4模型组对照组细胞存活率(%)62.978.375.353.645.2100由表2可知,流份8-3对于h2o2诱导的pc12细胞具有较好的保护作用。
77.实施例8本实施例采用纳升级液相色谱-q exactive质谱联用系统,对实施例1得到的流份8-3进行纯度和结构鉴定。
78.1. 色谱条件:流动相:a相:100%纯净水+0.1%甲酸;b相:100%乙腈+0.1%甲酸;流动相流速:300nl/min;进样量:1μl上清;流动相梯度程序如下表3所示。
79.表3 流动相梯度程序时间(分)02.036.038.041.042.045.0a(%)97976310109797b(%)3337909033利用纳升级液相色谱-q exactive质谱联用,从核桃肽流份8-3中纯化得到了1条多肽,鉴定其结构为geereergld(1189.186da)的单链多肽,具体序列结构见图1。通过液质联用技术测定所得核桃肽在核桃肽混合物中的质量百分含量为1.12%。
80.委托武汉星皓生物技术有限公司对核桃肽进行合成,样品性状为白色粉末,记为核桃肽t2,人体每日推荐用量为300mg/60kg.bw(5mg/kg.bw)。样品于干燥、通风处保存,用于后续实验。
81.实施例9本实施例研究了实施例1步骤g得到的核桃肽混合物和实施例8合成的核桃肽t2对中枢神经的保护作用。
82.1. 样品配制核桃肽混合物,用标准稀释水配制成2.00 mg/ml母液,现配现用。
83.核桃肽t2,用标准稀释水配制成2.00 mg/ml母液,现配现用。
84.阳性对照:谷胱甘肽,白色粉末,批号slcf2362,sigma,阴凉避光储存。用超纯水配制成154 mg/ml母液,-20℃储存。
85.2. 实验动物:斑马鱼均饲养于28℃的养鱼用水中(水质:每1 l反渗透水中加入200 mg速溶海盐,电导率为450~550
ꢀµ
s/cm;ph为6.5~8.5;硬度为50~100 mg/l caco3),实验动物使用许可证号为:syxk(浙)2012-0171。饲养管理符合国际aaalac认证(认证编号:001458)的要求。野生型ab品系斑马鱼,以自然成对交配繁殖方式进行。年龄为受精后1天(1 dpf)的斑马鱼用于样品最大检测浓度(mtc)测定及中枢神经保护功效评价。
86.3. mtc测定:随机选取1 dpf野生型ab品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。除正常对照组外,其余各实验组均水溶给予霉酚酸吗啉乙酯建立斑马鱼中
枢神经损伤模型。分别水溶给予样品(浓度见表4),同时设置正常对照组和模型对照组,每孔容量为3 ml。28℃处理24 h后,测定样品对模型斑马鱼的mtc。mtc测定结果详见表4。
87.表4 样品中枢神经保护功效浓度摸索实验结果(n=30)由表4可知,在本实验条件下,核桃肽混合物和核桃肽t2对模型斑马鱼的最大检测浓度(mtc)为2000μg/ml。
88.4. 中枢神经保护功效评价随机选取1 dpf野生型ab品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。分别水溶给予样品(浓度见表5),阳性对照谷胱甘肽616μg/ml浓度,同时设置正常对照组和模型对照组,每孔容量为3 ml。除正常对照组外,其余各实验组均水溶给予霉酚酸吗啉乙酯建立斑马鱼中枢神经损伤模型。28 ℃处理1天后,用吖啶橙(ao)进行染色,染色后每个实验组随机选取10尾斑马鱼置于荧光显微镜下拍照,使用nis-elements d 3.20高级图像处理软件采集数据,分析斑马鱼中枢神经凋亡细胞荧光强度,以该指标的统计学分析结果评价样品中枢神经保护功效,结果见表5和图2(图中方框为定量的区域)。统计学处理结果采用mean
±
se表示。用spss26.0软件进行统计学分析,p《0.05表明差异具有统计学意义。
89.表5 样品中枢神经保护功效评价实验结果(n=10)
由表5和图2可知,模型对照组斑马鱼中枢神经凋亡细胞荧光强度(242416像素)与正常对照组(85600像素)比较p《0.001,表明斑马鱼中枢神经损伤模型建立成功。阳性对照药谷胱甘肽616
ꢀµ
g/ml浓度组斑马鱼中枢神经凋亡细胞荧光强度(86541像素)与模型对照组比较p《0.001,说明谷胱甘肽对霉酚酸吗啉乙酯诱发的斑马鱼中枢神经损伤模型具有明显的中枢神经保护功效。
90.核桃肽混合物的125、250和500μg/ml浓度组斑马鱼中枢神经凋亡细胞荧光强度分别为176230、159168和125961像素,与模型对照组比较,p均《 0.001,说明核桃肽混合物在本实验浓度条件下对霉酚酸吗啉乙酯诱发的斑马鱼中枢神经损伤模型具有明显的中枢神经保护功效。
91.核桃肽t2的2.5、5.0和500μg/ml浓度组斑马鱼中枢神经凋亡细胞荧光强度分别为109321、86912和86691像素,与模型对照组比较,p均《 0.001,说明核桃肽t2在本实验浓度条件下对霉酚酸吗啉乙酯诱发的斑马鱼中枢神经损伤模型具有明显的中枢神经保护功效,且效果强于核桃肽混合物。
92.实施例10采用实施例8所述核桃肽t2进行动物实验。采用spss 20.0进行数据处理,数值变量资料以表示。多个组均值比较采用完全随机设计方差分析,其中两两比较若方差齐选用lsd法,方差不齐选用dunnett's t3法。
93.1、试验动物:spf级体重18~22g的c57bl/6jnifdc小鼠72只,雄性,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号为scxk(京)2016-0006。实验动物饲料生产许可证scxk(津)2020-0004。实验动物使用许可证号为syxk(鲁)20200022。实验环境温度22℃
±
2℃,相对湿度50%
±
10%。
94.2、剂量选择:分别采用受试物人体推荐量5mg/kg.bw的10倍、20倍、60倍设置低、中、高三个剂量组,即0.05g/kg.bw、0.10g/kg.bw、0.30g/kg.bw。阳性对照为吡拉西坦片,人体推荐量60mg/kg.bw,依据《药理学实验方法学附录》人和动物间按体表面积折算的等效剂量比值计算小鼠摄入量为72mg/kg.bw。
95.3、实验方法:实验共分为6组,包括空白对照组(nc)、模型对照组(mc)、阳性对照组
(pc)、模型低剂量组(ml)、模型中剂量组(mm)、模型高剂量组(mh),每组实验动物数12只。实验动物连续灌胃30天,阴性对照给予等剂量的蒸馏水,灌胃量按0.2ml/10g计。
96.连续给药30天,次日开始测试。依次进行openfield矿场实验、nor新物体识别实验及tmaze迷宫实验、morris水迷宫实验,各实验间间隔7天,训练期间继续给药,训练前1h给药,给药30min后灌胃给予30%乙醇(灌胃体积以0.2ml/10g计)。行为学实验结束后,各组随机取两只实验动物进行灌注,取大脑组织于10%甲醛中固定,用于病理切片制作。其余实验动物摘眼球取血处死,留取血清及大脑组织备用。
97.对各组小鼠给药后的基本情况进行观察,发现各组动物生长发育、活动均正常,精神状态良好,无中毒表现和死亡。
98.各组实验动物连续给予不同剂量的受试物,连续30天。实验结束后,各组间实验动物体重、脏器系数进行两两比较,差异均无统计学意义(p》0.05)。详见表6~8和图3~4。
99.表6 核桃肽t2对实验动物体重(g)的影响(,n=12)
分组0d6d12d18d24d30dnc23.30
±
1.3225.31
±
1.0126.72
±
0.7327.711
±
0.9228.54
±
0.8728.97
±
0.92mc22.50
±
0.9324.76
±
0.8526.06
±
1.6827.661
±
1.4328.84
±
1.1029.01
±
0.97ml22.93
±
1.0724.37
±
0.8125.55
±
1.3627.542
±
1.1728.50
±
1.4529.53
±
0.77mm22.75
±
1.0024.30
±
1.2925.75
±
1.7627.553
±
1.2728.28
±
1.0629.48
±
0.92mh22.32
±
0.9623.80
±
1.1925.11
±
1.6827.12
±
1.3628.20
±
1.1529.03
±
1.42pc22.83
±
1.1424.42
±
0.9825.47
±
2.2226.71
±
1.2228.69
±
1.1929.13
±
0.85
备注:表格6~14中,与空白对照组比较,*p<0.05,**p<0.01,***p<0.001;与模型组比较,#p<0.05,##p<0.01,###p<0.001。
100.表7 核桃肽t2对实验动物脏器湿重的影响(,n=10,g)
分组空腹体重肝脏脾脏肾脏心脏肺脏脑nc28.14
±
1.021.27
±
0.120.078
±
0.0100.31
±
0.0290.17
±
0.030.17
±
0.020.45
±
0.02mc28.21
±
1.641.24
±
0.090.078
±
0.0070.30
±
0.0170.19
±
0.030.16
±
0.020.45
±
0.02ml28.70
±
1.621.22
±
0.070.077
±
0.0140.30
±
0.0240.16
±
0.020.16
±
0.020.44
±
0.01mm27.89
±
1.891.20
±
0.110.081
±
0.0140.29
±
0.0250.16
±
0.020.17
±
0.020.45
±
0.02mh28.23
±
.401.22
±
0.130.079
±
0.0090.30
±
0.0340.17
±
0.020.16
±
0.010.46
±
0.02pc28.29
±
1.761.28
±
0.120.082
±
0.0070.31
±
0.0170.16
±
0.030.17
±
0.010.46
±
0.01
表8 核桃肽t2对实验动物脏器系数的影响(,n=10,%)
分组肝脏系数脾脏系数肾脏系数心脏系数肺脏系数脑系数nc4.49
±
0.360.28
±
0.0401.09
±
0.110.62
±
0.100.61
±
0.081.62
±
0.08mc4.42
±
0.440.28
±
0.0291.05
±
0.090.67
±
0.120.58
±
0.081.60
±
0.13ml4.26
±
0.200.27
±
0.0481.04
±
0.090.56
±
0.090.56
±
0.071.53
±
0.09mm4.32
±
0.560.29
±
0.0551.04
±
0.080.58
±
0.070.59
±
0.051.62
±
0.08mh4.33
±
0.510.28
±
0.0331.06
±
0.110.61
±
0.060.58
±
0.061.61
±
0.10pc4.49
±
0.370.29
±
0.0311.11
±
0.090.57
±
0.110.61
±
0.051.63
±
0.12
可见,核桃肽t2各剂量对实验动物体重、脏器系数无明显影响。
101.4、openfield旷场实验旷场实验在一个由压缩木材制成的方形盒子(48 cm
×
48 cm
×
36 cm)中进行。底部被白色网格划分为16个相等的正方形,包括外周区域(12个围绕正方形)和中心区域(4个
中间正方形)。小鼠被放置在中心区域,并自由探索10分钟,通过ccd摄像机进行跟踪,数据由smart 3.0,panlab,西班牙进行分析。每次测试之前,用75%的乙醇擦拭实验装置,以去除气味。以实验动物10min内总运动距离作为自发活动的量度,中心区活动时间和访问中心区次数作为衡量焦虑和探索行为的标准,结果见表9和图5~8。
102.表9核桃肽t2对矿场实验指标的影响(,n=12)
分组访问中心区次数(次)总运动距离(cm)周边时间(s)中心区时间(s)nc27.70
±
6.24##4724.39
±
769.79###512.70
±
37.53##87.3
±
37.53##mc7.10
±
1.10***2468.16
±
393.95***590.16
±
3.07**9.84
±
3.06**ml15.89
±
4.01**##3479.52
±
425.56***##559.72
±
18.26*##40.28
±
18.26##*mm21.60
±
7.38##3976.01
±
632.40###541.01
±
18.02###58.99
±
18.02###mh15.90
±
4.33**##3411.35
±
463.35**##561.17
±
18.37##*38.83
±
18.37##*pc23.00
±
7.42###4250.39
±
889.72##530.3
±
21.15###69.7
±
21.15###
可见,与mc比较,其他各组总运动距离、中心区域访问次数、周边区域活动、中心区域活动时间均有统计学意义(p<0.05或<0.01或p<0.001);与nc比较,除mm、pc组无统计学意义外,各组总运动距离、访问中心区次数、周边区域活动时间、中心区活动时间差异均有统计学意义。可以得出核桃肽t2可有效抵抗实验动物的焦虑程度,并且改善实验动物的探索行为,以中剂量效果最佳。
103.5、nor新物体识别在进行测试前,每天抚摸小鼠,消除陌生感,以免操作时对小鼠产生刺激。训练期间在装置中放入2个相同的物体,物体距离两侧壁10cm,将小鼠背朝物体从距物体等距离处放入装置中,5min内自由探索每个物体。训练结束后1h将两个相同物体中的一个物体替换成一个不同的物体放入装置中,同样将小鼠背朝物体从距物体等距离处放入装置中,记录5min内小鼠对新旧物体的探索的次数、时间和距离,评价检测小鼠的认知情况:若小鼠认知能力差,则在新旧物体的探索无差异;若小鼠认知能力正常,则对新事物的探索较旧事物长。认知指数(recognition index ,ri)计算公式为:ri=新物体/(新物体+旧物体)
×
100 %。结果见表10和图9~12。
104.表10 核桃肽t2对实验动物nor新物体识别指标的影响(,n=12,%)分组ri-次数ri-运动距离ri-时间nc39.50
±
7.05###4.18
±
5.94#9.18
±
5.47#mc17.61
±
5.48***1.10
±
1.080.86
±
0.54*ml33.32
±
9.68##2.37
±
2.164.56
±
2.30##mm36.09
±
11.44##2.13
±
2.655.30
±
1.79###mh31.99
±
9.37#2.27
±
2.484.43
±
2.04##pc40.32
±
17.52#2.81
±
2.687.39
±
1.06###由表10和图9~12可知,与mc比较,实验动物在新事物活动的次数、时间指数ri均有统计学意义(p<0.05或<0.01或p<0.001),运动距离指数ri差异无统计学意义,但是存在运动距离延长的趋势,同时在新事物周围活动的次数、时间相较与模型组均有显著差异,说明核桃肽t2能够提高实验动物的认知能力。
105.6、tmaze迷宫新异臂实验检测小鼠的空间探索能力。在行为学实验室进行检测,实验室内的检
测环境要保持安静,调整光源,避免强光直射。将小鼠提前从动物房带入行为学实验室,以适应实验环境。训练部分使用隔板封闭新异臂(novel arm),将小鼠放入其余2个臂中,并自由活动10min,1h后进行移开挡板,将小鼠由起始臂放入t迷宫中,录像并记录5min内每只小鼠在各个臂中的移动距离和停留时间。数据统计:计算5min内小鼠在新异臂的移动距离占总移动距离的比例r和停留时间。结果见表11和图13~15。
106.表11 核桃肽t2对实验动物tmaze迷宫指标的影响(,n=12)分组停留时间(s)r(%)nc117.71
±
36.54###37.24
±
12.18###mc47.88
±
19.00*15.96
±
6.34***ml89.42
±
18.39##33.88
±
9.67##mm101.64
±
29.02###29.81
±
6.13###mh86.34
±
16.28*##28.78
±
5.43##pc105.60
±
31.14###35.20
±
10.38###可见,与mc组比较,nc组、ml组、mm组、mh组及pc组停留时间及r值差异具有统计学意义(p<0.05或p<0.001),说明各核桃肽t2各剂量有提高实验动物探索的能力,以中剂量效果最佳。
107.7、morris水迷宫实验实验共分成6天进行:(1)第1天为训练试验:实验人员将实验动物背向水面、头面对池壁,轻轻放入水中,动物在每个象限的最长游泳时间设置为120s,四个象限依次进行。动物入水后,视频采集系统启动,若大鼠在最长游泳时间结束前主动找到平台,并且在平台上保持5s后,视频采集系统自动停止。若动物在最长游泳时间结束前未找到平台,将采用人工方式将实验动物引领至平台,持续20s。实验结束,根据实验记录数据,获取各组动物的游泳速度、游泳时间(逃避潜伏期)、游泳轨迹、游泳总距离等参数。(2)第2~5天为定位航行实验,主要反映动物的学习记忆能力。实验过程同第一天。(3)第6天为空间探索实验:主要反映动物对空间位置的记忆、探索能力。实验人员将之前放置的圆形平台撤走,将实验动物依次放入四个象限区域,每个象限的游泳时间调整为90s,每两个象限间隔时间为20s。同样,实验开始后,视频采集系统将自动记录实验动物的游泳轨迹,并计算穿越原平台位置的次数。结果见表12及图16~21。
108.表12 核桃肽t2对实验动物morris水迷宫各指标的影响(,n=12)
定位航行实验中,与nc组比,mc组小鼠的逃避潜伏期和游泳总距离明显延长(p<0.05或p<0.01),90s内穿越平台的次数显著减少(p<0.01);与mc组比较,除ml组第4d逃避潜伏期无统计学意义外,pc组、ml组、mm组和mh组第2~4d逃避潜伏期差异均具有统计学意义(p<0.05或p<0.01或p<0.0001);与mc组比较,pc组、ml组、mm组第4d游泳总距离明显缩短,差异具有统计学意义(p<0.05或p<0.01);空间探索试验中,与mc组比较,mm组、mh组、pc组90s内穿越原平台的次数明显增多,差异具有统计学意义(p<0.0001)。说明核桃肽t2各剂量均有改善学习记忆和空间记忆的功能,结合各个指标得出核桃肽t2中剂量改善记忆力效果最佳。
109.8、大脑组织冰冻切片各组随机选取2只进行灌注后,取大脑于4%甲醛中固定48h,沉糖后行冰冻切片,he
染色并观察海马ca3区域神经元结构改变,见图22。
110.由图22可见,模型组小鼠海马ca3区域的神经元排列疏松,神经元密度和数量减少,细胞层数减少,间隙增大。核桃肽t2各剂量的海马神经元有所改善,损伤减轻,神经元细胞数量增多,排列整齐,间隙减少,以中剂量组改善最佳。各组间神经元细胞未见明显异常。
111.9、生化指标测定实验结束后,摘眼球取血,4℃3000r/min(离心半径为12cm,下同)离心10min后,留取血清备用。取新鲜大脑组织,将组织称重放入装有匀浆介质的匀浆管中,使用高速组织匀浆仪10000-15000r/min研磨制成10%的组织匀浆,4℃3000r/min离心,取上清。参照说明书步骤分别检测血清和大脑组织中sod、mda、ache、gsh-px的含量,结果见表13~14和图23~24。(图23中1表示空白对照组,2表示模型对照组,3表示模型低剂量组,4表示模型中剂量组,5表示模型高剂量组,6表示阳性对照组)表13 核桃肽t2对实验动物血清生化指标的影响(,n=10)分组gsh-px(u/ml)sod(u/ml)ache(u/ml)mda(μmol/ml)nc769.27
±
95.75###107.08
±
21.86##22.14
±
1.50###21.32
±
4.94##mc545.87
±
76.80***82.94
±
12.27**29.74
±
4.54***28.50
±
3.79***ml631.18
±
94.76**#90.51
±
28.0023.68
±
2.54#24.13
±
5.95#mm738.43
±
109.63###103.72
±
14.35#21.37
±
2.64###22.84
±
3.82##mh679.04
±
99.14*##92.42
±
25.1323.03
±
1.40#25.52
±
4.19*pc715.69
±
80.20###104.27
±
11.44#22.36
±
1.17###22.61
±
3.59##由表13与图23可知,与nc组比较,mc组gsh-px、sod显著降低,ache及mda明显升高,差异具有统计学意义(p<0.01或p<0.001);与mc组比较,核桃肽t2各剂量组及pc组的gsh-px明显升高、ache明显降低差异具有统计学意义(p<0.05或p<0.01或p<0.001);与mc组比较,核桃肽t2各剂量组和pc组sod均有升高趋势,其中mm组、pc组差异具有统计学意义(p<0.05);与mc组比较,核桃肽t2各剂量组及pc组mda有降低趋势,其中ml组、mm组、pc组差异具有统计学意义(p<0.05)。
112.表14 核桃肽t2对实验动物脑组织生化指标的影响(,n=10)
分组gsh-px(u/mgpro)sod(u/mgpro)ache(u/mgpro)mda(μmol/mgpro)nc1171.90
±
143.39###113.6
±
9.76##7.12
±
0.53###10.51
±
1.40#mc949.69
±
157.55***100.39
±
14.11*8.58
±
0.44***12.84
±
1.64*ml967.45
±
266.86***107.56
±
15.128.38
±
0.39***12.11
±
2.86mm1087.49
±
81.81*##112.83
±
6.16*#7.73
±
0.51*##10.26
±
2.84##mh937.17
±
279.88***110.74
±
9.51#8.22
±
0.43***11.45
±
1.36pc1086.49
±
117.16###112.10
±
6.62#7.68
±
1.01*##9.83
±
2.03#
由表14和图24可知,与nc组比,mc组各大脑组织指标变化均有统计学意义(p<0.05或<0.01);与mc组比,核桃肽t2各剂量组及pc组gsh-px具有升高趋势,其中mm组、pc组升高具有统计学意义(p<0.01或<0.001);与mc组比,核桃肽t2各剂量组及pc组sod有升高趋势,其中mm组、mh组、pc组升高具有统计学意义(p<0.05);与mc组比,核桃肽t2各剂量组及pc组a-che有降低趋势,其中mm组、pc组降低具有统计学意义(p<0.05或<0.01);与mc组比,核桃肽t2各剂量组及pc组mda有降低趋势,其中mm组、pc组降低具有统计学意义(p<
0.05或<0.01)。
113.综上表明:核桃肽t2各剂量均有效改善实验动物空间记忆力和学习探索能力,以中剂量效果最佳。
114.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
