hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞分化的方法及应用
技术领域
1.本发明属于细胞分化技术领域,尤其涉及一种hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞分化的方法及应用。
背景技术:
2.肝脏是人和动物物质代谢的中心,为动物体内最大的内脏器官,也是唯一具有再生能力的内脏器官,除代谢毒素外,还有生物转化、糖原合成和分解、造血、分泌胆汁和各类生长因子的功能,并对维持体内的碳水化合物、脂肪和蛋白质平衡有着至关重要的作用。
3.在生物学领域,肝脏在受到不同程度的打击、部分切除和化学损伤后呈现出强大再生能力。肝脏再生的过程和机制十分复杂,其中有关于利用肝细胞增殖来促进肝脏再生的机制已经比较熟悉,但在肝祖细胞激活和分化方面的肝再生机制了解尚浅,还需要大量的研究来完善这一机制。
4.wnt信号通路在人体内胚胎发育,细胞增殖、凋亡和维持干细胞特性等方面调节范围十分广泛,对于维护自身代谢平衡有至关重要的作用。wnt信号在肝脏再生过程中持续激活,当剩余的hcs(hepatic cell;肝细胞)增殖被影响后,肝卵圆细胞这一类双能祖细胞被激活后能够弥补hcs增殖的不足,通过自身分化为bcs(biliary cells,胆管细胞)和成熟hcs,促进肝脏的自我更新和修复(nejak-bowen et al 2011)。尽管肝再生研究已有几十年,但肝祖细胞调控肝脏再生的机制尚不清楚。目前关于wnt信号通路调控hpc(hepaticprogenitor cell;肝祖细胞)激活、分化以及肝再生机制知之甚少。
5.此前有实验利用hepa1-6上清液体外培养成纤维细胞,然后再收集成纤维细胞上清配制成条件培养基用来处理胚胎肝干细胞,发现成纤维细胞能够被 hepa1-6上清液激活生成肌成纤维细胞,肌成纤维细胞的上清培养基培养胚胎肝干细胞,发现胚胎肝干细胞能够分化并且表达成熟hcs特异性标志物alb 和ckl8,通过最终肝糖原染色结果可知,肝干细胞在分化后已经具有成熟hcs 的糖原合成功能(谢言.hepa 1-6介导成纤维细胞促进胚胎肝细胞的增殖和分化. 硕士:重庆医科大学图书馆,2014.)。但上述肝细胞增殖分化的方法较为复杂,并不利于推广应用。
6.因此,目前亟待研发一种促进肝细胞分化的方法,分化效果显著且便于操作。
技术实现要素:
7.本发明实施例提供一种hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞分化的方法及应用,旨在解决现有肝细胞分化的细胞模型不足的问题。
8.本发明实施例是这样实现的,一种hepa1-6细胞上清条件培养基促进 wbf344细胞向肝细胞分化的方法,具体包括以下步骤:
9.(1)wb-f344细胞培养:
10.wb-f344细胞系采用双抗培养基,37℃,5%co2培养箱培养,待细胞长满至70%~
90%时,进行传代培养;
11.(2)cmhepa1-6培养基收集:
12.hepa1-6细胞系采用双抗培养基,37℃,5%co2培养箱培养;待细胞长满至70%~90%时,收集hepa1-6细胞上清培养基,将hepa1-6细胞上清培养基与含有20%fbs的高糖dmem基础培养基按照1:2混合,获得培养wbf344 细胞用的cmhepa1-6培养基为hepa1-6细胞上清条件培养基;
13.(3)hepa1-6上清培养基刺激wbf344细胞:
14.wbf344细胞传代培养,采用cmhepa1-6培养基培养5-6天后获得分化成熟肝细胞;
15.(4)对分化培养后获得的分化成熟肝细胞进行检测。
16.步骤(1)中所述的传代培养,具体为:
17.用dmem洗三次后,加入1ml 0.25%胰蛋白酶消化,消化完后吸出液体,加入细胞培养基1:1传代继续培养。
18.步骤(1)中所述的wb-f344细胞培养,还可包括冻存保藏处理,具体步骤如下:
19.wb-f344细胞系用高糖dmem加10%fbs和1%双抗,37℃,5%co2培养箱培养;待细胞长满至70%~90%时,用dmem洗三次后,加入1ml 0.25%胰蛋白酶消化,消化完后吸出液体,加入细胞培养基1:1传代继续培养;若细胞需要冻存即把细胞培养基换成细胞冻存液,将细胞吹匀打散后加入到冻存管中,每管1ml;置于冻存盒中放置-80℃冰箱,16h后转移至液氮罐保存。
20.步骤(1)中的双抗培养基,为双抗青链霉素1ml,fbs(fetal bovine serum,胎牛血清)10ml,高糖dmem基础培养基89ml。
21.所述的细胞冻存液,为fbs 2ml,dmso 1ml,dmem 7ml。
22.步骤(4)中所述分化成熟肝细胞进行检测,包括对成熟肝细胞标志基因的 western blot检测、rt-qpcr检测或糖原染色检测中的至少一种。
23.所述成熟肝细胞标志基因包含cd133基因、afp基因、alb基因、cyp2e1 基因、ck18基因、wnt通路配体基因、wnt通路相关基因中的一种或多种。
24.本发明还保护hepa1-6细胞上清条件培养基在促进wbf344细胞向肝细胞分化中应用。
25.hepa1-6细胞上清条件培养基通过激活wnt通路在促进wbf344细胞向肝细胞分化中应用。
26.本发明的技术方案与现有技术相比,具有以下有益效果:
27.1.本发明的hepa1-6细胞上清条件培养基能促进wbf344向成熟肝细胞的分化。
28.2.本发明利用hepa1-6细胞上清培养基制成条件培养基来培养wbf344细胞,wbf344细胞分化后利用western blot、rt-qpcr与糖原染色检测alb、 ck19、cd133、和cyp2e1及wnt通路相关基因和蛋白的表达;发现hepa1-6 细胞上清培养基能引起wnt通路的激活并促进wbf344细胞向肝细胞分化。
29.3.本发明提供的hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞分化的方法,分化获得肝细胞,成熟肝细胞标志基因表达普遍显著升高, rt-qpcr检测成熟hcs标志基因mrna的水平,发现成熟hcs的标志基因 afp、alb、cyp2e1和ck18 mrna转录水平显著上升;通过pas染色检验可知,cmhepa1-6组细胞相比dmem组紫红色颗粒积累明显,细胞形状为
多角菱形,细胞体积大小和表型与hpc不一致,说明此时的hpc分化后转为已经是具备糖原合成功能的成熟肝细胞。
附图说明
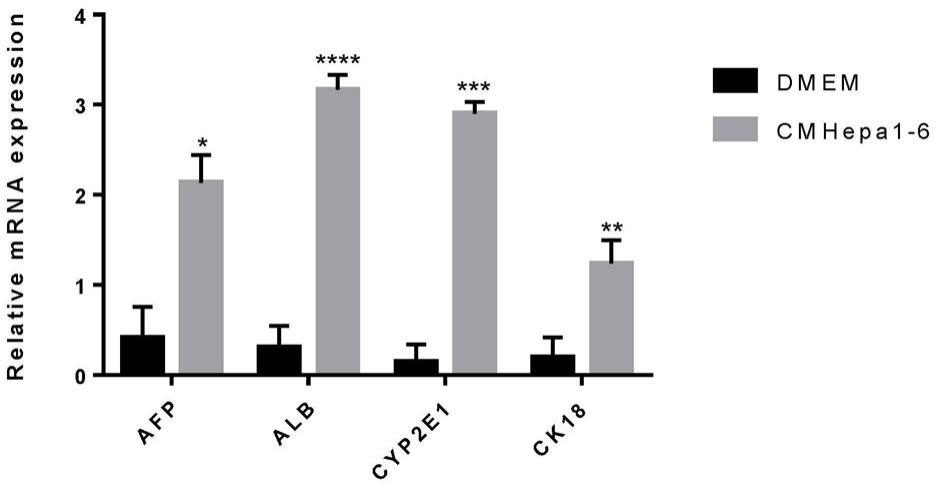
30.图1为实施例1.2中通过rt-qpcr检测成熟hcs标志基因mrna反转录水平结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001);
31.图2为实施例1.2中wb检测cd133和wnt通路相关蛋白表达结果示意图;
32.图3为实施例1.2中通过rt-qpcr检测wnt通路配体mrna反转录水平的结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001);
33.图4为实施例1.2中通过rt-qpcr检测wnt通路相关基因mrna水平的结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001);
34.图5为实施例1.2中通过rt-qpcr检测hpc标志基因mrna反转录水平的结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001);
35.图6为实施例1.2中对cmhepa1-6培养基和dmem培养基分别培养 wbf344细胞进行pas肝糖原染色的结果示意图;
36.图7为实施例1.3中对wb检测wnt信号通路相关基因蛋白表达的结果图;
37.图8为实施例1.3中rt-qpcr检测wnt通路配体mrna反转录水平表达的结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001);
38.图9为实施例1.3中rt-qpcr检测wnt通路相关基因mrna反转录水平表达的结果柱状图(*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001);
39.图10为实施例1.3中wb检测cd133的蛋白表达的结果图;
40.图11为实施例1.3中rt-qpcr方法检测成熟肝细胞标志基因mrna反转录水平表达的结果柱状图;
41.图12为实施例1.3中rt-qpcr检测hpc标志基因mrna反转录水平表达的结果柱状图;
42.图13为实施例1.3中对实验组细胞进行pas肝糖原染色的结果示意图。
具体实施方式
43.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.目前,肝细胞分化的诱导分化配方方法以及肝细胞分化的机理研究还不够完全清晰,为了解决上述技术问题,本发明提出了一种hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞分化的方法。
45.实施例中所用的细胞试验材料为:实验细胞:hepa1-6小鼠肝癌细胞系和 wbf344大鼠肝卵圆细胞系。
46.实施例1
47.1.1本实施例提供了一种hepa1-6细胞上清条件培养基促进wbf344细胞向肝细胞
分化的方法,具体包括以下步骤:
48.(1)wb-f344细胞培养
49.wb-f344细胞系用高糖dmem加10%fbs和1%双抗,37℃,5%co2培养箱培养,待细胞长满至70%~90%时,进行传代培养;
50.(2)cmhepa1-6培养基收集
51.hepa1-6细胞系用高糖dmem加10%fbs和1%双抗,37℃,5%co2培养箱培养;待细胞长满至70%~90%时,收集hepa1-6细胞上清培养基,将 hepa1-6细胞上清培养基与含有20%fbs的高糖dmem基础培养基按照1:2混合,获得培养wbf344细胞用的hepa1-6细胞上清条件培养基(cmhepa1-6培养基);
52.(3)hepa1-6上清培养基刺激wbf344细胞
53.wbf344细胞传代培养后,cmhepa1-6培养基培养6天后获得分化肝细胞;
54.(4)对分化培养后获得的分化肝细胞进行检测。
55.步骤(1)中所述的传代培养,具体为:
56.用dmem洗三次后,加入1ml 0.25%胰蛋白酶消化,消化完后吸出液体,加入细胞培养基1:1传代继续培养。
57.步骤(1)中所述的wb-f344细胞培养,还可包括冻存保藏处理,具体步骤如下:
58.wb-f344细胞系用高糖dmem加10%fbs和1%双抗,37℃,5%co2培养箱培养;待细胞长满至70%~90%时,用dmem洗三次后,加入1ml 0.25%胰蛋白酶消化,消化完后吸出液体,加入细胞培养基1:1传代继续培养;若细胞需要冻存即把细胞培养基换成冻存液,将细胞吹匀打散后加入到冻存管中,每管1ml;置于冻存盒中放置-80℃冰箱,16h后转移至液氮罐保存。
59.上述培养过程所用的细胞培养用试剂以培养液成分如下:
60.细胞培养基:双抗青链霉素1ml,fbs 10ml,高糖dmem基础培养基 89ml。
61.细胞冻存液:fbs 2ml,dmso 1ml,dmem 7ml。
62.dmem培养液:含有20%fbs的高糖dmem培养基。
63.cmhepa1-6培养液:hepa1-6细胞上清培养基收集后,与两倍的dmem且含20%fbs的培养基混合,形成培养wbf344cell用的条件培养基。
64.cmhepa1-6+fh535培养液:hepa1-6cell上清培养基收集后,与两倍的 dmem且含20%fbs的培养基混合,加入fh535形成培养wbf344cell用的条件培养基,fh535浓度为30μm/l。
65.5%bsa溶液:称取bsa 2g加入到dmem中,定容至100ml,37℃水浴溶解直到澄清;过滤,4℃保存。
66.500μmol pa+5%bsa溶液:称取0.064g pa,溶于1ml乙醇,37℃水浴溶解,直至澄清,配制成pa母液;取100μl pa母液加到50ml bsa溶液里面,37℃水浴溶解,直至澄清;过滤,4℃保存。
67.1.2实施例1的对照组试验设置具体如下:
68.上述步骤(3)中,wbf344细胞传代后培养,将孔板中的wbf344细胞分成两组,第一组用dmem培养液培养(dmem组),作为对照组;第二组用cmhepa1-6培养基培养(cmhepa1-6组),作为实验组,培养6天后收样做后续检测验证实验。
69.实验结果为:
70.为了探究hpc被激活后的分化与wnt之间的联系,本发明利用hepa1-6 细胞的条件培养基为cmhepa1-6培养基,培养wbf344细胞促进分化,dmem 培养基培养wbf344细胞做对照;rt-qpcr检测成熟肝细胞标志基因mrna 的水平,发现成熟肝细胞的标志基因afp、alb、cyp2e1和ck18 mrna转录水平显著上升(如图1所示)。证实hepa1-6细胞上清条件培养基促进wbf344 细胞向肝细胞分化。
71.利用western blot实验检测hpc标志蛋白cd133和wnt通路相关蛋白的蛋白表达(如图2所示),结果显示,hpc标志蛋白cd133表达上调,wnt 通路核基因β-catenin表达上调,wnt通路抑制因子gsk3β蛋白表达下调。
72.如图3-5所示,利用rt-qpcr检测,发现lgr5 mrna表达显著增加, cd133上升不显著,wnt通路关键因子β-catenin和靶基因axin2显著上调, wnt通路配体wnt3a、wnt4、wnt5a和wnt9b mrna表达显著上调,还发现肝细胞标志基因ck19 mrna转录水平下降。
73.如图6所示,通过pas糖原染色,发现糖原的积累在分化后明显增加。
74.综上结果表明,用cmhepa1-6培养基诱导wbf344细胞分化为成熟肝细胞,在分化过程中增加了wnt信号通路相关基因表达,激活了wnt信号通路。
75.1.3实施例1的wnt通路的抑制试验,验证wbf344细胞的分化对wnt 通路的依赖程度
76.上述1.2的实验证明了在wbf344 hpc分化的过程中,存在wnt通路的激活,为了进一步验证wnt通路对hpc分化的作用,将wbf344中的wnt 信号抑制,再观察分化情况。fh535可以通过阻止β-catenin/tcf的转录,能有效抑制β-catenin和ppar家族基因的合成,通常被看作wnt/β-catenin通路抑制剂使用。选用30μm/l的fh535浓度处理wbf344细胞2天,再用条件培养基诱导wbf344细胞分化,检测在wnt通路抑制后对hpc的影响。
77.wnt通路的抑制试验设置如下:
78.wbf344细胞传代后传6孔板培养,将孔板中的wbf344细胞分成三组;三组细胞先用细胞培养基培养直至细胞长到80%左右,吸出培养基,第一组用 dmem培养基培养(dmem组);第二组用cmhepa1-6培养基培养(cmhepa1-6 组);第三组用cmhepa1-6+fh535培养基培养(cmhepa1-6+fh535组)。孔板培养48h后给细胞换液继续培养,第一组用dmem培养基培养;第二组和第三组用cmhepa1-6培养基培养;培养3天后收样,做后续检测验证实验。
79.为了探讨wnt信号的激活是否对hpc的分化是必须的,待wbf344细胞 80%左右时加入抑制剂与分化培养基共培养,2天后换分化培养基继续培养, 3d后收样进行后续实验。
80.结果如图7所示,wnt通路关键调节因子β-catenin在不加抑制剂的培养基中蛋白表达上调,加了抑制剂后蛋白表达下调;抑制因子gsk3β在不加抑制剂的分化培养基中蛋白明显下调,加了抑制剂后蛋白表达上调;ser9位点磷酸化gsk3β在加了抑制剂的分化培养基中表达后明显上调;wnt通路靶基因 cyclind1在有和没有抑制剂的分化培养基中培养无差别,相较于dmem组,有和没有抑制剂的分化培养基中培养的wbf344细胞中cyclind1蛋白都降低。
81.如图8和图9所示,利用rt-qpcr方法检测wnt通路配体和相关蛋白的 mrna水平表达,加了抑制剂后发现除了wnt4以外,wnt3a、wnt5a、 wnt9b和wnt2mrna反转录水平都有显著降低,cyclind1、β-catenin、pcna 和axin2在加了抑制剂后mrna反转录水平显著降低。
82.以上结果表明wbf344细胞中wnt通路在分化培养基中培养后保持活跃,但是加了抑制剂fh535后,wnt通路活性降低,表明fh535能降低hpc分化时wnt的信号。但与dmem组相比,抑制剂fh535并不能完全抑制分化中的wnt通路信号,这可能是因为wbf344分化过程中只抑制前2天,在后期的分化培养基培养下wnt通路重新被激活。
83.上述用fh535抑制wnt通路信号后,wbf344细胞的分化能力明显下降, wnt信号通路配体和关键因子活力减弱。为了研究wnt信号对于hpc的分化的重要性,通过western blot实验检测hpc标志基因cd133在分化过程中的表达,发现未加抑制剂的分化培养基中cd133蛋白明显上调,加了抑制剂后 cd133蛋白显著降低(如图10所示);利用rt-qpcr检测成熟hcs标志基因 afp、alb、cyp2e1 mrna反转录水平,发现在加了抑制剂的分化培养基中 mrna反转录水平全部显著降低(如图11所示);利用rt-qpcr检测hpc 标志基因(sox9、cd133、epcam和lgr5)和bcs标志基因ck19的mrna 反转录水平,发现在抑制剂的分化培养基中,wbf344细胞中hpc标志基因和 bcs标志基因mrna水平显著降低(如图12所示);肝糖原pas染色结果可知在fh535抑制wbf344细胞中的wnt信号2天后,紫红色颗粒明显减少,糖原合成能力减弱(如图13所示)。
84.以上结果表明在fh535抑制wnt信号2天后对后续wbf344细胞的分化有延迟的影响,说明wnt信号的活跃是对hpc分化必不可少的。
85.本发明实施例利用hepa1-6细胞的上清培养基制成条件培养基,也就是 cmhepa1-6培养基,用来培养wbf344细胞,发现成熟肝细胞的标志基因afp、 alb、cyp2e1和ck18 mrna转录水平显著上升,这个结果表明分化后的肝细胞具有成熟肝细胞的标志基因特性,为了确定wbf344细胞在分化后是否具有成熟肝细胞的糖原合成功能,通过pas染色检验可知,cmhepa1-6组细胞相比dmem组紫红色颗粒积累明显,细胞形状为多角菱形,细胞体积大小和表型与hpc不一致,说明此时的hpc分化后转为已经是具备糖原合成功能的成熟hcs或中间hcs,如图1和图6所示。在hpc这一分化过程中hpc和 wnt信号通路也十分活跃,有意思的是发现cyclind1蛋白表达下降,这可能是在分化过程中通过降低cyclind1蛋白表达来抑制细胞增殖能力,同时lgr5 mrna反转录水平明显增加和ck19 mrna反转录水平明显降低,如图2-图5 所示。ck19作为bcs(biliary cells,胆管细胞)标志基因,它的反转录水平下降可以说明hpc wbf344在条件培养基中并没有分化为bcs,这可能是wnt 信号通路作用,促进了hpc向hcs(hepatic cell;肝细胞)分化,而不是向 bcs(biliary cells,胆管细胞)分化。
86.本实施例中利用fh535来抑制wnt通路信号,探究其对hpc分化的影响,考虑fh535长期使用会严重影响细胞增殖和正常功能,引起细胞大量凋亡,我们在wbf344分化前2天加入wnt通路抑制剂fh535,后3天正常分化培养基培养。通过图7-图9可知,fh535虽然只抑制2天,也影响了后续的hpc 分化能力,相较cmhepa1-6组,cmhepa1-6+fh535组wnt通路配体和β-catenin表达都显著下降。但结合dmem组观察实验结果来看,相比dmem 组,cmhepa1-6+fh535组wnt通路核因子β-catenin蛋白表达与cyclind1相反,有上升的趋势,如图7。这可能是在去除抑制剂后,wbf344在cmhepa1-6 培养基中wnt/β-catenin信号的重新激活。
87.为了验证上述猜想,实施例中利用wb、rt-qpcr和肝糖原pas染色方法来检测fh535对hpc分化的影响。如图10和图12,cmhepa1-6+fh535组 cd133蛋白表达下调明显,hpc标志基因cd133、sox9、epcam和lgr5 以及bcs标志基因ck19 mrna反转录水平明显降低,这说明了fh535抑制了 hpc的激活,wnt信号通路对于hpc的激活至关重要。实施例检测hcs标志基
因afp、alb和cyp2e1 mrna反转录水平明显降低,如图11。通过糖原 pas染色我们可知在加了抑制剂后降低了hpc的分化能力,cmhepa1-6组 wbf344细胞形态呈尖角菱形,和三角形类似,细胞较大,cmhepa1-6+fh535 组wbf344细胞形态多为椭圆形,细胞较小。这表明wnt通路的抑制不仅降低了hpc的活性,而且阻碍了hpc的分化,也提示我们hpc激活可能是hpc 向hcs分化的关键,而wnt/β-catenin信号激活是hpc激活的必须条件。
88.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
