一种通用的嵌合抗原受体调节t细胞制备方法及应用
技术领域
1.本发明涉及嵌合抗原受体调节t细胞技术领域,具体为一种通用的嵌合抗原受体调节t细胞制备方法及应用。
背景技术:
2.目前已有的获得批准临床应该的car-t细胞治疗均选用自体cd3+t细胞在体外进得基因改造后回输的方法;此种方法有以下两点缺陷:
3.1、通常进行car-t细胞治疗的病人均为癌症晚期且化疗后无效或者复发的病人,此类病人在大量的化疗药物治疗后,其自身的cd3+t细胞大多数会有数量少,并且功能受到药物的影响;
4.2、因此用病人自身的cd3+t细胞进行基因改造会影响car-t细胞的抗肿瘤效应,这也是为什么经car-t细胞治疗的病人仍然有大约50%的复发率;cd3+t细胞会产生大量的细胞因子,在杀伤肿瘤细胞的同时也会引起机体细胞因子释放综合症(crs),据研究统计,在b细胞非霍奇金淋巴瘤的cd3+car-t临床实验中,42-93%的病人在接受cd3+car-t细胞治疗后发生了不同程度的crs,发生3级以上crs的病人占2-22%。然而,一但crs发生就会引起病人脏器发生不可逆的损伤,严重时可导致死亡。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种通用的嵌合抗原受体调节t细胞制备方法及应用,解决了上述背景技术中提出的问题。
6.为实现以上目的,本发明通过以下技术方案予以实现:一种通用的嵌合抗原受体调节t细胞制备方法及应用,包括以下步骤:
7.s1、cd4+调节性t细胞的分离;
8.s2、制备慢病毒:使用293t细胞包装由慢病毒构建的car表达系统;
9.s3、转染cd4+调节性t细胞合成car-treg。
10.可选的,所述步骤s1、cd4+调节性t细胞的分离中,具体包括以下步骤:
11.s101、选取健康人员使用梯度离心法从外周血或脐带血分离出单个核细胞;
12.s102、使用磁珠法用阴性筛选法将cd4+的t细胞分离出来,再用阳性筛选法将cd4+cd25+的调节性t细胞分离出来。
13.可选的,所述步骤s2、制备慢病毒中,具体包括以下步骤:
14.s201、用商用化的转染试剂将慢病毒包装系统的dna按比例进行混合后,一同加入预培养的293t细胞;
15.s202、48小时后收集细胞上清,此上清中富含携带car基因慢病毒。
16.可选的,所述步骤s3、转染cd4+调节性t细胞合成car-treg中,具体包括以下步骤:
17.s301、用包被有cd3或cd28抗体的磁珠在含有1000单位/毫升的培养液中,对cd4+调节性t细胞进行体外激活;
18.s302、72小时后将制备好的慢病毒与体外激活的cd4+调节性t细胞共培养;
19.s303、48小时后该cd4+调节性t细胞就稳定的表达car。
20.一种通用的嵌合抗原受体调节t细胞应用于干细胞移植技术或肿瘤治疗。
21.本发明提供了一种通用的嵌合抗原受体调节t细胞制备方法及应用,具备以下有益效果:本发明利用cd4+的调节性t细胞代替cd3+t细胞进行基因重组,使调节性t细胞表达嵌合抗原受体生成嵌合抗原受体调节性t细胞从而且具备识别并杀伤肿瘤细胞的目的。
22.1、该通用的嵌合抗原受体调节t细胞制备方法及应用中,调节性t细胞是同胸腺分化而来的t细胞的亚群,占外周血cd4+t细胞的5-10%,这群细胞具有天然免疫调节作用,其主要功能可以抑制炎症反应,维持器官和组织内环境稳定;调节性t细胞发挥免疫抑制功能的途径主要有:分泌抑制性细胞因子il-10,il-35和tfg-beta,发挥直接的抑制作用;分泌穿孔素和颗粒酶,发挥其介导的细胞毒性作用;通过高表达cd25竞争并消耗t细胞活化因子il-2;通过竞争性结合抗原递呈细胞表面的cd80/cd86和主要组织相容性复合体,从而抑制抗原单递呈细胞的功能,因此调节性t细胞在临床上被用于治疗靠血干细胞移植或移植物抗宿主病,自身免疫性疾病以及炎症相关的疾病。
23.2、该通用的嵌合抗原受体调节t细胞制备方法及应用中,调节性t细胞分泌的穿孔素和颗粒酶可以对肿瘤细胞产生细胞毒效应,因此本发明用调节性t细胞作为细胞治疗的产品,将其进行基因重组合成car-treg,其细胞外的car可以与靶细胞的特异性抗原结合生成免疫突触,然后通过细胞内的信号域将调节性t细胞激活,刺激其分泌穿孔素和颗粒酶,穿孔素可以在肿瘤细胞表面打洞,随后颗粒酶被被输送到肿瘤细胞内部,直接通过物理作用对肿瘤细胞进行杀伤或者诱导肿瘤细胞发生调亡。
24.3、该通用的嵌合抗原受体调节t细胞制备方法及应用中的cd4+调节性t细胞的细胞功能是免疫调节,简单来说是抑制免疫激活,因此许多临床实验已经证明cd4+调节性t细胞并不会引起移植物抗宿反应(gvhd),不仅如此,用体外扩增的cd4+调节性t细胞对干细胞移植,器官移植所造成的gvhd进行治疗也取得显著的效果。
25.4、该通用的嵌合抗原受体调节t细胞制备方法及应用中,使用cd4+调节性t细胞对受者是安全无害的,其次可以进行异体细胞治疗及用健康人的cd4+调节性t细胞在不进行人类白细胞抗原匹配的情况下对病人进行细胞治疗。可以保证产品质量的稳定性;由于cd4+调节性t细胞经激活后分沁穿孔素和颗粒酶,因此对cd4+调节性t细胞进行car的基因重组,相当于给cd4+调节性t细胞一个特定的靶目标,使cd4+调节性t细胞对目标进行特异性的攻击,起到杀伤肿瘤的功效。
附图说明
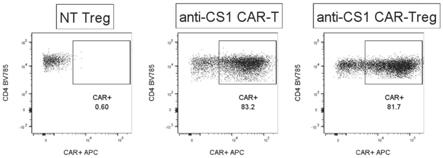
26.图1为本发明检测car的转染效率示意图;
27.图2为本发明car-treg细胞颗粒酶和穿孔素的检测示意图;
28.图3为本发明小鼠体内荧光成像的示意图;
29.图4为本发明小鼠生存曲线示意图。
具体实施方式
30.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
31.实施案例一
32.请参阅图1至图4,本发明提供一种技术方案:一种通用的嵌合抗原受体调节t细胞制备方法及应用,包括以下步骤:
33.s1、cd4+调节性t细胞的分离:
34.s101、选取健康人员使用梯度离心法从外周血或脐带血分离出单个核细胞;
35.s102、使用磁珠法用阴性筛选法将cd4+的t细胞分离出来,再用阳性筛选法将cd4+cd25+的调节性t细胞分离出来;
36.s2、制备慢病毒:使用293t细胞包装由慢病毒构建的car表达系统,即为:
37.s201、用商用化的转染试剂将慢病毒包装系统的dna按比例进行混合后,一同加入预培养的293t细胞;
38.s202、48小时后收集细胞上清,此上清中富含携带car基因慢病毒。
39.s3、转染cd4+调节性t细胞合成car-treg:
40.s301、用包被有cd3或cd28抗体的磁珠在含有1000单位/毫升的培养液中,对cd4+调节性t细胞进行体外激活;
41.s302、72小时后将制备好的慢病毒与体外激活的cd4+调节性t细胞共培养;
42.s303、48小时后该cd4+调节性t细胞就稳定的表达car。
43.实施案例二
44.如附图1-3所示,一种通用的嵌合抗原受体调节t细胞应用于干细胞移植技术或肿瘤治疗。
45.选用cs1为例,使用携带有抗cs1的嵌合抗原受体基因的逆转录病毒对外周血cd4+调节性t细胞进行转染,使cd4+调节性t细胞表达anti-cs1-car,生成anti-cs1-cartreg,转导率大于90%(见图1);后将anti-cs1-cartreg与多发性骨髓瘤细胞(mm1s)共培养,6小时后用流式细胞术的方法对anti-cs1-cartreg进行穿孔素和颗粒酶的检测,以及结合附图1所示,将anti-cs1-cartreg与多发性骨髓瘤共培养后,表达有car的cd4+treg大量分泌穿孔素和颗粒酶,而野生型的cd4+treg(没有表达car的cd4+treg)没有分泌穿孔素和颗粒酶;此结果表明anti-cs1-cartreg表面的抗cs1嵌合抗原受体成功识别多发性骨髓瘤细胞表面的cs1抗原并触发car的胞内激活信号,引起cd4+treg的免疫原性,促使其分泌穿孔素和颗粒酶。
46.进一步的,验证anti-cs1-cartreg是否具有对多发性骨髓瘤细胞的清除功能,选择进行体外细胞毒性实验,即将anti-cs1-cartreg与多发性骨髓瘤细胞共培养12小时后,检测多发性骨髓瘤细胞的存活率;经检测,在car-treg和mm1s的共培养比例中2:1,1:1和1:2的条件下,12小时后99%的mm1s细胞都发生了凋亡,1:4的比例条件下也有80%的mm1s细胞发生了凋亡;实验结果表明car-treg确实可以诱发肿瘤细胞的凋亡,结合前面提到的实验结果,此凋亡极有可能是由car-treg分泌的穿孔素和颗粒酶引起。
47.进一步证实car-treg在体内仍然可以发挥肿瘤的清除功能,选择进行了小鼠实验,用nsg基因敲出小鼠构建出多发性骨髓瘤的小鼠模型,后对小鼠进行分组治疗;为了比较car-treg与car-t细胞的治疗效果,预先设置car-t细胞治疗组做为对照;
48.在对小鼠的治疗过程中,使用体内生物成像(bli)技术对小鼠体内的肿瘤细胞进
行监测,色块显示肿瘤细胞的浓度和分布范围,首先发现anti-cs1-cartreg具有和anti-cs1-cart细胞一样的肿瘤细胞的抑制功能;不仅如此,在治疗后期,car-t细胞治疗组的小鼠发生了gvhd,即恶性炎症反应,并导致了小鼠的死亡,然而car-treg细胞治疗组的小鼠不但抑制了肿瘤的生长而且没有并发任何副作用,更重要的是所以该组的小鼠均存活大于55天,显著长于肿瘤组(图3)。
49.具体实施案例一
50.步骤一、购置实验材料:
51.主要仪器:生物安全柜(海尔,hr40-iia2),co2培养箱(thermo,3111),流式细胞仪(bd,fortesax20),细胞计数仪(nexcelom,cellometerauto2000)
52.试剂:fbs(lonsera、s711-001s),x-vivo15(lonza、04-418q),dynabeadscd3/cd28(lifetechnology、40203d),ficoll(达优、dkw-lsh-0250),luciferase检测(promega、e6120),抗人cd3(fitc,biolegen,300306),抗人cd4(bv785,bd、740962),car特异性单抗(自标),抗人granzymeb(pe/dazzle594,biolegend,372216),抗人perforin(bv421,biolegend,308122).
53.步骤二、实验方法,分为以下五个步骤:
54.第一步、载体构建
55.ncbi网站数据库搜索到人igg1铰链区,人cd28跨膜区,cd3z胞内区和抗cs-1单链抗体的基因序列信息;
56.受用重叠pcr将上述序列依次按抗cs-1-scfv基因,人igg1铰链区基因,人cd28跨膜区基因,cd3z胞内区基因进行连接,形成完整的抗cs-1-car基因序列(如图1所示);
57.该car分子的核苷酸序列经无缝克隆到逆转录病毒质粒sfg,经测序正确后,使用质粒纯化试剂盒提取并纯化质粒,后用热激法将纯化的质粒转染293t细胞(细胞转染试剂lipofectamine3000),进行病毒包装,后收集携带有car基因的病毒上清液。
58.第二步、cd4+调节性t细胞的分离活化与逆转录病毒转导
59.收集健康供者静脉血100ml,用ficol密度梯度离心法分离pbmc,后用人cd4+t细胞分选磁珠(miltenyi)将cd4+t细胞分离出来,之后用cd25+磁珠(miltenyi)对cd4+的t细胞进行cd25+的t细胞进行再一次分选,随即得到cd4+cd25+的t细胞,此为cd4+调节性t细胞;计算cd4+调节性t细胞数,按dynabeads与细胞比例3:1的比例在含有10%小牛血清(fbs)的xvivo15培养液中进行共培养;48小时后,对活化后的cd4+调节性t细胞进行逆转录病毒转导,即将细胞悬液与病毒上清液混合后置于包被有retronectin的24孔板中在37度co2的培养箱中静置48小时,之后即获得car-treg细胞。
60.第三步、流式检测car的阳性率
61.收集1x10^6未转导treg(nttreg)和anti-cs-1-cartreg细胞进行抗体染色,向样本管中加入抗人cd3,抗人cd4以及car特异性抗体。混匀后4度孵育30分钟,洗涤细胞后进行上机检测。
62.第四步、car-treg细胞颗粒酶和穿孔素的检测
63.将car-treg与多发性骨髓瘤细胞(mm1s)按1:1的比例进行共培养6小时,之后用流式技术检测treg细胞的颗粒酶(granzymeb)和穿孔素(perforin)
64.第五步、细胞杀伤功能检测
65.用标记有luciferase的多发性骨髓瘤细胞系(mm1s)与各组细胞分别按不同的效靶比在96孔板中进行混合(4:1,2:1,1:1,1:2,1:4),孵育24小时后在细胞悬液中加入luciferaseassaysubstrate,室温避光孵育10分钟后,在luminometer仪器上检测荧光强度,根本荧光强度判断肿瘤细胞的杀伤效率。
66.第六步、动物体内实验
67.用nsg小鼠构建多发性骨髓瘤的小鼠模型,从尾静脉给小鼠注射1x10^6肿瘤细胞mm1s,7天后对小鼠进行随机分组,对不同组小鼠分别进行不同的治疗,即anti-cs1-car-t细胞和anti-cs1-car-treg细胞。用常规cd3+的car-t细胞做为对照组用以验证cd4+调节性t细胞car-treg的治疗效果。t细胞注射后,用活体荧光成像技术对小鼠体内的肿瘤生长情况进行追踪检测以评估治疗效果,同时观测小鼠的生存时间,计算各组之间的生存率。
68.实验结果
69.(1)检测car的转染效率
70.如附图1所示,分别对通过逆转录病毒转染的cd3+t细胞和cd4+调节性t细胞进行转染效率的检测,转染效率均大于80%。
71.(2)car-treg细胞颗粒酶和穿孔素的检测
72.将传统的cd3+car-t细胞,treg-wt和car-treg细胞分别与mm1s细胞共培养后,流式细胞仪检测颗粒酶(granzymeb)和穿孔素(perforin).结果显示未经转染的treg细胞未显示颗粒酶和穿孔素的释放,而car-t和car-treg均显示出颗粒酶和穿孔素的高表达(图2a),对3个不同供者来源的t细胞进行颗粒酶和穿孔素的平均荧光强度(mfi)的统计计算,car-t和car-treg细胞均显示具有统计学意义的高表达(图2b)。
73.(3)见下表1,car-treg细胞体外杀伤效率
74.表1、各组car-treg体外杀伤效率
[0075][0076]
(4)如附图3所示,小鼠体内荧光成像
[0077]
(5)如附图4所示,小鼠生存曲线
[0078]
以上,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内,如更换car的靶目标(抗cd19,抗cd30,抗cd5,抗bcma等)。
