1.本发明涉及芯片技术领域,特别是氨基修饰的芯片及其制备方法和应用。
背景技术:
2.随着人类基因组(测序)计划(human genome project)逐步实施以及分子生物学相关学科的迅猛发展,越来越多的动植物、微生物基因组序列得以测定,基因序列数据正在以前所未有的速度迅速增长。基因芯片(又称dna芯片、生物芯片)技术就是顺应这一科学发展要求的产物,可用于制备和/或分析生物分子,具体是指将探针分子(不局限于核酸序列)固定于支持物上后与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度进而获取样品分子的数量和序列信息。
3.芯片通常由聚合物包被基底制成,分子分析和/或制备,如某些核酸测序方法,依赖于核酸链与芯片基底表面的结合,然后通过本领域公知的许多不同的方法来确定所结合的核酸链的序列。现有的基底通常为流动池,当前的用于包覆流动池的程序包括,将聚合性混合物转移至流动池上的通道中,并孵育固定的时间。该程序简单,并且产生始终能够支持包括桥式扩增和测序在内的所有下游化学处理步骤的可靠包被。
4.然而,目前已有的芯片仍存在诸多缺陷或限制,限制了其应用,有待进一步改进。
技术实现要素:
5.基于此,有必要提供一种氨基修饰的芯片。该氨基修饰的芯片能够更高密度地负载探针,满足不断发展的生物分子制备和/或分析需求,且稳定性好。
6.本发明的实施例提供一种氨基修饰的芯片,包括:
7.基底,所述基底修饰有环氧基;
8.经所述环氧基接枝于所述基底之上的高聚物,所述高聚物的至少一个结构单元包含氨基,所述氨基为伯氨基或/和仲氨基。
9.在某些实施方式中,所述高聚物中平均每个所述结构单元包含0.05~10个相同或不同的氨基。
10.在某些实施方式中,所述高聚物中平均每个所述结构单元包含1~5个相同或不同的氨基。
11.在某些实施方式中,所述高聚物的聚合度范围为10~5000。
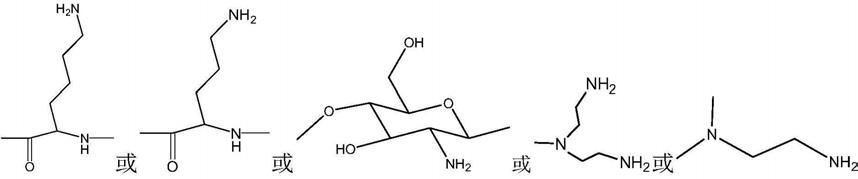
12.在某些实施方式中,所述高聚物中结构单元包括
中的至少一种。
13.在某些实施方式中,所述高聚物选自聚赖氨酸、聚鸟氨酸、壳聚糖、聚酰胺-胺树枝状大分子和聚乙烯亚胺中的至少一种。
14.在某些实施方式中,所述芯片还包括接枝于所述高聚物的探针。
15.在某些实施方式中,所述探针通过连接基团与所述高聚物键合,所述连接基团的分子结构中包含第一连接基团和第二连接基团;所述第一连接基团与所述探针键合,所述第二连接基团经所述氨基接枝于所述高聚物。
16.在某些实施方式中,所述第二连接基团选自-nhs基团、环氧基团和异氰酸酯基团中的至少一种。
17.在某些实施方式中,所述连接基团由nhs-peg
n-dbco或nhs-peg
n-n3制成,其中,n=3~2000;所述nhs-pegn-dbco或nhs-pegn-n3中的基团-nhs与所述氨基进行反应接枝。
18.在某些实施方式中,所述探针修饰有基团-dbco或基团-n3;所述键合的方式为基团-dbco与基团-n3间的共价键合。
19.本发明的实施例还提供一种芯片的制备方法,包括如下步骤:
20.(1)获取基底,所述基底修饰有环氧基;
21.(2)将高聚物反应接枝至所述基底,所述高聚物的至少一个结构单元包含氨基,所述氨基为伯氨基或仲氨基。
22.在某些实施方式中,所述高聚物中平均每个所述结构单元包含0.05~10个相同或不同的氨基。
23.在某些实施方式中,所述高聚物中平均每个所述结构单元包含1~5个相同或不同的氨基。
24.在某些实施方式中,所述高聚物的聚合度范围为10~5000。
25.在某些实施方式中,所述高聚物中结构单元包括在某些实施方式中,所述高聚物中结构单元包括中的至少一种。
26.在某些实施方式中,所述高聚物选自聚赖氨酸、聚鸟氨酸、壳聚糖、聚酰胺-胺树枝状大分子和聚乙烯亚胺中的至少一种。
27.在某些实施方式中,步骤(2)中,所述反应接枝是通过使所述高聚物与所述基底在
碱性溶液中接触进行的,所述碱性溶液的ph值为8.5~10。
28.在某些实施方式中,步骤(2)中,所述反应接枝是在反应温度为37~55℃的条件下反应3~24h。
29.在某些实施方式中,所述的制备方法还包括步骤(3):将探针接枝至所述高聚物。
30.在某些实施方式中,所述探针通过连接基团与所述高聚物接枝,所述连接基团的分子结构中包含第一连接基团和第二连接基团;所述第一连接基团与所述探针键合,所述第二连接基团经所述氨基接枝于所述高聚物。
31.在某些实施方式中,所述第二连接基团选自-nhs基团、环氧基团和异氰酸酯基团中的至少一种。
32.在某些实施方式中,所述连接基团由nhs-peg
n-dbco或nhs-peg
n-n3制成,其中,n=3~2000;所述nhs-pegn-dbco或nhs-pegn-n3中的基团-nhs与所述氨基进行反应接枝。
33.在某些实施方式中,所述探针修饰有基团-dbco或基团-n3;所述键合的方式为基团-dbco与基团-n3间的共价键合。
34.在某些实施方式中,所述反应接枝是通过使所述连接基团与所述高聚物在碱性溶液中接触进行的,所述碱性溶液的ph值为7~9。
35.在某些实施方式中,所述反应接枝是在反应温度为室温的条件下反应30~90min。
36.在某些实施方式中,所述共价键合是通过使所述探针与连接基团在碱性溶液中接触下进行的,所述碱性溶液的ph值为7~8。
37.在某些实施方式中,进行所述共价键合的所述碱性溶液中含有表面活性剂,所述表面活性剂选自十四烷基三甲基溴化铵、十六烷基三甲基溴化铵和十二烷基三甲基溴化铵中的至少一种。
38.本发明的实施的方式还提供如上所述的芯片、或如上所述的制备方法制备得到的芯片在生物分子制备或生物分子分析中的应用。
39.本发明一实施方式公开的氨基修饰的芯片,其基底修饰有特定活性基团的基底反应接枝包含伯氨基和/或仲氨基的高聚物,该高聚物可以形成密度较高,且反应活性高的修饰表面,用于接枝探针,能够更高密度地负载探针,满足不断发展的生物分子制备和/或分析需求,且稳定性好。本发明另一实施方式公开的制备芯片的方法,无需严格的反应条件控制,即可实现探针的接枝,使芯片的制作工艺简单易控,利于芯片的推广应用。
附图说明
40.图1为实施例中芯片的制备过程的示意图,x表示高聚物,primer表示引物/探针;
41.图2为实施例1-5制备的芯片的探针密度检测结果图;
42.图3为实施例1制备的芯片生成的dna簇检测结果图;
43.图4为实施例2制备的芯片生成的dna簇检测结果图;
44.图5为实施例3制备的芯片生成的dna簇检测结果图;
45.图6为实施例4制备的芯片生成的dna簇检测结果图;
46.图7为实施例5制备的芯片生成的dna簇检测结果图;
47.图8为实施例7中采用的dna文库的结构示意图。
具体实施方式
48.以下结合具体实施例对本发明的氨基修饰的芯片及其制备方法和应用作进一步详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
49.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
50.本文所述芯片,可以为接枝有所述高聚物的基底,也可以为在所述高聚物上进一步接枝探针的基底。基底材料并不受特别限制,基底由玻璃、硅片、塑料、凝胶和尼龙膜中的至少之一形成。
51.本文所述的“经
……
接枝于”、“修饰有
……”
可以表示直接接枝、修饰于对象之上,也可以表示进一步经过其他的过渡基团接枝、修饰于对象之上。
52.本文所述的氨基是指,具有式-n(x)2的结构特征,其中每个“x”独立地是h、取代的或未被取代的烷基、取代的或未被取代的环烷基、取代的或未被取代的杂环基等,可以理解地,在本发明的技术方案中,至少一个x为h。氨基的非限制性类型包括-nh2、-nh(烷基)、-nh(环烷基)、-nh(杂环基)、-nh(芳基)。
53.术语“烷基”是指包含伯(正)碳原子、或仲碳原子、或叔碳原子、或季碳原子、或其组合的饱和烃。合适的实例包括但不限于:甲基(me、-ch3)、乙基(et、-ch2ch3)、1-丙基(n-pr、n-丙基、-ch2ch2ch3)、2-丙基(i-pr、i-丙基、-ch(ch3)2)、1-丁基(n-bu、n-丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、i-丁基、-ch2ch(ch3)2)、2-丁基(s-bu、s-丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、t-丁基、-c(ch3)3)、1-戊基(n-戊基、-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3和辛基(-(ch2)7ch3)。
54.术语“环烷基”是指包含环碳原子的非芳香族烃,可以为单环烷基、或螺环烷基、或桥环烷基。合适的实例包括但不限于:环丙基、环丁基、环戊基、环己基和环庚基。另外,“环烷基”还可含有一个或多个双键,含有双键的环烷基的代表性实例包括环戊烯基、环己烯基、环己二烯基和环丁二烯基。
[0055]“芳基”是指在芳香环化合物的基础上除去一个氢原子衍生的芳族烃基,可以为单环芳基、或稠环芳基、或多环芳基,对于多环的环种,至少一个是芳族环系。合适的实例包括但不限于:苯、联苯、萘、蒽、菲、二萘嵌苯、三亚苯及其衍生物。
[0056]“杂环基”是指在环烷基的基础上至少一个碳原子被非碳原子所替代,非碳原子可以为n原子、o原子、s原子等,可以为饱和环或部分不饱和环。合适的实例包括但不限于:二氢吡啶基、四氢吡啶基(哌啶基)、四氢噻吩基、硫氧化的四氢噻吩基、四氢呋喃基、四氢喹啉
基、四氢异喹啉基、二氢吲哚基。
[0057]“结构单元”是指高聚物中由其中一个单体形成的单元结构。所述高聚物可以由一种单体聚合而成,也可以由两个以上不同种类的单体共聚而成,因此所述“结构单元”可以相同,也可以不同。
[0058]
聚酰胺-胺树枝状大分子聚合度与代数的关系:聚合度=2^(代数+1)-1,如pamamdendrimer3.0代,其聚合度为15。
[0059]
本发明的实施例提供一种氨基修饰的芯片,包括:
[0060]
基底,所述基底修饰有环氧基;
[0061]
经所述环氧基接枝于所述基底之上的高聚物,所述高聚物的至少一个结构单元包含氨基,所述氨基为伯氨基和/或仲氨基。
[0062]
可以理解地,所述芯片为可以用于基因检测的芯片,也可以为用于蛋白、多肽等检测的芯片。
[0063]
在其中一个具体的实施例中,所述高聚物中平均每个所述结构单元包含0.05~10个相同或不同的氨基。可以理解地,所述结构单元中可以包含氨基,也可以不包含氨基,所述“平均”是指以氨基的总数除以所述结构单元的总数所得的平均值,当平均每个所述结构单元包含氨基个数小于1时,所述高聚物为两个以上单体聚合而成的共聚物,其中至少一个单体不含氨基。举例可如,所述高聚物中平均每个所述结构单元包含0.5个氨基,所述高聚物可由19个无氨基结构单元和1个含氨基结构单元(含10个氨基)构成,通过控制聚合时的单体组合可控制氨基数量。
[0064]
优选地,所述高聚物中平均每个所述结构单元包含1~5个氨基。测试发现,高聚物上的氨基的数量与氨基的反应活性相关,而氨基的反应活性直接影响氨基与连接到高聚物上的连接物例如探针的连接密度/数量。在一个示例中,探针通过连接基团与高聚物的氨基相连而连接在芯片表面,使高聚物的每个所述结构单元平均包含1~5个氨基能够较好地调控探针的连接密度/数量,从而实现探针密度调控的优化,同时,使探针更易于通过连接基团接枝到高聚物上且探针密度更高。
[0065]
在其中一个具体的实施例中,所述高聚物的聚合度范围为10~5000。在另外一个具体的实施例中,所述高聚物的分子量为30kd~300kd。分子量越大,可接枝的核酸链密度越高,但是同时增加高聚物固定在基体表面的有效性,同时,分子量过大的分子还会对溶解度、反应效率等方便造成不良影响。故此在本发明的实施例中,优选所述高聚物的分子量为30kd~300kd。对于所述聚酰胺-胺树枝状大分子而言,以pamamdendrimer为例,其代数可以是3~11代。
[0066]
优选地,所述高聚物包含相同或不同的结构单元,可以采用市售,也可以委托厂家定制,只需满足本技术对聚合物所包含的氨基数量或/和聚合物的聚合度的要求即可。
[0067]
在其中一个具体的实施例中,所述高聚物中的结构单元包括(有时也
写作(有时也写作)、(有时也写作)、(有时也写作(有时也写作)中的至少一种。
[0068]
具体地,在一个示例中,所述高聚物包含相同的结构单元,如高聚物为包含相同结构单元的的共聚物。在另一个示例中,所述高聚物包含不同的结构单元,例如,高聚物为包含不同结构单元的共聚物,如参见kousaku ohkawaa,biodegradation of ornithine-containing polylysine hydrogels,biomaterials 19(1998)1855-1860.中所公开的内容包括以不同比例聚合的鸟氨酸和赖氨酸共聚物(lys orn),或高聚物为包含不同结构单元含不同结构单元的共聚物。
[0069]
优选地,所述高聚物选自聚赖氨酸、聚鸟氨酸、壳聚糖、聚酰胺-胺树枝状大分子和聚乙烯亚胺中的至少一种。
[0070]
在其中一个具体的实施例中,上述芯片还包括接枝于所述高聚物的探针。其中探针通过与目标分子结合,从而捕获目标分子。基于不同的目的,选用不同的探针种类,如,选用寡核苷酸片段、多肽序列、包含寡核苷酸片段、或包含多肽序列的片段,同时,探针可选择性标记荧光检测分子、抗原、生物素或链霉亲和素等检测分子。
[0071]
在其中一个具体的实施例中,所述探针可以为核酸链和/或多肽。
[0072]
在其中一个具体的实施例中,所述探针通过连接基团与所述高聚物接枝,所述连接基团的分子结构中包含第一连接基团和第二连接基团;所述第一连接基团一端与所述核
酸链探针键合,所述第二连接基团另一端经所述氨基接枝于所述高聚物。进一步地,所述第二连接基团选自-nhs基团、环氧基团和异氰酸酯基团中的至少一种。
[0073]
在其中一个具体的实施例中,所述连接基团由nhs-peg
n-dbco或nhs-peg
n-n3制成,其中,n=3~2000;所述nhs-pegn-dbco或nhs-pegn-n3中的基团-nhs与所述氨基进行反应接枝。
[0074]
优选地,所述探针修饰有基团-dbco或基团-n3;所述键合的方式为基团-dbco与基团-n3间的共价键合。其中,nhs为琥珀酰亚胺酯的缩写,peg为聚乙二醇的缩写,dbco为二苯基环辛炔的缩写,n3为叠氮的缩写。经由上述连接基团连接所述核酸链和高聚物,一方面nhs能够在较为稳定地与所述氨基接枝,另一方面dbco或n3能够与修饰有n3或dbco的核酸链在常温、无催化剂的条件下进行click反应,反应条件温和,效率高。
[0075]
本发明的实施例还提供一种芯片的制备方法,包括如下步骤:
[0076]
(1)获取基底,所述基底修饰有环氧基;
[0077]
(2)将高聚物反应接枝至所述基底,所述高聚物的至少一个结构单元包含氨基,所述氨基为伯氨基或仲氨基。
[0078]
上述制备方法中,关于所述高聚物的进一步限定同上述芯片,在此不再赘述。
[0079]
具体地,步骤(1)为获取基底步骤,其中所述获取可以是直接购买,即直接购买获得修饰有环氧基基底,也可以是自制,自制的方法可以为通过溶液反应,也可以通过等离子镀膜法在载体上修饰包含环氧基的化合物。
[0080]
所述包含环氧基的化合物可以选自环氧硅烷,例如3-(2,3环氧丙氧)丙基三甲氧基硅烷。另外,在其中一个具体的实施例中,所述载体的材料为玻璃、硅片、塑料、凝胶和尼龙膜中的至少一种。
[0081]
在其中一个具体的实施例中,采用溶液反应在载体上修饰包含环氧基的化合物的反应条件包括:反应温度为室温,反应时间为1~8小时。进一步地,反应结束后,于80~150℃条件下烘干。
[0082]
可以理解地,在进行所述溶液反应修饰之前,需要对载体进行深度清洗和活化处理。例如,采用醇类溶剂、水在超声条件下交替清洗,使用碱液活化载体表面。所述碱液活化可采用如0.1m~2m的naoh水溶液处理1~20分钟。
[0083]
具体地,步骤(2)为高聚物接枝步骤。所述基底修饰的是环氧基,步骤(2)中,所述氨基与所述环氧基进行反应接枝。
[0084]
优选地,所述反应接枝是通过所述高聚物与所述基底在碱性溶液中接触下进行的,所述碱性溶液的ph值为8.5~10。所述ph值包括但不限于以下数值:8.5、8.8、9、9.16、9.2、9.5、10。
[0085]
优选地,所述ph值为8.5~10的碱性溶液选自磷酸盐缓冲液、碳酸盐缓冲液和硼酸盐缓冲液中的至少一种。更进一步地,所述ph值为8.5~10的缓冲液中缓冲对的浓度为10~300mm。所述缓冲对的浓度包括但不限于以下浓度:10mm、50mm、100mm、120mm、150mm、190mm、195mm、200mm、205mm、210mm、220mm、250mm、300mm。
[0086]
优选地,以ph值为9.16的碳酸盐缓冲液作为反应溶剂,其中缓冲对的浓度为200mm。
[0087]
另外,步骤(2)中,所述反应接枝是在反应温度为37~55℃的条件下反应3~24h。
所述反应温度和反应时间的组合(温度*时间)包括但不限于以下组合:37℃*14h、37℃*16h、37℃*18h、37℃*20h、37℃*24h、40℃*12h、42℃*18h、45℃*10h、50℃*8h、55℃*5h、55℃*3h。
[0088]
优选地,反应温度为37℃,反应时间为16h。
[0089]
优选地,上述芯片的制备方法,还包括步骤(3):将探针接枝至所述高聚物。步骤(3)为探针接枝步骤。
[0090]
在其中一个具体的实施例中,步骤(3)中,所述探针通过连接基团与所述高聚物接枝,所述连接基团的分子结构中包含第一连接基团和第二连接基团;所述第一连接基团与所述探针键合,所述第二连接基团经所述氨基接枝于所述高聚物。更为具体地,所述第二连接基团选自-nhs基团、环氧基团和异氰酸酯基团中的至少一种。
[0091]
优选地,步骤(3)可以分为如下两步进行:
[0092]
(3-1)将提供所述连接基团的化合物与所述高聚物的氨基进行接枝反应;
[0093]
(3-2)将所述接枝反应的产物与活性基团修饰的探针进行键合。
[0094]
在其中一个具体的实施例中,所述连接基团由nhs-peg
n-dbco或nhs-peg
n-n3制成,其中,n=3~2000,所述nhs-peg
n-dbco或nhs-pegn-n3中的基团-nhs与所述氨基进行反应接枝。经由上述连接基团连接所述探针和高聚物,一方面-nhs能够较为稳定地与所述氨基接枝,另一方面-dbco或-n3能够与修饰有-n3或-dbco的探针在常温、无催化剂的条件下进行click反应,反应条件温和,效率高。
[0095]
优选地,所述活性基团修饰的探针修饰有基团-dbco或基团-n3;所述键合的方式为基团-dbco与基团-n3间的共价键合。更为具体地,所述共价键合为click反应。
[0096]
在其中一个具体的实施例中,所述活性基团修饰的探针为在5’端进行所述活性基团修饰的核酸链。可以理解地,若所述连接基团由nhs-pegn-dbco制备而成,即用于键合的为基团-dbco,那么5’端修饰的活性基团为-n3官能团;若所述连接基团由nhs-pegn-n3制备而成,即用于键合的为基团-n3,那么5’端修饰的活性基团为-dbco官能团。
[0097]
在其中一个具体的实施例中,步骤(3-1)中,所述提供连接基团的化合物在反应体系中的浓度为50μm~5mm。所述浓度包括但不限于以下浓度:50μm、100μm、500μm、800μm、1mm、1.2mm、1.5mm、2mm、5mm。
[0098]
在其中一个具体的实施例中,步骤(3-1)中,所述反应接枝是通过使所述连接基团与所述高聚物在碱性溶液中接触进行的,所述碱性溶液的ph值为7~9。具体地,所述ph值包括但不限于以下数值:7、7.3、7.5、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5。更为具体地,所述碱性溶液选自磷酸盐缓冲液和碳酸盐缓冲液中的至少一个。
[0099]
在其中一个具体的实施例中,所述磷酸盐缓冲液或碳酸盐缓冲液中缓冲对的浓度为10mm~300mm。所述缓冲对的浓度包括但不限于以下浓度:10mm、50mm、80mm、90mm、95mm、98mm、100mm、102mm、105mm、110mm、150mm、200mm、210mm、220mm、250mm、300mm。
[0100]
优选地,所述反应接枝是以ph值为8的磷酸盐缓冲液作为反应溶剂,其中缓冲对的浓度为100mm。在另一个具体的实施例中,所述反应接枝是以ph值为8.3的碳酸盐缓冲液作为反应溶剂,其中缓冲对的浓度为100mm。
[0101]
在其中一个具体的实施例中,步骤(3-1)中,所述反应接枝是在反应温度为室温的条件下反应30~90min。所述反应时间包括但不限于以下时间:30min、40min、50min、55min、
58min、60min、62min、65min、70min、80min、90min。
[0102]
在其中一个具体的实施例中,步骤(3-2)中,所述共价键合是通过使所述探针与连接基团在碱性溶液中接触下进行的,所述碱性溶液的ph值为7~8。具体地,所述ph值包括但不限于以下数值:7、7.3、7.5、7.7、7.8、7.9、8。更为具体地,所述碱性溶液为柠檬酸盐缓冲液。更为具体地,所述共价键合是在室温条件下进行。
[0103]
在其中一个具体的实施例中,所述碱性溶液中含有表面活性剂,所述表面活性剂选自十四烷基三甲基溴化铵(ttab)、十六烷基三甲基溴化铵(ctab)和十二烷基三甲基溴化铵(dtab)中的至少一种。采用所述表面活性剂有利于核酸链在表面沉降。
[0104]
优选地,所述共价键合是在反应温度为室温的条件下,使所述探针与连接基团在添加有1mm ttab的柠檬酸盐缓冲液中接触下进行的。
[0105]
另外,在不同应用中,键合所述探针的之前或之后,可选择性地对多余的官能团进行封闭,多余的官能团可例如-nh2、-dbco、-n3等。
[0106]
具体地,在其中一个具体的实施例中,还包括封闭步骤:采用nhs-(peg)n、乙酸酐、dbco-苯甲酸、叠氮-苯甲酸中的至少一种进行封闭处理,其中n=3~2000。更为具体地,-nh2的封闭可选用nhs-(peg)n(n可以为3~2000)、乙酸酐等;特殊地,例如使用1ul乙酸酐+1.75ul n,n-二异丙基乙胺(dipea)溶于甲酰胺对-nh2进行封闭。-n3的封闭可选用dbco-苯甲酸进行封闭。-dbco的封闭可选用叠氮苯甲酸进行封闭。
[0107]
本发明的实施例还提供如上所述的芯片、或如上所述的制备方法制备得到的芯片在生物分子制备或生物分子分析中的应用。具体地,所述生物分子制备或生物分子分析可如核酸测序、文库杂交、dna簇的生成等,也可如蛋白检测、多肽检测等。
[0108]
如下为具体的实施例,除非有特殊说明,所有的实验材料均来自商业供应商(如阿拉丁、simga、生工等)或者根据实施例提供的结构式和分子量等信息自行制备或委托制备。
[0109]
聚酰胺-胺树枝状大分子(pamamdendrimer),pamam dendrimer3.0代(简称:pd3.0),分子量6905.84,其分子式如下:
[0110][0111]
nhs-peg4-n3和nhs-peg4-dbco,二者的分子式如下所示:
[0112][0113]
无水二甲基亚枫(dmso)购买于sigma;
[0114]
聚乙烯亚胺(pei),分子量为60kd,其分子式如下:
[0115][0116]
聚赖氨酸(pll),分子量150-300kd,其分子式如下:
[0117][0118]
聚鸟氨酸(plo),分子量30kd-70kd,其分子式如下:
[0119][0120]
壳聚糖(chitosan),分子量为100kd,分子式如下:
[0121][0122]
碳酸氢钠和碳酸钠购买于sigma;
[0123]
十四烷基三甲基溴化铵(ttab)购买于sigma;
[0124]
磷酸氢二钠和磷酸二氢钠购买于sigma;
[0125]
20xssc购买于生工;hepes购买于sigma;tween20购买于sigma;
[0126]
十二烷基硫酸钠(sds)购买于阿拉丁;
[0127]
sc:0.2m碳酸钠盐ph=9.16(25℃);
[0128]
pc:0.1m磷酸钠盐ph=8.0(25℃);
[0129]
固定液:3xssc+1mm ttab(十四烷基三甲基溴化铵);
[0130]
清洗液1:150mm hepes+0.1%tween20+0.1%sds;
[0131]
ri02:3xssc ph=7.2~7.4。
[0132]
实施例1
[0133]
plo(聚鸟氨酸)包被环氧修饰的基底及官能团修饰plo包被的基底的具体操作过程如下:
[0134]
1.将0.1%plo溶液室温平衡15min,取200μl plo溶液,加入200ul sc缓冲液,涡旋混匀,短暂离心2s;
[0135]
2.将步骤1中配置的溶液通入环氧修饰的基底的通道,每条通道通入25μl溶液,密封通道口(防止溶液挥发),37℃反应16h;
[0136]
3.反应结束后,待基底恢复至室温,在流体仪上依次使用清洗液1和ri02各1ml清洗,流体仪参数设置:试剂量(reagent amount)=1000,速度(speed)=10,循环(circle)=1,延时=0,次数=1;
[0137]
4.将plo包被的基底浸泡在ri02溶液进行保存,4℃可保存1周;
[0138]
5.官能团修饰plo包被的基底,官能团指的是参与后续反应的基团,可为-n3、-dbco等基团,在本实施例中官能团为-n3基团,官能团修饰的具体步骤如下:
[0139]
1)配置终浓度100mm的nhs-peg4-n3溶液,溶剂为无水dmso(无水二甲基亚枫);
[0140]
2)将含有nhs-peg4-n3溶液通入plo包被的基底的通道:在流体仪上将基底的通道液体抽干,使用1ml/通道的pc缓冲液润洗通道,润洗完后抽干通道液体;
[0141]
3)将396μl pc缓冲液和4μl 100mm的nhs-peg4-n3溶液混合,涡旋混匀,短暂离心2s;
[0142]
4)将步骤3)中配置的溶液立即通入基底通道,25μl/通道;室温反应1h;
[0143]
5)反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0144]
6)在流体仪上将基底通道的液体抽干,取1个1.5离心管加入497.25μl甲酰胺,然后依次加入1.75μl dipea和1μl乙酸酐,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,室温反应15min;反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行
清洗;
[0145]
6.探针固定:
[0146]
1)在流体仪上将基底通道的液体抽干,使用1ml/通道的固定液润洗通道,润洗完后抽干通道液体;
[0147]
2)将360μl固定液与40μl 100μm a30(seq id no.1)混合,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,37℃反应16h;
[0148]
3)反应结束后,待芯片恢复至室温,在流体仪上依次使用清洗液1和ri02各1ml清洗;
[0149]
官能团修饰后的基底可以浸泡在ri02溶液中进行保存,4℃保存1年。
[0150]
实施例2
[0151]
pll(聚赖氨酸)包被环氧修饰的基底及官能团修饰pll包被的基底的具体操作过程如下:
[0152]
1.将0.1%pll溶液室温平衡15min,取200μl pll溶液,加入200μl sc缓冲液,涡旋混匀,短暂离心2s;
[0153]
2.将步骤1中配置的溶液通入环氧修饰的基底的通道,每条通道通入25μl溶液,密封通道口(防止溶液挥发),37℃反应16h;
[0154]
3.反应结束后,待基底恢复至室温,在流体仪上依次使用清洗液1和ri02各清洗1ml,流体仪参数设置:试剂量(reagent amount)=1000,速度(speed)=10,循环(circle)=1,延时=0,次数=1;
[0155]
4.将pll包被的基底浸泡在ri02溶液进行保存,4℃可保存1周;
[0156]
5.官能团修饰pll包被的基底,官能团指的是参与后续反应的基团,可为-n3、-dbco等基团,在本实施例中官能团为-n3基团,官能团修饰的具体步骤如下:
[0157]
1)配置终浓度100mm的nhs-peg4-n3溶液,溶剂为无水dmso(无水二甲基亚枫);
[0158]
2)将含有nhs-peg4-n3溶液通入pll包被的基底的通道:在流体仪上将基底的通道液体抽干,使用1ml/通道的pc缓冲液润洗通道,润洗完后抽干通道液体;
[0159]
3)将396μl pc缓冲液和4μl 100mm的nhs-peg4-n3溶液混合,涡旋混匀,短暂离心2s;
[0160]
4)将步骤3)中配置的溶液立即通入基底通道,25μl/通道;室温反应1h;
[0161]
5)反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0162]
6)在流体仪上将基底通道的液体抽干,取1个1.5离心管加入497.25μl甲酰胺,然后依次加入1.75μl dipea和1μl乙酸酐,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,室温反应15min;反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0163]
6.探针固定:
[0164]
1)在流体仪上将基底通道的液体抽干,使用1ml/通道的固定液润洗通道,润洗完后抽干通道液体;
[0165]
2)将360μl固定液与40μl 100μm a30混合,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,37℃反应16h;
[0166]
3)反应结束后,待芯片恢复至室温,在流体仪上依次使用清洗液1和ri02各清洗
1ml;
[0167]
官能团修饰后的基底可以浸泡在ri02溶液中进行保存,4℃保存1年。
[0168]
实施例3
[0169]
pamamdendrimer(聚酰胺-胺树枝状大分子)包被环氧修饰的基底及官能团修饰pamamdendrimer包被的基底的具体操作过程如下:
[0170]
1.将5%pamamdendrimer室温平衡15min,取200μl pamamdendrimer溶液,加入380μl sc缓冲液,涡旋混匀,短暂离心2s;
[0171]
2.将步骤1中配置的溶液通入环氧修饰的基底的通道,每条通道通入25μl溶液,密封通道口(防止溶液挥发),37℃反应16h;
[0172]
3.反应结束后,待基底恢复至室温,在流体仪上依次使用清洗液1和ri02各清洗1ml,流体仪参数设置:试剂量(reagent amount)=1000,速度(speed)=10,循环(circle)=1,延时=0,次数=1;
[0173]
4.将pamamdendrimer包被的基底浸泡在ri02溶液进行保存,4℃可保存1周;
[0174]
5.官能团修饰pamamdendrimer包被的基底,官能团指的是参与后续反应的基团,可为-n3、-dbco等基团,在本实施例中官能团为-n3基团,官能团修饰的具体步骤如下:
[0175]
1)配置终浓度100mm的nhs-peg4-n3溶液,溶剂为无水dmso(无水二甲基亚枫);
[0176]
2)将含有nhs-peg4-n3溶液通入plo包被的基底的通道:在流体仪上将基底的通道液体抽干,使用1ml/通道的pc缓冲液润洗通道,润洗完后抽干通道液体;
[0177]
3)将396μl pc缓冲液和4μl 100mm的nhs-peg4-n3溶液混合,涡旋混匀,短暂离心2s;
[0178]
4)将步骤3)中配置的溶液立即通入基底通道,25μl/通道;室温反应1h;
[0179]
5)反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0180]
6.探针固定:
[0181]
1)在流体仪上将基底通道的液体抽干,使用1ml/通道的固定液润洗通道,润洗完后抽干通道液体;
[0182]
2)将360μl固定液与40μl 100um a30混合,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,37℃反应16h;
[0183]
3)反应结束后,待芯片恢复至室温,在流体仪上依次使用清洗液1和ri02各1ml清洗;
[0184]
4)在流体仪上将基底通道的液体抽干,取1个1.5离心管加入497.25μl甲酰胺,然后依次加入1.75μl dipea和1μl乙酸酐,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,室温反应15min;反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0185]
官能团修饰后的基底可以浸泡在ri02溶液中进行保存,4℃保存1年。
[0186]
实施例4
[0187]
pei(聚乙烯亚胺)包被环氧修饰的基底及官能团修饰pei包被的基底的具体操作过程如下:
[0188]
1.将1%pei溶液室温平衡15min,取200μl pei溶液,加入380μl sc缓冲液,涡旋混匀,短暂离心2s;
n3、-dbco等基团,在本实施例中官能团为n3基团,官能团修饰的具体步骤如下:
[0211]
1)配置终浓度100mm的nhs-peg4-n3溶液,溶剂为无水dmso(无水二甲基亚枫);
[0212]
2)将含有nhs-peg4-n3溶液通入plo包被的基底的通道:在流体仪上将基底的通道液体抽干,使用1ml/通道的pc缓冲液润洗通道,润洗完后抽干通道液体;
[0213]
3)将396μl pc缓冲液和4μl 100mm的nhs-peg4-n3溶液混合,涡旋混匀,短暂离心2s;
[0214]
4)将步骤3)中配置的溶液立即通入基底通道,25μl/通道;室温反应1h;
[0215]
5)反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0216]
6)在流体仪上将基底通道的液体抽干,取1个1.5离心管加入497.25μl甲酰胺,然后依次加入1.75μl dipea和1μl乙酸酐,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,室温反应15min;反应结束后在流体仪上依次使用清洗液1、ri02和超纯水各1ml进行清洗;
[0217]
6.探针固定:
[0218]
1)在流体仪上将基底通道的液体抽干,使用1ml/通道的固定液润洗通道,润洗完后抽干通道液体;
[0219]
2)将360μl固定液与40μl 100μm a30混合,涡旋混匀,短暂离心2s,立即通入基底通道,25μl/通道,37℃反应16h;
[0220]
3)反应结束后,待芯片恢复至室温,在流体仪上依次使用清洗液1和ri02各清洗1ml;
[0221]
官能团修饰后的基底可以浸泡在ri02溶液中进行保存,4℃保存1年。
[0222]
实施例6
[0223]
本实施例对实施例1-5制备的芯片进行探针密度检测,具体检测过程如下:
[0224]
1.t20-cy3杂交:分别取实施例1-5中制备的芯片,在流体仪上抽干通道液体,每条通道通入20μl杂交液a(含3um t20-cy3的3xssc(ph 7.2-7.4)),于55℃杂交15min,待冷却至室温,在流体仪上使用ri02清洗1ml。其中t20-cy3的cy3位于t20序列的5’端。
[0225]
检测:利用20倍物镜的荧光检测系统,使用532nm的波长,激光功率为35mw,曝光时间为60ms,拍照收集数据,使用imagej分析图像信息。
[0226]
检测结果如图2所示,实施例1-5中制备的芯片探针密度检测结果,纵坐标为荧光强度(a.u.),单位dot/fov即1观测区域为110
×
110μm范围的平均荧光强度,横坐标pll、plo、pd3.0、cts、pei分别对应的是修饰了高聚物pll、plo、pd3.0(聚酰胺-胺树枝状大分子)、cts(壳聚糖)、pei的芯片。
[0227]
实施例7
[0228]
利用实施例1-5中制备的芯片进行文库杂交及检测,具体流程如下:
[0229]
1.dna杂交文库准备
[0230]
dna文库:片段长度为150-300bp双端含有已知序列的dna文库,文库的分子结构如图3所示,insertion:插入片段,来源于phi-x174标准菌株;t20、pe、rd分别为seq id no.2-4所示序列。
[0231]
将dna文库与52μl体积的去离子水混合,向其中加入18μl新鲜配制的0.2m naoh溶液,混合均匀后于室温静置变性8分钟,然后加入20μl体积ph8.0的400mmtris-hcl缓冲液终
止反应,获得100μl体积的100pm变性dna文库。2.dna变性文库与芯片探针杂交
[0232]
使用ph 7.3含有3
×
ssc(是将20
×
ssc缓冲液用无核酸酶水(rnase-free水)稀释而成)杂交液将变性好的dna文库稀释至5pm,然后通入芯片通道中于42℃杂交反应30分钟,接着以250μl/min的速度流通160~260μl体积的清洗试剂(5
×
ssc,0.05%吐温20,ph 7.0),完成杂交反应。
[0233]
3.模板初始延伸
[0234]
1)以500μl/min的速度流通芯片通道160~260μl体积的延伸缓冲试剂(20mm三羟甲基氨基甲烷(tris),10mm硫酸铵,2mm硫酸镁,1.5m甜菜碱,1.3%二甲基亚砜,0.45m n-甲基甲酰胺,1.5m甲酰胺(carboxamide),0.1%tritonx-100,ph 9.0);
[0235]
2)以500μl/min的速度流通芯片通道160~260μl体积的延伸试剂(延伸缓冲试剂,3ug/ml bst dna聚合酶,200μm dntps),然后于50~60℃反应5min,完成模板初始延伸。
[0236]
4.dna簇生成
[0237]
利用文章isothermal amplification method for next-generation sequencing(zhaochun ma,et.al,pnas august 27,2013 110(35)14320-14323,https://doi.org/10.1073/pnas.1311334110)公开的template walking技术进行扩增,生成dna簇。
[0238]
5.检测dna簇(cluster)
[0239]
1)设置热循环温度为50~60℃;
[0240]
2)以500μl/min的速度流通芯片通道160~260μl体积的变性试剂甲酰胺,变性5分钟打开dna双螺旋结构;
[0241]
3)以500μl/min的速度流通芯片通道160~260μl体积的质控试剂(0.5μm rd-cy3,3
×
ssc),其中rd-cy3中的cy3位于rd序列的5’端;
[0242]
4)设置热循环温度为25℃,反应15~30分钟;
[0243]
5)以500μl/min的速度流通芯片通道160~260μl体积的清洗试剂;
[0244]
6)利用20倍物镜的荧光检测系统,设置532nm波长激光功率为300mw,曝光时间为20ms,进行拍照观察。
[0245]
dna簇检测结果见图3-7以及表1,图4-8对应的芯片分别为利用实施例1-5制备的芯片生成的dna簇检测结果。
[0246]
表1
[0247][0248]
从检测结果可看出,利用实施例1-5制备的芯片可成功用于文库的杂交、dna簇的生成。
[0249]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实
施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0250]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
