利用血液中rna的covid-19重症化预测方法
1.相关申请的交叉引用
2.本国际申请主张基于如下申请的优先权:在2020年6月12日向日本专利局提交的日本专利申请第2020-116704号、在2020年8月20日向日本专利局提交的日本专利申请第2020-139049号和在2020年10月2日向日本专利局提交的日本专利申请第2020-168106号,将日本专利申请第2020-116704号、日本专利申请第2020-139049号和日本专利申请第2020-168106号的全部内容通过引用援用至本国际申请中。
技术领域
3.本发明涉及预测新型冠状病毒感染的重症化可能性的方法。
4.严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome coronavirus 2:sars-cov-2)感染症(covid-19)已在全世界蔓延而成流行病。sars-cov-2是冠状病毒属的病毒,是包含作为遗传信息发挥功能的核酸(rna)、包围所述核酸的蛋白质壳(capsid)、及具有刺突(spike)的脂质双层膜的衣壳(envelope)的极小粒子(直径0.1nm)。该病毒通过飞沫感染(感染者的咳嗽、喷嚏、鼻涕等飞沫中释放的病毒自口、眼侵入)、接触感染(接触了感染者的飞沫的病毒的手碰触到口、鼻)而扩大人传人的感染。
5.该感染症经过长达1~14天的潜伏期,成为类似于感冒等的发烧、咳嗽等初期症状。大部分感染者为轻症、无症状的非显性。covid-19中成为问题的是,其余部分患者产生了诸如急性呼吸窘迫综合征(ards)的重度呼吸障碍,进而并发心肌炎、血管炎、脑脊髓膜炎等而危及生命。
6.目前,各国正在积极地实施有无sars-cov-2感染的检查,除pcr检查外,还进行了抗原检查及抗体检查。但是,上述检查方法是判定病毒的存在本身或过去发生过病毒感染,存在无法预测到已发生病毒感染的患者的重症化的问题。虽然在携带一部分基础疾病、例如循环器官疾病、呼吸器官疾病、糖尿病等基础疾病的慢性病的患者中以及孕妇、老年人等中可见容易发生重症化的倾向,但在健康的年轻人中也可见重症化病例,需要更准确的重症化预测方法。
技术实现要素:
7.发明要解决的课题
8.因此,本发明以提供sars-cov-2感染患者中的重症化预测方法为目的。
9.用于解决课题的手段
10.本技术的发明人从经pcr检查判定为sars-cov-2阳性且呈现中等程度症状的患者中采集血液试样,并对之后的病情的发展程度进行了观察。之后,回顾性地分析了患者的病情的发展程度与血液试样中的rna之间的关系,结果发现,血液试样中所含的mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2的水平高的covid-19患者之后容易发生重症化。因此,本发明提供了covid-19患者的重症化预测方法,所述方法利用了血液中中所含的mir-122-5p、
snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2。
11.本说明书中,“covid-19患者”意指判明了感染sars-cov-2的对象或被怀疑感染sars-cov-2的对象(无论有无其症状)。例如,covid-19患者可以是在pcr检查中被判定了sars-cov-2为阳性的患者。sars-cov-2是被称为严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome coronavirus 2)或2019新型冠状病毒(2019 novel coronavirus:2019-ncov)的冠状病毒,是全长29.9kb的单链正链rna病毒。毒株基因序列最早公开于genbank_id mn908947中,但根据nextstrain的报告,报道有25.9个碱基突变/基因组/年的突变速度,并认为至少随机地出现了9个碱基的突变。因此,本说明书中,“sars-cov-2”包含具有公开于genbank_id mn908947中的基因序列的sars-cov-2毒株以及从其经由突变产生的所有衍生毒株。
12.本说明书中,所谓标志物rna,选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2,所述rna可例如按顺序具有序列号1~10中记载的核酸序列,但不限于此。
13.标志物rna中存在同工型或变体的情况下,所述同工型、变体也包含在本说明书中的标志物rna中。例如,本说明书中的标志物rna可取代或缺失作为上述标志物rna已知的序列中的一部分碱基,例如,1~5个、1~3个、1~2个或1个碱基,或者可以添加或插入不包含于上述标志物rna中的碱基(例如,1~5个、1~3个、1~2个或1个碱基)。此外,具有与上述标志物rna有90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上或约99%以上的同一性的碱基序列的rna也包含于本说明书中的标志物rna中。同一性可以通过例如blast等进行判定。尤其除了这样进行解释会存在矛盾的情况以外,本说明书中记载的标志物rna包括上述突变体、变体。
14.本说明书中,“血液试样”包括全血、血浆、血清、全血或血细胞的溶血液等血液的分级物或者处理物、及它们的稀释液、浓缩液,优选为血清或其稀释液。
15.本说明书中,“重症化”意指在以下的who 2020 covid-19病例评分(who 2020 scoring for covid-19 cases)中,分数为5以上(住院重症:hospitalized-severe disease)。
16.表1
[0017][0018]
本说明书中,“外泌体”是指从各种细胞释放的直径约20~200nm或50~150nm的细
胞外小泡体,也记作ev。已知外泌体可具有以细胞间通讯、抗原呈递、蛋白质以及mrna及mirna等核酸的运输为代表的各种功能。优选的是,本说明书中的外泌体于表面具有cd9及cd63。
[0019]
本说明书中,标志物蛋白质选自copb2(copi包被复合物亚基β2:copi coat complex subunit beta 2)(例如,序列号11)、kras(kras原癌基因:kras proto-oncogene)(例如,序列号12)、prkcb(β型蛋白激酶c:protein kinase c beta type)(例如,序列号13)、rhoc(ras同源家族成员c:ras homolog family member c)(例如,序列号14)、cd147(basigin,胞外基质金属蛋白酶诱导物:extracellular matrix metalloproteinase inducer(emmprin))(例如,序列号15)、capn2(calpain-2)(例如,序列号16)、ecm1(胞外基质蛋白1:extracellular matrix protein 1)(例如,序列号17)、fgg(纤维蛋白原γ链:fibrinogen gamma chain)(例如,序列号18)、mfap4(微纤维相关蛋白4:microfibril-associated protein 4)(例如,序列号19)、adi1(1,2-二羟基-3-酮-5-甲硫戊烯双加氧酶:1,2-dihydroxy-3-keto-5-methylthiopentene dioxygenase、apl1、ard、fe-ard、hmft1638、mtcbp1、ni-ard、sipl、mtnd)、ak1(腺苷酸激酶同工酶1:adenylate kinase isoenzyme 1)、mgat1(α-1,3-甘露糖基糖蛋白2-β-n-乙酰氨基葡萄糖转移酶:
[0020]
alpha-1,3-mannosyl-glycoprotein 2-beta-n-acetylglucosaminyltransferase)、cldn3(claudin 3)、crp(c反应蛋白:c-reactive protein)、uqcrc2(线粒体细胞色素b-c1复合物亚基2:cytochrome b-c1 complex subunit 2,mitochondrial)、fga(纤维蛋白原α链:fibrinogen alpha chain)、fgb(纤维蛋白原β链:fibrinogen beta chain)、fgl1(纤维蛋白原样蛋白1:fibrinogen-like protein 1)、gpx1(谷胱甘肽过氧化物酶1:glutathione peroxidase 1)、gsk3b(糖原合酶激酶3β:glycogen synthase kinase 3 beta)、lbp(脂多糖结合蛋白:lipopolysaccharide binding protein)、pdgfc(血小板衍生生长因子c:platelet derived growth factor c)、rab13(ras相关蛋白rab-13:ras-related protein rab-13)、rap1b(ras相关蛋白rap-1b:ras-related protein rap-1b)、slc6a4(钠依赖性血清素转运蛋白:sodium-dependent serotonin transporter)、uba7(泛素样修饰激活酶7:ubiquitin like modifier activating enzyme 7)、orm1(类粘蛋白1,α-1-酸糖蛋白1:orosomucoid 1,alpha-1-acid glycoprotein 1)、rnpep(氨肽酶b:aminopeptidase b)、angpt1(血管生成素1:angiopoietin 1)、apob、b4galt1、bhmt、cpn1、gnaz、icam2、sell、man1a1、serpina5、pacsin2、ncf1b、tmem59、ywhab、abat、adh1b、asl、ass1、cdh2、cab39、cps1、cd226、col6a3、cul4a、dsc1、entpd5、eif4a1、fn1、pgc、rheb、gnai2、gnb1、gna13、itga2b、itgb1、ilk、f11r、lta4h、lims1、nav2、fam129b、nnmt、nid1、ppia、pla1a、ppbp、pecam1、gp1bb、pcsk9、ment、serpina10、f2rl3、lox、sftpb、rab5b、ralb、reep6、retn、agxt、cct2、thbd、isg15、及zyx。优选选自copb2、kras、prkcb、rhoc、cd147、capn2、ecm1、fgg、mfap4、adi1、ak1、mgat1、cldn3、crp、uqcrc2、fga、fgb、fgl1、gpx1、gsk3b、lbp、pdgfc、rab13、rap1b、slc6a4、及uba7,更优选选自copb2、kras、prkcb、rhoc、cd147、capn2、ecm1、fgg、及mfap4。
[0021]
本说明书中的标志物蛋白质可以是上述标志物蛋白质的同工型(isoform)、前体蛋白质、成熟蛋白质,或截短型,还可以是上述的一部分的氨基酸、例如1~50个、1~30个、1~20个、1~10个、1~8个、1~5个、1~3个、1~2个、或1个氨基酸经取代或缺失,或者可以添
加或插入不包含于上述蛋白质中的氨基酸(例如,1~50个、1~30个、1~20个、1~10个、1~8个、1~5个、1~3个、1~2个、或1个氨基酸)。具有与上述标志物蛋白质有90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上或约99%以上的同一性的氨基酸序列的蛋白质也包含在标志物蛋白质中。同一性可以通过例如blast等进行判定。尤其除了这样进行解释会存在矛盾的情况以外,本说明书所述的标志物蛋白质包含上述突变体、变体。
[0022]
发明效果
[0023]
通过本发明的方法等,能够预测covid-19患者的重症化,因此可以用于判断是否入院、判断监控系统的必要性。尤其对于被预测为重症化的患者,通过进行更频繁的症状确认,使得进行适当的治疗、处置成为可能。
附图简介
[0024]
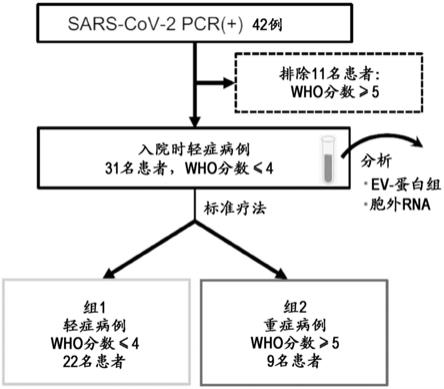
图1:图1示出了实施例中的队列(cohort)的患者募集流程图。
[0025]
图2:图2示出了通过ngs确定源于31人的轻度covid-19患者及10人的未感染健康对照的血清试样的exrna谱图的工作流程。31人的轻度covid-19患者根据试样采集后的病程分为组1(轻症;n=22)和组2(重症;n=9)。
[0026]
图3:图3为针对3个被测对象组的43种转录物的pca图谱。
[0027]
图4:图4为示出3个被测对象组之间的mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、及al365184.1的相关性的图。p值对应基于皮尔森相关性分析的趋势。误差线表示平均值
±
sem。纵轴表示rna量,横轴表示患者组(非感染,组1(轻症),组2(重症))。
[0028]
图5:图5为对6种rna实施的roc分析的图。数值表示评价的auc值(95%ci)。
[0029]
图6:图6示出了基于时序检验的6个转录物的kaplan-meier曲线。纵轴示出病情未发展的患者的比例,横轴的时间(天)表示自登录日起的病程天数。
[0030]
图7:图7示出了来自来源于31人的轻度covid-19患者及10人的未感染健康对照的血清试样的cd9+/cd63+ev的蛋白组学的lc-ms鉴定的工作流程。31人的轻度covid-19患者根据试样采集后的病程分为组1(轻症;n=22)和组2(重症;n=9)。
[0031]
图8:图8为来自3个被测对象组的723种蛋白质的pca图谱。
[0032]
图9:颜色示出皮尔森的相关系数。在上方的三角形部分中,正相关以紫色表示,负相关以棕色表示。圆的颜色浓度和椭圆化与相关系数成比例。下方的三角形中显示实际的相关值,粉色的高亮表示p<0.05。簇1(prkcb、rhoc、copb2、及kras)中包含了与抗病毒应答相关的ev蛋白质的组。簇2(吸烟、年龄、及mfpa4)及簇3(cm1、cdkn2b.as1、al365184.1、capn2、crp、fgg、及cd147)中包含了凝固相关标志物的组。簇4(alt、rnu2-29p、snord33、mir-122-5p、及al732437.2)中包含了与肝障碍相关的exrna的组。
[0033]
图10:图10为covid-19重症化居家判定法的图。
[0034]
图11:图11为sars-cov2检查装置及分析装置的图。
[0035]
图12:图12为sars-cov2检查法的图。
[0036]
附图标记说明
[0037]
1.新型冠状病毒的检查法
[0038]
2.外泌体的检查
[0039]
13.检查所
[0040]
14.使用者
[0041]
15.中央计算机
[0042]
16.个体计算机
[0043]
17.信息的发送
[0044]
18.信息的报告
[0045]
19.新型冠状病毒的居家检查法
具体实施方式
[0046]
1、重症化可能性的判定方法
[0047]
在一个方式中,本发明为对covid-19患者的重症化可能性进行判定的方法,所述方法包括如下步骤:测定来源于该患者的血液试样中的1种以上标志物rna的水平的步骤;和当被测定的标志物rna的水平比对照的该标志物rna水平高时,判定上述患者重症化的可能性高的步骤。上述标志物rna选自由以下rna组成的组:mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2。
[0048]
本发明的方法还可以任意地包括从covid-19患者的血液提取rna的步骤。rna可以使用市售的rna提取试剂盒(例如,mirneasymini kit、或者qiazol及mirneasy mini kit(均为qiagen,hilden,德国)),按照生产商的操作规程进行提取。
[0049]
用于判定发生重症化的可能性而进行测定的标志物rna可设为选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2中的1种或更多种,优选可设为选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、及al365184.1中的1种或更多种。例如,被测定的rna可设为2种或更多种、3种或更多种、4种或更多种、或者5种或更多种。
[0050]
当将2种以上进行组合并利用时,优选可以利用以下的(a)或(b)的组合:
[0051]
(a)cdkn2b-as1和al365184.1的组合
[0052]
(b)选自mir-122-5p、snord33、al732437.2、及rnu2-29p中的2种以上的组合。
[0053]
根据本技术的发明人的发现,在covid-19患者的血液中的这些rna水平与非感染的健康人或者高于在感染判明后的病程中维持了轻症状态的covid-19患者的感染判明时相比更高的情况下,容易发生重症化。因此,本发明的重症化可能性的判定可以通过比较作为covid-19患者的被测者的血液试样中的标志物rna水平与对照的rna水平来进行。当来源于被测者的血液试样中的标志物rna水平高于对照的标志物rna水平时,判定发生重症化的可能性高。此外,当来源于被测者的试样中的标志物rna水平不比对照的标志物rna水平高(即,相同或更低)时,可以判定发生重症化的可能性低或维持轻症状态的可能性高。
[0054]
本说明书中,“对照的标志物rna水平”意指阴性比较对象中的标志物rna水平。此处,“阴性比较对象”意指健康人或未发生重症化(维持了轻症或无症状)的covid-19患者的感染判明时(感染初期)、入院时的血液试样中的标志物rna水平。“对照的标志物rna水平”可如下获得:通过在测定被测患者的血液试样中的标志物rna水平时,以健康人的血液试样或未发生重症化(维持了轻症或无症状)的covid-19患者的感染判明之初、入院时的血液试
样为对照同时地进行测定。或者,也可以预先取得与针对这样的阴性比较对象已测定得到的标志物rna水平相关的信息,利用该水平或考虑该水平而设定的值作为对照的标志物rna水平。例如,这样的值可以是根据已经实施的试验的结果进行roc分析而设定的临界值。或者,也可以将含有如上述提前设定的水平的标志物rna的试样预先调整为对照试样,在测定被测患者的血液试样中的标志物rna水平时,通过同时测定获得对照的标志物rna水平。
[0055]
rna水平的测定只要是能测定rna量的方法即可,没有特别限定,一般是利用与标志物rna特异性结合的物质的方法进行。在一个例子中,“与标志物rna特异性结合的物质”可以是核酸分子,优选是与标志物rna具有互补序列的核酸分子。与标志物rna具有互补序列的核酸分子可以通过与标志物rna杂交进行特异性结合。本说明书中的“核酸”包括dna、rna或人工创造的核酸(包括pna、锁核酸(locked nucleic acid,2’,4
’‑
bna)等桥连型核酸)、或者它们的组合。与标志物rna特异性结合的核酸分子至少可包括一部分人工设计的序列(例如,用于标记、标签化的序列等)。
[0056]“探针”典型地是具有与标志物rna序列互补的序列、用于测定与标志物rna序列的结合的核酸分子。探针通常是能够与标志物rna特异性结合的10~30mer、10~20mer等的核酸分子。作为测定标志物rna与探针的结合水平的方法,可举出southern杂交、northern杂交、点杂交、荧光原位杂交(fish)、微阵列、aso法等,具体而言,可使用应用genechip
tm mirna array strip(thermo fisher scientific株式会社)、agilent mirna微阵列(agilent technologies公司)的方法。
[0057]
rna水平的测定可以通过测定结合于标志物rna上的可与标志物rna特异性结合的物质的结合水平来进行。“结合水平”可设为结合量、结合数或结合比例,或者对其进行表示的数值(例如,测得的荧光强度等测定值本身)。在此情况下,可以使用被标记的物质作为与标志物rna特异性结合的物质,或者可以将标志物rna进行标记并使用。此外,一般而言,将与标准试样同时测定、并基于该标准试样制成的标准曲线或校正线从测定试样的测定值计算而得的值、或者将标准试样水平标准化为指标而得的数值确定为结合水平。
[0058]
作为标记化的方法,例如,可举出放射性同位素(ri)标记、荧光标记、及酶标记。作为进行ri标记时的放射性同位素,可举出32p、131i、35s、45ca、3h、14c。此外、作为进行荧光标记时的荧光色素,可举出dapi、sytox(注册商标)green、syto(注册商标)9、to-pro(注册商标)-3、碘化丙啶、alexa fluor(注册商标)350、alexa fluor(注册商标)647、oregon green(注册商标)、alexa fluor(注册商标)405、alexa fluor(注册商标)680、fluorescein(fitc)、alexa fluor(注册商标)488、alexa fluor(注册商标)750、cy(注册商标)3、alexa fluor(注册商标)532、pacific blue(商标)、pacific orange(商标)、alexa fluor(注册商标)546、香豆素、四甲基罗丹明(tritc)、alexa fluor(注册商标)555、bodipy(注册商标)fl、texas red(注册商标)、alexa fluor(注册商标)568、pacific green(商标)、cy(注册商标)5、及alexa fluor(注册商标)594。作为酶标记,可利用生物素(生物素-16-dutp、生物素-11-dutp等)、地高辛(dig:甾体类天然物)(脱氧尿苷5
’‑
三磷酸)、碱性磷酸酶等。
[0059]
例如,本发明的方法可具备以下的(a)~(c):
[0060]
(a)使可与至少1个标志物rna的碱基序列或其一部分结合的核酸分子(探针)接触患者的血液试样;
[0061]
(b)测定结合于上述探针上的上述血液试样中的标志物rna的结合水平;以及
[0062]
(c)根据测得的结合水平确定该血液试样中的标志物rna水平。
[0063]
在上述方法中,可以利用包含本说明书中记载的所述核酸分子的组合物、试剂盒或装置,替代与至少1个标志物rna的碱基序列或其一部分结合的核酸分子(探针)。
[0064]
或者,rna水平可以使用利用了pcr的方法进行测定,例如,可以通过使用与标志物rna特异性结合的核酸(引物)进行qpcr、arms(扩增受阻突变系统:amplification refractory mutation system)、rt-pcr(逆转录酶-pcr)或巢式pcr来测定。或者,可以利用invade(注册商标)法。例如,可利用与适当的引物一同使用genoexplorertm mirna qrt-pcr kit(genosensor corporation)的方法。“引物”通常是用于核酸扩增的10~30mer(优选17~25mer,15~20mer等)的核酸分子,至少在其一部分(优选7mer以上、8mer以上、9mer以上、10mer以上的)中具有与标志物rna的末端序列互补的序列。
[0065]
因此,rna水平可以通过以下的步骤进行测定:
[0066]
(a)以患者的血液试样作为模板,使用能够与标志物rna特异性结合的核酸分子(引物),使该患者的血液试样中的标志物rna的全部或一部分扩增;
[0067]
(b)测定被扩增的核酸分子的水平;以及
[0068]
(c)根据被扩增的核酸分子的水平确定该血液试样中的标志物rna水平。
[0069]
患者的血液试样中的标志物rna的全部或一部分的扩增可以通过以该血液试样作为模板进行pcr反应等来实施。被扩增的核酸的水平可以通过点印迹(dot blot)杂交法、表面等离子体共振法(spr法)、pcr-rflp法、原位rt-pcr法、pcr-sso(序列特异性寡核苷酸:sequence specific oligonucleotide)法、pcr-ssp法、ampflp(可扩增片段长度多态性:amplifiable fragment length polymorphism)法、mvr-pcr法、pcr-sscp(单链构象多态性:single strand conformation polymorphism)法来测定。
[0070]
本说明书中,与rna“特异性结合”意指较之对于具有其他碱基序列的核酸的亲和性,所述物质以实质上更高的亲和性针对具有标志物rna序列的核酸进行结合。此处,“实质上高的亲和性”意指能够将具有标志物rna序列的核酸与具有其他碱基序列的核酸区别并进行检测的程度的亲和性。其他碱基序列优选以能够与标志物rna序列相区别的程度不同,可以是具有50%以下、40%以下、30%以下、20%以下、或10%以下的同一性的碱基序列。例如,实质上高的亲和性可以是:与标志物rna的结合量为与其他碱基序列的结合量的3倍以上、4倍以上、5倍以上、6倍以上、7倍以上、8倍以上、9倍以上、10倍以上、15倍以上、20倍以上、30倍以上、或50倍以上。
[0071]
除上述标志物rna以外,本发明的重症化可能性还可以利用来源于该患者的血液中的外泌体中存在的标志物蛋白质的水平进行判定。因此,上述方法可以进一步包括测定来源于该患者的血液中的外泌体中存在的1种以上的标志物蛋白质的水平的步骤,可组合上述标志物rna水平和该标志物蛋白质水平,判定发生重症化的可能性。
[0072]
其中,上述标志物蛋白质为选自以下组中的1种以上的蛋白质:copb2、kras、prkcb、rhoc、cd147、capn2、ecm1、fgg、mfap4、adi1、ak1、mgat1、cldn3、crp、uqcrc2、fga、fgb、fgl1、gpx1、gsk3b、lbp、pdgfc、rab13、rap1b、slc6a4、uba7、orm1、rnpep、angpt1、apob、b4galt1、bhmt、cpn1、gnaz、icam2、sell、man1a1、serpina5、pacsin2、ncf1b、tmem59、ywhab、abat、adh1b、asl、ass1、cdh2、cab39、cps1、cd226、col6a3、cul4a、dsc1、entpd5、eif4a1、fn1、pgc、rheb、gnai2、gnb1、gna13、itga2b、itgb1、ilk、f11r、lta4h、lims1、nav2、fam129b、
nnmt、nid1、ppia、pla1a、ppbp、pecam1、gp1bb、pcsk9、ment、serpina10、f2rl3、lox、sftpb、rab5b、ralb、reep6、retn、agxt、cct2、thbd、isg15、及zyx。标志物蛋白质优选为copb2、kras、prkcb、rhoc、cd147、capn2、ecm1、fgg、及mfap4。
[0073]
根据本技术的发明人的发现,除上述rna标志物以外,在来源于covid-19患者的血液的外泌体中的上述标志物蛋白质水平与未感染的健康人或在之后的病程维持了轻症状态的covid-19患者相比更高的情况或更低的情况下,容易发生重症化。因此,本发明的重症化可能性的判定可以包括比较来源于作为covid-19患者的被测者的血液的外泌体中的标志物蛋白质水平与对照的标志物蛋白质水平的步骤。例如,在被测定的蛋白质为copb2或kras的情况下,所述蛋白质的水平比健康人的蛋白质水平高时,判定上述患者发生重症化的可能性低或维持轻症状态,或者,当其不高于健康人的蛋白质水平(较之为低或为相同)时,可以判定发生重症化的可能性高。此外,在被测定的蛋白质为prkcb或rhoc的情况下,所述蛋白质的水平比健康人或维持了轻症状态的患者的感染判明时的蛋白质水平低时,判定上述患者发生重症化的可能性高,或者,当其不低于健康人或维持了轻症状态的患者的感染判明时的蛋白质水平(较之为高或为相同)时,可以判定上述患者发生重症化的可能性低。被测定的蛋白质为cd147、capn2、ecm1、及fgg中任一者的情况下,所述蛋白质的水平比健康人或维持了轻症状态的患者的感染判明时的蛋白质水平高时,判定上述患者发生重症化的可能性高,或者,当所述蛋白质的水平不高于健康人或维持了轻症状态的患者的感染判明时的蛋白质水平(较之为低或为相同)时,判定上述患者发生重症化的可能性低。此外,被测定的蛋白质为mfap4的情况下,所述蛋白质的水平比健康人的蛋白质水平低时,判定上述患者发生重症化的可能性低,或者,当其不低于健康人的蛋白质水平(较之为高或为相同)时,判定上述患者发生重症化的可能性高。
[0074]
本说明书中,“对照蛋白质水平”意指比较对象中的标志物蛋白质水平。此处,“比较对象”意指健康人或未发生重症化(维持了轻症或无症状)的covid-19患者的感染判明时(感染初期)、入院时的血液中外泌体的标志物蛋白质水平。“对照蛋白质水平”可如下获得:在测定来源于被测患者血液的外泌体中的标志物蛋白质水平时,同时地对来源于健康人血液的外泌体试样或对来源于未发生重症化的(维持了轻症或无症状)covid-19患者的感染判明之初、入院时的血液的外泌体试样进行测定。或者,也可以预先取得与针对这样的阴性比较对象已测定得到的标志物蛋白质水平相关的信息,利用该水平或考虑该水平而设定的值作为对照蛋白质水平。这样的值可以是根据已经实施的试验的结果进行roc分析而设定的临界(cutoff)值。或者,也可以将含有如上述提前设定的水平的标志物蛋白质的试样预先调整为对照试样,在测定来源于被测患者血液的外泌体中的标志物蛋白质水平时,通过同时地进行测定来获得对照蛋白质水平。
[0075]
当本发明的方法包括测定标志物蛋白质的方法时,本发明的方法根据需要可包括来自源于被测患者的血液试样的外泌体的制备步骤。外泌体的制备可以用从被测者采集的血液,使用任意的已知方法进行。例如,从血清等试样回收外泌体,可举出超速离心分离法(例如,thery c.,curr.protoc.cell biol.(2006)chapter 3:unit 3.22.)、聚合物沉淀法、免疫沉降法、facs法、超滤法、凝胶过滤法、hplc法、及利用抗体、凝集素使其吸附于珠子等担载体上的方法。此外,也可以使用市售的外泌体分离用试剂盒来回收外泌体。
[0076]
当采用使用抗体的方法时,可以利用外泌体表面的cd9和cd63,使用结合了抗cd9
抗体及抗cd63抗体的担载体进行分离。外泌体的制备步骤可包括例如将来源于被测患者的血液试样与结合了抗cd9抗体及抗cd63抗体的担载体混合、回收结合了外泌体的担载体。此外,该步骤中可包括洗涤结合了外泌体的担载体的工序、使外泌体从担载体解离的工序等。
[0077]
上述回收方法中,超速离心分离法是最常用于外泌体的分离的标准方法。超速离心分离法中的离心力可以是例如50000x g以上、100000xg以上、或150000x g以上,还可以是300000x g以下、250000x g以下、或200000x g以下。离心时间没有限定,例如,可设为30分钟~120分钟、60分钟~90分钟、或70分钟~80分钟。此外,离心分离前,根据需要,可以通过过滤器过滤及/或以更低离心力进行离心分离,除去或减少杂质。
[0078]
可以按照已知的方法,回收外泌体或确认外泌体的物性,例如可以通过电子显微镜在视觉上进行确认,或者使用nta(纳米跟踪分析:nano tracking analysis)技术测量外泌体的粒径和粒子数量。或者,可以通过确认可成为外泌体的标志物的蛋白质及/或基因的表达,确认外泌体的存在。
[0079]
蛋白质水平的测定可以原样地使用所制备的外泌体,或者可以在以sds、ripa缓冲液/ripa裂解缓冲液等表面活性剂破坏膜后进行。使用sds时,蛋白质发生变性,而使用ripa缓冲液/ripa裂解缓冲液时,可以制备为未变性的蛋白质试样。或者,可以从制备的外泌体中进一步提取蛋白质进行测定。因此,本发明的方法可以任意地包括从制备的外泌体中提取纯化蛋白质。提取蛋白质时,可使用市售的外泌体蛋白质提取试剂盒(cosmo bio株式会社)、exoms surface protein capture kit(system biosciences)等进行。
[0080]
蛋白质水平的测定只要是能测定蛋白质量的方法即可,没有特别限定,通常是利用与标志物蛋白质特异性结合的物质的方法。作为“与标志物蛋白质特异性结合的物质”,可举出抗体或其抗原结合性片段、适配体(aptamer)、配体/受体或其结合性片段、或者它们与其他物质的融合物。“抗原结合性片段”意指包含抗体的一部分(部分片段)的蛋白质或肽,是保持了抗体对抗原的作用(免疫反应性
·
结合性)的蛋白质或肽。作为这样的免疫反应性片段,例如可举出f(ab’)2、fab’、fab、fab3、单链fv(以下称为“scfv”)、(串联)双特异性单链fv(sc(fv)2)、单链triplebody、纳米抗体(nanobody)、二价vhh、五价vhh、微型抗体(minibody)、(双链)diabody、串联diabody、双特异性tribody、双特异性bibody、双亲和性重新靶向分子(dart)、三链抗体(triabody)(或tribody)、tetrabody(或[sc(fv)2]2”)、或者(scfv-sa)4)、二硫键fv(以下称为“dsfv”),紧凑型(compact)igg、重链抗体、或它们的聚合物(参见nature biotechnology,29(1):5-6(2011);maneesh jain等,trends in biotechnology,25(7)(2007):307-316;和christoph stein等,antibodies(1):88-123(2012))。本说明书中,抗体及免疫反应性片段可以是单特异性、双特异性(双重特异性)、三特异性(三重特异性)、及多特异性(多重特异性)中的任一者。
[0081]
蛋白质水平的测定典型地通过确定结合于与标志物蛋白质进行特异性结合的物质上的标志物蛋白质的结合水平来进行。所谓被测定的“结合水平”可设为上述物质的结合量、结合数或结合比例,或者对其进行表示的数值(例如,测得的荧光强度等测定值本身)。在此情况下,可以使用被标记的物质作为与标志物蛋白质进行特异性结合的物质,或者可以将标志物蛋白质进行标记并使用。此外,一般而言,将与标准试样同时测定、并基于该标准试样制成的标准曲线或校正线计算而得的值、或者将标准试样水平标准化为指标而得的数值确定为结合水平。
[0082]
因此,例如,本发明的方法可具备以下步骤:
[0083]
(a)使与至少1个标志物蛋白质进行结合的物质接触来源于患者体液的外泌体中的蛋白质;
[0084]
(b)确定结合于所述与标志物蛋白质进行结合的物质上的所述外泌体中的标志物蛋白质的结合水平;以及
[0085]
(c)根据测得的结合水平确定该外泌体中的标志物蛋白质水平。
[0086]
使用抗体或其抗原结合性片段作为与标志物蛋白质进行结合的物质时,结合的测定可以基于已知的检测及/或测定方法。例如,可以通过酶免疫测定法(eia法)、简易eia法、酶联免疫吸附法(elisa法)、放射性免疫测定法(ria法用),荧光免疫测定法(fia法)等标记化免疫测定法;western印迹法等免疫印迹法;金胶体凝聚法等免疫层析法;离子交换层析法、亲和层析法等层析法;比浊法(tia法);散射比浊法(nia法);比色法;乳胶凝聚法(lia法);粒子计数法(cia法);化学发光测定法(clia法、cleia法);沉降反应法;表面等离子体共振法(spr法);谐振镜检测法(rmd法);比较干涉法等来测定结合。
[0087]
具体而言,使被测试样(试样,sample)与固定在固相上的本发明的抗体或其抗原结合性片段接触,洗涤后,添加能够与标志物蛋白质结合的标记抗体,然后通过洗涤除去非结合抗体,通过检测所述抗体的标记或测定标记量(例如,标记的强度),可以确定标志物蛋白质的水平。此外,通过免疫层析进行时,使试样与未被固定的能够结合第一标志物蛋白质的标记化抗体接触后,使所述混合物与在特定部位固定有能够结合第二标志物蛋白质的抗体或其抗原结合性片段的担载体接触,通过检测该部位中的所述标记化抗体或测定标记量(例如,标记的强度),可以确定标志物蛋白质的水平。
[0088]
作为标记化的方法,例如,可举出放射性同位素(ri)标记、荧光标记、及酶标记。作为进行ri标记时的放射性同位素,可举出32p、131i、35s、45ca、3h、14c。此外,作为进行荧光标记时的荧光色素,可举出dapi、sytox(注册商标)green、syto(注册商标)9、to-pro(注册商标)-3、碘化丙啶、alexa fluor(注册商标)350、alexa fluor(注册商标)647、oregon green(注册商标)、alexa fluor(注册商标)405、alexa fluor(注册商标)680、fluorescein(fitc)、alexa fluor(注册商标)488、alexa fluor(注册商标)750、cy(注册商标)3、alexa fluor(注册商标)532、pacific blue(商标)、pacific orange(商标)、alexa fluor(注册商标)546、香豆素、四甲基罗丹明(tritc)、alexa fluor(注册商标)555、bodipy(注册商标)fl、texas red(注册商标)、alexa fluor(注册商标)568、pacific green(商标)、cy(注册商标)5、及alexa fluor(注册商标)594。作为酶标记,可利用生物素(生物素-16-dutp、生物素-11-dutp等)、地高辛(dig:甾体类天然物质)(脱氧尿苷5
’‑
三磷酸)、碱性磷酸酶等。
[0089]
此外,确定本发明的标志物蛋白质水平的步骤可利用如下记载的具有与标志物蛋白质结合的物质的组合物、装置。
[0090]
本说明书中,蛋白质“特异性结合”意指较之对于具有其他氨基酸序列的蛋白质的亲和性,所述物质以实质上更高的亲和性针对具有标志物蛋白质序列的核酸进行结合。此处,“实质上高的亲和性”意指能够将标志物蛋白质与具有其他氨基酸序列的蛋白质区别并进行检测的程度的亲和性。其他氨基酸序列优选以能够与标志物蛋白质序列相区别的程度不同,可以是具有50%以下、40%以下、30%以下、20%以下、或10%以下的同一性的氨基酸序列。例如,实质上高的亲和性可以是:与标志物蛋白质的结合量为与其他氨基酸序列的结
合量的3倍以上、4倍以上、5倍以上、6倍以上、7倍以上、8倍以上、9倍以上、10倍以上、15倍以上、20倍以上、30倍以上、或50倍以上。
[0091]
除了上述标志物rna、标志物蛋白质以外,本发明的方法还可以利用年龄、吸烟指数、血液中crp值、及血液中alt值实施。即,可以将年龄、吸烟指数、血液中crp值及/或血液中alt值与上述标志物rna水平组合,判定重症化的可能性,或者可以将年龄、吸烟指数、血液中crp值及血液中alt值与上述标志物rna水平及上述标志物蛋白质水平组合,判定重症化的可能性。此处,当年龄、吸烟指数、crp、及alt的数值均比健康人或维持了轻症的对照高时,判定重症化可能性高,或者,当其数值不高于健康人或作为轻症者的对照(较之为低或为相同)时,判定重症化可能性低。可以通过常规方法判定或测定吸烟指数、crp、及alt。
[0092]
因此,本发明的重症化预测还可包括通过选自以下的(a)~(d)的组合来判定重症化:
[0093]
(a)选自由prkcb、rhoc、copb2及kras组成的组中的2个以上的因子
[0094]
(b)选自由吸烟指数、年龄及mfap4组成的组中的2个以上的因子
[0095]
(c)选自由cdkn2b-as1、al365184.1、ecm1、capn2、crp、fgg及cd147组成的组中的2个以上的因子
[0096]
(d)选自由alt、rnu2-29p、snord33、mir-122-5p及al732437.2组成的组中的2种以上的因子。
[0097]
可以通过统计分析,确定来源于被测者的试样中的标志物水平是否高于或低于成为比较对象的对照水平。统计学的显著性可以通过t-test(t检验)、f检验、卡方检验等统计学方法进行判断,例如,可以通过比较2个以上的试样,确定置信区间及/或p值来确定(dowdy和wearden,statistics for research,john wiely&sons,newyord,1983)。本发明的置信区间可以是例如90%、95%、98%、99%、99.5%、99.9%或99.99%。p值可以是例如0.1、0.05、0.025、0.02、0.01、0.005、0.001、0.0005、0.0002或0.0001。
[0098]
在本说明书全文中,“水平”意指与被数值化的丰度相关的指标,例如,包括浓度、量或能够作为其替代使用的指标(优选数值指标)。因此,水平可以是荧光强度等测定值本身,也可以是被换算为浓度的值。此外,水平可以是绝对数值(丰度、每单位面积的丰度等),或者可以是与根据需要设定的比较对照进行比较而得的相对数值。
[0099]
本说明书中,判定发生重症化的可能性的方法可作为确定或评价发生重症化的可能性的方法、预测发生重症化或不发生重症化的方法、确定、判定或评价不发生重症化的可能性的方法、或者提供用于进行上述方法的信息的方法使用。
[0100]
对于本说明书的“可能性判定方法”而言,除了如下解释会存在矛盾的情况以外,包括对重症化可能性的变化进行监控的方法。因此,本说明书中,对于“判定可能性”的措辞而言,除了如下解释会存在矛盾的情况以外,可以解释为对重症化可能性的变化进行监控。此外,进行监控的方法中的可能性判定可以连续或间断地进行。
[0101]
此外,本发明的可能性判定方法可以以体内、离体或体外的任一者进行,但优选的,以离体或体外进行。
[0102]
可能性判定意味着藉此预测患者的状态的病程或转归,但并不意味着能以100%的准确性判断状态的病程或转归。所谓重症化可能性高,意味着重症化发生的可能性增大,而不意味以重症化不发生的情况为基准容易发生。即,可能性的判定结果意味着,在标志物
rna逐渐上升的患者中,较之未示出这样的特征的患者而言,更容易发生重症化。
[0103]
本发明的重症化可能性判定方法可以进一步包括对被判定为发生重症化的可能性高的covid-19患者施加重症化预防处置。作为这样的重症化预防处置,可举出疫苗、治疗药、或预防药的施予;基于人工呼吸器、ecmo、或impella等的治疗或处置;以及,提高患者的症状监控频率(例如,1日1次或更多、1日2次或更多、1日3次或更多等)等。
[0104]
2、covid-19重症化标志物
[0105]
在别的方式中,本发明涉及covid-19重症化标志物,所述标志物为选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2中的至少1种rna。这些标志物中优选选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、及al365184.1中的rna。
[0106]
本说明书中,“标志物”意指下述生物体内分子,所述分子以其在被测者中的表达或存在水平提示已发生的特定的疾病、状态或症状,或者提示在将来带来特定的疾病、状态或症状的可能性。换言之,标志物是用于对目前或将来的特定的疾病、状态或症状进行判断或预测的指标,或作为指标被测定的分子。具体而言,本发明中的标志物rna是通过存在水平高而示出covid-19发生重症化的可能性高的分子。
[0107]
3、covid-19重症化预测用组合物或试剂盒
[0108]
在别的方式中,本发明包括covid-19重症化预测用组合物或covid-19重症化预测用试剂盒,所述组合物或试剂盒包含能够与选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2中的至少1种标志物rna结合的物质。
[0109]
covid-19重症化预测用组合物或试剂盒还可包含能够与2种或更多种、3种或更多种、4种或更多种、5种或更多种的标志物rna结合的物质,例如,可包含以下(a)或(b)的组合:
[0110]
(a)能够与cdkn2b-as1结合的物质、及能够与al365184.1结合的物质的组合
[0111]
(b)选自能够与mir-122-5p结合的物质、能够与snord33结合的物质,能够与al732437.2结合的物质、及能够与rnu2-29p结合的物质中的2种以上的组合。
[0112]
能够与标志物rna结合的物质可以使用上述“1、重症化可能性的判定方法”中记载为“能够与标志物rna结合的物质”的物质。
[0113]
covid-19重症化预测用组合物或试剂盒根据需要还可以包含用于稳定保存能够与标志物rna结合的物质的缓冲液等。
[0114]
covid-19重症化预测用组合物或试剂盒可以用于测定标志物rna与特异性结合标志物rna的物质(探针)的结合水平。在此情况下,所述组合物或试剂盒可以与用于通过荧光等检测标志物rna与探针的结合的系统一同使用。
[0115]
covid-19重症化预测用组合物或试剂盒可以用于pcr反应。在此情况下,所述组合物或试剂盒可以与用于检测核酸扩增产物的系统一同使用。
[0116]
上述组合物或试剂盒还可包含能够与1种或更多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种的上述标志物蛋白质结合的物质。
[0117]
例如,上述组合物或试剂盒可包含以下的组合:
[0118]
(a)选自由能够测定prkcb的物质、能够测定rhoc的物质、能够测定copb2的物质、
及能够测定kras的物质组成的组中的2种以上的物质
[0119]
(b)选自由能够测定cdkn2b-as1的物质、能够测定al365184.1的物质、能够测定ecm1的物质、能够测定capn2的物质、能够测定crp的物质、能够测定fgg的物质、及能够测定cd147的物质组成的组中的2种以上的物质
[0120]
(c)选自由能够测定alt的物质、能够测定rnu2-29p的物质、能够测定snord33的物质、能够测定mir-122-5p的物质、及能够测定al732437.2的物质组成的组中的2种以上的物质。
[0121]
试剂盒还可一同包括外箱、容器、稀释剂、悬浮剂、及/或涉及制备方法
·
施予方法的说明书。试剂盒可以将所包含的不同构成成分包装于分开的容器中、并包含在一个试剂盒内,或者,试剂盒仅包含能够与标志物rna结合的物质,其他构成成分可以与试剂盒分开提供。
[0122]
4、covid-19重症化预测用装置
[0123]
本说明书中的装置可以是结合有能够与1种或更多种、2种或更多种、3种或更多种、4种或更多种、或5种标志物rna结合的物质(探针)的微阵列、珠子、或柱等。该装置可用于对上述标志物rna与可特异性结合标志物rna的物质(探针)的结合水平进行测定。
[0124]
本说明书中的装置可以还包含结合有能够与1种或更多种、2种或更多种、3种或更多种、4种或更多种、或5种标志物蛋白质结合的物质的阵列、珠子、芯片、免疫层析平板或柱等。该装置可用于对上述标志物蛋白质与可特异性结合标志物蛋白质的物质的结合水平进行测定。
[0125]“微阵列”指在一次性定量1个以上的标志物的方法中所使用的装置。微阵列可结合有与单个标志物结合的多种探针或者抗体或其抗原结合性片段。dna微阵列可结合例如与标志物rna互补的全长cdna或可与标志物rna的一部分进行杂交的cdna片段作为探针。
[0126]
5、标志物rna的测定方法
[0127]
在别的方式中,本发明涉及测定来源于患者的血液试样中的rna的水平的方法,所述rna为选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2中的至少1种rna,
[0128]
其中,所述方法包括使来源于该患者的血液试样与结合上述rna的物质接触的步骤。
[0129]
更具体而言,本发明可以是测定来源于患者的血液试样中的rna的水平的方法,所述rna为选自mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、al365184.1、let-7c-5p、mir-21-5p、mir-140-3p、及c5orf66-as2中的至少1种rna,
[0130]
其中,所述方法包括使来源于该患者的血液试样与上述组合物或上述装置接触的步骤,
[0131]
测定与上述组合物或上述装置中的上述探针结合的上述血液试样中的标志物rna的结合水平的步骤;以及,
[0132]
根据被测定的结合水平确定该血液试样中的标志物rna水平的步骤。
[0133]
在别的方式中,本发明涉及测定来源于患者的血液的外泌体中所含的1种以上标志物蛋白质的水平,以及,来源于患者的血液中所含的1种以上标志物rna的水平的方法,所述方法包括:
[0134]
使来源于该患者的血液的外泌体中所含的蛋白质与上述组合物或上述装置接触的步骤,以及
[0135]
使来源于该患者的血液中的rna与上述组合物或上述装置接触的步骤。
[0136]
更具体而言,本发明可以是测定源自来源于患者的血液的外泌体中所含的1种以上的标志物蛋白质的水平、以及来源于患者的血液中所含的1种以上的标志物rna的水平的方法,所述方法包括:
[0137]
使源自来源于该患者的血液的外泌体中所含的蛋白质与具有能够与标志物蛋白质结合的物质的上述组合物或上述装置接触的步骤,
[0138]
测定与上述组合物或上述装置中的上述能够与标志物蛋白质结合的物质结合的、上述外泌体中的标志物蛋白质的结合水平的步骤,和
[0139]
根据测得的结合水平,确定该外泌体中的标志物蛋白质水平的步骤;以及
[0140]
使来源于该患者的血液试样中所含的rna与具有能够与标志物rna结合的探针的上述组合物或上述装置接触的步骤,
[0141]
测定与上述组合物或上述装置中的上述探针结合的血液中的标志物rna的结合水平的步骤;和
[0142]
根据测得的结合水平,确定该血液中的标志物rna水平的步骤。
[0143]
在本说明书全文中,被测定的标志物rna或标志物蛋白质、或者组合物、装置中所含的标志物rna或标志物蛋白质可以是1种或更多种、2种或更多种、3种或更多种、4种或更多种、或者5种或更多种。测定2种以上时,可以通过综合考虑被测定的全部结果,判定重症化可能性。例如,在所测定的全部标志物均示出重症化可能性高的判定结果的情况下,可以判定重症化可能性高于所测定的一部分标志物示出重症化可能性高的判定结果的情况。或者,可以对各标志物进行加权,重视重要度更高的标志物rna的结果来判定重症化可能性。例如,可以使在辨别(descrimination)发生了重症化的患者方面表现得更有益的蛋白质的重要度高,所述蛋白质为灵敏度和特异性高的蛋白质(例如,copb2、kras、prkcb、rhoc、cd147)、p值低的蛋白质(rhoc、ecm1、fgg、mfap4)等。
[0144]
在本说明书全文中,本发明的方法中使用的、或者本发明的组合物、试剂盒及装置中所含的、能够与标志物rna结合的物质或者能够与标志物蛋白质结合的物质针对1种标志物rna或1种标志物蛋白质而言可以是2种以上。因此,例如,本发明的方法中,可以使用能够与同一标志物rna结合的不同的2种或更多种(3种或更多种、4种或更多种等)探针,能够与同一标志物rna结合的2种或更多种(3种或更多种、4种或更多种等)引物。此外,本发明的方法中,可以使用能够与同一标志物蛋白质结合的不同的2种或更多种(3种或更多种、4种或更多种等)抗体或其抗原结合性片段。此外,本发明的组合物、试剂盒及装置可以包含能够与同一标志物rna结合的不同的2种或更多种(3种或更多种、4种或更多种等)探针、能够与同一标志物rna结合的2种或更多种(3种或更多种、4种或更多种等)引物。进而,本发明的组合物、试剂盒及装置可包括能够与同一标志物蛋白质结合的不同的2种或更多种(3种或更多种、4种或更多种等)抗体或其抗原结合性片段。
[0145]
需要说明的是,本发明可以是以下发明。
[0146]
(1)冠状病毒检查方法,所述检查方法用于预测冠状病毒感染症(covid-19)的症状是否存在发生重症化的可能性,其特征在于包括以下步骤:
[0147]
从感染了冠状病毒(sars-cov-2)或怀疑已感染的被测者采集血液、鼻涕、唾液等体液作为试样的步骤,
[0148]
从采集的体液回收外泌体的步骤,
[0149]
从回收的外泌体提取rna的步骤,
[0150]
分析从外泌体提取的rna,取得其rna信息(与rna的种类和表达量相关的信息)的步骤,
[0151]
基于所取得的上述rna信息(与rna的种类和表达量相关的信息),预测上述被测者是否存在发生重症化的可能性的步骤。
[0152]
(2)如(1)所述的冠状病毒检查方法,其特征在于,
[0153]
将上述来源于外泌体的rna中的、预先规定的特定种类的mirna中的任意1种或2种以上的组合用作用于预测上述被测者是否存在发生重症化的可能性的重症化预测标志物(生物标志物)。
[0154]
(3)如(1)所述的冠状病毒检查方法,其特征在于,
[0155]
在预测重症化可能性的步骤中,当预先规定的特定种类的rna的表达量超过预先规定的基准值时,预测上述被测者存在发生重症化的可能性。
[0156]
(4)冠状病毒检查系统,所述系统是用于实施(1)~(3)中任一者所述的冠状病毒检查方法的系统,其特征在于具有以下手段:
[0157]
用于从感染了冠状病毒(sars-cov-2)或怀疑已感染的被测者采集血液、鼻涕、唾液等体液作为试样的采液手段,
[0158]
用于保存作为试样采集的血液、鼻涕、唾液等体液的保存手段,
[0159]
用于被采集并被保存的体液回收外泌体的外泌体回收手段,
[0160]
用于从回收的外泌体提取mirna的mirna提取手段,
[0161]
用于分析从来源于上述外泌体的mirna得到的mirna、取得其mirna信息(与mirna的种类和表达量相关的信息)的mirna分析手段,
[0162]
用于基于所取得的上述mirna信息(与mirna的种类和表达量相关的信息)预测上述被测者是否存在发生重症化的可能性的重症化预测手段。
[0163]
(5)冠状病毒检查方法,所述冠状病毒检查方法利用以下系统:
[0164]
病毒检查对象
·
病毒感染者
·
患者〃医院〃行政等使用者所使用的、具备通讯功能的使用者系统,和
[0165]
负责病毒检查的检查中心所使用的、具备通讯功能的分析判定系统,
[0166]
所述方法的特征在于,
[0167]
使用者系统具有:
[0168]
用于从感染了冠状病毒(sars-cov-2)或怀疑已感染的被测者采集血液、鼻涕、唾液等体液作为试样的采液手段,
[0169]
用于保存作为试样采集的血液、鼻涕、唾液等体液的保存手段,
[0170]
用于从被采集并被保存的体液回收外泌体的回收手段,
[0171]
用于从回收的外泌体提取mirna的步骤,
[0172]
用于分析回收的外泌体中所含的mirna、获得其mirna信息(与mirna的种类和表达量相关的信息)的mirna分析手段,和
[0173]
用于介由互联网与分析判定系统进行通讯的通讯手段,
[0174]
分析判定系统具有:
[0175]
用于基于从使用者系统发送的mirna信息、预测上述被测者是否存在发生重症化的可能性的重症化预测手段,和
[0176]
用于介由互联网与使用者系统进行通讯的通讯手段,
[0177]
所述方法包括以下步骤:
[0178]
步骤(a)使用者系统从采集自上述被测者的体液中回收外泌体,
[0179]
步骤(b)使用者系统从回收的外泌体提取mirna,
[0180]
步骤(d)使用者系统分析从外泌体提取的mirna、取得其mirna信息(与mirna的种类和表达量相关的信息),
[0181]
步骤(f)使用者系统针对分析判定系统,介由互联网发送所取得的上述mirna信息,
[0182]
步骤(g)分析判定系统基于从使用者系统接收的mirna信息(与mirna的种类和表达量相关的信息),预测上述被测者是否存在发生重症化的可能性,和
[0183]
步骤(k)分析判定系统针对使用者系统,介由互联网发送与上述步骤(g)的预测结果相关的信息。
[0184]
(6)病毒检查方法,其特征在于包括以下步骤:
[0185]
采集血液、鼻涕、唾液等体液作为试样的步骤,
[0186]
从采集的体液回收外泌体的步骤,
[0187]
从回收的外泌体提取mirna的步骤,
[0188]
分析从外泌体提取的mirna、获得mirna信息的步骤,
[0189]
基于从外泌体得到的mirna信息分析冠状病毒(sars-cov-2)的类型的步骤,
[0190]
基于分析得到的冠状病毒的类型,判定有无冠状病毒感染的步骤,和
[0191]
在判定感染了冠状病毒的情况下按多个阶段判定冠状病毒感染症(covid-19)的重症度的步骤。
[0192]
(7)病毒检查系统,所述系统是用于实施(6)所述的病毒检查方法的系统,其特征在于具有以下手段:
[0193]
用于采集血液、鼻涕、唾液等体液作为试样的采液手段,
[0194]
用于保存作为试样采集的血液、鼻涕、唾液等体液的保存手段,
[0195]
用于从被采集并被保存的体液回收外泌体的外泌体回收手段,
[0196]
用于从回收的外泌体提取mirna的mirna提取手段,
[0197]
用于分析回收的外泌体中所含的mirna、获得mirna信息的mirna分析手段,
[0198]
用于基于从外泌体得到的mirna信息分析冠状病毒(sars-cov-2)的类型的病毒分析手段,
[0199]
用于基于分析得到的冠状病毒的类型判定有无冠状病毒感染的第1判定手段,和
[0200]
用于在判定感染了冠状病毒的情况下按多个阶段判定冠状病毒感染症(covid-19)的重症度的第2判定手段。
[0201]
(8)病毒检查方法,所述方法是利用以下系统的病毒检查方法,
[0202]
病毒检查对象
·
病毒感染者
·
患者
·
医院
·
行政等使用者所使用的、具备通讯功
能的使用者系统,和
[0203]
负责病毒检查的检查中心所使用的、具备通讯功能的分析判定系统,
[0204]
所述方法的特征在于,
[0205]
使用者系统具有:
[0206]
用于采集血液、鼻涕、唾液等体液作为试样的采液手段,
[0207]
用于保存作为试样采集的血液、鼻涕、唾液等体液的保存手段,
[0208]
用于从被采集并被保存的体液回收外泌体的回收手段,
[0209]
用于从回收的外泌体提取mirna的步骤,
[0210]
用于分析回收的外泌体中所含的mirna获得mirna信息的mirna分析手段,和
[0211]
用于介由互联网与分析判定系统进行通讯的通讯手段,
[0212]
分析判定系统具有:
[0213]
用于基于从使用者系统发送的mirna信息分析冠状病毒(sars-cov-2)的类型的病毒分析手段,
[0214]
用于基于分析得到的冠状病毒的类型判定有无冠状病毒的感染的第1判定手段,
[0215]
用于在判定感染了冠状病毒的情况下按多个阶段判定冠状病毒感染症(covid-19)的重症度的第2判定手段,和
[0216]
用于介由使互联网与用者系统进行通讯的通讯手段,
[0217]
所述方法包括以下步骤:
[0218]
步骤(a)使用者系统从采集自病毒检查对象
·
病毒感染者
·
患者的体液中回收外泌体,
[0219]
步骤(b)使用者系统从回收的外泌体提取mirna,
[0220]
步骤(d)使用者系统分析从外泌体提取的mirna、获得mirna信息,
[0221]
步骤(f)使用者系统针对分析判定系统,介由互联网发送从外泌体得到的mirna信息,
[0222]
步骤(g)分析判定系统基于从使用者系统接收的mirna信息,分析冠状病毒(sars-cov-2)的类型,
[0223]
步骤(h)分析判定系统基于分析得到的冠状病毒的类型,判定有无冠状病毒的感染,
[0224]
步骤(i)在判定感染了冠状病毒的情况下按多个阶段判定冠状病毒感染症(covid-19)的重症度,
[0225]
步骤(j)分析判定系统针对使用者系统,介由互联网发送与上述步骤(h)的判定结果相关的信息,和
[0226]
步骤(k)分析判定系统针对使用者系统,介由互联网发送与上述步骤(i)的判定结果相关的信息。
[0227]
(9)冠状病毒的检查法,所述方法为采集且保存血液、鼻涕、唾液等体液作为试样,从该体液提取内包于外泌体中的mirna,此外,基于该mirna信息,瞬时地分析冠状病毒(sars-cov-2)的类型,做出如下判定,所述判定不限于有无冠状病毒的感染,还判定感染后会终止于轻症还是发生重症化。
[0228]
(10)用于实施(9)所述的冠状病毒检查法的装置,其包含检查装置和分析装置,所
19患者分为以下2组(图1),组1(轻症者)为22名,组2(重症者)为9名。
[0237]
组1(轻症者):维持了轻症状态(who分数≤4)的患者
[0238]
组2(重症者):发展为严重状态(severe status)(who分数≥5)的患者
[0239]
组2的患者中,2名由于covid-19并发症死亡。各患者的背景及试样采集后的症状的发展示于表3中。此外,临床参数的统计值示于表4中。健康人和covid-19患者之间在年龄、性别、bmi、吸烟指数、血清尿素氮(bun)、肌酐(cr)、丙氨酸转氨酶(alt)、高血压史、糖尿病、脂质异常症、及冠状动脉性心脏病的方面未发现差异(p>0.05)。另一方面,于白细胞(wbc)数、c-反应蛋白(crp)值确认到显著差异(p<0.05)。此外,组1和组2的covid-19患者之间,在性别、bmi、wbc数、bun、cr、肌酐激酶(ck)、d-二聚体、纤维蛋白原、高血压史、糖尿病、脂质异常症、及冠状动脉性心脏病的方面未发现差异(p>0.05)。另一方面,于年龄、吸烟指数、crp值、及alt值确认到显著差异(p<0.05)。由此显示了年龄、吸烟指数、crp值、及alt值这4个参数与重症化相关。
[0240]
表2
[0241][0242]
表3
[0243][0244]
(表中,性别栏的m表示男性,f表示女性);*“发生严重事件(天)”表示自接受许可并采样的当天起的天数
[0245]
表4
peptide assay(thermo fisher scientific inc)进行。肽的蛋白组学分析使用搭载有ultimate 3000nano lc systems(thermo fisher scientific inc.)的q exactive(thermo fisher scientific inc.)实施。向在与具备nano zero&captive spray insert(75μmx 25cm,ion opticks pty ltd)的c18反相aurorauhplc emitter柱相连接的腔室内加热至40℃的acclaim pepmap 1000捕获柱(75μm x 2cm,nanoviperc183μm,thermo fisher scientific inc)中,使用dreamspray接口(amr inc)注入肽试样(1μg)。纳米泵的流量设定为302分钟的梯度中为250nl/分钟,流动相是a(水中0.1%fa,fisher chemical,thermo fisher scientific inc.)和b(乙腈中0.1%fa,fisher chemical,thermo fisher scientific inc.)。层析梯度以从0~8分钟的2%b开始线性增加的方式设计,8~272分钟为2%b至35%b,272~282分钟为35%b至70%b,282~283分钟为70%b至95%b,洗涤8分钟及平衡10分钟。数据依赖性的取得以阳离子模式实施。质谱分析参数及proteome discoverer 2.2.0.388软件(thermo fisher scientific inc)的参数根据以前报道(ayako kurimoto等,enhanced recovery of cd9-positive extracellular vesicles fromhuman specimens by chelating reagent,doi:https://doi.org/10.1101/2020.06.17.155861)中记载的方法进行。
[0256]
(实施例4)统计学处理
[0257]
使用分类变量的费舍尔直接概率检验和连续变量的非配对学生t检验,比较2个组间的临床数据。为了从ev蛋白质和exrna之中甄别生物标志物候选物,首先使用单因素方差分析(anova),选择在3个被测者组(非感染、covid-19组1、及组2)间以p<0.05的差异水平存在的候选物。主成分分析(pca)使用partek genomics suite 7.0(partek,圣路易斯,密苏里州,美国),针对选择的候选物实施。之后,对组1和组2的识别力优异的候选物基于使用了留一交叉(leave one outcross)验证的线性判别分析进行选择,之后进行使用r版本3.6.3(r foundationfor statistics computing,http://www.r-project.org)、compute.es包版本0.2-2、hash包版本2.2.6.1、mass包版本7.3-51.5、mutoss包版本0.1-12、及proc包版本1.16.2的roc分析。各候选物的最适临界值基于灵敏度和特异性的合计最大值(youden指数)来设定。预测灵敏度、特异度、及精度使用对应各候选物的临界值进行计算。对于使用了时序检验的kaplan mayer分析和cox回归分析而言,使用ibm spss statistics 25(ibm japan,东京,日本)来实施。相关图表使用r版本3.6.3及corrplot包版本0.84来生成,无监督分层聚类分析使用partek genomics suite7.0来实施。所有分析的统计显著性的界限定义为0.05两侧的p值。
[0258]
(结果)
[0259]
(1)来自covid-19患者及非感染对照的血清试样中的exrna谱图的ngs测定
[0260]
循环的exrna有可能作为广泛的疾病的生物标志物发挥功能。exrna由通过摄入至ev、与脂质或蛋白质结合而免于分解的多种rna亚群组成。血液试样中的exrna谱图是动态的,包含mrna、mirna、pirna、及lncrna(murillo od等,cell.(2019)177(2):463-77e15.)。本实施例中,使用下一代测序(ngs)分析存在于患者血清试样中的exrna(图2)。
[0261]
从41种血清试样中,通过ngs分析鉴定了408个转录产物。然而,排除了所有试样中读取不足50的转录产物。上述exrna中,43个转录产物在3个组间差异性表达(p<0.05;单因素方差分析)。为了确定这43个转录产物在3个组间的表达模式,基于pca映射实施了无监督
多变量统计。根据来自ngs数据的pca图表可见3个组间分离的趋势(图3)。可以经由占分散的28.1%的第一主成分(first principal components:ps1)说明该分离。第二主成分(second principal components:ps2)占分散的14.5%。上述观察结果显示,covid-19患者的血清exrna谱图明显脱离了非感染供体的血清exrna谱图。进而,尽管有些重复或分散性,通过pca图表可以检测到组1和组2之间的exrna谱图的明显差异。
[0262]
为了区别组1和组2,基于费舍尔线性判别分析计算了所选择的各转录产物的相互验证分数。从候选物转录产物中,选择了交叉验证分数超过0.75的14个转录产物(表5)。
[0263]
表5
[0264][0265]
图4示出了针对交叉验证分数超过0.80的前6位的转录产物的表达对3个患者组进行比较的结果。作为这些转录产物,包括mir-122-5p、小核rna c/d box 33(snord33)、al732437.2、rna u2小核29伪基因(pseudogene)(rnu2-29p)、cdkn2b反义rna1(cdkn2b-as1)、及al365184.1(该转录物有5个不同的转录物id)。尤其对于snord33、al732437.2、cdkn2b-as1、及al365184.1这4个转录产物而言,较之未感染的对照或组1,组2显示出显著高水平的表达(p趋势<0.05)。
[0266]
(2)6个exrna针对covid-19重症度的预测值
[0267]
然后,制成组1和组2的roc曲线,进行6个预测exrna标志物的集合的灵敏度、特异性和auc值的稳健性检验测试(图5)。转录产物mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、及al365184.1的auc值分别是0.81(95%ci:0.64-0.99)、0.89(95%ci:0.78-1.00)、0.80(95%ci:0.60-1.00)、0.70(95%ci:0.49-1.92)、0.86(95%ci:0.71-1.00)、及0.90(95%ci:0.78-1.00)。该auc分析显示,covid-19患者受诊时的上述的exrna水平能够提供用于就之后的病程是维持轻症状态还是发生重症化进行区分的优异指标。为了按照youden指数确定6个转录产物的最适临界值,生成了追加的roc曲线。使用所生成的临界值将covid-19患者分为低组和高组,确定了重度的covid-19相关事件的发生率。分别针对6个转录产物,对入院后的危重事件发病为止的时间kaplan-meier曲线进行了分析(图6)。关于无恶化期,对于mir-122-5p、snord33、al732437.2、rnu2-29p、cdkn2b-as1、及al365184.1中的全部而言,高水平组均显著长于低水平组(依次为p=2.1
×
10-5
p=
0.00022;p=0.0067;p=3.8
×
10-5
;p=3.3
×
10-6
;p=0.0009)。该发现提示,上述exrna标志物可用于患者入院时的重度covid-19相关事件的发生率的预测。
[0268]
(3)来自covid-19患者及非感染对照的血清试样中的ev的蛋白组学谱图的lc-ms分析
[0269]
在临床现场,来自液体活检的ev的分析作为能给出各种疾病的诊断及预后的生物标志物的潜在手段而受到关注。然而,由于缺少用于将ev从患者分离的标准化方法,该策略并未被广泛使用。针对最适的ev制备法进行了各种研究后,通过以ev的表面标志物蛋白质为靶标的、基于免疫沉降(ip)的方法可以迅速且特异性地进行分离。具体而言,在螯合试剂的存在下,通过使用ip回收来自血清试样的cd9+或cd63+阳性ev,提高产量和纯度,同时适用于基于lc-ms的后续的ev蛋白组学分析(图7)。
[0270]
从41种血清试样进行lc-ms分析,去除在所有试样中均不存在的蛋白质后,结果甄别出1676种蛋白质。这1676种蛋白质中,723种蛋白质在3个组间以不同的水平存在(p<0.05;单因素方差分析)。为了在3个患者队列间比较这723种来源于ev的蛋白质的表达模式,使用基于主成分分析(pca)映射的无监督多变量统计。pca使用lc-ms数据的所有的项目出现频率(term frequency),将第1主成分(pc1)和第2主成分(pc2)制图,显示3个组间的分离趋势(图8)。最初的pc1占分散的28.1%,第二的pc2占分散的14.5%,因此二个主成分表现出能够以54.5%的贡献率在3个组间进行分离的趋势。
[0271]
该观察结果显示,covid-19患者的血清的ev蛋白组学谱图明显脱离了非感染被测者(健康人)。虽然存在轻微的重复或分散,但通过pca分数图表仍然发现,组1和组2之间存在明显的ev蛋白组学差异。为了进一步甄别来自组1和组2的患者的ev来源蛋白质的差异,基于所选择的各蛋白质的费舍尔线性判别分析,计算出显示它们之间的识别性能的稳健性(robustness)的交叉验证分数(urabe f等,clin cancer res.2019;25(10):3016-25.)。从候选物蛋白质中,列出了交叉验证分数超过0.75的91种蛋白质的名单(表6~表8)。
[0272]
表6
[0273]
用于区分轻症和重症covid-19患者的ev蛋白质
[0274][0275]
表7
[0276][0277]
表8
[0278][0279]
(4)为了预测疾病的重症度值而选择的标志物间的相关性
[0280]
之后,使用单变量cox回归分析,计算exrna标志物与ev蛋白质标志物的风险比(hr)。尤其低cobp2的hr不能进行使用最适临界值的统计学计算,提示evcopb2在2个集合的标志物中具有最高的预测值。高龄(hr28.1;95%ci3.4-231.9;p=0.0019)、高crp(hr8.4;95%ci1-67.5;p=0.045)、低prkcb(hr32.1;95%ci3.9-261.9;p=0.0012)、低rhoc(hr23.6;95%ci4.7-118;p=0.00012)、高cd147(hr10.7;95%ci2.5-45.1;p=0.0013)、高capn2(hr15.5;95%ci1.9-125.9;p=0.010)、高ecm1(hr11.6;95%ci2.8-48.4;p=
0.00079)、高fgg(hr21.4;95%ci4.2-110.4;p=0.00025)、高mfap4(hr12.7;95%ci3.3-48.6;p=0.00022)、高mir-122-5p(hr10.5;95%ci2.7-40.4;p=0.00063)、高al732437.2(hr9.9;95%ci1.2-79.9;p=0.031)、高rnu2-29p(hr10.4;95%ci2.6-40.8;p=0.00081)、高cdkn2b-as1(hr14.4;95%ci3.4-61.3;p=0.00031)、及高al365184.1(hr14.2;95%ci1.8-114.4;p=0.013)在统计学上是显著的(表9)。
[0281]
表9
[0282][0283]
hr,风险比;ci,置信区间;na,不适用
[0284]
为了调查所选择的标志物间的潜在关系,基于标志物水平计算spillman相关系数。为了将19个标志物的相关系数可视化,制成相关图(图9)。由此发现了在它们所属的组内共享强正相关的标志物的4个分层簇。各标志物似乎符合被明确定义的4个簇(即,簇1、2、3、及4)中的一者。尤其是簇1(prkcb、rhoc、copb2、及kras)与其他簇具有负相关关系,簇2、3、及4彼此具有实质上的强正相关关系。
[0285]
簇1的4个ev蛋白质均显示,较之组2的covid-19患者,组1的丰度显著更高。mfap4的水平与吸烟或年龄没有显著的相关关系。另一方面,簇3包含ecm1、cdkn2b.as1、al365184.1、capn2、crp、fgg、及cd147。1个exrna(簇3的cdkn2b.as1)以及与胞外基质形成相关的4个蛋白质(簇2的mfpa4和簇3的ecm1、capn2、cd147)的水平与在凝固中发挥重要功能的fgg的水平相关(p<0.05)(图4)。簇3的标志物的水平与年龄相关,后者与血管内皮功能障碍和凝固相关(donato aj等,circ res.2018;123(7):825-48)。大部分数据提示,簇2及3表示凝固相关标志物的组。簇4的组分alt、rnu2-29p、snord33、mir-122-5p、及al732437.2有可能反映了至少部分地与肝障碍相关的现象。alt作为主要与肝功能障碍相
关的代表性转氨酶,其水平与这3个exrna种类的水平相关(p<0.05)。
[0286]
上述结果显示,患者的血清中的ev蛋白质和exrna的谱图明确反映了针对sars-cov-2感染和疾病发展的特定的宿主反应。
