1.本发明属于植物种苗快繁技术领域,具体涉及一种柑橘愈伤组织和悬浮细胞的培养方法。
背景技术:
2.柑橘为世界上最重要的水果之一,我国也是重要的原产地,当前许多优良品种均起源于我国。到目前为止我国的柑橘业已经取得了长足的进展,产量居世界第3位,但其中仍然存在许多问题。柑橘很多病害仍然是威胁柑橘产业的主要因素,抗病育种被视为解决病害问题的根本途径。因此,研究病菌与寄主互作机制,尤其是寄主抗性反应机制,从中挖掘抗/耐病相关的基因,利用耐病基因进行聚合育种(pyramiding tolerance/resistance genes),是一条可行的途径。但由于柑橘获得转基因阳性植株时间较长,因此,柑橘愈伤组织是理化诱变和遗传转化的理想材料,诱导高频率的体细胞胚胎发生对于柑橘细胞的遗传转化、离体诱变、离体筛选突变体、快速繁殖等工作具有特别重要的意义,通过这种途径可以在较短的时间内获得大量的完整植株。因此,诱导柑橘愈伤组织及悬浮细胞培养具有重要的理论和实用价值。
3.广东省有丰富的柑橘种质资源,砂糖橘(citrus reticulata blanco)是广东省最具地方特色和优势的主栽柑橘品种,果肉爽脆,味甜多汁,深受广大群众的喜爱。但是,随着砂糖橘种植面积的迅速发展,一些生产和市场上所面临的问题也越来越多,市场竞争力正在逐年下降。因此,能够保存优秀的砂糖橘种质的砂糖橘愈伤组织的培养极为重要。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种柑橘愈伤组织和悬浮细胞的培养方法,包括以下步骤:
5.s1:选取种子消毒后取出胚珠;
6.s2:将胚珠接种到愈伤组织培养基中诱导培养得到愈伤组织;
7.s3:从步骤s2的愈伤组织培养基中取定量的愈伤组织转移到相应的液体培养基中培养,获得胚性悬浮细胞悬液。
8.在本发明的一些实施方式中,所述愈伤组织培养基组成包括:
9.培养基母液a:90~100g/l kno3,80~85g/l nh4no3,16~20g/l mgso4·
7h2o,5~10g/l kh2po4,0.5~1.5g/l k2hpo4,4℃保存;
10.培养基母液b:0.6~0.64g/l硼酸,1.6~1.75g/l mnso4·
h2o,0.7~1g/l znso4·
7h2o,0.073~0.093g/l ki,0.015~0.035g/l na2moo4·
2h2o,0.0015~0.0035g/l cuso4·
5h2o,0.0015~0.0035g/l cocl2·
6h2o,4℃保存;
11.培养基母液c:8~12g/l肌醇,0.5~1.5g/l维生素b1,0.5~1.5g/l维生素b6,0.25~0.75g/l烟酸,0.1~0.3g/l甘氨酸,4℃保存;
12.培养基母液d:29~30g/l cacl2·
2h2o,4℃保存;
13.培养基母液e:7.25~7.65g/l na
2-edta,5.47~5.67g/l feso4·
7h2o,4℃保存;
14.所述愈伤组织培养基配方为:18~20ml/l母液a,8~12ml/l母液b,8~12ml/l母液c,12~18ml/l母液d,2.5~7.5ml/l母液e,40~60g/l蔗糖,0.25~0.75g/l麦芽提取物,6~10g/l琼脂,ph值为5.5~6.5。
15.在本发明的一些优选的实施方式中,所述愈伤组织培养基组成包括:
16.培养基母液a:95g/l kno3,82.5g/l nh4no3,18.5g/l mgso4·
7h2o,7.5g/l kh2po4,1g/l k2hpo4,4℃保存;
17.培养基母液b:0.62g/l硼酸,1.68g/l mnso4·
h2o,0.86g/l znso4·
7h2o,0.083g/l ki,0.025g/l na2moo4·
2h2o,0.0025g/l cuso4·
5h2o,0.0025g/l cocl2·
6h2o,4℃保存;
18.培养基母液c:10g/l肌醇,1g/l维生素b1,1g/l维生素b6,0.5g/l烟酸,0.2g/l甘氨酸,4℃保存;
19.培养基母液d:29.33g/l cacl2·
2h2o,4℃保存;
20.培养基母液e:7.45g/l na
2-edta,5.57g/l feso4·
7h2o,4℃保存;
21.所述愈伤组织培养基配方为:20ml/l母液a,10ml/l母液b,10ml/l母液c,15ml/l母液d,5ml/l母液e,50g/l蔗糖,0.5g/l麦芽提取物,8g/l琼脂,ph值为5.8。
22.在本发明的一些实施方式中,所述液体培养基组成包括:
23.培养基母液f:140~160g/l kcl,35~40g/l mgso4·
7h2o,10~17g/l kh2po4,1.5~3g/l k2hpo4,4℃保存;
24.所述液体培养基配方为:8~12ml/l母液a,3~7ml/l母液f,8~12ml/l母液b,8~12ml/l母液c,10~20ml/l母液d,3~8ml/l母液e,30~40g/l蔗糖,0.25~0.75g/l麦芽提取物,1.45~1.65g/l谷氨酰胺,ph值为5.5~6.5。
25.在本发明的一些优选实施方式中,所述液体培养基组成包括:
26.母液f:150g/l kcl,37g/l mgso4·
7h2o,15g/l kh2po4,2g/l k2hpo4,4℃保存;
27.所述液体培养基配方为:10ml/l母液a,5ml/l母液f,10ml/l母液b,10ml/l母液c,15ml/l母液d,5ml/l母液e,35g/l蔗糖,0.5g/l麦芽提取物,1.55g/l谷氨酰胺,ph值为5.8。
28.在本发明的一些实施方式中,步骤s1所述消毒的具体方法为将种子放于20%次氯酸钠中20~40min。
29.在本发明的一些优选的实施方式中,步骤s1所述消毒的具体方法为将种子放于20%次氯酸钠中30min。
30.在本发明的一些实施方式中,步骤s1所述种子为未成熟的种子,未发育成熟的种子分化性,生长性能好,能够很快分化形成愈伤细胞。
31.在本发明的一些实施方式中,步骤s2所述愈伤组织的培养条件为:温度26~30℃,湿度70%~80%,暗培养。
32.在本发明的一些优选的实施方式中,步骤s2所述愈伤组织的培养条件为:温度28℃,湿度75%,暗培养。
33.在本发明的一些实施方式中,步骤s3所述培养为振动培养。
34.在本发明的一些实施方式中,所述振动培养的条件为:115~135rpm,14~18h/d,26~30℃。
35.在本发明的一些优选的实施方式中,所述振动培养的条件为125rpm,16h/d,28℃。
36.在本发明的一些实施方式中,所述愈伤组织培养基和液体培养基还需要高压灭菌。
37.在本发明的一些实施方式中,所述柑橘为宽皮柑橘。
38.在本发明的一些优选实施方式中,所述宽皮柑橘为砂糖橘。
39.本发明还提供一种愈伤组织,由上述培养方法培养而成。
40.本发明还提供一种悬浮细胞,由上述培养方法培养而成。
41.本发明还提供上述愈伤组织或悬浮细胞在柑橘培育中的应用。
42.在本发明的一些实施方式中,所述柑橘为宽皮柑橘。
43.在本发明的一些优选实施方式中,所述宽皮柑橘为砂糖橘。
44.本发明的有益效果是:
45.本发明以砂糖橘果实中未发育完全的种子为外植体,进行砂糖橘愈伤组织的诱导,诱导率为70%以上,形成的愈伤组织性状稳定,性状稳定,得到的悬浮细胞分散性好,溶液澄清透明。为今后砂糖橘种质保存以及通过生物技术手段进行品种改良奠定基础。
附图说明
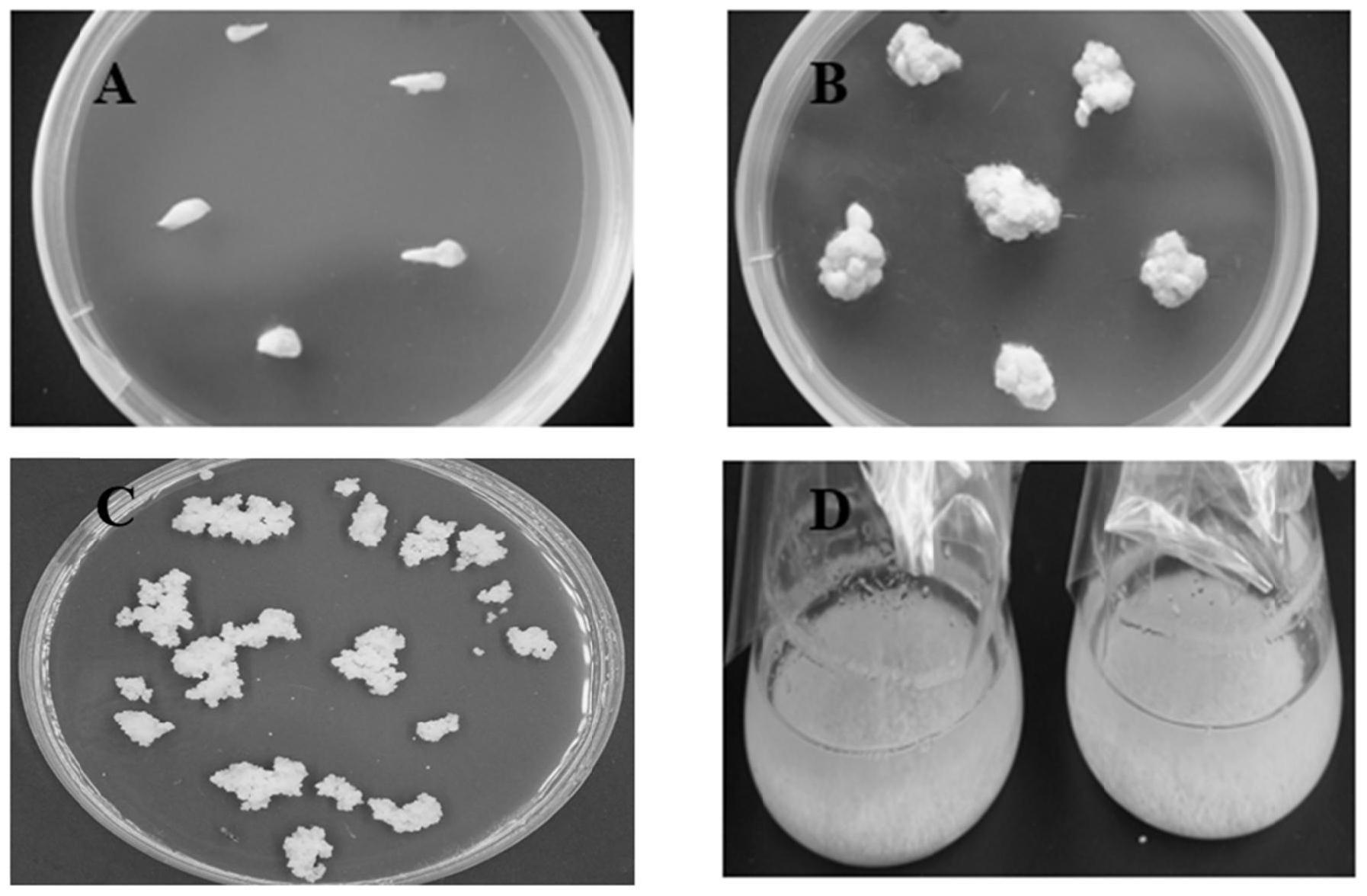
46.图1为本发明实施例1中培养结果。其中a图为培养基上的未成熟种子,b图为愈伤组织的形成,c图为胚胎愈伤组织的形成,d图为液体培养基中的悬浮细胞。
具体实施方式
47.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
48.以砂糖橘为试材,进行愈伤组织诱导:获得愈伤组织细胞及悬浮液。
49.实施例1
50.配方:
51.灭菌液:20%(v/v)次氯酸钠。
52.母液a:95g/l kno3,82.5g/l nh4no3,18.5g/l mgso4·
7h2o,7.5g/l kh2po4,1g/l k2hpo4,去离子水溶解,4℃保存。
53.母液b:0.62g/l硼酸,1.68g/l mnso4·
h2o,0.86g/l znso4·
7h2o,0.083g/l ki,0.025g/l na2moo4·
2h2o,0.0025g/l cuso4·
5h2o,0.0025g/l cocl2·
6h2o,去离子水溶解,4℃保存。
54.母液c:10g/l肌醇,1g/l维生素b1,1g/l维生素b6,0.5g/l烟酸,0.2g/l甘氨酸,去离子水溶解,4℃保存。
55.母液d:29.33g/l cacl2·
2h2o,去离子水溶解,4℃保存。
56.母液e:7.45g/l na
2-edta,5.57g/l feso4·
7h2o,去离子水溶解,4℃保存。
57.母液f:150g/l kcl,37g/l mgso4·
7h2o,15g/l kh2po4,2g/l k2hpo4,去离子水溶解,4℃保存。
58.mt固体培养基:20ml/l母液a,10ml/l母液b,10ml/l母液c,15ml/l母液d,5ml/l母液e,50g/l蔗糖,0.5g/l麦芽提取物,8g/l琼脂,ph值为5.8;高压灭菌后,在超净工作台内倒至培养皿内。
59.mh液体培养基:10ml/l母液a,5ml/l母液f,10ml/l母液b,10ml/l母液c,15ml/l母液d,5ml/l母液e,35g/l蔗糖,0.5g/l麦芽提取物,1.55g/l谷氨酰胺,ph值为5.8;高压灭菌后,在超净工作台内分装至已灭菌的三角瓶内,室温放置。
60.一种砂糖橘愈伤组织和悬浮细胞的培养方法,包括以下步骤:
61.s1:选取种子消毒后取出胚珠:具体为将未成熟种子在20%次氯酸钠中浸泡30min,用无菌镊子,将种子放在消毒后的滤纸上,用无菌手术刀,在种子赤道处切一个1~2cm深的切口,打开种子,用无菌镊子取出胚珠;
62.s2:将胚珠接种到愈伤组织培养基中诱导培养得到愈伤组织:具体为将取出的胚珠置于愈伤组织培养基(mt)上,28
±
2℃暗培养,每3~4周转移到新的愈伤组织诱导培养基中,直到胚珠冒出胚性(黄色易碎)愈伤组织;为了保持长期培养,每4~6周将胚性未分化的愈伤组织转移到新的培养基上,并在相同条件下培养;
63.s3:获得愈伤组织的胚性悬浮细胞悬液:具体为从愈伤组织诱导培养基中取2g愈伤组织,转移到125ml三角瓶瓶中,每烧瓶含有20ml mh液体培养基,在旋转摇床上以125rpm摇匀细胞悬液,光周期16h/d,28
±
2℃,1周后,向三角瓶中加入10ml新的mh液体培养基,并放回振动筛,一个多星期后,向三角瓶中加入20ml新的mh液体培养基,并放回振动筛,每2周传代一次,从培养液中取出20ml,代以20ml新鲜mh液体培养基,建立胚性细胞悬液培养;摇速125rpm,同等条件下孵育。
64.实施例2
65.配方:
66.母液a:90g/l kno3,80g/l nh4no3,16g/l mgso4·
7h2o,5g/l kh2po4,1.5g/l k2hpo4,去离子水溶解,4℃保存。
67.母液b:0.6g/l硼酸,1.75g/l mnso4·
h2o,0.7g/l znso4·
7h2o,0.073g/l ki,0.035g/l na2moo4·
2h2o,0.0035g/l cuso4·
5h2o,0.0035g/l cocl2·
6h2o,去离子水溶解,4℃保存。
68.母液c:8g/l肌醇,1.5g/l维生素b1,1.5g/l维生素b6,0.25g/l烟酸,0.1g/l甘氨酸,去离子水溶解,4℃保存。
69.母液d:29g/l cacl2·
2h2o,去离子水溶解,4℃保存。
70.母液e:7.25g/l na
2-edta,5.47g/l feso4·
7h2o,去离子水溶解,4℃保存。
71.母液f:140g/l kcl,40g/l mgso4·
7h2o,17g/l kh2po4,3g/l k2hpo4,去离子水溶解,4℃保存。
72.mt固体培养基:18ml/l母液a,12ml/l母液b,8ml/l母液c,18ml/l母液d,7.5ml/l母液e,40g/l蔗糖,0.75g/l麦芽提取物,10g/l琼脂,ph值为6.5;高压灭菌后,在超净工作台内倒至培养皿内。
73.mh液体培养基:8ml/l母液a,7ml/l母液f,12ml/l母液b,12ml/l母液c,10ml/l母液d,8ml/l母液e,40g/l蔗糖,0.75g/l麦芽提取物,1.15g/l谷氨酰胺,ph值为6.5;高压灭菌后,在超净工作台内分装至已灭菌的三角瓶内,室温放置。
74.其余培养方法同实施例1。
75.实施例3
76.配方:
77.母液a:100g/l kno3,85g/l nh4no3,20g/l mgso4·
7h2o,10g/l kh2po4,0.5g/l k2hpo4,去离子水溶解,4℃保存。
78.母液b:0.64g/l硼酸,1.6g/l mnso4·
h2o,1g/l znso4·
7h2o,0.093g/l ki,0.015g/l na2moo4·
2h2o,0.0015g/l cuso4·
5h2o,0.0015g/l cocl2·
6h2o,去离子水溶解,4℃保存。
79.母液c:12g/l肌醇,0.5g/l维生素b1,0.5g/l维生素b6,0.75g/l烟酸,0.3g/l甘氨酸,去离子水溶解,4℃保存。
80.母液d:30g/l cacl2·
2h2o,去离子水溶解,4℃保存。
81.母液e:7.65g/l na
2-edta,5.67g/l feso4·
7h2o,去离子水溶解,4℃保存。
82.母液f:160g/l kcl,35g/l mgso4·
7h2o,10g/l kh2po4,1.5g/l k2hpo4,去离子水溶解,4℃保存。
83.mt固体培养基:20ml/l母液a,8ml/l母液b,12ml/l母液c,12ml/l母液d,2.5ml/l母液e,60g/l蔗糖,0.25g/l麦芽提取物,6g/l琼脂,ph值为5.5;高压灭菌后,在超净工作台内倒至培养皿内。
84.mh液体培养基:12ml/l母液a,3ml/l母液f,8ml/l母液b,8ml/l母液c,20ml/l母液d,3ml/l母液e,30g/l蔗糖,0.25g/l麦芽提取物,1.65g/l谷氨酰胺,ph值为5.8;高压灭菌后,在超净工作台内分装至已灭菌的三角瓶内,室温放置。
85.其余培养方法同实施例1。
86.试验例:
87.1)对实施例1中培养结果进行诱导率检测,结果如下:
88.第一批:每个果子里取未成熟种子10粒放置愈伤组织培养基(mt)上,暗培养,一个月后看愈伤组织生长情况。10粒种子约有7粒形成愈伤细胞。
89.第二批:每个果子里取未成熟种子10粒放置愈伤组织培养基(mt)上,暗培养,一个月后看愈伤组织生长情况。10粒种子约有7粒形成愈伤细胞。
90.第三批:每个果子里取未成熟种子10粒放置愈伤组织培养基(mt)上,暗培养,一个月后看愈伤组织生长情况。10粒种子约有8粒形成愈伤细胞。
91.第四批:每个果子里取未成熟种子10粒放置愈伤组织培养基(mt)上,暗培养,一个月后看愈伤组织生长情况。10粒种子约有8粒形成愈伤细胞。
92.可以看出诱导率为70%以上,具有很好的诱导效果。
93.2)对实施例1中培养结果进行检测。培养结果见图1,其中图1中a图为培养基上的未成熟种子,图1中b图为愈伤组织的形成,图1中c图为胚胎愈伤组织的形成,图1中d图为液体培养基中的悬浮细胞。可以看出,培养得到的愈伤组织细胞形态好,颜色成白色且细胞成团紧实,细胞悬液颜色澄清透明。
94.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
