1.本发明涉及乳状液制备技术领域,特指一种以酪蛋白酸钠和果胶为原料,采用顺序阶梯式超声波技术制备蛋白质-多糖复合物乳状液的方法。
背景技术:
2.乳状液是一种液体以液珠形式分散在与它不相混溶的另一种液体中而形成的分散体系。为了提高乳状液的稳定性,通常需要加入乳化剂或表面活性剂。常见的乳化剂主要分为四种类型:阴离子型乳化剂(如油酸皂);阳离子乳化剂(如十二烷基氯化铵);非离子型乳化剂(如长链脂肪醇聚氧乙烯醚)和两性乳化剂(如蛋白质)。与传统乳状液相比,依靠蛋白质、多糖等生物大分子对油-水界面稳定而制备的乳状液,具有良好的生物相容性、降解性和稳定性,在食品科学与营养健康领域中发挥着越来越重要的作用。
3.蛋白质,尤其是酪蛋白和乳清蛋白,作为一种来源广泛、天然、可食用的乳化剂在食品乳状液中得到了广泛的应用。但单一蛋白质乳化剂ph敏感,制备的乳状液稳定性差,且易受环境影响,因此在食品工业中的应用较为局限。多糖作为一种亲水性大分子物质,具备多种功能性质,在食品领域中经常作为凝胶剂、稳定剂、增稠剂、乳化剂,其复杂结构使其对ph、温度、离子浓度等环境影响不敏感。近年来研究发现,蛋白质与多糖相互作用形成的静电复合物,既具备了蛋白质的两亲性,又具备了多糖的链状结构,因此有利于实现油-水界面行为调节并获得两相润湿性好、适宜稳定的乳状液。因此,将蛋白质与多糖制备成蛋白质-多糖复合物乳化剂可以克服单一蛋白组分乳液ph敏感、稳定性差等不足,制备成的乳液可作为潜在递送载体对生物活性成分进行高效递送。一般来说,蛋白质多糖的相互作用主要基于非共价相互作用的性质,包括静电、疏水、氢键和范德华力,这种相互作用导致了蛋白质-多糖的界面行为。
4.酪蛋白酸钠(sodium caseinate,nacas),是一种重要的乳制品成分,可增强酪蛋白胶束的功能性,如水溶性、乳化性、起泡性以及包封性。酪蛋白酸钠是通过酸沉淀酪蛋白胶束,然后用氢氧化钠中和喷雾干燥而产生。酪蛋白酸钠与酪蛋白的组成相似,但酪蛋白酸钠的质量比原始酪蛋白胶束小,水溶性高。因此,与酪蛋白一样,在食品应用中可作为乳化剂和稳定剂来使用,有助于食品保留脂肪和水,促进食品加工中各成分的均匀分布。同时,酪蛋白酸钠富含人体所需的各种氨基酸,营养价值很高,可以作为各类食品的营养增补剂。
5.果胶(pectin),是一类植物多糖,被认为是自然界中结构最复杂的多糖,主要由半乳糖醛酸单元组成,存在于植物细胞初生细胞壁和细胞间隙中,多与纤维素、半纤维素和木质素等细胞壁中所含的其他成分共存。果胶作为一种亲水胶体,分子中存在的极性区和非极性区使其具备多种功能性质,因而能够作为凝胶剂、稳定剂、增稠剂、乳化剂和稳定剂等用于不同食品体系。除了作为食品中的添加剂以改良食品的质地、感官,果胶还具有不容忽视的生理作用,果胶及经过降解的果胶可以起到抑制癌细胞的作用,主要体现在增强益生元活性、免疫增强、抑制肿瘤生长、抑制突变。
6.常用的酪蛋白酸钠-果胶复合物制备方法为ph驱动-热处理法。此类方法的不足表
现在复合物制备过程复杂、需要热处理,这些会对生物活性物质的活性产生潜在影响。同时,制备得到的复合物粒径较大且分布不均匀,作为乳化剂的乳化性差。而对于乳状液的制备技术,主要采用高压均质、高压微射流、先高速剪切后高压均质等高能乳化技术,使得蛋白质分子紧密排列在油-水界面,促使两相界面张力降低,制备得到乳状液。但是上述乳化技术设备造价昂贵、维护成本高、样品处理量小,复杂的操作,以及对操作人员的高要求限制了其在食品领域中的应用。本发明以酪蛋白酸钠、果胶为主要原料,研究以酪蛋白酸钠-果胶复合物为乳化剂的乳状液制备方法。
7.为了解决上述问题,本发明采用顺序阶梯式超声波技术制备酪蛋白酸钠-果胶复合物乳状液,以期获得粒径更小、稳定性更好、乳化性更好的酪蛋白酸钠-果胶复合物乳状液,并用于对生物活性成分的负载和保护。
技术实现要素:
8.为解决现有问题,该发明使用顺序阶梯式超声波处理技术对酪蛋白酸钠-果胶复合物乳状液进行超声处理,探究复合物的乳化性、理化特性、结构特性的变化,以及对乳状液稳定性、负载能力的影响。
9.顺序阶梯式超声波是指不同频率的超声波从低频到高频或者从高频到低频依次对物料进行处理的超声波(如图1所示),其克服了传统的单频或者双频超声波难以完全激发物料产生与其自身固有频率相匹配的共振频率,容易产生驻波,超声波空化额减少等缺点。对于蛋白质-多糖乳状液这样复杂的体系,更能激发和调控蛋白大分子结构的展开与多糖进行静电复合,并且可以调控蛋白质-多糖在油水界面的吸附和重排特性,从而影响乳状液的稳定性。
10.本发明中酪蛋白酸钠-果胶复合物乳状液,是由以下质量份的原料制备而成:
11.酪蛋白酸钠1-20份,
12.果胶1-20份,
13.大豆油50-100份,
14.水200-500份。
15.本发明中负载姜黄素的酪蛋白酸钠-果胶复合物乳状液,是由以下质量份的原料制备而成:
16.酪蛋白酸钠1-20份,
17.果胶1-20份,
18.姜黄素5-10份,
19.大豆油50-100份,
20.水200-500份。
21.本发明中负载β-胡萝卜素的酪蛋白酸钠-果胶复合物乳状液,是由以下质量份的原料制备而成:
22.酪蛋白酸钠1-20份,
23.果胶1-20份,
24.β-胡萝卜素5-10份,
25.大豆油50-100份,
26.水200-500份。
27.本发明中负载槲皮素的酪蛋白酸钠-果胶复合物乳状液,是由以下质量份的原料制备而成:
28.酪蛋白酸钠1-20份,
29.果胶1-20份,
30.槲皮素5-10份,
31.大豆油50-100份,
32.水200-500份。
33.本发明中负载柠檬精油的酪蛋白酸钠-果胶复合物乳状液,是由以下质量份的原料制备而成:
34.酪蛋白酸钠1-20份,
35.果胶1-20份,
36.柠檬精油10-50份,
37.大豆油50-100份,
38.水200-500份。
39.优选的酪蛋白酸钠-果胶复合物乳状液由以下重量份的原料制备而成:
40.酪蛋白酸钠4份,
41.果胶4份
42.大豆油100份
43.水400份。
44.优选的负载姜黄素的酪蛋白酸钠-果胶复合物乳状液由以下重量份的原料制备而成:
45.酪蛋白酸钠4份,
46.果胶4份
47.姜黄素1份
48.大豆油100份
49.水400份。
50.优选的负载β-胡萝卜素的酪蛋白酸钠-果胶复合物乳状液由以下重量份的原料制备而成:
51.酪蛋白酸钠4份,
52.果胶4份
53.β-胡萝卜素1份
54.大豆油100份
55.水400份。
56.优选的负载槲皮素的酪蛋白酸钠-果胶复合物乳状液由以下重量份的原料制备而成:
57.酪蛋白酸钠4份,
58.果胶4份
59.槲皮素1份
60.大豆油100份
61.水400份。
62.优选的负载柠檬精油的酪蛋白酸钠-果胶复合物乳状液由以下重量份的原料制备而成:
63.酪蛋白酸钠4份,
64.果胶4份
65.柠檬精油25份
66.大豆油75份
67.水400份。
68.酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
69.(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的酪蛋白酸钠溶液;
70.(2)将果胶溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的果胶溶液;
71.(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为(1~10):(1~10),然后调节混合溶液的ph=3~5;
72.(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,得到经超声处理后的复合物溶液;
73.(5)制备粗乳液:将油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
74.(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,得到酪蛋白酸钠-果胶复合物乳状液。
75.其中步骤(3)中优选调节混合溶液的ph=4。
76.其中步骤(3)中所述的酪蛋白酸钠和果胶的质量比例优选为5:5。
77.其中步骤(4)中所述的发散式超声工作模式为:单频20khz、35khz、40khz、50khz、60khz,双频20khz/35khz、20khz/40khz、20khz/50khz、20khz/60khz、35khz/50khz、40khz/60khz、三频20khz/40khz/60khz、20khz/35khz/50khz,超声功率密度为10w/l、20w/l、30w/l、40w/l、50w/l;超声时间为:5min、10min、15min、20min、25min、30min。优选的超声条件为:单频60khz、功率为50w/l、时间为25min;双频20khz/40khz、功率为30w/l、时间为25min。
78.其中步骤(6)中所述的聚能式超声工作模式为:单频20khz、28khz,双频20khz/28khz,超声功率为400w/l、800w/l、1200w/l、1600w/l、2000w/l;超声时间为:2min、4min、6min、8min、10min。优选的超声条件为:双频20khz/28khz、功率为1200w/l、时间为8min。
79.负载生物活性成分的酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
80.(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的酪蛋白酸钠溶液;
81.(2)将果胶溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的果胶溶液;
82.(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,
使得酪蛋白酸钠和果胶的质量比例为(1~10):(1~10),然后调节混合溶液的ph=3~5;
83.(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,得到经超声处理后的复合物溶液;
84.(5)制备粗乳液:将生物活性成分溶于大豆油,得到生物活性成分浓度为(1~5)mg/ml的油相,按油相与水相体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
85.(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,得到负载生物活性成分的酪蛋白酸钠-果胶复合物乳状液。
86.其中步骤(3)中优选调节混合溶液的ph=4。
87.其中步骤(3)中所述的酪蛋白酸钠和果胶的质量比例优选为5:5。
88.其中步骤(4)中所述的发散式超声工作模式为:单频20khz、35khz、40khz、50khz、60khz,双频20khz/35khz、20khz/40khz、20khz/50khz、20khz/60khz、35khz/50khz、40khz/60khz、三频20khz/40khz/60khz、20khz/35khz/50khz,超声功率密度为10w/l、20w/l、30w/l、40w/l、50w/l;超声时间为:5min、10min、15min、20min、25min、30min。优选的超声条件为:单频60khz、功率为50w/l、时间为25min。
89.其中步骤(5)中所述的生物活性成分为姜黄素、β-胡萝卜素或者槲皮素。优选的生物活性成分在油相中的浓度为1mg/ml。
90.其中步骤(6)中所述的聚能式超声工作模式为:单频20khz、28khz,双频20khz/28khz,超声功率为400w/l、800w/l、1200w/l、1600w/l、2000w/l;超声时间为:2min、4min、6min、8min、10min。优选的超声条件为:双频20khz/28khz、功率为1200w/l、时间为8min。
91.负载柠檬精油的酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
92.(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的酪蛋白酸钠溶液;
93.(2)将果胶溶解到蒸馏水中,磁力搅拌至完全溶解;得到浓度为(1~10)mg/ml的果胶溶液;
94.(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为(1~10):(1~10),然后调节混合溶液的ph=3~5;
95.(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,得到经超声处理后的复合物溶液;
96.(5)制备粗乳液:将柠檬精油按体积比1:3与大豆油混合,得到混合油相,按油相与水相体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
97.(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,得到负载柠檬精油的酪蛋白酸钠-果胶复合物乳状液。
98.其中步骤(3)中优选调节混合溶液的ph=4。
99.其中步骤(3)中所述的酪蛋白酸钠和果胶的质量比例优选为5:5。
100.其中步骤(4)中所述的发散式超声工作模式为:单频20khz、35khz、40khz、50khz、60khz,双频20khz/35khz、20khz/40khz、20khz/50khz、20khz/60khz、35khz/50khz、40khz/60khz、三频20khz/40khz/60khz、20khz/35khz/50khz,超声功率密度为10w/l、20w/l、30w/
l、40w/l、50w/l;超声时间为:5min、10min、15min、20min、25min、30min。优选的超声条件为:单频60khz、功率为50w/l、时间为25min。
101.其中步骤(6)中所述的聚能式超声工作模式为:单频20khz、28khz,双频20khz/28khz,超声功率为400w/l、800w/l、1200w/l、1600w/l、2000w/l;超声时间为:2min、4min、6min、8min、10min。优选的超声条件为:双频20khz/28khz、功率为1200w/l、时间为8min。
102.本发明的有益效果在于:
103.(1)本发明向酪蛋白酸钠中添加果胶,通过静电相互作用构建蛋白-多糖复合物,形成均匀、粒径小的复合物,并将此复合物作为乳化剂,制备酪蛋白酸钠-果胶复合物乳状液。
104.(2)本发明在制备酪蛋白酸钠-果胶复合物的过程中,使用阶梯式超声波加工装置代替加热,通过超声波的空化效应形成的物理力促进蛋白质和多糖相互作用形成复合物,改变复合物的理化结构,使复合物粒径降低10.2%,乳化性提高32.3%。
105.(3)本发明在制备酪蛋白酸钠-果胶复合物乳状液的过程中,使用了顺序阶梯式超声波处理技术,其克服了传统的单频或者双频超声波难以完全激发物料产生与其自身固有频率相匹配的共振频率,容易产生驻波、超声波空化额减少等缺点。对于蛋白质-多糖乳状液这样复杂的体系,更能激发和调控蛋白大分子结构的展开与多糖进行静电复合,并且可以调控蛋白质-多糖在油水界面的吸附和重排特性,从而影响乳状液的稳定性。相较于昂贵的高压均质法和微射流法,工艺操作简单,制备过程中未涉及高温、高压环境,适宜工业化生产,且原料、设备价格便宜。
106.(4)本发明的酪蛋白酸钠-果胶复合物粒径约为463.97nm,粒径小、粒径分布均匀、乳化性可达12.977m2·
g-1
、稳定性好、生物相容相好等优点,可应用于食品、保健品、药品及化妆品等多个领域。
107.(5)本发明的酪蛋白酸钠-果胶复合物乳状液储藏稳定性好,稳定性指数由25.62%提升至97.13%,受温度、ph等环境条件影响小,对生物活性成分的选择更加广泛。
108.(6)本发明的酪蛋白酸钠-果胶复合物乳状液对生物活性物质的负载能力显著提高,7天时姜黄素保留率由2.224%提高至42.785%,β-胡萝卜素保留率由3.695%提高至35.057%,槲皮素保留率由13.418%提高至48.274%。
附图说明
109.图1为本发明顺序阶梯式频率超声波频率示意图。
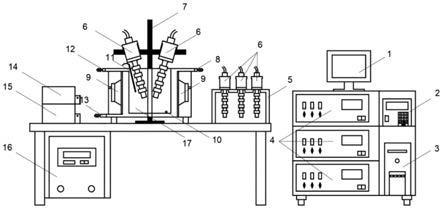
110.图2为本发明的阶梯式超声波加工装置结构图,其中1为显示器、2为超声控制器、3为电脑主机、4为超声波发生器、5为聚能式超声波探头储架、6为聚能式超声波探头、7为可升降探头支架、8为恒温水出口、9为发散式超声波换能器、10为料液出口、11为温度计、12为料液进口、13为恒温水进口、14为料液泵头、15为温控循环泵、16为温控器、17为超声波反应池。
111.图3为本发明制备的复合物红外光谱图。
112.图4为本发明原料及制备的复合物扫描电镜图,其中a1、a2为酪蛋白酸钠,b1、b2为果胶,c1、c2为未超声复合物,d1、d2为60khz超声复合物,e1、e2为20khz/40khz超声复合物。
113.图5为本发明柠檬精油及负载柠檬精油乳状液的气相色谱图,其中a为柠檬精油气
相色谱图,b为未超声的柠檬精油乳状液气相色谱图,c为20khz/28khz超声制备的柠檬精油乳状液气相色谱图。
具体实施方式
114.在本发明中所使用的术语,除非有另外说明,一般都能被本领域普通技术人员理解。下面结合具体的实施例,并参照数据进一步详细地描述本发明。特此说明,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
115.顺序阶梯式超声波是指不同频率的超声波从低频到高频或者从高频到低频依次对物料进行处理的超声波(如图1所示),图2为本发明的一种阶梯式超声波加工装置,包括显示器1、超声控制器2、电脑主机3、超声波发生器4、聚能式超声波探头储架5、聚能式超声波探头6、可升降探头支架7、恒温水出口8、发散式超声波换能器9、料液出口10、温度计11、料液进口12、恒温水进口13、料液泵头14、温控循环泵15、温控器16、超声波反应池17。
116.阶梯式超声加工装置,是一种六边形槽式结构作为反应池17,在超声反应池17器壁外侧的多个发散式超声波换能器9与超声波发生器4相连。超声波发生器4与超声波控制器2相连,超声控制器2可由电脑主机3控制,并在显示器1中显示工作状态。聚能式超声探头6放置在可升降的探头支架7上,与超声波发生器4相连,在不同加工阶段,超声探头6可自由升降,离开或浸入料液。超声反应池17内设有恒温水回流装置,恒温水由温控循环泵15从底部入水口12泵入,由顶部出水口8流出,恒温水温度由与温控仪16相连的温度计11测量得到,并根据与设定温度间温差实时控制调整。超声反应池17内上端和底部分别设有料液进口12和料液出口9,料液由料液泵头14泵入,反应结束后,料液由料液出口19流出。
117.实施例1:
118.酪蛋白酸钠-果胶复合物的制备方法,按照下述步骤进行:
119.(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
120.(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
121.(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
122.(4)将步骤(3)得到的复合物溶液放入多模式平板式超声设备中,进行发散式超声处理,超声条件为:单频20khz、35khz、40khz、50khz、60khz,双频20khz/35khz、20khz/40khz、20khz/50khz、20khz/60khz、35khz/50khz、40khz/60khz、三频20khz/40khz/60khz、20khz/35khz/50khz,超声功率密度为30w/l;超声时间为:20min;
123.(5)将复合物溶液冷冻干燥后,得到酪蛋白酸钠-果胶复合物。
124.测定方法:(1)复合物粒径测定:将已制备的酪蛋白酸钠-果胶复合物溶液置于25℃下平衡5min,将制备好的样品按1:10比例稀释。使用litesizertm500型激光粒度仪测定复合物的粒径、多分散性指数。
125.(2)复合物浊度测定:用紫外可见光分光光度计在600nm下测定酪蛋白酸钠-果胶复合物溶液的浊度。将样品放置于1cm光程的样品池中,在25℃下测量浊度,每个样品平行测定三次,取平均值。
126.(3)复合物乳化性、乳化稳定性测定:取20ml复合物溶液加入5ml大豆油混合,以12000r/min高速分散2min,静置,在0min和30min时从容器底部取50μl乳状液于试管中,加4.95ml质量分数为1%的sds溶液,在500nm处测定吸光度。式中:a0为零时刻的吸光度;c为复合物溶液质量浓度,g/ml;为油相体积分数;a
30
为静置30min后的吸光度。
127.esi=100
×a30
/a0128.通过表1对比不同超声频率对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响可以看出,与对照组相比(未超声),可以发现超声处理可以显著降低复合物的粒径和浊度、提高复合物乳化性和乳化稳定性。当超声条件为60khz或20/40khz时,粒径分别降低14.9%和13.5%,乳化性分别提高33.1%和35.1%。
129.表1表示不同频率超声对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响
[0130][0131]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0132]
实施例2:
[0133]
酪蛋白酸钠-果胶复合物的制备方法,按照下述步骤进行:
[0134]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0135]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0136]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0137]
(4)将步骤(3)得到的复合物溶液放入多模式平板式超声设备中,进行发散式超声处理,超声条件为:单频60khz、双频20/40khz,超声功率密度为10w/l、20w/l、30w/l、40w/l、
50w/l;超声时间为:20min;
[0138]
(5)将复合物溶液冷冻干燥后,得到酪蛋白酸钠-果胶复合物;
[0139]
测定方法:同实施例1。
[0140]
通过表2对比不同超声功率密度对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响可以看出,与对照组相比(未超声),可以发现60khz超声处理可以显著降低复合物的粒径和浊度、提高复合物乳化性和乳化稳定性。当超声功率密度为50w/l时,粒径降低26.4%,乳化性提高33.1%。
[0141]
通过表3对比不同超声功率密度对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响可以看出,与对照组相比(未超声),可以发现20khz/40khz超声处理可以显著降低复合物的粒径和浊度、提高复合物乳化性和乳化稳定性。当超声功率密度为30w/l时,粒径降低19.5%,乳化性提高28.9%。
[0142]
表2功率密度对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响(60khz)
[0143][0144]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0145]
表3功率密度对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响(20khz/40khz)
[0146][0147]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0148]
实施例3:
[0149]
酪蛋白酸钠-果胶复合物的制备方法,按照下述步骤进行:
[0150]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0151]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0152]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0153]
(4)将步骤(3)得到的复合物溶液放入多模式平板式超声设备中,进行发散式超声处理,超声条件为:单频60khz 50w/l,双频20/40khz 30w/l;超声时间为:5min、10min、15min、20min、25min、30min;
[0154]
(5)将复合物溶液冷冻干燥后,得到酪蛋白酸钠-果胶复合物;
[0155]
测定方法:同实施例1。
[0156]
通过表4、表5对比不同超声时间对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响可以看出,与对照组相比(未超声),可以发现60khz超声处理可以显著降低复合物的粒径和浊度、提高复合物乳化性和乳化稳定性。当超声时间为25min时,粒径降低20.9%,乳化性提高33.1%。20khz/40khz超声处理可以显著降低复合物的粒径和浊度、提高复合物乳化性和乳化稳定性。当超声时间为25min时,粒径降低10.2%,乳化性提高32.2%。
[0157]
表4超声时间对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响(60khz)
[0158][0159]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0160]
表5超声时间对酪蛋白酸钠-果胶复合物粒径、浊度、乳化性、乳化稳定性的影响(20khz/40khz)
[0161][0162]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0163]
复合物红外光谱测定:在4000~500cm-1
的波数范围内进行样品的红外光谱分析,分辨率为4cm-1
,扫描次数64次。试验结果使用omnic离线软件进行处理与分析。
[0164]
由图3可知,在酪蛋白酸钠ft-ir曲线中,3301.33cm-1
处的吸收峰主要是n-h的伸缩振动和部分o-h的伸缩振动叠加后的宽峰,2962.52cm-1
处的吸收峰为c-h的伸缩振动引起,1657.22cm-1
处的吸收峰为酰胺i带-c=o的伸缩振动引起,1536.21cm-1
处的吸收峰为酰胺ii带c-n的伸缩振动和n-h的弯曲振动引起,1240.27、1083.49cm-1
处为c-o的伸缩振动。在果胶ft-ir曲线中,3419.00cm-1
处的强宽峰是由于o-h伸缩振动引起的,另一处弱吸收峰(2931.40cm-1
)是c-h伸缩振动引起的。在1614.36cm-1
处的吸收峰是-cooh引起的。在1101.26、1018.05cm-1
处的吸收峰为呋喃糖的特征吸收峰。在1744.55cm-1
处有典型的糖醛酸的特征吸收峰。在酪蛋白酸钠-果胶复合物ft-ir曲线中,复合物o-h伸缩振动峰较蛋白和果胶红移至3286.58cm-1
,说明二者复合物分子中存在较强的氢键作用力。在2958.51cm-1处保留了酪蛋白酸钠的c-h伸缩振动引起的的吸收峰,但轻微蓝移,表明二者的结合引起了c-h空间结构的变化。酪蛋白酸钠在1083cm-1处的c-o伸缩振动和果胶1744.55cm-1处的糖醛酸特征吸收峰1614.36cm-1
处羧基的吸收峰消失,酰胺i带-c=o的伸缩振动峰红移至1653.95cm-1
,表明酪蛋白酸钠和果胶形成了相对稳定的二元复合物,并存在较强的静电相互作用力。经超声处理后,复合物o-h伸缩振动峰分别从3286.58cm-1
蓝移至3288.14和3290.79cm-1
,c-h伸缩振动峰从2958.51cm-1
分别蓝移至2959.52和2958.78cm-1
说明超声作用使复合物的结构更加紧凑、稳定。超声处理后,酰胺ⅰ带发生了较小偏移,说明复合物空间结构的变化,影响到了复合物内的静电相互作用力。
[0165]
复合物微观结构测定:酪蛋白酸钠-果胶复合物的表面结构通过扫描电子显微镜(sem)观察,将制备好的20μl样品滴加到5mm
×
5mm的抛光硅片上,自然风干后固定于样品台上,在15kv的加速电压下进行观察。
[0166]
图4通过sem观察了酪蛋白酸钠、果胶、酪蛋白酸钠-果胶复合物及超声处理后的复合物的微观结构。酪蛋白酸钠表现出光滑的球形颗粒。果胶表现为光滑、片状结构。酪蛋白酸钠、果胶通过静电作用力形成复合物,复合物仍为球状结构,但由于果胶分子间的黏连,复合物之间出现了粘结聚集情况。对复合物进行超声处理后,复合物两亲性改变,复合物间聚集情况得到改善,复合物颗粒形态均匀、粒径减小。
[0167]
实施例4:
[0168]
酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0169]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0170]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0171]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0172]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0173]
(5)制备粗乳液:将油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
[0174]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为:单频20khz、28khz,双频20khz/28khz,超声功率密度为600w/l,超声时间为6min,得
到酪蛋白酸钠-果胶复合物乳状液。
[0175]
测定方法:
[0176]
乳液粒径测定:采用mastersizer 3000粒度分布仪测定乳液滴的粒径大小。以水为分散剂,采用通用分析模式,部分参数如下:颗粒折射率1.47,颗粒吸收率0.001,分散剂折射率1.330,搅拌器的转速2500r/min。每次测定重复3次取平均值。
[0177]
乳液浊度测定:将不同超声条件制备的酪蛋白酸钠-果胶复合物乳状液稀释100倍,在500nm处测定样品的吸光度a500。每个样品测量3次。
[0178]
乳液稳定性指数测定:取40ml制得的酪蛋白酸钠-果胶复合物乳状液,在4000r/min条件下离心10min,等待乳状液分为两层,即上层为乳液层,清液层位于下部,测量上下两层的高度,并计算乳液稳定性指数。式中,hs为上层乳液层高度,cm;h
t
为总高度,cm。
[0179][0180]
界面蛋白含量测定:考马斯亮蓝法参考sn/t 3926-2014。
[0181]
界面多糖含量测定:1ml样品,加入0.5ml 0.1%咔唑-乙醇溶液,加入6ml浓硫酸,混匀后,置于80℃下水浴5min后测定其在530nm处的吸光度值,参照标准曲线计算出多糖含量。参照如下公式计算界面蛋白/多糖含量:
[0182][0183][0184]
其中,cw为乳状液中总蛋白/多糖浓度,cs为离心后下层清液中蛋白/多糖浓度,为乳状液中油相的体积分数,d
3,2
为乳状液油滴的表面积平均粒径。
[0185]
通过表6对比超声乳化和高速剪切对酪蛋白酸钠-果胶复合物乳状液粒径、浊度a
500
、稳定性指数、界面蛋白/多糖含量的影响可以看出,与对照组相比(未超声,只高速剪切),可以发现20khz/28khz超声处理可以显著降低乳液粒径,提高界面蛋白/多糖吸附量,进而提高乳液稳定性,相较于对照组稳定性指数提高约279.7%。
[0186]
表6超声频率对乳状液粒径、浊度、稳定性指数、界面蛋白含量、界面多糖含量的影响
[0187][0188]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0189]
实施例5:
[0190]
酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0191]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0192]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0193]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0194]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0195]
(5)制备粗乳液:将油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
[0196]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为400w/l、800w/l、1200w/l、1600w/l、2000w/l,超声时间为6min,得到酪蛋白酸钠-果胶复合物乳状液。
[0197]
测定方法:同实施例4。
[0198]
通过表7对比不同超声功率密度对酪蛋白酸钠-果胶复合物乳状液粒径、浊度a
500
、稳定性指数、界面蛋白/多糖含量的影响可以看出,与对照组相比(未超声,只高速剪切),可以发现当功率密度达到1200w/l时,乳液粒径、浊度不再显著减小,界面蛋白/多糖吸附量不再显著提高,此时乳液稳定性好,相较于对照组稳定性指数提高约269.1%。
[0199]
表7超声功率密度对乳状液粒径、浊度、稳定性指数、界面蛋白含量、界面多糖含量的影响
[0200][0201]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0202]
实施例6:
[0203]
酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0204]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0205]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0206]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0207]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0208]
(5)制备粗乳液:将油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物
溶液用高速剪切均质机均质,均质机转速12000rpm,均质2min形成粗乳液;
[0209]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为1200w/l,超声时间为2min、4min、6min、8min、10min,得到酪蛋白酸钠-果胶复合物乳状液。
[0210]
测定方法:同实施例4。
[0211]
通过表8对比不同超声时间对酪蛋白酸钠-果胶复合物乳状液粒径、浊度a
500
、稳定性指数、界面蛋白/多糖含量的影响可以看出,与对照组相比(未超声,只高速剪切),可以发现当超声时间达到8min时,乳液粒径、浊度不再显著减小,界面蛋白/多糖吸附量趋近饱和,乳液稳定性好,较对照组稳定性指数提高约279.1%。
[0212]
表8超声时间对乳状液粒径、浊度、稳定性指数、界面蛋白含量、界面多糖含量的影响
[0213][0214]
注:每个数值均以平均值
±
标准差表示,同一列中的字母(a,b,c,d)表示具有显著差异(p《0.05)。
[0215]
实施例7:
[0216]
负载姜黄素酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0217]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0218]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0219]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0220]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0221]
(5)制备粗乳液:将姜黄素溶于大豆油中,将含姜黄素的油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液中,用高速剪切均质机均质,转速12000rpm,均质2min得到含姜黄素为1mg/ml的粗乳液;
[0222]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为1200w/l,超声时间为8min,得到负载姜黄素的酪蛋白酸钠-果胶复合物乳状液。
[0223]
测定方法:
[0224]
姜黄素包埋率及保留率测定:取0.5ml的新鲜或储存7天的乳状液样品,加入4.5ml无水乙醇震荡破乳,在12000rpm下离心15min,取离心后的上清液,以无水乙醇溶液作空白
参比测定其吸光度,代入姜黄素标准曲线方程中,计算出样品的姜黄素的含量。姜黄素的包埋率或保留率按下式计算:
[0225][0226]
式中:x1—姜黄素的包埋率或保留率/%;m1—乳状液中的姜黄素质量/μg;m2—初始添加姜黄素的质量/μg。
[0227]
dpph自由基清除率测定:取2ml乳状液加入2ml浓度为0.1mm的dpph乙醇溶液,充分混匀,在室温下避光反应30min。经12000rpm离心10min后取上清液用紫外分光光度计在517nm波长处测定其吸光度值。dpph清除率计算公式如下:
[0228][0229]
式中:a0—dpph溶液与无水乙醇溶液混合后的吸光度;a1—样品溶液与乙醇溶液混合后的吸光度;a2—样品溶液与dpph溶液混合后的吸光度。
[0230]
通过表9可以看出,超声均质乳液对姜黄素的负载能力较未超声(分散均质)略微提高,但对姜黄素保留率提高较为显著,由2.22%提高至42.78%,说明用超声制备的乳液对生物活性成分有这更好的递送潜力。
[0231]
表9乳化方式对姜黄素包埋率、保留率、自由基清除率的影响
[0232][0233]
实施例8:
[0234]
负载β-胡萝卜素的酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0235]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0236]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0237]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0238]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0239]
(5)制备粗乳液:将β-胡萝卜素溶于大豆油中,将含β-胡萝卜素的油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液中,用高速剪切均质机均质,转速12000rpm,均质2min得到含姜黄素为1mg/ml的粗乳液;
[0240]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为1200w/l,超声时间为8min,得到负载β-胡萝卜素的酪蛋白酸钠-果胶复合物乳状液。
[0241]
测定方法:
[0242]
β-胡萝卜素包埋率及保留率测定:将0.5ml的乳液中加入4.5ml的正己烷,在旋涡
振荡器上振荡30s。混合均匀后在12000rpm下离心15min。取上清液,在450nm下测定β-胡萝卜素的吸光值,根据标准曲线计算出β-胡萝卜素的浓度及含量,用以下公式计算包埋率或保留率:
[0243][0244]
式中:x2—β-胡萝卜素的包埋率或保留率/%;m3—乳状液中β-胡萝卜素的质量/μg;m4—初始添加β-胡萝卜素的质量/μg。
[0245]
dpph自由基清除率测定:同实施例7。
[0246]
通过表10可以看出,超声均质乳液对β-胡萝卜素的负载能力较未超声(分散均质)略微提高,但对β-胡萝卜素保留率提高较为显著,由4.76%提高至62.32%,说明用超声制备的乳液对生物活性成分有这更好的递送潜力。
[0247]
表10乳化方式对β-胡萝卜素包埋率、保留率、自由基清除率的影响
[0248][0249]
实施例9:
[0250]
负载槲皮素的酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0251]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0252]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0253]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为:5:5,然后调节混合溶液的ph=4;
[0254]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0255]
(5)制备粗乳液:将槲皮素溶于大豆油中,将含槲皮素的油相按体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液中,用高速剪切均质机均质,转速12000rpm,均质2min得到含姜黄素为1mg/ml的粗乳液;
[0256]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为1200w/l,超声时间为8min,得到负载槲皮素的酪蛋白酸钠-果胶复合物乳状液。
[0257]
测定方法:
[0258]
槲皮素包埋率及保留率测定:将0.5ml的乳液中加入4.5ml的无水乙醇中,在旋涡振荡器上振荡30s。混合均匀后在12000rpm下离心15min。取上清液于375nm测定吸光度根据标准曲线计算包裹的槲皮素含量。
[0259][0260]
式中:x3—槲皮素的包埋率或保留率/%;m5—乳状液中槲皮素的质量/μg;m6—初始添加槲皮素的质量/μg。
[0261]
dpph自由基清除率测定:同实施例7。
[0262]
通过表11可以看出,超声均质乳液对槲皮素的负载能力较未超声(分散均质)略微提高,但对槲皮素保留率提高较为显著,由13.42%提高至48.27%,说明用超声制备的乳液对生物活性成分有这更好的递送潜力。
[0263]
表11乳化方式对槲皮素包埋率、保留率、自由基清除率的影响
[0264][0265]
实施例10:
[0266]
负载柠檬精油酪蛋白酸钠-果胶复合物乳状液的制备方法,按照下述步骤进行:
[0267]
(1)将酪蛋白酸钠溶解到蒸馏水中,磁力搅拌至蛋白完全溶解;得到浓度为10mg/ml的酪蛋白酸钠溶液;
[0268]
(2)将果胶溶解到水溶液中,磁力搅拌至完全溶解;得到浓度为10mg/ml的果胶溶液;
[0269]
(3)将步骤(2)果胶溶液按体积比1:1比例逐滴加入到步骤(1)酪蛋白酸钠溶液中,使得酪蛋白酸钠和果胶的质量比例为5:5,然后调节混合溶液的ph=4;
[0270]
(4)将步骤(3)得到的复合物溶液放入阶梯式超声波加工装置中,进行发散式超声处理,超声条件为:单频60khz,超声功率密度为50w/l;超声时间为25min;
[0271]
(5)制备粗乳液:将柠檬精油按体积比1:3与大豆油混合,得到混合油相,按油相与水相体积比1:4加入步骤(4)得到的经超声处理后的复合物溶液中,用高速剪切均质机均质,转速12000rpm,均质2min得到含柠檬精油为5%的粗乳液;
[0272]
(6)超声乳化:将粗乳液置于阶梯式超声波加工装置中进行聚能式超声处理,超声条件为双频20khz/28khz,超声功率密度为1200w/l,超声时间为8min,得到含柠檬精油的酪蛋白酸钠-果胶复合物乳状液。
[0273]
测定方法:
[0274]
柠檬精油乳化率测定:根据gb1886.22-2016做出适当修改,采用内标法测定乳状液中柠檬精油的含量。检测条件:毛细管柱db-ffap,长30m,内径0.53mm;色谱炉温度:70℃恒温5min;然后以20℃/min线性程序升温从70℃至90℃恒温3min;再以10℃/min线性程序升温从90℃至120℃恒温3min;最后以20℃/min线性程序升温从120℃至230℃恒温3min;进样口温度:250℃;检测器温度280℃;检测器:氢火焰离子化检测器;进样量1.0μl;载气为高纯氮,流速20.0ml/min;空气300ml/min;氢气30ml/min。
[0275]
试样中柠檬精油含量的计算公式如下:
[0276]
f=(as/ms)/(ar/mr) mi=f
×ai
/(as/ms[0277]
其中as和ar分别为内标物和对照品的峰面积,ms和mr分别为内标物和对照品的量;ai和as分别为样品和内标物的峰高,ms为加入内标物的量。
[0278]
表12乳化方式对负载精油乳状液dpph清除率的影响
[0279][0280]
通过表12可以看出,经过本发明超声处理的乳状液对柠檬精油的乳化率有显著提高,相较于分散均质样品,乳化率提高至72.89%,dpph清除率提高至68.11%。
