1.本发明涉及一种用于预防或治疗肌炎的药物组合物,其包含线粒体作为有效成分。
背景技术:
2.肌炎是一种在肌肉中发生炎症并且肌肉纤维受损的疾病,导致肌肉疼痛和肌肉收缩能力降低。肌炎分为皮肌炎、多发性肌炎和包涵体肌炎,其中多发性肌炎和皮肌炎是炎性肌病,其中出现了靠近躯干的四肢肌肉力量降低、肌肉酶水平增加、炎性细胞因子表达增加、肌电图异常、肌肉活检异常等症状。
3.此外,由于多发性肌炎和皮肌炎引起的肌肉无力大多在数周或数月内逐渐进展,但在极少数的情况下,其进展迅速。如果不治疗严重的肌无力,它将导致肌肉损失。据报道,约15%至30%的多发性肌炎患者伴有恶性肿瘤,当老年人发生皮肌炎时,癌症也随之发展。
4.类固醇、免疫抑制剂或免疫调节剂用于治疗多发性肌炎和皮肌炎。类固醇是早期治疗最常用的药物,根据对类固醇治疗的反应和副作用来决定是否使用免疫抑制剂。除类固醇外,约75%的肌炎患者开具了额外的免疫抑制剂。近来,已经证明作为免疫调节剂,用于静脉内给药的免疫球蛋白具有改善皮肌炎中的肌肉强度以及肌肉活检中显示的体征的作用,因此其用于皮肌炎。然而,免疫抑制剂和免疫调节剂的缺点是直接参与免疫系统,因此可能会产生副作用,而且药物的作用不会持续很长时间,因此必须每6至8周重复注射药物。
5.此外,近来,已经开发了肌炎诱导的小鼠模型并将其用于开发肌炎的治疗剂。具体而言,在2007年,单次施用重组骨骼肌快速型c蛋白能够在c57bl/6小鼠中诱导多发性肌炎,并提出了尝试研究针对肌炎的疾病特异性治疗方法的可能性(sugiharat等人,arthritis rheum.2007,56(4):1304-14)。肌炎诱导的小鼠模型已经用于评估免疫抑制剂对针对cxcl10(c-x-c基序趋化因子10)的肌炎治疗的作用,cxcl是在多发性肌炎的肌肉组织中表达增加的趋化因子(kim等人,arthritis research&therapy 2014,16:r126)。
6.另一方面,线粒体是真核细胞的细胞器,参与胞内能量源三磷酸腺苷(atp)的合成和调节。线粒体与多种体内代谢途径相关,例如细胞信号传导、细胞分化、细胞死亡以及细胞周期和细胞生长的控制。
具体实施方式
7.技术问题
8.已经进行了治疗肌炎的研究,但是所开发的药物存在副作用发生或需要定期注射的问题,因此,迄今为止还没有开发出创新的治疗方法。因此,需要持续研究和开发安全有效的肌炎治疗剂。
9.因此,本发明的目的是提供一种用于治疗肌炎的药物组合物和使用其治疗肌炎的
方法。
10.问题的解决方案
11.为了解决上述问题,本发明的一个方面提供了一种用于预防或治疗肌炎的药物组合物,其包含线粒体作为有效成分。
12.本发明的另一方面提供了一种用于预防或治疗肌炎的方法,其包括向受试者施用药物组合物的步骤。
13.发明效果
14.当将包含线粒体作为有效成分的本发明所述的药物组合物施用于患有肌炎的受试者时,可以减少浸润到受试者肌细胞中的炎性细胞。此外,本发明所述的药物组合物可以有效地降低其中发生肌炎的肌肉组织的炎性细胞因子的表达。因此,根据本发明的药物组合物可有效地用于预防或治疗肌炎。
附图说明
15.图1是显示在分离自脐带来源的间充质干细胞的线粒体中atp合成量的测量的图。
16.图2是显示在分离自脐带来源的间充质干细胞的线粒体中膜电位活性的测量的图。
17.图3是显示在分离自脐带来源的间充质干细胞的线粒体中活性氧簇(ros)的测量的图。
18.图4是用于证实使用肌炎诱导的小鼠根据线粒体的施用治疗肌炎的效果的初级动物实验计划的示意图。
19.图5是在阴性对照组、阳性对照组和实验组中用h&e(苏木精和曙红)染色的四头肌和腘绳肌的照片,所述实验组施用外源线粒体以鉴定浸润到肌纤维中的炎性细胞。
20.图6是显示在阴性对照组、阳性对照组和施用外源线粒体的实验组中,在用h&e染色四头肌后浸润到肌纤维中的炎性细胞的数量的测量和评分的图。
21.图7是显示正常组、阴性对照组、阳性对照组和施用线粒体的实验组中小鼠血液中il-6浓度的图。
22.图8是阴性对照组、阳性对照组和施用外源线粒体的实验组中小鼠的pet/mri照片。
23.图9显示在肌炎诱导的小鼠模型中移植线粒体后线粒体活性增加。
24.图10是用于证实使用肌炎诱导的小鼠根据外源线粒体的施用治疗肌炎的效果的二级动物实验计划的示意图。
25.图11是在阴性对照组、阳性对照组和实验组中用h&e染色的四头肌的照片,所述实验组施用外源线粒体以鉴定浸润到肌纤维中的炎性细胞。
26.图12是在阴性对照组、阳性对照组和实验组中用h&e染色的和腘绳肌的照片,所述实验组施用外源线粒体以鉴定浸润到肌纤维中的炎性细胞。
27.图13是显示在阴性对照组、阳性对照组和施用外源线粒体的实验组中,在用h&e染色四头肌后浸润到肌纤维中的炎性细胞的数量的测量和评分的图。
28.图14是显示正常组、阴性对照组、阳性对照组和施用外源线粒体的实验组中小鼠血液中il-1β浓度的图。
29.图15是显示正常组、阴性对照组、阳性对照组和施用外源线粒体的实验组中小鼠血液中il-6浓度的图。
30.图16是显示正常组、阴性对照组、阳性对照组和施用外源线粒体的实验组中小鼠血液中tnf-α浓度的图。
31.图17是显示正常组、阴性对照组、阳性对照组和施用外源线粒体的实验组中小鼠肌肉中il-6mrna的表达量的图。
32.图18是用于证实使用肌炎诱导的小鼠根据外源线粒体的施用治疗肌炎的效果的三级动物实验计划的示意图。
33.图19证实了在肌炎诱导的小鼠模型中移植线粒体后,用h&e(苏木精&曙红)染色的炎性细胞的数量减少。
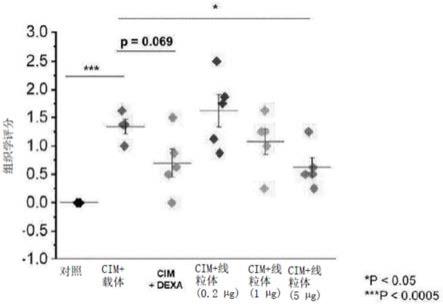
34.图20证实了在肌炎诱导的小鼠模型中移植线粒体后,根据评分系统的组织学评分降低。
35.图21显示了在肌炎诱导的小鼠模型中移植线粒体后炎性细胞因子的数量减少。
36.图22显示了在肌炎诱导的小鼠模型中移植线粒体后线粒体活性增加。
37.图23显示了在肌炎诱导的小鼠模型中移植线粒体后,通过代谢组分析的肌肉热力分布图的分析结果——骨骼肌的总代谢物的增加和减少。
38.图24至27证实,在肌炎诱导的小鼠模型中移植线粒体后,通过代谢组分析,苹果酸和天冬氨酸的相对定量值比率显著增加并恢复至对照组的水平。
39.图28是比较分离自冷冻保存的脐带来源间充质干细胞的线粒体的atp活性与分离自培养的脐带来源间充质干细胞的线粒体的atp活性的图。
40.图29是比较分离自冷冻保存的脐带来源间充质干细胞的线粒体的atp活性与分离自培养的脐带来源间充质干细胞的线粒体的膜电位的图。
41.图30是显示分离自冷冻保存的脐带来源间充质干细胞的线粒体的atp活性与分离自培养的脐带来源间充质干细胞的线粒体的活性氧簇的测量图。
42.图31是使用粒子计数器(multisizer 4e,beckman coulter)测量含有浓度为1μg/ml的线粒体的溶液中的线粒体数量的图。
43.图32是使用粒子计数器测量含有浓度为2.5μg/ml的线粒体的溶液中的线粒体数量的图。
44.图33是使用粒子计数器测量含有浓度为5μg/ml的线粒体的溶液中的线粒体数量的图。
45.图34是证实在lps活化的raw264.7细胞中抑制来自几种细胞的线粒体的tnf-α、il-1β和il-6mrna表达的能力的图。
46.图35是观察在用lps活化的thp-1细胞中来自几种细胞的线粒体抑制il-6的mrna表达的能力的图。
47.图36是观察在lps活化的thp-1细胞中来自数种细胞的线粒体对il-6蛋白表达的抑制能力的图。
48.图37显示了在代谢组分析中使用的肌肉信息。
49.实施本发明的最佳方式
50.在下文中,将详细描述本发明。
51.本发明的一个方面提供了用于预防或治疗肌炎的药物组合物,其包含线粒体作为有效成分。
52.如本文所用,术语“肌炎(myositis)”是指其中肌肉中发生炎症并且肌肉纤维受损的疾病。具体而言,肌炎分为皮肌炎、多发性肌炎和包涵体肌炎,其中多发性肌炎和皮肌炎属于炎性肌病。炎性细胞因子或趋化因子如cxcl10、il-1β、tnf-α、il-6等在多发性肌炎或皮肌炎的肌肉组织中的表达增加。正在开发抑制cxcl10、il-1β、tnf-α或il-6的免疫抑制剂或免疫调节剂作为肌炎的治疗剂。然而,在免疫抑制剂或免疫调节剂的情况下,存在由于直接参与免疫系统而发生副作用的问题。
53.此外,肌炎诱导的小鼠模型可用于开发肌炎的治疗剂。可以通过皮内注射含有c蛋白片段和热灭活的乳酪分枝杆菌(mycobacterium butyricum)的cfa(完全弗氏佐剂)和腹膜内注射pt(百日咳毒素)产生肌炎诱导的小鼠模型。在这种情况下,cd8t细胞在注射药物后7天迁移,且可能发生浸润到肌肉中而引起炎症。在这种情况下,由于在肌炎患者的肌肉中观察到炎症和炎性细胞的组织是四头肌和腘绳肌,所以四头肌和腘绳肌的组织也可用于肌炎诱导的小鼠。
54.除非在本说明书中另有说明,否则术语“有效成分(active ingredient)”是指单独或与本身不具有活性的佐剂(载体)组合表现出活性的成分。
55.如实验实施例所示,在c蛋白诱导的肌炎小鼠模型(cim)的肌肉中使用ce-tofms分析四头肌(白肌)和比目鱼肌(红肌)的代谢组学谱图(metabolomic profiles)。在肌炎诱导组中,苹果酸和天冬氨酸的比例降低,并且基于如上所述,证实存在线粒体损伤。实验结果表明,通过确定注射若干剂量外源线粒体效力的试验,在cim小鼠模型中炎症得到改善,线粒体损伤得到恢复。
56.线粒体可以从哺乳动物获得,并且也可以从人获得。具体地,可以从细胞或组织中分离线粒体。例如,可以从体外培养的细胞中分离线粒体。另外,线粒体可以从体细胞、生殖细胞、血细胞或干细胞获得。另外,线粒体可以从血小板获得。线粒体可以是从其中线粒体的生物活性正常的细胞获得的正常线粒体。此外,可以在体外培养线粒体。
57.另外,线粒体可以从自体、同种异体或异种受试者获得。具体地,自体线粒体是指从相同受试者的组织或细胞获得的线粒体。此外,异源线粒体是指从与受试者属于相同物种并且具有不同等位基因基因型的受试者获得的线粒体。此外,异种线粒体是指从与受试者属于不同物种的受试者获得的线粒体。
58.具体地,体细胞可以是肌肉细胞、肝细胞、神经细胞、成纤维细胞、上皮细胞、脂肪细胞、骨细胞、白细胞、淋巴细胞、血小板或粘膜细胞。此外,生殖细胞是经历减数分裂和有丝分裂的细胞,并且可以是精子或卵子。此外,干细胞可以是选自间充质干细胞、成体干细胞、诱导多能干细胞、胚胎干细胞、骨髓干细胞、神经干细胞、角膜缘干细胞和组织来源的干细胞构成的组中的任一种。在这种情况下,间充质干细胞可以是选自脐带、脐带血、骨髓、脂肪、肌肉、神经、皮肤、羊膜和胎盘构成的组中的任一种。
59.另一方面,当从特定细胞分离线粒体时,可以通过各种已知方法(例如,使用特定的缓冲溶液或使用电势差和磁场等)分离线粒体。
60.就保持线粒体的活性而言,可以通过破碎和离心细胞分离线粒体。在一个实施方案中,可以通过以下步骤进行:培养细胞并对包含细胞的药物组合物进行第一次离心以产
生沉淀,将沉淀再悬浮于缓冲溶液中并将其均化,对均化的溶液进行第二次离心以产生上清液,以及对上清液进行第三次离心以纯化线粒体。在这种情况下,就保持细胞活性而言,优选将进行第二次离心的时间调节为短于进行第一次离心和第三次离心的时间,并且可以从第一次离心到第三次离心增加速度。
61.具体地,第一次至第三次离心可以在0至10℃的温度下、优选在3至5℃的温度下进行。另外,进行离心的时间可以是1分钟至50分钟,并且可以根据离心的次数和样品的含量等适当地调节。
62.此外,第一次离心可以以100
×
g至1,000
×
g、或200
×
g至700
×
g、或300
×
g至450
×
g的速度进行。此外,第二次离心可以以1
×
g至2,000
×
g、或25
×
g至1,800
×
g、或500
×
g至1,600
×
g的速度进行。此外,第三次离心可以以100
×
g至20,000
×
g、或500
×
g至18,000
×
g、或800
×
g至15,000
×
g的速度进行。
63.分离的线粒体可以通过定量蛋白质来定量。具体地,分离的线粒体可以通过bca(二喹啉甲酸测定)分析定量。在这种情况下,药物组合物中的线粒体浓度可以为0.1μg/ml至1,000μg/ml、1μg/ml至750μg/ml或25μg/ml至500μg/ml。在本发明的一个实施例中,其以25μg/ml、50μg/ml和100μg/ml的浓度使用。
64.另外,分离的线粒体的数量可以通过粒子计数器(multisizer 4e,beckman coulter)测量,并且线粒体的数量可以如下表1中所示,参考由james d.mccully撰写的论文(j vis exp.2014;(91):51682)。
65.[表1]
[0066]
分离的线粒体的量(μg)线粒体的数量浓度(μg/ml)0.012.16
×
105±
0.01
×
1050.112.16
×
107±
0.08
×
10710250.54
×
109±
0.02
×
109250501.08
×
109±
0.04
×
1095001002.16
×
109±
0.08
×
1091,000
[0067]
如本发明实施例9所示,使用粒子计数器测量浓度为1μg/ml、2.5μg/ml和5μg/ml的线粒体的数量,测量结果为1.96
×
106±
0.98
×
106、5.97
×
106±
0.19
×
106和1.01
×
107±
0.32
×
107。与上表1相比,证实了浓度为10μg/ml的线粒体数量为2.16
×
107±
0.08
×
107,这与将浓度为5μg/ml的线粒体数量乘以2得到的2.02
×
107±
0.64
×
107相似。在这种情况下,药物组合物中线粒体的含量可以为1
×
105线粒体/ml至5
×
109线粒体/ml。具体地,药物组合物中的线粒体含量可为1
×
105线粒体/ml至5
×
109线粒体/ml、2
×
105线粒体/ml至2
×
109线粒体/ml、5
×
105线粒体/ml至1
×
109线粒体/ml、1
×
106线粒体/ml至5
×
108线粒体/ml、2
×
106线粒体/ml至2
×
108线粒体/ml、5
×
106线粒体/ml至1
×
108线粒体/ml、或1
×
107线粒体/ml至5
×
107线粒体/ml。药物组合物可以包括上述范围的浓度和含量的线粒体,因此易于在施用时调节线粒体的剂量,并且可以进一步提高患者肌炎症状改善的程度。
[0068]
特别地,包含在药物组合物中的线粒体的治疗有效剂量可以是3
×
105线粒体/kg至1.5
×
10
10
线粒体/kg,作为基于待施用的受试者的体重的一个剂量。具体地,包含在药物组合物中的线粒体的治疗有效剂量可以是3
×
105线粒体/kg至1.5
×
10
10
线粒体/kg、6
×
105线粒体/kg至6
×
109线粒体/kg、1.5
×
106线粒体/kg至3
×
109线粒体/kg、3
×
106线粒体/kg
至1.5
×
109线粒体/kg、6
×
106线粒体/kg至6
×
108线粒体/kg、1.5
×
107线粒体/kg至3
×
108线粒体/kg或3
×
107线粒体/kg至1.5
×
108线粒体/kg,作为基于待施用的受试者的体重的一个剂量。即,就细胞活性而言,最优选基于肌炎受试者的体重在上述待施用的线粒体剂量范围内施用包含线粒体的药物组合物。
[0069]
此外,药物组合物可施用1至10次、3至8次或5至6次,并且优选地可施用5次。在这种情况下,施用间隔可以是1至7天或2至5天,优选3天。
[0070]
此外,本发明的药物组合物可施用于易患肌炎或患有此类疾病或病症的人或其他哺乳动物。此外,药物组合物可以是可静脉内、肌内或皮下施用的注射剂,并且优选可以是可注射制剂。
[0071]
因此,本发明的药物组合物可以制成注射剂,其通过使用缓冲溶液如酸性水溶液或磷酸盐调节ph而在物理上或化学上非常稳定,所述缓冲溶液可以用于注射剂中,以确保根据处方注射剂的分布的产品稳定性。
[0072]
具体地,本发明的药物组合物可包含注射用水。注射用水是指用于溶解固体注射剂或稀释水溶性注射剂的蒸馏水。
[0073]
此外,本发明的药物组合物可包含稳定剂或增溶剂。例如,稳定剂可以是焦亚硫酸盐、柠檬酸或乙二胺四乙酸,且增溶剂可以是盐酸、乙酸、氢氧化钠、碳酸氢钠、碳酸钠或氢氧化钾。
[0074]
在本发明的另一个方面,本发明提供了一种用于预防或治疗肌炎的方法,其包括向受试者施用如上所述的药物组合物的步骤。在本文中,受试者可以是哺乳动物,并且优选地可以是人。
[0075]
在这种情况下,施用可以是静脉内、肌内或皮内施用。因此,本发明的药物组合物可以向患有肌炎的受试者的静脉提供具有正常活性的外源线粒体,因此,它可以用于增加具有降低的线粒体功能的细胞的活性或用于再生具有异常线粒体功能的细胞,并且可以用于预防或治疗肌炎。
[0076]
在本发明的另一方面,本发明提供了分离的线粒体用于预防或治疗肌炎的用途。线粒体和肌炎的细节如上所述。
[0077]
具体实施方式
[0078]
在下文中,提供了优选的实施例以帮助理解本发明。然而,提供以下实施例仅是为了更容易地理解本发明,并且本发明的内容不受以下实施例的限制。
[0079]
i.包含线粒体的组合物的制备
[0080]
制备例1.包含分离自人脐带来源间充质干细胞的线粒体的组合物的制备i
[0081]
将人脐带来源间充质干细胞接种到含有10%(v/v)胎牛血清(fbs,gibco)、100μg/ml链霉素和100u/ml氨苄青霉素的α-mem(α-最低必需培养基)培养基中,并培养72小时。完成培养后,用dpbs(dulbecco磷酸盐缓冲盐水,gibco)洗涤两次。洗涤的细胞用0.25%(v/v)胰蛋白酶-edta(te,gibco)处理以获得细胞。
[0082]
为了分离线粒体,使用血细胞计数器以1
×
107细胞/ml的浓度回收获得的细胞。将细胞系在4℃的温度下以350
×
g的速度进行第一次离心10分钟。此时,回收所得沉淀,再悬浮于缓冲溶液中,然后均化10至15分钟。之后,将含有沉淀的组合物在4℃的温度下以1,100
×
g的速度进行第二次离心3分钟以获得上清液。将上清液在4℃的温度下以12,000
×
g的速
度进行第三次离心15分钟,以从细胞系中分离线粒体。将由此获得的线粒体与pbs混合,然后填充到注射器中。
[0083]
制备例2.包含分离自人脐带来源间充质干细胞的线粒体的组合物的制备ii
[0084]
将人脐带来源间充质干细胞(uc-msc)接种到含有10%胎牛血清(fbs,gibco)、100μg/ml链霉素和100u/ml氨苄青霉素的α-mem(α-最低必需培养基,gibco)培养基中,并培养72小时。细胞培养完成后,用dpbs洗涤两次。此后,通过用0.25%胰蛋白酶/edta处理获得细胞。将细胞重悬,使细胞浓度为1
×
107细胞/ml后,在4℃的温度下以350
×
g的速度对细胞进行第一次离心10分钟。
[0085]
使用线粒体分离溶液再悬浮洗涤的细胞,然后使用1ml注射器压碎。此后,将含有破碎细胞的溶液在4℃以1,500
×
g离心5分钟以除去杂质,并回收含有线粒体的上清液。将回收的上清液在4℃以20,000
×
g离心5分钟以回收沉淀的线粒体,并将分离的线粒体漂浮在tris缓冲液中并在通过bca方法定量蛋白质后用于实验。
[0086]
制备例3.包含分离自人骨髓来源间充质干细胞的线粒体的组合物的制备
[0087]
将人骨髓来源间充质干细胞(bm-msc)接种到含有10%胎牛血清(fbs,gibco)、100μg/ml链霉素和100u/ml氨苄青霉素的dmem(gibco)培养基中,并培养72小时。
[0088]
在完成细胞培养后,如制备例2所述的方法回收并定量线粒体,然后用于实验。
[0089]
制备例4.包含分离自人成纤维细胞的线粒体的组合物的制备
[0090]
将人成纤维细胞(ccd-8lu,atcc)接种到含有10%胎牛血清(fbs,gibco)、100μg/ml链霉素和100u/ml氨苄青霉素的dmem(gibco)培养基中,并培养72小时。
[0091]
在完成细胞培养后,如制备例2所述的方法回收并定量线粒体,然后用于实验。
[0092]
制备例5.包含分离自人诱导多能干细胞的线粒体的组合物的制备
[0093]
在包被有10μg/ml玻连蛋白(干细胞07180)的细胞培养容器中的tesr
tm-e8
tm
(干细胞05990)培养基中培养人诱导的多能干细胞(ipsc),然后使用。
[0094]
在完成细胞培养后,如制备例2所述的方法回收并定量线粒体,然后用于实验。
[0095]
制备例6.包含分离自血小板线粒体的线粒体的组合物的制备
[0096]
为了从血小板中分离线粒体,将猪全血在环境温度下以500
×
g离心3分钟,然后回收含有富血小板血浆(prp)的上清液。将回收的上清液在1,500
×
g下离心5分钟以除去上清液,并回收含有血小板的沉淀。使用pbs再悬浮浓缩的血小板沉淀,然后以1,500
×
g离心5分钟并洗涤。使用线粒体分离溶液再悬浮洗涤的血小板,然后使用1ml注射器压碎。此后,将含有破碎血小板的溶液在4℃以1,500
×
g离心5分钟以除去杂质,并回收含有线粒体的上清液。将回收的上清液在4℃以20,000
×
g离心5分钟以回收沉淀的线粒体,并将分离的线粒体漂浮在tris缓冲液中并在定量蛋白质后用于实验。
[0097]
制备例7.包含分离自大鼠骨骼肌来源成肌细胞的线粒体的组合物的制备
[0098]
将一种大鼠骨骼肌来源的成肌细胞系l6细胞(美国典型菌种保藏中心,atcc,crl-1458)接种到含有10%胎牛血清(fbs,gibco)的dmem-高葡萄糖(dulbecco改良eagle培养基-高葡萄糖,gibco)培养基中,并培养72小时。
[0099]
在完成细胞培养后,如制备例2所述的方法回收并定量线粒体,然后用于实验。
[0100]
ii.线粒体特性的确认
[0101]
实施例1.线粒体atp合成的确认
[0102]
为了确认制备例1中分离的线粒体是否正常合成atp,通过bca(二喹啉甲酸测定)分析定量分离的线粒体的线粒体蛋白质浓度以制备5μg线粒体。此后,使用celltiter-glo发光试剂盒(promega,madison,wi)根据制造商的说明书定量atp的量。
[0103]
具体地,作为实验组,将5μg制备的线粒体混合在100μl的pbs中,然后分配在96孔板中。此外,作为对照组,将100μl不含线粒体的pbs分配在96孔板中。此后,用包含在celltiter-glo发光试剂盒中的100μl测试溶液处理每个孔,然后在搅拌器中反应2分钟并充分混合。此后,使其在环境温度下反应10分钟,然后使用发光酶标仪在560nm的波长下测量吸光度。
[0104]
结果证实,含有线粒体的实验组中atp的量比对照组中atp的量高出约3倍或更多(图1)。上述结果证实,在制备例1中分离的线粒体正常合成atp。
[0105]
实施例2.线粒体膜电位的测定
[0106]
为了测量制备例1中分离的线粒体的膜电位,通过bca定量分离的线粒体的线粒体蛋白质浓度以制备5μg线粒体。使用jc-1(分子探针,货号1743159)染料测量线粒体的膜电位。
[0107]
具体地,作为实验组,将5μg制备的线粒体混合在50μl的pbs中,然后分配在96孔板中。此外,作为对照组,将50μl不含线粒体的pbs分配在96孔板中。此外,作为另外的实验组,将5μg线粒体混合在50μl的cccp(r&d系统,cas 555-60-2)中,然后在室温下反应10分钟,然后分配在96孔板中。在这种情况下,cccp是线粒体的离子转运蛋白,并使线粒体的膜电位去极化,从而抑制线粒体的功能。
[0108]
此后,处理每个孔并与jc-1染料反应,使得浓度为2μm,然后使用荧光酶标仪测量吸光度。此时,jc-1染料以低浓度作为单体存在并因此显示绿色荧光,而在高浓度下,jc-1染料聚集并因此显示红色荧光(单体:ex 485/em 530,j-聚集体:ex 535nm/em 590nm)。通过计算绿色荧光的吸光度与红色荧光的吸光度的比率来分析线粒体的膜电位。
[0109]
结果,在含有线粒体的实验组中显示出高的膜电位活性。另一方面,在cccp处理线粒体的其他实验组中显示了低的膜电位活性(图2)。上述结果证实,在制备例1中分离的线粒体显示出正常的膜电位活性。
[0110]
实施例3.线粒体活性氧簇的测定
[0111]
为了证实制备例1中分离的线粒体的损伤,通过bca定量分离的线粒体的线粒体蛋白质浓度以制备5μg线粒体。使用mitosox红色指示剂(invitrogen,货号m36008)染料测量线粒体中的线粒体活性氧簇(ros)。
[0112]
具体地,作为实验组,将5μg制备的线粒体混合在50μl的pbs中,然后分配在96孔板中。此外,作为对照组,将50μl不含线粒体的pbs分配在96孔板中。此后,将mitosox红色指示剂染料在50μl的pbs中混合,使得浓度为10μm,然后用混合物处理各孔,并在培养箱中在37℃和5%co2的条件下反应20分钟。反应完成后,使用荧光酶标仪(ex 510nm/em 580nm)测量吸光度。结果证实,线粒体中的线粒体活性氧簇在对照组和实验组中均较低(图3)。上述结果证实,在制备例1中分离的线粒体没有损伤。
[0113]
iii.线粒体对肌炎体内治疗效果的确认
[0114]
实施例4.根据在肌炎诱导的小鼠模型中施用外源线粒体对肌炎治疗的作用的证实:一级实验
[0115]
实施例4.1.肌炎诱导的小鼠模型的构建和线粒体的施用(n=3)
[0116]
将含有200μg的c蛋白片段和100μg热灭活的乳酪分枝杆菌的cfa(完全弗氏佐剂)皮内注射到c57bl/6雌性8周龄小鼠中,并且腹膜内注射2μg的pt(百日咳毒素)。
[0117]
将在诱导肌炎后第1天或第7天静脉内单次施用在制备例1中分离的线粒体(5μg)的组设定为实验组。此外,将腹膜内施用100μl的pbs的组设定为阴性对照组,并且将在诱导肌炎后第1天至第14天腹膜内施用日剂量为0.8mg/kg的地塞米松的组设定为阳性对照组(图4)。
[0118]
实施例4.2.炎症浸润的肌纤维的确认
[0119]
在第14天处死实施例4.1的各组小鼠,收集四头肌和腘绳肌的组织并用h&e(苏木精和曙红)染色,然后用光学显微镜观察炎症细胞的浸润。
[0120]
结果证实,与阴性对照组相比,阳性对照组和实验组中浸润到肌纤维中的炎性细胞的数量减少(图5)。另外,在第14天处死各组小鼠,收集四头肌和腘绳肌的组织并用h&e染色,然后使用评分系统评估炎性细胞渗入其中的肌纤维的数量。评分系统的评分测量方法如下表2所示。在这种情况下,比较四头肌和腘绳肌的左右肌肉的平均值。
[0121]
[表2]
[0122]
评分评估方法(炎症浸润的肌纤维数量)1观察到1条炎症浸润的肌纤维2观察到2至5条炎症浸润的肌纤维3观察到6至15条炎症浸润的肌纤维4观察到16至30条炎症浸润的肌纤维5观察到30至99条炎症浸润的肌纤维6观察到100条或更多炎症浸润的肌纤维
[0123]
结果证实,与阴性对照组相比,阳性对照组和实验组中炎症浸润的肌纤维的评分降低(图6)。
[0124]
实施例4.3.血液中细胞因子浓度的确认
[0125]
为了在第14天确认正常小鼠和实施例4.1的各组小鼠的血液中的il-6浓度,从各组小鼠的血液中分离血清,然后根据制造商的说明书使用il-6elisa试剂盒(r&d系统,mn,usa)测量血液中的il-6浓度。
[0126]
结果证实,对照组的血液中il-6浓度增加,而阳性对照组和实验组的血液中il-6浓度降低(图7)。
[0127]
实施例4.4.通过pet/mri分析确认炎症反应
[0128]
首先,为了增加实施例4.1各组小鼠组织中的葡萄糖摄取效率,在成像前8小时不进食食物。8小时后,通过小鼠静脉注射200uci 18
f-fdg(回旋加速器室,核医学系,首尔国立大学医院),1小时后拍摄pet/mr图像。
[0129]
结果,在阴性对照组小鼠的腿中观察到强放射性核素信号。
18
f-fdg放射性药物主要在巨噬细胞中选择性摄取,巨噬细胞是炎性细胞。因此,通过核医学成像技术可以轻松监测炎症反应(图8)。
[0130]
实施例4.5.线粒体氧化磷酸化复合物表达变化的确认
[0131]
与对照组相比,阴性对照组(cim)的四头肌中氧化磷酸化复合物ii的表达减少,并
且与阳性对照组(dexa)相比,实验组(cim+线粒体第7天)中的表达增加。与对照组相比,阴性对照组(cim)中比目鱼肌中tom20的表达减少,并且与阳性对照组(dexa)相比,实验组(cim+线粒体第1天,cim+线粒体第7天)中的表达增加(图9)。
[0132]
考虑到上述实施例4.2至4.5的实验结果,通过将线粒体施用的时间点设定为诱导肌炎后的第7天来进行二次实验。
[0133]
实施例5.根据在肌炎诱导的小鼠模型中施用外源线粒体对肌炎治疗的作用的证实:二次实验实施例5.1.肌炎诱导的小鼠模型的构建和线粒体的施用(n=10)
[0134]
将含有200μg的c蛋白片段和100μg热灭活的乳酪分枝杆菌的cfa皮内注射到c57bl/6雌性8周龄小鼠中,并且腹膜内注射2μg的pt。
[0135]
将在诱导肌炎后第7天静脉内单次施用在制备例1中分离的线粒体(5μg)的组设定为实验组。此外,将腹膜内施用100μl的pbs的组设定为阴性对照组,并且将在诱导肌炎后第7天至第14天腹膜内施用日剂量为0.8mg/kg的地塞米松的组设定为阳性对照组(图10)。
[0136]
实施例5.2.炎症浸润的肌纤维的确认
[0137]
在第14天处死实施例5.1的各组小鼠,收集四头肌和腘绳肌的组织并用h&e染色,然后用光学显微镜观察炎症细胞的浸润。结果证实,与阴性对照组相比,阳性对照组和实验组中浸润到肌纤维中的炎性细胞的数量减少(图11和12)。
[0138]
另外,在第14天处死各组小鼠,收集四头肌和腘绳肌的组织并用h&e染色,然后使用评分系统评估炎性细胞渗入其中的肌纤维的数量。评分系统的评分测量方法与实施例4.2相同。在这种情况下,比较四头肌和腘绳肌的左右肌肉的平均值。结果证实,与阴性对照组相比,阳性对照组和实验组中炎症浸润的肌纤维的评分显著降低(图13)。
[0139]
实施例5.3.血液中细胞因子浓度的确认
[0140]
为了在第14天确认正常小鼠和实施例5.1的各组小鼠的血液中的il-1β、il-6和tnf-α的浓度,从各组小鼠的血液中分离血清,然后根据制造商的说明书分别使用il-1βelisa试剂盒(r&d系统,mn,usa),il-6elisa试剂盒和tnf-αelisa试剂盒(r&d系统,mn,usa)测量血液中的il-6浓度。
[0141]
结果证实,与阴性对照组相比,阳性对照组的血液中il-6浓度增加,而与阴性对照组相比,实验组血液中il-6、il-1β和tnf-α的浓度降低(图14、15和16)。
[0142]
实施例5.4.il-6的mrna表达变化的确认
[0143]
在第14天通过rt-qpcr证实从正常小鼠和实施例5.1各组小鼠的肌肉中分离的mrna中il-6的mrna的表达水平。具体地,使用trizol试剂(invitrogen)从肌肉分离总rna,并使用sybr green(perkin elmer,ma,usa)和7,500fast real-time pcr系统(applied biosystems)进行qpcr。将实验结果标准化为β-肌动蛋白mrna的量。在这种情况下,所用的引物示于下表3中。
[0144]
[表3]
[0145]
引物序列信息seq id no:il-6-ftagtccttcctaccccaatttcc1il-6-rttggtccttagccactccttc2
[0146]
结果证实,实验组中il-6的mrna的表达降低。另一方面,证实了在阳性对照组中il-6的mrna的表达没有降低,并且在降低il-6的mrna表达的效果方面,实验组比阳性对照
组更有效(图17)。
[0147]
实施例5.5.通过代谢组分析确认线粒体功能的改变
[0148]
在诱导肌炎动物模型(cim)后,在基于ce-tofms的代谢组分析的阳离子和阴离子模式下,在对照组、阴性对照组(cim)、阳性对照组(dexa)和移植有5μg线粒体的组的四头肌和比目鱼肌中测量线粒体功能。通过提高ce-ms分析的分析质量,如图37所示稀释样品以进行测量。
[0149]
从对肌肉的热分布图的分析可以看出,与对照组相比,它对阴性对照组(cim)的骨骼肌的代谢物分布具有显著的影响(图23)。证实与阳性对照组(dexa)相比,线粒体移植组的代谢物分布与对照组的代谢物分布恢复相似。苹果酸-天冬氨酸穿梭(有时简称为苹果酸穿梭、苹果酸天冬氨酸穿梭缺陷)是一种生物化学系统,其将糖酵解过程中产生的电子转移穿过线粒体的半渗透性内膜,用于真核生物中的氧化磷酸化。
[0150]
在肌炎模型中观察到的线粒体功能障碍与苹果酸-天冬氨酸穿梭有关,并且通过苹果酸和天冬氨酸的相对定量值的比率的降低证实了这一点。与阴性对照组(cim)和阳性对照组(dexa)相比,线粒体移植后苹果酸和天冬氨酸的相对定量值的比率显著增加,并且证实其恢复到与对照组相似的水平(图24至27)。
[0151]
总之,在cim小鼠模型中证实了5μg线粒体移植的治疗功效。
[0152]
实施例6.根据在肌炎诱导的小鼠模型中施用外源线粒体对肌炎治疗的作用的证实:三次实验
[0153]
实施例6.1.实验方法(n=5)
[0154]
将含有200μg的c蛋白片段和100μg热灭活的乳酪分枝杆菌的cfa(完全弗氏佐剂)皮内注射到c57bl/6雌性8周龄小鼠中,并且腹膜内注射2μg的pt(百日咳毒素)。
[0155]
将在诱导肌炎后第7天以0.2μg、1μg或5μg的剂量静脉内单次施用在制备例1中分离的线粒体的组设定为实验组。此外,将腹膜内施用100μl的pbs的组设定为阴性对照组,并且将在诱导肌炎后第7天至第14天腹膜内施用日剂量为0.8mg/kg的地塞米松(dexa)的组设定为阳性对照组(图18)。作为炎症评估方法,h&e染色后的肌炎通过根据组织学严重程度将评分从1到6进行评估。
[0156]
通过rt-qpcr观察从肌肉分离的mrna中炎性细胞因子的表达水平。线粒体移植后,通过线粒体氧化磷酸化复合物(oxphos复合物)表达的western印迹分析评估线粒体的活性水平。动物试验组信息示于表4。
[0157]
[表4]
[0158]
组别受试者数量(n)cim诱导目标对照(非处理)5x对照组载体(cim)5o阴性对照组地塞米松5o阳性对照组mt 0.2ug5o实验组mt 1ug5o实验组mt 5ug5o实验组受试者总数量30
ꢀꢀ
[0159]
实施例6.2.炎症浸润肌纤维的确认
[0160]
在第14天处死各组小鼠(表4),收集四头肌和腘绳肌的组织并用h&e(苏木精和曙红)染色,然后用光学显微镜观察炎症细胞的浸润。结果证实,与阴性对照组相比,阳性对照组和实验组中浸润到肌纤维中的炎性细胞的数量减少(图19)。另外,在第14天处死各组小鼠,收集四头肌和腘绳肌的组织并用h&e染色,然后使用评分系统评估炎性细胞渗入其中的肌纤维的数量。评分系统的评分测量方法如下表5所示。在这种情况下,比较四头肌和腘绳肌的左右肌肉的平均值。
[0161]
[表5]
[0162]
评分评估方法(炎症浸润的肌纤维数量)1观察到1条炎症浸润的肌纤维2观察到2至5条炎症浸润的肌纤维3观察到6至15条炎症浸润的肌纤维4观察到16至30条炎症浸润的肌纤维5观察到30至99条炎症浸润的肌纤维6观察到100条或更多炎症浸润的肌纤维
[0163]
结果证实,与阴性对照组相比,阳性对照组和移植了5μg线粒体的组中浸润到肌纤维中的炎性细胞的数量显著减少(图20)。
[0164]
实施例6.3.il-6和tnf-α的mrna表达变化的确认
[0165]
通过rt-qpcr,在从对照组、阴性对照组(cim)、阳性对照组(dexa)、实验组(线粒体移植组)的各组小鼠的肌肉中分离的mrna中,证实了炎症细胞因子il-6和tnf-α的mrna的表达水平。具体地,使用trizol试剂(invitrogen)从肌肉分离总rna,并使用sybr green(perkin elmer,ma,usa)和7,500fast real-time pcr系统(applied biosystems)进行qpcr。将实验结果标准化为β-肌动蛋白mrna的量。在这种情况下,rt-qpcr中使用的引物示于下表6中。
[0166]
[表6]
[0167]
引物序列信息seq id no:il-6-ftagtccttcctaccccaatttcc1il-6-rttggtccttagccactccttc2tnf-α-fccctcacactcagatcatcttct3tnf-α-rgctacgacgtgggctacag4
[0168]
结果证实,在线粒体移植组的肌肉中il-6的mrna的表达有降低的倾向。另外,证实了在移植5μg线粒体的组中tnf-α的mrna的表达显著降低。另一方面,证实了在阳性对照组(dexa)的肌肉中il-6和tnf-α的mrna的表达没有降低,并且线粒体移植组在降低il-6和tnf-α的mrna的表达的效果方面比阳性对照组(dexa)更有效(图21)。
[0169]
实施例6.4.线粒体氧化磷酸化复合物表达变化的确认
[0170]
通过蛋白质印迹(total oxphos mouse wb antibody cocktail,abcam)证实从对照组、阴性对照组(cim)、阳性对照组(dexa)、实验组(线粒体移植组)的各组小鼠肌肉中分离的蛋白质中氧化磷酸化复合物的表达的变化。证实了与对照组相比,阴性对照组(cim)中氧化磷酸化复合物i和ii的表达降低,而与阳性对照组(dexa)相比,实验组(线粒体移植组)中所有剂量的氧化磷酸化复合物i和ii的表达增加(图22)。
[0171]
总之,在cim小鼠模型中证实了5μg线粒体移植的治疗功效和剂量依赖性。
[0172]
iv.包含线粒体的组合物的毒性和物理性质的确认
[0173]
实施例7.毒性实验
[0174]
为了证实在施用线粒体后显示出毒性,将制备例1中制备的线粒体静脉内施用icr小鼠一次,然后通过尸检等确认体重变化和器官变化。如下表7所示,将12只雄性和雌性7周龄icr小鼠分成四组进行实验。
[0175]
[表7]
[0176][0177]
如上表7所示,g1组施用赋形剂。g2至g4组分别施用25μg、50μg或100μg线粒体。此时,对于g4组,以大于近似致死剂量(ald)的量施用线粒体。此时,施用部位用70%酒精棉消毒,然后使用装有26号注射针的注射器以1ml/min的速度通过尾静脉施用赋形剂或线粒体。
[0178]
首先,每天一次或多次观察所有小鼠的一般症状,并记录每个受试者的一般症状的类型和程度,包括繁殖期间的死亡。然而,在施用当天,观察持续至施用后1小时,然后以1小时的间隔进行5小时的观察。根据计划的尸检动物处理濒死动物和死亡动物。赋形剂或线粒体施用的起始日期设定为第1天。
[0179]
观察一般症状的结果表明,在整个试验期间在各组均未观察到动物死亡,并且在随后的试验期间未观察到在施用线粒体后第1天观察到的异常症状,因此认为它是由线粒体引起的暂时性变化。此外,在施用前、施用后第2天、第4天、第8天和第15天测量所有小鼠受试者的体重。测量结果如表8所示。
[0180]
[表8]
[0181][0182]
如表8所示,在g1至g4组中未观察到体重的显著变化。此外,在第15天麻醉所有小鼠受试者,然后切开腹部并肉眼检查所有器官。结果表明,在g1至g4组中未观察到器官的变化。
[0183]
基于上述结果,证实了在这些测试条件下对icr小鼠进行线粒体的静脉内单次施用时,雄性和雌性小鼠在高达100μg/头的线粒体浓度中均未显示毒性。
[0184]
实施例8.分离自脐带来源的冷冻保存干细胞的线粒体和分离自脐带来源的培养干细胞的线粒体的性质比较
[0185]
将脐带来源间充质干细胞接种到含有10%(v/v)胎牛血清(fbs)、100μg/ml链霉素和100u/ml氨苄青霉素的α-mem培养基中,并培养72小时。培养的细胞用0.25%胰蛋白酶-edta(te)处理以获得细胞。使用血细胞计数器将获得的细胞以1
×
107个细胞/ml的浓度重新悬浮,然后置于冷冻管中,转移到冷冻保存容器中,然后在-80℃的温度下冷冻24小时,并保存在液氮冷冻保存库中。从冷冻保存的脐带来源干细胞分离的线粒体以与上述制备例1相同的方式分离,并与制备例1中分离的培养的细胞衍生的线粒体在atp活性、膜电位和线粒体活性氧簇的性质方面进行比较。
[0186]
结果表明,为了比较从脐带来源的冷冻保存的干细胞分离的线粒体和从脐带来源的培养的干细胞分离的线粒体之间的atp合成能力,证实了加入底物(addp)并在两种条件下atp活性恢复到与基础能量代谢相似的比例。此外,证实了两种条件下的膜电位活性相似,线粒体活性氧簇的产生也相似(图28至30)。
[0187]
实施例9.使用粒子计数器测量线粒体数量
[0188]
以1μg/ml、2.5μg/ml和5μg/ml的浓度制备从制备例1中分离的人脐带来源的间充质干细胞分离的线粒体的各溶液,然后通过粒子计数器(multisizer 4e,beckman coulter)测量线粒体的数量。此时,对每种浓度测量两次,测量结果示于下表9和图31-33中。
[0189]
[表9]
[0190][0191]
v.体外线粒体抗炎作用的确认
[0192]
实施例10.利用实时定量聚合酶链反应比较raw264.7细胞中几种细胞来源的线粒体的抗炎活性
[0193]
为了比较和分析通过实施例2、实施例3、实施例4和实施例7的方法从各种细胞获得的线粒体的抗炎活性,使用实时定量聚合酶链反应进行基于细胞的分析实验。
[0194]
将来自小鼠的巨噬细胞细胞系raw264.7细胞在含有10%fbs的dmem培养基中培养。将约3
×
105个细胞/孔接种到6孔板中,并培养24小时,然后在去除了fbs的dmem培养基中维持缺陷条件约24小时。
[0195]
24小时后,将其用浓度为1μg/ml的沙门氏菌来源的脂多糖(lps)处理6小时以在巨噬细胞细胞系中诱导炎症应答。脂多糖处理6小时后,用pbs缓冲液洗涤细胞两次,然后用从每个细胞获得的线粒体处理并进一步培养18小时。在这种情况下,阴性对照组是未用脂多糖和线粒体处理的组,而阳性对照组是单独用浓度为1μg/ml的脂多糖处理的组。另外,实验组用1μg/ml浓度的脂多糖处理,6小时后,分别用30μg量的从骨髓来源的间充质干细胞(bm-msc)、脐带来源的间充质干细胞(uc-msc)、大鼠成肌细胞(l6成肌细胞)和人肺来源的成纤维细胞(ccd-8lu)获得的线粒体处理。
[0196]
线粒体处理18小时后,除去培养液,通过向细胞中加入pbs缓冲液洗涤细胞两次,
直接加入0.5ml的rna提取物(trizol试剂,thermo fisher scientific),然后在环境温度下放置10分钟。然后,加入0.1ml氯仿并搅拌15秒,然后以约12,000
×
g离心10分钟。
[0197]
获得分离的上清液,加入相同体积的异丙醇,然后以12,000
×
g离心10分钟。此后,除去液体并用75%乙醇洗涤一次,然后在环境温度下干燥。干燥后,加入约50μl无rna酶的纯化蒸馏水,并使用分光光度计测量所得rna的量和纯度。
[0198]
为了使用获得的rna合成cdna,将2μg纯化的总rna与寡dt在70℃进行结合反应5分钟,然后加入10x逆转录缓冲液、10mm dntp、rnase抑制剂和m-mlv逆转录酶(enzynomics,韩国),并在42℃进行cdna合成反应60分钟。
[0199]
cdna合成反应完成后,通过在72℃加热5分钟使逆转录酶失活,然后加入rna酶h以除去单链rna,得到最终的cdna。通过实时定量聚合酶链反应观察炎症反应的特征基因tnf-α基因、il-1β基因和il-6基因的表达变化。将gapdh基因与它们一起定量以校正表达的差异。用于实时定量聚合酶链式反应的基因的碱基序列如下表10所述。
[0200]
[表10]
[0201]
引物序列tnf-α-s5'-tctcatcagttctatggccc-3'(seq id no:5)tnf-α-as5'-gggagtagacaaggtacaac-3'(seq id no:6)il-1β-f5'-aacctgctggtgtgtgacgttc-3'(seq id no:7)il-1β-r5'-cagcacgaggcttttttgttgt-3'(seq id no:8)il-6-as5'-ctaggtttgccgagtagatct-3'(seq id no:9)il-6-s5'-ccaaactggatataatcaggaaat-3'(seq id no:10)gapdh-s5'-ggtgaaggtcggtgtgaag-3'(seq id no:11)gapdh-as5'-ctcgctcctggaagatggtg-3'(seq id no:12)
[0202]
如实验结果所示,发现当小鼠巨噬细胞系raw264.7细胞用脂多糖处理时,tnf-α基因、il-1β基因和il-6基因的表达增加。另外,证实了当用从骨髓来源的间充质干细胞、脐带来源的间充质干细胞、大鼠成肌细胞和人肺来源的成纤维细胞获得的线粒体处理时,脂多糖诱导的tnf-α基因、il-1β基因和il-6基因的表达被抑制至显著水平。基于上述,证实了从本发明使用的细胞获得的线粒体表现出显著优异的抗炎活性(图34)。
[0203]
实施例11.人单核细胞(thp-1)中几种细胞来源的线粒体的抗炎活性的比较
[0204]
将thp-1细胞(人源单核细胞)在含有10%的fbs的rpmi培养基中培养。将4
×
105个细胞/孔接种到24孔板中,并在含有1%fbs的rpmi培养基中培养15至16小时。
[0205]
将细胞用浓度为2μg/ml的沙门氏菌来源的脂多糖(lps)处理6小时以在thp-1细胞系中诱导炎症应答。脂多糖处理6小时后,用从每个细胞获得的线粒体处理细胞并进一步培养24小时。在这种情况下,阴性对照组是未用脂多糖和线粒体处理的组,而阳性对照组是单独用浓度为2μg/ml的脂多糖处理的组。此外,实验组用浓度为2μg/ml的脂多糖处理,6小时后,分别用40μg量的通过实施例2、实施例4、实施例5和实施例6的方法获得的脐带来源间充质干细胞(uc-msc)的线粒体,人肺来源成纤维细胞(ccd-8lu)人诱导的多能干细胞(ips)和猪血小板进行处理。为了比较反应后的抗炎活性,对细胞进行实时定量聚合酶链反应,并对培养液进行elisa。
[0206]
实施例11.1.使用实时定量聚合酶链反应比较抗炎活性
[0207]
此后,除去培养液,向细胞中加入pbs缓冲液,洗涤两次,直接加入0.5ml的rna提取物(trizol试剂,thermo fisher scientific)。在环境温度下静置10分钟后,加入0.1ml氯仿并搅拌15秒,然后在12,000
×
g下离心10分钟。取出分离的上清液,并加入相同体积的异丙醇,在12,000
×
g下离心10分钟,然后除去上清液,用75%乙醇洗涤一次,并在环境温度下干燥。
[0208]
加入50μl无rna酶的纯化蒸馏水,并使用分光光度计测量所得rna的量和纯度。为了合成cdna,将2μg纯化的总rna与寡dt在70℃进行结合反应5分钟,然后加入10x逆转录缓冲液、10mm dntp、rnase抑制剂和m-mlv逆转录酶(enzynomics,韩国),并在42℃进行cdna合成反应60分钟。反应后,通过在72℃加热5分钟使逆转录酶失活,然后加入rna酶h以除去单链rna,获得cdna。
[0209]
使用下表11中所示的引物进行定量聚合酶链反应(定量rt-pcr)以确定促炎细胞因子的表达是否改变。在这种情况下,通过用18s作为校正基因进行定量来校正表达的差异。
[0210]
[表11]
[0211]
引物碱基序列人il-6-sccacacagacagccactcac(seq id no:13)人il-6-astttcaccaggcaagtctcct(seq id no:14)人18s-sctcccacttggataactgtgg(seq id no:15)人18s-asgaccgggttggttttgatct(seq id no:16)
[0212]
如实验结果所示,发现当用脂多糖处理人单核细胞thp-1细胞时,il-6基因的表达增加。另外,证实了当用从脐带来源的间充质干细胞、人肺来源的成纤维细胞、人诱导的多能干细胞和猪血小板获得的线粒体处理时,脂多糖诱导的il-6基因的表达被抑制到显著水平。基于上述,证实了从各种细胞获得的线粒体表现出显著优异的抗炎活性(图35,*p《0.05)。
[0213]
实施例11.2.使用elisa方法比较抗炎活性
[0214]
为了用获得的上清液证实il-6(thp-1细胞的促炎细胞因子)的表达水平,如下使用人il-6(r&d系统)根据制造商的说明书进行实验。
[0215]
将100μl包被溶液放入96孔板中,在环境温度下反应过夜,洗涤3次,然后与试剂稀释剂在环境温度下反应1小时,并洗涤3次。将10倍稀释的上清液和标准溶液在环境温度下反应2小时,然后洗涤3次,然后用各孔中的标记抗体(检测抗体)处理,然后在环境温度下反应2小时。洗涤3次后,使链霉亲和素溶液(链霉亲和素-hrp)在环境温度下反应20分钟,然后洗涤3次,然后与有色溶液(底物溶液)在暗室中在环境温度下反应20分钟,然后加入反应终止溶液,并在450nm的波长下测量吸光度。
[0216]
如实验结果所示,发现当用脂多糖处理人单核细胞thp-1细胞时,il-6蛋白增加。另外,证实了当用从脐带来源的间充质干细胞、人肺来源的成纤维细胞、人诱导的多能干细胞和猪血小板获得的线粒体处理时,脂多糖诱导的il-6蛋白被抑制至显著水平,并且其与基因表达的结果一致。基于上述,证实了从各种细胞获得的线粒体表现出显著优异的抗炎活性(图36,*p《0.05)。
