用于改善花生过敏患者的生活质量的方法
1.相关申请的交叉引用
2.本技术要求2019年5月10日提交的美国临时申请no.62/846,481、2019年5月31日提交的美国临时申请no.62/855,384和2020年1月30日提交的美国临时申请no.62/967,948的优先权权益;这些美国临时申请中的每一项以引用方式并入本文以用于所有目的。
技术领域
3.本文描述了用于改善花生过敏患者的生活质量的方法。
背景技术:
4.花生过敏是免疫系统对花生蛋白的过敏、超敏反应。花生过敏通常发生在童年,并且如果没有有效的治疗,通常是终身的痛苦。对花生的过敏反应可能是严重的且危及生命的,并且是严重的食物诱发的过敏反应的主要来源。
5.花生过敏对个体及其护理人员/家庭带来了巨大的负担。花生过敏的管理涉及持续的医疗护理、财务成本和小心避免花生或其他对医疗建议的依从性。这些负担可以多种方式显现,包括焦虑症状和抑郁症状。关于过敏事件风险的焦虑可导致将花生过敏儿童排除在社交事件之外等等。参见例如bollinger等人,the impact of food allergy on the daily activities of children and their families,ann,allergy asthma immunol.,第96卷,第415-421页,2006年。总之,这些负担可影响个体的生活质量(qol),并且甚至影响其护理人员或家庭成员的生活质量。参见例如king等人,impact of peanut allergy on quality of life,stress and anxiety in the family,allergy,第64卷第3期,第461-468页,2009年。花生过敏个体所承受的负担可大于其他严重慢性疾病(包括1型糖尿病)个体所承受的负担。参见例如avery等人,assessment of quality of life in children with peanut allergy,ped.allergy immunol.,第14卷,第378-382页,2003年。
6.用于治疗花生过敏的护理标准通常包括饮食消除和避免花生,对过敏反应的迹象进行教育,以及施用可注射的肾上腺素以响应于饮食中暴露于花生蛋白而引起的严重过敏反应。然而,意外摄入花生是很常见的,由于难以解释食品标签和未标记食品中存在未申报的成分。口服免疫疗法(oit)是一种用于花生过敏的具有前景的新型治疗手段。参见例如,bird等人,efficacy and safety of ar101 in oral immunotherapy for peanut allergy:results of arc001;a randomized double-blind,placebo-controlled phase 2clinical trial,j.clin.immunol.pract.,第6卷第2期,第476-485页,2018年。花生oit包括使患者暴露于逐渐增加剂量的花生蛋白以诱导脱敏,这旨在降低意外暴露于花生时发生严重反应的风险。
技术实现要素:
7.本文描述了根据口服免疫疗法计划通过口服免疫疗法改善花生过敏患者的生活质量的方法。
8.在一些实施方案中,改善花生过敏患者的生活质量的方法包括:根据口服免疫疗法计划向患者施用花生组合物。
9.在一些实施方案中,告知患者正在施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划开始时正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的加药阶段期间正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的维持阶段期间正在向患者施用花生组合物。
10.在一些实施方案中,该方法还包括告知患者正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划开始之前正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的加药阶段期间正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的维持阶段期间正在向患者施用花生组合物。
11.在一些实施方案中,使用生活质量问卷(qolq)来测量生活质量改善。在一些实施方案中,qolq包括一个或多个得分的测量域。在一些实施方案中,qolq是食物过敏生命质量问卷(faqlq)。在一些实施方案中,faqlq是faqlq-儿童表(faqlq-cf)、faqlq-少年表(faqlq-tf)、faqlq-成人表(faqlq-af)或faqlq-父母表(faqlq-pf)。
12.在一些实施方案中,改善花生过敏患者的生活质量的方法,如通过生活质量问卷(qolq)所评估的,包括根据口服免疫疗法计划向患者施用花生组合物。在一些实施方案中,告知患者正在施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划开始时正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的加药阶段期间正在向患者施用花生组合物。在一些实施方案中,告知患者在口服免疫疗法计划的维持阶段期间正在施用花生组合物。在一些实施方案中,该方法还包括告知患者正在向患者施用花生组合物。在一些实施方案中,该方法还包括告知患者正在向患者施用花生组合物,并且告知患者在开始口服免疫疗法计划之前正在向患者施用花生组合物。在一些实施方案中,该方法还包括告知患者正在向患者施用花生组合物,并且告知患者在口服免疫疗法计划的加药阶段期间正在向患者施用花生组合物。在一些实施方案中,该方法还包括告知患者正在向患者施用花生组合物,并且告知患者在口服免疫疗法计划的维持阶段期间正在向患者施用花生组合物。在一些实施方案中,qolq包括一个或多个得分的测量域。在一些实施方案中,qolq是食物过敏生命质量问卷(faqlq)。在一些实施方案中,faqlq是faqlq-儿童表(faqlq-cf)、faqlq-少年表(faqlq-tf)、faqlq-成人表(faqlq-af)或faqlq-父母表(faqlq-pf)。在一些实施方案中,qolq是食物过敏独立测量(faim)。在一些实施方案中,faim是faim-儿童表(faim-cf)、faim-少年表(faim-tf)、faim-成人表(faim-af)或faim-父母表(faim-pf)。在一些实施方案中,qolq是儿科生活质量清单(pedsql)。
13.在前述方法的一些实施方案中,生活质量改善至少6个月。在一些实施方案中,生活质量改善至少12个月。
14.在一些实施方案中,qolq的该一个或多个得分域各自在1和7之间的标度上得分,或者各自转换为在第一得分和第二得分之间的得分,其中第二得分指示较差的生活质量。在一些实施方案中,与口服免疫疗法的时间段之前的第一时间点处的评估相比,在口服免疫疗法的时间段之后的第二时间点处,患者的生活质量在qolq的一个或多个域中至少有0.5分的改善。在一些实施方案中,与口服免疫疗法的时间段之前的第一时间点处的评估相
比,在口服免疫疗法的时间段之后的第二时间点处,患者的生活质量在qolq的总得分中至少有0.5分的改善;其中总得分是每个域得分的平均值。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法计划的维持疗法的至少1个月。
15.在一些实施方案中,使用生活质量问卷(qolq)来测量生活质量改善。在一些实施方案中,qolq是食物过敏独立测量(faim)。在一些实施方案中,faim是faim-儿童表(faim-cf)、faim-少年表(faim-tf)、faim-成人表(faim-af)或faim-父母表(faim-pf)。在一些实施方案中,与口服免疫疗法的时间段之前的第一时间点处的评估相比,在口服免疫疗法的时间段之后的第二时间点处,患者的生活质量在qolq的总得分中至少有0.5分的改善;其中总得分是每个域得分的平均值。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法计划的维持疗法的至少1个月。
16.在一些实施方案中,口服免疫疗法计划6个月之后,生活质量改善。
17.在一些实施方案中,口服免疫疗法计划包括加药阶段和维持阶段。在一些实施方案中,在维持阶段期间每天向患者施用花生组合物。在一些实施方案中,维持阶段是至少3个月。在一些实施方案中,在口服免疫疗法计划的维持阶段期间以约300mg花生蛋白或更多的剂量向患者施用花生组合物。在一些实施方案中,加药阶段包括向患者施用在约3mg和约初始维持阶段剂量的该剂量之间的两种或更多种不同剂量。
18.在一些实施方案中,口服免疫疗法计划包括长度在约3个月和约2年之间的加药阶段。
19.在一些实施方案中,口服免疫疗法计划还包括初始递增阶段。
20.在一些实施方案中,患者为约4岁以上。在一些实施方案中,患者在约4岁和约17岁之间。在一些实施方案中,患者在约8岁和约17岁之间。
21.在一些实施方案中,该方法包括在根据口服免疫疗法计划向患者施用花生组合物之前测量生活质量。在一些实施方案中,该方法包括在根据口服免疫疗法计划向患者施用花生组合物之后测量生活质量。在一些实施方案中,该方法包括在告知患者正在施用花生组合物之后测量生活质量。在一些实施方案中,如由生活质量问卷(qolq)所确定的,改善患者的生活质量。
附图说明
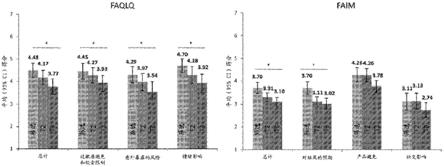
22.图1示出了参与两项花生oit临床试验(palisade试验和palisade试验的开放标签扩展试验)的受试者(年龄8岁至17岁)在三个时间点(左:faqlq;右:faim)如通过食物过敏生活质量问卷(faqlq;例如,faqlq-cf或faqlq-tf)以及通过食物过敏独立测量(faim;例如,faim-cf或faim-tf)测量的自我报告的生活质量结果。第一时间点发生在第一临床试验(palisade)的筛选期间。第二时间点(t2)发生在palisade退出时进行的双盲安慰剂对照食物挑战(dbpcfc)完成之后和开放标签扩展开始之前。第三时间点(t3)发生在开放标签扩展退出处。图1的左图示出了faqlq总得分以及过敏原避免和饮食限制、意外暴露风险和情绪影响的域的平均得分(指示95%置信区间)。图1的右图示出了针对faim总得分以及对结果
的预期、产品避免和社交影响的问题的平均得分(指示95%置信区间)。总得分结果和六个域/问题得分结果中的四个均超过palisade筛选和t3之间的最小临床重要差异(mcid)的阈值0.5,并且由条上方的星号指示。
23.图2示出了关于受试者(年龄4岁至17岁)参与两项花生oit临床试验(palisade和palisade的开放标签扩展)在三个时间点(左:faqlq;右:faim)如通过食物过敏生活质量问卷(faqlq;例如,faqlq-pf)以及通过食物过敏独立测量(faim;例如,faim-pf)测量的代理人报告的生活质量结果。第一时间点发生在第一临床试验(palisade)的筛选期间。第二时间点(t2)发生在palisade退出时进行的双盲安慰剂对照食物挑战(dbpcfc)完成之后和开放标签扩展开始之前。第三时间点(t3)发生在开放标签扩展退出处。图2的左图示出了faqlq总得分以及情续影响、食物焦虑与社交和饮食限制的域的平均得分(指示95%置信区间)。图2的右图示出了faim儿童对结果的预期(通过代理人)和父母/护理人员对结果的预期的平均得分(指示95%的置信区间)。对于儿童对结果的预期(通过代理),未针对该问题测试年龄为13岁至17岁的儿童的父母或护理人员。父母/护理人员对结果期望的问题超过palisade筛选和t3之间的最小临床重要差异(mcid),并且由条上方的星号指示。
24.图3示出了从第一花生oit临床试验(palsade)的筛选到palsade的开放标签延展的退出(包括palsade和开放标签扩展之间的时间点)的各种受试者生活质量的变化。圆点指示通过自我报告(例如,faqlq-cf或faqlq-tf)或通过代理人报告(例如,faqlq-pf)的食物过敏生活质量问卷(faqlq)总得分的平均值(指示95%置信区间)变化。三角点指示通过自我报告(例如,faim-cf或faim-tf)或通过代理人报告(例如,faim-pf)的食物过敏独立测量(faim)总得分的平均值(指示95%置信区间)变化。实线和虚线分别指示“是”和“否”,涉及特定受试者在两次临床试验之间的时间点(即,palisade退出)是否耐受至少600mg的花生蛋白,如在双盲安慰剂对照食物挑战中测量的,受试者是否在第一次临床试验(palisade)或开放标签扩展期间经历全身过敏反应,以及受试者是否在第一次临床试验(palisade)或开放标签扩展期间报告使用肾上腺素。竖直虚线(+/-0.5得分变化)指示每个qol工具的最小临床重要差值(mcid)。
25.图4示出了ar101的欧洲临床试验中年龄为8岁至12岁参与者在活性组筛选(每个总得分或域得分的第一行)、活性组退出(每个总得分或域得分的第二行)、安慰剂组筛选(每个总得分或域得分的第三行)和安慰剂组退出(每个总得分或域得分的第四行)时报告的faqlq和faqlq总得分和域得分。
26.图5示出了ar101的欧洲临床试验中年龄为13岁至17岁参与者在活性组筛选(每个总得分或域得分的第一行)、活性组退出(每个总得分或域得分的第二行)、安慰剂组筛选(每个总得分或域得分的第三行)和安慰剂组退出(每个总得分或域得分的第四行)时报告的faqlq和faqlq总得分和域得分。
27.图6示出了ar101的欧洲临床试验中年龄为4岁至12岁参与者的护理人员在活性组筛选(每个域的第一行)、活性组退出(每个域的第二行)、安慰剂筛选(每个域的第三行)和安慰剂退出(每个域的第四行)时报告的各域的代理人报告的faim得分。
具体实施方式
28.本文描述了改善花生过敏患者的生活质量的方法。该方法可包括根据口服免疫疗
法计划向患者施用花生组合物。已发现,由于花生过敏而遭受降低的生活质量的受试者通过根据口服免疫疗法计划用花生组合物进行治疗可具有改善的生活质量。在测试研究性花生蛋白口服生物药物ar101在口服免疫疗法中的疗效的多个大规模临床试验中,在初始脱敏和维持疗法时间段之后,观察到活性队列中的每个活性队列的受试者报告和代理人报告的生活质量的显著改善。整个队列中的这些实质性改善表明接受本文所述的治疗的个体可能具有生活质量的改善。
29.受试者的生活质量可通过通知受试者他们根据治疗花生过敏的口服免疫疗法计划将施用或正在施用花生组合物而得到改善。与在不了解治疗的盲法研究中施用组合物相反,用活性治疗剂(即花生组合物)治疗的了解可导致生活质量改善。口服免疫疗法涉及通过与意外膳食暴露(即,口服摄取)发生相同的途径给药花生蛋白。一旦实现了脱敏,与其他免疫疗法方法(诸如基于皮肤暴露或注射的那些方法)相比,口服免疫疗法因此可为患者和/或其护理人员提供保护患者免于意外暴露于花生蛋白的额外确定性。该效应可与实际的脱敏无关。在告知患者正在施用花生组合物之后,根据口服免疫疗法计划每剂量的花生蛋白可增强患者对他们意外暴露的脱敏的信心,并因此随时间推移改善患者的生活质量。因此,本文所述的改善患者的生活质量的方法可包括向了解治疗的患者(即,被告知他们正在接受花生组合物而不是安慰剂)施用花生组合物。可在开始口服免疫疗法计划之前或口服免疫疗法计划期间(诸如在口服免疫疗法计划的加药阶段或维持阶段期间)告知患者活性治疗。在一些实施方案中,该方法包括告知患者活性治疗(即,正在向患者施用花生组合物)。
30.口服免疫疗法(oit)是通过将受试者定期暴露于增加剂量的过敏原来诱导受试者对过敏原脱敏的方法。对于花生过敏,用于oit的方案通常涉及加药阶段(也称为积累阶段)和维持阶段。oit还可包括初始递增阶段,尽管该阶段是任选的且不是治疗所必需的。初始递增阶段涉及在临床监督的情况下暴露于小剂量的花生蛋白,以确定患者对花生蛋白的敏感性。此初始递增阶段通常发生在若干个(例如,三个或更多)小时至两天的过程中。增加这些小剂量,直到受试者达到初始递增阶段的目标剂量或最高耐受剂量。然后,受试者通常开始加药阶段,以在初始递增阶段施用的最高耐受剂量或稍低的剂量开始,并在加药阶段通过一系列剂量递增。另外,花生oit包括涉及持续施用花生蛋白一段时间的维持阶段。口服免疫疗法的一个目标是建立脱敏状态,其中所治疗的受试者在意外暴露于花生蛋白时不太可能遭受严重的或危及生命的过敏反应。
31.花生过敏受试者可能遭受降低的生活质量,并且他们的生活质量可通过本文所述的方法来改善。
32.定义
33.如本文所用,单数形式“一个”、“一种”和“该”包括多个指代物,除非上下文明确地另外指明。
34.本文提及的“约”值或参数包括(并描述)涉及该值或参数本身的变化。例如,提及“约x”的描述包括对“x”的描述。
35.术语“脱敏”在本文中用于指作为食物过敏原的口服免疫疗法,受试者对食物过敏原的反应阈值增加。对食物过敏原脱敏可以使用本领域已知的方法(包括口服食物激发)进行测试。脱敏可以是部分的,其中与治疗前相比,受试者耐受增加量的食物过敏原,但仍然
对更高剂量的食物过敏原有反应;或者脱敏可以是完全的,其中患者耐受所有测试剂量的食物过敏原。
36.如本文所用,短语“生活质量”与“疾病相关的生活质量”和“健康相关的生活质量”同义,并且是指受食物过敏影响和/或受其治疗影响的受试者生活的部分。
37.除非另外指明,否则术语“有效”、“功效”或“有效性”在本文中用于指疗法诱导免疫调节(诸如脱敏)或维持所需免疫状态(诸如脱敏状态)的能力。
38.如本文所使用的,“维持阶段”是指花生蛋白口服免疫疗法的阶段,该阶段包括对患者施用花生蛋白(即维持剂量),并且发生在加药阶段完成之后。
39.如本文所用,“轻度过敏不良事件”是指观察到或经历的与短暂不适相关联但不需要立即进行医疗干预(诸如住院或肾上腺素)并且基本上不干扰日常活动的oit治疗相关过敏不良事件。
40.如本文所用,“中度过敏不良事件”是指观察到的或经历的与足以干扰日常活动的程度的不适相关联并且可提示医疗干预和/或额外观察的oit治疗相关过敏不良事件。
41.如本文所用,“每天”给药是指在每个连续日历日施用一个剂量。剂量可在日历日作为单个部分施用,或细分为在同一日历日内施用的多个部分。
42.如本文所用,短语“重度过敏不良事件”是指观察到或经历的与oit治疗相关的过敏不良事件,导致需要住院和/或施用肾上腺素或其他挽救生命的医疗干预的过敏症。
43.术语“受试者”或“患者”在本文中同义和互换地用于描述任何年龄的人。
44.当向受试者施用剂量而没有任何中度或重度过敏不良事件时,受试者“耐受”该剂量。即使观察到或经历轻度过敏不良事件,受试者也被认为耐受该剂量。
45.术语“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”在本文中同义用于指向患有疾病状态或病症的受试者提供益处的任何行为,包括通过以下项来改善病症:减轻、抑制、压抑或消除至少一种症状;延缓疾病的进展;延缓疾病的复发;疾病的抑制;或部分或完全减少对过敏原的响应或反应。
[0046]“加药阶段”是指口服免疫疗法的以一系列增加的食物过敏原剂量为特征的阶段,从施用低于在口服免疫疗法期间向患者施用的最高剂量的食物过敏原剂量开始,并且在达到在口服免疫疗法期间向患者施用的最高剂量时结束。
[0047]
应当理解,本文所述的本发明的方面和变型包括“由...组成”和/或“基本上由...组成”的方面和变型。
[0048]
当提供一系列值时,应当理解所述范围的上限与下限之间的每个中间值以及所述陈述范围中的任何其他规定的或中间值涵盖在本公开的范围内。在所述范围包括上限或下限的情况下,排除那些所包括的限值中的任一者的范围也包括在本公开中。
[0049]
本文所用的章节标题仅用于组织目的,不应被解释为限制所描述的主题。提供该描述是为了使本领域的普通技术人员能够制备和使用本发明,并且是在专利申请及其要求的上下文中提供的。对所述实施方案的各种修改对于本领域的技术人员而言将是显而易见的,并且本文的一般原理可应用于其他实施方案。因此,本发明并非旨在限于所示的实施方案,而是要符合与本文所述的原理和特征一致的最广泛的范围。
[0050]
本文提及的所有出版物、专利和专利申请的公开内容均据此全文以引用方式并入。就以引用方式并入的任何参考文献与本公开冲突的程度而言,应以本公开为准。
[0051]
改善生活质量的方法
[0052]
可通过根据口服免疫疗法计划向患者施用花生组合物来改善花生过敏患者的生活质量。在一些实施方案中,可通过告知患者他们根据口服免疫疗法计划正在施用或将施用花生组合物来改善花生过敏患者的生活质量。在一些实施方案中,可通过指导患者的护理人员告知患者他们根据口服免疫疗法计划正在施用或将施用花生组合物来改善花生过敏患者的生活质量。
[0053]
在口服免疫疗法之前或期间的任何时间,可告知受试者他们根据口服免疫疗法计划将施用或正在施用花生组合物,或者可告知受试者的护理人员受试者根据口服免疫疗法计划将施用或正在施用花生组合物。在一些实施方案中,在开始口服免疫疗法计划之前,告知受试者,或者指导受试者的护理人员告知受试者。在一些实施方案中,在开始口服免疫疗法计划的加药阶段之前,告知受试者,或者指导受试者的护理人员告知受试者。在一些实施方案中,在口服免疫疗法计划的加药阶段期间,告知受试者,或者指导受试者的护理人员告知受试者。在一些实施方案中,在口服免疫疗法计划的加药阶段之后,告知受试者,或者指导受试者的护理人员告知受试者。在一些实施方案中,在口服免疫疗法计划的维持阶段期间,告知受试者,或者指导受试者的护理人员告知受试者。在一些实施方案中,在口服免疫疗法计划的维持疗法的至少一个月(诸如口服免疫疗法的维持疗法的至少2个月、至少3个月、至少6个月和至少12个月)之后,告知受试者,或者指导受试者的护理人员告知受试者。
[0054]
在口服免疫疗法之前、期间或之后,受试者可能经历生活质量评估。花生过敏通过对花生蛋白的过敏反应影响生活质量。然而,即使不存在过敏反应,花生过敏受试者也会遭受生活质量的受损,包括对过敏反应的恐惧、过敏的财务负担、过敏的社交限制等。受试者及其护理人员必须投入大量的时间来查看和验证食物选择,例如通过阅读食物标签、询问未标记食物中的成分、或避免在具有潜在交叉污染的环境中制备食物。受试者及其护理人员可能经历这些负担中的焦虑,这可进一步表现为抑郁症状。受试者可能会避免单独生活或甚至单独进食,因为担心快速发生过敏反应。这些效应一起降低了受试者的生活质量。
[0055]
oit之前、期间或之后测量生活质量(诸如疾病相关的qol)的方法已被开发和验证,以用于测量食物过敏(诸如花生过敏)受试者的生活质量。评估生活质量的最常见方法采用了问卷,这些问卷被设计成在定性和/或定量方面评估食物过敏(诸如花生过敏)所带来的负担的一个或多个域,每个域都有一个或多个问题。示例性问卷通常(1)有效,这意味着正在测量的生活质量的部分与食物过敏有关;(2)可重现,这意味着在类似条件下取得的问卷是等同的,并且通常可在食物过敏负担或治疗负担没有变化的情况下产生类似的结果;(3)响应,这意味着检测和/或可检测到食物过敏负担和/或治疗负担的变化;以及(4)可解释,这意味着得分的变化是临床上显著的,如由问卷的最小临床重要差异(mcid)所确定的。
[0056]
受试者生活质量的改善涉及至少两个时间点之间的变化。此外,相对于特定工具(诸如特定生活质量问卷或其他qol评估)来理解改善。例如,如果通过生活质量问卷来评估个体的生活质量,则改善是该相同生活质量问卷的得分的改善,诸如特定域的改善或所述问卷的总得分的改善。在一些实施方案中,改善在临床上是显著的,诸如等于或大于问卷的最小临床重要差异(mcid)。在一些实施方案中,改善是一个时间点(诸如基线测量)和第二时间点之间的生活质量问卷的域得分或总得分的变化。
[0057]
在一些实施方案中,熟练的医疗提供者(诸如医师、护士、过敏症专科医师或过敏治疗领域中训练有素的其他专业人员)可选择适用于通过口服免疫疗法将治疗或正在治疗食物过敏(诸如花生过敏)的受试者的qol评估工具。优选地,qol评估工具是适龄的,并且针对受试者的特定年龄范围进行验证。对于年轻受试者,例如对于年龄在12岁以下的受试者,可能需要代理人报告(诸如,由受试者的护理人员完成关于受试者花生过敏的报告)或者可以补充自我报告。对于6岁、7岁或8岁以上的受试者,单独的自我报告可能是足够的,但并不总是如此。在一些实施方案中,可针对受试者(针对自我报告)和/或受试者的护理人员(针对代理人报告)的母语验证评估工具。在一些实施方案中,评估工具可进行文化上的验证,例如,在受试者(针对自我报告)和/或受试者的护理人员(针对代理人报告)所居住的国家或地区进行验证。
[0058]
在一些实施方案中,生活质量可通过生活质量问卷(qolq)(诸如特定于食物过敏的qolq)进行评估。在一些实施方案中,特定于食物过敏的qolq是特定于花生过敏的qolq。qos通常被分成一个或多个域,其中每个域涉及身体、心理、情续或社交功能或良好状态的类别。qos的域可包括一个或多个问题。qolq可单独地和/或整体地对一个或多个域和/或一个或多个问题进行评分。涵盖的示例性域和/或问题可包括但不限于:霸凌、戏弄、家庭、家庭事件、学校、学校事件、社交、社交事件、田间旅行、聚会、留宿聚会、在朋友家里玩耍、用于制备食物的时间、身体状态、心理状态、情绪状态、对结果的期望、感知的风险、父母焦虑、父母抑郁、社会心理的影响、父母应对、家庭支持、社交预防、食物过敏原识别、情续影响、食物相关的焦虑、社交限制、过敏原避免、饮食限制、意外暴露的风险、恐惧、感知、独立和/或携带肾上腺素的负担。在一些实施方案中,由qolq测量的域和/或问题包括被验证为与食物过敏和/或治疗食物过敏的负担相关的任何域和/或问题。在一些实施方案中,由qolq测量的域和/或问题包括被验证为与食物过敏(即花生过敏)和/或治疗食物过敏(即花生过敏)的负担相关的任何域和/或问题。
[0059]
在一些实施方案中,可通过向花生过敏受试者施用一个或多个qolq以测量所述受试者的生活质量来评估花生过敏受试者的生活质量。在一些实施方案中,可由代理人通过向受试者的护理人员施用一个或多个qolq以测量所述受试者的生活质量来评估花生过敏受试者的生活质量。在一些实施方案中,可通过向花生过敏受试者施用一个或多个qolq以及通过向受试者的护理人员施用一个或多个qolq以测量所述受试者的生活质量来评估花生过敏受试者的生活质量。在一些实施方案中,受试者的护理人员是意识到花生过敏对所述受试者的生理、情绪、财务和/或身体负担的任何个体。在一些实施方案中,受试者的护理人员是家庭成员(诸如父母、祖父母、兄弟姐妹、姑妈、叔叔、表亲等)或其他监护人(诸如法律指定的监护人)。
[0060]
在一些实施方案中,可通过施用一个或多个qolq以测量受试者的生活质量来评估花生过敏受试者的生活质量。在一些实施方案中,用于测量受试者的生活质量的该一个或多个qolq包括选自以下各项的一个或多个qolq:食物过敏生活质量-父母负担问卷(faql-pb)、食物过敏影响量表(fais)、食物过敏独立测量(faim)、食物过敏独立测量儿童表(faim-cf)、食物过敏独立测量少年问卷(faim-tf),食物过敏独立测量成人表(faim-af)、食物过敏独立测量父母表(faim-pf)、食物过敏父母问卷(fapq)、儿童健康问卷父母表(chq-pf)、父母食物过敏自我效能量表(fase-p)、儿科过敏疾病生活质量问卷(padqlq)、食
物过敏生活质量问卷-父母表(faqlq-pf)、食物过敏生活质量问卷-儿童表(faqlq-cf)、食物过敏生活质量问卷-少年表(faqlq-tf)、用于青少年的食物过敏生活质量评估工具(faql-teen)、您和您的食物过敏问卷,食物过敏生活质量问卷-成人表(faqlq-af)、36项简表健康调查(sf-36)、euroqol eq-5d(诸如euroqol 5d青年(eq-5d-y)或5级eq-5d(eq-5d-5l)、医院焦虑和抑郁量表(hads)、对花生过敏影响情绪和生活(appeal)调查和儿科生活质量清单(pedsql)。在一些实施方案中,该一个或多个qolq包括faqlq,诸如faqlq-cf、faqlq-tf、faqlq-af或faqlq-pf。在一些实施方案中,该一个或多个qolq包括自报告的faqlq-cf、faqlq-tf或faqlq-af。在一些实施方案中,该一个或多个qolq包括代理人报告的faqlq-pf。在一些实施方案中,该一个或多个qolq包括自我报告的faqlq-cf、faqlq-tf、faqlq-af和代理人报告的faqlq-pf。在一些实施方案中,该一个或多个qolq包括faim,诸如faim-cf、faim-tf、faim-af或faim-pf。
[0061]
qolq通常包括一个或多个得分域,其中每个域反映与受试者的生活质量相关的方面或类别。在一些实施方案中,qolq将沿标度为每个域分配数值得分。得分可在任何标度上,其中第一得分与较好的生活质量相关联,并且第二得分与较差的生活质量相关联。例如,标度可在1和5之间、1和6之间、1和7之间或任何其他选择的值。根据一些标度,较高的得分可用于指示较差的生活质量。还可基于qolq的多个域的平均得分来评估总得分、累积得分和/或多域得分。在一些实施方案中,qolq的域得分和/或总得分可被转换成通用标度,例如,在1和7之间的得分,其中7与较差的生活质量相关联,或者在第一得分和第二得分之间的得分,其中第二得分与较差的生活质量相关联。
[0062]
施用的qolq应适用于受试者和/或他们的护理人员。在一些实施方案中,将施用的该一个或多个qolq翻译成由受试者和/或他们的护理人员理解的语言。在一些实施方案中,验证施用的该一个或多个qolq,以确保对受试者和/或他们的护理人员的语言和文化适用性。
[0063]
在一些实施方案中,至少部分地由代理通过将关于受试者的qolq施用给受试者的护理人员来评估受试者的生活质量。在一些实施方案中,施用给受试者的护理人员以评估受试者的qol的qolq是设计用于对食物过敏(诸如花生过敏)受试者进行代理人评估的qolq。在非限制性示例性实施方案中,施用给受试者的护理人员以由代理人评估受试者的qol的qolq是faqlq-pf。
[0064]
可通过根据口服免疫疗法计划向受试者施用花生组合物和/或告知受试者他们根据口服免疫疗法计划将施用或正在施用花生组合物来改善花生过敏受试者的生活质量。随着受试者根据口服免疫疗法计划继续施用(和/或意识到他们将继续施用)花生组合物,受试者生活质量的所述改善可在改善之后持续一段时间(包括继续进一步改善)。即使受试者对花生蛋白的生理敏感性没有进一步改善,该改善也可持续,包括继续改善。因此,在一些实施方案中,受试者的生活质量改善约1个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月或60个月中的至少任一者。在一些实施方案中,当根据口服免疫疗法计划继续向受试者施用花生组合物时,受试者的生活质量改善约1个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月或60个月中的至少任一者。在一些实施方案中,在受试者已实现对花生蛋白的峰值脱敏(诸如通过口服食物挑战测量的)之后,受试者的生活质量改善约1个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月或60个月
中的至少任一者。
[0065]
在一些实施方案中,通过根据口服免疫疗法计划向受试者施用花生组合物和/或告知受试者他们根据口服免疫疗法计划将施用或正在施用花生组合物来改善花生过敏受试者的生活质量。在一些实施方案中,通过在一个或多个qolq的一个或多个域中的改善来确定生活质量的改善,其中对每个域进行评分。在一些实施方案中,每个域的得分被转换为第一得分与第二得分之间的得分,其中第二得分指示较差的生活质量。在一些实施方案中,在第一时间点和第二时间点处评估生活质量。在一些实施方案中,受试者在第一时间点和第二时间点之间的生活质量改善为至少最小临床重要差异。在一些实施方案中,第一时间点在口服免疫疗法之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段期间。在一些实施方案中,第一时间点在口服免疫疗法的维持阶段期间。在一些实施方案中,告知受试者在第一时间点之前根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,告知受试者在第一时间点处根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0066]
在一些实施方案中,通过在一个或多个qolq的一个或多个域中的改善来确定生活质量的改善,其中对每个域进行评分。在一些实施方案中,至少一个域是焦虑的量度。在一些实施方案中,至少一个域是情绪影响的量度,诸如对过敏的情绪影响和/或对治疗过敏的情绪影响。在一些实施方案中,至少一个域是社交影响的量度,诸如社交交互和/或参与的限制。在一些实施方案中,至少一个领域是饮食影响的量度,诸如卡路里摄取、饮食多样性和/或饮食排斥。在一些实施方案中,至少一个领域是预期的量度,诸如对治疗成功的预期和/或关于过敏反应未来发生率的预期和/或关于疾病状况改善的预期。在一些实施方案中,每个域的得分被转换为第一得分与第二得分之间的得分,其中第二得分指示较差的生活质量。在一些实施方案中,在第一时间点和第二时间点处评估生活质量。在一些实施方案中,在第一时间点的得分等于或大于标度的中点。例如,在示例性实施方案中,每个域以1至7的标度得分,其中7指示较差的生活质量,并且一个或多个域在第一时间点处的得分等于或大于标度的中点,该中点等于或大于4。在一些实施方案中,一个或多个域在第二时间点处的得分小于标度的中点。例如,在示例性实施方案中,每个域以1至7的标度得分,其中7指示较差的生活质量,并且一个或多个域在第二时间点处的得分小于标度的中点,该中点小于4。在一些实施方案中,第一时间点在口服免疫疗法之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段期间。在一些实施方案中,第一时间点在口服免疫疗法的维持阶段期间。在一些实施方案中,告知受试者在第一时间点之前根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,告知受试者在第一时间点处根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4
个月、至少5个月、至少6个月或至少12个月。
[0067]
在一些实施方案中,通过根据口服免疫疗法计划向受试者施用花生组合物和/或告知受试者他们根据口服免疫疗法计划将施用或正在施用花生组合物来改善花生过敏受试者的生活质量。在一些实施方案中,通过一个或多个qolq的总得分的改善来确定生活质量的改善,其中总得分是qolq的一个或多个域的平均值。在一些实施方案中,总得分被转换为第一得分与第二得分之间的得分,其中第二得分指示较差的生活质量。在一些实施方案中,在第一时间点和第二时间点处评估生活质量。在一些实施方案中,受试者在第一时间点和第二时间点之间的生活质量改善为至少最小临床重要差异。在一些实施方案中,第一时间点在口服免疫疗法之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段期间。在一些实施方案中,第一时间点在口服免疫疗法的维持阶段期间。在一些实施方案中,告知受试者在第一时间点之前根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,告知受试者在第一时间点处根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0068]
在一些实施方案中,通过一个或多个qolq的总得分的改善来确定生活质量的改善,其中总得分是qolq的一个或多个域的平均值。在一些实施方案中,总得分被转换为第一得分与第二得分之间的得分,其中第二得分指示较差的生活质量。在一些实施方案中,在第一时间点和第二时间点处评估生活质量。在一些实施方案中,在第一时间点的得分等于或大于标度的中点。例如,在示例性实施方案中,总得分以1至7的标度得分,其中7指示较差的生活质量,并且在第一时间点处的总得分等于或大于标度的中点,该中点等于或大于4。在一些实施方案中,在第二时间点处的总得分小于标度的中点。例如,在示例性实施方案中,每个域以1至7的标度得分,其中7指示较差的生活质量,并且一个或多个域在第二时间点处的得分小于标度的中点,该中点小于4。在一些实施方案中,第一时间点在口服免疫疗法之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段之前。在一些实施方案中,第一时间点在口服免疫疗法的加药阶段期间。在一些实施方案中,第一时间点在口服免疫疗法的维持阶段期间。在一些实施方案中,告知受试者在第一时间点之前根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,告知受试者在第一时间点处根据口服免疫疗法计划将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法计划的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0069]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-cf。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faqlq-cf的总得分是4或更高。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faqlq-cf的一个或多个域的得分是4或更高,诸如在过敏原避免和饮
食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在口服免疫疗法之前的第一时间点处向花生过敏受试者施用的faqlq-cf的总得分相比,在口服免疫疗法时间段之后的第二时间点处之后向所述受试者施用的faqlq-cf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,与在口服免疫疗法的加药阶段期间的第一时间点处向花生过敏受试者施用的faqlq-cf的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faqlq-cf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在口服免疫疗法之后的第二时间点处,与口服免疫疗法之前的第一时间点或口服免疫疗法的加药阶段期间的每个域中的得分相比,向花生过敏受试者施用的faqlq-cf的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,告知受试者在口服免疫疗法之前将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0070]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-cf。在一些实施方案中,在告知花生过敏受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前在第一时间点处向他们施用的faqlq-cf的总得分是4或更高。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前的第一时间点处向花生过敏受试者施用的faqlq-cf的一个或多个域的得分是4或更高,诸如在过敏原避免和饮食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在告知之前的第一时间点处向花生过敏受试者施用的faqlq-cf的总得分相比,在告知他们根据口服免疫疗法计划将施用或正在施用花生组合物之后的时间段之后的第二时间点处向所述受试者施用的faqlq-cf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之后的第二时间点处,与告知之前时间点处的每个域中的得分相比,向花生过敏受试者施用的faqlq-cf的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是治疗的至少一个月。在一些实施方案中,第一时间点和第二时间点之间的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0071]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-tf。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faqlq-tf的总得分是4或更高。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花
生过敏受试者施用的faqlq-tf的一个或多个域的得分是4或更高,诸如在过敏原避免和饮食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在口服免疫疗法之前的第一时间点处向花生过敏受试者施用的faqlq-tf的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faqlq-tf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,与在口服免疫疗法的加药阶段期间的第一时间点处向花生过敏受试者施用的faqlq-tf的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faqlq-tf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在口服免疫疗法之后的第二时间点处,与口服免疫疗法之前的第一时间点或口服免疫疗法的加药阶段期间的每个域中的得分相比,向花生过敏受试者施用的faqlq-tf的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,告知受试者在口服免疫疗法之前将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0072]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-tf。在一些实施方案中,在告知花生过敏受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前在第一时间点处向他们施用的faqlq-tf的总得分是4或更高。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前的第一时间点处向花生过敏受试者施用的faqlq-tf的一个或多个域的得分是4或更高,诸如在过敏原避免和饮食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在告知之前的第一时间点处向花生过敏受试者施用的faqlq-tf的总得分相比,在告知他们根据口服免疫疗法计划将施用或正在施用花生组合物之后的时间段之后的第二时间点处向所述受试者施用的faqlq-tf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之后的第二时间点处,与告知之前第一时间点处的每个域中的得分相比,向花生过敏受试者施用的faqlq-tf的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法的至少一个月。在一些实施方案中,第一时间点和第二时间点之间的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0073]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-af。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faqlq-af的总得分是4或更高。在一些
实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faqlq-af的一个或多个域的得分是4或更高,诸如在过敏原避免和饮食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,在食物过敏相关健康域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在口服免疫疗法之前的第一时间点处向花生过敏受试者施用的faqlq-af的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faqlq-af的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,与在口服免疫疗法的加药阶段期间的第一时间点处向花生过敏受试者施用的faqlq-af的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faqlq-af的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在口服免疫疗法之后的第二时间点处,与口服免疫疗法之前的第一时间点或口服免疫疗法的加药阶段期间的每个域中的得分相比,向花生过敏受试者施用的faqlq-af的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,在食物过敏相关健康域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,告知受试者在口服免疫疗法之前将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0074]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faqlq-af。在一些实施方案中,在告知花生过敏受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前在第一时间点处向他们施用的faqlq-tf的总得分是4或更高。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前的第一时间点处向花生过敏受试者施用的faqlq-af的一个或多个域的得分是4或更高,诸如在过敏原避免和饮食限制域中的得分是4或更高,在情续影响域中的得分是4或更高,在食物过敏相关健康域中的得分是4或更高,以及/或者在意外暴露风险域中的得分是4或更高。在一些实施方案中,与在告知之前的第一时间点处向花生过敏受试者施用的faqlq-af的总得分相比,在告知他们根据口服免疫疗法计划将施用或正在施用花生组合物之后的时间段之后的第二时间点处向所述受试者施用的faqlq-af的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在告知受试者根据口服免疫疗法计划将施用或正在施用花生组合物之后的第二时间点处,与告知之前第一时间点处的每个域中的得分相比,向花生过敏受试者施用的faqlq-af的域的得分有至少0.5分的改善,诸如在过敏原避开和饮食限制域中的至少0.5分,在情续影响域中的至少0.5分,在食物过敏相关健康域中的至少0.5分,以及/或者在意外暴露风险域中的至少0.5分。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括治疗的至少一个月。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0075]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是向受试者的护理人员施用的代理人报告的faqlq-pf。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向受试者的护理人员施用的faqlq-pf的总得分是4或更高。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向受试者的护理人员施用的faqlq-pf的一个或多个域的得分是4或更高,诸如在情绪影响域中的得分是4或更高,在食物相关焦虑域中的得分是4或更高,以及/或者在饮食和社交限制域中的得分是4或更高。在一些实施方案中,与在口服免疫疗法之前的第一时间点处向受试者的护理人员施用的faqlq-pf的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者的护理人员施用的faqlq-pf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,与在口服免疫疗法的加药阶段期间的第一时间点处向受试者的护理人员施用的faqlq-pf的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者的护理人员施用的faqlq-pf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在口服免疫疗法之后的第二时间点处,与口服免疫疗法之前的第一时间点或口服免疫疗法的加药阶段期间的每个域中的得分相比,向受试者的护理人员施用的faqlq-pf的域的得分有至少0.5分的改善,诸如在情绪影响域中的至少0.5分,在食物相关焦虑域中的至少0.5分,以及/或者在饮食和社交限制域中的至少0.5分。在一些实施方案中,告知受试者在口服免疫疗法之前将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0076]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是向受试者的护理人员施用的代理人报告的faqlq-pf。在一些实施方案中,在告知受试者根据口服免疫疗法计划将向他们施用或正在施用花生组合物之前在第一时间点处向受试者的护理人员施用的faqlq-pf的总得分是4或更高。在一些实施方案中,在告知受试者根据口服免疫疗法计划将向他们施用或正在施用花生组合物之前在第一时间点处向受试者的护理人员施用的faqlq-pf的一个或多个域的得分是4或更高,诸如在情绪影响域中的得分是4或更高,在食物相关焦虑域中的得分是4或更高,以及/或者在饮食和社交限制域中的得分是4或更高。在一些实施方案中,与在告知受试者之前的第一时间点处向受试者的护理人员施用的faqlq-pf的总得分相比,在告知受试者根据口服免疫疗法计划将向他们施用或正在施用花生组合物之后的时间段之后的第二时间点处向所述受试者的护理人员施用的faqlq-pf的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,在告知受试者根据口服免疫疗法计划将向他们施用或正在施用花生组合物之后的时间段之后的第二时间点处,与告知之前第一时间点处的每个域中的得分相比,向受试者的护理人员施用的faqlq-pf的域的得分有至少0.5分的改善,诸如在情续影响域中的至少0.5分,在食物相关焦虑域中的至少0.5分,以及/或者在饮食和社交限制域中的至少0.5分。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是口服免疫疗法的至少一个月。在一些实施方案中,第一时间点和第二时间点之间的口服
免疫疗法的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0077]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faim。在一些实施方案中,在口服免疫疗法之前的第一时间点处或口服免疫疗法的加药阶段期间,向花生过敏受试者施用的faim的总得分是4或更高。在一些实施方案中,与在口服免疫疗法之前的第一时间点处向花生过敏受试者施用的faim的总得分相比,在口服免疫疗法时间段之后的第二时间点处之后向所述受试者施用的faim的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,与在口服免疫疗法的加药阶段期间的第一时间点处向花生过敏受试者施用的faim的总得分相比,在口服免疫疗法时间段之后的第二时间点处向所述受试者施用的faim的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,告知受试者在口服免疫疗法之前将向他们施用花生组合物。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段包括维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0078]
在一些实施方案中,花生过敏受试者的生活质量由一个或多个qolq确定,其中至少一个qolq是faim。在一些实施方案中,在告知花生过敏受试者根据口服免疫疗法计划将施用或正在施用花生组合物之前在第一时间点处向他们施用的faim的总得分是4或更高。在一些实施方案中,与在告知之前的第一时间点处向花生过敏受试者施用的faim的总得分相比,在告知他们根据口服免疫疗法计划将施用或正在施用花生组合物之后的时间段之后的第二时间点处向所述受试者施用的faim的总得分有至少0.5分的改善,诸如至少1分、至少2分、至少3分或至少4分。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是治疗的至少一个月。在一些实施方案中,第一时间点和第二时间点之间的时间段包括口服免疫疗法的加药阶段。在一些实施方案中,第一时间点和第二时间点之间的口服免疫疗法的时间段是维持疗法的至少1个月,诸如维持疗法的至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少12个月。
[0079]
花生口服免疫疗法
[0080]
在一些实施方案中,在口服免疫疗法的过程期间,可通过根据给药计划向花生过敏受试者施用一系列剂量的花生蛋白组合物来改善受试者的生活质量。在一些实施方案中,在口服免疫疗法的过程期间,可通过告知花生过敏受试者根据给药计划将向受试者施用或正在施用一系列剂量的花生蛋白组合物来改善受试者的生活质量。在一些实施方案中,在口服免疫疗法的过程期间,可通过指导受试者的护理人员告知花生过敏受试者根据给药计划将向受试者施用或正在施用一系列剂量的花生蛋白组合物来改善受试者的生活质量。
[0081]
口服免疫疗法的全长(例如,加药阶段的持续时间)可根据年龄、健康状况、花生过敏的性质和类型、并发干预和/或复杂适应症等而有所不同。疗法通常是多阶段的,并且至少包括加药阶段和维持阶段。在一些实施方案中,口服免疫疗法还可包括加药阶段之前的初始递增阶段。可以周期性地调整或计划在加药阶段和维持阶段施用的花生蛋白组合物的
剂量以增加、减少或保持不变。可以基于受试者的医疗护理人员的判断和/或受试者的需要根据需要调整在加药阶段和维持阶段施用的花生蛋白组合物的剂量大小。
[0082]
诊断花生过敏的方法是本领域已知的,包括免疫测定(诸如花生特异性ige)、皮肤点刺测试、食物激发和试验性排除饮食。为了通过食物激发诊断花生过敏,受试者接受增加剂量的花生蛋白。在食物激发期间观察到的对花生蛋白的过敏反应表明受试者有花生过敏并且是花生口服免疫疗法的候选者。受试者在食物激发期间是否对特定剂量有反应的判断取决于测试标准,该标准可能有所不同。食物激发中的反应可以通过症状的严重程度(例如,轻度、中度或重度)和/或症状的可观察性(例如,症状是由患者主观报告还是由医疗护理人员客观观察)来判断。
[0083]
如本文所述接受花生oit治疗以改善受试者生活质量的受试者已知或疑似对花生过敏。在一些实施方案中,受试者先前已经尝试或完成花生蛋白oit。在一些实施方案中,先前的花生蛋白oit是无效的(例如,由于未能诱导可接受的脱敏、产生不可接受的过敏不良反应,未能赋予足够的保护以防止意外暴露于花生蛋白或未能改善受试者的生活质量),由于不适、不便(例如,由于每天给药或频繁的临床访问)或必要(例如,由于对花生蛋白剂量的反应和/或由于oit过程中的过敏不良事件)而被患者终止,或被终止患者的医疗提供者终止(例如,由于对花生蛋白剂量的过敏不良反应和/或由于oit过程中的过敏不良事件)。
[0084]
如本文所述,接受花生oit治疗以改善受试者的生活质量的受试者可能是未经治疗的,从未接受过花生oit治疗以改善他们的生活质量。通过诊断性暴露于花生蛋白而被诊断为花生过敏的受试者(诸如在食物激发中,但没有其他临床暴露于花生蛋白的病史)在诊断性暴露以用于本技术的目的后仍被认为是未经治疗的。
[0085]
接受口服免疫疗法治疗以改善他们的生活质量的受试者是人类受试者。在一些实施方案中,受试者约12个月以上,诸如约12个月至约48个月(例如,约12个月至约24个月、约24个月至约36个月或约36个月至约48个月)。在一些实施方案中,受试者为约4岁以上。在一些实施方案中,受试者介于4岁和不到18岁之间。在一些实施方案中,受试者为18岁以上。
[0086]
加药阶段在维持阶段之前,并且包括施用一系列递增剂量以达到在口服免疫疗法过程中向受试者施用的最大剂量。加药阶段的时间长度可以根据个体患者的需要进行调整,但通常在约22周至约40周内完成。对于一些患者,加药阶段可能持续长达2年或更长。例如,如果患者在剂量系列中开始较高剂量后经历过敏不良事件,则可以延长加药阶段。
[0087]
花生oit的加药阶段通常涉及在一段时间后(例如,近似每1周至4周)递增地增加所施用的花生蛋白剂量。系列中的特定剂量被重复地(例如,每天)施用于患者,直到前进至系列中的下一个剂量。在一些情况下,诸如当受试者不耐受系列中的特定剂量或受试者经历一个或多个过敏不良事件时,在推进至系列中的下一个剂量之前减少该剂量或重复系列中的该剂量一段时间。可以基于一个或多个所观察的过敏不良事件来调整加药的速率(例如,施用系列中的个体剂量的时间长度或系列中剂量之间的剂量增量的大小)。
[0088]
任选地,口服免疫疗法包括加药阶段之前的初始递增阶段,其中在一天或两天的过程中向受试者施用一系列递增剂量。初始递增阶段与加药阶段的区别在于其剂量范围较低、剂量递增间隔较短以及由受试者的医疗护理人员进行的监测通常更密切。例如,两天的初始递增可包括约0.5mg至约6mg花生蛋白的一系列剂量,诸如单个剂量为约0.5mg、约1mg、约1.5mg、约3mg和约6mg花生蛋白。初始递增阶段的最高耐受剂量或低于初始递增阶段中的
最高耐受剂量的剂量可以是加药阶段的第一剂量。如果受试者在初始递增阶段至少不耐受某一剂量,则可将该受试者从口服免疫疗法中排除。例如,如果受试者在施用0.5mg、1mg或1.5mg花生蛋白剂量后出现重度过敏不良事件,则可不允许该受试者进行到加药阶段。初始递增阶段的目的包括校准加药阶段的剂量(例如,加药阶段的初始剂量),以及确保受试者适合安全地进行加药阶段。
[0089]
在口服免疫疗法之前、期间或之后(诸如在加药阶段之前、期间或之后,或者在维持阶段之前、期间或之后),花生过敏受试者和/或受试者的护理人员可接受生活质量评估。
[0090]
维持阶段给药计划
[0091]
花生口服免疫疗法的维持阶段在达到加药阶段的最高剂量后开始。维持阶段超过约24周或更长,并且可能持续患者的整个人生。例如,维持阶段的长度可超过约28周、超过约32周、超过约36周、超过约40周、超过约44周或超过约48周。在一些实施方案中,维持阶段为约24周至约28周、约28周至约32周、约32周至约36周、约36周至约40周、约40周至约44周、约44周至约48周、约48周至约52周、约52周至约60周、约60周至约72周、约72周至约80周或多于约80周,诸如受试者的一生。在一些实施方案中,维持阶段长达约108周。
[0092]
在一些实施方案中,在维持阶段的至少一部分期间每天向受试者施用维持阶段剂量。在一些实施方案中,维持阶段剂量在维持阶段期间每日向受试者施用约6个月至约2年,诸如约6个月、约6个月至约12个月、约12个月至约18个月或约18个月至约2年。
[0093]
在维持阶段期间向受试者施用的花生蛋白的剂量介于约200mg和约1,000mg花生蛋白之间。例如,在一些实施方案中,维持阶段期间的剂量介于约200mg和约300mg花生蛋白、约300mg和约500mg花生蛋白、约500mg和约1,000mg花生蛋白之间或者为它们之间的值和范围。在示例性实施方案中,在维持阶段期间向受试者施用的维持阶段剂量为约300mg花生蛋白。
[0094]
加药阶段
[0095]
口服免疫疗法的加药阶段包括向患者施用一系列递增剂量,以比口服免疫疗法的最高剂量低的剂量开始,并且以口服免疫疗法的最高剂量结束。该系列剂量中的每个剂量周期性地(诸如每天)施用。该系列中的每个剂量可以包括每天施用花生蛋白组合物持续一段时间,诸如约1周至约4周,诸如约2周。在完成该系列中的特定剂量一段时间后,可以将治疗推进至该系列中的更高剂量。在一些实施方案中,治疗的加药阶段包括一系列2个和10个之间的不同剂量水平。如果受试者在加药阶段期间耐受特定剂量水平一段时间,则受试者可推进至加药阶段的该系列中的下一个剂量水平。如果受试者在加药阶段期间不能耐受特定剂量水平一段时间,则受试者可重复该系列中的当前剂量水平。另选地,如果受试者在加药阶段期间不能耐受特定剂量水平一段时间,则受试者可返回至该系列中的较早剂量水平。因此,加药阶段的持续时间取决于受试者的具体反应。受试者可根据需要多次重复该系列中的剂量,以达到该系列中的最高剂量。当耐受最高剂量两周时,加药阶段结束。
[0096]
在加药阶段期间施用的剂量的花生蛋白的药物组合物包含约0.5mg和约5,000mg之间的花生蛋白,诸如约0.5mg至约10mg花生蛋白、约10mg至约100mg花生蛋白、约100mg至约300mg花生蛋白、约300mg至约500mg花生蛋白、约500mg至约1,000mg花生蛋白、约1,000mg至约2,000mg花生蛋白或约2,000mg至约5,000mg花生蛋白以及它们之间的值和范围。在非限制性示例性实施方案中,加药阶段的剂量是每天施用初始递增阶段的最大耐受剂量(诸
如3mg或6mg花生蛋白),然后每天施用约12mg花生蛋白、约20mg花生蛋白、约40mg花生蛋白、约80mg花生蛋白、约120mg花生蛋白、约160mg花生蛋白、约200mg花生蛋白、约240mg花生蛋白和约300mg花生蛋白的一系列剂量,其中在推进至该系列中的下一个剂量之前,施用每个剂量水平约1周至约4周(诸如约2周)。在另一个示例性实施方案中,加药阶段的剂量是每天施用初始递增阶段的最大耐受剂量(诸如3mg或6mg花生蛋白),然后每天施用受试者的医疗护理人员规定的一系列递增日剂量,其中每个日剂量包含一个或多个选自由以下项组成的组的胶囊或药囊:0.5mg花生蛋白胶囊、1mg花生蛋白胶囊、10mg花生蛋白胶囊、20mg花生蛋白胶囊、100mg花生蛋白胶囊或300mg花生蛋白药囊,其中在推进至该系列中的下一个剂量之前,施用每个剂量水平约1周至约4周(诸如约2周)。
[0097]
加药阶段的该系列剂量通过调整所施用的剂量来区分。周期性地(诸如每周一次至每六周一次)调整加药阶段的该系列剂量中的剂量大小。在一些实施方案中,加药阶段包括每周剂量调整、每两周剂量调整、每三周剂量调整、每四周剂量调整、每五周剂量调整、每六周剂量调整或基于受试者的医疗护理人员的判断根据需要调整。可将剂量增加至该系列中的下一个计划剂量,响应于过敏不良事件而降低至该系列中的前一个剂量,在该系列中的当前剂量下维持另外的时间间隔,基于受试者的医疗护理人员的判断增加至该系列中的较高剂量,或基于受试者的医疗护理人员的判断降低至该系列中的较低剂量。在一些实施方案中,基于受试者的医疗护理人员对受试者不耐受该系列中的当前剂量的判断,在任何时候调整加药阶段。
[0098]
加药阶段进行直到受试者达到加药系列中的最终剂量。在一些实施方案中,加药阶段为约1个月至约6个月,诸如约1个月至约3个月或约3个月至约6个月。在一些实施方案中,加药阶段为约6个月至约2年,诸如约6个月至约1年、约1年至约18个月或约18个月至约2年。在非限制性示例性实施方案中,根据剂量减少和重新递增的次数以及剂量水平重复,通过12mg花生蛋白、20mg花生蛋白、40mg花生蛋白、80mg花生蛋白、120mg花生蛋白、160mg花生蛋白、200mg花生蛋白、240mg花生蛋白的剂量,加药阶段持续22周至2年,并以300mg花生蛋白终止。在所描述的实施方案中的任何实施方案中,当受试者耐受加药阶段的该系列中的最终剂量的计划剂量2周时,加药阶段终止,由此开始维持阶段。
[0099]
可计划加药阶段的该系列中的每个剂量持续约1周、约2周、约3周、约4周或它们之间的值和范围。基于对过敏不良事件的观察,受试者的护理人员可重复加药系列中受试者的当前剂量。可根据需要重复具有特定剂量的特定部分多次(诸如一次、两次、三次、四次或更多次),以使受试者对该剂量充分脱敏,诸如当受试者在意外(或故意)暴露于食物过敏原时不再经历中度或重度过敏不良事件。
[0100]
初始递增阶段
[0101]
任选地,口服免疫疗法包括在加药阶段之前的初始递增阶段。初始递增阶段可以确保口服免疫疗法对特定受试者的安全性和适用性。初始递增阶段在适当的医疗机构(诸如医生办公室或过敏门诊)在短时间(诸如一天或两天)内施用。受试者通常由医疗护理人员密切监测,医疗护理人员可以在发生需要干预的过敏不良反应时提供干预,诸如肾上腺素、沙丁胺醇和苯海拉明。口服免疫疗法的初始递增阶段(如果存在)包括向受试者施用多个小剂量的花生蛋白组合物。小剂量可以间隔一段时间,诸如约10分钟至约60分钟,并且可以包括1个、2个、3个、4个或5个或更多个剂量。
[0102]
初始递增阶段可包括约0.5mg和约6mg花生蛋白之间(诸如约0.5mg至约1.5mg花生蛋白、约1.5mg至约3mg花生蛋白或约3mg至约6mg花生蛋白)的剂量。在非限制性示例中,初始递增阶段包括在一天内从约0.5mg花生蛋白递增至最大约6mg花生蛋白的增量,其中单次剂量为约0.5mg、约1mg、约1.5mg、约3mg和约6mg花生蛋白,其中3mg或6mg花生蛋白剂量的耐受性表明受试者可以安全地进行到口服免疫疗法的加药阶段。
[0103]
用于口服免疫疗法的组合物
[0104]
用于治疗花生过敏的示例性组合物详细描述于美国公布2014/0271721中,该公布的内容以引用方式全文并入本文。用于制备花生蛋白质制剂的示例性方法详细描述于美国公布2014/0271836中,该公布的内容以引用方式全文并入本文。
[0105]
通过在花生蛋白口服免疫疗法的过程期间向受试者施用一系列剂量的花生蛋白组合物,可改善花生过敏受试者的生活质量。花生蛋白组合物优选为用于治疗花生过敏的包含一种或多种花生过敏原蛋白的药物组合物。在一些实施方案中,花生蛋白可从花生粉中分离,并且任选地还包含一种或多种稀释剂、一种或多种助流剂和/或一种或多种润滑剂。在一些实施方案中,花生蛋白的药物组合物包含约0.05%至约100%w/w的花生蛋白。
[0106]
在一些实施方案中,花生蛋白的药物组合物包含所表征的花生蛋白。在一些实施方案中,所表征的花生蛋白包含所表征的花生过敏原蛋白ara h1、ara h2和/或ara h6。在一个实施方案中,用于治疗花生过敏的最终制剂包含花生粉,该花生粉包含所表征的花生过敏原蛋白ara h1、ara h2和/或ara h6,这些花生过敏原蛋白与稀释剂、助流剂和润滑剂以包括含有约0.5mg和约5,000mg之间的花生蛋白的胶囊的分级剂量配制,以用于在口服免疫疗法的加药、维持和/或初始递增阶段施用。
[0107]
在本文所描述的方法中的任何方法中,用于在口服免疫疗法的维持阶段施用的花生蛋白的药物组合物可包含约200mg至约1,000mg之间的花生蛋白(诸如约200mg和约250mg之间的花生蛋白、约250mg和约300mg之间的花生蛋白、约300mg和约500mg之间的花生蛋白以及约500mg和约1,000mg之间的花生蛋白)的剂量。在非限制性优选实施方案中,用于在口服免疫疗法的维持阶段施用的花生蛋白的剂量为约300mg花生蛋白。
[0108]
在一些实施方案中,用于在口服免疫疗法的加药阶段施用的花生蛋白的药物组合物包含约0.5mg和约5,000mg之间的花生蛋白,诸如一系列中的单个剂量为约3mg、约6mg、约10mg、约12mg、约20mg、约40mg、约80mg、约100mg、约120mg、约160mg、约200mg、约240mg和约300mg花生蛋白。在非限制性示例性实施方案中,用于在口服免疫疗法的加药阶段施用的花生蛋白的剂量是每天施用初始递增阶段的最大耐受剂量(诸如约3mg花生蛋白或约6mg花生蛋白),然后每天施用由受试者的医疗护理人员规定的一系列递增日剂量,其中每个日剂量包含一个或多个选自由以下项组成的组的胶囊或药囊:约0.5mg花生蛋白胶囊、约1mg花生蛋白胶囊、约10mg花生蛋白胶囊、约20mg花生蛋白胶囊、约100mg花生蛋白胶囊或约300mg花生蛋白药囊,其中在推进至下一个剂量之前,施用每个剂量水平约1周至约4周(诸如约2周)。
[0109]
在本文所描述的方法中,口服免疫疗法可任选地包括初始递增阶段。在一些实施方案中,用于在口服免疫疗法的初始递增阶段施用的花生蛋白的药物组合物包含约0.5mg和约6mg之间的花生蛋白,诸如单个剂量为约0.5mg、约1mg、约1.5mg、约3mg和约6mg花生蛋白。在一些实施方案中,用于在口服免疫疗法的初始递增阶段施用的花生蛋白的药物组合
物包含约0.5mg和约6mg之间的花生蛋白,诸如单个剂量为约0.5mg、约1mg、约1.5mg、约3mg、约6mg和约12mg花生蛋白。
[0110]
示例性实施方案
[0111]
通过参考以下示例性实施方案可更好地理解本发明。然而,这些示例性实施方案并非旨在限制本文所述的本发明的范围。
[0112]
实施方案1.改善花生过敏患者的生活质量的方法包括:根据口服免疫疗法计划向所述患者施用花生组合物。
[0113]
实施方案2.根据实施方案1所述的方法,其中告知所述患者正在施用所述花生组合物。
[0114]
实施方案3.根据实施方案2所述的方法,其中告知所述患者在所述口服免疫疗法计划开始时正在向所述患者施用所述花生组合物。
[0115]
实施方案4.根据实施方案2所述的方法,其中告知所述患者在所述口服免疫疗法计划的加药阶段期间正在向所述患者施用所述花生组合物。
[0116]
实施方案5.根据实施方案2所述的方法,其中告知所述患者在所述口服免疫疗法计划的维持阶段期间正在向所述患者施用所述花生组合物。
[0117]
实施方案6.根据实施方案1所述的方法,所述方法还包括告知所述患者正在向所述患者施用所述花生组合物。
[0118]
实施方案7.根据实施方案6所述的方法,其中告知所述患者在所述口服免疫疗法计划开始之前正在向所述患者施用所述花生组合物。
[0119]
实施方案8.根据实施方案6所述的方法,其中告知所述患者在口服免疫疗法计划的加药阶段期间正在向所述患者施用所述花生组合物。
[0120]
实施方案9.根据实施方案6所述的方法,其中告知所述患者在所述口服免疫疗法计划的维持阶段期间正在向所述患者施用所述花生组合物。
[0121]
实施方案10.根据实施方案1至9中任一项所述的方法,其中使用生活质量问卷(qolq)来测量所述生活质量改善。
[0122]
实施方案11.根据实施方案10所述的方法,其中所述qolq包括一个或多个得分的测量域。
[0123]
实施方案12.根据实施方案11所述的方法,其中所述qolq是食物过敏生活质量问卷(faqlq)。
[0124]
实施方案13.根据实施方案12所述的方法,其中所述faqlq是faqlq-儿童表(faqlq-cf)、faqlq-少年表(faqlq-tf)、faqlq-成人表(faqlq-af)或faqlq-父母表(faqlq-pf)。
[0125]
实施方案14.根据实施方案10所述的方法,其中所述qolq是食物过敏独立测量(faim)。
[0126]
实施方案15.根据实施方案14所述的方法,其中所述faim是faim-儿童表(faim-cf)、faim-少年表(faim-tf)、faim-成人表(faim-af)或faim-父母表(faim-pf)。
[0127]
实施方案16.改善花生过敏患者的生活质量的方法,如通过生活质量问卷(qolq)所评估的,所述方法包括根据口服免疫疗法计划向所述患者施用花生组合物。
[0128]
实施方案17.根据实施方案16所述的方法,其中告知所述患者正在施用所述花生
组合物。
[0129]
实施方案18.根据实施方案17所述的方法,其中告知所述患者在所述口服免疫疗法计划开始时正在向所述患者施用所述花生组合物。
[0130]
实施方案19.根据实施方案17所述的方法,其中告知所述患者在所述口服免疫疗法计划的加药阶段期间正在向所述患者施用所述花生组合物。
[0131]
实施方案20.根据实施方案17所述的方法,其中告知所述患者在所述口服免疫疗法计划的维持阶段期间正在向所述患者施用所述花生组合物。
[0132]
实施方案21.根据实施方案16所述的方法,所述方法还包括告知所述患者正在向所述患者施用所述花生组合物。
[0133]
实施方案22.根据实施方案21所述的方法,其中告知所述患者在所述口服免疫疗法计划开始之前正在向所述患者施用所述花生组合物。
[0134]
实施方案23.根据实施方案21所述的方法,其中告知所述患者在口服免疫疗法计划的加药阶段期间正在向所述患者施用所述花生组合物。
[0135]
实施方案24.根据实施方案21所述的方法,其中告知所述患者在所述口服免疫疗法计划的维持阶段期间正在向所述患者施用所述花生组合物。
[0136]
实施方案25.根据实施方案16至24中任一项所述的方法,其中所述qolq包括一个或多个得分的测量域。
[0137]
实施方案26.根据实施方案25所述的方法,其中所述qolq是食物过敏生活质量问卷(faqlq)。
[0138]
实施方案27.根据实施方案26所述的方法,其中所述faqlq是faqlq-儿童表(faqlq-cf)、faqlq-少年表(faqlq-tf)、faqlq-成人表(faqlq-af)或faqlq-父母表(faqlq-pf)。
[0139]
实施方案28.根据实施方案25所述的方法,其中所述qolq是食物过敏独立测量(faim)。
[0140]
实施方案29.根据实施方案28所述的方法,其中所述faim是faim-儿童表(faim-cf)、faim-少年表(faim-tf)、faim-成人表(faim-af)或faim-父母表(faim-pf)。
[0141]
实施方案30.根据实施方案25所述的方法,其中所述qolq是儿科生活质量清单(pedsql)。
[0142]
实施方案31.根据实施方案1至30中任一项所述的方法,其中所述生活质量改善至少6个月。
[0143]
实施方案32.根据实施方案1至31中任一项所述的方法,其中所述生活质量改善至少12个月。
[0144]
实施方案33.根据实施方案11至13或25至27中任一项所述的方法,其中所述qolq的所述一个或多个得分域各自在1和7之间的标度上得分,或者各自转换为第一得分和第二得分之间的得分,其中所述第二得分指示较差的生活质量。
[0145]
实施方案34.根据实施方案11至13或25至27中任一项所述的方法,其中与口服免疫疗法的时间段之前的第一时间点处的评估相比,在口服免疫疗法的所述时间段之后的第二时间点处,所述患者的生活质量在所述qolq的一个或多个域中至少有0.5分的改善。
[0146]
实施方案35.根据实施方案11至17或25至34中任一项所述的方法,其中与口服免
疫疗法的时间段之前的第一时间点处的评估相比,在口服免疫疗法的所述时间段之后的第二时间点处,所述患者的生活质量在所述qolq的总得分中至少有0.5分的改善;其中所述总得分是每个域得分的平均值。
[0147]
实施方案36.根据实施方案34或实施方案35所述的方法,其中所述第一时间点和所述第二时间点之间的口服免疫疗法的所述时间段是所述口服免疫疗法计划的所述加药阶段。
[0148]
实施方案37.根据实施方案34或实施方案35所述的方法,其中所述第一时间点和所述第二时间点之间的口服免疫疗法的所述时间段是所述口服免疫疗法计划的维持疗法的至少1个月。
[0149]
实施方案38.根据实施方案1至37中任一项所述的方法,其中在所述口服免疫疗法计划的6个月之后,所述生活质量改善。
[0150]
实施方案39.根据实施方案1至38中任一项所述的方法,其中所述口服免疫疗法计划包括加药阶段和维持阶段。
[0151]
实施方案40.根据实施方案39所述的方法,其中在所述维持阶段期间每天向所述患者施用所述花生组合物。
[0152]
实施方案41.根据实施方案39或实施方案40所述的方法,其中所述维持阶段为至少3个月。
[0153]
实施方案42.根据实施方案39至41中任一项所述的方法,其中在所述口服免疫疗法计划的维持阶段期间以约300mg花生蛋白或更多的剂量向所述患者施用所述花生组合物。
[0154]
实施方案43.根据实施方案39至42中任一项所述的方法,其中所述加药阶段包括向所述患者施用约3mg和约初始维持阶段剂量的所述剂量之间的两种或更多种不同剂量。
[0155]
实施方案44.根据实施方案1至43中任一项所述的方法,其中所述口服免疫疗法计划包括长度约3个月和约2年之间的加药阶段。
[0156]
实施方案45.根据实施方案1至44中任一项所述的方法,其中所述口服免疫疗法计划还包括初始递增阶段。
[0157]
实施方案46.根据实施方案1至45中任一项所述的方法,其中所述患者为约4岁以上。
[0158]
实施方案47.根据实施方案1至46中任一项所述的方法,其中所述患者在约4岁和约17岁之间。
[0159]
实施方案48.根据实施方案1至47中任一项所述的方法,其中所述患者在约8岁和约17岁之间。
[0160]
实施方案49.根据实施方案1至48中任一项所述的方法,其中所述方法包括在根据口服免疫疗法计划向所述患者施用花生组合物之前测量所述生活质量。
[0161]
实施方案50.根据实施方案1至49中任一项所述的方法,其中所述方法包括在根据口服免疫疗法计划向所述患者施用花生组合物之后测量所述生活质量。
[0162]
实施方案51.根据实施方案2至15或17至50中任一项所述的方法,其中所述方法包括在告知所述患者正在施用所述花生组合物之后测量所述生活质量。
[0163]
实施方案52.根据实施方案1至51中任一项所述的方法,其中如通过生活质量问卷
(qolq)所确定的,所述患者的所述生活质量得到改善。
[0164]
实施例
[0165]
通过参考作为本技术的示例性实施方案提供的以下非限制性示例,可更好地理解本技术。给出以下实施例是为了更全面地说明实施方案,然而,决不应被解释为限制本技术的广泛范围。虽然本文已示出和描述了本技术的某些实施方案,但显而易见的是,此类实施方案仅以举例的方式提供。在不脱离本发明的实质和范围的情况下,本领域的技术人员可想到许多变型、改变和替换。应当理解,在实施本文所述的方法时,可采用本文所述实施方案的各种替代形式。
[0166]
实施例1
–
花生过敏对生活质量的影响
[0167]
进行了一项研究来评估花生过敏对美国患者和护理人员的实际负担。
[0168]
在本研究的一部分中,自我报告的、提供者诊断的花生过敏的13岁至17岁的青少年以及13岁至17岁的青少年的护理人员完成了验证的、适龄的食物过敏生活质量问卷(faqlq-tf用于自我报告或者faqlq-pf用于代理人报告;其中对于每个答案1=无问题,并且7=极端问题)。进行了组间分析(卡方;t检验)。青少年(n=102)和青少年的护理人员(n=94)完成了调查。青少年中的关键人口统计变量和疾病病史变量(自我报告与代理人报告)相似。相对于护理人员,青少年报告称,花生过敏给他们的日常生活带来的限制以及对影响情绪健康的反应的恐惧给他们带来了更大的负担,并且在避免直接接触花生方面更加小心。青少年与护理人员的评估相比在faqlq情绪量表上具有较高的得分(即,较差的生活质量)(平均值5.07对4.21,p《0.001)。青少年和护理人员在pa的最相关方面也有显著差异,与青少年的护理人员相比,青少年表达了关于反应期间身体症状以及花生过敏对家庭的影响的更多关注。总之,与护理人员相比,青少年报告了较差的生活质量(对日常生活、情绪健康和faqlq情绪量表的影响)、对反应的身体症状的较大关注和对家庭的影响,以及更小心避免暴露于花生。
[0169]
在完成faqlq-tf的自我报告的青少年中,许多变量与faqlq-tf总得分在统计意义上显著相关:社会心理变量,包括恐惧反应对情感健康的影响(p《0.001)、日常生活限制(p《0.001)、对肾上腺素自动注射器进入的担忧(p《0.001)、应对反应的信心(p=0.025)、一生中使用高级干预措施(er、医院、iv肾上腺素或插管)的总数(p=0.003)以及他们最严重反应的严重性(p=0.006)。与年龄、性别、其他食物过敏的数量以及其他健康状况、自最近一次反应和自最近一次严重反应以来的时间、一生中的中度/重度反应次数以及最近一年中的反应次数没有统计意义上的显著相关性。这些数据表明,社会心理变量和修改日常活动以实践避免的需要,以及由于暴露而需要寻求高级治疗的病史与降低的特定于疾病的生活质量相关联。
[0170]
在本研究的另一个部分中,自我报告、提供者诊断的花生过敏的13岁至17岁的青少年完成了儿科生活质量清单(pedsql;得分0至100,较高的得分是较好的生活质量)。进行了组间分析(卡方;t检验)。花生过敏青少年(n=102)的平均pedsql总得分为48.8。平均子标度得分为:身体(53.6)、情绪(43.0)、社交(48.2)、学校(46.0)和社会心理(44.5)。这些得分显著低于8岁至16岁的普通人群的量表得分(n》5900;范围78.2-87.0)并且超过最小临床重要差异(4.36分至9.12分)。过去一年中经历≥1次花生过敏相关反应的青少年具有显著较低的pedsql总得分(p=0.008),过去一年中接受≥1次花生过敏反应的临床医生干预的
青少年也是如此(p《0.001,那些对目前花生过敏反应的预防方法“完全不满意”到“有点满意”的人(p=0.012),那些说花生过敏“有点”到“完全”限制了他们的日常生活的人(p=0.013),或者那些报告有“很大”到“100%机会”不能有效处理反应的人)。因此,花生过敏青少年具有比相似年龄个体的普通群体显著更低的pedsql得分。pedsql总得分在由最近的过敏反应/需要临床医生干预、对反应预防的满意度、对日常生活的感知限制以及对他们处理反应的能力的担忧所限定的亚组之间显著不同。
[0171]
实施例2
–
花生口服免疫疗法临床试验
[0172]
a)双盲临床试验。用年龄为4岁至49岁的花生过敏受试者进行随机、双盲、安慰剂对照的3期临床试验(palisade)。受试者经历初始递增,然后经历加药阶段,达到每天300mg的目标剂量的花生蛋白,接着经历大约六个月的维持阶段,包括每天施用300mg的花生蛋白。参见jones等人,efficacy and safety of ar101 in peanut allergy:results from a phase 3,randomized,double-blind,placebo-controlled trial(palisade),j.allergy clin.immunol.,第141卷第2期,增刊ab400,2018年;以及vickery等人,ar101 oral immunotherapy for peanut allergy,n.engl.j.med.,第379卷,第21期,第1991-2001页,2018年。
[0173]
在基线筛选和退出palisade时,受试者(自我报告)以及他们的父母或监护人/护理人员(代理人报告)完成了适龄的食物过敏生活质量问卷(faqlq;例如,faqlq-cf、faqlq-tf或faqlq-pf)。计算年龄≥8岁的受试者和4岁至17岁的受试者的父母/护理人员的域和总得分。为了在整个临床试验中报告结果,使用常见项目(即,问题)将自我报告faqlq得分组合成单个儿童、少年和成人表(称为faqlq-ctaf)。标度范围为1至6或1至7,其中较高的分数指示较差的qol。还评估了与人口统计变量和疾病病史变量的关系。367名花生过敏受试者和442名父母/护理人员完成了基线评估。结果表明花生过敏对受试者的生活质量具有显著影响。对于自我报告,情绪影响具有最高的得分(4.80),然后是过敏原避免和饮食限制(4.40),以及意外暴露的风险(4.20)。对于父母/护理人员,食物焦虑具有最高的得分(4.23),然后是社交和饮食限制(4.17)和情绪影响(3.82)。参见wang等人,impact of peanut allergy on quality of life:baseline results from palisade,a phase 3,double-blind,placebo-controlled trial for ar101 oral immunotherapy,j.immunol.第143卷第2期,2019年。
[0174]
在基线筛选和退出palisade时,受试者(自我报告)以及他们的父母或监护人(代理人报告)也完成了适龄的食物过敏独立测量(faim;例如,faim-cf或faim-pf)。faim问卷由预期结果和疾病严重程度问题组成。每个faim问题的得分为从1到7,其中较高的评分指示较差的qol(例如,最大严重程度的感知或较差的对结果的期望)。
[0175]
b)开放标签扩展。一些用活性制剂(即,非安慰剂)治疗的palisade完成者选择参与开放标签扩展(ole)后续临床试验,其中告知受试者他们将继续接受活性治疗。在开始ole(在palisade退出时)之前,受试者(自我报告)和/或他们的父母或护理人员/监护人(代理人报告)完成了适龄的faqlq(例如,faqlq-cf、faqlq-tf或faqlq-pf)或faim(例如,faim-cf或faim-pf)。如上所述,为了在整个试验中报告结果,使用共同项目组合自我报告的faqlq得分。参与ole的受试者另外接受大约6个月(即,大约28周)的维持疗法,该维持疗法包括每天施用300mg花生蛋白。在ole维持疗法的另外大约6个月结束时(即,在总共大约52
周的每日300mg花生蛋白维持疗法之后),受试者接受退出双盲安慰剂对照食物挑战(dbpcfc)。受试者和/或其父母/护理人员完成了退出适龄的faqlq(例如,faqlq-cf、faqlq-tf、或faqlq-pf)和faim(例如,faim-cf或faim-pf)。
[0176]
c)结果。110名花生过敏受试者进入ole,并且103名完成了另外6个月的日常维持疗法。在参与ole试验的那些中,62.7%在4岁和11岁之间,并且剩余的37.2%在12岁和17岁之间。
[0177]
在ole结束时完成faqlq自我评估的8岁和17岁之间的68名患者中,与faqlq palisade基线评估相比,在所有个体量表(过敏避免和饮食限制、意外暴露风险和情绪影响)和总得分(全部p《0.01)中均观察到了高于开发者报告的最小临床重要差异(mcid)的统计意义上的显著改善,如图1所报告。在ole结束时完成faim自我评估的8岁和17岁之间的72名患者中,在对结果的预期问题和总得分中观察到超过开发者报告的mcid的统计意义上的显著改善。对于产品避免和社交影响的问题,观察到低于mcid的降低。受试者报告从palisade筛选到palisade退出(盲法时间段)以及从palisade退出到ole退出(开放标签时间段)的qol改善。对于faqlq自我报告,这些变化具有相似的量值。
[0178]
如图2所报告,由父母/监护人完成的faqlq-pf的三个域中的两个对于参与ole的93名花生过敏受试者也观察到统计意义上的显著改善(社交限制和饮食限制:p《0.01;食物焦虑:p《0.05;情绪影响:p=0.07),并且与基线faqlq-pf基线评估相比,总得分也是显著的(p《0.01)。然而,代理人报告的faqlq得分中没有一个超过指示如开发者报告的mid的阈值。对于faim问卷,仅从13岁以下儿童的父母/护理人员收集了儿童对结果的期望值(通过代理人)。在完成ole的花生过敏儿童的这62名父母/护理人员中,观察到儿童对结果的预期(通过代理人)域的统计意义上的显著降低,尽管该降低不超过开发者报告的mcid。在完成ole的花生过敏儿童的91名父母/护理人员中,父母/护理人员对结果的预期域表明在ole结束时域得分在统计意义上的显著降低。该降低超过了开发者报告的mid。与自我报告的qol测量相比,代理人所报告的qol的大部分改善是在告知花生过敏受试者他们正在接收花生蛋白质组合物之后,即,在开放标签周期之后。
[0179]
还通过食物挑战结果、不良事件和肾上腺素使用的变量来分析这些faqlq和faim数据。如图3所示,基于ole退出双盲安慰剂对照食物挑战中600mg花生蛋白剂量的耐受、palisade或ole临床试验期间全身过敏反应的发生以及palisade或ole临床试验期间肾上腺素的使用来划分完成ole的受试者。在图3中,faim的代理人报告限制在年龄为4岁至12岁的受试者的儿童对结果得分的预期。花生蛋白oit始终与自我评估的qol的改善相关联。oit的疗效(如通过口服食物挑战、全身过敏反应的存在以及肾上腺素的使用所测量的)与改善降低相关联,但与基线相比仍有改善。令人惊讶的是,代理人报告的qol的改善一致地不如自我评估显著,这表明父母/护理人员低估了他们孩子的qol的改善。在口服食物挑战中不耐受600mg花生蛋白剂量的儿童与耐受600mg花生蛋白剂量的儿童相比,父母/护理人员的代理人报告的qol的差异也比自我评估更显著。
[0180]
d)另外的处理队列。除了上述患者队列(称为开放标签扩展的“队列1”)之外,另一个患者队列进入开放标签扩展(称为“队列3a”)。与队列1的受试者一样,队列3a的受试者是已经用活性制剂(即,非安慰剂)治疗并选择参与开放标签扩展后续临床试验的palisade完成者,其中告知受试者他们将继续接受活性治疗。在开始ole(在palisade退出)之前,队列
3a的受试者(自我报告)和/或他们的父母或护理人员/监护人(代理人报告)完成了适龄的faqlq或faim,与上述队列1的受试者一样。队列3a的受试者另外接受大约56周的维持疗法,该维持疗法包括每天施用300mg花生蛋白。在维持疗法的另外大约56周结束时(即,在总共大约82周的每日300mg花生蛋白维持疗法之后),受试者接受退出双盲安慰剂对照食物挑战。队列3a的受试者和/或他们的父母/护理人员完成了退出适龄的faqlq和faim。
[0181]
31名受试者被分配到队列3a,其中16名完成退出faqlq,17名完成退出faim评估。与队列1一样,队列3a的受试者的faqlq得分超过开发者报告的mid,即总得分-0.5(平均变化-0.63,范围-1.36,0.11)。在队列1中,所有子域均超过了mid,而在队列3a中,仅情绪影响改善超过了mid。就两个队列而言,faim总得分超过mid(就队列1而言,n=72,平均变化-0.60,范围-0.83至-0.36;对于队列3a,n=17,平均变化-0.83,范围-1.39至-0.37)。对于faim,仅受试者对结果的期望得分超过mid,而在队列3a中,所有子域faim得分均改善超过了mid。这些结果表明,在告知受试者进行活性疗法之后,他们的生活质量的总体改善在较长的维持疗法中得以维持。
[0182]
总之,这些结果表明花生oit可显著改善患者报告的跨测量域的qol。这些改善可能超出患者的父母/护理人员的期望。在初始筛选和初始退出测量之间发生改善,其中初始退出测量在第一次试验揭盲之后立即进行,并且在初始脱敏和维持时间段之后立即进行。然而,即使在盲法试验期间实现了显著的脱敏,但在揭盲法开放标签扩展试验期间生活质量的改善仍继续显现,从而导致整个群体甚至更显著的改善。
[0183]
实施例3
–
欧洲花生口服免疫疗法临床试验
[0184]
a)试验设计。欧洲3期试验(artemis)是针对花生过敏儿童进行的,这些儿童在入组双盲安慰剂对照食物挑战(dbpcfc)期间经历了≤300mg花生蛋白(约1颗花生仁)的剂量限制症状。该试验是在七个欧洲国家的18个地点进行的随机、安慰剂对照、多中心试验:爱尔兰、法国、德国、意大利、西班牙、瑞典和英国。
[0185]
如果年龄为4岁至17岁的儿童具有花生过敏的临床病史,与阴性对照相比,平均花生皮肤点刺测试(spt)风团直径≥3mm,以及/或者血清花生特异性免疫球蛋白e(psige)水平≥0.35kua/l(如通过所测定),并且在入组dbpcfc期间经历了≤300mg花生蛋白剂量限制症状,则这些儿童有资格登记。主要排除标准包括在筛选dbpcfc后60天内发生过任何严重或危及生命的过敏反应发作、严重或不受控制的哮喘、嗜酸性食管炎病史、或未确诊病因的慢性、复发性或严重胃肠(gi)症状。
[0186]
将有资格的受试者在为期一天的初始剂量递增期以3:1的比例随机化到活性药物(ar101;研究性生物药物,包含花生蛋白)或安慰剂组,其中他们在试验地点监控下依次给予0.5mg至6mg的剂量。在加药阶段的20周至40周期间,受试者接受日剂量的花生蛋白(ar101)或安慰剂。每周增加剂量,直到达到300mg剂量并维持3个月(初始3mg至最终300mg)。在维持阶段期间,受试者在家中接受300mg花生蛋白的日剂量持续12周。在试验结束访视时进行退出dbpcfc,并且在耐受情况下用另外的600mg和1,000mg花生蛋白挑战剂量。主要终点是在dbpcfc存在时可食用单剂量的1,000mg花生蛋白(约3颗至4颗花生仁)而没有剂量限制症状的参与者的比例。另外的终点包括不良事件(ae)的频率和严重程度,以及食物过敏相关生活质量(qol)的变化。
[0187]
使用faqlq和faim测量评估qol。适龄版本的faqlq和faim由年龄为8岁至12岁和13
岁至17岁的参与者以及所有护理人员在试验期间的两个时间点完成:在筛选dbpcfc之前和在试验结束访视时,在退出dbpcfc并且揭盲之后立即进行。两个工具利用七分标度,其中一分指示最小损伤,七分指示最大损伤,并且≥0.5的变化被认为已超过开发者引用的最小重要差异(mid)。
[0188]
b)结果。所有主要端点和次要端点均得到满足。在132名接受活性治疗的参与者中有77名(58.3%)耐受1,000mg花生蛋白退出挑战剂量,而安慰剂有1名(2.3%)(治疗差异:56.0%;95%ci:44.1,65.2;p《0.0001)。
[0189]
在接收ar101的参与者中发现自我报告和护理人员代理人报告的生活质量评估的显著改善。在所有faqlq域中,在活性组中年龄为8岁至12岁的参与者中自我报告改善的qol。总得分和“过敏原避免和饮食限制”以及“意外暴露的风险”域的改善具有统计意义上的显著性(活性—安慰剂的ls平均差异分别为[95%ci]:-1.09[-1.95,-0.22];-1.18[-2.06;-0.30];-1.20[-2.26,-0.15];所有的p《0.05)。
[0190]
在所有faim域上观察到自我报告和代理人报告的qol的改善程度不同。与安慰剂组相比,活性组的参与者和护理人员分别在“严重反应的可能性”和“意外过敏原暴露而死亡的几率”域自我报告和代理人报告了得分得到改善,超过mid。改善的得分是护理人员针对“有效治疗/在意外暴露时进行治疗”域的代理人报告和自我报告(ls平均治疗不同活性
–
安慰剂[95%ci]护理人员4岁至12岁自我报告:0.85[-0.17,1.88]p》0.05;护理人员4岁至12岁代理人报告:0.67[-0.43,1.77]p》0.05;护理人员13岁至17岁自我报告:0.98[0.03,1.94]p=0.04)。faqlq和faim结果汇总于图4至图6中。
[0191]
由于暴露于过敏物质,如预期的,与安慰剂组相比,活性参与者经历了更多与治疗相关的不良事件,这可能会降低生活质量。针对该预期,与安慰剂组相比,未在活性组中的任何faqlq或faim域中观察到到达mid的qol的恶化。
