光敏神经组织的组合光和电刺激
1.相关申请的交叉引用
2.本技术要求2019年6月26日提交的澳大利亚临时专利申请号 2019902232的优先权,该澳大利亚临时专利申请的全部内容以引用方式并入本文。
技术领域
3.本公开总体上涉及神经组织的刺激,并且具体地涉及用于刺激经遗传修饰以表达光敏蛋白的神经元的方法和设备。
背景技术:
4.神经组织的刺激,也称为神经调节,提供了一种干预神经系统运作的手段。神经调节装置(诸如人工耳蜗或起搏器)通常使用电刺激来触发靶神经组织的神经元中的动作电位。然而,提高空间选择性和减少侵入性的需求已经促使人们对其他神经调节方法(诸如光遗传学)越来越感兴趣。
5.光遗传学涉及对神经元进行遗传工程化以在神经元的质膜中表达光敏离子通道,使得暴露于光(或某些波长的光)可触发靶神经元中的膜去极化。
6.对本说明书中所包括的对文献、法案、材料、装置、制品等的任何讨论不应因为其在所附权利要求中的每一条权利要求的优先权日期之前已经存在而被认为是承认任何或所有这些内容形成现有技术基础的一部分或者是与本公开相关的领域中的一般常识。
技术实现要素:
7.根据一个方面,本公开提供了一种用于刺激神经组织的方法,所述神经组织包括至少一个经遗传修饰以表达光敏蛋白的神经元,所述方法包括:
8.对所述神经组织施加光刺激;以及
9.对所述神经组织施加电刺激,从而在所述神经组织的一个或多个神经元中触发膜去极化。
10.由于对神经组织施加光刺激和电刺激两者,因此所公开的方法应被视为提供神经组织的组合电和光刺激或“共刺激”(本文中也描述为神经组织的“混合刺激”)。
11.在一些实施方案中,膜去极化包括动作电位。在其他实施方案中,膜去极化包括亚阈值去极化事件。亚阈值去极化事件可以“启动”或使神经组织更易响应于进一步的刺激被兴奋。
12.光刺激的功率水平可以低于阈值功率水平,以在不存在电刺激 (即,只有光刺激)的情况下触发至少一个神经元中的动作电位。类似地,电刺激的功率水平可以小于阈值功率水平,以在不存在光刺激 (即,只有电刺激)的情况下触发至少一个神经元中的动作电位。
13.如本文所用,当提及体外组织刺激时,阈值光功率水平(在本文中也称为100%光功率水平)被定义为这样的光刺激的光功率水平,所述光功率水平将导致有0.5的概率(即,
2分之1的机会)在不存在任何其他刺激的情况下响应于光刺激在至少一个神经元中唤起动作电位。类似地,对于体外组织刺激,阈值电功率水平(在本文中也称为100%电功率水平)被定义为这样的电刺激的电功率水平,所述电功率水平将导致有0.5的概率(即,2分之1的机会)在不存在任何其他刺激的情况下响应于电刺激在至少一个神经元中唤起动作电位。
14.如本文所用,当提及体内组织刺激时,阈值光功率水平(100%光功率水平)被定义为这样的光刺激的光功率水平,所述光功率水平将导致在自发放电率与最大放电率之间的神经元放电率增加30%。类似地,对于体内组织刺激,阈值电功率水平(100%电功率水平)被定义为这样的电刺激的电功率水平,所述电功率水平将导致在自发放电率与最大放电率之间的神经元放电率增加30%。
15.如上所定义的低于或高于阈值功率水平的功率水平分别被认为是“亚阈值”或“超阈值”,并且可以表示为光阈值功率水平或电阈值功率水平的百分比。应当理解的是,阈值功率水平可以根据光刺激或电刺激的选定持续时间而变化。在一些实施方案中,所述方法还可包括在施加光刺激和施加电刺激之前确定阈值光功率水平和/或阈值电功率水平。
16.在一些实施方案中,光刺激的功率水平是亚阈值并且电刺激的功率水平是超阈值。在一些实施方案中,光刺激的功率水平是超阈值并且电刺激的功率水平是亚阈值。在一些实施方案中,光刺激的功率水平是亚阈值并且电刺激的功率水平是亚阈值。在一些实施方案中,光刺激的功率水平是超阈值并且电刺激的功率水平是超阈值。
17.在一些实施方案中,当光刺激的功率水平是亚阈值时,光刺激的功率水平可以在光阈值功率水平的约5%至95%之间。例如,光刺激的功率水平可为光阈值功率水平的约5%、10%、20%、30%、40%、 50%、60%、70%、80%、90%、95%,或其他。
18.在一些实施方案中,当电刺激的功率水平是亚阈值时,电刺激的功率水平可以在电阈值功率水平的约5%至95%之间。例如,电刺激的功率水平可为电阈值功率水平的约5%、10%、20%、30%、40%、 50%、60%、70%、80%、90%、95%,或其他。
19.在一些实施方案中,光刺激和电刺激的阈值功率水平的组合百分比可以小于100%。作为一个示例,光刺激可以是阈值光功率水平的40%,并且电刺激可以是阈值电功率水平的40%(在这个示例中提供为40%+40%=80%的组合百分比)。应当理解的是,可以使用百分比的各种组合来响应于共刺激(组合的电和光刺激)引发膜去极化。在其他实施方案中,光和电刺激的阈值功率水平的组合百分比可大于 100%。
20.通过利用光刺激和电刺激两者的亚阈值功率水平,所公开的方法可以降低人工刺激神经元的功率需求,从而导致与仅电刺激或仅光刺激相比增加的神经调节能量效率。此外,与仅电刺激或仅光刺激相比,刺激功率或刺激强度的降低可以减少来自神经组织的光刺激或电刺激的不希望的副作用。不希望的副作用可包括对受刺激细胞的光毒性或电损伤。例如,通过光吸收导致或来自光源(例如,嵌入式led或电池)的温度或热积聚可能会导致细胞损伤。此外,使用低(亚阈值) 功率水平的电刺激来兴奋神经元的能力可以使得能够对已知神经调节装置进行设计修改。例如,使用较低电功率水平进行刺激的能力可以改善与电极上的电荷密度有关的设计约束,从而潜在地使得能够使用具有较小有效电极面积的电极。
21.在电刺激的功率水平为亚阈值的实施方案中,该方法可导致电流在受刺激的神经组织内的传播减少,由此允许提高所施加的刺激的空间分辨率,从而提供更精确的靶神经
元激活。此外,与传统的仅电刺激相比,亚阈值功率电刺激可生成减少的刺激伪影。这可以提高对刺激的神经反应的记录的品质。
22.此外,光敏神经组织的组合电和光刺激可以提供提高的时间准确性,从而与仅光刺激相比以更快的速度刺激神经元。这在诸如人工耳蜗植入系统的应用中可为特别有利的,在所述应用中使用快速放电率来表示声音信息。该方法可以使得能够以比仅光刺激更高的频率刺激光敏神经组织,而无需重新工程化光敏蛋白以具有更快的动力学特性。因此,本方法可能导致更高的空间和/或时间精度。
23.所施加的光刺激的持续时间可以大于约0.1ms、0.5ms、1ms、或其他。所施加的光刺激的持续时间可以小于约100ms、小于约50 ms、小于约20ms、或其他。例如,光刺激的持续时间可以在约0.1ms 至100ms之间、0.1ms至50ms之间、0.1ms至20ms之间、0.5ms 至100ms之间、0.5ms至50ms之间、0.5ms至20ms之间、1ms 至100ms之间、1ms至50ms之间、1ms至20ms之间、或其他。例如,光刺激的持续时间可以是约0.1ms、0.2ms、0.5ms、1ms、2ms、 4ms、6ms、8ms、10ms、12ms、14ms、16ms、18ms、20ms、 30ms、40ms、50ms、100ms、或其他。光刺激的持续时间可以被配置为对应于受刺激的神经元达到期望(或峰值)兴奋性水平所需的时间段。应当理解的是,对于具有较高功率水平的光刺激,可以减少达到期望的兴奋性水平所需的光刺激的持续时间。在光刺激的施加停止之后,神经元的兴奋性增强时段(在本文中也称为“促进时段”)可以持续。例如,在利用某些视蛋白(诸如阶跃函数视蛋白(step function opsin, sfo)或稳定化的阶跃函数视蛋白(stabilised step function opsin,ssfo)) 的实施方案中,在光刺激的施加停止之后,兴奋性增强时段可以持续数秒或数分钟。
24.电刺激的施加可以与光刺激的施加开始同时开始,或者在光刺激的施加开始之后的预定延迟时间处开始。预定延迟时间可以在约0.1 ms至约60ms之间,或是其他。例如,预定延迟时间可以是约0.1ms、 0.2ms、0.5ms、1ms、5ms、10ms、15ms、20ms、25ms、30ms、 40ms、50ms、60ms、或更长时间。在一些实施方案中,预定延迟时间可经选择为使得电刺激基本上在受刺激的神经元处于由光刺激导致的兴奋性增强状态下的时段内开始。在一些实施方案,诸如采用阶跃函数视蛋白的实施方案中,兴奋性增强状态可以在光刺激的施加停止之后持续相对较长的时间段,该时间段为秒或分钟的量级。在一些实施方案中,预定延迟时间可以长达30分钟。例如,预定延迟时间可以是约0.1s、0.2s、0.3s、0.4s、0.5s、0.6s、0.8s、1s、2s、3 s、4s、5s、10s、15s、20s、30s、45s、1分钟、2分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、或更长时间。在一些替代实施方案中,电刺激可以在光刺激之前开始。
25.有可能在由光刺激引起的神经元兴奋性增强时段内传递多个电脉冲。在一些实施方案中,电刺激可以作为一系列脉冲或作为脉冲串施加。在此类实施方案中,电脉冲中的一个或多个电脉冲可以在光刺激的施加开始之后或之前的预定延迟时间发生。在一些实施方案中,电刺激可以基本上连续地施加,例如,作为基本上连续的一系列脉冲。在一些实施方案中,电脉冲可以以预定脉冲频率施加。例如,预定脉冲频率可以在约5hz至约5khz之间,或更高。例如,频率可以为约或可以大于5hz、10hz、20hz、30hz、40hz、50hz、60hz、 70hz、80hz、90hz、100hz、150hz、200hz、300hz、400hz、 500hz、600hz、700hz、800hz、900hz、1khz、2khz、3khz、 4khz、5khz、或更高。根据本公开进行的组合光和电刺激可以使得能够使用比单独光刺激可能的更高的脉冲频率来触发膜去极化。
26.在一些实施方案中,预定延迟时间大于光刺激的施加的持续时间,使得电刺激的
施加在光刺激的施加停止之后开始。在其他实施方案中,预定延迟时间小于光刺激的施加的持续时间,使得电刺激的施加在光刺激的施加停止之前开始。
[0027]“施加”可以被认为是在将光或电刺激信号或脉冲分别递送至神经组织的光或电刺激元件处于活动或“导通”状态时发生。如本文所述,所施加的电或光刺激的开始、起始或出现被定义为相关联的刺激信号或脉冲的前沿半最大值。类似地,所施加的电或光刺激的结束或停止被定义为相关联的刺激信号或脉冲的后沿半最大值。如上所述,在光刺激的施加停止之后,由于光刺激的施加而导致的神经元兴奋性增强时段可持续。
[0028]
施加电刺激与光刺激的施加停止之后的兴奋性增强时段相重合可以进一步降低光刺激的不希望的副作用(诸如光毒性)的风险,因为可能不需要一直施加光刺激来有效刺激神经组织生成动作电位。此外,在此类实施方案中可以实现提高的能量效率,因为不需要同时施加光刺激和电刺激,这可以减少刺激的瞬时和/或总体功率要求。
[0029]
与此相关,根据一个方面,提供了一种用于刺激神经组织的方法,所述组织包括一个或多个经遗传修饰以表达光敏蛋白的神经元,所述方法包括:
[0030]
对所述神经组织施加光刺激;以及
[0031]
对所述神经组织施加电刺激;
[0032]
从而在所述神经元中的至少一个神经元中触发膜去极化,
[0033]
其中电刺激的施加在光刺激的施加停止之后开始。
[0034]
在光刺激的施加的停止与电刺激的施加的开始之间可能存在时间间隔。电刺激的施加可以在光刺激的施加停止之后在约0.1ms至约 60ms之间或其他时间开始。例如,电刺激的施加可以在光刺激的施加停止之后约0.1ms、0.2ms、0.5ms、1ms、5ms、10ms、15ms、 20ms、25ms、30ms、40ms、50ms、60ms、或更长时间开始。在一些实施方案中,停止之后的时间可经选择为使得电刺激基本上在受刺激的神经元处于由光刺激导致的兴奋性增强状态下的时段内开始。在一些实施方案,诸如采用阶跃函数视蛋白的实施方案中,兴奋性增强状态可以在光刺激的施加停止之后持续相对较长的时间段,该时间段为秒或分钟的量级。在一些实施方案中,电刺激的施加可在光刺激的施加停止后长达30分钟开始,例如在光刺激的施加停止后约0.1s、 0.2s、0.3s、0.4s、0.5s、0.6s、0.8s、1s、2s、3s、4s、5s、10s、 15s、20s、30s、45s、1分钟、2分钟、5分钟、10分钟、15分钟、 20分钟、25分钟、30分钟或更长时间开始。
[0035]
在一些实施方案中,光刺激可以作为一系列脉冲或作为脉冲串施加以维持至少一个靶神经元的兴奋性。在一些实施方案中,光刺激可以是基本上连续的。
[0036]
光刺激可以包括具有在紫外光(uv)、可见光或红外光谱中的波长的光。光刺激可包括波长在约300nm至约2000nm之间的光。然而,在一些实施方案中,可优选的是光刺激包括可见光谱中的光,并且因此可以排除例如红外光或紫外光。例如,光刺激可包括波长在约380 nm至约740nm之间的光。在一些实施方案中,光刺激可包括波长在约450nm至约600nm之间的光。
[0037]
光的波长可经选择为对应于经遗传修饰的神经元的光敏蛋白的一种或多种波长敏感性。在一些实施方案中,光刺激可包括多个离散波长的光。在一些实施方案中,光刺激可包括具有跨越预定波段的连续波长范围的光。在其他实施方案中,光刺激可以包括具有单个离散波长的光。
[0038]
通过依赖光敏、经光遗传学修饰的组织,特别是通过使用波长可在可见光谱内的
光,本技术可与红外神经刺激技术有很大不同,红外神经刺激技术依赖于神经组织的热激活机制,由此温度的快速变化会触发靶神经元中的动作电位。
[0039]
根据一个方面,本公开提供了一种被配置为执行前述方面的方法的设备。该设备可包括用于选择性地施加光刺激的光刺激装置;以及用于选择性地施加电刺激的电刺激装置。
[0040]
与此相关,根据一个方面,本公开提供了一种被配置为刺激神经组织的设备,所述组织包括一个或多个经遗传修饰以表达光敏蛋白的神经元,所述设备包括:
[0041]
光刺激装置,所述光刺激装置用于对神经组织选择性地施加光刺激;以及
[0042]
电刺激装置,所述电刺激装置用于对神经组织选择性地施加电刺激;
[0043]
从而在神经元中的至少一个神经元中触发膜去极化。
[0044]
该设备可为至少部分可植入的。该设备可包括可植入外壳或基板,所述可植入外壳或基板支撑光刺激装置的至少部分和/或电刺激装置的至少部分。该设备可被配置为部分植入在人类或动物患者中以用于诊断和/或治疗目的。
[0045]
光刺激装置可包括光能源和用于将来自光能源的光能施加至神经组织的至少一个光刺激元件。至少所述光刺激元件可为可植入的。例如,至少所述光刺激元件,以及任选地光刺激元件和光能源两者,可以由可植入的外壳或基板支撑。
[0046]
类似地,电刺激装置可包括电能源和用于将电能施加至神经组织的至少一个电刺激元件。至少所述电刺激元件可为可植入的。例如,至少所述电刺激元件,以及任选地电刺激元件和电能源两者,可以由可植入的外壳或基板支撑。
[0047]
在一些实施方案中,外壳或基板可包括神经接口部分,所述神经接口部分可被配置为定位成接近或直接接触待刺激的神经组织。电刺激元件和光刺激元件可以定位在神经接口部分之上或之中,或者以其他方式由神经接口部分支撑。神经接口部分可以是基板或外壳的面向和/或接触待刺激的神经组织的表面。至少所述外壳或基板的神经接口部分可以是柔性的,和/或预先形成有某一形状,使得它可以基本上符合待刺激的神经组织的形状。
[0048]
在一些实施方案中,该设备还包括用于控制光刺激和电刺激的施加的系统控制器。例如,系统控制器可被配置用于选择性地触发光刺激和电刺激的施加。系统控制器可被配置为在触发光刺激的施加之后预定延迟时间触发电刺激的施加。另外地或替代地,系统控制器可被配置为控制持续时间和/或光和电刺激的功率水平。
[0049]
在一些实施方案中,该设备还包括被配置为检测神经活动的记录装置。记录装置可包括记录电极,所述记录电极连接至示波器、控制器、计算机接口、或其他信号处理设备,例如神经反应遥测设备或听觉脑干反应设备。在一些实施方案中,记录装置的记录电极可包括电刺激装置的电刺激元件。在此类实施方案中,电刺激元件可以选择性地可操作为刺激或记录电极。或者,记录装置可以是钙成像设备。记录装置可被配置为检测、记录和/或监测神经组织对光和电刺激的反应。例如,记录装置可检测膜电位的变化和/或响应于电和/或光刺激而生成的动作电位。另外或替代地,记录装置可被配置为测量与电和 /或光刺激相关联的参数,包括刺激的持续时间或功率水平或刺激之间的延迟时间。在一些实施方案中,记录装置可以使得能够进行设备的闭环控制。
[0050]
所公开的方法和设备可用于刺激神经组织以改变身体(例如,人类患者的身体)中
选定神经部位处的神经元的活动。该方法和设备可用作神经假体装置的一部分,以补充或替代患者的神经系统的正常功能。例如,该方法和设备可用作人工耳蜗植入系统的一部分,以触发听神经中的动作电位并提供或增强听觉。一般而言,该方法和设备可用于各种神经调节应用,包括但不限于听觉神经刺激、听觉脑干刺激、脊髓刺激、深部脑刺激、功能性电刺激、脑机接口、外周神经刺激、视网膜刺激或其他神经刺激应用。此类应用可为可用的,例如用于检测和/或治疗听力损失、癫痫、抑郁症、运动神经元疾病和其他治疗性应用。
[0051]
在整篇本说明书和权利要求书中,词语“包括”或变型形式诸如“包含”或“含有”应理解为暗示包括所述要素、整数或步骤、或成组的要素、整数或步骤,而不排除任何其他要素、整数或步骤、或成组的要素、整数或步骤。
附图说明
[0052]
图1示出了根据本公开的实施方案在刺激神经组织的方法中进行的步骤的流程图,所述组织包括一个或多个经遗传修饰以表达光敏蛋白的神经元;
[0053]
图2示出了图1的方法的光刺激和电刺激的图形表示;
[0054]
图3a示出了根据本公开的实施方案的被配置为执行图1的方法的设备的系统图;
[0055]
图3b示出了根据本公开的另一实施方案的被配置为执行图1的方法的设备的系统图;
[0056]
图4a和图4b示出了根据本公开的实施方案的设备的示意图;
[0057]
图5a示出了经遗传修饰的神经元对仅电(e)、仅光学(o)、以及光学和电共刺激(o+e)的反应的典型迹线,其中光功率和电功率均处于亚阈值电平;
[0058]
图5b示出了映射在神经元的共刺激期间唤起动作电位的刺激水平的几种组合的图;
[0059]
图5c、图5d和图5e示出了从在两种刺激之间的不同延迟和不同功率水平下的光学和电共刺激获得的迹线;
[0060]
图6a示出了仅电(e)、仅光学(o)、光学和电共刺激(o+e)以及全电共刺激(e+e,其中光刺激时段被电斜坡替换)的刺激模式的比较;
[0061]
图6b示出了响应于电(e)、光学(o)以及光学和电共刺激(o+e) 而生成的动作电位的比较;
[0062]
图6c示出了由光学和电共刺激生成的一系列叠加的动作电位迹线,其中在光学刺激的出现与电刺激的出现之间具有不同的延迟时间;
[0063]
图6d示出了光学和电共刺激引发基于所述光学刺激与所述电刺激之间的延迟时间的动作电位的概率,所述概率叠加了膜电位的平均变化;
[0064]
图6e比较了亚阈值和超阈值光学和电刺激的时间常数;
[0065]
图7a示出了由全电(e+e)刺激生成的一系列叠加的动作电位迹线,其中在电斜坡与电触发脉冲之间具有不同的延迟时间;
[0066]
图7b示出了作为全电(e+e)刺激的延迟时间的函数的放电概率,该放电概率叠加了膜电位的平均变化;
[0067]
图7c示出了相对于最大膜电位绘制的膜去极化率;
[0068]
图7d示出了在电脉冲之前有和没有光学脉冲的情况下,电调节脉冲之后是电测试
脉冲的最大唤起电流与测试电位之间的关系;
[0069]
图7e示出了在各种刺激模式的动作电位尖峰上升期间的平均 dvm/dt;
[0070]
图8a和图8b分别示出了细胞对10hz和20hz下的组合光学和电脉冲串响应的典型电压迹线;
[0071]
图8c示出了不同频率下脉冲串的适应率和矢量强度;
[0072]
图8d示出了在不同刺激模式和不同脉冲频率下达到0.5的放电率所需的电刺激功率水平的图表;
[0073]
图8e示出了对增加电功率的平均放电概率的比较,所述比较是按脉冲频率分组的;
[0074]
图9示出了体外单细胞膜对单独施加的亚阈值光学和亚阈值电脉冲(小图a)的响应,以及当亚阈值光学和亚阈值电脉冲被作为混合刺激施加时膜的放电概率(小图b);
[0075]
图10a示出了在转基因小鼠中使用的体内实验方案;
[0076]
图10b示出了在新霉素暴露之前和紧接之后的转基因小鼠短音 abr阈值的比较;
[0077]
图11示出了光栅图,所述光栅图指示了在不同时间延迟下的亚阈值光雪、亚阈值电和组合光和电(混合)刺激之后何时检测到了神经反应;
[0078]
图12示出了电刺激阈值的百分比,在所述电刺激阈值处,在光学脉冲开始与电脉冲开始之间的各种延迟下对9个耳蜗的混合刺激引起神经反应;
[0079]
图13示出了光栅图,所述光栅图比较了不同刺激速率下仅光学刺激和混合刺激实现的夹带;
[0080]
图14示出了单独的超阈值光学刺激和混合刺激的跟随百分比的示例;
[0081]
图15示出了与使用单独的光学刺激相比,当使用混合刺激时跟随率的平均增加;
[0082]
图16示出了正常听力chr2-h134小鼠的下丘(inferior colliculus, ic)响应于声刺激生成的反应(小图a),以及急性失聪chr2-h134r转基因小鼠的下丘对电刺激、混合刺激和光学刺激的反应(小图b、小图c、小图d);并且
[0083]
图17示出了在高于阈值的不同鉴别指数水平(d’)的强度下评定的兴奋宽度。
具体实施方式
[0084]
现在描述根据本公开的实施方案的用于刺激神经组织的方法。
[0085]
参照图1的流程图100,公开了一种根据本公开的实施方案的用于刺激神经组织的方法,所述组织包括一个或多个经遗传修饰以表达光敏蛋白的神经元。所述方法包括向神经组织施加光刺激110和向神经组织施加电刺激120,从而在神经元中的至少一个神经元中触发膜去极化。流程图100中描绘的方法步骤的相对位置不应解释为将这些步骤限制为以任何特定次序执行。
[0086]
在图2中,光刺激110的施加和电刺激120的施加均以图形方式表示,其中x轴代表时间并且y轴代表刺激功率。光刺激110具有持续时间112和光功率水平114。类似地,电刺激120具有持续时间 122和电功率水平124。应当理解的是,作为施加光刺激110和施加电刺激120的结果而递送至神经组织的能量的量可以根据相应刺激的所选持续时间和功率水平而变化。
[0087]
光刺激110的施加的开始111和电刺激120的施加的开始121相隔预定延迟时间
130,使得电刺激120的施加在光刺激110的施加开始之后开始。在所图示的实施方案中,预定延迟时间130大于光刺激 110的持续时间112。结果,电刺激120的施加的开始121发生在光刺激110的施加的停止113之后,在光刺激110的施加的停止113与电刺激120的施加的开始之间存在时间间隔。然而,将理解的是,预定延迟时间130可以小于光刺激110的持续时间112,使得电刺激120 的施加的开始121发生在光刺激110的施加的停止113之前(即,使得电刺激的施加与光刺激110的施加至少部分重叠)。在一些实施方案中,预定延迟时间130可被配置为使得电刺激120的施加的开始 121与光刺激110的施加的结束113重合。
[0088]
在一些实施方案中,预定延迟时间130可被配置为对应于受刺激的经遗传修饰的神经元响应于光刺激110而达到兴奋性峰值水平所需的时段。如下面更详细讨论的图6d的示例中所示,神经元的放电概率ap/脉冲(即,响应于电刺激的施加而在神经元处获得动作电位的概率)可以与由于光刺激110的施加而导致的神经元的膜电位变化δvm强相关,使得当朝向光刺激110的施加的结束113或在所述光刺激的施加停止之后开始电刺激120的施加时,在神经元中响应于电刺激120的施加而生成动作电位的机会最大化。
[0089]
在一些实施方案中,电刺激可以作为一系列电脉冲施加。在一些实施方案中,电脉冲可以以预定脉冲频率施加,例如,在约5hz至约5khz之间或更高。例如,图8a至图8e示出了来自使用电刺激的刺激的实验数据,所述电刺激包括在各种预定脉冲频率下的脉冲串。可以根据手头的神经刺激应用来选择脉冲频率。例如,相对较低的脉冲频率,诸如约130hz,可用于诸如深部脑刺激的应用,而高达 5khz或更高的相对较高的脉冲频率可用于诸如听觉神经刺激的应用以产生听觉知觉。根据本公开进行的组合光和电刺激可以使得能够使用比单独光刺激可能的更高的脉冲频率来触发膜去极化。
[0090]
适用于本文所述方法的设备200在图3的系统图中示出。设备 200被配置为刺激神经组织,该组织包括一个或多个经遗传修饰以表达光敏蛋白的神经元。设备200包括用于对神经组织选择性地施加光刺激的光刺激装置210和用于对神经组织选择性地施加电刺激的电刺激装置220,从而在至少一个神经元中触发膜去极化。
[0091]
任选地,设备200包括用于控制光刺激和电刺激的施加的系统控制器230。系统控制器230可选择性地触发光刺激110的施加并且选择性地触发电刺激120的施加。系统控制器230可被配置为依次触发光刺激和电刺激的施加,使得在光刺激的施加之后预定延迟时间130 触发电刺激的施加。系统控制器230可被配置为控制光刺激110和电刺激120的各种参数,包括电刺激和光刺激的持续时间112、122和功率水平114、124或其他。
[0092]
设备200任选地包括记录装置240,所述记录装置可包括例如记录电极,所述记录电极连接至示波器、计算机接口、神经反应遥测系统或其他信号处理装置。记录装置240可被配置为监测受刺激的神经组织对施加的电和/或光刺激的反应。另外或替代地,记录装置240 可被配置为监测所施加的光和/或电刺激的参数,包括持续时间、功率水平和时间延迟。如图3a中的虚线所示,记录装置240可以与系统控制器230相关联。或者,记录装置240可以与电刺激装置220集成在一起,如图3b所示。例如,系统控制器240可被配置为基于从记录装置240接收的数据自动调整电刺激120和光刺激110的参数,从而提供对设备200的闭环控制。
[0093]
参考图4a,该设备可包括部分地支撑光刺激装置210和电刺激装置220的可植入基板250。基板250包括神经接口部分252,该神经接口部分被配置为定位成接近(或直接接触)
待刺激的神经组织。例如,如图4a所示,神经接口部分252可以是基板250的面向和/或接触待刺激的神经组织的表面。神经接口部分252可以是柔性的,和/ 或预先形成有某一形状,使得它可以基本上符合待刺激的神经组织的形状。
[0094]
在该实施方案中,光刺激装置210包括连接至多个光刺激元件 212的至少一个光能源214。光能源214可以选自包括激光器、发光二极管(light-emitting diode,led)和激光二极管或其他合适的光能源的组。
[0095]
电刺激装置类似地包括通过导体226连接至多个电刺激元件的至少一个电能源224。电能源224可包括电信号发生器或其他合适的电能源。电刺激元件222可以是用于将电能施加至神经组织的电极 222的形式。
[0096]
在该实施方案中,多个光刺激元件212和多个电刺激元件222布置成阵列,每个元件沿着神经接口部分252间隔开,以用于将光刺激 110和电刺激120施加至神经组织。
[0097]
在一些实施方案中,光能由光发射器216从光能源214发射至光刺激元件212。光发射器可以是光纤、波导(或其他合适的光传输设备)。在一些实施方案中,光刺激元件212还包括折射器和/或反射器以用于将光能更多地引导至神经组织。
[0098]
在替代实施方案中,光能可以局部地生成至神经接口部分252以用于直接照射神经组织(例如,光能源214可以与光刺激元件212成为一体,因此不需要光发射器)。例如,光刺激装置210可包括支撑在可植入基板250上的一个或多个激光器、微型led或其他合适的光源。
[0099]
在图4a所示的实施方案中,光刺激元件212和电刺激元件222 离散地定位。然而,在替代实施方案中,光和电部件可以至少部分地进行组合。例如,可以提供与电刺激元件222整体或部分集成的光刺激装置210。例如,参考图4b所示的实施方案,神经接口部分252 包括多个电极222形式的电刺激元件,所述电刺激元件具有嵌入式微型led形式的集成光刺激装置210。作为另一示例,虽然未示出,但是光刺激元件可以由光纤(或光纤束)的端部提供,并且电刺激元件可以由光纤或光纤束的导电外涂层提供。
[0100]
尽管所示实施方案示出了电和光刺激元件的一维线性阵列,但是在上述实施方案中的任一个实施方案中,阵列可以是二维或三维的。
[0101]
在本公开的上下文中使用的术语“经遗传修饰的”是指在将新核酸(即,对细胞外源的核酸)引入细胞后在所述细胞中诱导的永久性或瞬时遗传改变。遗传改变(“修饰”)可以通过将新核酸掺入宿主细胞的基因组中来实现,或者通过将新核酸作为染色体外元件的瞬时或稳定维持来实现。当细胞是真核细胞时,可以通过将核酸引入细胞基因组来实现永久性遗传改变。在本公开的上下文中,所引入的核酸编码光敏蛋白。
[0102]
各种合适的遗传修饰方法是本领域已知的。例如,可以使用本领域已知的神经外科技术,诸如通过立体定位注射(参见例如,davidson 等人,nat.genet.,1993,3:219-223;和alisky和davidson,hum.genether.,2000,11:2315-2329)或荧光镜透视检查,用针、导管或相关装置将编码本文所公开的光敏蛋白的表达载体直接递送至中枢或外周神经系统的神经元。其他合适的基因修饰方法包括病毒感染、转染、接合、原生质体融合、电穿孔、粒子枪技术和磷酸钙沉淀。在一个示例中,可以使用报告基因或选择性标记来鉴定经遗传修饰的神经元。在另一个示例中,可以基于在本文中公开的经遗传修饰的神经元的光敏蛋白表达来鉴定所述经遗传修饰的神经元。例如,可以使用常规的基于扩增的检测方法(诸如
pcr)来测量编码光敏蛋白的核酸的水平。在其他示例中,光敏蛋白水平可以通过免疫组织化学或基于elisa的测定来评定。
[0103]
各种表达载体可用于对本文所公开的神经元进行遗传修饰。术语“表达载体”在本公开的上下文中用于指能够促进核酸在宿主细胞中表达的基因构建体。表达载体可以以分离的多核苷酸,例如“裸dna”的形式存在,或者可包含一种或多种增强递送至宿主细胞的试剂,诸如病毒衣壳和/或包膜、脂质或聚合物。因此,本公开所涵盖的表达载体的示例包括但不限于裸dna、噬菌体、病毒、纳米粒子诸如基于脂质的纳米粒子、质粒、线性dna、粘粒、附加体、微环dna(例如,如us 2004/0214329中所述)、和细菌。通常,表达载体能够转化神经元宿主细胞并实现编码光敏蛋白的核酸的表达。表达载体的选择将取决于多种因素,诸如宿主、载体的免疫原性、光敏蛋白生产所需的持续时间等。在一个示例中,表达载体是病毒载体。在一些示例中,表达载体指导光敏蛋白在特定神经元细胞类型中的表达。因此,在一些示例中,表达载体包含细胞类型特异性启动子。例如,表达载体可包含螺旋神经节神经元细胞特异性启动子。
[0104]
神经组织包含神经元,并且构成神经组织的一个或多个神经元可以经遗传修饰以表达光敏蛋白。因此,可以通过本公开的方法刺激神经元的个体或群体。对通过本文所公开的方法刺激的神经元没有特别限制,只要它们表达光敏蛋白即可。示例性神经元包括中枢或外周神经系统的神经元。例如,可以通过本文所公开的方法刺激的神经元包括感觉神经元、运动神经元、中间神经元和大脑中的神经元。在一个示例中,通过本文所公开的方法刺激的神经元是感觉神经元。在另一个示例中,神经元是运动神经元。在另一个示例中,神经元是中间神经元。在另一个示例中,神经元是大脑中的神经元。在另一个示例中,神经元是螺旋神经节神经元。在另一个示例中,神经元是视网膜神经元。
[0105]
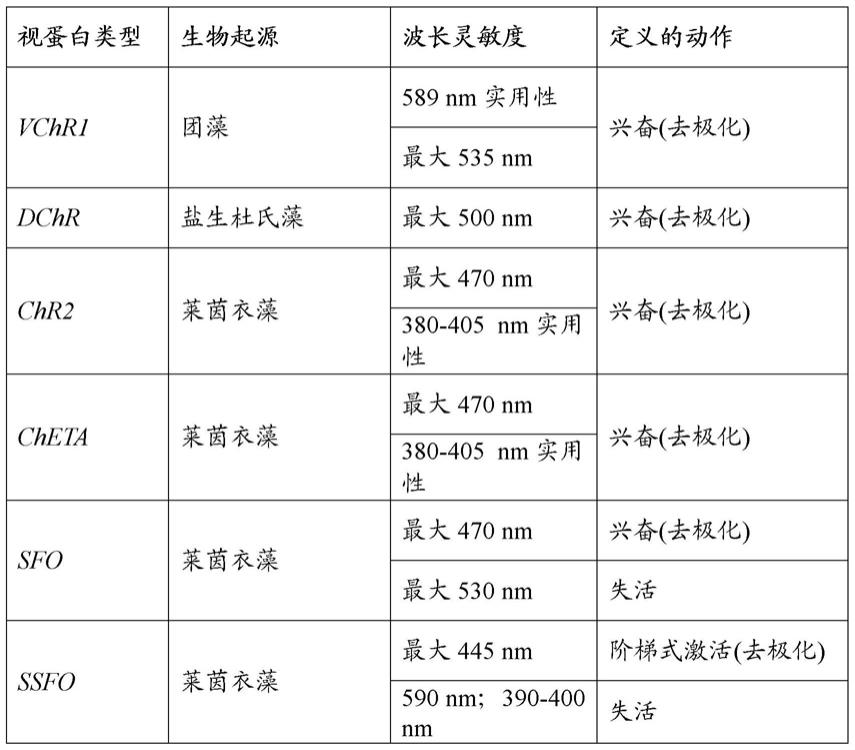
对本公开所涵盖光敏蛋白没有特别限制,只要它们可以使用本文所公开的方法进行刺激即可。在一个示例中,合适的蛋白质是定位于经遗传修饰的神经元细胞的质膜上的光响应性通道或泵蛋白。例如,光敏蛋白(例如,视蛋白)可在至少一个经遗传修饰的神经元中充当光激活的离子转运通道。在一个示例中,光敏蛋白可以是光敏视蛋白。光敏视蛋白的示例包括通过光诱导神经元超极化的视蛋白和通过光诱导神经元去极化的视蛋白。视蛋白的示例显示在下表1中。
[0106]
表1:用于可见光谱上的激发和调节的示例性视蛋白。
[0107][0108][0109]
在一个示例中,光敏蛋白质是光敏氯化物泵。例如,蛋白质可以是光敏氯化物泵的嗜盐视紫红质家族的一个或多个成员。在一个示例中,光敏氯泵蛋白来源于法老盐碱单胞菌(natronomonas pharaonis)。在另一个示例中,光敏氯泵蛋白来源于盐沼盐杆菌(halobacteriumsalinarum)。在另一个示例中,光敏蛋白是光敏质子泵。在一个示例中,光敏质子泵蛋白来源于蓝隐藻(guillardia theta)。在另一个示例中,光敏蛋白是光敏阳离子通道。在一个示例中,光敏阳离子通道蛋白来源于莱茵衣藻(chlamydomonas reinhardtii)。在一个示例中,当通过本文所公开的方法刺激神经元时,阳离子通道蛋白能够介导经遗传修饰的神经元中的去极化电流。在一个示例中,光敏蛋白是视紫红质通道蛋白2(channelrhodopsin-2,chr2)。在另一示例中,光敏蛋白是 chr2/h134(chr2(h134r)在h134位处携带单点突变)。参见ncbi 登录号af461397。在另一个示例中,光敏蛋白来源于盐生杜氏藻 (dunaliella salina)。例如,光敏蛋白可为dchr。
[0110]
实施例1
[0111]
从在sgn中表达chr2*h134r的出生后3-5天的雄性和雌性转基因小鼠制备分离的螺旋神经节神经元(spiral ganglion neuron,sgn) 的培养物。
[0112]
对于每个神经元,单独针对3ms电脉冲(176
±
13pa)和10ms 光学刺激(10.3
±
3.4mw,在空气中的光纤尖端测量)测定了放电阈值(针对所呈递的刺激的至少一半唤起动作电位(ap)的功率水平)。ap 被定义为膜电压的任何快速尖峰,在所述快速尖峰中瞬时变化率超过了变化率阈值。阈值功率定义为100%刺激水平,而低于或高于该阈值功率的功率水平分别表示为“亚阈值”和“超阈值”。
[0113]
施加由三个连续脉冲组成的刺激方案:组合的光和电(o+e)、仅电(e)和仅光学(o),其中单独的功率水平设置为亚阈值电平。图5a 示出了对刺激方案的典型细胞反应,其中o+e脉冲唤起ap,而单独的e脉冲和o脉冲则没有。
[0114]
图5b示出了在共刺激期间唤起ap的几种刺激水平的组合,表明用电或光刺激作为主要刺激可唤起共刺激ap。对于几种组合,两种刺激的总和低于100%、例如40%的电刺激和40%的光学刺激。
[0115]
图5c、图5d和图5e示出了在两种刺激之间的不同延迟时间和不同功率水平下的o+e共刺激。所表示的功率水平为:图5c是40%的光学功率水平、40%的电功率水平;图5d是45%的光学功率水平、 80%的电功率水平;并且图5e是65%的光学功率水平和70%的电功率水平。阴影区域指示光学刺激的持续时间。电刺激出现相对于光刺激出现的时序变化,所述变化在顶部线处开始,在所述顶部线处电刺激领先光学刺激5ms。在每个后续迹线中,电刺激的施加的开始相对于光学刺激的施加的开始被进一步延迟。当电刺激先于光学刺激时,去极化的两个阶段是明显的(急剧的电去极化和更渐进的光学去极化) 并且不会引起ap。在发生电“触发”脉冲的情况下,当膜被光学基础充分去极化时,就会唤起ap。这些数字揭示了共刺激效应的时间依赖性,因为大多数ap发生在光刺激时段的后期或光刺激完成之后。
[0116]
在不表达chr2的野生型细胞中,最大功率光学脉冲不会引起膜去极化,并且当与高达90%的电刺激一起出现时也无法引起ap(n=4 个细胞,数据未显示)。这些结果表明膜中chr2/h134的存在需要引起共刺激ap,并且同时激活光遗传学和电压敏感离子通道是通过组合亚阈值刺激唤起ap所必需的。
[0117]
四种刺激模式的特征在图6a中进行了比较。四种模式是o、e、o+e和e+e(其中光刺激时段被电斜坡代替)。图6a示出了这些刺激模式中的每一种刺激模式的关键特征,包括ap的幅值和持续时间以及作为ap衰减至峰值幅度值的36.8%的时间给出的关断时间常数τ
关断
。对于光学刺激,n=21个细胞,对于电刺激,n=11个细胞,对于全电刺激,n=7个细胞,并且对于共刺激,n=7个细胞。
[0118]
所有刺激方法的ap的平均幅值是显著不同的(单因素方差分析, p<0.01),其中具有最大幅值的共刺激尖峰(105.6
±
0.6mv,n=7细胞) 之后是电(100.2
±
1.4mv,n=11个细胞),然后是光学(87.1
±
1.5mv, n=21个细胞)。0mv时的平均尖峰持续时间也是显著不同的(单因素方差分析,p<0.01)。共刺激ap(0.87
±
0.01ms,n=7个细胞)的持续时间明显短于电唤起的ap(1.29
±
0.02ms,n=11个细胞,tukeyhsdp=0.001)和光唤起的ap(1.19
±
0.04ms,n=21个细胞,tukeyhsd, p=0.001)。
[0119]
共刺激和电唤起的ap的“关断”时间常数τ
关断
没有显著差异(共刺激是1.22
±
0.06ms,电刺激是1.36
±
0.03ms,tukeyhsd,p=0.16),而光唤起的ap具有显著较慢的动力学(1.63
±
0.03ms,tukeyhsd, p=0.001)。共刺激和仅电刺激的类似关断时间常数表明共刺激ap主要由电触发脉冲驱动。
[0120]
图6b比较了电(e)、光学(o)和光学+电(o+e)ap的动作电位。较浅色的阴影区域表示光刺激,而较深色的阴影区域表示电刺激。可以看出,对于o ap和o+e ap,在光刺激停止后的几十毫秒内,膜保持轻微的去极化,并且在ap后约40ms的缓慢复极化是明显的。这种动态行为对应于亚阈值光学反应之后的典型复极化。
[0121]
为了确定唤起共刺激ap所需的刺激的最佳时序,改变电刺激相对于光学刺激的出现。最初,电刺激的出现先于光学刺激的出现3ms。然后在每个后续呈递中将电刺激移动2ms,直到它比光刺激的开始滞后长达30ms。一系列延迟刺激在图6c中示出为叠加的,以证明共刺激效应的时间依赖性。光脉冲由ap迹线上方的条形指示。当电刺激在光刺激出现后发生时,ap更有可能被放电。
[0122]
图6d示出了共刺激引发基于电脉冲相对于光学脉冲的延迟的a p的概率。在电刺激滞后于光学刺激的出现的所有延迟上,在此考虑的所有功率水平都超过了共刺激阈值。光刺激的持续时间由阴影区域表示。对于显示为产生共刺激ap的刺激水平,当在光刺激出现后3 ms呈递电刺激时,实现了每个脉冲0.5个尖峰的阈值放电概率。当电刺激出现滞后于光学刺激出现10ms时,触发概率接近1,这也是光学刺激停止但在最大电压变化之前的时间点。在该实施例中,观察到在光学刺激停止之后,在缓慢衰减之前,放电概率在例如约15ms 的时段内保持相对较高。亚阈值光刺激导致的膜电位平均变化以灰色叠加示出,并且与放电概率呈强正相关(皮尔逊相关系数ρ=0.85,p<0. 001)。在整个延迟范围内,膜电位的变化率与放电概率的相关性很差 (皮尔逊相关系数ρ=0.11,p=0.66),然而在光刺激的时段期间,膜电位的瞬时变化率与放电概率呈强正相关(皮尔逊相关系数ρ=0.94,p<0. 01)。这表明放电概率与光学介导的膜去极化及其变化率有关。使用vm知作为因变量的多元线性回归在整个延迟范围内产生了强相关性 (皮尔逊相关系数ρ=0.91,p<0.01;)。
[0123]
与超阈值刺激相比的亚阈值光学和电刺激的时间常数可以在图 6e中看到。正如预期的那样,与超阈值刺激相比,细胞对亚阈值刺激的反应是明显不同的。亚阈值和超阈值反应的出现动力学处于相似的量级,但与亚阈值去极化相比,ap之后的复极化明显更快。对于光学刺激,亚阈值反应与超阈值反应之间的导通ap动力学没有显著差异(τ
导通
=对于亚阈值为11.7
±
1.6ms,τ
导通
=对于超阈值为10.6
±
0.4 ms,两个带尾t检验,p=0.44)。这些相对较长的时间常数可能与10ms 光学脉冲引起的缓慢去极化有关。发生ap时,关断动力学明显更快 (τ
关断
=对于亚阈值为24.0
±
0.8ms,τ
关断
=对于超阈值为1.63
±
0.03 ms,p<0.001)。
[0124]
对于电刺激,与超阈值反应(3.9
±
0.1ms,双尾t检验,p<0.001) 相比,亚阈值反应的τ
导通
明显更短(2.0
±
0.2ms)。这个令人惊讶的结果很可能与为了确保电压阈值仅在3ms电脉冲结束附近才达到而选择的脉冲参数有关。与亚阈值(1.0
±
0.3ms,双尾t检验,p<0.001)相比,超阈值的细胞复极化明显更快(1.36
±
0.03ms)
[0125]
光学去极化与放电概率之间的强相关性以及e ap与o+e ap之间的特征类似性表明,在光遗传学共刺激期间,电压敏感离子通道和视蛋白以“相加”方式组合以唤起共刺激ap。为了检查这种相同的关系是否仅通过膜去极化存在,提出了两个单独的电刺激的组合(表示为“全电”共刺激,或e+e)。在该测试中,10ms光学脉冲被20ms电斜坡代替,所述20ms电斜坡的幅值和时间过程近似于亚阈值光学刺激导致的平均膜变化。
[0126]
电压迹线在图7a中示出,所述电压迹线显示了在3ms电触发脉冲与电斜坡之间的时间延迟不断增加的情况下,细胞对全电(e+e)刺激的典型反应。阴影区域表示电斜坡的持续时间。图6c中的共刺激 ap共享几个特征,包括存在两个峰值(一个针对斜坡,一个针对3ms 触发脉冲),以及一旦细胞膜充分去极化就会唤起ap。与o+e刺激一样,ap更有可能出现在电斜坡的后期。
[0127]
图7b示出了作为全电共刺激模拟的时间延迟的函数的放电概率 (每个刺激脉冲的ap)。由于20ms的电斜坡,这与膜电位变化叠加。电斜坡的持续时间由阴影区域指示。与光刺激一样,峰值放电概率在 10ms后实现,并在整个斜坡持续时间内保持高。与光刺激不同,在电斜坡刺激停止后,放电概率以与针对亚阈值电刺激的相对缓慢的τ
关断
=10.0
±
0.3ms不一致的方式迅速下降。全电共刺激的放电概率与膜电压呈弱正相关(皮尔逊相关系数ρ=0.44,p=0.051),然而与膜电位的瞬时一阶导数的相关性在斜坡期间产生了更积极的结果(ρ=0.55, p=0.01)。如果只考虑刺激期间的时段,则相关性更强,对应于 dvm/dt>0(ρ=0.66,p=0.02)。
[0128]
与仅电ap相比,共刺激ap已经减少了na
+
失活
[0129]
已知许多细胞的放电概率取决于紧接在刺激之前的膜电位变化率。参考图7c,对于本实施例中研究的sgn,通过施加不同的梯度电流斜坡研究了膜去极化变化率对ap生成的影响(n=6个细胞)。最初调谐斜坡直到生成ap,然而随着斜坡的梯度随后减小(具有相同的峰值电流),ap最终被废除。这种效应通常归因于在较慢的去极化期间na
+
失活增加的效应。
[0130]
由于光学刺激不直接激活na
+
离子通道,所以它们可允许具有减少的na
+
失活的膜去极化。为了测试这一点,进行300ms的调节脉冲(处于-20mv或-80mv),之后是200ms的测试脉冲(范围从-80mv 至+10mv)。在测试脉冲之前有和没有50ms光学脉冲的情况下,评定了最大唤起电流与电压之间的关系。参考图7d,对于-80mv调节脉冲,对于高于-50mv的测试脉冲,会唤起类似于i
na
的瞬态内向电流。对于-20mv的调节脉冲,瞬态电流最初是向内的,但在-20mv 或更高的测试脉冲后主要向外。在调节脉冲期间包含光学刺激并没有显著改变-80mv或-20mv调节脉冲的瞬态电流的幅值,表明光学脉冲没有增加na
+
失活(两侧kolmogorov-smirnov;在-80mv,得分=0.22,p=0.96,在-20mv,得分=0.11,p=1.0)。
[0131]
用于调查na
+
失活程度的另一种方式是测量尖峰上行期间的平均 dvm/dt,其是当dvm/dt超过导数阈值直到峰值vm测量的。如图7e所示,o+e共刺激和e+e共刺激的平均dvm/dt之间存在显著差异 (o+e=75.3
±
1.8mv/ms,e+e=46.9
±
0.8mv/ms,双尾t检验p<0.001,图7e)。该结果与同o+e共刺激期间的光学去极化相比在电斜坡期间较高的na
+
通道失活一致。来自o+e共刺激的平均导数与仅电刺激的平均导数没有显著差异(双尾t检验,p=0.33),然而明显低于仅光刺激的平均导数(87.16
±
1.38mv/ms,p<0.001),这与在光学唤起的ap 期间降低的对na
+
通道的依赖性一致。这些结果表明光遗传学共刺激可用于通过膜
去极化延长细胞兴奋性达延长的时间段,而不会有过多的na
+
失活。
[0132]
现在参考图8a至图8e,以10hz、20hz、33hz和50hz呈现脉冲串,以检查光遗传学共刺激对增加尖峰率的有效性。测试了亚阈值和超阈值光学和电刺激的组合(在0%与140%的单脉冲阈值功率之间变化)。为了一致性,使用与单脉冲方案相同的脉冲长度(10ms光学和3ms电),并且电刺激固定为在光刺激出现之后滞后3ms(对应于图6d中的放电概率0.5)。
[0133]
图8a和图8b中分别示出了细胞对10hz和20hz下的组合光血和电串的典型反应。在这些示例中,光血功率保持恒定,而电功率增加,如从左到右的各小图中所示。被放电的ap的数量随着电功率的增加而增加。共刺激反应是与刺激锁相的(所有实验情况下的矢量强度接近1)。如图8c所示,有证据表明脉冲串中的后续脉冲发生了适应。适应率(定义为串中最后一个尖峰与第一个尖峰的幅值之比)在 10hz时的接近1(0.94
±
0.00,n=10个细胞)至50hz时的0.69
±
0.01 (n=10个细胞)的范围中。在50hz下,与仅电刺激的适应率(0.77
±
0.01, n=5个细胞)相比,共刺激的适应率(0.73
±
0.02,n=5个细胞)略高,但没有显著差异(双尾t检验,p=0.49)。
[0134]
图8d中示出了对于不同的刺激模式,达到为0.5的放电率所需的电刺激水平。对于给定的光学刺激水平,唤起ap所需的电刺激随频率而增加。令人惊讶的是,亚阈值和超阈值光学共刺激的电刺激是相似的,并且在这两种情况下与仅电刺激相比都减少了(n=12个细胞)。这很可能与3ms的延迟时间有关,该延迟时间比为约10ms的τ
导通
更短(参见图6e)。在所有频率下,共刺激放电概率都超过了仅电和仅光学的放电概率。
[0135]
图8e比较了增加电功率的平均放电概率,所述比较是按脉冲频率分组的(n=12个细胞)。黑点表示超阈值光学功率,灰点表示亚阈值光学功率,并且白点表示没有光学刺激。针对给定的光学功率水平生成的ap的数量随着电功率的增加而增加。在所有频率下,与仅电刺激相比,共刺激(具有亚阈值和超阈值光刺激)导致更高的放电概率 (p<0.05,kolmogorov-smirnov双样本测试),而亚阈值和超阈值光学没有显著差异(p>0.05),但是所述模式的放电概率在接近这种细胞类型的体外刺激极限的频率下收敛。
[0136]
对于光刺激本身,10hz下的脉冲串实现了接近0.5的触发概率。使用共刺激技术时,可以在高达33hz的频率下以0.5的放电概率驱动脉冲串,这是使用单独的光学刺激时的至少三倍快,与此同时维持与所有电刺激相比较低的电流。
[0137]
讨论
[0138]
基于光遗传学的植入物是用于提高假肢装置性能的有前途的途径。它们对于容易受到由于电激活在组织中的传播而导致的通道之间的串扰影响的人工耳蜗来说是感兴趣的。光学刺激比电刺激具有更大的功率要求,这限制了其在电池供电装置中的应用。此外,与装置中通常使用的脉冲速率相比,大多数通道视紫红质变体具有较慢的时间动力学,所述时间动力学在人工耳蜗中可在每个电极每秒250个至多于4,000个脉冲的范围中。虽然在生成快速尖峰通道视紫红质突变体方面已经做了大量工作,但其他补充这些更快视蛋白的方法可能是有益的。
[0139]
此实施例表明,与独立光学刺激相比,将亚阈值光遗传学刺激与亚阈值电刺激组合可以在螺旋神经节神经元中唤起共刺激ap,并增加脉冲串放电概率。这种方法很可能可用于增强现有经工程化的视蛋白和基于光学的探针的性能和应用,而无需对视蛋白本身进行重大重新工程化。
[0140]
本实施例中考虑的chr2/h134视蛋白是一种高光电流变体,其与野生型chr2相比具有较慢的动力学。先前已经在各种功率水平下以5hz或直至100hz的频率驱动了体外仅光刺激唤起的脉冲串,但是已经报道了高达70hz的体内放电率。一般来说,光学唤起的ap 的放电概率受视蛋白的关断时间常数的限制,所述关断时间常数对于 chr2/h134而言为约18ms。使用单独的光学刺激时,发现10hz脉冲串的放电概率接近0.5。尽管这在先前结果中报告的范围的下限侧,但它可能受到所选刺激参数的约束;更短、更高功率的脉冲可潜在地为光遗传学共刺激提供进一步的益处。事实上,先前在体外已经用仅电刺激唤起的ap实现了更高的频率,其中sgn使用0.3ms、1.5na 的脉冲将放电概率在高达66hz下维持高于0.5。之前已经报道过体内高达1khz的放电率,但是这些在体外制备中没有被复制。
[0141]
共刺激放电概率与na
+
失活之间的关系
[0142]
在本实施例中,共刺激刺激的放电概率被证明与光学刺激期间的膜电位变化和膜电位瞬时变化率两者有关。这种双重依赖性与先前的动态电压阈值体内观察结果一致。也就是说,ap生成的阈值电压随着膜电位变化率的降低而增加,这继而意味着放电概率与dvm/dt之间存在正相关性。这种反应是na
+
通道的同步激活和失活的结果。通常 na
+
失活比激活发生得更慢,然而当去极化足够慢时,失活可以在同一时间尺度内发生。作为这种同步的结果,在缓慢去极化之后,可用于生成ap的na
+
通道的池与快速去极化之后相比更少,并且因此细胞兴奋性降低。还已得到公认的是,即使当通道尚未首先进入开放状态时,na+失活也可能发生。这种关闭状态失活在适度去极化的膜电位下发生,并且与开放状态失活一起可进一步导致在缓慢去极化后的兴奋性降低。
[0143]
由于长亚阈值光学去极化,缓慢去极化期间的钠通道动力学对在本实施例中描述的o+e共刺激来说是感兴趣的。有趣的是,o+e共刺激期间放电概率的长尾(图6d,其中ap在光学刺激出现后至多30 ms生成)似乎与同步激活和失活的观点相矛盾。与仅电刺激相比使用 e+e共刺激时明显显著较低的dvm/dt(图7e)不同,o+e ap期间的膜电位导数保持高,表明na
+
失活在长时间段的光学去极化期间没有显著增加。这个令人惊讶的结果可以通过单独的开放状态和关闭状态失活过程来解释。在e+e共刺激期间,使用na
+
通道对细胞进行去极化 (从而导致开放状态失活),并且由于去极化缓慢,所以大量离子通道进入此状态。对于o+e共刺激,去极化主要是通过视紫红质离子通道进行的,这减少了发生的开放状态失活的数量,从而使细胞处于更兴奋的状态。
[0144]
与红外线神经刺激的比较
[0145]
先前已经在使用2ms光学和电刺激的研究中将电刺激与使用 1875nm光的红外神经刺激(ins)组合施加,其中光学和电脉冲之间的延迟为0-2.5ms。已知ins是热驱动过程,主要取决于组织中的温度变化率。先前的模型化已经显示了辐射强度与组织中的温度升高之间的对数关系,这支持ins共刺激所需的光能和电能之间的对数关系。这种对数反应的结果是,当ins中的光功率低于70%时,需要指数增加的电功率才能达到共刺激阈值。
[0146]
ins使用快速温度变化来调节神经元活动,相比之下,光遗传学刺激是由视蛋白吸收光子时离子电导的直接变化驱动的。这是与ins 截然不同的机制。光遗传学共刺激方法可有助于保持光遗传学的空间优势,与此同时缓解基于仅光学的可植入装置的实践问题一些实践问题,包括高功耗和神经元的快速控制。
[0147]
以相对较低的光学和电功率唤起ap的能力表明,使用光遗传学共刺激时对光刺激
水平的敏感性较低,因此与红外共刺激相比,该技术可能更节能。在这两种情况下光学刺激的效应都是创建兴奋性增强时段。由于ins是热介导的过程,所以可通过增加光学功率水平以生成更大的温度升高,来控制可兴奋时段的持续时间。然而,人们认识到过多的热量可导致细胞损伤或ins介导的抑制。对于光遗传学共刺激,去极化的形状由辐射强度和脉冲持续时间导致。与先前的ins 研究相比,这个实施例利用了更长的脉冲以及增加的延迟。此外,由于视蛋白的通道动力学,在关闭光源后通常可出现峰值电流,而离子通道的较慢关闭动力学意味着增强的兴奋性可以在刺激停止后持续很长时段。此外,较短和较高功率的光脉冲可减少相对于此处报告的 10ms时段,细胞达到峰值兴奋性所需的时间。控制兴奋性增强的程度和出现的能力可以为可植入装置中的自适应控制方案提供额外的工具。
[0148]
光学辐照度和功耗
[0149]
使用单独的光遗传学刺激在耳蜗中实现ap的典型能量需求(2 μj/mm2)先前已被证明是电刺激(0.2μj/mm2)的十倍高。此外,许多具有外部光源的光学装置的光学效率为约10-30%,表明光学神经接口可能需要比电气装置高几个数量级的功率。如在本公开的方法中那样将激活的负担从光激发偏移至电激发可降低唤起ap所需的功率。应当理解的是,确切的功率节省将取决于所选择的脉冲参数和刺激接口的特征。
[0150]
除了减少功率需求之外,本文所公开的方法的共刺激技术还可以减少组织的蓝光暴露。光刺激中的蓝光毒性是新出现的问题;虽然几项研究已经表明光遗传学离子通道的病毒递送在数月内是安全的,但其他研究已表明蓝光暴露与体外视网膜神经元死亡之间存在联系。已知的是,在视网膜中,过量的蓝光可改变全反式视黄醛(all-trans retinal, atr)(它在哺乳动物中自然表达,并且是视紫红质运行机制的关键部分)并导致随后的细胞信号传导中断。增加的蓝光毒性与较高的功率水平相关联,因此减少辐射暴露或允许更快地控制红移视蛋白可能降低损伤的可能性。
[0151]
最近对诸如“f-克里姆森(f-chrimson)”或“克罗诺斯(chronos)”的经工程化的视蛋白的研究努力已经集中在减少τ
导通
和τ
关断
以允许以更高的尖峰频率光学驱动神经元。由于光遗传学共刺激方法不太可能与特定的视蛋白相关联,因此在设计未来的视蛋白变体时,使用光遗传学共刺激驱动更快的尖峰的能力可允许研究人员专注于纯开放和关闭动力学之外的生物相容性。
[0152]
实施例2
[0153]
对来自chr2-h134r转基因小鼠的经培养的螺旋神经节神经元进行电生理学记录,以检查单个细胞中的尖峰形状和刺激后促进时段。参考图9,使细胞经受1ms光学脉冲910和300μs的单相电脉冲920。阈值刺激被定义为所呈现的刺激的至少一半唤起动作电位的功率水平。如图9,小图a所示,对于单独呈现的单个脉冲,细胞膜对亚阈值刺激的反应存在显著差异。平均而言,膜对亚阈值电刺激的反应921是膜电位急剧增加,之后是在电刺激停止后立即快速衰减。相比之下,膜亚阈值光学刺激的反应911是膜电位缓慢上升,所述膜电位缓慢上升在光刺激停止后继续,之后是在30-50ms内的膜电位衰减。
[0154]
参考图9,小图b,然后呈现了具有可变延迟的混合刺激(电处于阈值的30-80%并且光学处于单脉冲阈值的80-100%)。当电脉冲先于光学脉冲(td<0)时,放电概率从小于10%增加到几乎40%。当电脉冲在光学脉冲(td=-1ms)之前1ms呈现时,观察到放电概率增加了近 40%。当电脉冲滞后于光学脉冲(td>0)时,在光学刺激开始后9ms 至13ms施加电
脉冲时,放电概率增加至最大值(83%)。当在光刺激开始后大于30ms施加电脉冲时,放电概率降至低于50%。然而,动作电位促进(在本实施例中定义为30-40%的放电概率)在光学刺激开始后持续了长达60ms。
[0155]
实施例3
[0156]
参考图10a,将经由小清蛋白启动子在螺旋神经节神经元(sgn) 中表达chr2-h134r的转基因小鼠通过经由耳蜗圆窗输注10%的新霉素溶液300进行急性失聪,以消除毛细胞介导的听觉反应的可能性。将带有附接的铂丝320、330的光纤插入耳蜗400的圆窗410内1-2mm。使用光纤320和铂丝330递送光学刺激、电刺激或混合刺激。在刺激期间,使用32通道记录阵列340从听觉中脑500的下丘510 进行神经记录。
[0157]
经由chr2抗体在组织学上证实chr2-h134r的表达,以反映增强黄色荧光蛋白(enhanced yellow fluorescent protein,eyfp)在螺旋神经节神经元细胞体、外周纤维和中央纤维中的定位。最强的荧光定位于螺旋神经节神经元的膜上。此外,chr2-h134r存在于成年转基因小鼠的内毛细胞中,而在外毛细胞中则更弱地存在。这种表达模式在整个耳蜗中从底转至顶转都很明显。
[0158]
将小鼠用新霉素急性失聪,以减少毛细胞介导的听觉反应的可能性。急性暴露于新霉素后,存在中高频听力损失,其中与失聪前的阈值相比,8khz、16khz和32khz的短音阈值显著升高(p<0.05,双因素rm方差分析)。在小鼠子集中对急性新霉素失聪工序的功效进行组织学验证,所述小鼠显示出内毛细胞和外毛细胞的完全或接近完全丧失(n=2)。
[0159]
图10b示出了在新霉素暴露之前和紧接之后的转基因小鼠的短音abr阈值。急性新霉素暴露导致了中高频听力损失,其中与失聪前的阈值相比,8khz、16khz和32khz的短音阈值显著增加(p<0.05,双因素rm方差分析)。在小鼠子集中对急性新霉素失聪工序的有效性进行组织学验证,所述小鼠显示出内毛细胞和外毛细胞的完全或接近完全丧失(n=2)。
[0160]
阈值
[0161]
光学脉冲和电脉冲的阈值功率水平分别被定义为引起至少0.3的归一化尖峰率(即自发放电率与最大放电率之间增加30%)所需的最低刺激功率水平。
[0162]
然后以高于和低于阈值的不同水平呈现了混合电(250μs)和光学(1ms)脉冲(其中电脉冲相对于光学脉冲延迟)。相对于光学脉冲的开始,电脉冲的开始延迟了延迟td,使得当td=750μs时,光学脉冲和电脉冲两者同时结束。所测试的延迟为0μs(即无延迟)、750μs、1750 μs、2750μs和3750μs。
[0163]
图11是光栅图,指示了何时检测到神经反应。脉冲时序在曲线图的左手侧以灰色的条形(光学刺激)和方点(电刺激)图示。可以看出,单独施加的亚阈值光学刺激和亚阈值电刺激不会唤起神经反应。相比之下,这些刺激的组合施加引起了下丘中的活动。在这个实施例中,神经反应是可观察到的,其中混合脉冲呈现为在光学脉冲的开始与电脉冲的开始之间存在延迟。在这个实施例中,电刺激是阈值的64%,并且光刺激是阈值的70%
[0164]
图12示出了电刺激阈值的百分比,在所述电刺激阈值处,在光学脉冲开始与电脉冲开始之间的各种延迟下对9个耳蜗的混合刺激引起神经反应。在此实施例中,当电脉冲的开始与光学脉冲的开始重合(无延迟)时,对电阈值的影响最小。当电脉冲的开始延迟到光学脉冲开始之后时,则在亚阈值水平的光学功率和电功率时都检测到了神经反应。观察到这种效应的延迟长达3.75ms,其中电脉冲的开始在光学脉冲停止之后发生。
[0165]
夹带率
[0166]
评定了下丘对耳蜗处呈现的混合刺激或光学刺激的突发的反应,以评估混合刺激与单独的光学刺激相比的时间性能。刺激突发的持续时间均为300ms,并且以不同的脉冲频率呈现。
[0167]
图13示出了光栅图,所述光栅图比较了仅光学刺激和混合刺激实现的夹带。在40pps时,两种刺激都有稳健的夹带,但在80pps 时,只有混合刺激显示出夹带。在所测试的最大速率(240pps)下,在仅光刺激初始出现后记录的反应非常少。相比之下,在240pps时,混合刺激能够在整个300ms刺激时段内唤起反应。
[0168]
为了更好地量化刺激,找到最大跟随率(mfr)(即80%的触发具有至少一个响应尖峰(80%的“跟随百分比”))。为了避免在高脉冲速率下的窗重叠,使用固定的6-10ms后刺激窗来对尖峰进行计数。图14 示出了单独的超阈值光学刺激和混合刺激的跟随百分比的示例(超阈值光学具有从阈值的40%至阈值的不断增加的电水平)。在这个示例中,随着电流增加,跟随百分比增加,并且最大跟随率从51hz偏移至122hz。
[0169]
图15示出了与使用单独的光学刺激相比,当使用混合刺激时跟随率的平均增加(n=4)。与单独的光学刺激时仅46hz相比,使用混合刺激时实现了111hz的最大跟随率。
[0170]
激活的传播
[0171]
参考图16,响应于声学刺激生成了正常听力chr2-h134小鼠的下丘(ic)的反应图像。生成了急性失聪chr2-h134r转基因小鼠对电刺激、光刺激和混合刺激的下丘反应的类似图像。光学刺激脉冲为1 ms,电脉冲为250μs,混合刺激使用td=750μs,所以光学和电脉冲一起结束。对于混合刺激,光学刺激是亚阈值,而电刺激范围从亚阈值至超阈值。
[0172]
图16a示出了在正常听力chr2-h134r转基因小鼠中对12khz 纯音声学刺激的ic反应图像和空间调谐曲线(spatial tuning curve, stc)。图16b至图16d示出了急性失聪小鼠中底转电刺激、混合刺激或光学刺激的ic反应图像和stc,其中光纤和铂丝通过圆窗膜插入2mm。在每个图像中,放电率由色调指示,其中黑色指示自发神经放电率,而白色指示最大神经放电率。在所有情况下,stc的宽度随着刺激强度增加到高于阈值而增加。在不表达chr2-h134r的小鼠中未检测到光学反应。
[0173]
比较耳蜗底部的声学刺激、光学刺激、电学刺激和混合刺激的激活扩散。所有模式都导致更多腹侧记录电极中的最低刺激阈值,所述最低刺激阈值指示耳蜗底部的激活。电和光学反应在空间上比声学更宽广。
[0174]
在高于阈值的不同鉴别指数水平(d
′
:源自信号检测理论的灵敏度或可鉴别性的量度)的强度下评定兴奋的宽度,以控制刺激的线性差异。stc的宽度取自高于阈值d’=1和d
′
=2的水平。图17示出了与混合刺激相比,光学刺激和电刺激的stc宽度显著更宽。仅光刺激与仅电刺激之间没有显著差异。
[0175]
本领域的技术人员将了解,在不脱离本公开的广泛一般范围的情况下,可以对上述实施方案作出众多变型和/或修改。因此,本发明的实施方案被视为在所有方面都是说明性而非限制性的。
