用于hla-dpb*0202基因检测的引物组、试剂盒及其方法
技术领域
1.本技术涉及生物医药工程的技术领域,尤其是涉及一种用于hla-dpb*0202基因检测的引物组、试剂盒及其方法。
背景技术:
2.格雷夫斯病(gd)又称为毒性弥漫性甲状腺肿,是一种自身免疫紊乱的免疫学疾病,其临床表现不仅限于甲状腺,而是一种多系统的综合征,包括高代谢症候群、弥漫性甲状腺肿、眼征、皮损以及甲状腺肢端病;且gd在家族中可见到先后发病的病例,其与遗传基因有密切的联系,科学家推测gd可能是一种受到人类白细胞抗原(hla)基因调控的疾病。hla是人类的主要组织相容性复合体(mhc)的表达产物,具有224个基因座,并且已经发现了2000多个等位基因,是人类迄今为止最复杂的基因群,根据分布和功能可将其分为ⅰ类抗原和ⅱ抗原。其中,ii类抗原主要分布在抗原呈递细胞、胸腺上皮细胞和活化的t细胞表面,由6号染色体上的hla-d区编码,其包括hla-dpb、hla-dqb以及hla-drb等类型,是由一条被糖基化的α重链和β轻链非共价结合而成的异源二聚体糖蛋白。根据ii类抗原的位置,可将其分为胞外区、跨膜区以及胞内区;其中,胞外区可进一步分为肽结合区以及多肽性区,ii类抗原的抗原多态性取决于多肽性区上的β1结构域。ii类抗原的肽结合区和多态性区协作配合结合、提呈外源性抗原肽给cd4
+
t细胞,具有调节t细胞分化的功能。
3.据研究表明,gd患者体内出现异常的自身免疫反应,b细胞分泌甲状腺刺激性免疫球蛋白(tsab),tsab与甲状腺滤泡细胞结合诱导甲状腺激素不受控制地分泌,使得炎症细胞浸润到甲状腺组织,导致甲状腺炎症的发生;同时,患者体内还会分泌抑制性促甲状腺激素结合免疫球蛋白(tbii),tbii对b细胞分泌tsab起负反馈调节作用。因此在一般的gd患者体内可检测到tsab以及tbii阳性,但是在最近的研究中发现具有hla-a*0201、hla-a*0207以及hla-dpb*0202等基因的患者血液中呈tbii阴性,且tbii呈阴性的患者在临床治疗中的治疗效果比呈阳性的患者的效果好,依据tbii可将gd分为典型性和非典型性,借助对hla-a*0201、hla-a*0207以及hla-dpb*0202等基因的检测可实现对gd的分类。
4.基因扩增是分子生物学领域的基本研究手段之一,传统的聚合酶链式反应(pcr)以及在基础上发展起来的sanger测序法、荧光pcr等技术能够实现对生物体核酸的有效扩增与检测。
5.目前,对于hla-dpb*0202基因的检测一般采用sanger测序法,sanger测序法利用因双脱氧核苷三磷酸(ddntp)缺乏pcr延伸所需的3
’‑
oh导致链延伸终止的原理。但是sanger测序法通过进行多次扩增得到多段dna片段,且需要对扩增得到的dna进行电泳,操作较为繁琐,检测所需要的时间长。
技术实现要素:
6.为了对hla-dbp*0202基因进行快速检测,缩短检测时间,本技术提供一种用于hla-dpb*0202基因检测的引物组、试剂盒及其方法。
7.第一方面,本技术提供的一种用于hla-dpb*0202基因lamp检测的引物组采用如下的技术方案:一种用于hla-dpb*0202基因检测的引物组,包括前向外引物f3、前向内引物fip、后向外引物b3以及后向内引物bip;所述前向外引物f3的核苷酸序列如seq id no:2所示;所述前向内引物fip的核苷酸序列如seq id no:3所示;所述后向外引物b3的核苷酸序列如seq id no:4所示;所述后向内引物bip的核苷酸序列如seq id no:5所示。
8.第二方面,本技术提供的试剂盒采用如下的技术方案:一种试剂盒,包括上述用于hla-dpb*0202基因检测的引物组。
9.优选的,还包括dntp、bst dna聚合酶、甜菜碱以及无核酸酶水。
10.通过采用上述技术方案,进行检测时,使用含有引物组、dntp、bst dna聚合酶、甜菜碱以及无核酸酶水的试剂盒,若待测样品中含有hla-dpb*0202基因,便可实现对hla-dpb*0202基因的特异性扩增;并且试剂盒中含有四种引物,对于hla-dpb*0202基因的扩增特异性更强,提高了检测的准确性。
11.优选的,还包括指示剂。
12.优选的,所述指示剂为可溶性镁盐。
13.通过采用上述技术方案,使用上述试剂盒进行检测时,若样品中含有hla-dpb*0202基因会发生扩增反应,在扩增反应的过程中会产生副产物焦磷酸离子,焦磷酸离子会与试剂盒中的可溶性镁盐反应生成焦磷酸镁沉淀,通过判断是否有白色沉淀生成,便可判断待测样品中是否含有hla-dpb*0202基因,使得不需要再借助其他仪器对检测结果进行判定,简化检测操作,提高检测效率。
14.优选的,所述指示剂为染料。
15.优选的,所述染料独立选自羟基萘酚蓝指示染料以及钙黄绿素指示染料。
16.通过采用上述技术方案,扩增体系中存在扩增产物时,染料会有特异性显色反应,通过体系对体系颜色的判断,便可判断待测样品中是否含有hla-dpb*0202基因,便于检测结果的判定;当染料为羟基萘酚蓝指示染料时,待测样品中含有hla-dpb*0202基因时,反应体系发生特异性扩增呈天蓝色,反之则为紫罗兰色;当染料为钙黄绿素指示染料时,待测样品中呈hla-dpb*0202阳性时,反应体系发生特异性扩增呈绿色,反之则为橘黄色。
17.优选的,还包括阳性对照品和阴性对照品。
18.优选的,所述阳性对照品为人工合成的含有hla-dpb*0202等位基因的dna片段,所述dna片段的核苷酸序列如seq id no:1所示的,所述阴性对照品为无核酸酶水。
19.通过采用上述技术方案,在试剂盒中加入阳性对照品和阴性对照品,含有人工合成的hla-dpb*0202等位基因的dna片段的阳性对照品可排除因假阴性导致检测结果出现错误的情况,而阴性对照品无核酸酶水用来判断扩增体系中是否存在污染导致假阳性的情况,阳性对照品和阴性对照品的配合使用,可提高hla-dpb*0202基因检测的准确性。
20.第三方面,本技术提供的检测hla-dpb*0202基因的方法采用如下的技术方案:一种检测hla-dpb*0202基因的方法,包括使上述任一种试剂盒进行lamp扩增的步骤。
21.综上所述,本技术包括以下至少一种有益技术效果:
(1)本技术提供的试剂盒中包括用于检测hla-dpb*0202基因的引物组、dntp、bst dna聚合酶、甜菜碱、无核酸酶水以及指示剂,本试剂盒中提供的试剂为环介导的等温扩增技术(lamp)的扩增反应体系,通过该反应扩增体系实现对hla-dpb*0202基因的检测;若是待测样品中含有hla-dpb*0202基因时发生lamp扩增反应,而lamp扩增只需要在恒温的条件下便可以进行,完成扩增仅需60min左右,并且可通过指示剂对检测结果进行判读,实现了简化检测操作、有效缩短检测时间的效果,提高了检测效率,并且在检测过程中不需要用到昂贵的仪器,节约了检测成本;(2)在试剂盒中加入阳性对照品和阴性对照品,可以对假阳性结果和假阴性结果进行排除,提高hla-dpb*0202基因检测结果的可靠性。
附图说明
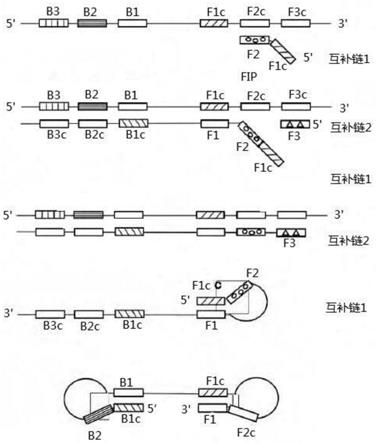
22.图1是lamp扩增起始物合成阶段的原理图;图2是lamp扩增扩增循环阶段的原理图;图3是实施例1中五组引物组lamp扩增产物的琼脂糖凝胶电泳图;图4是实施例2某一全血样品的hla-dpb*0202基因检测的结果;图5是实施例3中检测hla-dpb*0202基因方法的特异性检测结果;图6是实施例4中检测hla-dpb*0202基因方法的灵敏度检测结果。
具体实施方式
23.以下结合附图1-6对本技术作进一步详细说明。
24.本技术涉及的试剂或试剂盒及其来源如下:dna ladder(货号为11721933001,merck公司);15min高产全血基因组dna提取试剂盒(产品编号为b0136,哈尔滨新海基因检测有限公司);dntp mix(货号为r0191,thermo fisher公司);bst dna聚合酶(产品编号为12908es60,翌圣生物科技(上海)股份有限公司);甜菜碱(货号为b802386-100g,macklin公司);钙黄绿素指示染料(货号为40719es50,翌圣生物科技(上海)股份有限公司)。
25.环介导等温扩增(lamp)是一种新式核酸扩增技术,利用具有链置换活性的dna聚合酶和两对特殊设计的引物,在等温条件下高效快速完成扩增反应的方法。相比于传统扩增检测方法,lamp技术克服了传统pcr反应需要通过反复热变性获得单链模板的缺点,避免了反复升降温的过程,实现了恒温条件下的连续快速扩增,具有更高的灵敏度和扩增效率;并且lamp针对靶序列六个区域设计的四种特异性引物,若待测序列中不能与这六个区域完全匹配就不能进行核酸扩增,因此lamp技术具有更强的特异性。
26.lamp技术是由notomi等人提出的,其能实现核酸扩增的核心就在于具有链置换活性的dna聚合酶以及两对特殊的引物。bstdna聚合酶是一种具有链置换活性的酶,可作为lamp技术中催化dna扩增的酶;两对特异性强的引物包括包括一对内引物和一对外引物,其中内引物包括前向内引物fip和后向内引物bip,外引物包括前向外引物f3和后向外引物b3。
27.图1是lamp扩增起始物合成阶段的原理图:针对靶基因3’端的f3c、f2c和f1c以及5’端的b1、b2和b3这六个不同的位点设计四条引物fip、f3、bip以及b3,合成时,任何一个引物向双链dna的互补部位进行碱基配对延伸使得dna双链解开,fip上的f2与其模板的互补序列f2c结合,在bstdna聚合酶的作用下,从f2的3’末端开始启动dna合成,合成一条以fip为起始的新dna单链并与模板链结合形成形的双链dna,接着再以f3为起始合成的新链与模板链形成双链,而原合成的以fip为起始的dna单链被置换而脱离产生一条单链dna,该dna单链5’末端上的f1c和f1区发生碱基互补配对,形成茎环结构,同时bip的b2模板与模板链b2c区互补配对,合成以bip为起始的新链,并与模板链互补形成dna双链,最终其5’末端的b1c和b1区发生碱基互补配对,形成茎环结构,整条链呈现哑铃状。
28.图2是lamp扩增扩增循环阶段的原理图:以具有茎环结构的dna双链为模板,fip与茎环的f2c区结合,进行链置换合成使得具有茎环结构的dna双链解离形成单链核酸,单链核酸也会形成环状结构;同时以3’末端的b1区段为起点,以自身为模板,进行dna合成延伸及链置换,形成长短不一的两条新茎环状结构的dna,bip上的b2与其碱基互补配对,启动新一轮扩增,在本阶段会的到不同个数茎环结构、不同长度dna混合物,并且扩增得到的dna为靶序列的交替反向重复序列。
29.lamp扩增包括起始物合成和循环扩增两个阶段:起始物合成阶段最终形成了一条茎环状dna,作为循环扩增阶段的模板;循环扩增阶段在内引物和bstdna聚合酶的催化下发生置换反应,在外引物的共同作用下形成长短不同的茎环结构,最终的扩增产物为茎环状dna与花椰菜状dna所组成的混合物。
30.根据核苷酸序列如seq id no:1所示的hla-dpb*0202等位基因上的六个不同区域设计得到的多组引物组,将上述多组引物组交由化学合成公司进行合成,使用上述五组引物组分别对含有hla-dpb*0202等位基因的dna样品进行lamp扩增的效果差;因此对上述引物组的核苷酸序列进行调整以实现对引物的改造,最终得到一组lamp扩增效果好的引物组。
31.在本技术中,使用经过调整的引物组作为hla-dpb*0202基因检测的引物组,该引物组的核苷酸序列如下所示:前向外引物f3:seq id no:2;前向内引物fip:seq id no:3;后向外引物b3:seq id no:4;后向内引物bip:seq id no:5。
32.并且,在本技术中还提供了一种试剂盒,试剂盒中含有上述的引物组、lamp扩增反应体系所需的试剂以及用来指示检测结果的指示剂。进行检测时,只需要将试剂盒中的试剂以及待测dna样本混合均匀,在恒温60℃的条件下反应一个小时左右,通过指示剂判断检测结果。相比最常用的sanger测序法,本技术的检测时间仅需一至两个小时,有效缩短了检测时长,提高hla-dpb*0202基因的检测效率。
33.在本技术提供的试剂盒中,lamp扩增反应体系的试剂组成如表1所示。
34.表1
其中,当任何一个引物向双链dna的互补部位进行碱基互补配对延伸时,dna双链打开解离成两条单链,fip中f2序列与模板f2c结合,bst dna聚合酶催化链置换合成反应,利用四种dntp合成新的dna单链;且甜菜碱起稳定bst dna聚合酶的功能,利于lamp扩增反应的进行。
35.并且,在核酸扩增的过程中会产生副产物焦磷酸根,通过检测反应体系中是否有焦磷酸根的生成,判断lamp扩增反应的发生,进而实现对反应体系中是否存在靶基因的判断。目前,利用焦磷酸根进行核酸等温扩增的方法主要有浊度法和比色法。
36.在本技术提供的试剂盒中还包括了用来指示焦磷酸根的指示剂,指示剂包括可溶性镁盐以及染料两种类型。
37.其中,可溶性镁盐为mgcl2以及mgso4中的一种,进行lamp扩增前将可溶性镁盐加入反应体系中,可溶性镁盐溶于水以离子的形式存在;当发生lamp扩增时,反应体系中的镁离子与焦磷酸根反应生成焦磷酸镁沉淀,通过反应体系中是否有沉淀生成,判断lamp扩增的发生,进而实现对待测dna样品中是否存在hla-dpb*0202基因检测,实现易于检测结果判读的效果。
38.用来指示焦磷酸根的染料为羟基萘酚蓝指示染料以及钙黄绿素指示染料中的一种。羟基萘酚蓝指示染料包括羟基萘酚蓝(hnb)以及镁离子,hnb与镁离子结合形成的络合物呈紫罗兰色,当体系中发生lamp扩增生成焦磷酸根,焦磷酸根与镁离子反应生成焦磷酸镁沉淀,hnb失去镁离子使得体系颜色呈天蓝色,通过体系颜色的变化可以进行检测结果的判断;钙黄绿素指示染料变色指示检测结果的原理与hnb指示染料的原理类似:在未发生lamp扩增时,钙黄绿素与锰离子结合形成的化合物呈橘黄色,若发生lamp扩增生成焦磷酸根,焦磷酸根与锰离子反应生成焦磷酸锰沉淀,钙黄绿素失去锰离子使得体系呈绿色。
39.此外,指示剂还可以是直接对扩增合成得到的dna进行标记的染料,其可独立地选自sybr green i、溴化乙锭(eb)以及cfi荧光染料中的一种。
40.并且,为了提高hla-dpb*0202基因检测结果的可靠性,本技术提供的试剂盒中还包括阳性对照品和阴性对照品。阳性对照品可以为经过分离纯化得到的含有hla-dpb*0202等位基因片段的标准dna样品,还可以为人工合成的含有hla-dpb*0202等位基因的dna片段;阴性对照品可以为经过分离纯化得到的已知不含有hla-dpb*0202等位基因片段的阴性dna样品,还可以为无核酸酶水,其中上述所提到的hla-dpb*0202等位基因的核苷酸序列如seq id no:1所示。
41.在相同的反应体系以及反应条件下进行阳性对照品以及阴性对照品的lamp扩增,若阳性对照品发生了lamp扩增,则证明该试剂盒所提供的检测体系有效,减小因lamp扩增假阴性的现象给检测结果带来的影响;若阴性对照品中不发生lamp扩增,则可以排除因引
物二聚体引起的非特异性扩增造成假阳性现象给检测结果带来的影响;通过设置阳性对照品和阴性对照品,可以减少因假阳性以及假阴性现象给检测结果判断带来的影响,实现提高检测结结果准确性的效果。
42.实施例1:用于hla-dpb*0202基因检测的引物组通过primerexplorer v5网站,根据hla-dpb*0202等位基因设计得到五组用于lamp扩增的引物组,所述五组引物组的核苷酸序列如表2所示。将上述五组引物组交由化学合成公司进行合成,并且每组引物组都对已知含有hla-dpb*0202基因的dna样品以及无核酸酶水进行lamp扩增,其中dna样品浓度为10ng/μl,并且对lamp扩增得到的产物进行琼脂糖凝胶电泳。
43.表2
得到的电泳结果如图3所示,1-2号孔为第1组引物组、3-4号孔为第2组引物组、5-6号孔为第3组引物组、7-8号孔为第4组引物组以及9-10号孔为第5组引物组;由电泳结果可知,第1组引物组以及第5组引物组在靠近200bp的位置上出现了条带,第3组引物组以及第四组引物组未发生lamp扩增,而在第2组引物组中出现了假阳性的现象。
44.从结果上可以看出,上述五组引物组中只有第1组和第5组发生了特异性lamp扩增,但是上述两组引物组的lamp扩增效果不佳。因此,在第一组和第五组引物组的基础上,通过改变引物的核苷酸序列对其进行改造,得到多组引物组,并且使用引物组分别对已知含有hla-dpb*0202基因的dna样品以及无核酸酶水进行lamp扩增,对lamp扩增产物进行电泳,最终确实了一组lamp扩增效果最佳的引物组,该引物组的核苷酸序列如下所示:前向外引物f3:seq id no:2;前向内引物fip:seq id no:3;后向外引物b3:seq id no:4;后向内引物bip:seq id no:5。
45.实施例2:一种检测hla-dpb*0202基因的方法1.待测样品dna的提取在本实施例中是对全血样品中是否存在hla-dpb*0202基因进行检测,使用dna提取试剂盒对全血样品dna进行提取,dna的提取按照dna提取试剂盒所提供的说明书进行操作。
46.2.lamp扩增引物组将用于对hla-dpb*0202基因进行lamp检测的引物组交由合成公司进行合成,并且提供合成检验合格报告,引物组的核苷酸序列如下所示:前向外引物f3:seq id no:2;前向内引物fip:seq id no:3;后向外引物b3:seq id no:4;后向内引物bip:seq id no:5。
47.3.lamp扩增反应在本实施例中,使用含有dntp、bst dna聚合酶、甜菜碱、无核酸酶水、钙黄绿素指示染料、阳性对照品以及阴性对照品的试剂盒进行lamp扩增反应。对一个全血样品进行检测时,需要用到3根lamp反应管,分别为阴性对照管、阳性对照管以及检测管,每根lamp反应管反应体系如表3所示。
48.表3试剂用量10
×
buffer2.5μlfip/bip各2μlf3/b3各0.5μldntp mix3μlbst dna聚合酶1μl甜菜碱4μl钙黄绿素指示染料2.5μldna样品/阴性对照品2μl无核酸酶水5μl在进行扩增前,将表2中除了dna样品以及阴性对照品外的试剂在室温下融化且2000rmp离心10s混合均匀,然后分别将阴性对照品、阳性对照品以及待测dna样品加入阴性对照管、阳性对照管以及检测管,在62℃恒温条件下反应60min;反应完成后将上述lamp反应管冷却至室温,2000rmp离心10s后,在紫外灯下观察lamp反应管的颜色。
49.图4为某一全血样品的检测结果,从左到右依次为阴性对照管、阳性对照管以及检测管;其中,阴性对照管呈绿色说明未发生lamp扩增,阳性对照管呈橘黄色说明该管内发生了lamp扩增,通过阴性对照管和阳性对照管可确定该lamp反应体系有效;且检测管也呈橘黄色,则说明该全血样品中含有hla-dpb*0202基因。
50.实施例3:检测hla-dpb*0202基因方法的特异性检测使用实施例1中所述的试剂盒对九份已知不含有hla-dpb*0202基因的全血样品以及一份已知含有hla-dpb*0202基因的全血样品进行检测。
51.首先使用dna提取试剂盒对上述十份全血样品dna进行提取,接着将表2中除了dna样品以及阴性对照品外的试剂在室温下融化且2000rmp离心10s混合均匀,然后分别将阴性对照品、阳性对照品以及待测dna样品加入阴性对照管、阳性对照管以及检测管,在62℃恒温条件下反应60min;反应完成后将上述lamp反应管冷却至室温,2000rmp离心10s后,在紫外灯下观察lamp反应管的颜色。
52.得到的检测结果如图5所示,1-9号管呈绿色,10号管呈橘黄色。1-9号管分别为九份已知不含有hla-dpb*0202基因的全血样品,10号管为已知含有hla-dpb*0202基因的全血样品,结果显示只有10号管为阳性结果,而1-9号管为阴性结果,说明只有含有hla-dpb*0202基因的全血样品中呈阳性结果,说明本技术提供的试剂盒具有较强的特异性。
53.实施例4:检测hla-dpb*0202基因方法的灵敏度检测将核苷酸序列如seq id no:1所示的hla-dpb*0202等位基因进行人工合成,并且配制一系列浓度的hla-dpb*0202等位基因的dna样品,样品浓度及其对应的lamp反应管如表4所示。
54.得到的检测结果如图6所示,1-6号管呈阳性结果,而7-8号管呈阴性结果,根据以上结果可以知道,使用lamp技术对hla-dpb*0202基因进行检测的最低检出限为0.5ng/μl,说明本实施例所述的方法具有较高的检测灵敏度。
55.表4
编号浓度(ng/μl)1100250310455160.570.180.01本技术提供的用于hla-dpb*0202基因检测的引物组、试剂盒及其方法,具有检测时间短、检测效率高、特异性强以及高灵敏度等优点。
56.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
