用于hla-a*29基因检测的引物、探针、试剂盒和方法
技术领域
1.本技术涉及生物医药工程的技术领域,尤其是涉及一种用于hla-a*29基因检测的引物、探针、试剂盒和方法。
背景技术:
2.抗原呈递是获得性免疫反应的重要环节,其过程包括抗原呈递细胞(apc)摄入、加工、处理及提呈胞外抗原产生免疫原性肽,免疫原性肽被传送出细胞并与人类白细胞抗原(hla)结合,接着通过抗原受体(tcr)激活t细胞最终触发机体内的免疫应答反应。其中,hla是人类的主要组织相容性复合体(mhc)的表达产物,属于跨膜糖蛋白,根据分布和功能可将其分为ⅰ类抗原和ⅱ抗原。
[0003]ⅰ类抗原分布于所有的有核细胞中,由一条被糖基化的α重链和一条β2-微球蛋白非共价结合而成,其抗原的特异性主要取决于肽链抗原决定簇的特定氨基酸序列,由6号染色体上的hla-a、b、c位点编码,编码i类抗原的基因序列可被外来物质例如某种病毒或化学物质改变,使得基因表达的产物被改变,成为自身免疫原,进而导致持续性感染、癌症或者自身免疫性疾病等有关疾病的发生。
[0004]
hla-a*29属于i类抗原中的一种,hla-a*29与其他hla最大的区别在于63号位点上的氨基酸,该位点上氨基酸种类的变化会导致hla与t细胞表面上的白细胞分化抗原(cd8)之间的结合力发生改变;其他hla在63号位点上的氨基酸为天冬酰胺或谷氨酸,而hla-a*29的63号位点上的氨基酸突变为更容易与感染物质(如病毒)结合的天冬酰胺,并且结合了感染物质的hla-a*29与 t细胞表面的cd8的结合力更强,结合了感染物质的hla-a*29活化t细胞分化成细胞毒性细胞,进而导致某些自身免疫疾病的发生。
[0005]
在1982年,nussenblatt和同事发现hla-a*29基因与鸟枪弹样脉络膜视网膜病变(bsr)之间存在异常强的遗传关联,遗传学研究显示bsr患者hla-a*29基因的阳性率为80%-96%。bsr是一种自身免疫性葡萄膜炎,其具有独特的眼底表现和遗传感性。bsr的临床症状表现为视网膜下多发性奶油状病灶和视网膜血管炎,且常伴有黄斑囊样水肿、视盘水肿以及玻璃体的炎症。
[0006]
bsr的发病机理可能是:体内携带有hla-a*29抗原的患者在某些感染物质(如病毒)入侵后,hla-a*29抗原的α重链与感染物质的结合力更强,两者结合后释放出s抗原,进而引发机体连续的自身免疫反应,被激活的t细胞攻击视网膜上的光感受细胞,破坏视网膜的结构,最终导致疾病的发生。
[0007]
目前,主要通过sanger测序法对hla-a*29基因进行检测,sanger测序法利用一种dna聚合酶从某一固定的点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生不同长度的一系列核苷酸,然后在尿素变性的page胶上对pcr扩增产物进行电泳,从而获得dna碱基序列,sanger测序法的操作步骤较为复杂、耗时长且需要用到昂贵的仪器,检测成本较高。
技术实现要素:
[0008]
为了简化hla-a*29基因检测的操作步骤,缩短检测时间,提高检测效率,本技术提供一种用于人hla-a*29基因检测的引物、探针、试剂盒和方法。
[0009]
第一方面,本技术提供一种用于人hla-a*29基因检测的检测引物及其相应探针,采用如下的技术方案:一种用于hla-a*29基因检测的引物对及其探针组,包括根据hla-a*29等位基因特异位点设计的引物对和探针组,所述引物对包括核苷酸序列如seq id no:1所示的正向引物和如seq id no:2所示的反向引物;所述探针组核苷酸序列如seq id no:11所示的捕获探针和如seq id no:12所示的检测探针;或其互补序列。
[0010]
优选的,所述正向引物和反向引物解链温度相等。
[0011]
通过采用上述技术方案,一个pcr扩增循环中包括dna模板变性、引物退火以及引物延伸,而引物退火失败是导致pcr扩增失败的最主要原因,因此引物组的解链温度以及退火温度的选择对pcr扩增结果具有较大的影响;当正向引物解链温度与反向引物的解链温度相差较大时,会出现具有较高解链温度的引物在退火之前复性或者是具有较低解链温度的引物无法退火,进而导致无效或者非特意性扩增;因此对设计得到的引物组进行改性,使得正向引物和反向引物的解链温度相等,减少因引物退火失败引起的pcr无效扩增或非特异性扩增,进而实现提高检测结果的准确性。
[0012]
第二方面,本技术提供了一种试剂盒,采用如下的技术方案:一种试剂盒,包括上述所述的用于hla-a*29基因检测的引物对及其相应探针组。
[0013]
优选的,还包括pcr扩增反应体系,所述pcr扩增反应体系包括10
×
tris-hcl缓冲液、可溶性镁盐、dntp、taq dna聚合酶以及氯化四甲基铵。
[0014]
优选的,还包括尿嘧啶dna糖基化酶,且所述dntp包括datp、dutp、dctp以及dgtp。
[0015]
通过采用上述技术方案,气溶胶污染是造成pcr扩增呈假阳性最主要的原因之一,通过在pcr扩增反应体系中加入尿嘧啶dna糖基化酶以及dutp,在反应体系中加入dutp使得每次扩增生成的pcr产物成为含有dutp的dna链,在每次新扩增前,对pcr扩增体系进行保温,使得尿嘧啶dna糖基化酶水解du-dna链中的尿嘧啶碱基和糖磷酸骨架的n-糖苷键,形成有缺失碱基的dna链,而后在预变性的过程中,有缺失碱基的dna链水解断裂且嘧啶dna糖基化酶失失活,从而有效消除pcr扩增体系中的气溶胶污染,并且在pcr反应体系中加入氯化四甲基铵,氯化四甲基铵在不抑制taq dna聚合酶的情况下去除非特异性扩增,进而提高扩增结果准确性的效果。
[0016]
优选的,还包括表面包被有n-羟化琥珀酰亚胺酯的微孔板。
[0017]
优选的,所述捕获探针的5’端经过氨基修饰,所述捕获探针吸附固定在微孔板上;所述检测探针为5’端经过生物素结合蛋白以及辣根过氧化酶修饰的检测探针。
[0018]
优选的,还包括核酸杂交液、tmb显色液以及1
×
pbst buffer。
[0019]
通过采用上述技术方案,试剂盒提供了微孔板夹心杂交检测体系,通过微孔板夹心杂交法对pcr扩增的产物进行检测,第一探针通过5’端上的氨基与n-羟化琥珀酰亚胺酯的结合固定在微孔板上,在核酸杂交液中进行pcr扩增产物与第一探针以及第二探针的杂交,而后使用1
×
pbst buffer冲洗微孔板,最后使用tmb显色液对微孔板进行染色,若扩增产物与第一探针以及第二探针均发生了杂交,第二探针通过扩增产物以及第一探针被固定
在多孔板上,第二探针上的辣根过氧化酶催化tmb显色液发生显色反应,tmb显色液呈蓝色,通过测试吸光度或观察显色液颜色变化便可以对待测样品中是否含有hla-a*29基因做定性分析,实现便于检测结果判读的效果;并且微孔板夹心杂交法中发生两次特异性杂交,相比于其他的一次杂交检测法来说,其具有更好的特异性。
[0020]
第三方面,本技术提供了一种检测hla-a*29基因的方法,采用如下的技术方案:一种检测hla-a*29基因的方法,使用上述所述的试剂盒。
[0021]
优选的,包括如下步骤:首先提取待测样品中的dna,接着对提取得到的dna样品进行pcr扩增;最后通过微孔板杂交法对pcr扩增产物进行检测。
[0022]
综上所述,本技术包括以下至少一种有益技术效果:(1)本技术提供的试剂盒中包括用于hla-a*29基因检测的引物对、探针组、扩增缓冲液、可溶性镁盐、dntp、taq dna聚合酶以及尿嘧啶dna糖基化酶,上述试剂构成了hla-a*29基因检测中的扩增体系;并且正向引物的解链温度等于反向引物的解链温度,减小因退火失败导致的无效或者非特异性扩增的发生,在扩增反应体系中还加入了尿嘧啶dna糖基化酶以及以dutp代替dttp,通过尿嘧啶dna糖基化酶有效消除pcr扩增体系中的气溶胶污染,同时还加入了甜菜碱提高反应体系的稳定性,进而实现提高扩增效果准确性的效果。
[0023]
(2)本技术的试剂盒中还包括表面包被有n-羟化琥珀酰亚胺酯的微孔板、核酸杂交液、tmb显色液以及1
×
pbst buffer,微孔板和上述试剂构成了微孔板夹心杂交检测体系,通过该检测体系对pcr扩增产物进行检测;在该检测体系中,扩增产物分别与第一探针以及第二探针发生两次特异性杂交,检测的特异性高;并且通过tmb显色液对杂交结果进行检测,具有操作简单、检测时间短以及检测效率高的优点。
[0024]
(3)本技术提供的检测人hla-a*29基因的方法包括提取待测样品中的dna、对提取得到的dna样品进行pcr扩增以及使用微孔板杂交法对pcr扩增产物进行检测三个步骤,使用该方法进行hla-a*29基因检测所需的检测时间大约为两个小时,相比于sanger测序法,该方法有效缩短了检测时长,提高了检测效率。
附图说明
[0025]
图1是实施例1中琼脂糖凝胶电泳图;图2是待测全血样品进行hla-a*29基因检测的结果图。
具体实施方式
[0026]
本技术涉及的试剂或试剂盒及其来源如下:dna ladder(货号为11721933001,merck公司);15min高产全血基因组dna提取试剂盒(产品编号为b0136,哈尔滨新海基因检测有限公司);dutp(货号为10128es72,翌胜生物科技公司);氯化四甲基铵(货号为87718,merck公司);尿嘧啶dna糖基化酶(货号为hmd3201,武汉瀚海新酶生物科技有限公司);n-羟化琥珀酰亚胺酯(货号为h1759,merck公司);核酸杂交液(货号为r21069,源叶生物有限公司);
tmb显色液(货号为t0440,merck公司)。
[0027]
以下结合附图1-2对本技术作进一步详细说明。
[0028]
基因检测是通过血液、其他体液或细胞对dna进行检测的技术,其包括对上述提取生物样品的dna、特异性扩增dna样品以及检测扩增产物等步骤。其中,pcr扩增技术是对dna进行特异性扩增最常用到的技术,其通过一对引物实现对靶序列的特异性扩增;在pcr扩增的过程中,引物的长度、二级结构、g-c含量以及解链温度均会对pcr扩增结果造成影响。
[0029]
本技术根据hla-a*29等位基因通过引物设计软件设计得到一组引物组,使用该引物组对已知含有hla-a*29等位基因的dna片段进行pcr扩增,接着通过琼脂糖凝胶电泳对扩增产物进行检测,发现电泳图中并未出现目标条带,则说明扩增失败。发明人通过对pcr扩增的靶序列以及引物的分析总结了扩增失败的原因,并且根据其重新对引物组进行调整,最终得到了一组特异性扩增效果好的引物对,该引物组的核苷酸序列如下所示:正向引物:seq id no:1;反向引物:seq id no:2。
[0030]
在本技术中还提供了一种试剂盒,该试剂盒中含有pcr扩增反应体系,且为了提高pcr扩增效果,试剂盒中还加入了氯化四甲基铵(tmac),tmac可以在不抑制taq dna聚合酶活性的前提下,去除反应体系中的非特异性扩增。本试剂盒提供的pcr扩增反应体系的试剂组成如表1所示:表1本技术提供的试剂盒中还包括尿嘧啶dna糖基化酶,且试剂盒中的dntp包括datp、dutp、dctp以及dgtp。气溶胶污染是pcr扩增的过程中出现假阳性现象的主要原因,试剂盒中的尿嘧啶dna糖基化酶可以水解人工合成的含有尿嘧啶的dna双链,在每次新扩增前,对pcr扩增体系进行保温,使得尿嘧啶dna糖基化酶水解气溶胶污染中的du-dna链,接着进行预变性,尿嘧啶dna糖基化酶在高温的条件下变性失活,使得新一轮的pcr扩增反应不受尿嘧啶dna糖基化酶的影响而正常进行;通过添加尿嘧啶糖基化酶以及用dutp代替dttp,在新的一轮pcr扩增前除去反应体系中的气溶胶污染,减少pcr扩增假阳性的现象,提高hla-a*29基因检测的准确性。
[0031]
使用上述试剂盒对待测dna进行扩增之后,通过微孔板夹心杂交法对扩增产物进行分析。微孔板夹心杂交法是一种对pcr扩增产物进行分析的方法,在该方法中使用一对捕获探针和检测探针与靶基因发生特异性杂交,并且通过显色液对特异性杂交结果进行判断,其具有操作简单、检测所需的时间短以及特异性高等优点。
[0032]
其中,微孔板表面上包被有n-羟化琥珀酰亚胺酯,且捕获探针的5’端上经过氨基修饰,捕获探针通过氨基与n-羟化琥珀酰亚胺酯的相互作用力固定在微孔板上,检测探针的5’端经过生物素结合蛋白以及辣根过氧化酶(hrp)修饰,若pcr扩增得到含有靶序列的dna片段,捕获探针与该dna片段杂交将其固定在微孔板上,同时检测探针也会与该dna片段杂交进而被固定在微孔板上,接着加入tmb显色液,固定在微孔板上的检测探针上的辣根过氧化酶催化tmb发生显色反应,使得显色液呈蓝色,通过对显色液颜色的变化可判断扩增产物中是否存在靶序列。
[0033]
本技术提供的试剂盒中还包括了微孔板夹心杂交法检测体系,该检测体系包括表面包有n-羟化琥珀酰亚胺酯的微孔板、检测探针、固定在微孔板上的捕获探针、核酸杂交液、tmb显色液以及1
×
pbst buffer。
[0034]
使用试剂盒对pcr扩增产物进行检测时,首先将pcr扩增产物在100℃下水浴10min,接着马上冰浴10min,在微孔板的孔内加入经过处理的pcr扩增产物、检测探针以及核酸杂交液,在52℃的条件下恒温培育45min,而后用1
×
pbst buffer漂洗5次,最后加入tmb显色液在室温下反应15min,观察tmb显色液的颜色变化或者使用紫外分光光度计测吸光度。
[0035]
本技术中还提供了一种检测人hla-a*29基因的方法,首先提取待测生物样品中的dna得到待测dna样品,接着使用上述的试剂盒对待测dna样品进行pcr扩增反应,最后使用微孔板夹心杂交法对扩增产物进行检测;在该方法中,使用的引物对可以对含有hla-a*29等位基因的片段进行pcr扩增,且扩增的特异性高,提高该方法检测的准确性,且通过微孔板夹心杂交法对扩增产物进行检测所需的检测时间较短,缩短了检测时间,实现有效提高检测效率的效果。
[0036]
实施例1:用于hla-a*29基因检测的引物对和探针组引物的设计在基因检测的过程中是非常重要的环节,在设计的过程中需要考虑扩增特异性和扩增效率两个方面,目前,一般使用引物设计软件进行引物的设计。在本实施例中,发明人根据hla-a*29等位基因的核苷酸序列,通过引物设计软件设计得到了一组引物对,该引物对的核苷酸序列如下所示:正向引物:seq id no:2;反向引物:seq id no:3。
[0037]
将上述引物对交由化学合成公司进行合成,并且得到了合成检验合格报告,使用上述引物对对已知含有hla-a*29基因的dna样品进行pcr扩增反应,并对扩增产物进行琼脂糖凝胶电泳,但电泳未得到目标条带,说明使用该引物不能对hla-a*29基因进行特异性扩增。发明者对软件设计得到的引物对进行分析,发现正向引物和反向引物之间的解链温度差值较大,阻碍pcr扩增过程中的变性以及退火复性的过程,可能是导致pcr扩增失败的原因之一,并且该引物对还存在着会形成二级结构等其他问题。
[0038]
根据上述分析,发明者引物设计软件设计的引物对的基础上手工设计了4对引物对,其核苷酸序列如表2所示,将这4对引物对交由合成公司进行合成后,分别使用4对引物对对已知含有hla-a*29基因的dna样品进行pcr扩增,并对扩增产物进行琼脂糖凝胶电泳。
[0039]
表2
得到的琼脂糖凝胶电泳图如图1所示,第1对引物对和第二对引物对未出现特异性条带,不能使用上述两对引物进行hla-a*29基因的pcr特异性扩增;第3对引物对出现了538bp的条带,第4对引物对出现了531bp的条带,说明使用第3对引物对以及第4对引物对能够实现hla-a*29基因的pcr特异性扩增,并且从电泳图中可以看出,第3对引物对具有更好的扩增效果。
[0040]
因此,在本实施例中选择3号引物对作为用于hla-a*29基因检测的引物对,接着根据该引物对合成出来的靶序列特异性设计了一组探针,该探针组能与靶序列碱基互补配对,且与该探针组配对的核苷酸序列在靶序列上相互靠近。本实施例最终确定的探针组的核苷酸序列如下所示:捕获探针:seq id no:11;引物探针:seq id no:12。
[0041]
实施例2:一种检测hla-dpb*0202基因的方法1、待测dna样品的提取在hla-a*29的检测中,可以从组织细胞或血浆中提取待测dna样品。在本实施例中,使用15min高产全血基因组dna提取试剂盒对待检测者的血液样品进行待测dna样品的提取,并且使用genequant pro核酸蛋白浓度测定仪对提取得到的待测dna样品的浓度和纯度进行测定,其浓度大于10ng/μl,且od
260nm
/od
280nm
的值在1.7-2.0之间。
[0042]
2、pcr扩增引物对及探针组将用于对hla-a*29基因进行检测的引物对以及探针组交由合成公司进行合成,并且提供合成检验合格报告。引物对以及探针组的核苷酸序列如下所示:正向引物:seq id no:1;反向引物:seq id no:2;
捕获探针:seq id no:11;检测探针:seq id no:12。
[0043]
3、pcr扩增反应在本实施例中,使用含有10
×
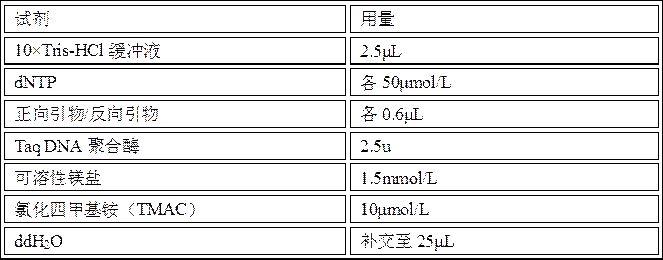
tris-hcl缓冲液、可溶性镁盐、dntp、taq dna聚合酶、氯化四甲基铵以及尿嘧啶dna糖基化酶的试剂盒进行pcr扩增反应;其中,dntp包括datp、dutp、dctp以及dgtp这四种。pcr反应体系的试剂及其用量如下表所示:表2试剂用量10
×
tris-hcl缓冲液2.5μldntp各50μmol/l正向引物/反向引物各0.6μltaqdna聚合酶2.5u可溶性镁盐1.5mmol/l氯化四甲基铵(tmac)10μmol/l尿嘧啶dna糖基化酶0.1μl待测dna样品2μlddh2o补交至25μl将表2中的试剂加入离心管中120rmp离心混合均匀30s,后将其放置在pcr扩增仪上按照表3所示的循环程序进行扩增。
[0044]
表3在进行hla-a*29基因检测时,设置阳性对照和阴性对照用来检测pcr扩增体系的有效性;其中,阳性对照为已知含有hla-a*29基因的dna样品、阴性对照为ddh2o。
[0045]
4、微孔板夹心杂交法在本实施例中,使用微孔板夹心杂交法对pcr扩增产物进行检测,通过tmb显色液
对检测结果进行指示。
[0046]
首先,将pcr扩增得到的扩增产物在100℃下水浴10min,完成水浴后马上放置在冰上进行冰浴,冰浴的时间为5min;而后将20μl的扩增产物、20μl的含有检测探针的探针液以及40μl的核酸杂交液加入微孔板的孔内,并在52℃的条件下恒温培育45min,接着使用1
×
pbst buffer漂洗微孔板5次,最后加入tmb显色液在室温下反应10min,通过微孔板孔内显色液的颜色变化来判断pcr扩增是否得到含有hla-a*29基因核苷酸序列的dna片段。
[0047]
5、结果分析图2为待测全血样品进行hla-a*29基因检测的结果图,1号孔使用待测样品的pcr扩增产物与捕获探针进行杂交,2号孔使用ddh2o与捕获探针进行杂交,3号孔使用已知含有hla-a*29基因的dna样品的pcr扩增产物与捕获探针进行杂交,1号孔以及2号孔呈无色,而3号孔呈蓝色;3号孔中存在hla-a*29基因,检测结果呈阳性,1号孔以及2号孔呈阴性结果,该份全血样品为hla-a*29阴性。
[0048]
实施例3:检测hla-dpb*0202基因方法的特异性检测使用实施例2中所述的检测hla-a*29基因的检测方法对九份已知不含有hla-a*29基因的全血样品以及一份已知含有hla-a*29基因的全血样品进行检测。
[0049]
首先使用15min高产全血基因组dna提取试剂盒对上述十份全血样品进行dna提取,接着使用试剂盒提供了试剂对上述十份待测dna样品进行pcr扩增得到扩增产物,并对扩增产物进行变性处理,将经过变性的扩增产物和含有检测探针的探针液以及核酸杂交液混合放入微孔板的孔中在一定的温度下进行杂交,接着使用1
×
pbst buffer漂洗微孔板多次,最后使用tmb显色液进行显色反应10min,显色反应结束后马上加入硫酸终止显色反应,并使用紫外分光光度计测吸光度。
[0050]
得到的结果如表4所示,1至9号全血样品hla-a*29基因检测的结果呈阴性,而10号全血样品hla-a*29基因检测的结果呈阳性,只有含有hla-a*29基因的全血样品检测结果呈阳性,说明本技术提供的试剂盒具有较强的特异性。
[0051]
表4
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
