1.本发明属于疫苗生产技术领域,具体涉及一种单一病毒收获液的生产方法。
背景技术:
2.细胞工厂是一种用于生产生物化学产品的反应装置,其设计通常是以产品的高效生产为理念,并在此过程中是遵循以下五大准则:(
ⅰ
)构建一条由原料到产品的最优合成途径;(
ⅱ
)平衡代谢途径中每步反应的代谢流,使该途径代谢通量远高于细胞基础代谢;(
ⅲ
)足量地供应合成途径的前体,多个前体根据需要调整供应比例;(
ⅳ
)酶促反应往往有各种辅因子的参与,顺畅的代谢通路需要平衡或者再生各种辅因子;(
ⅴ
)通过遗传改造或者工艺改进解除产物和代谢中间体的反馈抑制,以获取更高的产量。细胞工厂在疫苗生产中已经有较广泛的应用。例如,将其用于生产并收获乙型脑炎病毒、森林脑炎病毒和狂犬病毒等病毒,进而获得对应疾病的疫苗生产原料。“中国发明专利申请cn201910924577.4一种基于细胞工厂的森林脑炎病毒的制备方法”提供了一种利用细胞工厂首先培养地鼠肾细胞,然后利用生长出的地鼠肾细胞培养用于制备疫苗的森林脑炎病毒的方法。
3.现有的细胞工厂在培养过程中通常采用静置敞口的方式,然而这种方式难以保证每层的通气量稳定,影响培养效果和产量。然而,如果改用密闭培养的方式,则细胞产生的酸和二氧化碳容易导致培养体系的ph不稳定,影响细胞和病毒的生长。此外,在密闭培养的方式下,也不能加入碳酸氢钠等ph调节剂对后续产生的酸和二氧化碳进行缓冲,使得体系ph过高导致细胞不贴壁,影响细胞的生长,该问题导致目前细胞工厂的培养过程实际上不能够实现密闭培养的方式。
4.因此,需要对现有细胞工厂的培养方法进行改进。
技术实现要素:
5.针对现有技术的缺陷,本发明提供一种单一病毒收获液的生产方法,目的在于实现细胞工厂的密闭生产,有效维持通气量及ph的稳定,实现稳定、高产量的收获。
6.一种单一病毒收获液的生产方法,包括如下步骤:
7.(1)将地鼠肾制备成单分散的地鼠肾细胞,采用细胞工厂密闭培养地鼠肾细胞,所述细胞工厂的层数n与地鼠肾的用量m的关系为:m=n
×
2.25,m的单位为对;用于培养地鼠肾细胞的细胞生长液的初始ph为7.0-7.5,优选为7.4-7.5。
8.制备单分散的地鼠肾细胞的方法为:采用胰蛋白酶消化液于2-8℃消化地鼠肾16-20h;所述胰蛋白酶消化液的用量为每对地鼠肾2-4ml,所述胰蛋白酶消化液的ph为7.0-7.8,其含有重量百分比0.1%的胰蛋白酶和32iu/ml的硫酸庆大霉素;
9.(2)所述地鼠肾细胞生长为致密单层后,将所述地鼠肾细胞感染病毒,培养后收获单一病毒收获液。
10.优选的,所述病毒为乙型脑炎病毒、森林脑炎病毒或狂犬病毒。
11.优选的,所述细胞工厂的层数为40层,使用的地鼠肾的用量为90对。
12.优选的,步骤(1)的具体步骤为将分散为单细胞的地鼠肾细胞分装至细胞工厂,每层细胞工厂加入细胞生长液200-300ml,36-38℃培养68-72h,即得生长成致密单层的地鼠肾细胞。
13.优选的,步骤(1)中,用于培养地鼠肾细胞的细胞生长液含体积百分比5%-8%的新生牛血清、重量百分比0.2-0.3%的水解乳蛋白和0.01g/l的谷氨酰胺。
14.优选的,步骤(2)的具体步骤为:所述地鼠肾细胞生长为致密单层后,排尽用于培养地鼠肾细胞的细胞生长液,加入生理盐水清洗后,接种病毒,病毒接种moi为0.001-0.01,每层细胞工厂加入病毒维持液200-250ml,35-37℃培养48-52h后进行第一次收获,收获后继续补加200-250ml病毒维持液,继续培养18-20h进行第二次收获。
15.优选的,步骤(2)中,用于培养病毒的病毒维持液的ph为7.2-7.6。
16.优选的,步骤(2)中,用于培养病毒的病毒维持液是以mem培养液作为基础培养基,添加有终浓度为:重量百分比0.3-0.5%的人血白蛋白和0.03g/l的谷氨酰胺。
17.本发明还提供上述生产方法生产得到的单一病毒收获液。
18.本发明还提供上述单一病毒收获液为原料制备得到的疫苗。
19.本发明中,术语“单一病毒收获液”是指种毒后经培养至病毒增殖的适宜阶段收获的病毒液,检定合格同一亚批的病毒收获液合并后即为单一病毒收获液。
20.本发明具有如下有益效果:
21.1、细胞工厂的生产过程中通常都是静置敞口培养,在这种培养方式下,难以保证每层通气量的稳定。此外,维持细胞工厂中培养ph的稳定一直是本领域的难点(特别是在密闭条件下)。本发明将培养方式设置为静置密闭培养,同时将现有技术(例如专利申请cn201910924577.4)中的每层4对地鼠肾的用量降低为每层2.25对地鼠肾,通过选取合适的地鼠肾用量、合适的初始ph,兼顾了培养过程中通气量的良好控制和维持体系的ph的效果,能够实现稳定、高产量的收获。
22.2、本发明中选取的地鼠肾的用量不仅能够产生上述维持ph稳定的效果,而且在本发明的地鼠肾的用量下,生长得到的细胞致密单层的质量最佳(细胞覆盖率98%以上),相对其他工艺有很大的优势。
23.3、本发明采用细胞工厂培养病毒的过程中可进行两次收获,第一次收获在培养48-52h后,cpe可达到10%-20%即可;第二次收获在继续培养18-20h后,cpe可达到50%-75%即可。通过两次收获能够将产量提升100%。而现有的其他工艺,如转瓶工艺中,一般都是cpe达到50%-75%时为最佳收获,仅收获1次。
24.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
25.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
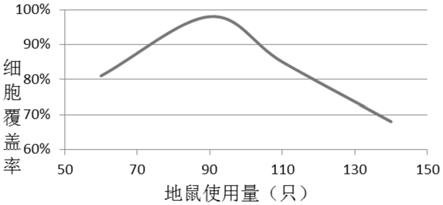
26.图1为地鼠肾的用量与细胞覆盖率之间的关系;
27.图2为地鼠肾用量65对时培养的细胞的显微镜观察图片,细胞覆盖率80%;
28.图3为地鼠肾用量80对时培养的细胞的显微镜观察图片,细胞覆盖率90%;
29.图4为地鼠肾用量90对时培养的细胞的显微镜观察图片,细胞覆盖率98%以上;
30.图5为地鼠肾用量100对时培养的细胞的显微镜观察图片,细胞覆盖率90%;
31.图6为地鼠肾用量110对时培养的细胞的显微镜观察图片,细胞覆盖率80%;
32.图7为地鼠肾用量140对时培养的细胞的显微镜观察图片,细胞覆盖率50%以下;
33.图8为实验例2中敞口静置培养结果的显微镜观察图片,细胞几乎不贴壁;
34.图9为实验例2中半敞口静置培养结果的显微镜观察图片,细胞覆盖率80%;
35.图10为实验例2中密闭静置培养结果的显微镜观察图片,细胞覆盖率98%以上;
36.图11为转瓶生产工艺与本发明的生产工艺的病毒增值曲线。
具体实施方式
37.本发明的实施例和实验例中所用的试剂和材料均为市售品。
38.实施例1乙脑减毒疫苗的生产
39.1、对地鼠进行无菌取肾,剪碎并洗涤,按每个肾加入胰蛋白酶消化液1.5ml,并于5℃消化18h。其中胰蛋白酶消化液ph为7.0-7.8,浓度为0.1%,且胰蛋白酶消化液含有32iu/ml的硫酸庆大霉素。
40.2、将消化后的肾脏组织适当进行研磨,分散成单个细胞,然后分装至40层细胞工厂,装入量为90对地鼠肾制成的单分散地鼠肾细胞,每层加入细胞生长液200ml,至37.5℃培养间培养70h,使原代地鼠肾细胞生长成致密单层。
41.细胞生长液ph为7.0-7.5,且含体积百分数6%新生牛血清,重量百分数0.2%的水解乳蛋白,0.01g/l谷氨酰胺。
42.3、排尽40层细胞工厂中的生长液,加入生理盐水清洗,每层加入300ml,震荡清洗3次,接种乙脑病毒,病毒接种moi为0.003,加入病毒维持液,每层200ml,置于36.5℃培养50h后进行第一次收获,收获后补加200ml病毒维持液,继续培养18h后进行第二次收获,共计进行二次收获。两次收获得到单一病毒收获液,然后向单一病毒收获液加入保护剂制成疫苗的半成品。保护剂的种类和用量可根据现有技术进行选取,例如可选择明胶、乳糖、蔗糖、人血白蛋白和尿素等。
43.病毒维持液ph为7.2-7.6,以mem培养液作为基础培养基,添加有终浓度为:重量百分比0.3%的人血白蛋白和0.03g/l的谷氨酰胺。
44.为了进步证明本发明的技术效果,下面通过实验例对本发明的技术方案作进一步的说明。
45.实验例1地鼠肾用量的优选
46.本实验例按照实施例1中步骤1和步骤2的方法培养地鼠肾细胞的致密单层(40层细胞工厂),区别在于地鼠肾脏的用量不同,培养得到的致密单层的细胞覆盖率如图1所示,地鼠肾用量为65对、80对、90对、100对、110对和140对时培养得到的细胞层的显微镜观察结果如图2-7。具体覆盖率数值如下表:
[0047][0048]
从结果可以看到,当地鼠肾的使用量小于90对时,细胞覆盖率随着地鼠肾用量的增加而增加;地鼠肾的使用量达到90对时,细胞覆盖率达到最大值(98%以上);继续增加地鼠肾的使用量,细胞覆盖率反而下降。
[0049]
以上实验表明,在本发明的技术方案中,对于40层细胞工厂,地鼠肾的最佳使用量为90对。
[0050]
实验例2敞口培养与密闭培养的对比
[0051]
本实验例采用与实施例1相同的培养条件,区别在于将密闭培养改变为敞口静置培养(即细胞工厂的两个通气孔全部敞开)和半敞口静置培养(即细胞工厂的两个通气孔中有一个敞开)。在培养过程中向细胞培养液中加入ph指示剂酚红。
[0052]
在本实验例的敞口静置培养过程中,细胞培养液颜色变成紫色(酚红显色),ph明显升高,细胞不贴壁(如图8所示)。
[0053]
半敞口静置培养过程中,ph指示剂酚红未显色,液体颜色应为红色(偏黄),但细胞覆盖率较低,仅为80%(如图9所示)。
[0054]
而在实施例1正常培养情况下,ph为7.1-7.3,加入ph指示剂酚红液体颜色应为红色(偏黄),细胞覆盖率高,可达到98%以上(如图10所示)。
[0055]
该实验例结果表明,实施例1优选的培养条件只能够适用于细胞工厂的密闭培养,而不能够适用于现有技术中常用的敞口静置培养。
[0056]
实施例3与15l转瓶生产工艺的对比
[0057]
本实验例将转瓶生产工艺(15l)与实施例1的生产工艺(cf40)进行对比。
[0058]
15l转瓶生产工艺具体为:每个亚批使用110对肾,7个15l转瓶为1个亚批,每个15l转瓶瓶加细胞悬液2000ml,初始ph为7.0-7.1,36-38℃使用转瓶机滚动培养68-96h,细胞贴壁后,使用乙脑sa14-14-2工作种子批接种,35-37℃在45-72h收获1次病毒原液,然后加入疫苗保护剂制成半成品,分装后即得成品。
[0059]
两种工艺的增值曲线如图11所示。从图中可以看到,在转瓶生产工艺生产进行一次收获的生产周期内,实施例1的生产工艺能够收获两次。
[0060]
对产量进行对比,转瓶生产工艺每亚批产原液量为11500ml/瓶,滴度约为7.3-7.6lgpfu/ml,使用地鼠(肾)量为110只(对);实施例1的生产工艺每个cf40病毒液产量为16000ml/cf40,滴度约为7.3-7.6lgpfu/ml,使用地鼠(肾)量为90只(对)。
[0061]
从以上对比可以看出,实施例1的生产工艺相对于现有的转瓶工艺具有生产效率高、产量大、消耗小的优点。
[0062]
通过上述实验例和实施例可以看到,本发明对细胞工厂培养生产病毒的培养方式和地鼠肾细胞用量等参数进行了优选,能够有效提高培养过程中ph的稳定性,提高地鼠肾细胞的生长质量。此外,本发明的工艺能够进行两次病毒收获。由于以上有益的效果,采用本发明方法生产病毒具有稳定、生产效率高和产量大的优点。本发明生产的病毒可进一步
用作原料生产相应疾病的疫苗,具有很好的应用前景。
