新型crispr-cas12i系统
技术领域
1.本发明涉及一种新型crispr-cas12i系统。
背景技术:
2.成簇规律间隔短回文重复序列(crispr)和crispr相关(cas)基因,统称为crispr-cas或crispr/cas系统,目前已被理解为对细菌和古细菌提供抗噬菌体感染的免疫。原核生物适应性免疫的crispr-cas系统是一组极其多样的效应子、非编码元件以及基因座结构,其可被工程化并用于基因编辑、靶标检测和疾病治疗等应用。张锋等发现了cas12a蛋白(过去称为cpf1蛋白),可用于基因编辑和基因诊断。后来又发现了更多的cas12蛋白,包括cas12b(c2c1)、cas12c(c2c3)、cas12d(casy)、cas12e(casx)、cas12f(c2c10/cas14)、cas12k(c2c5),但其性能各有优劣。
3.尽管有现有技术,本领域仍然需要新的cas蛋白和crispr-cas系统以满足多样化的应用需求。
技术实现要素:
4.本发明通过提供新的cas12i蛋白以及crispr-cas系统满足了上述需求。
5.在一个方面,本发明提供了一种cas12i蛋白,其包含与seq id no:1-10(优选地,seq id no:1-3和6,更优选地,seq id no:1)中任一项所示的氨基酸序列具有至少80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,99.5%或100%同一性的氨基酸序列。
6.在一个实施方式中,所述cas12i蛋白实质性缺乏(例如,保留小于50%、40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的)对应的野生型cas12i蛋白的针对与指导序列互补的靶dna的靶序列的间隔序列(spacer)特异性核酸内切酶切割活性。在另一个实施方式中,所述cas12i蛋白连接至一个或多个功能结构域。
7.在一个方面,本发明提供了一种编码所述cas12i蛋白的多核苷酸。在另一个方面,本发明提供了一种载体,其包含所述的多核苷酸。在另一个方面,本发明提供了一种递送系统,其包含(1)递送介质;和(2)所述cas12i蛋白、多核苷酸或载体。
8.在一个方面,本发明提供了一种工程化的、非天然存在的crispr-cas系统,其包含:
9.(1)所述的cas12i蛋白或编码所述cas12i蛋白的多核苷酸;和
10.(2)crispr rna(crrna)或编码所述crrna的多核苷酸,所述crrna包含:
11.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
12.(ii)连接至所述间隔序列的能够引导所述cas12i蛋白结合至所述crrna以形成靶向所述靶序列的crispr-cas复合物的直接重复(direct repeat,dr)序列。
13.在另一个方面,本发明提供了一种crispr-cas系统,其包括一个或多个载体,所述
一个或多个载体包含:
14.(1)第一调控元件,所述第一调控元件可操作地连接至编码所述的cas12i蛋白的核苷酸序列;和
15.(2)第二调控元件,所述第二调控元件可操作地连接至编码crispr rna(crrna)的多核苷酸,所述crrna包含:
16.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
17.(ii)连接至所述间隔序列的能够引导所述cas12i蛋白结合至所述crrna以形成靶向所述靶序列的crispr-cas复合物的直接重复(direct repeat,dr)序列;
18.其中所述第一调控元件和所述第二调控元件位于所述crispr-cas载体系统的相同或不同载体上。
19.在另一个方面,本发明提供了一种工程化的、非天然存在的crispr-cas复合物,其包含:
20.(1)所述的cas12i蛋白;和
21.(2)crispr rna(crrna),所述crrna包含:
22.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
23.(ii)连接至所述间隔序列的的直接重复(direct repeat,dr)序列;所述dr序列引导所述cas12i蛋白结合至所述crrna。
24.在一个方面,本发明提供了一种修饰靶dna的方法,其包括使所述靶dna与所述的crispr-cas系统或复合物接触,所述接触导致cas12i蛋白对所述靶dna的修饰。
25.在一个方面,本发明提供了一种细胞或其后代,其包含所述的cas12i蛋白、多核苷酸、载体、递送系统、crispr-cas系统或复合物,优选地,所述细胞选自原核细胞、真核细胞、动物细胞、植物细胞、真菌细胞、脊椎动物细胞、无脊椎动物细胞、啮齿动物细胞、哺乳动物细胞、灵长类动物细胞、非人灵长类动物细胞、和人细胞。
26.在另一个方面,本发明提供了一种非人多细胞生物体,其包含所述的细胞或其后代;优选地,所述非人多细胞生物体是用于人类基因相关疾病的动物(例如,啮齿类或非人灵长类动物)模型。
27.在一个方面,本发明提供了一种修饰靶dna的方法,其包括使所述靶dna与所述的crispr-cas系统或复合物接触,所述接触导致cas12i蛋白对所述靶dna的修饰。
28.在另一个方面,本发明提供了一种来自所述的方法的细胞或其后代,其包含在未经受所述方法的细胞中不存在的所述修饰。在另一个方面,本发明提供了一种来自所述的细胞或其后代的细胞产物,其中所述产物是以相对于来自未经受所述方法的细胞的细胞产物的性质或量来修饰的。
29.在一个方面,本发明提供了一种非特异性切割非靶dna的方法,所述方法包括使所述靶dna与所述的crispr-cas系统或复合物接触,由此所述间隔序列与所述靶dna的靶序列杂交和所述cas12i蛋白对所述靶序列的切割导致所述cas12i蛋白通过间隔序列非特异性核酸内切酶旁切活性来切割所述非靶dna。
30.在另一个方面,本发明提供了一种检测样品中的靶dna的方法,所述方法包括:
31.(1)使所述样品与所述的crispr-cas系统或复合物与被切割后可释放可检测信号的报告核酸接触,由此所述间隔序列与所述靶dna的靶序列的杂交和所述cas12i蛋白对所
述靶序列的切割导致所述cas12i蛋白通过间隔序列非特异性核酸内切酶旁切活性来切割所述报告核酸;和
32.(2)测量由所述报告核酸的切割产生的可检测信号,由此检测所述靶dna在所述样品中的存在。
33.在另一个方面,本发明提供了一种治疗有需要的受试者的病症或疾病的方法,所述方法包括向所述受试者施用所述的crispr-cas系统。
34.在一个方面,本发明提供了一种试剂盒,其包含所述的crispr-cas系统;优选所述系统的组分在同一个容器中或者在单独的容器中。在另一个方面,本发明提供了一种无菌容器,其包含所述的crispr-cas系统;优选所述无菌容器是注射器。在另一个方面,本发明提供了一种可植入装置,其包含所述的crispr-cas系统;优选所述crispr-cas系统存储在储库中。
附图说明
35.图1:bfp-p2a-gfxfp荧光报告系统示意图。
36.图2:转染sicas12i-crrna的细胞在荧光显微镜下的结果。
37.图3:10种新型cas12i与spcas9,lbcas12i,cas12i.3之间切割活性比较。
38.图4:sicas12i的适用pam的测试。
39.图5:sicas12i的适用间隔子(spacer)长度的测试。
40.图6:sicas12i与spcas9,lbcas12i,cas12i.3对ttr基因的切割活性比较。
41.图7:sicas12i与cas12i.3对ttr基因的不同位点的切割活性比较。
42.图8:sicas12i与cas12i.3对pcsk9基因的不同位点的切割活性比较。
43.图9:具有四种不同点突变的sicas12i突变体的切割活性比较,即wt sicas12.i的d700a,d650a,e875a和d1049a单突变变体版本,降低或消除切割活性。
44.图10:dsicas12i-tada8e的单碱基编辑(a-》i)活性测试。
45.图11:sicas12i在不同dr变体下的切割活性比较。
具体实施方式
46.新型cas12i蛋白
47.本发明发现新cas12i蛋白,例如sicas12i,si2cas12i,wicas12i,wi2cas12i,wi3cas12i,sacas12i,sa2cas12i,sa3cas12i,wacas12i和wa2cas12i,其具有单链或双链dna切割活性,所述序列与已知其他cas12i的序列同一性小于约50%,与其他cas例如cas9或cas12相比分子较小,具有更好的递送效率。
48.cas12i蛋白,例如sicas12i,si2cas12i,wicas12i和sacas12i在体外或在细胞水平对外源基因或内源基因均具有优异的切割活性,与spcas9,lbcas12a,cas12i.3的切割活性相当,甚至更好。cas12i蛋白,例如sicas12i,si2cas12i,wicas12i和sacas12i在细胞水平对外源基因或内源基因的特定靶序列的切割活性可达到大于约15%、20%、30%、40%、50%、60%、70%、80%、90%、95%或甚至大于99%,总体而言,其在细胞水平对外源基因或内源基因的特定靶序列的切割活性优于cas12i.3。
49.sicas12i在体外或在细胞水平对外源基因或内源基因的切割活性与spcas9或
lbcas12a相当,甚至更好,且显著优于cas12i.3。其在细胞水平对外源基因或内源基因的特定靶序列的切割活性可达到大于约15%、20%、30%、40%、50%、60%、70%、80%、90%、95%或甚至大于99%。总体而言,sicas12i在细胞水平对外源基因或内源基因的特定靶序列的切割活性显著优于cas12i.3。
50.以上新型cas12i蛋白还可含有对于所述cas12i的催化活性(核酸内切酶切割活性)或者核酸结合功能无实质影响的氨基酸突变。
51.实质性缺乏催化活性的cas12i蛋白(dcas12i)
52.本发明还提供缺乏催化活性的dcas12i蛋白,其例如,保留小于50%、40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的)对应的野生型cas12i蛋白的针对与指导序列互补的靶dna的靶序列的间隔序列(spacer)特异性核酸内切酶切割活性。其包含ruvc结构域的一个或多个氨基酸置换,所述一个或多个氨基酸置换导致实质性缺乏催化活性,例如包含在与seq id no:1所示序列的第700位、第650位、第875位或第1049位相对应的一个或多个位置处的置换,所述置换为d700a,v;d650a,v;e875a,v;或d1049a,v。在一个实施方式中,dcas12i具有seq id no:79-82所示的氨基酸序列。除此之外,dcas12i还可包含如前所述突变之外的其他突变,所述其他突变对于dcas12i蛋白的催化活性或者核酸结合功能无实质影响。实质性缺乏催化活性的dcas12i蛋白可用作dna结合蛋白。
53.如上所述的dcas12i可与腺苷脱氨酶或胞苷脱氨酶或其催化结构域相缔和,可实现单碱基编辑,碱基转化的效率高于约10%、20%、30%、40%、50%、60%、70%、80%或90%。
54.本发明以上所述的cas12i或dcas12i的全长氨基酸数目显著少于其他类型的cas12蛋白,分子小便于后续cas系统的组装和递送。
55.本发明提供了以下实施方式:
56.1.一种cas12i蛋白,其包含与seq id no:1-10(优选地,seq id no:1-3和6,更优选地,seq id no:1)中任一项所示的氨基酸序列具有至少80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,99.5%或100%同一性的氨基酸序列。
57.cas12i蛋白还可含有对于cas12i的催化活性(核酸内切酶切割活性)或者核酸结合功能无实质影响的氨基酸突变。
58.2.前述实施方式中任一项所述的cas12i蛋白,其中所述cas12i蛋白实质性缺乏(例如,保留小于50%、40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的)对应的野生型cas12i蛋白的针对与指导序列互补的靶dna的靶序列的间隔序列(spacer)特异性核酸内切酶切割活性。
59.在一个实施方式中,所述cas12i实质性缺乏(例如,保留小于50%、40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的)对应的野生型cas12i蛋白的间隔序列(spacer)特异性核酸内切酶切割活性或间隔序列非特异性旁切活性。
60.3.前述实施方式中任一项所述的cas12i蛋白,其中所述cas12i蛋白包含在其ruvc结构域中的一个或多个氨基酸变化使得所述cas12i蛋白实质性缺乏(例如,保留小于50%、
40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的)对应的野生型cas12i蛋白的针对与指导序列互补的靶dna的靶序列的间隔序列(spacer)特异性核酸内切酶切割活性。
61.4.前述实施方式中任一项所述的cas12i蛋白,所述氨基酸变化选自氨基酸添加、插入、缺失和置换;
62.5.前述实施方式中任一项所述的cas12i蛋白,所述cas12i蛋白包含在与seq id no:1所示序列的第700位(d700)、第650位(d650)、第875位(e875)或第1049位(d1049)相对应的一个或多个位置处的氨基酸置换。
63.在如上氨基酸位点(d700,d650,e875或d1049)的氨基酸可突变为与野生型序列上的对应氨基酸不同的其他氨基酸从而实质性丧失核酸内切酶切割活性。
64.所述cas12i蛋白还可含有其他突变,所述其他突变对于所述cas12i的催化活性或者核酸结合功能无实质影响。
65.6.前述实施方式中任一项所述的cas12i蛋白,所述氨基酸置换选自d700a/v、d650a/v、e875a/v和d1049a/v。
66.7.前述实施方式中任一项所述的cas12i蛋白,所述氨基酸置换选自d700a,d650a,e875a和d1049a。
67.8.前述实施方式中任一项所述的cas12i蛋白,所述氨基酸置换选自d700a、d650a、e875a、d1049a、d700a+d650a、d700a+e875a、d700a+d1049a、d650a+e875a、d650a+d1049a、e875a+d1049a、d700a+d650a+e875a、d700a+d650a+d1049a、d650a+e875a+d1049a、和d700a+d650a+e875a+d1049a。
68.9.前述实施方式中任一项所述的cas12i蛋白,所述cas12i蛋白包含seq id no:79-82中任一项所示的氨基酸序列。
69.10.前述实施方式中任一项所述的cas12i蛋白,其连接至一个或多个功能结构域。
70.11.前述实施方式中任一项所述的cas12i蛋白,其中所述功能结构域与所述cas12i蛋白的n末端和/或c末端连接。
71.所述连接可为直接连接或通过接头间接连接。
72.12.前述实施方式中任一项所述的cas12i蛋白,其中所述功能结构域选自核定位信号(nls)、核输出信号(nes)、脱氨酶(例如腺苷脱氨酶或胞苷脱氨酶)催化结构域、dna甲基化催化结构域、组蛋白残基修饰结构域、核酸酶催化结构域、荧光蛋白、转录修饰因子、光门控因子、化学诱导型因子、染色质可视化因子、提供与靶细胞或靶细胞类型上的细胞表面部分的结合的靶向多肽。
73.13.前述实施方式中任一项所述的cas12i蛋白,其中所述功能结构域表现出修饰靶dna的活性,其选自:核酸酶活性、甲基化活性、脱甲基化活性、dna修复活性、dna损伤活性、脱氨基活性、歧化酶活性、烷基化活性、脱嘌呤活性、氧化活性、嘧啶二聚体形成活性、整合酶活性、转座酶活性、重组酶活性、聚合酶活性、连接酶活性、解旋酶活性、光裂合酶活性、糖基化酶活性、乙酰基转移酶活性、脱乙酰酶活性、激酶活性、磷酸酶活性、泛素连接酶活性、去泛素化活性、腺苷酸化活性、脱腺苷酸化活性、sumo化活性、脱sumo化活性、核糖基化活性、脱核糖基化活性、豆蔻酰化活性、脱豆蔻酰化活性、糖基化活性(例如,来自o-glcnac转移酶)、脱糖基化活性、转录抑制活性、转录激活活性。
74.14.前述实施方式中任一项所述的cas12i蛋白,其中所述功能结构域选自腺苷脱氨酶催化结构域或胞苷脱氨酶催化结构域。
75.15.前述实施方式中任一项所述的cas12i蛋白,其中所述功能结构域是tada8e的全长或功能性片段。
76.16.前述实施方式中任一项所述的cas12i蛋白,所述cas12i蛋白包含seq id no:85所示的氨基酸序列。
77.17.前述实施方式中任一项所述的cas12i蛋白,其被修饰以降低或消除间隔序列非特异性核酸内切酶旁切活性。
78.18.一种编码前述实施方式中任一项所述的cas12i蛋白的多核苷酸。
79.19.前述实施方式中任一项所述的多核苷酸,其被密码子优化以在真核细胞中表达。
80.20.前述实施方式中任一项所述的多核苷酸,其包含与seq id no:11-20和seq id no:37-46中任一项所示的核苷酸序列具有至少80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,99.5%或100%同一性的核苷酸序列。
81.21.一种载体,其包含前述实施方式中任一项所述的多核苷酸。
82.22.前述实施方式中任一项所述的载体,其中所述多核苷酸可操作地连接至启动子。
83.23.前述实施方式中任一项所述的载体,其中所述启动子是组成型启动子、诱导性启动子、泛在性(ubiquitous)启动子、细胞类型特异性启动子或组织特异性启动子。
84.24.前述实施方式中任一项所述的载体,其是质粒。
85.25.前述实施方式中任一项所述的载体,其是逆转录病毒载体、噬菌体载体、腺病毒载体、单纯疱疹病毒(hsv)载体、腺相关病毒(aav)载体或慢病毒载体。
86.26.前述实施方式中任一项所述的载体,其中所述aav载体选自血清型aav1、aav2、aav4、aav5、aav6、aav7、aavrh74、aav8、aav9、aav10、aav11、aav12和aav13的重组aav载体。
87.27.一种递送系统,其包含(1)递送介质;和(2)前述实施方式中任一项所述的cas12i蛋白、多核苷酸或载体。
88.28.前述实施方式中任一项所述的递送系统,其中所述递送介质是纳米颗粒、脂质体、外泌体、微囊泡或基因枪。
89.29.一种工程化的、非天然存在的crispr-cas系统,其包含:
90.(1)前述实施方式中任一项所述的cas12i蛋白或编码所述cas12i蛋白的多核苷酸;和
91.(2)crispr rna(crrna)或编码所述crrna的多核苷酸,所述crrna包含:
92.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
93.(ii)连接至所述间隔序列的能够引导所述cas12i蛋白结合至所述crrna以形成靶向所述靶序列的crispr-cas复合物的直接重复(direct repeat,dr)序列。
94.所述cas12i蛋白能够结合至所述crrna,并靶向所述靶序列,其中所述靶序列为单链或双链dna或rna。
95.30.一种crispr-cas系统,其包括一个或多个载体,所述一个或多个载体包含:
96.(1)第一调控元件,所述第一调控元件可操作地连接至编码前述实施方式中任一项所述的cas12i蛋白的核苷酸序列;和
97.(2)第二调控元件,所述第二调控元件可操作地连接至编码crispr rna(crrna)的多核苷酸,所述crrna包含:
98.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
99.(ii)连接至所述间隔序列的能够引导所述cas12i蛋白结合至所述crrna以形成靶向所述靶序列的crispr-cas复合物的直接重复(direct repeat,dr)序列;
100.其中所述第一调控元件和所述第二调控元件位于所述crispr-cas载体系统的相同或不同载体上。
101.31.一种工程化的、非天然存在的crispr-cas复合物,其包含:
102.(1)前述实施方式中任一项所述的cas12i蛋白;和
103.(2)crispr rna(crrna),所述crrna包含:
104.(i)能够与靶dna的靶序列杂交的间隔(spacer)序列,和
105.(ii)连接至所述间隔序列的的直接重复(direct repeat,dr)序列;所述dr序列引导所述cas12i蛋白结合至所述crrna。
106.32.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述间隔序列的长度大于16个核苷酸,优选16至100个核苷酸,更优选16至50个核苷酸(例如,16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50个核苷酸),更优选16至27个核苷酸,更优选17至24个核苷酸,更优选18至24个核苷酸,最优选18至22个核苷酸。
107.33.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述dr序列具有与seq id no:21-30中任一项所示的dr序列的二级结构基本上相同的二级结构。
108.34.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述dr序列与seq id no:21-30中任一项所示的dr序列相比具有不导致二级结构发生实质性差异的核苷酸添加、插入、缺失或置换。
109.35.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述dr序列包含靠近所述dr序列的3’末端的茎环结构,
110.其中所述茎环结构包含5
’‑
x1x2x3x4x5nnnnnnnx6x7x8x9x
10-3’(x1,x2,x3,x4,x5,x6,x7,x8,x9,x
10
是任何碱基,n是任何核碱基或缺失,n是任何核碱基);其中x1x2x3x4x5与x6x7x8x9x
10
可彼此杂交。
111.36.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述dr序列包含以下任一项的茎环结构:
112.靠近dr序列3’末端的5
’‑
cucccnnnnnnugggag-3’,其中n为任何核碱基;
113.靠近dr序列3’末端的5
’‑
cuccunnnnnnugggag-3’,其中n为任何核碱基;
114.靠近dr序列3’末端的5
’‑
gucccnnnnnnugggac-3’,其中n为任何核碱基;
115.靠近dr序列3’末端的5
’‑
gugucnnnnnnugacac-3’,其中n为任何核碱基;
116.靠近dr序列3’末端的5
’‑
gugccnnnnnnuggcac-3’,其中n为任何核碱基;
117.靠近dr序列3’末端的5
’‑
ugugunnnnnnucacac-3’,其中n为任何核碱基;和
118.靠近dr序列3’末端的5
’‑
ccgucnnnnnnugacgg-3’,其中n为任何核碱基。
119.靠近dr序列3’末端的5
’‑
gtttcnnnnnnugaaac-3’,其中n为任何核碱基。
120.靠近dr序列3’末端的5
’‑
gtgttnnnnnnuaacac-3’,其中n为任何核碱基。
121.靠近dr序列3’末端的5
’‑
ttgtcnnnnnnugacaa-3’,其中n为任何核碱基。
122.37.前述实施方式中任一项所述的crispr-cas系统或复合物,其还包含能够与所述间隔序列杂交的靶dna。
123.38.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述靶dna是真核dna。
124.39.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述靶dna在细胞中;优选所述细胞选自原核细胞、真核细胞、动物细胞、植物细胞、真菌细胞、脊椎动物细胞、无脊椎动物细胞、啮齿动物细胞、哺乳动物细胞、灵长类动物细胞、非人灵长类动物细胞、和人细胞。
125.40.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述crrna与所述靶dna的靶序列杂交且形成复合物,导致所述cas12i蛋白切割所述靶序列。
126.41.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述靶序列在原型间隔子邻近基序(pam)的3’端。
127.42.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述pam包含5
’‑
t富集基序。
128.43.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述pam是5
’‑
tta、5
’‑
ttt、5
’‑
ttg、5
’‑
ttc、5
’‑
ata或5
’‑
atg。
129.44.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述一个或多个载体包括一个或多个逆转录病毒载体、噬菌体载体、腺病毒载体、单纯疱疹病毒(hsv)载体、腺相关病毒(aav)载体或慢病毒载体。
130.45.前述实施方式中任一项所述的crispr-cas系统或复合物,所述aav载体选自血清型aav1、aav2、aav4、aav5、aav6、aav7、aavrh74、aav8、aav9、aav10、aav11、aav12和aav13的重组aav载体。
131.46.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述调控元件包含启动子。
132.47.前述实施方式中任一项所述的crispr-cas系统或复合物,所述启动子选自组成型启动子、诱导性启动子、泛在性(ubiquitous)启动子、细胞类型特异性启动子或组织特异性启动子。
133.48.前述实施方式中任一项所述的crispr-cas系统或复合物,所述启动子在真核细胞中是功能性的。
134.49.前述实施方式中任一项所述的crispr-cas系统或复合物,其中所述真核细胞包括动物细胞、植物细胞、真菌细胞、脊椎动物细胞、无脊椎动物细胞、啮齿动物细胞、哺乳动物细胞、灵长类动物细胞、非人灵长类动物细胞、和人细胞。
135.50.前述实施方式中任一项所述的crispr-cas系统或复合物,其还包含dna供体模板,任选地,所述dna供体模板通过同源定向修复(hdr)而被插入到感兴趣的基因座处。
136.51.一种细胞或其后代,其包含前述实施方式中任一项所述的cas12i蛋白、多核苷酸、载体、递送系统、crispr-cas系统或复合物,优选地,所述细胞选自原核细胞、真核细胞、
动物细胞、植物细胞、真菌细胞、脊椎动物细胞、无脊椎动物细胞、啮齿动物细胞、哺乳动物细胞、灵长类动物细胞、非人灵长类动物细胞、和人细胞。
137.52.一种非人多细胞生物体,其包含前述实施方式中任一项所述的细胞或其后代;优选地,所述非人多细胞生物体是用于人类基因相关疾病的动物(例如,啮齿类或非人灵长类动物)模型。
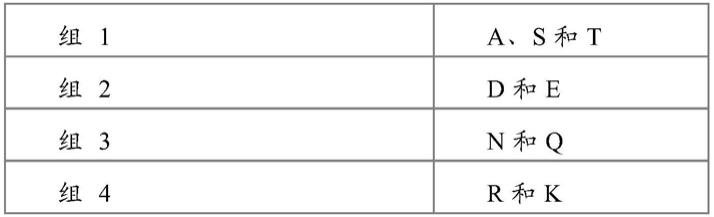
138.53.一种修饰靶dna的方法,其包括使所述靶dna与前述实施方式中任一项所述的crispr-cas系统或复合物接触,所述接触导致cas12i蛋白对所述靶dna的修饰。
139.54.前述实施方式中任一项所述的方法,其中所述修饰在体外在细胞外部发生。
140.55.前述实施方式中任一项所述的方法,其中所述修饰在体外在细胞内部发生。
141.56.前述实施方式中任一项所述的方法,其中所述修饰在体内在细胞内部发生。
142.57.前述实施方式中任一项所述的方法,其中所述细胞是真核细胞。
143.58.前述实施方式中任一项所述的方法,其中所述真核细胞选自动物细胞、植物细胞、真菌细胞、脊椎动物细胞、无脊椎动物细胞、啮齿动物细胞、哺乳动物细胞、灵长类动物细胞、非人灵长类动物细胞、和人细胞。
144.59.前述实施方式中任一项所述的方法,其中所述修饰是对所述靶dna的切割。
145.任选地,以切割单链dna的方式,或任选地,以顺序切割双链dna的相同位点或不同位点的方式。
146.60.前述实施方式中任一项所述的方法,其中所述切割导致核苷酸序列的缺失和/或核苷酸序列的插入。
147.61.前述实施方式中任一项所述的方法,其中所述切割包括在两个位点上切割所述靶核酸,从而导致所述两个位点之间的序列的缺失或倒置。
148.62.前述实施方式中任一项所述的方法,其中所述修饰是碱基变化,优选a
→
g或c
→
t碱基变化。
149.63.一种来自前述实施方式中任一项所述的方法的细胞或其后代,其包含在未经受所述方法的细胞中不存在的所述修饰。
150.64.前述实施方式中任一项所述的细胞或其后代,其中未经受所述方法的细胞包含异常且来自所述方法的所述细胞的所述异常已经得到解决或校正。
151.65.一种来自前述实施方式中任一项所述的细胞或其后代的细胞产物,其中所述产物是以相对于来自未经受所述方法的细胞的细胞产物的性质或量来修饰的。
152.66.前述实施方式中任一项所述的细胞产物,其中未经受所述方法的细胞包含异常且所述细胞产物反映所述异常已经通过所述方法得到解决或校正。
153.67.一种非特异性切割非靶dna的方法,所述方法包括使所述靶dna与前述实施方式中任一项所述的crispr-cas系统或复合物接触,由此所述间隔序列与所述靶dna的靶序列杂交和所述cas12i蛋白对所述靶序列的切割导致所述cas12i蛋白通过间隔序列非特异性核酸内切酶旁切活性来切割所述非靶dna。
154.68.一种检测样品中的靶dna的方法,所述方法包括:
155.(1)使所述样品与前述实施方式中任一项所述的crispr-cas系统或复合物与被切割后可释放可检测信号的报告核酸接触,由此所述间隔序列与所述靶dna的靶序列的杂交和所述cas12i蛋白对所述靶序列的切割导致所述cas12i蛋白通过间隔序列非特异性核酸
内切酶旁切活性来切割所述报告核酸;和
156.(2)测量由所述报告核酸的切割产生的可检测信号,由此检测所述靶dna在所述样品中的存在。
157.69.前述实施方式中任一项所述的方法,所述方法进一步包括将所述可检测信号的水平与参比信号水平进行比较,并基于所述可检测信号的水平来确定所述样品中的所述靶dna的量。
158.70.前述实施方式中任一项所述的方法,其中使用金纳米颗粒检测、荧光偏振、胶体相变/分散、电化学检测或基于半导体的传感进行所述测量。
159.71.前述实施方式中任一项所述的方法,其中所述报告核酸包括荧光发射染料对、荧光共振能量转移(fret)对或猝灭剂/荧光团对,所述cas12i蛋白对所述报告核酸的切割导致由所述报告核酸的切割产生的可检测信号的量的增加或减少。
160.72.一种治疗有需要的受试者的病症或疾病的方法,所述方法包括向所述受试者施用前述实施方式中任一项所述的crispr-cas系统。
161.73.前述实施方式中任一项的方法,其中所述病症或疾病是癌症或感染性疾病或神经疾病,
162.任选地,所述癌症选自以下:
163.维尔姆斯瘤、尤文肉瘤、神经内分泌瘤、胶质母细胞瘤、神经母细胞瘤、黑色素瘤、皮肤癌、乳腺癌、结肠癌、直肠癌、前列腺癌、肝癌、肾癌、胰腺癌、肺癌、胆道癌、宫颈癌、子宫内膜癌、食管癌、胃癌、头颈癌、甲状腺髓样癌、卵巢癌、胶质瘤、淋巴瘤、白血病、骨髓瘤、急性淋巴细胞白血病、急性髓细胞性白血病、慢性淋巴细胞白血病、慢性髓细胞性白血病、何杰金氏淋巴瘤、非何杰金氏淋巴瘤和尿膀胱癌;
164.任选地,所述所述感染性疾病由以下引起:
165.人类免疫缺陷病毒(hiv)、单纯疱疹病毒-1(hsv1)和单纯疱疹病毒-2(hsv2);
166.任选的,所述神经疾病选自以下:
167.青光眼、与年龄相关的rgc丧失、视神经损伤、视网膜缺血、leber遗传性视神经病变、与rgc神经元退化相关的神经系统疾病、与有需要的受试者纹状体中功能性神经元退化相关的神经系统疾病、帕金森氏症疾病、阿尔茨海默病、亨廷顿病、精神分裂症、抑郁症、毒瘾、运动障碍,如舞蹈病、舞蹈手足徐动症和运动障碍、双相情感障碍、自闭症谱系障碍(asd)或功能障碍。
168.74.前述实施方式中任一项的方法,其中所述病症或疾病选自以下:囊性纤维化、进行性假肥大性肌营养不良、贝克肌营养不良、α-1-抗胰蛋白酶缺乏、庞贝病、强直性肌营养不良、亨廷顿病、脆性x综合征、弗里德赖希共济失调、肌萎缩侧索硬化、额颞叶痴呆、遗传性慢性肾脏病、高脂血症、高胆固醇血症、莱伯氏先天性黑蒙、镰状细胞病和β地中海贫血。
169.75.前述实施方式中任一项的方法,其中所述病症或疾病是由含有致病性点突变引起的疾病。
170.76.一种试剂盒,其包含前述实施方式中任一项所述的crispr-cas系统;优选所述系统的组分在同一个容器中或者在单独的容器中。
171.77.一种无菌容器,其包含前述实施方式中任一项所述的crispr-cas系统;优选所述无菌容器是注射器。
turksen,ed.,2006);human embryonic stem cell protocols(methods in molecular biology)(kursad turksen ed.,2006);mesenchymal stem cells:methods and protocols(methods in molecular biology)(darwin j.prockop,donald g.phinney,and bruce a.bunnell eds.,2008);hematopoietic stem cell protocols(methods in molecular medicine)(christopher a.klug,and craig t.jordan eds.,2001);hematopoietic stem cell protocols(methods in molecular biology)(kevin d.bunting ed.,2008)neural stem cells:methods and protocols(methods in molecular biology)(leslie p.weiner ed.,2008);hogan et ah,methods of manipulating the mouse embyro(2
nd edition,1994);nagy et al,methods of manipulating the mouse embryo(3
rd edition,2002),和the zebrafish book.a guide for the laboratory use of zebrafish(danio rerio),4th ed.,(univ.of oregon press,eugene,or,2000)。
175.本文引用的所有公开文件、专利和专利申请通过引入全文并入本文。
176.除非另有说明,本文使用的所有技术和科学术语具有本发明所属的技术领域的普通技术人员通常理解的含义。为了本发明的目的,定义以下术语,以同本技术领域通常理解的含义保持一致。
177.冠词"一个/一种(a/an)"和"该/所述(the)"在本文中用于指一个/一种或超过一个/一种(即至少一个/一种)所述冠词的语法对象。例如,"要素"意指一个/一种要素或超过一个/一种要素。
178.替代(例如"或")的使用应理解为意指替代方案中任一、两者或其任何组合。
179.术语"和/或"应理解为意指替代方案中任一或两者。
180.如本文使用的,术语"约"或"大约”是指与参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度相比较,改变多达15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度。在一个实施方式中,术语"约"或"大约”是指围绕参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度
±
15%、
±
10%、
±
9%、
±
8%、
±
7%、
±
6%、
±
5%、
±
4%、
±
3%、
±
2%或
±
1%的数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度范围。
181.如本文使用的,术语"基本上(substantially/essentially)”是指与程度、参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度相比较,是约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%或更高的程度、数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度。
182.数值范围,包含该范围的端点值,以及范围的每个具体数值,例如“16至100个核苷酸之间”包括16和100,以及16至100之间的每一个具体数值。
183.在本说明书全文,除非上下文另有要求,否则术语"包含",“包括”、“含有”和“具有”应理解为暗示包括所述步骤或要素或者步骤或要素组,但不排除任何其他步骤或要素或者步骤或要素组。在特定实施方式中,术语"术语"包含",“包括”、“含有”和“具有”同义使用。
184."由
……
组成"意指包括但限于在短语"由
……
组成"后的任何。因此,短语"由
……
组成”是指示所列出的要素是需要的或强制性的,并且没有其他要素是可以存在的。
185."基本上由
……
组成"意指包括在短语"基本上由
……
组成"后列出的任何要素,并且限于不干扰或贡献于所列出的要素的公开内容中指定的活动或动作的其他要素。因此,短语"基本上由
……
组成”是指示所列出的要素是需要的或强制性的,但没有其他要素是任选的,并且取决于它们是否影响所列出的要素的活动或动作而可以存在或不存在。
186.在本说明书全文,提到"一个实施方式"、"实施方式"、"特定实施方式"、"相关实施方式"、"某个实施方式"、"另外的实施方式"或"进一步的实施方式"或其组合意指与所述实施方式结合描述的特定特征、结构或特性被包括在本发明的至少一个实施方式中。因此,前述短语在本说明书全文的各个地方的出现不一定全部指相同实施方式。此外,特定特征、结构或特性可以以任何合适方式在一个或多个实施方式中组合。
187.两条多肽或核酸序列之间的“序列同一性”表示所述序列之间相同的残基的数目占残基总数的百分比,且基于突变类型确定残基总数的计算。突变类型包括在序列任一端或两端的插入(延伸)、在序列任一端或两端的缺失(截短)、一个或多个氨基酸/核苷酸的置换/替代、在序列内部的插入、在序列内部的缺失。举多肽为例(核苷酸同理),如果突变类型为以下中的一种或多种:一个或多个氨基酸/核苷酸的置换/替代、在序列内部的插入和在序列内部的缺失,则残基总数以比较的分子中较大者来计算。如果突变类型还包括在序列任一端或两端的插入(延伸)或在序列任一端或两端的缺失(截短),则在任一端或两端插入或缺失的氨基酸的数量(例如,在两端插入或缺失的数量小于20个)并不计入残基总数中。在计算同一性百分数时,将正在比较的序列以产生序列之间最大匹配的方式比对,通过特定算法解决比对中的空位(如果存在的话)。
188.可以保守性置换非关键的氨基酸而不影响蛋白质的正常功能。保守性置换意指用化学或功能相似的氨基酸置换氨基酸。提供相似氨基酸的保守性置换表是本领域熟知的。举例来说,在一些实施方式中,以下提供的氨基酸组被认为是相互的保守性置换。
189.在某些实施方式中,被认为是相互保守性置换的氨基酸的所选组
190.酸性残基d和e碱性残基k、r和h亲水性不带电荷的残基s、t、n和q脂肪族不带电荷的残基g、a、v、l和i非极性不带电荷的残基c、m和p芳香族残基f、y和w
191.在某些实施方式中,被认为是相互的保守性置换的氨基酸的其他所选组
192.[0193][0194]
在某些实施方式中,被认为是相互的保守性置换的氨基酸的其他所选组
[0195]
组aa和g组bd和e组cn和q组dr、k和h组ei、l、m、v组ff、y和w组gs和t组hc和m
[0196]
术语“氨基酸”意指二十种常见的天然存在的氨基酸。天然存在的氨基酸包括丙氨酸(ala;a)、精氨酸(arg;r)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、半胱氨酸(cys;c);谷氨酸(glu;e)、谷氨酰胺(gln;q)、甘氨酸(gly;g)、组氨酸(his;h)、异亮氨酸(ile;i)、亮氨酸(leu;l)、赖氨酸(lys;k)、蛋氨酸(met;m)、苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)和缬氨酸(val;v)。
[0197]
本文中,术语“cas12i蛋白”取其最广泛的含义,包含野生型cas12i蛋白,其衍生物或变体,及其功能性片段例如寡核苷酸结合片段。
[0198]
本文中,术语“crrna”可与指导分子、grna、指导rna互换使用,是指基于核酸的分子,包括但不限于能够与crispr-cas蛋白质形成复合物的基于rna的分子(例如直接重复序列),并包含与靶核酸序列具有足够互补性以与靶核酸序列杂交并引导复合物与靶核酸序列的序列特异性结合的序列(例如间隔序列)。
[0199]
本文中,术语“crispr阵列”是指包括crispr重复和间隔序列的核酸(例如dna)片段,其从第一个crispr重复的第一个核苷酸开始并以最后一个(末端)crispr重复的最后一个核苷酸结束。典型地,crispr阵列中的每个间隔子位于两个重复之间。本文中使用的术语“crispr重复”或“crispr直接重复”或“直接重复”是指多个短的直接重复序列,其在crispr阵列中显示出非常小的序列变化或没有序列变化。适当地,v-i型直接重复可以形成茎环结构。
[0200]“茎环结构”是指具有二级结构的核酸,所述二级结构包括已知或预测形成双链(茎部分)的核苷酸区域,所述双链(茎部分)在一侧由主要为单链核苷酸的区域(环部分)连接。术语“发夹”和“折回”结构在本文中也用于指茎环结构。这样的结构在本领域中是公知的,并且这些术语与其在本领域中的公知含义一致地使用。如本领域已知的,茎环结构不需要精确的碱基配对。因此,茎可以包括一个或多个碱基错配。可替代地,碱基配对可以是精确的,即不包括任何错配。
[0201]
本文中,靶核酸与靶序列或靶核酸序列互换使用,是指特定的核酸,其包含与crrna中间隔序列的全部或部分互补的核酸序列。在一些实例中,靶核酸包含基因或基因内的序列。在一些实例中,靶核酸包含非编码区(例如,启动子)。在一些实例中,靶核酸是单链
的。在一些实例中,靶核酸是双链的。
[0202]
本文中,“供体模板核酸”或“供体模板”可互换使用,是指在本文所述的crispr酶改变了靶核酸之后,一种或多种细胞蛋白质可以使用其来改变靶核酸的结构的核酸分子。在一些实例中,供体模板核酸是双链核酸。在一些实例中,供体模板核酸是单链核酸。在一些实例中,供体模板核酸是线性的。在一些实例中,供体模板核酸是环状的(例如,质粒)。在一些实例中,供体模板核酸是外源核酸分子。在一些实例中,供体模板核酸是内源核酸分子(例如,染色体)。
[0203]
靶核酸应与pam(原间隔子相邻基序)相缔合。也就是说,由crispr复合物识别的短序列。取决于crispr-cas蛋白的性质,所述靶序列应当进行选择,使得其在dna双链体中的互补序列(靶序列的互补序列)在pam的上游或下游。在本发明的实施方式中,靶序列的互补序列在pam的下游或3’。pam的精确序列和长度要求因所使用的cas12i蛋白而异。
[0204]
本文中,术语“切割”是指由本文所述crispr系统的核酸酶产生的靶核酸中的dna断裂。在一些实例中,切割是双链dna断裂。在一些实例中,切割是单链dna断裂。
[0205]
本文中,“切割靶核酸”或“修饰靶核酸”的含义可以重叠。修饰靶核酸不仅包括对单核苷酸的修饰,还包括核酸片段的插入或缺失。
[0206]
旁切活性
[0207]
cas12i蛋白可具有附带活性,也就是说,在某些环境中,激活的cas12i蛋白在结合靶序列后仍然保持活性,并继续非特异性地切割非靶寡核苷酸。该旁切活性能够使用cas12i系统检测特定靶寡核苷酸的存在。在一个实施方式中,将cas12i系统工程化以非特异性切割ssdna或转录物。在某些实施方式中,cas12i在体外系统或细胞中瞬时或稳定地提供或表达,并靶向或触发以非特异性地切割细胞核酸,例如ssdna,例如病毒ssdna。
[0208]
旁切活性最近被用于称为sherlock的高灵敏度和特异性核酸检测平台,该平台可用于许多临床诊断(gootenberg,j.s.等人,nucleic acid detection with crispr-cas13a/c2c2.science 356,438-442(2017))。
[0209]
报告核酸
[0210]“报告核酸”是指可被本文所述的激活的crispr系统蛋白切割或以其他方式减活的分子。报告核酸包含可被crispr蛋白切割的核酸元件。核酸元件的切割释放出剂或产生构象变化,从而允许产生可检测的信号。在切割之前,或者当报告核酸处于“活性”状态时,报告核酸阻止阳性可检测信号的产生或检测。将理解的是,在某些示例实施方式中,在存在活性报告核酸的情况下可产生最小的背景信号。阳性可检测信号可以是可使用光学、荧光、化学发光、电化学或本领域已知的其他检测方法检测的任何信号。例如,在某些实施方式中,当存在报告核酸时,可检测到第一信号(即阴性可检测信号),然后在检测到靶分子以及通过激活的crispr蛋白切割或减活后将其转换为第二信号(例如阳性可检测信号)。
[0211]
本文中,实质性缺乏核酸内切酶切割活性的cas12i蛋白(dcas12i),其是指与野生型酶相比保留小于50%、40%、35%、30%、27.5%、25%、22.5%、20%、17.5%、15%、12.5%、10%、7.5%、5%、4%、3%、2.5%、2%、1%或更低的核酸内切酶切割活性。一个实例可以是当突变形式的dna切割活性与非突变形式相比为零或可忽略时。在一个实例中,cas12i蛋白是无催化活性的cas12i蛋白,其在ruvc结构域中包含突变,允许形成crispr复合物并成功结合至靶核酸而同时不允许成功的核酸酶活性(催化/切割活性)。
[0212]
功能结构域
[0213]
功能结构域取其最广泛的含义,包括蛋白例如酶或因子本身或其特定功能片段(结构域)。
[0214]
cas12i蛋白(例如dcas12i)与一个或多个功能结构域相缔合,所述功能结构域选自脱氨酶(例如腺苷脱氨酶或胞苷脱氨酶)催化结构域、dna甲基化催化结构域、组蛋白残基修饰结构域、核酸酶催化结构域、荧光蛋白、转录修饰因子、光门控因子、化学诱导型因子或染色质可视化因子;优选地,所述功能结构域选自腺苷脱氨酶或胞苷脱氨酶催化结构域。
[0215]
在一些实施方式中,功能结构域可以是转录激活结构域。在一些实施方式中,功能结构域是转录阻遏结构域。在一些实施方式中,功能结构域是表观遗传修饰结构域,使得提供了表观遗传修饰酶。在一些实施方式中,功能结构域是激活结构域。在一些实施方式中,cas12i蛋白与一个或多个功能性结构域相缔合;并且cas12i蛋白在ruvc结构域内含有一个或多个突变,由此形成的crispr复合物能够递送表观遗传修饰子或者转录或翻译激活或阻遏信号。
[0216]
功能结构域可以是例如来自由以下组成的组的一个或多个结构域:甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、rna切割活性、dna切割活性、核酸结合活性和分子开关(例如光诱导型)。当包括多于一个功能结构域时,所述功能结构域可以相同或不同。
[0217]
碱基编辑
[0218]
在某些示例实施方式中,cas12i(例如dcas12i)可与腺苷脱氨酶或胞苷脱氨酶融合以用于碱基编辑目的。
[0219]
腺苷脱氨酶
[0220]
如本文所用,术语“腺苷脱氨酶”或“腺苷脱氨酶蛋白”是指蛋白质,多肽,或蛋白质或多肽的一个或多个功能结构域,其能够催化将腺嘌呤(或分子的腺嘌呤部分)转化为次黄嘌呤(或分子的次黄嘌呤部分)的水解脱氨反应,如下所示。在一些实施方式中,含腺嘌呤的分子是腺苷(a),并且含次黄嘌呤的分子是肌苷(i)。含腺嘌呤的分子可以是脱氧核糖核酸(dna)或核糖核酸(rna)。
[0221]
根据本公开,可与本公开结合使用的腺苷脱氨酶包括但不限于称为作用于rna的腺苷脱氨酶的酶家族成员(adar),称为作用于trna的腺苷脱氨酶的酶家族成员(adat),以及其他含腺苷脱氨酶结构域(adad)的家族成员。根据本公开,腺苷脱氨酶能够靶向rna/dna和rna双链体中的腺嘌呤。实际上,zheng等人,(nucleic acids res.2017,45(6):3369-3377)证实adar可对rna/dna和rna/rna双链体进行腺苷至肌苷的编辑反应。在特定的实施方式中,腺苷脱氨酶已被修饰以增加其编辑rna双链体的rna/dna异源双链体中的dna的能力,如下文所详述。
[0222]
在一些实施方式中,腺苷脱氨酶源自一种或多种后生动物物种,包括但不限于哺乳动物、鸟类、青蛙、鱿鱼、鱼、蝇和蠕虫。在一些实施方式中,腺苷脱氨酶是人类、鱿鱼或果蝇腺苷脱氨酶。
[0223]
在一些实施方式中,腺苷脱氨酶是人类adar,包括hadar1、hadar2、hadar3。在一些实施方式中,腺苷脱氨酶是秀丽隐杆线虫(caenorhabditis elegans)adar蛋白,包括adr-1和adr-2。在一些实施方式中,腺苷脱氨酶是果蝇adar蛋白,包括dadar。在一些实施方式中,
腺苷脱氨酶是鱿鱼(长翼鱿鱼(loligo pealeii))adar蛋白,包括sqadar2a和sqadar2b。在一些实施方式中,腺苷脱氨酶是人类adat蛋白。在一些实施方式中,腺苷脱氨酶是果蝇adat蛋白。在一些实施方式中,腺苷脱氨酶是人类adad蛋白,包括tenr(hadad1)和tenrl(hadad2)。
[0224]
在一些实施方式中,腺苷脱氨酶是tada蛋白,例如大肠杆菌tada。参见kim等人,biochemistry 45:6407-6416(2006);wolf等人,embo j.21:3841-3851(2002)。在一些实施方式中,腺苷脱氨酶是小鼠ada。参见grunebaum等人,curr.opin.allergy clin.immunol.13:630-638(2013)。在一些实施方式中,腺苷脱氨酶是人类adat2。参见fukui等人,j.nucleic acids 2010:260512(2010)。在一些实施方式中,脱氨酶(例如腺苷或胞苷脱氨酶)是以下文献中描述的那些中的一种或多种:cox等人,science.2017年11月24日;358(6366):1019-1027;komore等人,nature.2016年5月19日;533(7603):420-4;以及gaudelli等人,nature.2017年11月23日;551(7681):464-471。
[0225]
在一些实施方式中,腺苷脱氨酶蛋白识别双链核酸底物中的一个或多个靶腺苷残基并将其转化为肌苷残基。在一些实施方式中,双链核酸底物是rna-dna杂合双链体。在一些实施方式中,腺苷脱氨酶蛋白识别双链底物上的结合窗口。在一些实施方式中,结合窗口包含至少一个靶腺苷残基。在一些实施方式中,结合窗口在约3bp至约100bp的范围内。在一些实施方式中,结合窗口在约5bp至约50bp的范围内。在一些实施方式中,结合窗口在约10bp至约30bp的范围内。在一些实施方式中,结合窗口为约1bp、2bp、3bp、5bp、7bp、10bp、15bp、20bp、25bp、30bp、40bp、45bp、50bp、55bp、60bp、65bp、70bp、75bp、80bp、85bp、90bp、95bp或100bp。
[0226]
在一些实施方式中,腺苷脱氨酶蛋白包含一个或多个脱氨酶结构域。不希望受特定理论的束缚,预期脱氨酶结构域用于识别双链核酸底物中所含的一个或多个靶腺苷(a)残基并将其转化为肌苷(i)残基。在一些实施方式中,脱氨酶结构域包含活性中心。在一些实施方式中,活性中心包含锌离子。在一些实施方式中,在a-i编辑过程期间,靶腺苷残基处的碱基配对被破坏,并且靶腺苷残基被“翻转”出双螺旋,以变得可被腺苷脱氨酶接近。在一些实施方式中,活性中心中或附近的氨基酸残基与靶腺苷残基的5'的一个或多个核苷酸相互作用。在一些实施方式中,在活性中心内或附近的氨基酸残基与靶腺苷残基的3'的一个或多个核苷酸相互作用。在一些实施方式中,活性中心中或附近的氨基酸残基进一步与和相反链上的靶腺苷残基互补的核苷酸相互作用。在一些实施方式中,氨基酸残基与核苷酸的2'羟基形成氢键。
[0227]
在一些实施方式中,腺苷脱氨酶包含人类adar2全蛋白(hadar2)或其脱氨酶结构域(hadar2-d)。在一些实施方式中,腺苷脱氨酶是与hadar2或hadar2-d同源的adar家族成员。
[0228]
特别地,在一些实施方式中,同源adar蛋白是人类adar1(hadar1)或其脱氨酶结构域(hadar1-d)。在一些实施方式中,hadar1-d的甘氨酸1007对应于甘氨酸487hadar2-d,并且hadar1-d的谷氨酸1008对应于hadar2-d的谷氨酸488。
[0229]
在一些实施方式中,腺苷脱氨酶包含hadar2-d的野生型氨基酸序列。在一些实施方式中,腺苷脱氨酶在hadar2-d序列中包含一个或多个突变,使得hadar2-d的编辑效率和/或底物编辑偏好根据特定需要而改变。
[0230]
胞苷脱氨酶
[0231]
在一些实施方式中,脱氨酶是胞苷脱氨酶。如本文所用,术语“胞苷脱氨酶”或“胞苷脱氨酶蛋白”是指蛋白质、多肽或者蛋白质或多肽的一个或多个功能结构域,其能够催化将胞嘧啶(或分子的胞嘧啶部分)转化为尿嘧啶(或分子的尿嘧啶部分)的水解脱氨基反应,如下所示。在一些实施方式中,含胞嘧啶的分子是胞苷(c),并且含尿嘧啶的分子是尿苷(u)。所述含胞嘧啶的分子可以是脱氧核糖核酸(dna)或核糖核酸(rna)。
[0232]
根据本公开,可与本公开结合使用的胞苷脱氨酶包括但不限于被称为载脂蛋白b mrna编辑复合物(apobec)家族脱氨酶的酶家族的成员,激活诱导的脱氨酶(aid),或胞苷脱氨酶1(cda1)。在特定的实施方式中,apobec1脱氨酶、apobec2脱氨酶、apobec3a脱氨酶、apobec3b脱氨酶、apobec3c脱氨酶和apobec3d脱氨酶、apobec3e脱氨酶、apobec3f脱氨酶、apobec3g脱氨酶、apobec3h脱氨酶或apobec4脱氨酶中的脱氨酶。
[0233]
在本发明的方法和系统中,胞苷脱氨酶能够靶向dna单链中的胞嘧啶。在某些示例实施方式中,胞苷脱氨酶可在存在于结合组分外部的单链上进行编辑,例如结合cas13。在其他示例实施方式中,胞苷脱氨酶可在局部化泡,例如由靶标编辑位点处但指导序列错配形成的局部化泡处编辑。在某些示例实施方式中,胞苷脱氨酶可包含有助于聚焦活性的突变,例如kim等人,nature biotechnology(2017)35(4):371-377(doi:10.1038/nbt.3803中所述的那些。
[0234]
在一些实施方式中,胞苷脱氨酶源自一种或多种后生动物物种,包括但不限于哺乳动物、鸟类、青蛙、鱿鱼、鱼、蝇和蠕虫。在一些实施方式中,胞苷脱氨酶是人类、灵长类、牛、狗、大鼠或小鼠胞苷脱氨酶。
[0235]
在一些实施方式中,胞苷脱氨酶是人类apobec,包括hapobec1或hapobec3。在一些实施方式中,胞苷脱氨酶是人类aid。
[0236]
在一些实施方式中,胞苷脱氨酶蛋白识别rna双链体的单链泡中的一个或多个靶胞嘧啶残基并将其转化为尿嘧啶残基。在一些实施方式中,胞苷脱氨酶蛋白识别rna双链体的单链泡上的结合窗口。在一些实施方式中,结合窗口包含至少一个靶胞嘧啶残基。在一些实施方式中,结合窗口在约3bp至约100bp的范围内。在一些实施方式中,结合窗口在约5bp至约50bp的范围内。在一些实施方式中,结合窗口在约10bp至约30bp的范围内。在一些实施方式中,结合窗口为约1bp、2bp、3bp、5bp、7bp、10bp、15bp、20bp、25bp、30bp、40bp、45bp、50bp、55bp、60bp、65bp、70bp、75bp、80bp、85bp、90bp、95bp或100bp。
[0237]
在一些实施方式中,胞苷脱氨酶蛋白包含一个或多个脱氨酶结构域。不希望受理论的束缚,预期脱氨酶结构域用于识别rna双链体的单链泡中所含的一个或多个靶胞嘧啶(c)残基并将其转化为尿嘧啶(u)残基。在一些实施方式中,脱氨酶结构域包含活性中心。在一些实施方式中,活性中心包含锌离子。在一些实施方式中,在活性中心内或附近的氨基酸残基与靶胞嘧啶残基的5'的一个或多个核苷酸相互作用。在一些实施方式中,在活性中心内或附近的氨基酸残基与靶胞嘧啶残基的3'的一个或多个核苷酸相互作用。
[0238]
在一些实施方式中,胞苷脱氨酶包含人类apobec1全蛋白(hapobec1)或其脱氨酶结构域(hapobec1-d)或其c末端截短形式(hapobec-t)。在一些实施方式中,胞苷脱氨酶是与hapobec1、hapobec-d或hapobec-t同源的apobec家族成员。在一些实施方式中,胞苷脱氨酶包含人类aid1全蛋白(haid)或其脱氨酶结构域(haid-d)或其c末端截短形式(haid-t)。
在一些实施方式中,胞苷脱氨酶是与haid、haid-d或haid-t同源的aid家族成员。在一些实施方式中,haid-t是c末端截短约20个氨基酸的haid。
[0239]
在一些实施方式中,胞苷脱氨酶包含胞嘧啶脱氨酶的野生型氨基酸序列。在一些实施方式中,胞苷脱氨酶在胞嘧啶脱氨酶序列中包含一个或多个突变,使得胞嘧啶脱氨酶的编辑效率和/或底物编辑偏好根据特定需要而改变。
[0240]
本文中,“缔合”取其最广泛的含义,涵盖两个功能模块直接或间接(通过接头)形成融合蛋白的情形,也涵盖两个功能模块各自独立,通过共价键(例如二硫键等)或非共价键键合在一起的情形。
[0241]
术语“载体”是指能够转运与其连接的另一核酸的核酸分子。它是复制子,例如质粒、噬菌体或粘粒,可在其中插入另一个dna区段以实现所插入区段的复制。通常,当与适当的控制元件结合时,载体能够复制。
[0242]
在某些情况下,载体系统包含单个载体。或者,载体系统包含多个载体。载体可以是病毒载体。
[0243]
载体包括但不限于单链、双链或部分双链的核酸分子;包含一个或多个自由端、无自由端(例如环状)的核酸分子;包含dna、rna或两者的核酸分子;和本领域已知的其他多核苷酸变体。载体的一种类型是“质粒”,其是指环状双链dna环,例如通过标准分子克隆技术,可以在其中插入其他dna区段。另一种类型的载体是病毒载体,其中载体中存在病毒来源的dna或rna序列,用于包装成病毒(例如逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒和腺相关病毒)。病毒载体还包括病毒携带的用于转染到宿主细胞中的多核苷酸。某些载体能够在引入它们的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和游离型哺乳动物载体)。在引入宿主细胞中后,将其他载体(例如,非游离型哺乳动物载体)整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与其可操作连接的基因的表达。此类载体在本文中称为“表达载体”。在真核细胞中表达的载体和导致在真核细胞中表达的载体在本文中可称为“真核表达载体”。在重组dna技术中有用的常见表达载体通常是质粒的形式。
[0244]
重组表达载体可以适合在宿主细胞中表达核酸的形式包含本发明的核酸,这意味着重组表达载体包含一个或多个调控元件,所述调控元件可根据待用于表达的宿主细胞进行选择,所述核酸可操作地连接至待表达的核酸序列。在重组表达载体内,“可操作地连接”旨在是指目标核苷酸序列以允许核苷酸序列表达的方式(例如,在体外转录/翻译系统中或者当载体被引入宿主细胞中时在宿主细胞中)连接至调控元件。有利的载体包括慢病毒和腺相关病毒,并且也可选择这些载体的类型以靶向特定类型的细胞。
[0245]
术语“调控元件”旨在包括启动子、增强子、内部核糖体进入位点(ires)和其他表达控制元件(例如,转录终止信号,例如聚腺苷酸化信号和poly-u序列)。此类调控元件描述于例如goeddel,gene expression technology:methods in enzymology 185,academic press,san diego,calif.(1990)中。调控元件包括在许多类型的宿主细胞中引导核苷酸序列组成性表达的那些和仅在某些宿主细胞中引导核苷酸序列表达的那些(例如组织特异性调控序列)。组织特异性启动子可引导主要在目标所需组织例如肌肉、神经元、骨骼、皮肤、血液、特定器官(例如肝、胰腺)或特定细胞类型(例如淋巴细胞)中表达。调控元件也可以时间依赖性的方式引导表达,例如以细胞周期依赖性或发育阶段依赖性的方式引导表达,其
也可以是或可以不是组织或细胞类型特异性的。
[0246]
在一些实施方式中,载体编码cas12i蛋白,所述cas12i蛋白包含一个或多个核定位序列(nls),例如约或大于约1、2、3、4、5、6、7、8、9、10个或更多个nls。更特别地,载体包含一个或多个天然不存在于cas12i蛋白中的nls。最特别地,nls存在于cas12i蛋白序列的载体5’和/或3’中。在一些实施方式中,靶向rna的蛋白在氨基末端处或其附近包含约或大于约1、2、3、4、5、6、7、8、9、10个或更多个nls,在羧基末端处或其附近包含约或大于约1、2、3、4、5、6、7、8、9、10个或更多个nls,或这些的组合(例如,在氨基末端处的0个或至少一个或多个nls和在羧基末端处的0个或一个或多个nls)。当存在一个以上的nls时,各自可彼此独立地进行选择,使得单个nls可存在于一个以上的拷贝中和/或与一个或多个其他nls组合存在于一个或多个拷贝中。在一些实施方式中,当nls的最接近的氨基酸从n末端或c末端沿着多肽链在约1、2、3、4、5、10、15、20、25、30、40、50个或更多个氨基酸内时,认为nls接近n末端或c末端。
[0247]“密码子优化”是指通过用宿主细胞的基因中更频繁或最频繁使用的密码子代替天然序列的至少一个密码子(例如,约或大于约1、2、3、4、5、10、15、20、25、50个或更多个密码子)并同时保持天然氨基酸序列而在目标宿主细胞中修饰核酸序列以增强表达的方法。各种物种对特定氨基酸的某些密码子表现出特定的偏性。密码子偏性(生物体之间密码子使用的差异)通常与信使rna(mrna)的翻译效率相关,而信使rna(mrna)的翻译效率又被认为尤其取决于所翻译的密码子的特性和特定转移rna(trna)分子的可用性。所选trna在细胞中的优势通常反映了肽合成中最常使用的密码子。因此,可基于密码子优化来定制基因以在给定生物中最佳基因表达。密码子使用表很容易获得,例如,可在www.kazusa.orjp/codon/的“密码子使用数据库”中获得,并且这些表格可通过多种方式进行修改。参见nakamura,y.等人,“codon usage tabulated from the international dna sequence databases:status for the year 2000”nucl.acids res.28:292(2000)。也可获得用于密码子优化特定序列以在特定宿主细胞中表达的计算机算法,例如gene forge(aptagen;jacobus,pa)。在一些实施方式中,编码靶向dna/rna的cas蛋白的序列中的一个或多个密码子(例如1、2、3、4、5、10、15、20、25、50个或更多个或所有密码子)对应于特定氨基酸最常用的密码子。关于酵母中的密码子使用,参考可在www.yeastgenome.org/community/codon_usage.shtml获得的在线酵母基因组数据库,或codon selection in yeast,bennetzen和hall,j biol chem.1982年3月25日;257(6):3026-31。关于在包括藻类的植物中的密码子使用,参考codon usage in higher plants,green algae,and cyanobacteria,campbell和gowri,plant physiol.1990年1月;92(1):1-11.;以及codon usage in plant genes,murray等人,nucleic acids res.1989年1月25日;17(2):477-98;或selection on the codon bias of chloroplast and cyanelle genes in different plant and algal lineages,morton br,j mol evol.1998年4月;46(4):449-59。
[0248]
递送系统
[0249]
在一些实施方式中,crispr-cas系统的组分可以各种形式递送,例如dna/rna或rna/rna或蛋白质rna的组合。例如,cas12i蛋白可作为编码dna的多核苷酸或编码rna的多核苷酸或作为蛋白质被递送。所述指导物可作为dna编码多核苷酸或rna被递送。设想了所有可能的组合,包括混合的递送形式。
[0250]
在一些方面,本发明提供了包括将一个或多个多核苷酸例如如本文所述的一个或多个载体、其一个或多个转录物和/或从其转录的一个或多个蛋白质递送至宿主细胞的方法。
[0251]
在一些实施方式中,将驱动核酸靶向系统的一个或多个元件表达的一个或多个载体引入宿主细胞,使得核酸靶向系统的元件的表达引导核酸靶向复合物在一个或多个靶位点的形成。例如,核酸靶向效应酶和核酸靶向指导rna可各自可操作地连接至分开的载体上的分开的调控元件。可将核酸靶向系统的rna递送至转基因核酸靶向效应蛋白动物或哺乳动物,例如,组成性或诱导性或条件性表达核酸靶向效应蛋白的动物或哺乳动物;或以其他方式表达核酸靶向效应蛋白或者具有含有核酸靶向效应蛋白的细胞的动物或哺乳动物,例如通过事先向其施用编码并表达体内核酸靶向效应蛋白的一个或多个载体。或者,可将由相同或不同调控元件表达的两个或更多个元件组合在单个载体中,而一个或多个额外载体提供不包含在第一载体中的核酸靶向系统的任何组分。组合在单个载体中的核酸靶向系统元件可以任何合适的方向排列,例如一个元件位于相对于第二元件的(“上游”)5'或相对于第二元件的(“下游”)3'。一个元件的编码序列可位于第二元件的编码序列的相同或相反链上,并以相同或相反的方向定向。在一些实施方式中,单个启动子驱动编码核酸靶向效应蛋白和核酸靶向指导rna的转录物的表达,所述转录物嵌入一个或多个内含子序列内(例如,各自在不同的内含子中,两个或更多个在至少一个内含子中,或全部在单个内含子中)。在一些实施方式中,核酸靶向效应蛋白和核酸靶向指导rna可以可操作地连接至同一启动子并从同一启动子表达。用于表达核酸靶向系统的一个或多个元件的递送媒介物、载体、粒子、纳米粒子、制剂及其组分如前述文件例如wo 2014/093622(pct/us2013/074667)中所使用。在一些实施方式中,载体包含一个或多个插入位点,例如限制性核酸内切酶识别序列(也称为“克隆位点”)。在一些实施方式中,一个或多个插入位点(例如,约或大于约1、2、3、4、5、6、7、8、9、10个或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。当使用多个不同的指导序列时,单个表达构建体可用于将核酸靶向活性靶向细胞内的多个不同的相应靶序列。例如,单个载体可包含约或大于约1、2、3、4、5、6、7、8、9、10、15、20个或更多个指导序列。在一些实施方式中,可提供约或大于约1、2、3、4、5、6、7、8、9、10个或更多个这样的含指导序列的载体,并任选地递送至细胞。在一些实施方式中,载体包含与编码核酸靶向效应蛋白的酶编码序列可操作地连接的调控元件。核酸靶向效应蛋白或者一种或多种核酸靶向指导rna可分开递送;并且有利地,这些中的至少一种经由粒子复合物递送。可在核酸靶向指导rna之前递送核酸靶向效应蛋白mrna,以留出时间表达核酸靶向效应蛋白。核酸靶向效应蛋白mrna可在施用核酸靶向指导rna之前1-12小时(优选约2-6小时)施用。或者,核酸靶向效应蛋白mrna和核酸靶向指导rna可一起施用。有利地,可在初次施用核酸靶向效应蛋白mrna+指导rna后1-12小时(优选约2-6小时)施用指导rna的第二加强剂量。核酸靶向效应蛋白mrna和/或指导rna的其他施用可能对实现最有效的基因组修饰水平有用。
[0252]
常规的基于病毒和非病毒的基因转移方法可用于将核酸引入哺乳动物细胞或靶组织中。此类方法可用于向培养中或宿主生物体中的细胞施用编码核酸靶向系统组分的核酸。非病毒载体递送系统包含dna质粒,rna(例如本文所述的载体的转录物),裸核酸和与例如脂质体的递送媒介物复合的核酸。病毒载体传递系统包含dna和rna病毒,它们在递送至
细胞后具有游离或整合的基因组。关于基因治疗程序的综述,参见anderson,science 256:808-813(1992);nabel和felgner,tibtech 11:211-217(1993);mitani和caskey,tibtech 11:162-166(1993);dillon,tibtech 11:167-175(1993);miller,nature 357:455-460(1992);van brunt,biotechnology 6(10):1149-1154(1988);vigne,restorative neurology and neuroscience 8:35-36(1995);kremer和perricaudet,british medical bulletin 51(1):31-44(1995);haddada等人,current topics in microbiology and immunology,doerfler和(编)(1995);以及yu等人,gene therapy 1:13-26(1994)。
[0253]
核酸的非病毒递送方法包括脂质转染、核转染、显微注射、生物弹射(biolistics)、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸缀合物、裸dna、人工病毒体和试剂增强的dna摄取。脂质转染描述于例如美国专利第5,049,386号、第4,946,787号;和第4,897,355号中并且脂质转染试剂在商业上出售(例如transfectam
tm
和lipofectin
tm
)。适用于多核苷酸的有效受体识别脂质转染的阳离子脂质和中性脂质包括felgner,wo 91/17424;wo 91/16024的那些。可递送至细胞(例如体外或离体施用)或靶组织(例如体内施用)。
[0254]
质粒递送涉及将指导rna克隆到表达crispr-cas蛋白的质粒中,并在细胞培养物中转染dna。质粒骨架可商购获得并且不需要特定的设备。它们具有模块化的优势,能够携带不同大小的crispr-cas编码序列(包括编码更大尺寸蛋白质的序列)以及选择标志物。同时,质粒的优点在于它们可确保瞬时但持续的表达。然而,质粒的递送并不是直接的,使得体内效率通常很低。持续表达也可能是不利的,因为它可增加脱靶编辑。另外,crispr-cas蛋白的过量积累可能对细胞有毒。最后,质粒始终具有dsdna在宿主基因组中随机整合的风险,更特别是考虑到产生双链断裂(在靶和脱靶)的风险。
[0255]
脂质:核酸复合物(包括靶向脂质体,例如免疫脂质复合物)的制备是本领域技术人员众所周知的(参见例如crystal,science 270:404-410(1995);blaese等人,cancer gene ther.2:291-297(1995);behr等人,bioconjugate chem.5:382-389(1994);remy等人,bioconjugate chem.5:647-654(1994);gao等人,gene therapy 2:710-722(1995);ahmad等人,cancer res.52:4817-4820(1992);美国专利第4,186,183号、第4,217,344号、第4,235,871号、第4,261,975号、第4,485,054号、第4,501,728号、第4,774,085号、第4,837,028号和第4,946,787号)。这将在下面更详细地讨论。
[0256]
使用基于rna或dna病毒的系统来递送核酸利用了将病毒靶向体内的特定细胞并将病毒有效载荷运输至细胞核的高度进化的过程。病毒载体可直接施用于患者(体内),或者它们可用于体外治疗细胞,并且修饰的细胞可任选地施用于患者(离体)。常规的基于病毒的系统可包括逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒载体,用于基因转移。用逆转录病毒、慢病毒和腺相关病毒基因转移方法可整合到宿主基因组中,这通常会导致插入的转基因的长期表达。另外,已在许多不同的细胞类型和靶组织中观察到高转导效率。
[0257]
逆转录病毒的嗜性可通过并入外来包膜蛋白,扩大靶细胞的潜在靶标群体来改变。慢病毒载体是能够转导或感染非分裂细胞并通常产生高病毒滴度的逆转录病毒载体。因此,逆转录病毒基因转移系统的选择将取决于靶组织。逆转录病毒载体由顺式作用的长末端重复序列组成,其包装能力高达6-10kb的外来序列。最小的顺式作用ltr足以复制和包
装载体,然后将其用于将治疗性基因整合到靶细胞中以提供永久性转基因表达。广泛使用的逆转录病毒载体包括基于鼠类白血病病毒(mulv)、长臂猿白血病病毒(galv)、猿猴免疫缺陷病毒(siv)、人免疫缺陷病毒(hiv)及其组合的载体(参见例如buchscher等人,j.virol.66:2731-2739(1992);johann等人,j.virol.66:1635-1640(1992);sommnerfelt等人,virol.176:58-59(1990);wilson等人,j.virol.63:2374-2378(1989);miller等人,j.virol.65:2220-2224(1991);pct/us94/05700)。
[0258]
在优选瞬时表达的应用中,可使用基于腺病毒的系统。基于腺病毒的载体在许多细胞类型中都能够实现很高的转导效率并且不需要细胞分裂。利用这样的载体,已经获得了高滴度和表达水平。该载体可在相对简单的系统中大量产生。腺相关病毒(“aav”)载体也可用于用靶核酸转导细胞,例如,在核酸和肽的体外生产中,以及用于体内和离体基因治疗程序(参见例如west等人,virology 160:38-47(1987);美国专利第4,797,368号;wo 93/24641;kotin,human gene therapy 5:793-801(1994);muzyczka,j.clin.invest.94:1351(1994))。重组aav载体的构建描述于许多出版物,包括美国专利第5,173,414号;tratschin等人,mol.cell.biol.5:3251-3260(1985);tratschin等人,mol.cell.biol.4:2072-2081(1984);hermonat和muzyczka,pnas 81:6466-6470(1984);以及samulski等人,j.virol.63:03822-3828(1989)。
[0259]
本发明提供了aav,其包含以下或基本上由以下组成:编码crispr系统的外源核酸分子,例如,多个包含第一盒或由第一盒组成的盒,所述第一盒包含以下或基本上由以下组成:启动子,编码crispr相关(cas)蛋白(假定核酸酶或解旋酶蛋白)的核酸分子,例如,cas12i和终止子,以及一个或多个,有利地多达载体的包装大小极限,例如,总共五个盒(包括第一盒),所述盒包含以下或基本上由以下组成:启动子,编码指导rna(grna)的核酸分子和终止子(例如,每个盒示意性表示为启动子-grna1-终止子,启动子-grna2-终止子...启动子-grna(n)-终止子,其中n是可插入的载体的包装大小极限的上限的数目),或两个或更多个单独的raav,每个raav含有一个或多于一个crispr系统的盒,例如,第一raav,其含有第一盒,所述第一盒包含以下或基本上由以下组成:启动子,编码cas的核酸分子,例如cas(cas12i)和终止子,和第二raav,其含有一个或多个盒,每个盒包含以下或基本上由以下组成:启动子,编码指导rna(grna)的核酸分子和终止子(例如,每个盒示意性表示为启动子-grna1-终止子,启动子-grna2-终止子...启动子-grna(n)-终止子,其中n是可插入的载体的包装大小极限的上限的数目)。或者,由于cas12i可处理其自身的crrna/grna,因此单个crrna/grna阵列可用于多重基因编辑。因此,并非包含多个盒来递送grna,raav可含有单个盒,所述盒包含以下或基本上由以下组成:启动子,多个crrna/grna和终止子(例如,示意性表示为启动子-grna1-grna2
…
grna(n)-终止子,其中n是可插入的载体的包装大小极限的上限的数目)。参见zetsche等人,nature biotechnology 35,31-34(2017),其通过引用整体并入本文。由于raav是dna病毒,因此本文关于aav或raav的讨论中的核酸分子有利地是dna。在一些实施方式中,启动子有利地是人突触蛋白i启动子(hsyn)。用于将核酸递送至细胞的其他方法是本领域技术人员已知的。参见例如us20030087817,其通过引用并入本文。
[0260]
在另一个实施方式中,考虑了科卡尔水疱病毒(cocal vesiculovirus)包膜假型逆转录病毒载体粒子(参见例如转让给fred hutchinson cancer research center的美国专利公开第20120164118号)。科卡尔病毒属于水疱病毒属,并且是哺乳动物中的水疱性口
炎的病原体。科卡尔病毒最初是从特立尼达的螨虫中分离出来的(jonkers等人,am.j.vet.res.25:236-242(1964)),并且已经在特立尼达、巴西和阿根廷从昆虫、牛和马中鉴定出感染。已经从自然感染的节肢动物中分离出许多使哺乳动物感染的水疱病毒,这表明它们是媒介传播的。在地方性和实验室获得病毒的农村地区,人们普遍获得水疱病毒抗体;人类感染通常会导致类似流感的症状。科卡尔病毒包膜糖蛋白在氨基酸水平上与vsv-g indiana共有71.5%的同一性,并且水疱病毒包膜基因的系统发育比较显示,科卡尔病毒与水疱病毒中的vsv-g indiana菌株在血清学上有所区别,但最密切相关。jonkers等人,am.j.vet.res.25:236-242(1964)和travassos da rosa等人,am.j.tropical med.&hygiene 33:999-1006(1984)。科卡尔水疱病毒包膜假型逆转录病毒载体粒子可包括例如慢病毒、α逆转录病毒、β逆转录病毒、γ逆转录病毒、δ逆转录病毒和ε逆转录病毒载体粒子,其可包含逆转录病毒gag、pol和/或一种或多种辅助蛋白和科卡尔水疱病毒包膜蛋白。在这些实施方式的某些方面,gag、pol和辅助蛋白是慢病毒和/或γ逆转录病毒。
[0261]
在一些实施方式中,用本文所述的一个或多个载体瞬时或非瞬时转染宿主细胞。在一些实施方式中,当细胞天然存在于受试者中时,将细胞转染,任选地将其重新引入其中。在一些实施方式中,转染的细胞取自受试者。在一些实施方式中,细胞是源自取自受试者的细胞,例如细胞系。用于组织培养的广泛多种细胞系是本领域已知的。细胞系的实例包括但不限于c8161、ccrf-cem、molt、mimcd-3、nhdf、hela-s3、huh1、huh4、huh7、huvec、hasmc、hekn、heka、miapacell、panc1、pc-3、tf1、ctll-2、c1r、rat6、cv1、rpte、a10、t24、j82、a375、arh-77、calu1、sw480、sw620、skov3、sk-ut、caco2、p388d1、sem-k2、wehi-231、hb56、tib55、jurkat、j45.01、lrmb、bcl-1、bc-3、ic21、dld2、raw264.7、nrk、nrk-52e、mrc5、mef、hep g2、hela b、hela t4、cos、cos-1、cos-6、cos-m6a、bs-c-1猴肾上皮、balb/3t3小鼠胚胎成纤维细胞、3t3 swiss、3t3-l1、132-d5人胎儿成纤维细胞;10.1小鼠成纤维细胞、293-t、3t3、721、9l、a2780、a2780adr、a2780cis、a172、a20、a253、a431、a-549、alc、b16、b35、bcp-1细胞、beas-2b、bend.3、bhk-21、br 293、bxpc3、c3h-10t1/2、c6/36、cal-27、cho、cho-7、cho-ir、cho-k1、cho-k2、cho-t、cho dhfr-/-、cor-l23、cor-l23/cpr、cor-l23/5010、cor-l23/r23、cos-7、cov-434、cml t1、cmt、ct26、d17、dh82、du145、ducap、el4、em2、em3、emt6/ar1、emt6/ar10.0、fm3、h1299、h69、hb54、hb55、hca2、hek-293、hela、hepa1c1c7、hl-60、hmec、ht-29、jurkat、jy细胞、k562细胞、ku812、kcl22、kg1、kyo1、lncap、ma-mel 1-48、mc-38、mcf-7、mcf-10a、mda-mb-231、mda-mb-468、mda-mb-435、mdck ii、mdck ii、mor/0.2r、mono-mac 6、mtd-1a、myend、nci-h69/cpr、nci-h69/lx10、nci-h69/lx20、nci-h69/lx4、nih-3t3、nalm-1、nw-145、opcn/opct细胞系、peer、pnt-1a/pnt 2、renca、rin-5f、rma/rmas、saos-2细胞、sf-9、skbr3、t2、t-47d、t84、thp1细胞系、u373、u87、u937、vcap、vero细胞、wm39、wt-49、x63、yac-1、yar及其转基因品种。细胞系可从本领域技术人员已知的多种来源获得(参见例如美国典型培养物保藏中心(atcc)(manassus,va.))。
[0262]
在特定的实施方式中,ad官能化的crispr系统的一种或多种组分的瞬时表达和/或存在可以是令人感兴趣的,例如以降低脱靶效应。在一些实施方式中,用本文所述的一个或多个载体转染的细胞用于建立包含一个或多个载体衍生序列的新细胞系。在一些实施方式中,用如本文所述的ad官能化的crispr系统的组分瞬时转染(例如通过一个或多个载体的瞬时转染,或用rna转染)并通过crispr复合物的活性进行修饰的细胞用于建立新细胞
系,所述新细胞系包含含有修饰但缺乏任何其他外源序列的细胞。在一些实施方式中,用本文所述的一个或多个载体瞬时或非瞬时转染的细胞,或衍生自此类细胞的细胞系用于评估一种或多种测试化合物。
[0263]
在一些实施方式中,设想将rna和/或蛋白质直接引入宿主细胞。例如,可将crispr-cas蛋白作为编码mrna与体外转录的指导rna一起递送。此类方法可减少确保crispr-cas蛋白作用的时间,并进一步防止crispr系统组分的长期表达。
[0264]
在一些实施方式中,本发明的rna分子以脂质体或lipofectin制剂等形式递送,并且可通过本领域技术人员众所周知的方法来制备。这类方法描述于例如美国专利第5,593,972号、第5,589,466号和第5,580,859号,所述专利通过引用并入本文。已经开发了专门针对增强和改善sirna进入哺乳动物细胞的递送的递送系统(参见例如shen等人,febs let.2003,539:111-114;xia等人,nat.biotech.2002,20:1006-1010;reich等人,mol.vision.2003,9:210-216;sorensen等人,j.mol.biol.2003,327:761-766;lewis等人,nat.gen.2002,32:107-108;以及simeoni等人,nar 2003,31,11:2717-2724),并且可应用于本发明。sirna最近已成功地用于抑制灵长类动物中的基因表达(参见例如tolentino等人,retina 24(4):660),其也可应用于本发明。
[0265]
实际上,rna递送是体内递送的有用方法。可使用脂质体或粒子将cas12i、腺苷脱氨酶和指导rna递送至细胞中。因此,crispr-cas蛋白(例如cas12i)的递送,腺苷脱氨酶(其可与crispr-cas蛋白或衔接子蛋白融合)的递送和/或本发明的rna的递送可为rna形式并经由微囊泡、脂质体或粒子或纳米粒子。例如,可将cas12i mrna、腺苷脱氨酶mrna和指导rna包装到脂质体粒子中以在体内递送。脂质体转染试剂,例如来自life technologies的lipofectamine和市场上的其他试剂,可有效地将rna分子递送至肝脏中。
[0266]
rna的递送方式还优选包括经由粒子(cho,s.,goldberg,m.,son,s.,xu,q.,yang,f.,mei,y.,bogatyrev,s.,langer,r.和anderson,d.,lipid-like nanoparticles for small interfering rna delivery to endothelial cells,advanced functional materials,19:3112-3118,2010)或外泌体(schroeder,a.,levins,c.,cortez,c.,langer,r.和anderson,d.,lipid-based nanotherapeutics for sirna delivery,journal of internal medicine,267:9-21,2010,pmid:20059641)递送rna。实际上,已显示外泌体在递送sirna中特别有用,它是与crispr系统有些相似的系统。例如,el-andaloussi s等人,(“exosome-mediated delivery of sirna in vitro and in vivo.”nat protoc.2012年12月;7(12):2112-26.doi:10.1038/nprot.2012.131.电子出版于2012年11月15日)描述了外泌体如何成为有前途的工具用于跨不同生物屏障的药物递送,并且可用于体外和体内sirna的递送。他们的方法是通过转染包含与肽配体融合的外泌体蛋白的表达载体来生成靶向外泌体。然后将外泌体纯化并从转染的细胞上清液中表征,然后将rna装载到外泌体中。根据本发明的递送或施用可用外泌体进行,特别是但不限于大脑。维生素e(α-生育酚)可与crispr cas缀合并与高密度脂蛋白(hdl)一起递送至大脑,例如,采用与uno等人(human gene therapy 22:711-719(2011年6月))类似的方式,用于向大脑递送短干扰rna(sirna)。经由充满磷酸盐缓冲盐水(pbs)或游离tocsibace或toc-sibace/hdl并与脑输注试剂盒3(alzet)连接的osmotic微型泵(型号1007d;alzet,cupertino,ca)向小鼠输注。将脑输注套管放置在前囟后面约0.5mm的中线处,以输注到第三脑室背侧。uno等人发现,通过
相同的icv输注方法,低至3nmol的含hdl的toc-sirna可以相当程度诱导靶标减少。在本发明中,对于人类,可考虑缀合至α-生育酚并与靶向脑的hdl共同施用的相似剂量的crispr cas,例如,可考虑约3nmol至约3μmol的靶向脑的crispr cas。zou等人((human gene therapy 22:465-475(2011年4月))描述了一种慢病毒介导的靶向pkcγ的短发夹rna的递送方法,以在大鼠的脊髓中进行体内基因沉默。zou等人通过鞘内导管施用了约10μl的重组慢病毒,滴度为1
×
109转导单位(tu)/ml。在本发明中,人类可考虑在靶向脑的慢病毒载体中表达的相似剂量的crispr cas,例如,可考虑在滴度为1
×
109转导单位(tu)/ml的慢病毒中约10-50ml的靶向脑的crispr cas。
[0267]
对于本领域技术人员而言将显而易见的是,本文所述的本发明方法的其他适宜的修改和改变是显而易见的,并且在不脱离本发明或本文所公开的实施方式的范围的前提下,可以使用适宜的等同物来进行。
[0268]
实施例
[0269]
在下文中,将通过实施例详细描述本发明。然而,在此提供的实施例仅用于说明目的,并不用于限制本发明。
[0270]
下述实施例所用的实验方法如无特殊说明,均为常规方法。
[0271]
下述实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0272]
实施例1:新型cas12i蛋白的识别
[0273]
下载joint genome institute(jgi)的宏基因组数据库(https://jgi.doe.gov/),总共得到了16tb的高质量数据。用tblastn(https://blast.ncbi.nlm.nih.gov/)对超过6,000份宏基因组数据进行本地比对。在其中在4组来源不同的样品中找到了10个新的cas12i蛋白,根据样品来源地不同(新加坡,威斯康辛,旧金山,华盛顿)将其分别命名为sicas12i,si2cas12i,wicas12i,wi2cas12i,wi3cas12i,sacas12i,sa2cas12i,sa3cas12i,wacas12i和wa2cas12i。sicas12i比spcas9和lbcas12a分别小287和193个氨基酸。
[0274]
sicas12i,si2cas12i,wicas12i,wi2cas12i,wi3cas12i,sacas12i,sa2cas12i,sa3cas12i,wacas12i和wa2cas12i的氨基酸序列分别为seq id no:1-10,核苷酸编码序列分别为seq id no:11-20。用pilercr对4份含有cas12i的样品进行crispr座的注释,获得了cas12i相对应的dr序列,分别为seq id no:21-30。
[0275]
实施例2:利用荧光报告系统比较cas12i与三种对照spcas9,lbcas12a、cas12i.3的切割活性
[0276]
为了灵敏地检测crispr/cas系统的切割活性,构建了转录bfp-p2a-gfxfp mrna的报告载体(bfp-p2a-gfxfp报告载体,seq id no:31,图1)。bfp表达蓝色荧光蛋白的编码序列,通过蓝色荧光指示报告载体成功转染宿主细胞。gfxfp中gf和fp序列分别是编码绿色荧光蛋白基因egfp的n端的561nt序列和c端的609nt序列,这两段序列共有450nt的重叠。gfxfp中间为插入片段(seq id no:32),其中含有crispr/cas系统靶向的靶序列(seq id no:33)。
[0277]
目前大部分已知的cas12蛋白识别双链dna的5
’‑
t富集pam,而cas9识别双链dna的3
’‑
g富集pam。为了同时能对spcas9(seq id no:34),lbcas12a(seq id no:35),cas12i.3(seq id no:36)和如上所述的10个cas12i进行切割活性比较,在靶序列的外部5’端设计了
序列为ttc的pam,且在靶序列的外部3’端设计了序列为ggg的pam。靶序列外部两端带有5
’‑
ttc和3
’‑
ggg的pam结构域,使其同时适用于crispr/cas12系统和crispr/cas9系统。
[0278]
靶序列中间有一个tag提前终止子,当它被切割时,gfxfp利用重组机制产生正确的gfp编码框,表达gfp,使细胞由无绿色荧光变为有绿色荧光(图2)。
[0279]
对10个新的cas12i蛋白的核苷酸编码序列进行了哺乳动物密码子优化,分别为seq id no:37-46,将其构建在表达mcherry红色荧光蛋白的表达载体上,并用cag启动子驱动cas表达,通过红色荧光指示表达载体成功转染宿主细胞。
[0280]
分别设计cas12i蛋白各自的靶向bfp-p2a-gfxfp靶序列的crrna(seq id no:47-56),含有dr+spacer结构,其中spacer长度为20nt,并将其和用于驱动crrna转录的u6启动子一起构建在bfp-p2a-gfxfp报告载体上,通过蓝色荧光指示报告载体成功转染宿主细胞。
[0281]
类似地,将spcas9(seq id no:57),lbcas12a(seq id no:58)和cas12i.3(seq id no:59)的哺乳动物密码子优化的核苷酸编码序列插入表达mcherry红色荧光蛋白的表达载体中,用cag启动子驱动cas表达,通过红色荧光指示表达载体成功转染宿主细胞。类似地,构建相应的转录各自crrna/sgrna(seq id no:60-62)和bfp-p2a-gfxfp mrna的报告载体,通过蓝色荧光指示报告载体成功转染宿主细胞。
[0282]
用pei转染法分别将表达cas12i/lbcas12a/spcas9的表达载体(红色荧光)和转录bfp-p2a-gfxfp mrna和crrna/sgrna的报告载体(蓝色荧光)共同转入到hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到转染双阳性(红色和蓝色荧光两者)的细胞。
[0283]
通过分析,发现sicas12i,si2cas12i,wicas12i和sacas12i具有显著的切割活性(通过绿色荧光强度表征),其中sicas12i具有最高的切割活性(最高绿色荧光强度),甚至显著强于spcas9,lbcas12a和cas12i.3(图3)。
[0284]
实施例3:sicas12i的pam识别和有效靶序列长度的测试
[0285]
为了测试sicas12i的pam识别,分别设计了具有5
’‑
ttn或5
’‑
ntn(其中n为a、t、g或c)的靶序列(seq id no:33),并将其插入前述bfp-p2a-gfxfp报告载体。报告载体上还带有sicas12i的前述相应crrna(seq id no:47)和用于驱动crrna转录的u6启动子。
[0286]
用pei转染法分别将前述sicas12i表达载体和具有不同pam的bfp-p2a-gfxfp报告载体共同转入到hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到转染双阳性(红色和蓝色荧光两者)的细胞。通过分析,发现sicas12i在pam为5
’‑
ttn(其中n为a、t、g或c)的情况下具有高度的切割活性,在pam为5
’‑
ata或atg的情况下具有较低但仍然显著的切割活性(图4)。
[0287]
为了测试sicas12i对应的crrna上的有效spacer长度,分别设计了10到50nt的不同长度的spacer序列(表1),并将含有所述spacer序列的crrna的编码序列和用于驱动crrna转录的u6启动子一起构建在bfp-p2a-gfxfp报告载体上。20-nt长度的spacer即为前述seq id no:33本身。短于20-nt长度的spacer是seq id no:33的截短版本。长于20-nt的spacer的超出seq id no:33的部分是gfxfp的紧邻x的c端的fp区段的核苷酸编码序列的5’部分,即从seq id no:33向3’方向连续延伸的核苷酸序列。
[0288]
用pei转染法分别将前述sicas12i表达载体和具有不同pam的bfp-p2a-gfxfp报告载体共同转入到hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到转染双阳性(红色和蓝色荧光两者)的细胞。发现当spacer长度大于15nt时,sicas12i在细胞内具有高
效的切割活性(图5)。
[0289] 间隔序列/靶序列10-ntccattacagt12-ntccattacagtag14-ntccattacagtagga15-ntccattacagtaggag16-ntccattacagtaggagc17-ntccattacagtaggagca18-ntccattacagtaggagcat19-ntccattacagtaggagcata20-ntccattacagtaggagcatac(seq id no:33)21-ntccattacagtaggagcatacg22-ntccattacagtaggagcatacga23-ntccattacagtaggagcatacgaa24-ntccattacagtaggagcatacgaag26-ntccattacagtaggagcatacgaagct27-ntccattacagtaggagcatacgaagctt28-ntccattacagtaggagcatacgaagcttg30-ntccattacagtaggagcatacgaagcttgtg32-ntccattacagtaggagcatacgaagcttgtgag35-ntccattacagtaggagcatacgaagcttgtgagcaa40-ntccattacagtaggagcatacgaagcttgtgagcaagggcg45-ntccattacagtaggagcatacgaagcttgtgagcaagggcgaggag50-ntccattacagtaggagcatacgaagcttgtgagcaagggcgaggagctgtt
[0290]
表1:不同长度的间隔序列/靶序列
[0291]
实施例4:sicas12i在哺乳动物细胞中对ttr基因的切割
[0292]
为了测试sicas12i对内源基因的切割活性,分别对小鼠ttr基因(mttr)和人ttr基因(httr)设计了14条和6条crrna,分别包含不同的5
’‑
ttn作为pam。将crrna-mttr和crrna-httr构建在能在哺乳动物细胞中表达sicas12i蛋白的mcherry红色荧光蛋白表达载体上,即通过单一载体转录crrna且表达sicas12i蛋白,通过红色荧光指示该载体成功转染宿主细胞。用pei转染法分别将sicas12i/crrna-mttr和sicas12i/crrna-httr表达载体分别转染到小鼠n2a细胞系和人hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到mcherry红色荧光阳性的细胞。
[0293]
对转染阳性细胞的ttr基因靶位点进行pcr扩增。通过对pcr产物进行深度测序和比对分析,发现本发明的crispr-sicas12i系统在小鼠n2a细胞系的ttr基因处的切割活性最高为91.77%,而在人hek293细胞系的ttr基因处的切割活性最高为99.85%。由于在ttr基因的任意一个或多个所示靶位点处的切割均可导致ttr基因失活,所示位点任一处的最高切割活性即可认为是使作为整体的ttr基因失活的最高效率。换句话说,sicas12i可实现对小鼠ttr基因高达91.77,对人ttr基因高达99.85%的基因失活效率。
[0294] 靶序列indel总计比率(%)mttr-1ttgcctcgctggactggtatttg36,25071,55350.66mttr-2ttgtgtctgaagctggccccgcg60,83773,70882.53mttr-3ttcccttcgactcttcctccttt63,02478,41880.37mttr-4ttcctcctttgcctcgctggact39,196107,17936.57mttr-5ttgaccatcagaggacatttgga83,346120,33669.26mttr-6ttggattctccagcaccctgggc57,889315,35118.36mttr-7ttacagccacgtctacagcaggg79,919117,01568.30mttr-8ttcaaaaagacctctgagggatc89,744148,54160.42mttr-9ttgaacacttttacagccacgtc20,802136,68215.22mttr-10ttgtagaaggagtgtacagagta96,448105,09491.77mttr-11ttctcatctgtggtgagcccgtg20,54899,36820.68mttr-12ttgtagaaggagtgtacagagta26,79135,92574.57mttr-13ttctacaaacttctcatctgtgg43,757116,43037.58mttr-14tttcacagccaacgactctggcc26,290106,51024.68
[0295]
表2:sicas12i在小鼠ttr基因的不同位点处的编辑效率(前三个碱基为pam区域)
[0296] 靶序列indel总计比率(%)httr-1ttgaccatcagaggacacttgga18,383159,00511.56httr-2ttcagaaaggctgctgatgacac116,017292,24739.70httr-3ttgtagaagggatatacaaagtg647,858673,47096.20httr-4ttggcatctccccattccatgag1,085,2941,086,93199.85httr-5ttccagtaagatttggtgtctat711,892768,86192.59httr-6ttccaccacggctgtcgtcacca233,948504,80446.34
[0297]
表3:sicas12i在人类ttr基因的不同位点处的编辑效率(前三个碱基为pam区域)
[0298]
实施例5:比较sicas12i和对照spcas9,lbcas12a和cas12i.3在哺乳动物细胞的切割活性
[0299]
为了比较sicas12i和对照spcas9,lbcas12a和cas12i.3在不同内源基因位点中的切割活性。分别在人的dnmt1,ttr和pcsk9基因中选择4个同时具有5
’‑
ttn和3
’‑
ngg的pam的位点进行测试,这四个位点适用于cas12和cas9两者。分别对这四位点设计了sicas12i,spcas9,lbcas12a和cas12i.3相应的指导rna(对于cas12为crrna,对于cas9为sgrna)(seq id no:63-78)。将指导rna相应构建在能在哺乳动物细胞中表达sicas12i,spcas9,lbcas12a或cas12i.3蛋白的mcherry红色荧光蛋白表达载体上,即通过单一载体转录指导rna且表达cas蛋白,通过红色荧光指示该载体成功转染宿主细胞。用pei转染法分别将sicas12i/crrna,spcas9/sgrna,lbcas12a/crrna和cas12i.3/crrna表达载体转染到人类hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到mcherry红色荧光阳性的细胞。
[0300]
对转染阳性细胞的靶位点进行pcr扩增。通过对pcr产物进行深度测序和比对分析,发现sicas12i在三个位点具有最高的切割活性,在四个位点的切割活性均高于cas12i.3和lbcas12a(图6)。
[0301]
实施例6:比较sicas12i和对照cas12i.3在内源基因中的切割活性
[0302]
为了进一步比较sicas12i和对照cas12i.3在内源基因中的切割活性,在ttr和pcsk9基因中选择了11个具有不同5
’‑
ttn作为pam的靶序列进行测试。分别对这11个位点设计了sicas12i和cas12i.3各自的crrna。将crrna构建在能在哺乳动物细胞中表达sicas12i或cas12i.3蛋白的mcherry红色荧光蛋白表达载体上,即通过单一载体转录crrna且表达cas蛋白,通过红色荧光指示该载体成功转染宿主细胞。用pei转染法分别将sicas12i/crrna和cas12i.3/crrna表达载体转染到人hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到mcherry红色荧光阳性的细胞。
[0303]
对转染阳性细胞的靶位点进行pcr扩增。通过t7e1酶处理和凝胶电泳,发现sicas12i在所有位点处的切割活性都比cas12i.3高或者相当(图7-8)。
[0304]
ꢀꢀ
靶序列5
’‑
pamttr-1aatccaagtgtcctctgatggtttgttr-2aatgtggccgtgcatgtgttcattcttr-3tagatgctgtccgaggcagtccttcttr-4caccacggctgtcgtcaccaatttcpcsk9-1ttcctggcttcctggtgaagttcpcsk9-2ctggtgaagatgagtggcgattcpcsk9-3aagttgccccatgtcgactattgpcsk9-4cccagagcatcccgtggaacttgpcsk9-5gcccagagcatcccgtggaatttpcsk9-6cccctccacggtaccgggcgttapcsk9-7cccctccacggtaccgggcgtta
[0305]
表4:具有不同pam的人ttr和pcsk9基因靶序列
[0306]
实施例7:sicas12i在单碱基编辑(a-》i)中的应用
[0307]
为了获得失去切割活性的dsicas12i版本,构建了分别具有d700a,d650a,e875a或d1049a单点突变的dsicas12i(氨基酸序列分别为seq id no:79-82)。针对人klf4基因位点设计了20nt和23nt两种长度的spacer序列(分别为seq id no:83-84)。将具有前述spacer序列的两种crrna构建在能在哺乳动物细胞中表达四种dsicas12i的mcherry红色荧光蛋白表达载体上,即通过单一载体转录crrna且表达cas蛋白,通过红色荧光指示该载体成功转染宿主细胞。用pei转染法分别将dsicas12i/crrna表达载体转染到人hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到mcherry红色荧光阳性的细胞。
[0308]
对转染阳性细胞的klf4位点进行pcr扩增。通过测序分析发现d700a点突变导致切割活性与其野生型相比降低约84%。而d650a导致切割活性与其野生型相比降低约99%,e875a导致切割活性与其野生型相比降低约100%,d1049a点突变导致切割活性与其野生型相比降低约98%。20nt和23nt的spacer长度差异对切割活性没有显著影响(图9)。
[0309]
选择dsicas12i(d1049a)以与tada8e建立融合蛋白(seq id no:85),还用dcas12i.3分别与tada8e构建融合蛋白(seq id no:86)作为对照。这个针对人klf4基因位点设计了tada8e-dsicas12i和tada8e-dcas12i.3相应的指导rna(seq id no:87-88)。将所述指导rna分别构建在能在哺乳动物细胞中表达tada8e-dsicas12i,和tada8e-dcas12i.3
蛋白的mcherry红色荧光蛋白表达载体上,即通过单一载体转录指导rna且表达cas蛋白,通过红色荧光指示该载体成功转染宿主细胞。用pei转染法分别将tada8e-dsicas12i/crrna,和tada8e-dcas12i.3/crrna表达载体转染到人hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到mcherry红色荧光阳性的细胞。
[0310]
对转染阳性细胞的klf4位点进行pcr扩增。通过测序分析,发现tada8e-dsicas12i在哺乳动物细胞内具有超过10%的单碱基编辑活性(图10)。
[0311]
实施例8:sicas12i的dr序列对活性的影响
[0312]
为了测试sicas12i的dr序列是否可以容忍突变,分别在dr序列的不同位置设计了一系列错配或缺失。在不破坏dr二级结构(即,dr变体的二级结构与dr wt的二级结构基本上相同)的情况下,总共设计了5种不同的dr变体(dr-a、dr-b、dr-c、dr-d、dr-e;图11左侧小图),在茎环区包含5%到30%的突变。将靶序列(seq id no:33)设计在前述bfp-p2a-gfxfp报告载体上(参见实施例2),同时将五种相应的crrna的编码序列构建在该报告载体上用于驱动crrna转录的u6启动子后面(seq id no:89-94)。
[0313]
用pei转染法分别将前述sicas12i mcherry红色荧光表达载体和此处bfp-p2a-gfxfp报告载体共同转染到人hek293细胞系中。在培养48小时后,通过流式细胞仪分选得到转染双阳性(红色和蓝色荧光两者)的细胞。通过分析,发现sicas12i在不同dr变体下均具有高度的切割活性(通过绿色荧光强度表征),与wt dr相当(图11右侧小图)。可见在dr二级结构得以维持(即,dr变体的二级结构与dr wt的二级结构基本上相同)的情况下,该crispr-cas12i系统可以容忍dr上的错配或缺失而不损失切割活性,具有对dr变化的广泛适应性。
[0314]
序列
[0315]
[0316]
[0317]
[0318]
[0319]
[0320]
[0321]
[0322]
[0323]
[0324]
[0325]
[0326]
[0327]
[0328]
[0329]
[0330]
[0331]
[0332]
[0333]
[0334]
[0335]
[0336]
[0337]
[0338]
[0339]
[0340]
[0341]
[0342]
[0343]
[0344]
[0345]
[0346]
[0347]
[0348]
[0349]
[0350]
[0351]
