一种hbrca-959细胞系及其培养方法和应用
技术领域
1.本发明涉及生物技术领域,尤其涉及hbrca-959细胞系。
背景技术:
2.乳腺癌是乳腺上皮细胞在多种致癌因子的作用下,发生增殖失控的现象。疾病早期常表现为乳房肿块、乳头溢液、腋窝淋巴结肿大等症状,晚期可因癌细胞发生远处转移,出现多器官病变,直接威胁患者的生命。
3.由于乳腺癌严重危害人类健康,为了研究其发病机制和治疗方法,多以商品化的细胞系为材料。但经过长期培养,其生物学特性和遗传学易发生改变而不利于发病机制和治疗方法的研究。
4.然而,在现有技术中,对于癌症机理的研究和抑制大多采用免疫系统的相关分子标记鉴定或通用癌症标记物,如公开号为cn112898428a的中国专利提供的检测乳腺癌干细胞的组合物,包括特异性结合细胞表面cd44蛋白的第一抗体核酸偶联物、特异性结合细胞表面cd24蛋白的第二抗体核酸偶联物、dna单链t链和dna单链f链,t链与第一抗体核酸偶联物的核酸链互补结合,f链与第二抗体核酸偶联物的核酸链互补结合,共同构成程序化dna回路,擦除cd44阳cd24阳表型的乳腺癌细胞表面的信号标记,保留标记至乳腺癌干细胞的信号探针。cd24蛋白为一种黏蛋白样黏附分子,大量研究表明,cd24可见于肿瘤、炎症与自身免疫疾病,并在不同疾病发挥不同作用,因此上述专利中使用的cd24和cd44的标记物检测极有可能存在非特异性的疾病检测误差,导致二次诊断如组织切片等方向的误导问题。
5.肿瘤原代细胞培养是指从肿瘤患者体内通过手术切除肿瘤组织,获得肿瘤细胞,并在体外进行短期培养的过程。原代培养的肿瘤细胞由于组织刚刚离体,其生物学特性未发生很大变化,仍保留原遗传特性,其性状与体内相似,适用于生化分子、药物敏感性及机制探究相关实验,其数据更具有说服力。可见,人乳腺癌原代细胞的培养尤为必要。
6.本发明自临床患者的疾病组织处分离一种人乳腺癌原代细胞,并得到其特异性培养的方法,从而为后续乳腺癌诊断和药理研究提供特异性的模型。
7.此外,一方面由于对本领域技术人员的理解存在差异;另一方面由于申请人做出本发明时研究了大量文献和专利,但篇幅所限并未详细罗列所有的细节与内容,然而这绝非本发明不具备这些现有技术的特征,相反本发明已经具备现有技术的所有特征,而且申请人保留在背景技术中增加相关现有技术之权利。
技术实现要素:
8.针对现有技术之不足,本发明提供了一种细胞hbrca-959,其系以保藏编号cgmcc no.23022保藏于中国微生物菌种保藏管理委员会普通微生物中心。自临床病变组织处分离的一种人乳腺癌原代细胞,命名为人乳腺癌细胞hbrca-959,已于2021年08月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心(china general microbiological culture collection center,cgmcc),保藏地址为北京市朝阳区北辰西路1号院3号,中国
科学院微生物研究所,邮政编码为100101,保藏编号为cgmcc no.23022。
9.本发明提供一种培养基。该培养基为用于培养人乳腺癌原代细胞的无血清培养基。培养基包括:添加物、抑制微生物生长的抗生素和df培养基,其中,添加物包括细胞生长诱导素、细胞生长营养素和atp竞争性抑制剂。
10.根据一种优选实施方式,用于培养人乳腺癌原代细胞的培养基包括:添加物、抗生素和df培养基。其中,添加物包括谷氨酰胺、胰岛素、转铁蛋白、亚硒酸钠、表皮生长因子、牛血清白蛋白bsa、y-27632和wnt 3a。抗生素包括青霉素、硫酸卡那霉素、两性霉素b、头孢美唑、万古霉素等抑制微生物生长的抗生素。
11.详细地,y-27632是一种atp竞争性的rock-i和rock-ii抑制剂。
12.优选地,用于培养人乳腺癌原代细胞的培养基包括:1-10mm谷氨酰胺、3-50mg/l胰岛素、3-30mg/l转铁蛋白、5-50μg/l亚硒酸钠、5-50μg/legf、1-5mg/ml bsa、5-20μm y-27632、50~500ng/ml wnt 3a、0-2000μg/ml青霉素、0-3000μg/ml硫酸卡那霉素、0-10μg/ml两性霉素b、0-500μg/ml头孢美唑、0-50μg/ml万古霉素。
13.根据一种优选实施方式,由于细胞hbrca-959来源于人乳腺癌组织中,并具有乳腺癌的形态特征和生理生化性质,细胞hbrca-959能够在开发抑制或治疗乳腺癌的药物中应用。
14.一种培养细胞的方法,包含以下步骤:
15.提供细胞hbrca-959;
16.细胞置于上述培养基,以使细胞增殖的条件培养hbrca-959细胞。
17.根据一种优选实施方式,人乳腺癌原代细胞的培养方法,包括:
18.s1:用样本保存液保存收集的新鲜人乳腺癌组织;
19.其中,样本保存液包括胎牛血清、抗生素和df培养基,所述抗生素包括青霉素、硫酸卡那霉素、两性霉素b;
20.s2:用清洗液清洗s1保存的乳腺癌组织;
21.其中,清洗液包括含抗生素的生理盐水或pbs缓冲液;
22.s3:取s2清洗处理后的乳腺癌组织,用含血清培养基进行原代分离培养;
23.其中,含血清培养基包括胎牛血清、抗生素和df培养基;
24.s4:取s3原代分离培养出的细胞,用上述提供的任一无血清培养基进行纯化及传代培养,得到人乳腺癌原代细胞。
25.详细地,df培养基为本领域常见的dme/f-12 1:1培养基(美国hyclone)。
26.优选地,含血清培养基包括:50-2000μg/ml青霉素、20-3000μg/ml硫酸卡那霉素、0.5-10μg/ml两性霉素b。
27.优选地,清洗液包括:0.1-1mg/ml青霉素、0.1-1mg/ml硫酸卡那霉素、1-10μg/ml两性霉素b。
28.现代研究认为,乳腺癌不是一种单一的疾病,而是作为以组织学,基因组改变,基因表达,转移行为和治疗反应多样性为特征的疾病异质性集合。对于以人乳腺癌原代细胞构建的模型,人乳腺癌原代细胞分泌蛋白对于疾病的正向影响同样对于乳腺癌的机理研究具有价值。同样的,细胞在制造蛋白质上的用途能够为后续乳腺癌的蛋白标记物及蛋白水平的靶向药物研究提供依据。因此,人乳腺癌原代细胞,或者说hbrca-959细胞系用于制造
蛋白质上的用途同样值得探究。
29.同样地,在分子医学领域,生物标记物及生物标记组合物的筛选成为疾病早期诊断的有效手段。细胞hbrca-959自人体乳腺癌组织中分离得到,对于乳腺癌的识别具有特异性。基于此,本发明设计一种标记物。标记物包括细胞hbrca-959,用于筛查乳腺癌。
30.进一步地,本发明设计一种试剂盒,包括细胞hbrca-959,用于表达所述细胞中包含的基因的表达载体及用于培养所述细胞的细胞培养基。通过rt-pcr或细胞培养的手段进行筛查,并进一步以此细胞为靶点选择范围,从而为患者提供多靶点药物筛查的可能性。
31.本发明提供了人乳腺癌原代细胞或细胞hbrca-959、利用用于培养人乳腺癌原代细胞或细胞hbrca-959的无血清培养基培养得到的人乳腺癌原代细胞或细胞hbrca-959,或利用上述培养方法培养得到的人乳腺癌原代细胞或细胞hbrca-959,在药物敏感性研究及检测中的应用。
32.本发明提供了人乳腺癌原代细胞或细胞hbrca-959、利用用于培养人乳腺癌原代细胞或细胞hbrca-959的无血清培养基培养得到的人乳腺癌原代细胞或细胞hbrca-959,或利用上述培养方法培养得到的人乳腺癌原代细胞或细胞hbrca-959,在构建乳腺癌动物模型中的应用。
33.本发明提供了人乳腺癌原代细胞或细胞hbrca-959、利用用于培养人乳腺癌原代细胞或细胞hbrca-959的无血清培养基培养得到的人乳腺癌原代细胞或细胞hbrca-959,或利用上述培养方法培养得到的人乳腺癌原代细胞或细胞hbrca-959,在开发抑制乳腺癌药物中的应用。
34.本发明提供了人乳腺癌原代细胞或细胞hbrca-959、利用用于培养人乳腺癌原代细胞或细胞hbrca-959的无血清培养基培养得到的人乳腺癌原代细胞或细胞hbrca-959,或利用上述培养方法培养得到的人乳腺癌原代细胞或细胞hbrca-959,在乳腺癌体外研究中的应用。
35.需要说明的是,本发明提供的上述人乳腺癌原代细胞的应用,为非疾病的诊断与治疗目的。
36.本发明提供的人乳腺癌细胞hbrca-959至少具有以下特征:
37.特征1:原代分离培养自中国人的乳腺癌组织,该细胞未经过任何基因工程改造和基因修饰。
38.特征2:显微镜下观察人乳腺癌细胞hbrca-959,为上皮样细胞形态,肿瘤细胞增殖速度较快,细胞大小、形态不等,呈不规则形或多角形,排列紊乱,无接触抑制,细胞界限欠清晰,其具有乳腺癌细胞的形态特征。
39.特征3:人乳腺癌细胞hbrca-959的细胞群体倍增时间为~130小时,细胞增殖速度较快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
40.特征4:人乳腺癌细胞hbrca-959经免疫荧光鉴定为上皮来源的肿瘤细胞标记物ck18(细胞角蛋白18)和ck8(细胞角蛋白8)强表达。
41.特征5:人乳腺癌细胞hbrca-959经核型分析鉴定为肿瘤细胞异型核型,细胞的染色体结构和数目均表现异常,细胞的染色体数目为52条,属于超二倍体核型,符合人源恶性肿瘤的遗传特性。
42.特征6:人乳腺癌细胞hbrca-959经str(short tandem repeat,短串联重复序列)基因分型鉴定,其为单一人类来源且无交叉污染的细胞,是一株新获得的乳腺癌原代细胞。
43.特征7:人乳腺癌细胞hbrca-959,可用于药物敏感性研究及检测、构建乳腺癌动物模型、开发抑制乳腺癌药物、乳腺癌体外研究的用途。
附图说明
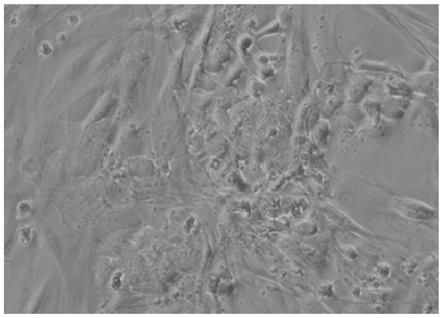
44.图1是本发明一实施例提供的人乳腺癌细胞hbrca-959的细胞形态图;
45.图2是本发明一实施例提供的人乳腺癌细胞hbrca-959的生长曲线图;
46.图3是本发明一实施例提供的人乳腺癌细胞hbrca-959的免疫荧光鉴定结果图;
47.图4是本发明一实施例提供的人乳腺癌细胞hbrca-959的染色体核型分析图;
48.图5是本发明一实施例提供的人乳腺癌细胞hbrca-959的str基因分型图。
具体实施方式
49.下面结合附图进行详细说明。
50.需要说明的是,由于乳腺癌组织的特殊性、有效可用的乳腺癌标本的缺乏以及建立乳腺癌原代细胞培养的技术困难等因素,使得现有的乳腺癌体外研究模型严重缺乏,从而极大地限制了乳腺癌细胞学水平的研究。基于此,本发明实施例提供了一种人乳腺癌原代细胞及其培养方法和应用,可为乳腺癌的分子发生机制、临床治疗途径等相关研究提供良好的实验材料。下面,分别针对该人乳腺癌原代细胞及其培养方法和应用进行说明。
51.实施例1
52.本发明实施例提供了一种人乳腺癌原代细胞,命名为人乳腺癌细胞hbrca-959,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.23022。
53.该人乳腺癌细胞hbrca-959原代分离培养自中国人的乳腺癌组织,该细胞未进行任何基因工程改造及修饰。
54.下面,分别针对人乳腺癌细胞hbrca-959的各生物学特性进行说明。
55.1.1细胞形态学观察
56.在倒置显微镜下观察人乳腺癌细胞hbrca-959,为上皮样细胞形态,肿瘤细胞增殖速度较快,细胞大小、形态不等,呈不规则形或多角形,排列紊乱,无接触抑制,细胞界限欠清晰,其具有乳腺癌细胞的形态特征。形态学观察结果如图1所示。
57.1.2生长曲线和倍增时间的测定
58.1.2.1生长曲线测定步骤
59.(1)人乳腺癌细胞hbrca-959的细胞汇合度达到70-90%时,移除无血清培养基,用pbs(0.01m,ph 7.4)洗涤细胞至少两次,以去除旧的无血清培养基和飘浮的状态差的细胞,用1-2ml edta-trypsin(胰蛋白酶-edta消化液)消化处理,并用df10培养基(df培养基和10%fbs)终止消化。
60.其中,edta(ethylene diamine tetraacetic acid)为乙二胺四乙酸,trypsin为胰蛋白酶。
61.(2)细胞以2.5
×
105/ml接种至12个48孔板的36个孔中,每孔加入500μl细胞悬液。
62.(3)从接种时间起,每隔24小时弃去3孔中的培养基,加入edta-trypsin消化处理,
混悬细胞并计数3孔内的细胞密度的平均值,每孔计数3次,取平均值,其余孔内的细胞继续培养,直至第12日;每隔2天更换一次培养基。
63.(4)连续测定12天,得到下述表1所示的生长曲线数据。
64.1.2.2生长曲线测定结果
65.表1示出了连续测定12天所得到的生长曲线数据。
66.表1
67.培养时间(天)细胞平均密度111.3
×
104个/ml211.73
×
104个/ml313.29
×
104个/ml417.01
×
104个/ml519.02
×
104个/ml620.05
×
104个/ml721.85
×
104个/ml823.10
×
104个/ml926.53
×
104个/ml1030.20
×
104个/ml1134.80
×
104个/ml1241.87
×
104个/ml
68.基于表1中的细胞生长曲线数据,得到如图2所示的细胞生长曲线示意图。图2的横坐标为培养时间(天数),纵坐标为细胞数目(
×
104个/ml)。
69.请参考表1中的生长曲线数据及图2所示的生长曲线示意图,可以看出人乳腺癌细胞hbrca-959连续12天生长良好,其对数生长期为10天。
70.1.2.3细胞群体倍增时间
71.肿瘤细胞的群体倍增时间的计算公式为:dt=t
×
[lg2/(lgnt-lgno)]。其中,dt为倍增时间,t为时间间隔,no为起始细胞数,nt为终末细胞数。
[0072]
经计算,人乳腺癌细胞hbrca-959的细胞群体倍增时间为~130h。
[0073]
综上可知,人乳腺癌细胞hbrca-959的细胞增殖速度较快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
[0074]
1.3免疫荧光鉴定
[0075]
1.3.1免疫荧光鉴定步骤
[0076]
(1)人乳腺癌细胞hbrca-959汇合度达到70-90%左右,移除无血清培养基,用pbs(0.01m,ph 7.4)洗涤细胞至少两次,以去除旧的无血清培养基和飘浮的状态差的细胞,用1-2ml edta-trypsin消化,接种至包被了胶原的48孔板;
[0077]
(2)当细胞汇合度达70-90%时,去除无血清培养基,pbs清洗3次,加入500μl/孔的冰甲醇,固定30min后移除;
[0078]
(3)加入300μl/孔2.5%bsa封闭液,室温封闭60min后吸出封闭液;
[0079]
(4)加入300μl/孔的一抗(keratin 18mouse mab,1:800稀释;keratin 8rabbit mab 1:200稀释释),4℃过夜孵育后吸出;
[0080]
(5)加入300μl/孔的荧光二抗(二抗anti-mouse igg(whole molecule)-fitc antibody produced in rabbit,1:100稀释;cy3标记山羊抗兔igg,1:500稀释),室温避光孵育1h,吸出二抗,pbs洗涤3次;
[0081]
(6)每孔加入2滴dapi原液(ab104139),室温避光染色5min;
[0082]
(7)吸出dapi,pbs洗涤3次;
[0083]
(8)加入300μl/孔的pbs,荧光拍照,物镜
×
目镜(10
×
10),得到免疫荧光鉴定结果。
[0084]
1.3.2免疫荧光鉴定结果
[0085]
细胞角蛋白(cytokeratin,ck)是上皮细胞的常见标志物,上皮细胞及上皮来源的肿瘤细胞中表达ck。
[0086]
免疫荧光鉴定结果如图3所示。请参考图3,经免疫荧光鉴定发现,dapi对肿瘤细胞核进行了染色,该人乳腺癌细胞hbrca-959ck18和ck8强表达,说明该人乳腺癌细胞hbrca-959来源于上皮细胞。
[0087]
1.4染色体核型分析鉴定
[0088]
1.4.1染色体核型分析鉴定步骤
[0089]
(1)细胞培养
[0090]
当人乳腺癌细胞hbrca-959汇合度达到70-90%时,移除无血清培养基培养,用pbs(0.01m,ph7.4)洗涤细胞至少两次,以去除旧的无血清培养基和脱落的状态差的细胞,用1-2ml edta-trypsin消化处理,显微镜下观察,边消化边收集消化处理后的细胞,收集的细胞用df10培养基终止消化,直至所有细胞均消化完成。1000rpm离心5min,移除上清液。
[0091]
(2)秋水仙素处理
[0092]
向细胞沉淀中加入浓度为300μg/ml的秋水仙素20-50μl,37℃培养箱中处理25min。
[0093]
(3)低渗处理
[0094]
秋水仙素处理完毕后,离心(1300rpm,10min),弃上清液。然后加入37℃水浴的0.075mol/l的kcl溶液低渗液至10ml,用吸管吹打成细胞悬液,置37℃水浴处理30-60min。
[0095]
(4)预固定
[0096]
低渗处理结束在每个离心管中加入1ml的固定液,继续37℃水浴5min。
[0097]
(5)离心
[0098]
1300rpm离心10min,弃上清液。
[0099]
(6)固定
[0100]
在离心管中加入固定液6-8ml,立即用吸管轻轻吹打成单个细胞悬液,在37℃水浴中固定30min后,1300rpm离心10min,弃上清液。
[0101]
(7)第二次固定
[0102]
在离心管中加入固定液6-8ml,立即用吸管轻轻吹打成单个细胞悬液,在37℃水浴中固定15min后,1300rpm离心10min,弃上清液。
[0103]
(8)制片
[0104]
在离心管中加入新固定液0.2ml左右,用吸管轻轻吹打成细胞悬液,从冰箱的冷冻室内取出冰片,调到合适悬液,每片滴加悬液1-2滴,75℃烤3h。
[0105]
(9)染色
[0106]
用6%giemsa染液染色10min,然后用镊子夹出玻片,用自来水轻轻冲洗两面,室温干燥后镜检。
[0107]
(10)镜检
[0108]
待玻片干后,在显微镜下检查。先用低倍镜寻找良好的分裂相,然后用高倍油镜观察,得到染色体核型分析鉴定结果。
[0109]
1.4.2染色体核型分析鉴定结果
[0110]
染色体核型分析鉴定结果如图4所示。请参考图4,经染色体核型分析鉴定,人乳腺癌细胞hbrca-959经核型分析鉴定为肿瘤细胞异型核型,细胞的染色体结构和数目均表现异常,细胞的染色体数目为52条,属于超二倍体核型,符合人源恶性肿瘤的遗传特性。
[0111]
1.5str鉴定
[0112]
1.5.1str鉴定步骤
[0113]
(1)将贴壁生长的人乳腺癌细胞hbrca-959(1
×
106个)用pbs(0.01m,ph7.4)洗涤细胞两次,顺次用1-2ml edta-trypsin消化3-30min,10ml df10培养基终止消化反应。
[0114]
(2)10000rpm离心1min,弃上清液,加200μl缓冲液ga(细胞/组织基因组dna提取试剂盒dp304,天根公司),振荡至彻底悬浮。
[0115]
(3)加入20μl proteinase k溶液,混匀。
[0116]
(4)加入200μl缓冲液gb(细胞/组织基因组dna提取试剂盒dp304,天根公司),充分颠倒混匀,70℃放置10min,简短离心。
[0117]
(5)加入200μl无水乙醇,充分振荡混匀15s,简短离心。
[0118]
(6)将所得溶液和絮状沉淀都加入一个吸附柱中(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0119]
(7)向吸附柱中加入500μl缓冲液gd(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0120]
(8)向吸附柱中加入600μl漂洗液pw(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0121]
(9)将吸附柱转入另一离心管中,向吸附膜的中间部位滴加50-200μl洗脱缓冲液te(细胞/组织基因组dna提取试剂盒dp304,天根公司),室温放置2-5min,12000rpm离心2min,将提取的dna溶液收集到离心管中。
[0122]
(10)采用goldeneye tm20a str复合扩增试剂盒进行扩增,在abi3100型遗传分析仪上连续对21个已知的str位点和性别基因amelogenin进行检测分析。
[0123]
(11)使用genemapper3.2软件分析样本数据,进行自动基因分型,得到str分型结果。
[0124]
1.5.2str鉴定结果
[0125]
str分型结果如图5所示。请参考图5,检测21个基因座,以“基因座/等位基因长度”来表示:d19s433/13.2/14/14.2,d5s818/11/13,d21s11/29/30,d18s51/13/20,d6s1043/18/20,amel/x/x,d3s1358/15/15,d13s317/10/11,d7s820/10/11,d16s539/13/13,csfipo/10/11,pentad/9/12,d2s441/10/10,vwa/14/18,d8s1179/10/13,tpox/11/11,pentae/12/18,th01/7/7,d12s391/23/24,d2s1338/23/23,fga/23/24。
[0126]
由上可知,经str基因分型鉴定,可以得出以下结论:
[0127]
(1)人乳腺癌细胞hbrca-959仅在d19s433基因座出现三等位基因现象,细胞中未发现人类细胞交叉污染。
[0128]
(2)将人乳腺癌细胞hbrca-959的str数据与atcc(美国模式菌种收集中心)和dsmz(德国的国家菌种保藏中心)的str数据库中数据相对比,可知在atcc和dsmz细胞库中,均未找到与人乳腺癌细胞hbrca-959的细胞分型100%相匹配的细胞。
[0129]
(3)将人乳腺癌细胞hbrca-959的str数据与atcc和dsmz的str数据库中数据相对比,可知其与hroc278met t2 m2(cvcl_1u90)细胞的str数据匹配率相对最高,为75%。
[0130]
综上,经对人乳腺癌细胞hbrca-959进行str基因分型鉴定,结果证实其为单一人类来源且无交叉污染的细胞,是一株新获得的乳腺癌原代细胞。
[0131]
1.6细胞用途
[0132]
1.6.1用于药物敏感性研究及检测
[0133]
1.6.1.1药敏检测步骤(cd-dst方法)
[0134]
(1)胶原凝胶滴培养
[0135]
取人乳腺癌细胞hbrca-959与凝胶构成液(ⅰ:ⅱ:ⅲ=8:1:1)混合均匀,按照30μl/胶滴,3个胶滴/孔,将细胞悬液接种于6孔板中,同时在另一6孔板中接种3个胶滴,作为0-time对照组。1-2h后待胶滴凝固加入3ml含10%胎牛血清的df培养基,于37℃、5%co2培养箱中过夜培养。
[0136]
(2)抗癌药物接触与清洗
[0137]
上述步骤(1)的人乳腺癌原代细胞培养24h后加入抗癌药物,设置未用药物的阴性对照孔(control),及临床乳腺癌常用药(需要说明的是,通常可根据细胞来源患者的主要临床表现进行药物选择)处理的阳性对照孔,同时将0-time组进行染色固定。培养相应时间后,用df培养基清洗2次,每次15min,然后用无血清培养基继续培养5天,其中第3天更换一次培养基。
[0138]
(3)染色固定与扫描
[0139]
第8天进行染色固定,终浓度为50μg/ml的中性红染色2h,pbs清洗细胞3次,每次5min,中性福尔马林固定45min,蒸馏水清洗15min,通风干燥,获得具有活性的肿瘤细胞。然后用primage图像分析系统对胶滴进行扫描分析,得到药敏检测结果。
[0140]
1.6.1.2药敏检测结果
[0141]
人乳腺癌细胞hbrca-959的药敏检测(cd-dst法)结果见下述表2。
[0142]
表2
[0143]
药物名称细胞存活率(%)卡铂+紫杉醇(cbdca+pac)94.75顺铂+诺维本(cddp+vnr)74.21卡培他滨+多西紫杉醇(cap+doc)88.26表阿霉素+多西紫杉醇(epi+doc)95.38顺铂+吉西他滨(cddp+gem)90.43
[0144]
其中,若细胞存活率小于50%,可以说明个体肿瘤细胞对相应药物的敏感度较高(即高敏感);若细胞存活率为50-60%,可以说明个体肿瘤细胞对相应药物的敏感度处于高
敏感与低敏感的临界范围(即临界);若细胞存活率大于60%,可以说明个体肿瘤细胞对相应药物的敏感度较低(即耐药)。
[0145]
参考表2可知,人乳腺癌细胞hbrca-959对卡铂+紫杉醇(cbdca+pac)、顺铂+诺维本(cddp+vnr)、卡培他滨+多西紫杉醇(cap+doc)、表阿霉素+多西紫杉醇(epi+doc)、顺铂+吉西他滨(cddp+gem)等五种用药方案均为低敏感,故而可用于该5种联药临床乳腺癌常用药的有效性评价。经该药敏检测实验,可以更有针对性的为相关乳腺癌患者(如人乳腺癌细胞hbrca-959的乳腺癌患者、具有相同或相似临床表现或药物敏感特点的其他乳腺癌患者或乳腺癌转移病灶患者等)进行临床用药指导,对其个性化治疗具有重要意义。
[0146]
1.6.2用于构建乳腺癌动物模型
[0147]
将处于对数生长期的人乳腺癌细胞hbrca-959按照规定剂量,接种于哺乳动物(如裸鼠)体内,并培养若干天数以构建乳腺癌动物模型。该乳腺癌动物模型可用于乳腺癌的发展研究、转移机理的研究、放化疗药物临床治疗的疗效评价等。
[0148]
1.6.3用于开发抑制乳腺癌药物
[0149]
人乳腺癌细胞hbrca-959培养自刚刚离体的乳腺癌组织,其生物学特性变化小,保留原遗传特性,故而可应用于筛选或评估治疗乳腺癌的药物。
[0150]
通过向人乳腺癌细胞hbrca-959培养基中添加不同化疗药物,观察细胞生长增殖、死亡、周期等变化,获得初步有效的候选药物。再将候选药物用于乳腺癌动物模型,检测药物的体内作用,观察动物的一般情况、存活时间、肿瘤大小改变,以及药物作用后动物机体变化情况,从而对候选药物进行疗效评估和机制分析。
[0151]
1.6.4用于乳腺癌体外研究
[0152]
人乳腺癌细胞hbrca-959培养自刚刚离体的乳腺癌组织,其生物学特性变化小,保留原遗传特性,可作为人乳腺癌发病机制及个体化治疗体外研究的细胞材料,进而为人乳腺癌发生机理模型的建立以及抗人乳腺癌药物的制备、筛选、评价等提供基础。
[0153]
综上所述,本发明实施例提供的人乳腺癌细胞hbrca-959至少具有以下特征:
[0154]
特征1:原代分离培养自中国人的乳腺癌组织,该细胞未经过任何基因工程改造和基因修饰。
[0155]
特征2:显微镜下观察人乳腺癌细胞hbrca-959,为上皮样细胞形态,肿瘤细胞增殖速度较快,细胞大小、形态不等,呈不规则形或多角形,排列紊乱,无接触抑制,细胞界限欠清晰,其具有乳腺癌细胞的形态特征。
[0156]
特征3:人乳腺癌细胞hbrca-959的细胞群体倍增时间为~130小时,细胞增殖速度较快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
[0157]
特征4:人乳腺癌细胞hbrca-959经免疫荧光鉴定为上皮来源的肿瘤细胞标记物ck18(细胞角蛋白18)和ck8(细胞角蛋白8)强表达。
[0158]
特征5:人乳腺癌细胞hbrca-959经核型分析鉴定为肿瘤细胞异型核型,细胞的染色体结构和数目均表现异常,细胞的染色体数目为52条,属于超二倍体核型,符合人源恶性肿瘤的遗传特性。
[0159]
特征6:人乳腺癌细胞hbrca-959经str(short tandem repeat,短串联重复序列)基因分型鉴定,其为单一人类来源且无交叉污染的细胞,是一株新获得的乳腺癌原代细胞。
[0160]
特征7:人乳腺癌细胞hbrca-959,可用于药物敏感性研究及检测、构建乳腺癌动物模型、开发抑制乳腺癌药物、乳腺癌体外研究的用途。
[0161]
实施例2
[0162]
本实施例是对实施例1的进一步改进,重复的内容不再赘述。
[0163]
本实施例用于说明人乳腺癌原代细胞的培养方法,包括下述步骤1-步骤4。使用该培养方法可培养得到实施例1中提供的人乳腺癌细胞hbrca-959。
[0164]
步骤1,用样本保存液保存收集的新鲜人乳腺癌组织。其中,所述样本保存液包括胎牛血清、抗生素和df培养基。
[0165]
步骤2,用清洗液清洗步骤1保存的乳腺癌组织。其中,所述清洗液包括含所述抗生素的生理盐水。
[0166]
步骤3,取步骤2清洗处理后的乳腺癌组织,用含血清培养基进行原代分离培养。其中,所述含血清培养基包括胎牛血清、所述抗生素和df培养基。
[0167]
具体地,步骤3可以包括下述步骤3.1)-步骤3.3)。
[0168]
步骤3.1),用细胞分散酶处理清洗后的乳腺癌组织。
[0169]
具体地,步骤3.1)可以包括下述步骤3.1.1)-步骤3.1.4)。
[0170]
步骤3.1.1),将清洗后的乳腺癌组织剁成碎泥状。
[0171]
其中,经剁成碎泥状,可便于乳腺癌组织消化成适宜大小的肿瘤细胞。
[0172]
步骤3.1.2),将碎泥状的乳腺癌组织在800-1500rpm下离心5-10min,移除上清液,并向移除上清液后的细胞沉淀中加入df培养基进行重悬。
[0173]
其中,经离心移除上清,可以去除乳腺癌组织中的杂质,例如,脂肪组织、粘膜组织、结缔组织以及坏死组织。
[0174]
步骤3.1.3),顺次加入细胞分散酶,置于37℃、5%co2培养箱中低速振荡消化20min-2h,以分散乳腺癌组织,防止细胞结块,再加入df10培养基终止反应,吹散混匀。
[0175]
其中,细胞分散酶可以为:含有1-10mg/ml的胶原酶ⅰ和0.2-2mg/ml透明质酸酶的混合物。
[0176]
步骤3.1.4),顺次在800-1500rpm下离心5-10min,移除上清液,得到细胞分散酶消化后的细胞。
[0177]
步骤3.2),用细胞消化液进行消化处理。
[0178]
具体地,步骤3.2)可以包括:向细胞分散酶消化处理后得到的细胞中加入细胞消化液,吹散混匀,室温消化2-20min,加入df10培养基终止反应,吹散混匀,离心去除上清,得到细胞消化液消化后的细胞。
[0179]
其中,细胞消化液可以是egta-trypsin。
[0180]
步骤3.3),用含血清培养基培养消化处理后得到的细胞,得到原代分离培养出的细胞。
[0181]
具体地,步骤3.3)可以包括下述步骤3.3.1)-步骤3.3.3)。
[0182]
步骤3.3.1),通过200-400μm尼龙膜过滤消化处理后得到的细胞,收集过滤后的细胞。其中,利用尼龙膜进行过滤可滤除非肿瘤组织,例如脂肪组织。
[0183]
步骤3.3.2),在800-1500rpm下离心5-10min,移除上清液,并利用含血清培养基对移除上清液后的细胞沉淀进行重悬,将重悬后的细胞置于37℃、5%co2培养箱中培养。比如
培养24-48h,以使细胞完全贴壁生长。
[0184]
步骤3.3.3),当培养的细胞完全贴壁生长后,将含血清培养基换为无血清培养基,置于37℃、5%co2培养箱中继续培养,得到原代分离培养出的细胞。
[0185]
步骤4,取步骤3原代分离培养出的细胞,用无血清培养基进行纯化及传代培养,得到人乳腺癌原代细胞。其中,所述无血清培养基包括添加物、所述抗生素和df培养基。
[0186]
该步骤中,可以当培养的细胞的汇合度达到70-90%时,采用胰酶差时消化法、差时贴壁法、反复贴壁法相结合的方式对培养的细胞进行纯化,获得人乳腺癌原代细胞。
[0187]
基于此,步骤4可以包括下述步骤4.1)-步骤4.4)。
[0188]
步骤4.1),移除培养的细胞中的无血清培养基,并用edta-trypsin消化处理,消化时间为3-30min。
[0189]
步骤4.2),显微镜下观察,弃掉edta-trypsin先消化下来的成纤维细胞,再边消化边收集消化处理后的细胞,收集的细胞用df10培养基终止消化,直至所有细胞均消化完成。
[0190]
步骤4.3),顺次在800-1500rpm下离心5-10min,移除上清液,并用无血清培养基将移除上清液后的细胞沉淀重悬,并将重悬后的细胞置于37℃、5%co2培养箱中5-10min,使成纤维细胞贴壁,收集未贴壁的人乳腺癌原代细胞,并转入新的细胞培养瓶继续培养,反复贴壁2-6次,获得纯化的人乳腺癌原代细胞。如此,可达到全部清除成纤维细胞的作用,同时还可以避免因过度消化导致细胞状态差或者死亡。
[0191]
步骤4.4),对纯化的人乳腺癌原代细胞进行传代培养。
[0192]
本实施例中,所述抗生素包括青霉素、硫酸卡那霉素、两性霉素b。在保存、清洗乳腺癌组织以及在培养肿瘤细胞时,抗生素的存在可起到抑菌杀菌作用,以保护原代细胞免受微生物污染,其对革兰氏阳性菌、革兰氏阴性菌、支原体和真菌均有杀伤作用。
[0193]
本实施例中,所述添加物包括谷氨酰胺、胰岛素、转铁蛋白、亚硒酸钠、表皮生长因子、牛血清白蛋白、y-27632和wnt 3a。
[0194]
优选地,所述清洗液包括:0.1-1mg/ml青霉素、0.1-1mg/ml硫酸卡那霉素、1-10μg/ml两性霉素b。
[0195]
比如,清洗液中,青霉素的浓度可为0.1、0.3、0.5、0.7、0.8或1mg/ml,硫酸卡那霉素的浓度可为0.1、0.3、0.5、0.7、0.8或1mg/ml,两性霉素b的浓度可为1、3、5、8或10μg/ml。
[0196]
优选地,所述含血清培养基包括:50-2000μg/ml青霉素、20-3000μg/ml硫酸卡那霉素、0.5-10μg/ml两性霉素b。
[0197]
比如,含血清培养基中,青霉素的浓度可为50、200、300、500、1000或2000μg/ml,硫酸卡那霉素的浓度可为20、200、500、1000、2000或3000μg/ml,两性霉素b的浓度可为0.5、2、4、6、8或10μg/ml。
[0198]
优选地,所述无血清培养基包括:1-10mm谷氨酰胺、3-50mg/l胰岛素、3-30mg/l转铁蛋白、5-50μg/l亚硒酸钠、5-50μg/l egf、1-5mg/ml bsa、5-20μm y-27632、50~500ng/ml wnt 3a、0-2000μg/ml青霉素、0-3000μg/ml硫酸卡那霉素、0-10μg/ml两性霉素b、0-500μg/ml头孢美唑、0-50μg/ml万古霉素。该无血清培养基能够有效地促进人乳腺癌原代细胞生长,抑制成纤维细胞等杂质细胞。
[0199]
比如,无血清培养基中,谷氨酰胺的浓度可为1、3、5、8或10mm,胰岛素的浓度可为5、10、15、30、40或50mg/l,转铁蛋白的浓度可为3、10、20或30mg/l,亚硒酸钠的浓度可为5、
25、35或50μg/l,egf的浓度可为5、20、35或50μg/l,bsa的浓度可为1、2、3、4或5mg/ml,y-27632的浓度可为5、10、15或20μm,wnt 3a的浓度可为50、100、200、300、400或500ng/ml,青霉素的浓度可为0、50、200、300、500、1000或2000μg/ml,硫酸卡那霉素的浓度可为0、20、200、500、1000、2000或3000μg/ml,两性霉素b的浓度可为0.5、2、4、6、8或10μg/ml,头孢美唑的浓度可为0、100、300或500μg/ml,万古霉素的浓度可为0、10、30或50μg/ml。
[0200]
下面,结合下述具体培养方法,分别对上述步骤1-步骤4的具体实现进行说明。
[0201]
对于步骤1:
[0202]
在步骤1中,用样本保存液保存收集的新鲜人乳腺癌组织,其具体实现请参见下述步骤1.1-步骤1.2:
[0203]
步骤1.1,在病人或病人监护人知情同意的情况下,收集病人手术时切除的部分乳腺癌组织。
[0204]
步骤1.2,用样本保存液保存步骤1.1收集的乳腺癌组织。
[0205]
对于步骤2:
[0206]
在步骤2中,用清洗液清洗步骤1保存的乳腺癌组织,其具体实现请参见下述步骤2.1-步骤2.2:
[0207]
步骤2.1,将步骤1.2保存的乳腺癌组织转移至细胞培养皿中,用清洗液冲洗6次,去除脂肪、粘膜、红细胞等非癌组织杂质。
[0208]
步骤2.2,将步骤2.1中清洗处理后的乳腺癌组织转移至新的培养皿中。
[0209]
对于步骤3:
[0210]
在步骤3中,取步骤2清洗处理后的乳腺癌组织,用含血清培养基进行原代分离培养,其具体实现请参见下述步骤3.1-步骤3.6:
[0211]
步骤3.1,用剪刀和刀片将步骤2.2中清洗处理后的乳腺癌组织剪成小块并剁成碎泥状。
[0212]
步骤3.2,将步骤3.1中碎泥状的乳腺癌组织转移至50ml离心管中,在1300rpm离心6min,移除上清液,顺次加入9ml df培养基进行重悬,顺次再加入1ml含有10mg/ml的胶原酶ⅰ和2mg/ml透明质酸酶的细胞分散酶,在37℃、5%co2培养箱中低速振荡消化1h以分散乳腺癌组织,防止细胞结块。细胞分散酶反应结束后,加入20ml df10培养基终止反应,吹散混匀,并在1000rpm离心5min,移除上清液,取细胞沉淀。
[0213]
步骤3.3,向步骤3.2得到的细胞沉淀中加入4ml egta-trypsin溶液,混匀,室温静置5min,顺次加入20ml df10培养基终止反应,吹散混匀,得到细胞消化液消化后的细胞。
[0214]
该步骤中,egta-trypsin溶液为细胞消化液,其消化时间可为3-5min。
[0215]
步骤3.4,将步骤3.3得到的细胞通过300μm尼龙膜过滤,将过滤后细胞液收集到50ml离心管中,1000rpm离心5min,移除上清液,取细胞沉淀。
[0216]
步骤3.5,将步骤3.4得到的细胞沉淀用10ml含血清培养基重悬接种至25cm2的培养瓶中,顺次置于37℃、5%co2培养箱中过夜(24h)培养。
[0217]
步骤3.6,当步骤3.5培养的细胞完全贴壁生长后,将含血清培养基换为无血清培养基,并置于37℃、5%co2培养箱中继续培养。
[0218]
其中,步骤3.6中培养得到的细胞,即为原代分离培养出的细胞。
[0219]
对于步骤4:
[0220]
在步骤4中,取步骤3原代分离培养出的细胞,用无血清培养基进行纯化及传代培养,得到人乳腺癌原代细胞,其具体实现请参见下述步骤4.1-步骤4.5(步骤4.1-步骤4.3为纯化培养过程,步骤4.4-步骤4.6为传代培养过程):
[0221]
步骤4.1,当步骤3.6中培养的细胞的汇合度达到70-90%时,移除无血清培养基,用1-2ml edta-trypsin消化处理。
[0222]
步骤4.2,显微镜下观察,待细胞从培养瓶中脱离下来,弃掉edta-trypsin先消化下来的成纤维细胞,再边消化边收集消化处理后的细胞。将每次收集的细胞均转移至放置有df10培养基的离心管中,以便及时终止消化,直至所有细胞均消化完成。
[0223]
该步骤中,通过及时终止消化,可以避免因过度消化而导致细胞状态差或者死亡。
[0224]
步骤4.3,1000rpm离心5min,移除上清液,用无血清培养基重悬,并在37℃、5%co2细胞培养箱中放置0.5h,成纤维细胞贴壁后再将未贴壁的细胞收集起来,转入新的培养瓶继续培养,反复贴壁5次,以全部清除成纤维细胞,得到已纯化的人乳腺癌原代细胞。
[0225]
基于上述内容,本培养方法通过采用胰酶差时消化法、差时贴壁法、反复贴壁法相结合的方式进行细胞纯化,可避免纯化过程中因过度消化导致细胞状态差或者死亡,以得到状态良好、无成纤维细胞等杂质细胞的人乳腺癌原代细胞,提高人乳腺癌原代细胞培养的成功率。
[0226]
步骤4.4,用无血清培养基培养步骤4.3得到的人乳腺癌原代细胞,当细胞汇合度达到70-90%时,用1倍浓度(1
×
)磷酸缓冲盐溶液pbs(0.01m,ph 7.4)洗涤细胞至少两次,以去除旧的无血清培养基和脱落的状态差的细胞,再用1-2ml edta-trypsin消化3-30min。
[0227]
步骤4.5,显微镜下观察,边消化边收集消化处理后的细胞,收集的细胞及时用df10培养基终止消化,直至所有细胞均消化完成。
[0228]
步骤4.6,在1000rpm下离心6min,移除上清液,再用无血清培养基重悬,接种于新的培养瓶中,顺次在37℃、5%co2细胞培养箱中培养,得到传代后的人乳腺癌原代细胞。
[0229]
之后,按需重复上述步骤4.4-步骤4.6,区别在于非首次执行步骤4.4时,步骤4.4中培养的人乳腺癌原代细胞不再为步骤4.3得到的人乳腺癌原代细胞,而为上一个步骤4.6得到的人乳腺癌原代细胞(即上一代的人乳腺癌原代细胞)。
[0230]
需要说明的是,由于原代分离培养均自同一乳腺癌组织,故步骤4.3和每一次步骤4.6所得到的细胞均为人乳腺癌原代细胞,均具有相同的细胞特性,区别仅在于细胞代数不同。如此,基于本实施例提供的培养方法所培养出的任一代人乳腺癌原代细胞,均具有与上述人乳腺癌细胞hbrca-959相同的细胞特性。
[0231]
基于上述内容,对于步骤4.3和每一次步骤4.6中得到的人乳腺癌原代细胞,必要时可将(1
×
106个)人乳腺癌原代细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso,v/v)中,储存于液氮中备用。其中,dmso(dimethyl sulfoxide)为二甲基亚砜。
[0232]
需要说明的是,上述培养方法中所用到的无血清培养基包括:df培养基、5mm谷氨酰胺、25mg/l胰岛素、10mg/l转铁蛋白、20μg/l亚硒酸钠、30μg/l egf、1.5mg/ml bsa、10μm y-27632、100ng/ml wnt3a、500μg/ml青霉素、500μg/ml硫酸卡那霉素、5μg/ml两性霉素b、100μg/ml头孢美唑、10μg/ml万古霉素。
[0233]
上述培养方法中所用到的含血清培养基包括:df培养基、10%fbs(fetal bovine serum,胎牛血清)、1000μg/ml青霉素、1500μg/ml硫酸卡那霉素、50μg/ml两性霉素b。
[0234]
df培养基即dme/f-12 1:1培养基。
[0235]
上述培养方法中所用到的清洗液包括:生理盐水、0.5mg/ml青霉素、0.5mg/ml硫酸卡那霉素、5μg/ml两性霉素b。
[0236]
需要说明的是,本实施例提供的人乳腺癌原代细胞培养方法不仅可以用于乳腺癌原代肿瘤细胞的培养,也可用于乳腺癌转移病灶原代肿瘤细胞的培养。
[0237]
实施例3
[0238]
本实施例是对实施例1和/或实施例2的进一步改进,重复的内容不再赘述。
[0239]
本实施例用于说明人乳腺癌原代细胞的非疾病的诊断与治疗目的的用途。该人乳腺癌原代细胞可以为实施例1提供的人乳腺癌细胞hbrca-959,也可以为使用实施例2提供的培养方法所培养得到的人乳腺癌原代细胞,以及可以为使用实施例3提供的无血清培养基所培养得到的人乳腺癌原代细胞。
[0240]
本发明实施例提供的人乳腺癌原代细胞的用途,具体可以用于药物敏感性研究及检测、构建乳腺癌动物模型、开发抑制乳腺癌药物、乳腺癌体外研究等。
[0241]
需要注意的是,上述具体实施例是示例性的,本领域技术人员可以在本发明公开内容的启发下想出各种解决方案,而这些解决方案也都属于本发明的公开范围并落入本发明的保护范围之内。本领域技术人员应该明白,本发明说明书及其附图均为说明性而并非构成对权利要求的限制。本发明的保护范围由权利要求及其等同物限定。本发明说明书包含多项发明构思,诸如“优选地”、“根据一个优选实施方式”或“可选地”均表示相应段落公开了一个独立的构思,申请人保留根据每项发明构思提出分案申请的权利。在全文中,“优选地”所引导的特征仅为一种可选方式,不应理解为必须设置,故此申请人保留随时放弃或删除相关优选特征之权利。
