用于高效rna反式剪接的三螺旋终止子
背景技术:
1.许多遗传性视网膜疾病是由位于较大眼部基因各部分的突变,一般是多个突变引起。举个例子,斯塔加特氏病(stargardt disease),又称为斯塔加特氏1(stgd1),是一种体染色体隐性视网膜营养不良,通常以中心视力的进行性丧失为特征。类似视网膜疾病是由其它较大眼部基因中的缺陷引起,包括cep290(7440个核苷酸),其缺陷或突变引起雷伯氏先天性黑蒙(leber's congenital amaurosis)等眼部疾病;和myo7a(7465个核苷酸),其缺陷或突变引起尤塞氏病(usher's disease)。
2.此类较大眼部基因和其它基因中多个突变的出现和位置使得修复突变的策略极具挑战性。尽管跨越二十多年的反式剪接技术有望应对此挑战,但尚未出现一种有意义的基因治疗方法。这主要但不仅仅归因于反式剪接反应的不良效率。重要的是,应认识到反式剪接在包括人类在内的高等真核生物中并不常见。而且,内源反式剪接的实例极其少见,而顺式剪接明显占据主导。简单点说,反式剪接在人体中看来是一类新颖的替代性剪接,它利用了与介导传统顺式剪接路径相同的细胞因子和机制。
3.仍需要用于治疗此类病症的有效组合物和治疗方法。
技术实现要素:
4.本文提供了可用于治疗由编码序列一个或多个外显子中的缺陷引起的疾病的rna反式剪接分子(rtm)。还提供了利用这些rtm的方法和组合物。
5.一方面,本发明包括一种核酸反式剪接分子(例如rtm),其包含3'转录终止子结构域(ttd),该ttd包含三螺旋。在一些实施例中,所述三螺旋包含至少五个连续a-u胡斯坦碱基对(hoogsteen base pair)(例如四至20个连续a-u胡斯坦碱基对、四至18个连续a-u胡斯坦碱基对、四至15个连续a-u胡斯坦碱基对、四至12个连续a-u胡斯坦碱基对、四至11个连续a-u胡斯坦碱基对或四至10个连续a-u胡斯坦碱基对,例如六至八个连续a-u胡斯坦碱基对、八至10个连续a-u胡斯坦碱基对、10至12个连续a-u胡斯坦碱基对、12至14个连续a-u胡斯坦碱基对、14至16个连续a-u胡斯坦碱基对、16至18个连续a-u胡斯坦碱基对或18至20个连续a-u胡斯坦碱基对)。
6.在一些实施例中,所述三螺旋包含具有5-30个核酸(例如5-10个核酸、10-20个核酸或20-30个核酸)的富含a的区域。在一些实施例中,所述富含a的区域在ttd的3'端(例如在聚a尾处或在聚a尾内)。
7.在一些实施例中,所述三螺旋包含具有10个连续核苷酸的链,其中所述10个连续核苷酸中的9个通过胡斯坦碱基配对进行配对。在一些实施例中,ttd包含茎-环基序。
8.在一些实施例中,3'ttd包含以5'至3'方向操作性连接的5'富含u的基序、茎-环基序、t'富含u的基序和富含a的区域。
9.在一些实施例中,3'ttd与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少95%同源(例如与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少96%同源;与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少97%同
源;与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少98%同源;与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少99%同源;或与seq id no:13、seq id no:15、seq id no:17或seq id no:23达100%同源)。
10.在一些实施例中,3'ttd与seq id no:13至少95%同源(例如至少96%、至少97%、至少98%或至少99%同源),并且其中三螺旋包含seq id no:13的u7-u11与富含a的区域的胡斯坦碱基配对。在一些实施例中,3'ttd是pan ene+a。
11.在一些实施例中,3'ttd与seq id no:15至少95%同源(例如至少96%、至少97%、至少98%或至少99%同源),并且其中三螺旋包含seq id no:15的u6-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。在一些实施例中,3'ttd是malat1 ene+a。
12.在一些实施例中,3'ttd与seq id no:17至少95%同源(例如至少96%、至少97%、至少98%或至少99%同源),并且其中三螺旋包含seq id no:17的u6-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。在一些实施例中,3'ttd是malat1核心ene+a。
13.在一些实施例中,3'ttd与seq id no:23至少95%同源,并且其中三螺旋包含seq id no:23的u8-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。在一些实施例中,3'ttd是menβene+a。
14.一方面,提供了一种核酸反式剪接分子。rtm包括以下以5'至3'方向操作性连接的:
15.(a)包含选定基因的一个或多个功能性外显子的编码序列结构域(cds);
16.(b)具有不同长度和/或组成的接头序列,所述接头序列充当所述编码结构域与结合结构域之间的结构连接,并且可以含有基序,所述基序用作剪接增强子;或具有折叠成复杂二级结构的能力,所述二级结构用以在反式剪接事件发生之前使编码区的翻译减到最少;或在rtm提前成熟情况下编码降解肽;
17.(c)被配置成用于起始剪接体介导的反式剪接的剪接体识别基序(剪接供体,sd,又称为5'剪接位点(5'ss));
18.(d)被设计成用于与所述选定基因的靶标内含子杂交的具有不同长度和序列的结合结构域(bd),其中所述基因在所述靶标内含子的5'端的外显子中具有至少一个缺陷或突变;以及
19.(e)3'转录终止子结构域(ttd),
20.其中所述核酸反式剪接分子被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。
21.在一个实施例中,所述结合结构域与在所述突变3'端的选定基因的靶标内含子杂交,并且所述编码结构域包含在所述靶标内含子5'端的一个或多个外显子。
22.另一方面,rtm包括以下以5'至3'方向操作性连接的:
23.(a)被设计成用于与所述选定基因的靶标内含子杂交的具有不同长度和序列的结合结构域(bd),其中所述基因在所述靶标内含子的3'端的外显子中具有至少一个缺陷或突变;
24.(b)具有不同长度和组成的接头序列,所述接头序列充当所述结合结构域与编码区之间的结构连接,并且含有基序,所述基序用作剪接增强子;或折叠成复杂二级结构,所
述二级结构阻碍作为反式剪接的竞争性事件的编码区翻译;或在rtm提前成熟情况下编码降解肽;
25.(c)被配置成用于介导反式剪接的3'剪接体识别基序((剪接受体,sa),又称为3'剪接位点(3'ss));
26.(d)包含所述选定基因的一个或多个功能性外显子的编码序列结构域(cds);以及
27.(e)3'转录终止子结构域(ttd),
28.其中所述核酸反式剪接分子被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。在一个实施例中,所述结合结构域结合至在所述突变3'端的选定基因的靶标内含子,并且所述编码结构域包含在所述靶标内含子5'端的一个或多个外显子。
29.在一个实施例中,3'转录终止子结构域是来自一个或多个含有3'转录终止子的长链非编码rna(lncrna)或其它核rna分子的序列,所述序列凝集成三螺旋3'钝端帽。
30.另一方面,提供了一种重组腺相关病毒(raav),所述raav包括本文所描述的rtm中的任一个。
31.另一方面,提供了一种治疗由靶标基因中的缺陷或突变引起的疾病的方法。所述方法包括向患有所述疾病的受试者的细胞施用包含重组aav的组合物,所述重组aav包含如本文所描述的核酸反式剪接分子。
32.在又另一方面,提供了一种药物制剂,所述药物制剂包含生理上可接受的载剂和如本文所描述的raav或rtm。
33.在以下详细描述中将描述其它方面和实施例。
附图说明
34.图1a-1e显示靶向来自人cep290的内含子26的rtm荧光素酶报告体构建体的图谱和部分序列。所述构建体编码荧光素酶编码序列(cds)的5'半部分以及不同的转录终止子序列:聚(a),即来自sv40的聚腺苷酸化信号,其在聚(a)信号裂解并添加非模板化聚(a)尾之后产生3'末端(图1a);hhrz,即锤头核糖核酸酶,其自裂解产生rtm的3'末端(图1b);comp14,即截短的malat1三螺旋终止子结构,其在核糖核酸酶p裂解之后产生rtm的3'末端(两种型式,即图1c、1d);以及comp14的mascrna结构域被hhrz替代的杂交物,其在核糖核酸酶自裂解之后产生rtm的3'末端(图1e)。
35.在图1a中(391.聚(a)),显示seq id no:31nt 2081-2600。在图1b(391.hhrz)中,显示seq id no:32nt 2081-2447。在图1c(391.comp14-v1)中,显示seq id no:33nt 2081-2470。在图1d(391.comp14-v2中,显示seq id no:34nt 2081-2470。在图1e(391.comp14.hhrz)中,显示seq id no:35nt 2081-2470。
36.图1f显示小基因的图谱和序列,该小基因含有与荧光素酶cds的3'半部分相融合的来自人cep290的内含子26。在图1f(pcdna_frt.in26 target.3'luc)中,显示seq id no:36nt 6761-7280。
37.图2a和2b显示如实例1中所论述,测量的图1a至1d中所描述的构建体的荧光素酶水平。rtm被递送至表达图1f中所显示的小基因的细胞系,所述小基因含有与荧光素酶cds
的3'半部分相融合的来自人cep290的内含子26。
38.图3a至3c显示靶向人abca4的内含子23的rtm构建体的图谱和部分序列。所述构建体包括针对abca4反式剪接活性测试的若干终止子序列中的一个:hhz,即锤头核糖核酸酶,其自裂解产生rtm的3'末端(图3a);c14或comp14,即malat1三螺旋结构的截短衍生物,其在核糖核酸酶p裂解之后产生rtm的3'末端(图3b);以及wt,即原始malat1三螺旋终止子,其在核糖核酸酶p裂解之后产生rtm的3'末端(图3c)。图3a显示seq id no:28中所示序列的一部分,其中5'ss(又称为sd或剪接结构域)在nt 4311处开始,并且绝缘子在nt 4591处终止。图3b显示seq id no:29中所示序列的一部分,其中5'ss(又称为sd或剪接结构域)在nt 4311处开始,并且mascrna在nt 4620处终止。图3c显示seq id no:30中所示序列的一部分,其中5'ss(又称为sd或剪接结构域)在nt 4311处开始,并且mascrna在nt 4654处终止。
39.图4a和4b是蛋白质印迹和其定量,显示了通过rtm介导的反式剪接产生的abca4蛋白质。图3中测试的rtm包括abca4内含子23(基序27和81)和内含子22(基序117和118)的结合结构域。nb是阴性对照非结合基序。
40.图5a显示含有来自lncrna的不同三螺旋终止子的rtm的蛋白质印迹分析。其包括来自malat1和neat1(menβ)的野生型序列,以及来自malat1的三螺旋结构域与来自neat1的trna样基序(称为menrna)融合的嵌合形式和来自neat1的三螺旋结构域与来自malat1的mascrna基序融合的嵌合形式。数据表明,当rtm含有野生型malat1终止子时,反式剪接活性最高。
41.图5b显示了包括malat1、menβ(neat1)和pan rna(由卡波济氏肉瘤(kaposi'ssarcoma)相关疱疹病毒kshv产生)在内的来自三种不同lncrna的三螺旋终止子的预测碱基配对情况。不同lncrna间的结构相似性表明在转录终止之后保护lncrna的3'端的常见进化策略。然而,malat1三螺旋结构域的x射线晶体学披露,该结构域含有10个大沟和2个小沟的三联体,其中大多数具有任何已知的天然存在的三螺旋结构(brown,j.a.等人,2014)。这种错综复杂的设计可能赋予超过neat1或pan的水平的结构稳定性,并且可以解释为何malat1终止子看来更好地支持反式剪接。借助于防止rtm在细胞核中降解。重要的是,如通过体内衰变测定(brown,j.a.,2014)所显示,malat1的钝端三螺旋可抑制快速核rna衰变。
42.图6a显示来自若干物种的malat1的高度保守的mascrna序列以及其预测折叠构象。红色箭头指示的g变为a的单点突变被插入mascrna序列中以测试这一结构域对于反式剪接活性的重要性。如蛋白质印迹(图6b)中所示,所述点突变消除所验证的靶向abca4的rtm的反式剪接活性。这可能是因为突变序列无法呈现核糖核酸酶p识别和裂解所需的正确构象。
43.图7显示了包括密码子优化的abca4编码序列和锤头核糖核酸酶(hhrz)的载体的载体图。序列显示于seq id no:28中。
44.图8显示了包括密码子优化的abca4编码序列、关于密码子1-23的malat1和截短的malat1 comp14 3'ttd序列的载体的载体图。序列显示于seq id no:29中。
45.图9显示了包括密码子优化的abca4编码序列、关于密码子1-23的malat1和wt malat1 3'ttd序列的载体的载体图。序列显示于seq id no:30中。
46.图10显示来自人malat1 lncrna的三螺旋区的图谱和序列。malat1的序列显示于seq id no:7中。所述三螺旋区在seq id no:7的8287处开始,并且mascrna在seq id no:7
的8437处终止。
具体实施方式
47.文献中报告的许多实验性反式剪接研究通常达不到有治疗意义的终点。这并不表明这些研究不重要,因为它们都展示出了rtm结合结构域和剪接位点信号的必要作用。而且,尽管这些基本元件确实很重要,但rna剪接的复杂性还涉及用于模板识别、剪接体组装的一系列额外顺式和反式作用因子,更别提可直接影响rtm分子的周转或定位的其它非剪接机制。由于反式剪接相对于顺式剪接处于竞争劣势,故rna反式剪接分子(rtm)的技术设计包括增加有利于rtm的优势的特征是有必要的。一种实现此目的的方式是通过增加细胞核中rtm的有效浓度或通过使rtm成为剪接体的更引人注目的靶标(通过顺式作用元件或定位)。
48.本公开的中心是rna反式剪接分子(rtm),所述rtm被设计成通过反式剪接反应特异性靶向所关注基因并递送其基因有效负载。结构上,rtm被组织成三个核心结构域:1)蛋白质编码区;2)与靶标基因rna转录物内的内含子杂交的结合结构域;以及3)将编码区连接至结合结构域的具有剪接信号(5'ss或3'ss)的接头序列。需要强调的是,这三个区域各自也具有功能作用。尽管对这些区域中任一个的修改在理论上都可能影响rtm活性,但结合结构域吸引了最多的注意力。实际上,文献中的大部分报告包括一定程度的筛选以鉴别最佳的结合序列。经显示,靶标序列的位置和长度将影响rtm活性。然而,没有证据表明序列特异性特征可能构成共有基序或有助于开发可能适用于不同基因靶标的结合结构域设计规则。因此,结合结构域一直是通过反复试验确定。
49.尚不清楚为何一些结合结构域要比其它结合结构域更好地作用。可能的解释涉及rna折叠,以及这可能如何影响用于杂交rtm的给定靶标序列的可获得性。rna折叠也可影响rtm结合结构域本身;即,如果结合结构域呈现复杂的二级结构,则其将不可用于与靶标内含子杂交。鉴于鉴别出了最佳的结合结构域,rtm仍遵守与细胞核中的其它rna相同的规则。而且,这可以不依赖于结合反应而影响rtm活性。在机理上,rtm必须在细胞核中具有长到足以允许结合反应发生的半衰期。如果rtm被转运出细胞核或被普遍存在的核中核糖核酸酶降解,这两个事件会明显降低有效rtm浓度,则反式剪接效率将减小。
50.长链非编码rna(lncrna)的生物学最近已变为生物医学研究和医学中引起极大关注的话题。这在很大程度上归因于观察到一些lncrna在某些癌症中显示上调。而且,尽管这种关系看来没有因果关系,但理解这些神秘rna的作用可以阐明它们在基因调控中的可能作用。与rtm相同,lncrna也是由rna聚合酶ii转录。而且,它们都面对相同的问题;3'端加工确保精确聚合酶终止和成熟转录物的功能性。对于rtm,大部分文献报告都使用了聚腺苷酸化信号进行3'端加工。然而,这种方法将rtm信号发送到细胞质,有效地减少核拷贝数并允许rtm表达具有未知生物后果的截短的蛋白质。产生截短的蛋白质的rtm表达,或有时称为rtm成熟,是不合需要的结果/具有未知生物后果的脱靶作用。相比之下,许多lncrna缺乏聚腺苷酸化信号并且实际上,依赖于用于polii终止的非标准3'端加工。其中有一些在3'端呈现简单的茎-环结构,相信所述结构有助于使成熟转录物(例如组蛋白mrna)稳定。而其它lncrna采用明显更复杂的二级结构。
51.lncrna已进化出用于核定位的蓝图,所述蓝图看来包括至少两种特征:1)核定位
信号和2)用于非标准3'端加工以避开核糖核酸酶降解,由此增加其稳定性的机制。经显示包括这两个特征的原型lncrna称为malat1(转移相关肺腺癌转录物1)。有趣的是,malat1的3'端在各物种间高度保守并且显示在核糖核酸酶p识别并裂解trna样结构之后凝集成三螺旋结构(wilutz等人,2012.《基因与发育(genes and develop.)》26:2392-2407)。相信这种三螺旋有助于使malat1转录物在核酸酶中稳定。
52.如本文所描述,将来自人malat1的3'末端三螺旋添加至研究用rtm中,所述研究用rtm靶向由cep290荧光素酶报告体编码的初级rna转录物或由内源abca4基因编码的初级rna转录物。在所有情况下,所述3'三螺旋终止子的存在明显增强反式剪接活性。这最初是利用3'末端三螺旋的117bp截短型式(称为comp14,如wilutz等人,2012中所描述)展示并且随后利用151bp天然序列(ncbi refseq:nr_002819)展示。
53.一方面,本文所描述的组合物和方法采用了使用腺相关病毒(aav)的基因疗法作为治疗遗传性基因病症的手段。更确切地说,本文中所描述的方法和组合物离体和在体内采用了前mrna反式剪接作为基因疗法来治疗由大基因的缺陷引起的疾病。在一个实施例中,这些组合物和方法克服了由包装至aav中的核酸局限于4700个核苷酸的包装限制所引起的问题。当包括产生有效raav治疗剂并表达rna反式剪接分子(rtm)所需的序列时,关于含有眼部基因序列的rtm的有效大小约束是约4000个核苷酸。这些方法和组合物特别适合治疗由如abca4、cep290和myo7a等超出aav中并入和表达所需大小的基因中的缺陷所引起的病症。
54.除非另外定义,否则本文所使用的技术和科学术语具有与本发明所属领域的普通技术人员参考公开的文本通常所理解相同的含义,这些术语为本领域的技术人员提供了本技术中使用的许多术语的大体指导。本文中所使用的定义仅出于清楚起见而提供且并不打算限制所要求的发明。
55.如此处所使用,“3'转录终止子结构域”或“3'ttd”是指定位于反式剪接分子的3'末端处的长链非编码rna(lncrna)。在一些情况下,3'ttd增加反式剪接效率。在一些情况下,转录终止子结构域包括表达和核保留元件(ene),所述ene当与富含a的区域(例如聚a尾)对准时可形成ene+a。
56.如本文所使用,“长链非编码rna”或“lncrna”是指长度超过200个核苷酸(例如长度超过300个核苷酸、长度超过400个核苷酸或长度超过500个核苷酸)的非蛋白质编码rna转录物。在一些实施例中,lncrna是200至300个核苷酸、300至400个核苷酸、400至500个核苷酸或超过500个核苷酸。
57.如本文所使用,术语“反式剪接效率”是指施用至细胞的每个反式剪接分子所产生的反式剪接的rna转录物的数量。因此,反式剪接效率反映反式剪接分子的稳定性以及核定位和保留。
58.如本文所使用,术语“三螺旋”、“三螺旋结构”和“三链体”以及其语法衍生形式可互换使用并且是指以通过胡斯坦碱基配对形成的堆叠的大沟三联体表征的聚核苷酸(例如rna)区域。在一些情况下,三螺旋包括通过胡斯坦碱基配对进行配对的多个(例如四个或更多个)连续核苷酸。在一些实施例中,所述三螺旋包括四个或更多个连续的腺苷核苷酸,其中所述连续腺嘌呤各自通过胡斯坦碱基配对与尿嘧啶配对(例如聚a区域与富含u的基序,例如堆叠的大沟三联体中富含u的基序对准)。
59.如本文所使用,术语“富含a的区域”是指至少80%的连续核酸是腺嘌呤(a)的连续核酸链。
60.如本文所使用,术语“富含u的基序”是指至少80%的连续核酸是尿嘧啶(u)的连续核酸链。
[0061]“核酸反式剪接分子”或“反式剪接分子”具有三个主要元件:(a)通过将反式剪接分子系栓至其靶标基因(例如前mrna)而赋予特异性的结合结构域;(b)剪接结构域(例如具有3'或5'剪接位点的剪接结构域);以及(c)被配置成用于反式剪接至靶标基因上的编码序列,所述编码序列可替代靶标基因中的一个或多个外显子(例如一个或多个突变的外显子)。“前mrna反式剪接分子”或“rtm”是指靶向前mrna的核酸反式剪接分子。在一些实施例中,反式剪接分子,如rtm,可包括cdna,例如作为功能性外显子的一部分以替代或校正突变的外显子。
[0062]
一个核酸在与另一核酸序列呈结构或功能关系时是“可操作地连接”的。例如,如果一个核酸序列与另一核酸序列在同一连续聚核苷酸上相对于彼此定位并且具有结构或功能关系,如形成三螺旋(例如通过胡斯坦碱基配对),则该一个核酸序列可操作地连接至该另一核酸序列。在一些情况下,可操作地连接的核酸序列是直接连接的(即,所述核酸序列直接地共价连接至另一核酸序列,而无间插核苷酸)。在其它情况下,可操作地连接的核酸序列并非直接连接的。在可操作地连接的核酸序列并非直接连接的情况下,这些核酸序列是通过接头序列操作性地连接(间接连接)。在一些情况下,接头序列可为1-1,000个碱基长(例如1-900个、1-800个、1-700个、1-600个、1-500个、1-400个、1-300个、1-250个、1-200个、1-150个、1-100个、1-90个、1-80个、1-70个、1-60个、1-50个、1-40个、1-30-个、1-20个、1-10个、1-8个、1-6个、1-5个、1-4个或1-3个碱基长,例如1-10个、10-15个、15-20个、20-30个、30-40个、40-50个、50-100个、100-150个、150-200个或200-500个碱基长)。在一些情况下,富含a的区域通过接头序列操作性地连接至富含u的基序的3'端。
[0063]
如本文所使用,术语“哺乳动物受试者”或“受试者”包括需要这些治疗或预防方法的任何哺乳动物,尤其包括人类。需要此类治疗或预防的其他哺乳动物包括狗、猫或其他家养动物、马、家畜、实验动物,包括非人类灵长类动物等。受试者可以是雄性或雌性。
[0064]
在一个实施例中,受试者发展由基因突变引起的病症或有发展由基因突变引起的病症的风险。在一个实施例中,受试者发展眼部病症或有发展眼部病症的风险。在另一个实施例中,受试者显示出眼部病症,特别是与基因abca4、cep290或myo7a中的缺陷或突变有关的病症的临床征象。
[0065]
术语“眼部病症”包括但不限于斯塔加特氏病(体染色体显性或体染色体隐性)、色素性视网膜炎、视杆-视锥营养不良、雷伯氏先天性黑蒙、尤塞氏综合征、巴迪特-别铎氏综合征(bardet-biedl syndrome)、贝斯特氏病(best disease)、视网膜劈裂症、未治疗的视网膜脱落、图形营养不良、视锥-视杆营养不良、全色盲、眼睛白化病、增强s视锥细胞综合征、糖尿病性视网膜病变、年龄相关黄斑变性、早产儿视网膜病、镰状细胞性视网膜病、先天性静止性夜盲、青光眼或视网膜静脉阻塞。在另一个实施例中,受试者发展青光眼、雷伯氏遗传性视神经病变、溶酶体贮积病或过氧化物酶体病症,或有发展这些疾病的风险。
[0066]
眼部疾病的临床征象包括但不限于周边视力下降、中心(阅读)视力下降、夜间视力下降、颜色感知丧失、视敏度下降、感光功能下降、色素变化。在另一个实施例中,受试者
已被诊断患有stgd1。在另一个实施例中,受试者已被诊断患有幼年发作性黄斑变性,即眼底黄色斑点症。在另一个实施例中,受试者已被诊断患有视锥-视杆营养不良。在另一个实施例中,受试者已被诊断患有色素性视网膜炎。在另一个实施例中,受试者已被诊断患有年龄相关黄斑变性(amd)。在另一个实施例中,受试者已被诊断患有lca10。在又一个实施例中,受试者尚未显示这些眼部病变的临床征象。
[0067]
如本文所使用,术语“治疗(treatment)”或“治疗(treating)”定义为以下一种或多种:在给定受试者中减少眼部疾病的发生或进展;预防疾病;降低疾病症状的严重程度;或延迟其进展;除去疾病症状;延缓疾病的发作;或监测疾病的进展或疗法的功效。
[0068]
如本文所使用,术语“选定细胞”是指被递送rtm的任何细胞或细胞类型(即,使用本文所提供的组合物和方法进行改变的所关注靶标)。在某些实施例中,所述选定细胞是原核细胞。在其它实施例中,所述选定细胞是真核细胞,其非限制性实例包括植物细胞和组织、动物细胞和组织,以及人体细胞和组织。细胞可来自现有细胞系,或其可为初代细胞,其中“初代细胞”、“初代细胞系”和“初代培养物”在本文中可互换使用,意思指来源于受试者并且允许在体外生长以实现培养物的有限次数传代的细胞和细胞培养物。选定细胞可以例如是癌细胞,但不限于此。在某些实施例中,对所述选定细胞进行离体操作,然后施用给受试者。在又其它实施例中,所述选定细胞作为体内靶标,例如通过将ravv递送给受试者来靶向所述细胞。在一些实施例中,术语“选定细胞”是指眼部细胞,这些细胞是与眼睛功能相关联的任何细胞,如感光细胞。在一些实施例中,所述术语是指视杆、视锥、光敏性神经节细胞、视网膜色素上皮(rpe)细胞、米勒细胞(mueller cell)、双极细胞、水平细胞或无长突细胞。一些基因靶标在眼睛中以及其它器官中表达。例如,cep290在肾脏上皮中和中枢神经系统中表达,并且my07a是在耳蜗毛细胞中表达。因此,选定细胞还可包括这些眼外细胞。在某些实施例中,所述选定细胞是骨骼肌细胞,例如红(慢)骨骼肌细胞、白(快)骨骼肌细胞或中间骨骼肌细胞。在某些实施例中,所述选定细胞是心脏肌肉细胞,例如心肌细胞或结节心脏肌肉细胞。在某些实施例中,所述选定细胞是平滑肌细胞。在某些实施例中,所述选定细胞是肌卫星细胞或肌肉干细胞。
[0069]
如本文所使用,术语“宿主细胞”可以指包装细胞系,在所述细胞系中,由质粒产生重组aav。在替代方案中,术语“宿主细胞”可以指希望表达转基因的靶标细胞。
[0070]
密码子优化是指修饰核酸序列以改变个别核酸,而不会在所编码的氨基酸中引起任何变化。这一程序可对本说明书中所描述的任一序列执行以增强表达或稳定性。密码子优化可通过例如以引用的方式并入本文中的美国专利第7,561,972号、第7,561,973号和第7,888,112号中所描述的方式执行,并将翻译起始位点周围的序列转化成共有kozak序列。参见kozak等人,《核酸研究(nucleic acids res.)》15(20):8125-8148,其以引用的方式并入本文中。在一个实施例中,编码序列经历密码子优化。
[0071]
术语“同源”是指两个核酸序列的序列之间的同一性程度。同源序列的同源性是通过比较在最佳条件下于所比较序列内对准的两个序列确定。本文中比较的序列可在最佳对准的两个序列中具有添加或缺失(例如空位等)。此类序列同源性可通过使用例如clustalw算法进行对准来计算(《核酸研究》,22(22):4673 4680(1994)。也可以使用可商购的序列分析软件,更确切地说vector nti、genetyx、blast或由公共数据库提供的分析工具。
[0072]
术语“药学上可接受的”意思指由联邦或州政府的管理机构批准或在美国药典或
其它普遍认可的药典中列出可用于动物并且更特定地用于人。
[0073]
术语“载剂”是指与合成物质一起施用的稀释剂、佐剂、赋形剂或媒剂。适合药物载剂的实例描述于e.w.martin的《雷氏药学大全(remington's pharmaceutical sciences)》中。
[0074]
术语“一个(种)”是指一个(种)或多个(种),例如“一个基因”应理解为表示一个或多个此类基因。因此,术语“一个(种)(a/an)”、“一个(种)或多个(种)”和“至少一个(种)”在本文中可互换使用。
[0075]
除非另有说明,否则如本文所使用,术语“约”意思指相对于给定参考值的
±
0.1至10%的变化。
[0076]
关于以下描述,预期本文所描述的组合物中的每一种在另一个实施例中都可用于本文所描述的治疗方法中。此外,还预期本文描述为可用于所述方法中的组合物中的每一种本身都是一个实施例。尽管说明书中的各种实施例是使用“包含”语言呈现,该语言包括其它组分或步骤,但在其它情况下,相关实施例也意图使用“由
……
组成”或“基本上由
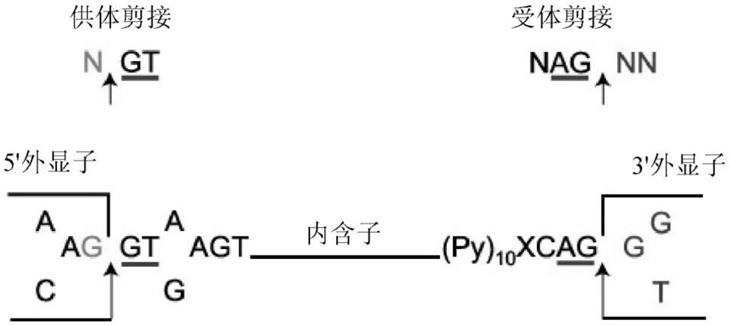
……
组成”语言解释和描述,该语言不包括明显改变所述实施例的所有或任何组分或步骤。
[0077]
前mrna反式剪接方法和分子
[0078]
在细胞内存在前mrna中间物,其包括非编码核酸序列,即内含子,以及编码形成基因产物的氨基酸的核酸序列。内含子散布于前mrna中基因的外显子之间,并且最后,当通过称为剪接体的蛋白质复合物将外显子接合在一起时,从所述前mrna分子切除。使用剪接体活性,可通过引入第二核酸来引入替代性外显子。剪接体介导的rna反式剪接(smart)被描述为采用工程改造的前mrna反式剪接分子(rtm),所述rtm特异性结合至细胞核中的靶标前mrna并在由剪接体介导的过程中触发反式剪接。这一方法描述于例如puttaraju m等人,1999,《自然
·
生物技术(nat biotechnol.)》,17:246-252;gruber c等人,2013年12月,《分子癌症学(mol.oncol.)》7(6):1056;avale me,2013年7月,《人类分子遗传学(hum.mol.genet.)》,22(13):2603-11;rindt h等人,2012年12月,《细胞和分子生命科学(cell mol.life sci.)》,69(24):4191;美国专利申请公开第2006/0246422号和第20130059901号,以及美国专利第6,083,702号、第6,013,487号、第6,280,978号、第7,399,753号和第8,053,232号中。这些文献以引用的方式并入本文中。
[0079]
本文所公开的核酸反式剪接分子可包括本领域中已知的核酸反式剪接分子的任何结构或功能特征以及相关方法,例如wo 2017/087900和wo 2019/2045114中所描述的那些,其各自以全文引用的方式并入本文中。
[0080]
在一些实施例中,本文所描述的rna反式剪接分子(rtm)具有五个主要元件。在一个实施例中,所述元件包括以5'至3'方向操作性地连接的:
[0081]
(a)包含选定基因的一个或多个功能性外显子的编码结构域(cd);
[0082]
(b)具有不同长度和序列的接头结构域(ld),所述ld充当所述编码结构域与结合结构域之间的结构连接,并且可以含有基序,所述基序用作剪接增强子;或具有折叠成复杂二级结构的能力,所述二级结构用以在反式剪接事件发生之前使编码区的翻译减到最少;或在rtm提前成熟情况下编码降解肽;
[0083]
(c)被配置成用于起始剪接体介导的反式剪接的剪接体识别基序(剪接供体,sd);
[0084]
(d)被配置成用于与所述选定基因的靶标内含子杂交的具有不同长度和序列的结
合结构域(bd),其中所述基因在所述靶标内含子的5'端的外显子中具有至少一个缺陷或突变;以及
[0085]
(e)增加反式剪接的效率的3'转录终止子结构域(ttd)。
[0086]
所述核酸反式剪接分子被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。
[0087]
在另一个实施例中,所述元件包括以5'至3'方向操作性地连接的:
[0088]
(a)被配置成用于结合选定基因的靶标内含子的结合结构域(bd),其中所述基因在所述靶标内含子的3'端的外显子中具有至少一个缺陷或突变;
[0089]
(b)具有不同长度和组成的接头序列,所述接头序列充当所述结合结构域与编码区之间的结构连接,并且含有基序,所述基序用作剪接增强子;或折叠成复杂二级结构,所述二级结构阻碍作为反式剪接的竞争性事件的编码区翻译;或在rtm提前成熟情况下编码降解肽;
[0090]
(c)被配置成用于介导反式剪接的3'剪接体识别基序(剪接受体,sa);
[0091]
(d)包含所述选定基因的一个或多个功能性外显子的编码结构域(cd);以及
[0092]
(e)增加反式剪接的效率的3'转录终止子结构域(ttd)。
[0093]
编码结构域序列(cds)
[0094]
本文所描述的rtm的编码结构域包括野生型编码序列中打算反式剪接至靶标前mrna的部分。“野生型编码序列”意思指当翻译和组装时提供功能蛋白质的序列。表达或功能不必与野生型蛋白质具有相同的水平。在一个实施例中,野生型编码序列被修饰,例如通过密码子优化进行修饰。
[0095]
前rna反式剪接分子(rtm)被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。取决于rtm的配置,cds可在结合结构域的3'端或5'端提供选定基因的一些或全部外显子。例如,对于5'反式剪接反应,在bd的5'端的外显子的全部或一部分被替代。对于3'反式剪接反应,在bd的3'端的外显子的全部或一部分被替代。rtm的设计允许用核酸序列,即一个或多个具有不含缺陷或突变的正常序列的外显子替代一个或多个前mrna外显子的缺陷或突变部分。“正常”序列可以是天然存在的野生型序列或具有不会引起疾病的某一其它修饰,例如密码子修饰的校正的序列。
[0096]
在一个实施例中,编码结构域是靶标基因的单个外显子,其含有缺乏致病突变的正常野生型序列,例如abca4的外显子22。在另一个实施例中,编码结构域包括含多个致病突变的多个外显子,例如abca4的外显子1-22。取决于待校正的外显子的位置,rtm可以含有位于靶标基因的5'或3'端的多个外显子,或rtm可被设计用于替代在所述基因中间的外显子。对于在raav中使用和递送,除非这一技术涉及长度小于3000个核苷酸的较小眼部基因,否则不可使用眼部基因的整个编码序列作为rtm的编码结构域。如本文所描述,为替代整个大基因,可在不同raav粒子中使用两个rtm,即3'和5'rtm。
[0097]
本文所描述的rtm可包含编码本文所鉴别的一个或多个外显子并以含有与相关疾病有关的基因突变或缺陷为特征的编码结构域,例如abca4的外显子27可以作为设计用于治疗斯特格氏病的rtm的编码结构域。在本文的表1至3中,标识出靶标基因和含有可能致病
的突变的外显子的名称。
[0098]
在一个实施例中,5'rtm的编码结构域被设计用于替代在靶标基因5'部分中的外显子。在另一个实施例中,3'rtm的编码结构域被设计用于替代在基因3'部分中的外显子。在另一个实施例中,编码结构域是位于基因内部的一个或多个外显子并且编码结构域位于双重反式剪接rtm中。
[0099]
因此,例如,有三种可能类型的rtm可用于治疗由例如abca4中的缺陷引起的疾病:包括5'剪接位点的5'反式剪接rtm。在反式剪接之后,5'rtm将变为靶标mrna的5'区;包括3'剪接位点的3'rtm,其用于反式剪接并替代靶标mrna的3'区;以及双重反式剪接rtm,其携带多个结合结构域以及3'和5'剪接位点。在反式剪接之后,这一rtm替代加工后的靶标mrna中的内部外显子。在其它实施例中,编码结构域可包括含天然存在或人工引入的终止密码子以便减少基因表达的外显子;或rtm可含有产生rnai样作用的其它序列。
[0100]
对于用于治疗斯特格氏病,abca4的适合编码区是独立rtm中的外显子1-22或27-50。对于用于治疗lca10,cep290的适合编码区是独立rtm中的外显子1-26或外显子27-54。对于用于治疗尤塞氏综合征,myo7a的适合编码区是独立rtm中的外显子1-18或33-49。
[0101]
根据本文所提供的教导,本领域的技术人员可构建其它编码结构域以替代由5'rtm和3'rtm和/或双重剪接rtm所提供的片段中的所有基因。
[0102]
接头结构域(ld)
[0103]
在一些实施例中,本文所描述的rtm包括具有不同长度和序列的接头结构域(ld),所述ld充当编码结构域与结合结构域之间的结构连接。在一个实施例中,ld含有用作剪接增强子的一个或多个基序。在一个实施例中,ld提供一个或多个基序,所述基序具有折叠成复杂二级结构的能力,所述二级结构用以在反式剪接事件发生之前使编码区的翻译减到最少。
[0104]
在一个实施例中,接头序列是ccgaatacgacacgtagcaagatct。
[0105]
剪接体识别基序(剪接供体(sd)和剪接受体(sa))
[0106]
取决于rtm(5'或3')方向,rtm包括剪接体识别基序,所述基序是剪接供体(sd)、剪接受体(sa)或两者。
[0107]
内含子在两端始终具有两个不同的核苷酸。在5'端,dna核苷酸是gt[前信使rna(前mrna)中的gu];在3'端,所述dna核苷酸是ag。这些核苷酸是剪接位点的一部分。sd是在内含子开始处,即在内含子5'左端的剪接位点,并且有时称为5'剪接位点或5'ss。sa是在内含子结束处,即在内含子3'右端的剪接位点,并且有时称为3'剪接位点或3'ss。
[0108]
[0109]
简单点说,剪接结构域提供被剪接体识别的必不可少的共有基序。bp和ppt的使用遵循执行顺式剪接以及可能地反式剪接所涉及的两个磷酰基转移反应所需的共有序列。在一个实施例中,哺乳动物中的分支点共有序列是ynyurac(y=嘧啶;n=任何核苷酸)。加下划线的a是分支形成的位点。聚嘧啶区域位于分支点与剪接位点受体之间并且对于不同分支点利用和3'剪接位点识别至关重要。rna剪接中使用的5'剪接供体位点和3'剪接区的共有序列是本领域中众所周知的。此外,也可使用修饰过的共有序列,所述共有序列维持用作5'供体剪接位点和3'剪接区的能力。简单点说,在一个实施例中,5'剪接位点共有序列是核酸序列ag/guragu(其中/指示剪接位点)。在另一个实施例中,可采用对应于剪接位点附近的外显子的内源剪接位点来维持任何剪接调控信号。在一个实施例中,abca4 5'rtm使用内源内含子22 5'剪接位点,所述rtm含有作为编码区的编码外显子1-22的序列和与内含子22中的区域互补的结合结构域。在另一个实施例中,abca4 3'rtm使用了内源内含子26 3'剪接位点,所述rtm编码外显子27-50并具有与内含子26互补的结合结构域。
[0110]
在一个实施例中,具有间隔子的适合5'剪接位点是:5'-gta aga gag ctc gtt gcg ata tta t-3'seq id no:1。在一个实施例中,适合5'剪接位点是aggt。
[0111]
在一个实施例中,适合3'rtm bp是5'-tactaac-3'(seq id no:2)。在一个实施例中,适合3'剪接位点是:5'-tac taa ctg gta cct ctt ctt ttt ttt ctg cag-3'seq id no:2或5'-caggt-3'(seq id no:4)。在一个实施例中,适合3'rtm ppt是5'-tgg tac ctc ttc ttt ttt ttc tg-3'seq id no:5。
[0112]
结合结构域(bd)
[0113]
rtm包括被配置成用于与选定基因的靶标内含子杂交的具有不同长度和序列的结合结构域(bd)。在一个实施例中,结合结构域是这样一种核酸序列,该核酸序列与靶标前mrna序列互补以抑制内源性靶标顺式剪接,同时增强反式剪接分子与靶标前mrna之间的反式剪接,例如以产生具有内源性mrna的一部分和含一个或多个功能性外显子的编码结构域的嵌合分子。在一些实施例中,结合结构域相对于靶标内含子序列呈反义取向。
[0114]
5'反式剪接分子一般将结合在突变3'端的靶标内含子,而3'反式剪接分子一般将结合在突变5'端的靶标内含子。在一个实施例中,结合结构域包含与靶标内含子互补的序列的一部分。在本文中的一个实施例中,结合结构域是与最接近(即,邻近于)所校正的外显子序列的内含子互补的核酸序列。
[0115]
在另一个实施例中,结合结构域被靶向非常接近于靶标内含子的3'或5'剪接信号的内含子序列。在再另一个实施例中,结合结构域序列可结合至靶标内含子以及相邻外显子的一部分。
[0116]
因此,在一些情况下,结合结构域特异性结合至突变的内源性靶标前mrna以将反式剪接分子的编码结构域锚定至前mrna,由此允许在靶标基因中的正确位置进行反式剪接。接着,细胞核的剪接体加工机构可介导针对致病性突变外显子的校正外显子的成功反式剪接。
[0117]
在某些实施例中,反式剪接分子的特征在于在靶标前mrna上含有结合多于一个位置的序列的结合结构域。所述结合结构域可以含有稳定结合至靶标前mrna以允许与编码结构域发生反式剪接所需的多种核苷酸。在一个实施例中,结合结构域是使用针对可接近环的mfold结构分析选择(zuker,《核酸研究》2003,31(13):3406-3415)。
[0118]
适合靶标结合结构域的长度可以是10至500个核苷酸。在一些实施例中,所述结合结构域的长度是20至400个核苷酸。在一些实施例中,所述结合结构域的长度是50至300个核苷酸。在一些实施例中,所述结合结构域的长度是100至200个核苷酸。在一些实施例中,结合结构域是10-20个核苷酸长(例如10、11、12、13、14、15、16、17、18、19或20个核苷酸长)、20-30个核苷酸长(例如20、21、22、23、24、25、26、27、28、29或30个核苷酸长)、30-40个核苷酸长(例如30、31、32、33、34、35、36、37、38、39或40个核苷酸长)、40-50个核苷酸长(例如40、41、42、43、44、45、46、47、48、49、50个核苷酸长)、50-60个核苷酸长(例如50、51、52、53、54、55、56、57、58、59或60个核苷酸长)、60-70个核苷酸长(例如60、61、62、63、64、65、66、67、68、69或70个核苷酸长)、70-80个核苷酸长(例如70、71、72、73、74、75、76、77、78、79或80个核苷酸长)、80-90个核苷酸长(例如80、81、82、83、84、85、86、87、88、89或90个核苷酸长)、90-100个核苷酸长(例如90、91、92、93、94、95、96、97、98、99或100个核苷酸长)、100-110个核苷酸长(例如100、101、102、103、104、105、106、107、108、109或110个核苷酸长)、110-120个核苷酸长(例如110、111、112、113、114、115、116、117、118、119或120个核苷酸长)、120-130个核苷酸长(例如120、121、122、123、124、125、126、127、128、129或130个核苷酸长)、130-140个核苷酸长(例如130、131、132、133、134、135、136、137、138、139或140个核苷酸长)、140-150个核苷酸长(例如140、141、142、143、144、145、146、147、148、149或150个核苷酸长)、150-160个核苷酸长(例如150、151、152、153、154、155、156、157、158、159或160个核苷酸长)、160-170个核苷酸长(例如160、161、162、163、164、165、166、167、168、169或170个核苷酸长)、170-180个核苷酸长(例如170、171、172、173、174、175、176、177、178、179或180个核苷酸长)、180-190个核苷酸长(例如180、181、182、183、184、185、186、187、188、189或190个核苷酸长)、190-200个核苷酸长(例如190、191、192、193、194、195、196、197、198、199或200个核苷酸长)、200-210个核苷酸长、210-220个核苷酸长、220-230个核苷酸长、230-240个核苷酸长、240-250个核苷酸长、250-260个核苷酸长、260-270个核苷酸长、270-280个核苷酸长、280-290个核苷酸长、290-300个核苷酸长、300-350个核苷酸长、350-400个核苷酸长、400-450个核苷酸长或450-500个核苷酸长。在一些实施例中,所述结合结构域的长度是约150个核苷酸。在另一个实施例中,靶标结合结构域可包括长度是至多750个核苷酸的核酸序列。在另一个实施例中,靶标结合结构域可包括长度是至多1000个核苷酸的核酸序列。在另一个实施例中,靶标结合结构域可包括长度是至多2000个核苷酸或更多的核酸序列。
[0119]
在一些实施例中,通过增加靶标结合结构域的长度可增加反式剪接分子的特异性。取决于反式剪接分子中其它组分的长度,也可使用其它长度。
[0120]
结合结构域可与靶标内含子具有80%至100%互补性以便能与靶标内含子稳定杂交。例如,在一些实施例中,结合结构域与靶标内含子具有80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补性。互补性程度是由本领域的技术人员基于将反式剪接分子以及含有表达和包括在raav中所需序列的核酸构建体保持在3,000个或至多4,000个核苷酸碱基的限值内的要求进行选择。这一序列和杂交强度的选择取决于核酸的互补性和长度。
[0121]
在一个实施例中,bd靶向内含子23,即abca4的基序81。在一个实施例中,所述序列是:seq id no:6:tcactgtttaatctgttaattcatctgagcattttgagggtg tagtcgcttgattttatcctagagagtgtgtgagtcacacacagagaggagcagaa cctccaagggtccctttggcttgtcatcaattatgtg
gcagctgtaggttct。
[0122]
3'转录终止子结构域(ttd)
[0123]
本文所描述的rtm含有3'转录终止子结构域(ttd),例如增加反式剪接的效率的3'ttd。在一个实施例中,ttd包含以下序列中的一个或多个:参与形成三链体(在本文中又称为“三螺旋”或“三螺旋结构”)的序列、核糖核酸酶p裂解位点、用作核糖核酸酶p裂解的模板的trna样结构(在本文中又称为trna样结构域、结构或序列)以及可促进这些结构域独立地或一起地折叠的任何侧接序列。此类侧接序列可以是人工接头、来源于另一个序列的接头或来自原始lncrna的侧接序列。在一个实施例中,3'转录终止子结构域形成三螺旋结构,该结构有效地对3'端戴帽或保护3'端免于被核酸酶降解。如本文所论述,trna样结构域也可包括核糖核酸酶p裂解位点。
[0124]
长链非编码rna在基因表达中充当重要的调控介体。经显示,一些lncrna具有由trna样结构被核糖核酸酶p的非标准识别和裂解而产生的3'端。在一些情况下,经显示,高度保守的三螺旋结构保护一些lncrna免受3'-5'核酸内切酶影响。如本文所提供,某些lncrna的3'末端序列能够并入rtm中作为末端结构域(ttd),由此能够增加反式剪接的效率。在一个实施例中,ttd是来自一个或多个含有3'转录终止子的长链非编码rna(lncrna)或其它核rna分子的序列,所述序列凝集成三螺旋3'端帽。在一个实施例中,ttd序列来自人长链非编码rna malat1。在另一个实施例中,ttd序列来自人lncrna menβ。在一个实施例中,ttd包括人malat1(seq id no:7)的核苷酸8287-8437。在另一个实施例中,ttd以5'至3'次序包括:包含seq id no:7的核苷酸8287-8379的三链体形成序列;;包含seq id no:7的核苷酸8379-8380的核糖核酸酶p裂解位点;以及包含seq id no:7的核苷酸8380-8437的trna样序列。
[0125]
在一些实施例中,3'ttd以5'至3'方向(直接或间接地连接)包含5'富含u的基序、茎-环基序、3'富含u的基序和富含a的区域(例如聚a尾)。在一些情况下,所述富含a的区域能够与5'富含u的基序进行胡斯坦碱基配对。在一些实施例中,一条或两条茎链是约8-20个碱基对长(例如9-16个、10-14个或11-23个碱基对长)。在一些实施例中,所述5'富含u的基序和所述3'富含u的基序各自包含至少五个连续尿嘧啶。在一些实施例中,所述5'富含u的基序和所述3'富含u的基序各自是5-15个碱基对长。
[0126]
在一些实施例中,3'ttd以5'至3'方向包含:包含五个连续尿嘧啶的5'富含u的基序、至少一个茎链的长度是约16个碱基对的茎-环基序、包含五个连续尿嘧啶的3'富含u的基序以及包含至少18个腺嘌呤的富含a的区域。在一些实施例中,3'ttd包含seq id no:14。在一些实施例中,3'ttd包含seq id no:13。
[0127]
在一些实施例中,3'ttd以5'至3'方向包含:包含seq id no:18的5'富含u的基序、至少一个茎链的长度是约13个核苷酸的茎-环基序、包含seq id no:19的3'富含u的基序以及包含seq id no:20的富含a的区域。在一些实施例中,3'ttd包含seq id no:16。在一些实施例中,3'ttd包含seq id no:15。
[0128]
在一些实施例中,3'ttd以5'至3'方向包含seq id no:18、seq id no:19和seq id no:20。在一些实施例中,3'ttd包含seq id no:17。
[0129]
在一些实施例中,3'ttd以5'至3'方向包含:包含seq id no:23的5'富含u的基序、至少一个茎链的长度是约13个核苷酸的茎-环基序、包含seq id no:24的3'富含u的基序以
及包含seq id no:25的富含a的区域。在一些实施例中,3'ttd包含seq id no:24。在一些实施例中,3'ttd包含seq id no:23。
[0130]
在一些实施例中,3'ttd的长度在200个与1000个核苷酸之间(例如其长度是200至900个、200至800个、200至700个、200至600个、200至500个、200至400个或200至300个核苷酸)。
[0131]
三链体形成结构
[0132]
在一个实施例中,三螺旋结构是由富含a的基序(例如富含a的区域)以及上游(例如5')两个富含u的基序和茎-环结构形成。如本文中所例示,这些序列在转移相关肺腺癌转录物1(malat1)中,即在与某些癌症相关的lncrna中在进化上具有高度保守性。在menβ长链核保留非编码rna的3'端存在类似的高度保守的富含a和富含u的基序,所述menβ长链核保留非编码rna又称为neat1_2,其3'端也通过核糖核酸酶p加工。经显示,这些高度保守的富含a和富含u的基序形成对保护malat1的3'端免受3'-5'核酸外切酶影响至关重要的三螺旋结构。
[0133]
多个三螺旋可用于工程改造本文所描述的构建体中的任一种。此类三螺旋包括ene+a、核糖开关(riboswitch)和端粒酶三螺旋(参见例如brown等人,《自然-结构与分子生物学(nature structural and molecular biology)》21,633-642,2014,其以引用的方式并入本文中)。例如,已描述人malat1(brown等人,《自然-结构与分子生物学(nat.struct.mol.biol.)》,7,633-40,2014.)、kshv pan(mitton-fry等人,《科学(science)》,330,1244-7,2010)、人menβ(brown等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》,109,19202-7,2012)、多食棘阿米巴拟虫病毒(acanthamoeba polyphaga mimivirus)(tycowski等人,《细胞报告(cell rep.)》,2,26-32,2012)、集盘绒茧蜂病毒(cotesia congregata bracovirus)(tycowski等人,《细胞报告》,2,26-32,2012)、大螟绒茧蜂病毒(cotesia sesamiae bracovirus)(tycowski等人,《细胞报告》,2,26-32,2012)、马疱疹病毒2(ehv2)(tycowski等人,《细胞报告》,2,26-32,2012)、小珀蝽象(plautia stali)肠病毒(psiv)(tycowski等人,《细胞报告》,2,26-32,2012)及恒河猴细长病毒pan(rrv)(tycowski等人,《细胞报告》,2,26-32,2012)的ene+a三螺旋。其它例示性三螺旋包括核糖开关三螺旋,所述核糖开关三螺旋已关于来自鼠李糖乳杆菌(lactobacillales rhamnosus)的preq
1-ii核糖开关(liberman等人,《自然-化学生物学(nat.chem.biol.)》,9,353-5,2013)和马尾藻海(sargasso sea)宏基因组中所发现的sam-ii核糖开关(gilbert等人,《自然-结构与分子生物学》,15,177-82,2008)描述。在又另一个实例中,已描述人(theimer等人,《分子与细胞蛋白质组学(mol cell)》,17、671-82,2005)和乳酸克鲁维酵母菌(kluyveromyces lactis)(cash等人,《美国国家科学院院刊》,110,10970-5,2013)的端粒酶三螺旋。
[0134]
在一个实施例中,rtm含有三链体形成序列,该序列包含富含u的基序1(例如5'富含u的基序)、保守茎-环、富含u的基序2(例如3'富含u的基序)和富含a的区域(例如作为聚a尾的一部分),其中所述富含a的区域与所述富含u的基序2形成沃森-克里克茎双链体(watson-crick stem duplex),并且所述富含u的基序1与所述富含a的区域对准而形成胡斯坦碱基对。(buske等人,2012;beal和dervan,1991),其以引用的方式并入本文中。在一个实施例中,所述序列来自人malat1。因此,在一个实施例中,rtm含有三链体形成序列,该序
列包含富含u的基序1(人malat1的8292-8301)、保守茎-环(人malat1的8302-8333)、富含u的基序2(人malat1的8334-8343)和富含a的区域(人malat1的8369-8379),其中所述富含a的区域与所述富含u的基序2形成沃森-克里克茎双链体,并且所述富含u的基序1与所述富含a的区域对准而形成胡斯坦碱基对。
[0135]
在另一个实施例中,本文所描述的3'ttd具有新颖设计,该设计是通过理论建模和/或通过延伸天然存在的序列得到。在一个实施例中,ttd以5'至3'次序包含:具有不同长度和组成的三链体形成序列、核糖核酸酶p裂解位点以及具有不同长度和组成的trna样序列。在一个实施例中,三链体形成序列符合三个已知的基础“基序”中的一个,并且由三螺旋中第三条链的碱基组成指代:嘧啶基序(t、c)、嘌呤基序(g、a)和嘌呤-嘧啶基序(g、t)(buske fa,bauer dc,mattick js,bailey tl.2012.triplexator:在基因组和转录组数据中检测核酸三螺旋(triplexator:detecting nucleic acid triple helices in genomic and transcriptomic data.),《基因组研究(genome res.)》22:1372-1382;beal pa,dervan pb.1991.通过寡核苷酸引导的三螺旋形成来识别dna的第二结构基序(second structural motif for recognition of dna by oligonucleotide-directed triple-helix formation)《科学》251:1360-1363,其均以引用的方式并入本文中)。
[0136]
在另一个实施例中,ttd是人malat1三螺旋的截短型式。在一个实施例中,ttd含有三链体形成序列,该序列包含富含u的基序1(人malat1的8292-8301)、保守茎-环(人malat1的8302-8310和8325-8333)、富含u的基序2(人malat1的8334-8343)、富含a的区域(人malat1的8369-8379)和跨越在富含u的基序2与富含a的区域之间的间插序列的人malat1的核苷酸8345-8364的缺失,其中所述富含a的区域与所述富含u的基序2形成沃森-克里克茎双链体,并且所述富含u的基序1与所述富含a的区域对准以形成胡斯坦碱基对。
[0137]
在一个实施例中,三螺旋结构来源于lncrna。在一个实施例中,三螺旋结构来源于malat1。由于malat1序列在进化上高度保守,故malat1序列可来自任何物种。在一个实施例中,malat1序列来自人。在另一个实施例中,malat1序列来自小鼠。在另一个实施例中,malat1序列来自非人类灵长类动物。在另一个实施例中,malat1序列来自狗。在另一个实施例中,malat1序列来自大象。在另一个实施例中,malat1序列来自负鼠。在另一个实施例中,malat1序列来自鱼。此类序列是本领域中已知的且可见于例如genbank。在一个实施例中,malat1序列是seq id no:7。
[0138]
在另一个实施例中,三螺旋序列是作为天然序列的截短或修饰型式提供,只要该序列保留折叠成所需三螺旋结构的能力即可。
[0139]
在一个实施例中,三螺旋结构来源于menβ。menβ序列可来自任何物种。在一个实施例中,menβ序列来自人。在另一个实施例中,menβ序列来自小鼠。在另一个实施例中,menβ序列来自非人类灵长类动物。在另一个实施例中,menβ序列来自狗。在另一个实施例中,menβ序列来自大象。在另一个实施例中,menβ序列来自负鼠。在另一个实施例中,menβ序列来自鱼。此类序列是本领域中已知的且可见于例如genbank。
[0140]
在另一个实施例中,三螺旋序列是作为天然序列的截短或修饰型式提供,只要该序列保留折叠成所需三螺旋结构的能力即可。在一个实施例中,menβ序列是seq id no:8。
[0141]
在一些实施例中,三螺旋包括四至100个通过胡斯坦碱基配对进行配对的连续腺苷(例如四至80个通过胡斯坦碱基配对进行配对的连续腺苷、四至60个通过胡斯坦碱基配
对进行配对的连续腺苷、四至50个通过胡斯坦碱基配对进行配对的连续腺苷、四至40个通过胡斯坦碱基配对进行配对的连续腺苷、四至30个通过胡斯坦碱基配对进行配对的连续腺苷、四至20个通过胡斯坦碱基配对进行配对的连续腺苷、四至18个通过胡斯坦碱基配对进行配对的连续腺苷、四至15个通过胡斯坦碱基配对进行配对的连续腺苷、四至12个通过胡斯坦碱基配对进行配对的连续腺苷、四至11个通过胡斯坦碱基配对进行配对的连续腺苷、四至10个通过胡斯坦碱基配对进行配对的连续腺苷、四至九个通过胡斯坦碱基配对进行配对的连续腺苷、四至八个通过胡斯坦碱基配对进行配对的连续腺苷、四至七个通过胡斯坦碱基配对进行配对的连续腺苷或四至六个通过胡斯坦碱基配对进行配对的连续腺苷,例如五至50个通过胡斯坦碱基配对进行配对的连续腺苷、五至40个通过胡斯坦碱基配对进行配对的连续腺苷、五至30个通过胡斯坦碱基配对进行配对的连续腺苷、五至20个通过胡斯坦碱基配对进行配对的连续腺苷、五至18个通过胡斯坦碱基配对进行配对的连续腺苷、五至15个通过胡斯坦碱基配对进行配对的连续腺苷、五至12个通过胡斯坦碱基配对进行配对的连续腺苷、五至10个通过胡斯坦碱基配对进行配对的连续腺苷、五至九个通过胡斯坦碱基配对进行配对的连续腺苷、五至八个通过胡斯坦碱基配对进行配对的连续腺苷、五至七个通过胡斯坦碱基配对进行配对的连续腺苷或五至六个通过胡斯坦碱基配对进行配对的连续腺苷,例如六至八个通过胡斯坦碱基配对进行配对的连续腺苷、八至10个通过胡斯坦碱基配对进行配对的连续腺苷、10至12个通过胡斯坦碱基配对进行配对的连续腺苷、12至14个通过胡斯坦碱基配对进行配对的连续腺苷、14至16个通过胡斯坦碱基配对进行配对的连续腺苷、16至18个通过胡斯坦碱基配对进行配对的连续腺苷、18至20个通过胡斯坦碱基配对进行配对的连续腺苷、20至30个通过胡斯坦碱基配对进行配对的连续腺苷、30至40个通过胡斯坦碱基配对进行配对的连续腺苷或40至50个通过胡斯坦碱基配对进行配对的连续腺苷)。
[0142]
在一些实施例中,三螺旋包括连续核苷酸的链,其中至少90%的核苷酸通过胡斯坦碱基配对进行配对(例如至少90%的核苷酸通过胡斯坦碱基配对进行配对,至少91%的核苷酸通过胡斯坦碱基配对进行配对,至少92%的核苷酸通过胡斯坦碱基配对进行配对,至少93%的核苷酸通过胡斯坦碱基配对进行配对,至少94%的核苷酸通过胡斯坦碱基配对进行配对,至少95%的核苷酸通过胡斯坦碱基配对进行配对,至少96%的核苷酸通过胡斯坦碱基配对进行配对,至少97%的核苷酸通过胡斯坦碱基配对进行配对,至少98%的核苷酸通过胡斯坦碱基配对进行配对,至少99%的核苷酸通过胡斯坦碱基配对进行配对,或100%的核苷酸通过胡斯坦碱基配对进行配对)。
[0143]
结构域2-trna样结构
[0144]
本文所描述的trna样结构是这样一类序列,所述序列形成trna样三叶草二级结构,使其能够被核糖核酸酶p、核糖核酸酶z和cca添加酶中的一种或多种识别。
[0145]
malat1的trna样结构称为mascrna(malat1相关小胞质rna)。这一序列是61nt长并且显示于seq id no:9中。mascrna的trna样结构通过进化而得到保持,因为在小鼠与人直系同源物之间的四个错配维持三叶草式二级结构。尽管结构类似于trna并且含有较为保守的b盒,但所述61nt的mascrna转录物小于大多数trna(约76nt)并具有保守性相对较弱的小反密码子环。wilusz等人,《细胞(cell.)》2008年11月28日;135(5):919-932,以引用的方式并入本文中。menβ的trna样结构称为menrna。zhang等人,2017,《细胞报告》19,1723-1738,
其以引用的方式并入本文中。
[0146]
在一个实施例中,trna样结构来源于lncrna。在一个实施例中,trna样结构来源于malat1。由于malat1序列在进化上高度保守,故malat1序列可来自任何物种。在一个实施例中,malat1序列来自人。在另一个实施例中,malat1序列来自小鼠。在另一个实施例中,malat1序列来自非人类灵长类动物。在另一个实施例中,malat1序列来自狗。在另一个实施例中,malat1序列来自大象。在另一个实施例中,malat1序列来自负鼠。在另一个实施例中,malat1序列来自鱼。此类序列是本领域中已知的且可见于例如genbank。
[0147]
在另一个实施例中,trna样序列是作为天然序列的截短或修饰型式提供,只要该序列保留折叠成所需trna样结构的能力即可。
[0148]
在一个实施例中,trna样结构来源于menβ。menβ序列可来自任何物种。在一个实施例中,menβ序列来自人。在另一个实施例中,menβ序列来自小鼠。在另一个实施例中,menβ序列来自非人类灵长类动物。在另一个实施例中,menβ序列来自狗。在另一个实施例中,menβ序列来自大象。在另一个实施例中,menβ序列来自负鼠。在另一个实施例中,menβ序列来自鱼。此类序列是本领域中已知的且可见于例如genbank。
[0149]
在另一个实施例中,trna样序列是作为天然序列的截短或修饰型式提供,只要该序列保留折叠成所需trna样结构的能力即可。
[0150]
ttd的组分可源自相同或不同lncrna,包括来自不同物种的lncrna同源物。例如,三螺旋结构域和trna样结构域可源自来源于人类或任何其他物种的相同长链非编码rna或长链非编码rna结构域的不同组合。在一个实施例中,三螺旋结构域和trna样结构域来自malat1或neat1/menβ。
[0151]
靶标基因
[0152]
靶标基因是含有一个或多个引起眼部疾病的缺陷或突变的基因。在本文所描述的一个实施例中,靶标基因是具有已知会引起疾病或病症的缺陷的哺乳动物基因。
[0153]
基因和所编码蛋白质的野生型序列和/或基因组和染色体序列是从公开可用的数据库得到并且其寄存编号提供于本文中。除这些公开的序列外,还包括随后获得的所有校正或出现在人类或其他哺乳动物群体中的天然存在的保守和非致病性变体序列。此外,还包括保守性核苷酸替代或引起密码子优化的那些。还可以使用以数据库寄存编号提供的序列搜索相同或另一哺乳动物生物体中的同源序列。
[0154]
预期本文中标识的靶标眼部核酸序列和所得到的蛋白质截短物或氨基酸片段可在核酸水平上容许某些少量修饰以包括例如对沉默核苷酸碱基的修饰,例如偏好密码子。在其它实施例中,预期改变氨基酸,例如以改善所得肽/蛋白质的表达的核酸碱基修饰。还包括由遗传密码的天然简并性引起的等位基因变化作为对片段的可能修饰。
[0155]
也包括本文所提供的所编码的蛋白质片段的类似物或修饰型式作为对选定基因的修饰。典型地,这些类似物不同于仅通过一至四个密码子变化特异性鉴别的蛋白质。保守替代是在侧链和化学特性方面相关的一系列氨基酸内进行的那些。
[0156]
编码正常基因的核酸序列可来源于天然地表达所述基因或其同源物的任何哺乳动物。在另一个实施例中,基因序列来源于与打算用组合物治疗相同的哺乳动物。在另一个实施例中,基因序列来源于人。在其它实施例中,对基因序列进行某些修饰以便增强靶标细胞中的表达。此类修饰包括密码子优化。
[0157]
在一个实施例中,基因是abca4,该基因在斯塔加特氏病中指示。这一基因的dna的基因组序列可见于关于染色体1的ncbi参考序列(135313bp)ng_009073.1。所述基因的mrna以及外显子的位置在ncbi报告中指出。abca4的dna序列以ncbi参考序列:nm_000350.2提供。氨基酸序列以ncbi参考序列:np000341.2提供。
[0158]
在另一个实施例中,基因是cep290。雷伯氏先天性黑蒙包含以视力丧失、眼球震颤和严重视网膜功能障碍为特征的一组早发型儿童视网膜营养不良。患者通常在出生时出现严重的视力丧失和钟摆型眼球震颤。视网膜电图(erg)反应通常是无法记录的。其它临床发现可包括高度远视、畏光、眼指体征、圆锥形角膜、白内障和眼底的可变外观。lca10是由染色体12q21上cep290基因中的突变引起并且可占lca病例的多达21%。cep290中的突变也可引起眼外发现,包括肾脏和cns异常,并因此可引起多种综合征(老年洛肯氏综合征(senior loken syndrome)、朱伯特氏综合征(joubert syndrome)、巴迪特-别铎氏综合征)。
[0159]
这一基因的dna的基因组序列可见于染色体12的ncbi参考序列nc_000012.12从nt.88049013-88142216(93,204bp)。mrna和外显子标识于ncbi报告中。cep290的dna序列以ncbi参考序列:nm_025114.3提供。氨基酸序列以ncbi参考序列:np0789390.3提供。mrna含有54个外显子和59个内含子(由替代性剪接引起)。已知cep290的许多突变和其在核苷酸序列中的位置。
[0160]
在另一个实施例中,基因是myo7a。这一基因中的突变与尤塞氏综合征相关。尤塞氏综合征是以听力损失和进行性视力丧失为特征的疾患。视力丧失是由称为色素性视网膜炎(rp)的眼部疾病引起,该疾病影响光敏性视网膜层。视力丧失是随着视网膜光敏性细胞逐渐退化而发生。随着时间的流逝,这些盲点会扩大并合并,从而产生隧道视觉。在尤塞氏综合征的一些病例下,视力因眼睛晶状体变浑浊(白内障)而进一步减退。然而,许多患有色素性视网膜炎的人在其一生中保持一定中心视力。听觉丧失是由耳蜗毛细胞中的疾病引起,所述耳蜗毛细胞也逐渐退化。i型尤塞氏综合征可由cdh23、myo7a、pcdh15、ush1c或ush1g基因中的突变引起。
[0161]
已在患有1b型尤塞氏综合征的人中鉴别出myo7a基因的超过250个突变。这些基因变化中有许多将改变肌球蛋白viia蛋白质关键区域中的单一蛋白质构造块(氨基酸)。其它突变在肌球蛋白viia蛋白质的说明(instruction)中引入提前终止信号。因此,制备出这一蛋白质的异常小的型式。一些突变在myo7a基因中插入或缺失少量dna,由此改变蛋白质。所有这些变化都引起非功能性肌球蛋白viia蛋白质的产生,所述蛋白质会不利地影响内耳和视网膜中细胞的发育和功能,由此引起尤塞氏综合征。
[0162]
这一基因的dna的基因组序列可见于染色体11的ncbi参考序列nc_000011.9从nt.77,128,255至77,215,240(86,986bp)。myo7a的dna序列以ncbi参考序列:nm_000260.3提供。氨基酸序列以ncbi参考序列:np 000251.1提供。myo7a的dna序列、氨基酸序列、外显子序列和内含子序列在线提供于https://grenada.lumc.nl/lovd2/usher_montpellier/refseq/myo7a_codingdna.html,2010年2月17日最后一次修改。mrna含有49个外显子和61个内含子。myo7a的许多突变可见于cchmc分子遗传学实验室突变数据库(molecular genetics laboratory mutation database),lovd v.2.0。
[0163]
rtm靶标基因编码序列
[0164]
在一个实施例中,编码结构域是靶标基因的单个外显子,其含有缺乏致病突变的
正常野生型序列,例如abca4的外显子27。在另一个实施例中,编码结构域包括含多个致病突变的多个外显子,例如abca4的外显子1-22。取决于待校正的外显子的位置,rtm可以含有位于靶标基因的5'或3'端的多个外显子,或rtm可被设计用于替代在所述基因中间的外显子。对于在raav中使用和递送,除非这一技术涉及长度小于3000个核苷酸的小基因,否则不可使用所述基因的整个编码序列作为rtm的编码结构域。如本文所描述,为替代整个大基因,可在不同raav粒子中使用两个rtm,即3'和5'rtm。
[0165]
在一个实施例中,5'rtm的编码结构域被设计用于替代在靶标基因5'部分中的外显子。在另一个实施例中,3'rtm的编码结构域被设计用于替代在基因3'部分中的外显子。在另一个实施例中,编码结构域是位于基因内部的一个或多个外显子并且编码结构域位于双重反式剪接rtm中。
[0166]
因此,例如,有三种可能类型的rtm可用于治疗由例如abca4中的缺陷引起的疾病:包括5'剪接位点的5'反式剪接rtm。在反式剪接之后,5'rtm将变为靶标mrna的5'区;包括3'剪接位点的3'rtm,其用于反式剪接并替代靶标mrna的3'区;以及双重反式剪接rtm,其携带多个结合结构域以及3'和5'剪接位点。在反式剪接之后,这一rtm替代加工后的靶标mrna中的内部外显子。在其它实施例中,编码结构域可包括含天然存在或人工引入的终止密码子以便减少基因表达的外显子;或rtm可含有产生rnai样作用的其它序列。
[0167]
对于用于治疗斯特格氏病,abca4的适合编码区是独立rtm中的外显子1-22或27-50。对于用于治疗lca10,cep290的适合编码区是独立rtm中的外显子1-26或外显子27-54。对于用于治疗尤塞氏综合征,myo7a的适合编码区是独立rtm中的外显子1-18或33-49。
[0168]
rtm的任选组分或修饰
[0169]
可使用任选的间隔子区隔开rtm中的剪接结构域与靶标结合结构域。间隔子区可设计成包括如下特征:(i)用于阻断任何未剪接的rtm的翻译的终止密码子和/或(ii)增强与靶标前mrna的反式剪接的序列。取决于rtm中其它组分的长度和raav限制,间隔子可在3至25个核苷酸或更多个之间。在一个实施例中,适合5'rtm间隔子是aga tct cgt tgc gat att at seq id no:10。在一个实施例中,适合3'间隔子是:5'-gag aac att att ata gcg ttg ctc gag-3'seq id no:11。
[0170]
rtm的又其它任选组分包括微型内含子,以及调控反式剪接的内含子或外显子增强子或沉默子(参见例如本文中引用的rtm技术出版物中的描述)。
[0171]
在另一个实施例中,rtm另外包含并入间隔子、结合结构域或rtm中别处的至少一个安全序列以防止非特异性反式剪接。这是rtm的一个区域,该区域通过相对较弱的互补性覆盖rtm的3'和/或5'剪接位点的元件,由此防止非特异性反式剪接。rtm的设计方式使得在杂交rtm的一个或多个结合/靶向部分后,3'和/或5'剪接位点被暴露出来并变成具有完全活性。此类“安全”序列包含顺式序列的互补延伸段(或可以是核酸的第二条独立链),该互补延伸段结合至rtm分支点的一侧或两侧、嘧啶区域、3'剪接位点和/或5'剪接位点(剪接元件),或可结合至剪接元件本身的各部分。所述“安全”的结合可通过rtm靶标结合区结合至靶标前mrna破坏,由此暴露并激活rtm剪接元件(使其可反式剪接至靶标前mrna中)。在另一个实施例中,rtm在3或5'端添加3'utr序列或核糖核酸酶序列。
[0172]
在一个实施例中,在合成rtm的结构中也可包括剪接增强子,如称为外显子剪接增强子的序列。可将额外特征添加至rtm分子,如改变rna表达/稳定性的聚腺苷酸化信号,或
增强剪接的5'剪接序列、额外结合区、“安全”自互补区、额外剪接位点或调节分子的稳定性并防止降解的保护基。此外,在rtm结构中也可包括终止密码子以防止未剪接的rtm翻译。可将其它元件,如3'发夹结构、环化rna、核苷酸碱基修饰或合成类似物并入rtm中以促进或有助于核定位和剪接体并入,以及细胞内稳定性。
[0173]
rtm核酸分子与靶标前mrna的结合是由互补性(即,基于核酸的碱基配对特征)、三螺旋形成或蛋白质-核酸相互作用介导的(如本文中引用的文献中所描述)。在一个实施例中,rtm核酸分子由dna、rna或dna/rna杂交分子组成,其中dna或rna是单链或双链的。还包含rna或dna,其优选地在严格条件下与前述rna或dna中的一种杂交,如例如在60℃下于2.5xssc缓冲液中杂交并在37℃下于较低缓冲液浓度,如例如0.5xssc缓冲液下洗涤若干次,并且编码展现脂质磷酸酯磷酸酶活性和/或与质膜缔合的蛋白质。当在体外合成rtm(合成rtm)时,此类rtm可在碱基部分、糖部分或磷酸酯主链处进行修饰,例如以改善分子的稳定性、与靶标mrna的杂交、细胞中的转运、在细胞中对酶裂解的稳定性等。例如,修饰rtm以减小总体电荷可增强分子的细胞吸收。此外,可进行修饰以减小对核酸酶或化学降解的敏感性。核酸分子的合成方式可使其与另一个分子,例如肽、杂交触发的交联剂、转运剂、杂交触发的裂解剂等缀合。
[0174]
可引入对于核酸分子的各种其它众所周知的修饰作为增加细胞内稳定性和半衰期的一种手段(也参见以上关于寡核苷酸所描述)。可能的修饰是本领域中已知的(参见本文中引用的文献)。可对合成rtm的结构进行的修饰包括但不限于主链修饰,如所引用的rtm技术文献中所描述的修饰。
[0175]
重组aav分子
[0176]
多种已知的核酸载体可用于这些方法中以设计和组装rtm的组分和重组腺相关病毒(aav),以便将rtm递送至靶标细胞。本领域的技术人员已知的许多出版物论述了使用多种此类载体递送基因(参见例如ausubel等人,《现代分子生物学实验技术(current protocols in molecular biology)》,john wiley&sons,纽约(new york),1989;kay,m.a.等人,2001,《自然-医学(nat.medic.)》,7(1):33至40;以及walther w.和stein u.,2000,《药物(drugs)》,60(2):249至71)。在本文所描述的一个实施例中,载体是重组aav,其携带rtm并由启动子驱动以在患病受试者的选定靶标细胞中表达rtm。用于组装所述重组载体的方法是众所周知的(参见例如2000年3月23日公布的国际专利公开第wo 00/15822号,和本文中引用的其它参考文献)。
[0177]
在本文所描述的某些实施例中,将一个或多个携带选定基因结合和编码序列的rtm递送至需要借助于腺相关病毒载体治疗的靶标细胞,例如感光细胞。可得到许多天然存在的血清型的aav。aav衣壳存在许多天然变体,允许鉴别和使用具有特别适合眼部细胞的特性的aav。aav病毒可以通过常规的分子生物学技术进行工程改造,由此可以优化这些粒子以实现rtm核酸序列的细胞特异性递送、最大限度地减小免疫原性、调整稳定性和粒子寿命、实现高效降解、实现向细胞核的准确递送等。
[0178]
本文所描述的rtm的表达可在选定细胞中,通过含有编码所希望rtm的序列的以重组方式工程改造的aav或人工aav递送实现。aav的使用是外源递送dna的一种常见方式,因为这种方式相对无毒,提供高效的基因转移,并且可以容易地优化以达到特定目的。在从人类或非人类灵长类动物(nhp)分离并得到充分表征的aav血清型中,人血清型2被广泛用于
在不同靶标组织和动物模型中进行的高效基因转移实验。其它aav血清型包括但不限于aav1、aav3、aav4、aav5、aav6、aav7、aav8和aav9。除非另外说明,否则本文所描述的aav itr和其它选定的aav组分可容易地从任何aav血清型中选出,包括但不限于aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav8bp、aav7m8或其它已知和未知的aav血清型。这些itr或其它aav组分可以使用本领域技术人员可用的技术从aav血清型中容易地分离。此类aav可以从学术、商业或公共来源分离(例如维吉尼亚州马纳萨斯的美国典型培养物保藏中心(american type culture collection,manassas,va))。或者,可以通过合成或其它适合的手段,通过参考公开的序列,如在文献中或在如genbank、pubmed等数据库中可获得的公开的序列获得aav序列。关于各种aav血清型的论述,参见例如wo 2005/033321或wo2014/124282,其以引用的方式并入本文中。
[0179]
用于组装成载体的希望的aav片段包括cap蛋白质,包括vp1、vp2、vp3和高变区;rep蛋白质,包括rep 78、rep 68、rep 52和rep 40;以及编码这些蛋白质的序列。这些片段可容易地用于多种载体系统和宿主细胞中。此类片段可单独使用,与其它aav血清型序列或片段组合使用,或与来自其它aav或非aav病毒序列的元件组合使用。如本文所使用,人工aav血清型包括但不限于具有非天然存在的衣壳蛋白的aav。此类人工衣壳可以通过任何适合的技术,使用选定的aav序列(例如vp1衣壳蛋白的片段)与异源序列的组合产生,所述异源序列可以从不同的选定aav血清型、同一aav血清型的不连续部分、非aav病毒来源或非病毒来源获得。人工aav血清型可以是但不限于假型化aav、嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。假型化载体可用于本发明中,其中一个aav的衣壳被异源衣壳蛋白替代。在一个实施例中,aav2/5是一种有用的假型化载体。在另一个实施例中,所述aav是aav2/8。
[0180]
在一个实施例中,可用于制备本文所描述的组合物和方法的载体在最低限度上含有编码选定aav血清型衣壳,例如aav2衣壳或其片段的序列。在另一个实施例中,有用的载体在最低限度上含有编码选定aav血清型rep蛋白质,例如aav2 rep蛋白质或其片段的序列。任选地,此类载体可以含有aav cap和rep蛋白质。在提供aav rep和cap的载体中,aav rep和aav cap序列可以是一种血清型来源,例如所有aav2来源。或者,可使用rep序列来自与提供cap序列不同的aav血清型的载体。在一个实施例中,rep和cap序列是由独立来源(例如独立的载体,或宿主细胞和载体)表达。在另一个实施例中,这些rep序列与不同aav血清型的cap序列同框融合以形成嵌合aav载体,如以引用的方式并入本文中的美国专利第7,282,199号中所描述的aav2/8。
[0181]
适合重组腺相关病毒(aav)是通过培养宿主细胞产生,所述aav含有如本文所定义的编码腺相关病毒(aav)血清型衣壳蛋白的核酸序列或其片段;功能性rep基因;在最低限度上由aav反向末端重复序列(itr)和rtm核酸序列构成的小基因;以及允许将所述小基因包装至aav衣壳蛋白中的足够辅助功能。在宿主细胞中培养以将aav小基因包装于aav衣壳中所需的组分可按反式形式提供至宿主细胞。或者,可由稳定宿主细胞提供所需组分(例如小基因、rep序列、cap序列和/或辅助功能)中的任一种或多种,所述宿主细胞已使用本领域技术人员已知的方法工程改造成含有所需组分中的一种或多种。
[0182]
在一个实施例中,raav包含启动子(或启动子的功能片段)。用于raav中的启动子可选自多种能够在所希望的靶标细胞中表达选定的转基因的组成性或诱导性启动子。参见例如2014年8月14日公布的国际专利公开第wo2014/12482号中所标识的启动子清单,该案
以引用的方式并入本文中。在一个实施例中,启动子具有“细胞特异性”。术语“细胞特异性”意思指,被选择用于重组载体的特定启动子可以引导选定的转基因在一种特定细胞或眼部细胞类型中的表达。在一个实施例中,启动子对转基因在感光细胞中的表达具有特异性。在另一个实施例中,启动子对视杆和/或视锥中的表达具有特异性。在另一个实施例中,启动子对转基因在rpe细胞中的表达具有特异性。在另一个实施例中,启动子对转基因在神经节细胞中的表达具有特异性。在另一个实施例中,启动子对转基因在米勒细胞中的表达具有特异性。在另一个实施例中,启动子对转基因在双极细胞中的表达具有特异性。在另一个实施例中,转基因在上述任何眼部细胞中表达。
[0183]
在另一个实施例中,启动子是待表达的靶标眼部基因的原始启动子。有用的启动子包括但不限于视杆视蛋白启动子、红色-绿色视蛋白启动子、蓝色视蛋白启动子、cgmp-β-磷酸二酯酶启动子、小鼠视蛋白启动子(以上引用的beltran等人,2010)、视紫质启动子(mussolino等人,《基因疗法(gene ther)》,2011年7月,18(7):637-45);视锥转导蛋白的α亚基(morrissey等人,《bmc发育生物学(bmc dev,biol)》,2011年1月,11:3);β磷酸二酯酶(pde)启动子;色素性视网膜炎(rp1)启动子(nicord等人,《基因医学杂志(j.gene med)》,2007年12月,9(12):1015-23);nxnl2/nxnl1启动子(lambard等人,《公共科学图书馆
·
综合(plos one)》,2010年10月,5(10):e13025)、rpe65启动子;视网膜缓慢变性/盘膜边缘蛋白2(rds/perph2)启动子(cai等人,《实验眼科研究(exp eye res.)》2010年8月;91(2):186-94);以及vmd2启动子(kachi等人,《人类基因疗法(human gene therapy)》,2009(20:31-9))。这些文献各自以引用的方式并入本文中。
[0184]
小基因或raav中所包含的其它常规调控序列也公开于如引用并以引用的方式并入本文中的wo2014/124282等文献中。本领域的技术人员可在不脱离本文所描述的范围的情况下对这些和其它表达控制序列进行选择。
[0185]
所希望的aav小基因在最低限度上由本文所描述的rtm和其调控序列以及5'和3'aav反向末端重复序列(itr)构成。在一个实施例中,使用了aav血清型2的itr。在另一个实施例中,使用了aav血清型5或8的itr。然而,也可选择来自其它适合血清型的itr。这一小基因被包装至aav衣壳中并递送至选定的宿主细胞中。
[0186]
制造raav所需的小基因、rep序列、cap序列和辅助功能可以呈转移其上携带的序列的任何遗传元件形式递送至包装宿主细胞。选定的遗传元件可通过包括本文所描述的方法在内的任何适合方法递送。用于构建本文所描述的任何实施例的方法对于具有核酸操作技能的人员是已知的并且包括基因工程改造、重组工程改造和合成技术。参见例如sambrook等人,《分子克隆实验指南(molecular cloning:a laboratory manual)》,cold spring harbor press,纽约冷泉港(cold spring harbor,ny)。类似地,产生raav病毒粒子的方法是众所周知的并且适合方法的选择不对本发明构成限制。参见例如k.fisher等人,1993,《病毒学杂志(j.virol.)》,70:520至532和美国专利5,478,745等。这些出版物以引用的方式并入本文中。
[0187]
本领域的技术人员易于选择适合的生产细胞系。例如,适合宿主细胞可选自任何生物有机体,包括原核(例如细菌)细胞和真核细胞,包括昆虫细胞、酵母细胞和哺乳动物细胞。简单点说,将携带小基因的aav生产质粒转染至选定的包装细胞中,在所述细胞中,该质粒可短暂地存在。或者,将侧接itr的小基因或基因表达盒通过染色体或作为游离基因稳定
整合至宿主细胞的基因组中。适合转染技术是已知的并且可容易地用于将重组aav基因组递送至宿主细胞中。典型地,在表达cap和/或rep蛋白质的宿主细胞中培养生产质粒。在宿主细胞中,由侧接aav itr的rtm组成的小基因得到拯救并且被包装至衣壳蛋白或包膜蛋白中以形成感染性病毒粒子。因此,重组aav感染性粒子是通过以下方式产生:在足以允许将基因表达盒病毒基因组包装至感染性aav包膜或衣壳中的病毒序列存在下,培养携带原病毒质粒的包装细胞。
[0188]
药物载剂和药物组合物
[0189]
优选通过常规方法评估本文所描述的用于治疗斯塔加特氏病的组合物的污染情况,然后将其配制成欲用于适合施用途径的药物组合物,所述组合物含有如上文详述的重组病毒载体,例如aav,所述重组病毒载体含有用于选定的靶标细胞,例如感光细胞的所希望的rtm小基因。含有rtm,例如呈裸dna或蛋白质形式的又其它组合物可与适合载剂以类似方式配制。此类配制物涉及使用药学上和/或生理上可接受的媒剂或载剂,特别是针对施用至靶标细胞。在一个实施例中,适于施用至眼睛细胞的载剂包括缓冲盐水、等渗氯化钠溶液或其它缓冲液,例如hepes,以将ph值维持在适当的生理水平,并且任选地,还包括其它药物试剂、药剂、稳定剂、缓冲液、载剂、佐剂、稀释剂等。
[0190]
对于注射,载剂典型地是液体。例示性生理上可接受的载剂包括无菌、无热原水和无菌、无热原磷酸盐缓冲盐水。美国专利第7,629,322号中提供了多种此类已知的载剂,该案以引用的方式并入本文中。在一个实施例中,载剂是等渗氯化钠溶液。在另一个实施例中,载剂是平衡盐溶液。在一个实施例中,载剂包括tween。如果病毒要长期存储,则其可以在甘油或tween20存在下冷冻。
[0191]
在其它实施例中,例如,含有本文所描述的rtm的组合物包括表面活性剂。可包括有用的表面活性剂,如pluronic f68((poloxamer 188),又称为f68),因为这些表面活性剂防止aav粘附至惰性表面并因此确保递送所希望的剂量。
[0192]
举例来说,设计用于治疗本文所描述的眼部疾病的一种示例性组合物包含重组腺相关载体和药学上可接受的载剂,所述重组腺相关载体携带如本文所描述的编码3'rtm的核酸序列,所述核酸序列处于调控序列控制下以在哺乳动物受试者的眼部细胞中表达rtm。所述载剂是等渗氯化钠溶液并且包括表面活性剂pluronic f68。在一个实施例中,rtm是实例中描述的rtm。在另一个实施例中,rtm含有cep290或myo7a的结合和编码区。
[0193]
在另一个例示性实施例中,组合物包含重组aav2/5假型化腺相关病毒,其携带用于内部基因替代的3'或5'或rtm,即处于引导rtm在靶标细胞中的表达的启动子控制下的核酸序列,其中所述组合物是与载剂和适于注射的额外组分一起配制。
[0194]
在再另一个实施例中,所述组合物或用于制造或组装这一组合物的组分,包括载剂、raav粒子、表面活性剂和/或用于产生raav的组分,以及适合制备所述组合物的实验室硬件,都可以并入试剂盒中。
[0195]
治疗病症的方法
[0196]
因此,以上描述的组合物可用于治疗一种或多种与选定基因相关联的疾病的方法中。在一个实施例中,疾病是眼部疾病(例如斯塔加特氏病、雷伯氏先天性黑蒙、视锥视杆营养不良、眼底黄色斑点症、色素性视网膜炎、年龄相关黄斑变性、老年洛肯氏综合征(seniorsyndrome)、朱伯特氏综合征或尤塞氏综合征等)。在一个实施例中,治疗包括延缓或
改善与本文所描述的眼部疾病相关联的症状。此类方法涉及使靶标前mrna(例如abca4、cep290、myo7a)与如本文所描述的3'rtm、5'rtm、3'和5'rtm或双重反式剪接rtm中的一个或多个在一定条件下接触,使得一部分rtm剪接至靶标前mrna以用靶标基因的“健康”或正常或野生型或校正过的mrna替代携带一个或多个缺陷或突变的靶标基因的全部或一部分,以便校正靶标细胞中该基因的表达。或者,可形成前mirna(参见本文中引用的rtm文献),该前mirna被设计成用于减少靶标mrna的表达。因此,所述方法和组合物被用于治疗与特定突变和/或基因表达相关联的眼部疾病/病变。
[0197]
在一个实施例中,所述接触涉及直接施用给患病受试者;在另一个实施例中,所述接触可与培养的细胞离体发生并将处理过的细胞再植入受试者体内。在一个实施例中,所述方法涉及施用携带3'rtm的raav粒子。在另一个实施例中,所述方法涉及施用携带5'rtm的raav粒子。在另一个实施例中,所述方法涉及施用携带双重反式剪接rtm的raav粒子。在再另一个实施例中,所述方法涉及施用携带3'rtm的raav粒子与携带5'rtm的raav粒子的混合物。在再另一个实施例中,所述方法涉及施用携带3'rtm的raav粒子与携带双重反式剪接rtm的raav粒子的混合物。在再另一个实施例中,所述方法涉及施用携带5'rtm的raav粒子与携带双重反式剪接rtm的raav的混合物。在再另一个实施例中,所述方法涉及施用携带3'rtm的raav粒子与携带5'rtm的raav粒子和携带双重反式剪接rtm的raav粒子的混合物。
[0198]
这些方法包含向有需要的受试者受试者施用有效浓度的本文所描述的组合物中的任一种组合物。在一个示例性实施例中,提供的此类方法用于预防受试者的与斯塔加特氏病相关联的视力丧失,停滞其进展或改善视力丧失,所述方法包含向有需要的哺乳动物受试者的眼部细胞施用有效浓度的组合物,所述组合物包含重组腺相关病毒(aav),所述aav携带处于调控序列的控制下的如以上和实例中所描述的3'rtm,所述调控序列允许rtm起作用并引起哺乳动物受试者的眼部细胞,例如感光细胞中缺陷性靶标基因的反式剪接。在再另一个实施例中,所述方法涉及施用两种raav粒子,一个携带5'rtm并且另一个携带3'rtm,如实例中所描述的那些rtm,以替代大基因中的较大部分。
[0199]
所述方法中所使用的“施用”意思指将组合物递送至靶标选定细胞,所述细胞以由靶标基因中的突变或缺陷引起的疾病为特征。例如,在一个实施例中,所述方法涉及通过视网膜下注射将组合物递送至感光细胞或其它眼部细胞。在另一个实施例中,可采用对眼部细胞进行玻璃体内注射或通过眼睑静脉对眼部细胞进行注射。在另一个实施例中,所述方法涉及通过直接注射至指定器官,例如肝脏来递送组合物。在又一个实施例中,所述方法涉及通过静脉内注射来递送组合物。本领域技术人员可根据本公开选择其它施用方法。
[0200]
此外,在某些实施例中,希望执行无创视网膜成像和功能研究,以鉴别保留感光器中作为疗法的靶标的区域。在这些实施例中,采用了临床诊断测试来确定一次或多次视网膜下注射的精确位置。这些测试可包括视网膜电图(erg)、视野测定法、借助于共聚焦扫描激光扫描检眼镜检查法(confocal scanning laser ophthalmoscopy,cslo)和光学相干断层扫描(oct)进行的视网膜各层的表面形状定位和其层厚的测量、通过自适应光学(adaptive optics,ao)进行的视锥密度的表面形状定位、功能性眼睛检查等。鉴于所进行的成像和功能研究,在一些实施例中,在同一只眼睛中执行一次或多次注射,以靶向保留感光器的不同区域。
[0201]
为了在这些方法中使用,如下文进一步描述,每次注射的体积和病毒滴度是单独
确定的并且可以与在同一受试者中执行的其它次注射相同或不同。在另一个实施例中,进行单次较大体积的注射以治疗整只眼睛。剂量、施用和方案可以由主治医生根据本说明书的教导来确定。
[0202]
在一个实施例中,raav组合物的体积和浓度的选择应使得仅影响感光器或其它眼部细胞的某些区域。在另一个实施例中,raav组合物的体积和/或浓度是较大量,以便达到眼睛的较大部分。对于施用至其它器官,以类似方式调整剂量。
[0203]
携带如本文所描述的rtm的重组腺相关病毒的有效浓度在每毫升约108与10
13
个载体基因组(vg/ml)之间的范围内。raav感染单位是如s.k.mclaughlin等人,1988,《病毒学杂志》,62:1963中所描述测量。在另一个实施例中,浓度范围在每毫升109与10
13
个载体基因组(vg/ml)之间。在另一个实施例中,有效浓度是约1.5
×
10
11
vg/ml。在一个实施例中,有效浓度是约1.5
×
10
10
vg/ml。在另一个实施例中,有效浓度是约2.8
×
10
11
vg/ml。在又一个实施例中,有效浓度是约1.5
×
10
12
vg/ml。在另一个实施例中,有效浓度是约1.5
×
10
13
vg/ml。希望的是,利用最低有效浓度的病毒以降低如毒性以及与对眼睛施用有关的其它问题,例如视网膜发育不良和脱落等不希望作用的风险。在这些范围内或其它单位中的又其它剂量可由主治医师考虑所治疗的受试者、优选地人的身体状态,包括受试者的年龄;所施用的组合物和特定病症;靶标细胞和病症(如果是进行性)发展的程度来选择。
[0204]
取决于待治疗区域的大小、所用病毒滴度、施用途径和所述方法的希望作用,递送的组合物可以是约50μl至约1ml体积,包括在所述范围内的所有数字。在一个实施例中,体积是约50μl。在另一个实施例中,体积是约70μl。在另一个实施例中,体积是约100μl。在另一个实施例中,体积是约125μl。在另一个实施例中,体积是约150μl。在另一个实施例中,体积是约175μl。在又另一个实施例中,体积是约200μl。在另一个实施例中,体积是约250μl。在另一个实施例中,体积是约300μl。在另一个实施例中,体积是约450μl。在另一个实施例中,体积是约500μl。在另一个实施例中,体积是约600μl。在另一个实施例中,体积是约750μl。在另一个实施例中,体积是约850μl。在另一个实施例中,体积是约1000μl。
[0205]
以下实例并不限制本文所描述的实施例的范围。本领域的技术人员应了解,可在以下实例中进行修改,所述实例意图涵盖在本发明的精神和范围内。
[0206]
实例1:剪接依赖性报告体rtm
[0207]
将图1a-1d中所示的rtm递送递送至表达小基因(图1f)的细胞系,所述小基因含有与荧光素酶orf的3'半部分相融合的来自cep290的内含子26。rtm结合(通过结合结构域)至内含子26中的靶标序列,使所述rtm中的5'剪接位点(5'ss)接近cep290小基因的3'剪接位点(3'ss)。发生剪接体介导的剪接,产生荧光素酶表达作为反式剪接活性的直接量度(图2a)。含有聚腺苷酸化信号(聚a)或锤头核糖核酸酶(hhrz)的两个参考rtm构成转录终止元件的现有技术,并在此处用于建立活性基线。数据表明,相对于含有hhrz用于转录终止的参考rtm,malat1转录终止子的comp14衍生物增强反式剪接。此外,这一活性看来取决于mascrna结构域及其相关核糖核酸酶p裂解。当mascrna结构域被hhrz替代时活性丧失证实了这一点。
[0208]
在图2b中,实验被设计成分别通过taqman和蛋白质印迹法测量荧光素酶rna和蛋白质。每一构建体测试n=4次重复实验,披露当hhrz被comp14 malat1衍生物替代时荧光素酶蛋白质增加,这与图2a中显示的荧光素酶活性相符。对从处理过的细胞提取的rna进行
taqman分析显示,根据两个不同的引物-探针集(s2和s4),当rtm含有malat1终止子的comp14衍生物时,反式剪接的荧光素酶rna有类似增加。由于这些研究中的rtm使用了靶向cep290基因的内含子26的结合结构域,故也可测量针对内源cep290转录物的rtm反式剪接活性。如图2b中所示,根据两个不同的taqman引物-探针集(s2和s3),相较于具有hhrz终止子的rtm,携带malat1终止子的comp14衍生物的rtm产生较高水平的嵌合luc-cep290 rna。
[0209]
实例2:3'终止子序列的比较
[0210]
制备rtm构建体,针对abca4表达量测试若干终止子序列:hhz,即锤头核糖核酸酶,其自裂解产生rtm的3'末端(图3a);c14或comp14,即截短的malat1三螺旋结构(seq id no:12),其在核糖核酸酶p裂解之后产生rtm的3'末端(图3b);以及wt,即原始malat1三螺旋,其在核糖核酸酶p裂解之后产生rtm的3'末端(图3c)。
[0211]
图4a和4b是蛋白质印迹和其定量,显示了通过rtm介导的反式剪接产生的abca4蛋白质。图3中测试的rtm包括abca4内含子23(基序27和81)和内含子22(基序117和118)的结合结构域。nb是阴性对照非结合基序。图4a中的数据显示,当hhrz终止子被comp14衍生物替代时,abca4蛋白质明显增加。在图4b中,将comp14衍生物与野生型malat1三螺旋终止子相比较,披露利用后者的反式剪接活性甚至有更大增加,取决于结合结构域,增加范围是5-10倍。在图4c中,显示了野生型malat1三螺旋终止子与comp14衍生物的预测碱基配对情况。在设计comp14衍生物时,wilusz等人表明,其应当在富含a的结构域与富含u的结构域之间具有与野生型malat1序列相同的碱基配对特征,但又具有截短的侧接茎-环结构域。然而,这一假设忽略了侧接茎-环在适当碱基配对中的可能作用,并且可以解释comp14的ene活性低于野生型malat1三螺旋终止子的原因。利用野生型malat1序列观察到高于comp14衍生物的反式剪接活性水平展示了所述三螺旋终止子结构和ene功能的重要特征。
[0212]
图5a显示了含有来自lncrna的不同三螺旋终止子的rtm的蛋白质印迹分析。其包括来自malat1和neat1(menβ)的野生型序列,以及来自malat1的三螺旋结构域与来自neat1的trna样基序(称为menrna)融合的嵌合形式和来自neat1的三螺旋结构域与来自malat1的mascrna基序融合的嵌合形式。数据表明,当rtm含有野生型malat1终止子时,反式剪接活性最高。
[0213]
图5b显示了包括malat1、menβ(neat1)和pan rna(由卡波济氏肉瘤相关疱疹病毒kshv产生)在内的来自三种不同lncrna的三螺旋终止子的预测碱基配对情况。不同lncrna间的结构相似性表明在转录终止之后保护lncrna的3'端的常见进化策略。然而,malat1三螺旋结构域的x射线晶体学披露,该结构域含有10个大沟和2个小沟的三联体,其中大多数具有任何已知的天然存在的三螺旋结构(brown,j.a.等人,2014)。这种错综复杂的设计可能赋予超过neat1或pan的水平的结构稳定性,并且可以解释为何malat1终止子看来更好地支持反式剪接。借助于防止rtm在细胞核中降解。重要的是,如通过体内衰变测定(brown,j.a.,2014)所显示,malat1的钝端三螺旋可抑制快速核rna衰变。
[0214]
图6a显示了来自若干物种的malat1的高度保守的mascrna序列以及其预测折叠构象。将红色箭头指示的g变为a的单点突变插入mascrna序列中以测试这一结构域对于反式剪接活性的重要性。如蛋白质印迹(图6b)中所示,所述点突变消除所验证的靶向abca4的rtm的反式剪接活性。这可能是因为突变序列无法呈现核糖核酸酶p识别和裂解所需的正确构象。
[0215]
以下额外编号的段落进一步界定本文所描述的本发明的一些实施例。
[0216]
1.一种核酸反式剪接分子,其包含3'转录终止子结构域(ttd),所述ttd包含三螺旋。
[0217]
2.根据权利要求1所述的核酸反式剪接分子,其中所述三螺旋包含至少五个连续的a-u胡斯坦碱基对。
[0218]
3.根据权利要求1或2所述的核酸反式剪接分子,其中所述三螺旋包含具有5-30个核酸的富含a的区域。
[0219]
4.根据权利要求3所述的核酸反式剪接分子,其中所述富含a的区域是在所述ttd的3'端。
[0220]
5.根据权利要求1至4中任一项所述的核酸反式剪接分子,其中所述三螺旋包含具有10个连续核苷酸的链,其中所述10个连续核苷酸中的9个通过胡斯坦碱基配对进行配对。
[0221]
6.根据权利要求1至5中任一项所述的核酸反式剪接分子,其中所述ttd包含茎-环基序。
[0222]
7.根据权利要求1至6中任一项所述的核酸反式剪接分子,其中所述3'ttd包含以5'至3'方向操作性连接的5'富含u的基序、茎-环基序、3'富含u的基序和富含a的区域。
[0223]
8.根据权利要求1至4中任一项所述的核酸反式剪接分子,其中所述3'ttd与seq id no:13、seq id no:15、seq id no:17或seq id no:23至少95%同源。
[0224]
9.根据权利要求8所述的核酸反式剪接分子,其中所述3'ttd与seq id no:13至少95%同源,并且其中所述三螺旋包含seq id no:13的u7-u11与富含a的区域的胡斯坦碱基配对。
[0225]
10.根据权利要求9所述的核酸,其中所述3'ttd是pan ene+a。
[0226]
11.根据权利要求1至8中任一项所述的核酸反式剪接分子,其中所述3'ttd与seq id no:15至少95%同源,并且其中所述三螺旋包含seq id no:15的u6-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。
[0227]
12.根据权利要求11所述的核酸,其中所述3'ttd是malat1 ene+a。
[0228]
13.根据权利要求8所述的核酸反式剪接分子,其中所述3'ttd与seq id no:17至少95%同源,并且其中所述三螺旋包含seq id no:17的u6-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。
[0229]
14.根据权利要求13所述的核酸,其中所述3'ttd是malat1核心ene+a。
[0230]
15.根据权利要求8所述的核酸反式剪接分子,其中所述3'ttd与seq id no:23至少95%同源,并且其中所述三螺旋包含seq id no:23的u8-10、c11和u12-15与富含a的区域的胡斯坦碱基配对。
[0231]
16.根据权利要求15所述的核酸反式剪接分子,其中所述3'ttd是menβene+a。
[0232]
17.一种核酸反式剪接分子,其包含以5'至3'方向操作性连接的:
[0233]
(a)包含选定基因的一个或多个功能性外显子的编码结构域序列(cds);
[0234]
(b)具有不同长度的接头结构域序列(lds),所述lds充当所述编码结构域与结合结构域之间的结构连接,
[0235]
(c)被配置成用于起始剪接体介导的反式剪接的剪接体识别基序(5'剪接位点);
[0236]
(d)被配置成用于与所述选定基因的靶标内含子杂交的具有不同长度和序列的结
合结构域(bd),其中所述基因在所述靶标内含子的5'端的外显子中具有至少一个缺陷或突变;以及
[0237]
(e)增加反式剪接的效率的3'转录终止子结构域(ttd),
[0238]
其中所述核酸反式剪接分子被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。
[0239]
18.根据权利要求17所述的核酸反式剪接分子,其中所述结合结构域与在所述突变的3'端的所述选定基因的靶标内含子杂交并且所述编码结构域包含在所述靶标内含子的5'端的一个或多个外显子。
[0240]
19.一种核酸反式剪接分子,其包含以5'至3'方向操作性连接的:
[0241]
(a)被配置成用于结合选定基因的靶标内含子的结合结构域(bd),其中所述基因在所述靶标内含子的3'端的外显子中具有至少一个缺陷或突变;
[0242]
(b)具有不同长度和组成的接头序列,所述接头序列充当所述结合结构域编码区之间的结构连接;
[0243]
(c)被配置成用于介导反式剪接的3'剪接体识别基序(3'剪接位点);
[0244]
(d)包含所述选定基因的一个或多个功能性外显子的编码结构域序列(cds);以及
[0245]
(e)增加反式剪接的效率的3'转录终止子结构域(ttd),
[0246]
其中所述核酸反式剪接分子被配置成用于将所述编码结构域反式剪接至邻近于所述靶标内含子的所述选定基因的内源外显子,由此用所述功能性外显子替代所述内源缺陷性或突变外显子并校正所述选定基因中的突变。
[0247]
20.根据权利要求19所述的核酸反式剪接分子,其中所述结合结构域结合至在所述突变的3'端的所述选定基因的靶标内含子并且所述编码结构域包含在所述靶标内含子的5'端的一个或多个外显子。
[0248]
21.根据权利要求17至20中任一项所述的核酸反式剪接分子,其中所述3'转录终止子结构域形成三螺旋结构,所述三螺旋结构有效地在所述3'端戴帽。
[0249]
22.根据任何前述权利要求所述的核酸反式剪接分子,其中所述3'转录终止子结构域是来自一个或多个含有3'转录终止子的长链非编码rna(lncrna)或其它核rna分子的序列,所述序列凝集成三螺旋钝端结构。
[0250]
23.根据权利要求17至22中任一项所述的核酸反式剪接分子,其中所述3'转录终止子结构域是来自人长链非编码rna malat1。
[0251]
24.根据权利要求23所述的核酸反式剪接分子,其中所述3'转录终止子结构域包含人malat1的核苷酸8287-8437。
[0252]
25.根据权利要求23所述的核酸反式剪接分子,其中所述3'转录终止子结构域以5'至3'次序包含:包含核苷酸8287-8379的三链体形成序列、包含核苷酸8379-8380的核糖核酸酶p裂解位点和包含核苷酸8380-8437的trna样序列。
[0253]
26.根据权利要求23所述的核酸反式剪接分子,其中所述3'转录终止子结构域含有三链体形成序列,所述三链体形成序列包含富含u的基序1(8292-8301)、保守茎-环(8302-8333)、富含u的基序2(8334-8343)和富含a的区域(8369-8379),其中所述富含a的区域与所述富含u的基序2形成沃森-克里克茎双链体,并且所述富含u的基序1与所述富含a的
区域对准以形成胡斯坦碱基对。
[0254]
27.根据权利要求23所述的核酸反式剪接分子,其中所述3'转录终止子结构域是所述人malat1三螺旋的截短型式。
[0255]
28.根据权利要求27所述的核酸反式剪接分子,其中所述3'转录终止子结构域含有三链体形成序列,所述三链体形成序列包含富含u的基序1(8292-8301)、保守茎-环(8302-8310和8325-8333)、富含u的基序2(8334-8343)、富含a的区域(8369-8379)和跨越在富含u的基序2与所述富含a的区域之间的间插序列的核苷酸8345-8364的缺失,其中所述富含a的区域与所述富含u的基序2形成沃森-克里克茎双链体,并且所述富含u的基序1与所述富含a的区域对准以形成胡斯坦碱基对。
[0256]
29.根据权利要求27所述的核酸反式剪接分子,其中所述3'转录终止子结构域以5'至3'次序包含:具有不同长度和组成的三链体形成序列、核糖核酸酶p裂解位点以及具有不同长度和组成的trna样序列。
[0257]
30.根据权利要求27所述的核酸反式剪接分子,其中所述3'转录终止子结构域含有三链体形成序列,所述三链体形成序列符合三个已知基础“基序”中的一个,并且通过所述三螺旋中第三条链的碱基组成指代:嘧啶基序(t、c)、嘌呤基序(g、a)和嘌呤-嘧啶基序(g、t)。
[0258]
31.根据权利要求22所述的核酸反式剪接分子,其中所述3'转录终止子结构域包含三螺旋结构域和trna样结构域。
[0259]
32.根据权利要求31所述的核酸反式剪接分子,其中所述三螺旋结构域和所述trna样结构域源自来源于人或任何其他物种的相同长链非编码rna或长链非编码rna结构域的不同组合。
[0260]
33.根据权利要求31所述的核酸反式剪接分子,其中所述三螺旋结构域和所述trna样结构域来自malat1或neat1/menβ。
[0261]
34.根据任何前述权利要求17所述的核酸反式剪接分子,其中靶标哺乳动物基因是abca4、cep290或myo7a。
[0262]
35.根据任何前述权利要求所述的核酸反式剪接分子,其中所述基因是abca4并且所述缺陷或突变是在外显子1-23中的任一个中。
[0263]
36.根据任何前述权利要求所述的核酸反式剪接分子,所述核酸反式剪接分子另外包含一个或多个接头序列。
[0264]
37.根据权利要求26所述的核酸反式剪接分子,所述核酸反式剪接分子包含在剪接结构域与所述结合结构域之间的接头。
[0265]
38.根据权利要求36或37所述的核酸反式剪接分子,所述核酸反式剪接分子包含在所述结合结构域与3'末端结构域之间的接头。
[0266]
39.一种重组腺相关病毒(raav),所述raav包含根据权利要求1至38中任一项所述的核酸分子。
[0267]
40.根据权利要求39所述的raav,其中所述aav优先靶向感光细胞。
[0268]
41.根据权利要求39或40所述的raav,其中所述aav包含aav5衣壳蛋白、aav8衣壳蛋白、aav8(b)衣壳蛋白或aav9衣壳蛋白。
[0269]
42.一种治疗由靶标基因中的缺陷或突变引起的疾病的方法,所述方法包含:向患
有所述疾病的受试者的细胞施用包含重组aav的组合物,所述重组aav包含根据权利要求1至38中任一项所述的核酸反式剪接分子。
[0270]
43.一种治疗由靶标基因中的缺陷或突变引起的眼部疾病的方法,所述方法包含:向患有眼部疾病的受试者的眼部细胞施用包含重组aav的组合物,所述重组aav包含根据权利要求1至38中任一项所述的核酸反式剪接分子。
[0271]
44.根据权利要求43所述的方法,其中所述疾病是斯塔加特氏病、雷伯氏先天性黑蒙(lca)、视锥视杆营养不良、眼底黄色斑点症、色素性视网膜炎、年龄相关黄斑变性或尤塞氏综合征。
[0272]
45.根据权利要求43或44所述的方法,其中所述组合物是通过视网膜下注射施用。
[0273]
46.根据权利要求43所述的方法,其中所述疾病是斯塔加特氏病,所述细胞是感光细胞,眼部基因是abca4并且校正的外显子序列是外显子1-19、外显子1-22、外显子1-23或外显子1-24。
[0274]
47.一种药物制剂,所述药物制剂包含生理上可接受的载剂和根据权利要求39至41中任一项所述的raav。
[0275]
本说明书中所引用的所有出版物均以全文引用的方式并入本文中。此外,2019年4月17日申请的美国临时专利申请第62/835,164号是以全文引用的方式并入本文中。类似地,本文中所提到的并出现在所附序列表中的seq id no也以引用的方式并入。虽然已经参照特定实施例描述了本发明,但应当理解,可以在不脱离本发明的精神的情况下进行修改。此类修改意图在所附权利要求的范围内。
