一种植物可变剪接的实时荧光定量pcr检测方法及应用
技术领域
1.本发明涉及生物检测技术领域,特别涉及一种植物可变剪接的实时荧光定量pcr检测方法及应用。
背景技术:
2.可变剪接(alternative splicing,as)是指一个m-rna前体经过不同的剪接方式产生不同的mrna剪接异构体的过程,可以产生多种功能相似或完全不同的转录本,导致了转录本和蛋白质结构与功能的多态性。可变剪接不仅对基因表达的转录后调控十分重要,也极大地丰富了蛋白质结构和功能的多样性。可变剪接几乎在生物体的各个阶段和部位均有发生,参与一系列的生物学过程,同时在特定的条件或组织部位中,可以产生特定的转录本,说明可变剪接不仅参与植物生长发育和环境适应等过程,还具有特定的时间与空间作用。随着高通量测序技术的不断发展,在植物体内所发现的可变剪接远超过预期,表明可变剪接在植物体内的作用和意义仍有待于进一步探索。
3.非生物胁迫是影响植物生长和发育的重要因素,提高植物的胁迫耐受性对于植物的各项生命活动是至关重要的,可变剪接广泛参与植物对非生物胁迫逆境的转录调控过程,为植物提供了一条迅速应对环境变化的有效调控方案。一些基因在经历可变剪接后,其产物会影响其他基因的可变剪接,而后者可能又会与前者发生相互作用,抑制或增强其功能,以达到植物应对胁迫的正负调控。
技术实现要素:
4.本发明的主要目的在于提供一种植物可变剪接的实时荧光定量pcr检测方法及应用,提高可变剪接检测的效率和准确性。本发明可以通过实时荧光定量pcr扩增针对植物中不同可变剪接事件的发生及存在状态进行检测和分析,包括是否含有不同转录本以及各个转录本之间的存在情况,以此判断植物在不同生长发育阶段、不同组织部位或不同生长环境下所发生的可变剪接事件变化,为植物可变剪接机制的研究提供印证。
5.为实现上述目的,本发明采取的技术方案为:
6.一种植物可变剪接的实时荧光定量pcr检测方法,其特征在于:包括以下步骤:
7.步骤一、根据转录本序列使用特定的dna模板作为标准品;
8.步骤二、根据标准品序列进行特异性扩增引物的序列设计;
9.步骤三、根据待分析植物品种选择合适的内参基因,合成其扩增引物对;
10.步骤四、提取植物总rna并进行逆转录反应获得cdna,使用上述引物对配制反应体系,进行实时荧光定量pcr扩增;
11.步骤五、根据标准品扩增ct值和浓度绘制标准曲线,计算不同转录本的拷贝数,进行检测结果的分析。
12.优选的,所述步骤一中特定的dna选取为杨树dna,所述杨树dna为potri.003g058400,使用杨树不同处理下根组织的cdna作为模板。
13.优选的,所述步骤四中植物总rna的提取质量为260/280在1.9-2.0。
14.优选的,所述步骤三中扩增引物对中可变剪接的特异性上下游扩增引物对包括:
15.转录本1:as1-f:ttacgaagtaccgcacaccg,即seq id no.1;as1-r:ttgtgaacgagtttcagcct,即seq id no.2;
16.转录本2:as2-f:cgcgattcgaagccctatga,即seq id no.3;as2-r:gcttgcttatacgcagctttca,即seq id no4;
17.转录本3:as3-f:tggttcatgcaaggtccatca,即seq id no.5;as3-r:cacccttctctagtcgtgcc,即seq id no.6。
18.优选的,所述步骤三中内参基因的上下游扩增引物对包括:rg-f:gattacccggagaagccacc,即seq id no.7;rg-r:gttgtgtggtgctgtcatct,即seq id no.8。
19.优选的,所述步骤四中反应体系包括:所述扩增引物对、cdna、rox reference dye、2
×
sybr green pro taq hs premix和rnase free water。
20.优选的,所述步骤四中实时荧光定量pcr的扩增条件包括:
21.step1:95℃30sec;
22.step2:40个循环(两步法:95℃5sec,60℃30sec,荧光信号于60℃处收集)(三步法:95℃5sec,60℃30sec,72℃30sec,荧光信号于72℃处收集);
23.step3:95℃15sec;60℃1min;95℃15sec(每0.3℃收集一次荧光信号)。
24.与现有技术相比,本发明具有如下有益效果:
25.本发明中,本发明所提供的植物可变剪接的实时荧光定量pcr检测方法及应用,通过qrt-pcr收集基因不同转录本特异性区段的荧光信号,绘制标准曲线计算不同转录本的精确拷贝数量,以检测植物可变剪接事件存在与否,并分析不同处理或状态下的可变剪接事件变化,为植物发育或逆境胁迫等过程中可变剪接机制的研究提供佐证。
附图说明
26.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
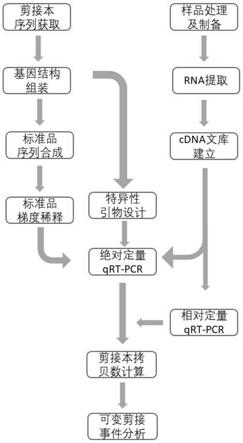
27.图1为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的技术路线图;
28.图2为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的as1的标准品扩增曲线及标准曲线;
29.图3为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的as2的标准品扩增曲线及标准曲线;
30.图4为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的as3的标准品扩增曲线及标准曲线;
31.图5为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的as1/as2/as3处理前后的转录本数量变化示意图;
32.图6为本发明一种植物可变剪接的实时荧光定量pcr检测方法及应用的
potri.005g124300不同转录本基因结构图。
具体实施方式
33.为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。
34.下面将结合本发明具体的实施例,对本发明技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.本发明提供的一种检测植物可变剪接的绝对定量技术,该技术是对植物可变剪接事件进行准确快速定量的应用。通过对基因不同转录本的特异性区段进行实时荧光定量pcr得到其在植物体内的拷贝数量从而分析发生的剪接事件。
36.实施例1样品获取
37.以苗龄为两个月左右的杨树无菌组培苗作为实验材料,选取3株以上长势均一且无明显黄叶的植株,设置处理组和对照组。非生物胁迫处理24小时后,收取对照组与处理组的根组织,放入液氮中迅速冷冻,再放入-80℃超低温冰箱备用。
38.实施例2杨树总rna的提取
39.对上述样品于使用多糖多酚植物总rna试剂盒提取总rna,rna提取试剂盒的各项提取液的组成如下表1:
40.表1多糖多酚植物总rna提取试剂盒组成表
[0041][0042]
裂解液sl在使用前加入β-巯基乙醇至终浓度5%,漂洗液rw中加入无水乙醇。
[0043]
杨树总rna提取的步骤,具体如下:
[0044]
(1)将保存好的样品于研钵中加入液氮中研磨成均匀的粉末,取50-100mg粉末置入1.5ml离心管中并加入500μl裂解液sl,涡旋震荡均匀;
[0045]
(2)12000rpm离心2min;
[0046]
(3)将上清转移至过滤柱cs上(过滤柱cs置于收集管中),12000rpm离心2min,小心
吸取收集管中的上清至新的rnase-free的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀;
[0047]
(4)缓慢加入上清液体积0.4倍的无水乙醇,混匀后转入吸附柱cr3中,12000rpm离心15sec,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
[0048]
(5)向吸附柱cr3中加入350μl去蛋白液rw1,12000rpm离心15sec,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
[0049]
(6)dnase i工作液的配制:取10μl dnase i储存液放入新的rnase-free离心管中,加入70μl rdd缓冲液,轻柔混匀;
[0050]
(7)向吸附柱cr3中央加入80μl的dnase i工作液,室温放置15min;
[0051]
(8)向吸附柱中加入350μl去蛋白液rw1,12000rpm离心15sec,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
[0052]
(9)向吸附柱cr3中加入500μl漂洗液rw,12000rpm离心15sec,倒掉收集管中的废液,将吸附柱cr3放回收集管中,重复一次;
[0053]
(10)12000rpm离心2min,将吸附柱cr3放入一个新的rnase-free离心管中,向吸附膜的中间部位悬空滴加30-50μl rnase-free ddh2o,室温放置2min,12000rpm离心1min,得到rna溶液。
[0054]
注:最终获得的rna溶液od
260
/od
280
应在1.8-2.1之间,以用作后续实验。
[0055]
实施例3rna逆转录反应
[0056]
测定rna浓度后,使用试剂盒进行逆转录反应,反应体系如下表2。
[0057]
表2逆转录反应的组分和用量表
[0058][0059]
实施例4标准品及引物合成
[0060]
根据数据库信息,获取杨树基因potri.005g124300的三个转录本as1,as2,as3的基因组dna及cds信息,使用gsds网站(http://gsds.gao-lab.org/)进行基因结构组装,找到其三个转录本间的特异性区段,进行区分并设计引物。
[0061]
引物设计要求:
[0062]
(1)引物序列g/c含量在50%-60%;
[0063]
(2)引物tm值在50℃-65℃之间
[0064]
(3)产物长度在120bp-300bp为佳
[0065]
(4)避免三个以上的g/c重复和二级结构的产生
[0066]
(5)设计时尽可能将g/c置于引物的末端
[0067]
(6)尽可能降低引物的3’互补性
[0068]
(7)对引物的特异性进行比对
[0069]
(8)若没有使用dnase,可以将引物设计在跨内含子区域,以避免gdna干扰
[0070]
基因标准品序列:
[0071]
(1)as1:
[0072]
tttcgctctatttacgaagtaccgcacaccgcccctttccttctcgctggcgcttcgttccgagaaattctaatcggacccaaaaaaaccgatccaaaaaataagaaatccctatcgatgcacgttattattaatttattttcactatcttgttaaaacctcgatttctctataaaatcataaaaaccctagctagctagtacagcttcgatccctccaccatgggagacgacaacgatgccttcatgcgcaaccaaaacgccgctgtacgcggcacgacgaaaggacagaaccgcgccaacgttctccagctcaaactgattggtcaaagtcatccgacgggattaacaacaaatctcttgaagctttttgagccccgacttcctctggagtttaaacccccgccggagaagagaaaatgcccaccttattcaggaatggctcagtttgtgagtaactttgcagagcctggtgatctggagtatgctccgcctatcaaagaggctgaaactcgttcacaaagaaaggctagaattcacatggcacgactagagaagggtgcagaaaaagctg
[0073]
(2)as2:
[0074]
tttaaaacaatttattccctggtaaggggatgttagtttgttcaagaattggtaaaattgccttgatttatcagtttttctgcaactctagcactggtggtgatgcatctcgcgattcgaagccctatgagtaaaggtttgcatggtagctgataaagtgtcaaataaacctaggggctatgctttcattgaatacatgcatacacgagacatgaaagctgcgtataagcaagctgatgggcggaagcttgatggcagaagggtactagtggatgttgaacggggtaggactgtaccaaattggcgacctcgcagactaggtggtggacttggaactaccagagttgggggtgaagaagttaatcagtaaaaacaactcttgtgcttaccagttcatt
[0075]
(3)as3:
[0076]
atggttcatgcaaggtccatcattgtttcttatgtcctctgtcttgtatctttcctctttctaagcagttttgttttatattttataactttgagggtgcattttcatgggctccagtcacaaagaaaggctagaattcacatggcacgactagagaagggtgcagaaaaagctgcagaggagctccaaaaatatgatcctaataatgat
[0077]
引物序列:
[0078]
(1)as1-f:ttacgaagtaccgcacaccg
[0079]
(2)as1-r:ttgtgaacgagtttcagcct
[0080]
(3)as2-f:cgcgattcgaagccctatga
[0081]
(4)as2-r:gcttgcttatacgcagctttca
[0082]
(5)as3-f:tggttcatgcaaggtccatca
[0083]
(6)as3-r:cacccttctctagtcgtgcc
[0084]
(7)rg-f:gattacccggagaagccacc
[0085]
(8)rg-r:gttgtgtggtgctgtcatct
[0086]
实施例5实时荧光定量pcr
[0087]
(1)标准品的稀释
[0088]
为了绘制标准曲线,对标准品进行梯度稀释,稀释倍数为10倍。为了混样更加均匀,将3μl质粒溶液加入27μl ddh2o,混匀后离心,取3μl溶液加入27μl ddh2o,以此类推,根据预实验结果,直至稀释到10-9
,可保证标准曲线完全包含全部样品。标准品溶液留作备用。
[0089]
(2)样品混合
[0090]
每组实验设置3个技术性重复,为降低系统误差,将样品cdna与反应体系中的水提前混匀以减少实验误差,同时,反应时加入的cdna浓度应稀释至200ng。
[0091]
(3)体系配制
[0092]
预先将体系中的2
×
sybr green pro taq hs premix、rox reference dye及上下游引物按照比例混匀后分装至各孔中,最后加入模板。该过程中需尽可能排尽吸头中的液体以保证一致性。离心后确认管盖及侧壁无液体残留,反应液无气泡即可进行实时荧光定量pcr反应。反应的体系和用量,具体如下表2:
[0093]
表2 pcr反应的组分和用量表(20μl)
[0094][0095]
上下游引物,具体如下表3:
[0096]
表3 pcr反应的扩增引物
[0097]
[0098][0099]
反应程序为:
[0100]
step1:95℃30sec;
[0101]
step2:40个循环(两步法:95℃5sec,60℃30sec,荧光信号于60℃处收集)(三步法:95℃5sec,60℃30sec,72℃30sec,荧光信号于72℃处收集);
[0102]
step3:95℃15sec;60℃1min;95℃15sec(每0.3℃收集一次荧光信号)。
[0103]
设备型号:abi steponeplus
[0104]
软件使用:
[0105]
(1)打开软件,选择advanced setup,进入experimentproperties界面
[0106]
(2)输入实验名称
[0107]
(3)选择仪器型号(steponeplus
tm instrument 96wells)
[0108]
(4)在实验类型中选择quantitation-standard curve
[0109]
(5)试剂种类选择sybr@green reagents
[0110]
(6)选择运行模式(standard)
[0111]
(7)进入plate setup,设置基因(target)及样本(sample)
[0112]
①
通过add new sample添加样本
[0113]
②
在assigntargets and sample界面中进行布板,其中标准曲线样品选择s,未知样品选择u,阴性对照选择n
[0114]
③
设置标准曲线:选中反应孔后候选左侧的基因,在task选项中选择s,然后在quantity中输入基因拷贝数,依次完成其余各数据点的设置。
[0115]
(8)进入setup下的run method界面,设定反应条件
[0116]
(9)运行程序
[0117]
实施例6数据获取及分析
[0118]
待程序运行完毕,选择右上角export选项导出数据,根据各浓度梯度标准品及其对应c
t
值可绘制标准曲线,并通过标准曲线计算各样品内转录本的拷贝数变化。
[0119]
计算公式如下:
[0120]
标准曲线的线型方程:y=mx+b,(|r|》0.990,r2》0.980),其中y轴为不同浓度标准
溶液所对应的c
t
值,x轴为模板的浓度对数。
[0121][0122]
c=a
×nn
此时a为最低浓度标准品的相对浓度单位:ng/μl
[0123]
mw=basepair
×
660/330/340dsdna:660ssdna:330ssrna:340
[0124]
c:浓度(通过c
t
值计算得出)单位:nm/μl
[0125]
copy=na×
n单位:copies/μl。
[0126]
结果如图5所示,为本发明实验关于杨树基因potri.005g124300三个不同转录本在胁迫下的剪接变化结果,经过计算比对发现,该基因各转录本在应对胁迫时表达水平均有上升,其中as1数量变化不显著且占比极低,as2所占比例大幅上升,而as3的占比则有所下降,说明该基因在胁迫相应过程中,剪接事件里首个外显子可变剪接(alternative first exon,afe)发生较多,为后续其剪接机制的深入研究提供验证手段。
[0127]
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
