1.本发明属于医药化学领域。具体的,本发明提供了一种治疗泌尿系统结石症症的药物,所述药物为包含特定结构的黄酮醇类化合物、呫吨酮(xanthone)类化合物和糖脂作为主要活性成分的植物瓜子金(polygala japonica houtt.)提取物。其中,所述提取物优选是瓜子金茎叶部分的提取物。本发明的药物在治疗泌尿系统结石症及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药具备明显优于现有主流临床药物枸橼酸氢钾钠、副作用更小,具备良好的医药经济价值。
背景技术:
2.泌尿系统结石症(简称尿石症)是人类最早发现的疾病,早在公元前4800年,距今6800年以前埃及el amrah坟墓中发现尿石。2000多年前希波克拉底注意到肾结石发生肾脓肿,也描述痛风。我国两千年前古医书中也有、石淋和砂淋的记载。尿石症不仅是人类的病,也可见于动物。
3.尿石症是由于泌尿系统结石症而引起的病症的统称,其结石是由尿液中的晶体析出凝聚而成。尿结石的发病机制与尿中存在促使形成结石的盐类过饱和的因素(如盐类排泄过多,尿液酸度,尿量减少),预先形成的核心(如尿酸结晶和其他结石)以及结晶生成抑制物异常有关。特发性高钙尿症[男性尿钙》300mg/d(》7.5mmol/d),女性》250mg/d(6.2mmol/d)],是一种遗传性疾病,见于 50%有钙结石的男性和 75%有钙结石的女性。低枸橼酸尿症[尿枸橼酸《350mg/d (《1820μmol/d)]单独存在或伴有其他疾病时,可促使结石形成,因为正常情况下,枸橼酸能结合尿钙形成可溶性枸橼酸钙盐。
[0004]
世界上有许多尿石高发地区,称为结石区,当时主要指营养不良,小儿膀胱结石高发地区。尿石发病率比较高的地区为美国东南部、英国、北欧诸国、地中海国家、北印度、巴基斯坦、北澳大利亚、中欧、马来半岛、中国南部等。发病率较低的地区为中美和南美、非洲等。尿石症在我国发病率平均为 5%,尿石症患者约 5000 万,分布有一定地区性,以广东、广西、云南、贵州、山东、湖南、江西及安徽省等地区发生率较高,南方发病率明显高于北方,其中发病率最低的黑龙江为2.5%、发病率最高的贵州为最高达59%,相差20倍之多。而且尿石症复发率很高,约为15~50%。
[0005]
长期以来,人们在不断探索尿石症的有效治疗方法,包括体外冲击波碎石治疗、输尿管软镜碎石取石、皮肾镜微创碎石取石、(结石直径≤2cm)、开放性手术治疗(结石直径≥2cm)、药物治疗(结石直径<0.6cm)等各种方法。其中,体外冲击波碎石对输尿管上、中、下窄口处的结石进行碎石,不可避免的会造成输尿管损伤,对肾盂处的结石冲击碎石也可能导致肾损伤,临床上血尿明显。输尿管软镜碎石、取石,也会导致输尿管和肾的损伤,可能造成取石不完全。皮肾镜微创碎石、取石,会导致肾损伤和可能取石不完全。随着临床医学的发展,目前已经很少采用开放性手术治疗肾结石了。
[0006]
临床上西医治疗泌尿系统结石症常用枸橼酸氢钾钠颗粒、枸橼酸钾、噻嗪类利尿剂、镁剂、乙酰半胱酸等促排剂,其疗效不甚理想,且毒副反应明显。枸橼酸氢钾钠颗粒(商
品名:友来特)是 1965 年德国马博士大药厂(madaus ag)全球首先开发成功溶解和预防尿酸结石的枸橼酸盐制剂。2005 年被中华医学会泌尿外科学会分会尿石学组推荐为迄今为止国内唯一合法的具有独立化学结构的、具有溶石功效的枸橼酸盐制剂。但是,枸橼酸氢钾钠颗粒需摄入非常高的有效剂量,日剂量为4袋(每袋为2.5克,共10克颗粒),分三次饭后服用。早晨、中午各一袋,晚上服两袋,颗粒可以用水冲服。其中1克枸橼酸氢钾钠含有0.172克或4.4mmol钾且含有0.1克或4.4mmol钠(相当于0.26克氯化钠)。每日服用如此大量的钠钾离子会引发严重的高钾血症、心律失常、高血压等严重疾病,因此严重限制了该药物的使用范围。
[0007]
在我国,在临床和医学研究中也探索了大量的中草药和中成药治疗方案。例如中国专利申请cn103285355a、cn103704591a、cn104083644a、cn105213919a、cn105998861a、cn1653929a等记载了一系列的治疗尿结石症的多组方中草药。但多组方中草药普遍存在成分复杂、制药工艺原始、质量控制难、定量检测方法不准确、服用量大等问题、质量控制标准不完善、不符合现代临床制药标准和用药要求的问题。此外,一些传统的中成药如泌石通、排石冲剂、石淋通片、热淋清颗粒也是常见的用于治疗泌尿系统结石的中成药药物。但是以上这些传统的中成药,存在成分复杂、制药工艺原始、质量控制难、定量检测方法不准确、服用量大等问题,质量控制标准不完善。且不符合现代临床用药要求。
[0008]
而随着我国药品评审制度改革的不断深入,对于申报注册的药品的质量要求不断提高。其中,对于中草药及其活性提取成分的临床试验,新的审批标准一般需要对比相同适应症的典型西药(如治疗泌尿系统结石的枸橼酸氢钾钠)进行双盲对比试验,并要求所述的天然药物或其提取物在临床试验中取得与相同适应症的西药(化合物药物)相同或更优的临床药效和安全性时,所述药物才可能获得批准上市。由于这一高要求的天然药物的评审标准,当前我国每年有40-50个化学和生物新药的上市许可,但每年仅仅1-2个中药或者天然药物的上市许可。因此,近年来虽然有制药企业尝试从各类中草药中提取有效活性提取物和有效活性成分用于治疗泌尿系统结石症,却几乎无一获得上市许可。甚至有个别药物进入ii/iii期临床试验后最终仍然无果而终。其中重要的原因是对这些药物活性部位和活性成分的研究不足,导致这些药物的临床有效性和安全性明显不如枸橼酸氢钾钠等已有的典型临床西药,因而未能通过评审,获得上市许可。
[0009]
因此,开发成本低廉、工艺简便、安全有效、质量稳定可控、疗效明确、副作用小(相当于或优于现有泌尿系统结石症主流药物枸橼酸氢钾钠)、体内吸收更好、符合现代药品注册要求的泌尿系统结石症药物,仍然是医药界的迫切追求。
[0010]
瓜子金是一种广泛分布于我国的远志科植物(polygala japonica houtt.)。在我国民间曾被广泛药用,主要用于祛痰止咳、散瘀止血、宁心安神、解毒消肿等。
[0011]
《中国药典》(2015版一部)收载的中药瓜子金功能与主治为祛痰止咳,活血消肿,解毒止痛。用于咳嗽痰多,咽喉肿痛;外治跌打损伤,疔疮疖肿,蛇虫咬伤。
[0012]
《中国药典》(2015版一部)收载的瓜子金成方制剂为复方瓜子金颗粒,处方为:瓜子金150g,大青叶350g,野菊花200g,海金沙250g,白花蛇舌草250g,紫花地丁200g。功能与主治为清热利咽,散结止痛,祛痰止咳。用于风热袭肺或痰热壅肺所致的咽部红肿、咽痛、发热、咳嗽;急性咽炎、慢性咽炎急性发作及上呼吸道感染见上述证候者。
[0013]
此外,还有大量的专利文献记载了提取瓜子金的各种有效成分用于医药用途。例
如专利cn1303097c记载了瓜子金皂苷类化合物及其苷元、总皂苷及其总皂苷元及其在治疗抑郁、益智、镇静、抗焦虑和催眠的作用。专利cn104004110b记载了一种从瓜子金中提取的瓜子金多糖在制备增强机体免疫功能药物及保健食品中的应用。专利cn108159126a记载了瓜子金皂苷提取物在制备抗肿瘤药物中的应用。专利cn103006793b记载了瓜子金抗炎有效部位的分离纯化工艺,并公开了瓜子金总黄酮和总皂苷提取物是抗炎有效部位。专利cn108948125a,利用瓜子金制备瓜子金皂苷元的方法,提及了制备瓜子金皂苷元的方法和瓜子金黄酮的方法,其中提及了四种具体的黄酮分子:叶含山柰酚
‐3‐o‐6”‐o‐
(3
‐
羟基
‐3‐
甲基
‐
戊二酰基)葡萄糖甙、紫云英甙、山柰酚3
‐
(6
‐
乙酰基)葡萄糖甙、山柰酚3,7
‐
二葡萄糖甙。但是并没有确认所述提取成分的药用活性。而且,现有的公开文献均没有公开瓜子金特定提取物用于治疗泌尿系统结石症的用途。
[0014]
另外,上述专利均使用瓜子金全草,且将皂苷类化合物作为不可或缺的活性成分。《中国药典》(2015版一部)记载的瓜子金的化合物质控检测标准是:按干燥品计算,含瓜子金皂苷己(c53h86o23)不得少于0.60%。而瓜子金化学成分有皂苷类、黄酮类、糖脂类、生物碱类、酚类、鞣质类、多糖等,成分非常复杂,仅据cnki中国知网文献查询就有超过100种确定分子结构的化合物。因此很难将瓜子金全草开发成符合现代药用标准的天然药物,事实上,目前市场上仅有瓜子金复方制剂销售,连作为单一中草药使用的瓜子金都没有上市销售。
技术实现要素:
[0015]
因此,本发明的主要目的在于,提供一种成本低廉、工艺简便、安全有效、质量稳定可控、疗效明确、副作用小(相当于或优于现有泌尿系统结石症主流药物枸橼酸氢钾钠)、体内吸收更好、符合现代药品注册要求的泌尿系统结石症药物。
[0016]
本发明人经过大量的试验研究发现,由植物瓜子金(polygala japonica houtt.)提取得到的包含式(i)特定结构的黄酮醇类化合物药用活性提取物。
[0017]
具体来说,本发明提供了一种由植物瓜子金(polygala japonica houtt.)提取得到的药用活性提取物,其包含下述式(i)结构的作为第一活性成分的黄酮醇类化合物。
[0018]
(i)其中,r1为选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-api,
ꢀ‑
orha,
ꢀ‑
o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-api,
ꢀ‑
o-glc-rha,
ꢀ‑
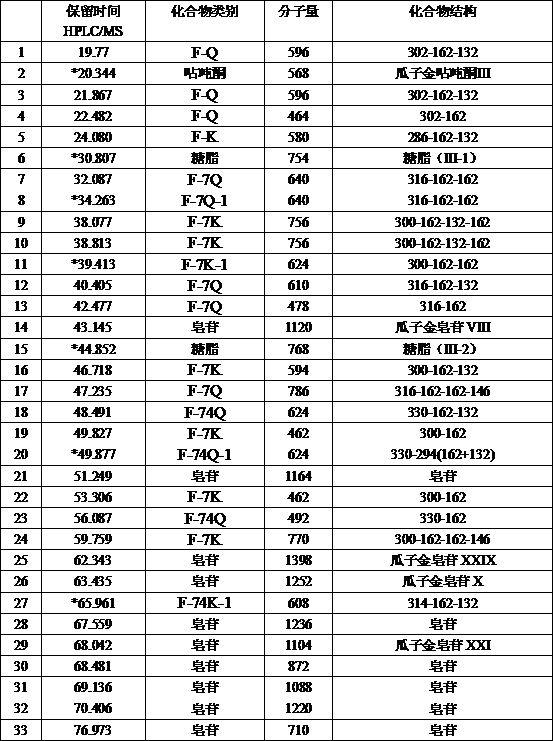
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-api,
ꢀ‑
o-gal-rha,
ꢀ‑
o-glc-glc-api,
ꢀ‑
o-gal-glc-api,-o-glc-gal-api ,-o-gal-gal-api,-o-gal-rha-gal,-o-gal-rha-glc,-o-glc-rha-glc,-o-glc-rha-gal;r2为选自-oh,
ꢀ‑
o-me,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-api、-o-rha的取代基;
r3为选自h, oh,
ꢀ‑
o-me,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-api、-o-rha的取代基;r4为选自oh,
ꢀ‑
o-me的取代基;所述药用活性提取物任选地包含:选自下述式(ii)的作为第二活性成分的呫吨酮类化合物、和选自下式(iii)的作为第三活性成分的糖脂类化合物(ii)其中,r5为选自-o-gal,
ꢀ‑
o-api,
ꢀ‑
orha,
ꢀ‑
o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-api,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-api,
ꢀ‑
o-gal-rha,
ꢀ‑
o-api-glc,
ꢀ‑
o-api-gal,
ꢀ‑
o-api-api,-o-api-rha的取代基;r6为选自-oh,
ꢀ‑
o-me的取代基;(iii)其中,r7、r8各自独立地选自h、ch3;其中,上述式(i)和式(ii)中r1~r6定义所述的glc表示葡萄糖基、gal表示半乳糖基、api表示芹糖基、rha表示鼠李糖。
[0019]
在优选的技术方案中,所述的作为第一活性成分的式(i)结构的黄酮醇类化合物优选选自下述通式化合物中的一种或多种(f-7k)其中,r1为选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,-o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-rha,
ꢀ‑
o-glc-glc-api,
ꢀ‑
o-gal-glc-api,
ꢀ‑
o-glc-gal-api ,-o-gal-gal-api
(f-7q)其中,r1选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-api,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-api,
ꢀ‑
o-gal-rha,
ꢀ‑
o-glc-glc-api,
ꢀ‑
o-gal-glc-api,-o-glc-gal-api ,-o-gal-gal-api,-o-gal-rha-gal,-o-gal-rha-glc,-o-glc-rha-glc,-o-glc-rha-gal(f-74q)其中,r1选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,-o-glc-api,
ꢀ‑
o-gal-api,(f-k)其中,r选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-rha,(f-q)其中,r选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-rha(f-74k)其中,r选自-oh,
ꢀ‑
o-gal,
ꢀ‑
o-gal-api;所述的作为第二活性成分的式(ii)结构的呫吨酮(xanthone)类化合物优选选自下式(ii-1)、(iii-2)、和(ii-3)中的一种或多种
(ii-1,polygalaxanthone
ꢀⅲ
)(ii-2,polygalaxanthone
ꢀⅺ
)(ii-3,polygalaxanthone viii)所述作为第三活性成分糖脂类化合物优选为下式(iii-1)或(iii-2)的化合物:(iii-1,3, 6
ʹ
ꢀ‑
disinapoyl sucrose)(iii-2,tenuifoliside c)。
[0020]
在进一步优选的技术方案中,所述的瓜子金药用活性提取物中的第一活性成分选自上述通式f-7k、f-7q、f-74q、f-74k的黄酮醇类化合物。
[0021]
在进一步优选的技术方案中,所述的瓜子金药用活性提取物中的第一活性成分优选选自下述化合物的至少一种:
(f-7q-1)、(f-7k-1)、(f-74q-1)。
[0022]
在进一步优选的技术方案中,所述的瓜子金药用活性提取物中,作为第一活性成分的式(i)结构的黄酮醇类化合物、以及任选的作为所述第二活性成分的式(ii)结构呫吨酮(xanthone)类化合物和式(iii)结构糖脂的总含量占瓜子金总提取物的30~100%。其中,所述成分含量(%)是根据业界通行的方法使用hplc积分面积归一法测算的hplc%含量。
[0023]
在进一步优选的技术方案中,所述的瓜子金药用活性提取物中,所述作为第一活性成分的式(i)结构的黄酮醇类化合物总含量占瓜子金总提取物的20~100%。
[0024]
在进一步优选的技术方案中,所述的瓜子金药用活性提取物中,所述作为第一活性成分的式(i)结构的黄酮醇类化合物总含量占瓜子金总提取物的75~100%。
[0025]
本发明还提供了所述瓜子金药用活性成分提取物的制备方法,包括如下步骤(1)瓜子金的预处理取瓜子金全草或瓜子金地上部分、或市售瓜子金药材,洗净,粉碎,得瓜子金原料;(2)瓜子金有效部位的粗提取步骤(1)所得的瓜子金原料若干,以约瓜子金原料重量6~12倍的、浓度20~95%(v/v)的乙醇加热回流,每次回流1~3小时,反复回流提取1~3次,合并所得的醇提取液,过滤或离心,浓缩,得瓜子金总醇提物;或者,取步骤(1)所得的瓜子金原料若干,以约瓜子金原料重量6~15倍的去离子水加热
至沸腾并保持沸腾1~3小时,反复提取1~3次,合并所得的水提取液,过滤或离心,浓缩,得瓜子金总水提物;(3)瓜子金有效部位的精制将步骤(2)中的瓜子金总水提物或总醇提物浓缩液用大孔吸附树脂或聚酰胺树脂色谱柱分离,依次用不同配比的水/乙醇梯度洗脱至流出液无色,收集0~95%乙醇洗梯度脱液,减压干燥,即得到所需要的瓜子金药用活性提取物。
[0026]
在上述提取方法中,优选所述步骤(3)中所述大孔树脂选自d101型、 hpd100型、hpd200型或ab-8型大孔树脂,所述聚酰胺树脂选自100-200目沪试聚酰胺树脂。
[0027]
在上述提取方法中,优选所述步骤(1)中瓜子金优选为瓜子金的茎叶部分。
[0028]
在上述提取方法中,优选所述步骤(3)中所述大孔树脂选自d101型或 ab-8型大孔树脂,所述聚酰胺树脂选自100-200目沪试聚酰胺树脂。
[0029]
在上述提取方法中,优选述步骤(3)中的梯度洗脱依次采用水、25%乙醇、50%乙醇、75%乙醇、95%乙醇洗脱至流出液无色。
[0030]
本发明提供了瓜子金药用活性成分提取物在制备药物中的用途,所述的药物用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药。
[0031]
本发明还提供了一种药物组合物,其包含选自下式化合物中的至少一种作为活性成分:(f-7q-1)、(f-7k-1)、(f-74q-1)。
[0032]
在一个优选的技术方案中,所述的药物组合物进一步包含药学上可接受的载体、赋形剂或辅料。
[0033]
本发明进一步提高了上述的药物组合物在制备药物中的用途,所述的药物用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治
疗泌尿系统结石症后的辅助用药。
[0034]
本发明还提供了下述化合物中任一种在制备药物中的用途,(f-7q-1)、(f-7k-1)、(f-74q-1)所述的药物用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药。
[0035]
本发明人通过大量的试验研究发现,本发明的活性提取物在治疗泌尿系统结石症及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药等方面,具有明显优于目前已知的公开文献中记载的中草药、植物药提取物的效果,并且具备与已知临床西药枸橼酸氢钾钠相当或更优的效果(具体参见后述药理实施例)。初步的研究表明,关键在于本发明选取的作为主要活性成分的式(i)和式(ii)化合物在所述的黄酮类化合物和呫吨酮(xanthone)类化合物的羰基的β位具备一个羟基取代基,该羟基与酮羰基共同作用,能够更有效地与泌尿系统中的含钙离子结石成分发生反应,从而更有效地降解或溶解泌尿系统的结石。
[0036]
因此,在本发明的一个具体技术方案中,提供了前述式(i)、式(ii)化合物中的任一种、或其两种或多种的组合在制备药物中的用途,所述的药物用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药。
[0037]
在本发明的一个优选的技术方案中,提供了前述式(i-1)~(i-4)、和/或式(ii-1)~(ii-3)化合物中的任一种,或其两种或多种的组合在制备药物中的用途,所述的药物用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药。
[0038]
本发明的瓜子金药物活性提取物还可以采用制剂学的常规方法制备成各种剂型,如胶囊、片剂、丸剂、口服液、颗粒剂、酊剂、缓释剂等胃肠道给药剂型及注射剂、外用制剂等
胃肠外给药剂型。
[0039]
附图的说明图1为本发明的瓜子金全草醇提的hplc分析图谱图2为本发明的瓜子金地上部分醇提的hplc分析图谱图3为本发明的瓜子金地上部分聚酰胺树脂梯度洗脱后所得有效部位的hplc分析图谱图4为本发明化合物f-7q-1的c-h相关二维核磁共振谱图图5为本发明化合物f-7q-1的c-h远程二维核磁共振相关谱图图6为本发明化合物f-7k-1的c-h相关二维核磁共振谱图图7为本发明化合物f-7k-1的c-h远程相关二维核磁共振谱图图8为本发明化合物f-74q-1的c-h相关二维核磁共振谱图图9为本发明化合物f-74q-1的c-h远程相关二维核磁共振谱图图10为本发明药物的肾小管扩张病变动物试验he镜下观察结果(正常组)图11为本发明药物的肾小管扩张病变动物试验he镜下观察结果(模型组)图12为本发明药物的肾小管扩张病变动物试验he镜下观察结果(枸橼酸氢钾钠药物组)图13为本发明药物的肾小管扩张病变动物试验he镜下观察结果(低剂量组)图14为本发明药物的肾小管扩张病变动物试验he镜下观察结果(中剂量组)图15为本发明药物的肾小管扩张病变动物试验he镜下观察结果(高剂量组)
实施例
[0040]
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0041]
一、制备实施例制备实施例1:瓜子金全草醇提成分分析称取瓜子金全草,加入10倍药材量的75%乙醇,加热回流,提取3次,每次3小时,趁热过滤,然后合并醇提液;将醇提液浓缩至相对密度为1.1-1.3克/毫升的提取浓缩液。
[0042]
使用hplc对所获得瓜子金全草醇提提取浓缩液进行指纹图谱分析。
[0043]
hplc试验条件流动相:乙腈(a)、0.1%甲酸水溶液(b),二元梯度分离;流速:0.8ml
·
min-1;检测波长:330nm;柱温:20℃;进样量:20μl。
[0044]
记录90min色谱图。
[0045]
制备实施例2:瓜子金全草的水提成分分析称取瓜子金全草,加入10倍药材量的去离子水,加热回流,提取2次,每次3小时,趁热过滤,然后合并水提液,提取液是深棕黄色的液体。
[0046]
将水提液浓缩至相对密度为1.1-1.3克/毫升的提取浓缩液。
[0047]
使用hplc对所获得瓜子金全草水提提取浓缩液进行指纹图谱分析(具体参见说明书附图图1),基本上可以确定,所述的提取物中主要包含了四大类成分几十种化合物以及其他种类的几十种化合物。其中hplc图谱中,呫吨酮(xanthone)类化合物出峰时间在12-25分钟之间,黄酮醇类化合物出峰时间在18-68分钟之间,糖脂主要出峰时间在15-45分钟之间,而皂苷的出峰时间在42-85分钟之间。
[0048]
对比水提法和醇提法所获得的成分可以发现:由于水的极性比较大,采用水提法获得的提取物中叶绿素一类的极性比较低的杂质含量就会比较少、而高极性的鞣质成分比较多。提取物呈深棕黄色。而醇提物中低极性成分(如叶绿素等)含量较多、而高极性成分(如鞣质等)的含量显著降低。醇提物显示为偏绿色,但冷却静置后呈棕黄色。
[0049]
全草提取对药用植物的消耗是巨大的,考虑到市售的瓜子金药材多为地上部分,而仅选取地上部分,保留植物根部,对于保护药材植物资源也是有利的。因此,发明人进一步尝试采用醇提法第瓜子金的地上部分提取有效成分。具体方法如下。
[0050]
制备实施例3:瓜子金地上部分的水提成分分析称取瓜子金地上部分,加入10倍药材量的去离子水,加热回流,提取3次,每次3小时,趁热过滤,然后合并水提液;将水提液浓缩至相对密度为1.1-1.3克/毫升的提取浓缩液。
[0051]
使用hplc对所获得瓜子金地上部分去离子水提提取浓缩液进行指纹图谱分析。
[0052]
制备实施例4:瓜子金地上部分的醇提成分分析称取瓜子金地上部分,加入10倍药材量的50%乙醇,加热回流,提取3次,每次3小时,趁热过滤,然后合并醇提液;将醇提液浓缩至相对密度为1.1-1.3克/毫升的提取浓缩液。
[0053]
使用hplc对所获得瓜子金地上部分醇提提取浓缩液进行指纹图谱分析。(结果详见附图2)。
[0054]
为了确认此提取浓缩液的化学组成成分,我们通过hplc-ms分析,其中的ms分析包括正离子和负离子以及ms-ms,ms-ms-ms分析,并将分析结果与现有文献进行比对,初步确认了黄酮醇类化合物、占吨酮、糖脂和皂苷四大类的化合物结构类型,进一步的我们根据黄酮醇类化合物母核的差异又将黄酮醇类化合物进行了细分。
[0055]
但是由于糖苷中糖的空间结构及连接方式的复杂性和多样性。通过hplc和多级串联ms,我们能判断多个糖苷与黄酮醇类化合物母核连接的是不是单条糖链,以及糖苷在质谱断裂的次序以确认糖链末端糖的分子量及糖元的基本类型。但是,由于糖苷中糖的空间结构及连接方式的复杂性和多样性。对于同分异构体的糖环的某一个碳原子上的羟基的构型(比如是葡萄糖还是半乳糖)、糖苷与糖苷的糖链链接位置(比如是1-2链接,还是1-4链接,还是1-6链接)、以及及糖的构型α还是β构型则需要借助其他手段进一步鉴定。因此,仅通过hplc-ms-ms鉴定的结构,分子式相同的化合物存在黄酮醇类化合物苷元与不同种类糖苷多种结构组合的可能。
[0056]
为了便于区分,本技术对存在多种结构单元组合可能的化合物使用化合物类别进行标识区分。例如本技术中用f表示黄酮醇类化合物大类,f-q表示黄酮醇类化合物大类的母核为槲皮素的一类黄酮醇苷,结构判断中302-162-132表示黄酮醇苷元母核为槲皮素连接一个葡萄糖(或半乳糖)在这个葡萄糖(或半乳糖)上连接一个芹糖,302为槲皮素母核,
162为葡萄糖(或半乳糖)质谱断裂碎片特征峰分子量,132为芹糖断裂碎片特征峰分子量。
[0057]
经hplc和多级串联ms分析,初步确认瓜子金地上部分的醇提物主要包含如下成分:表1:瓜子金地上部分醇提物成分分析上表中,所述的化学成分结构主要包括如下几类:(一)带糖苷的黄酮醇1、化合物类别为f-7k黄酮醇苷类化合物。其中,所述化合物的苷元结构是分子量300的rhamnocitrin或3,4',5-trihydroxy
ꢀ‑
7-methoxyflavone, 或7-methoxyl-kaempferol,所述化合物具有如下通式结构:
(f-7k)其中,r1=糖基,可选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,-o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-rha,
ꢀ‑
o-glc-glc-api,
ꢀ‑
o-gal-glc-api,
ꢀ‑
o-glc-gal-api ,-o-gal-gal-api,2、化合物类别为f-7q的黄酮醇苷类化合物。其中,所述化合物的苷元结构是分子量316的rhamnetin或3, 3', 4',5-tetrahydroxy
ꢀ‑
7-methoxyflavone,或 7-methoxyl-quercetin,所述化合物具有如下通式结构:(f-7q)其中,r1=糖基,可选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-glc,
ꢀ‑
o-glc-gal,
ꢀ‑
o-glc-api,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-glc,
ꢀ‑
o-gal-gal,
ꢀ‑
o-gal-api,
ꢀ‑
o-gal-rha,
ꢀ‑
o-glc-glc-api,
ꢀ‑
o-gal-glc-api,-o-glc-gal-api ,-o-gal-gal-api,-o-gal-rha-gal,-o-gal-rha-glc,-o-glc-rha-glc,-o-glc-rha-gal;3、化合物类别为f-74q的黄酮醇苷类化合物。其中,所述化合物的苷元结构是分子量为330的ombuine或3,5,3
ʹ-trihydroxy 7, 4
ʹ-dimerhoxyflavone,或7, 4
ʹ-dimerhoxyl-quercetin, 所述化合物具有如下通式结构:(f-74q)其中,r1为糖基, 可选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,-o-glc-api,
ꢀ‑
o-gal-api,4、化合物类别为f-k的黄酮醇苷类化合物。其中,所述化合物的苷元结构是分子量为286的kaempferol或3,4',5,7-tetrahydroxyflavone,所述化合物具有如下通式结构:(f-k)
其中,r可选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-rha,5、化合物类别为f-q的黄酮醇苷类化合物。其中,苷元结构是分子量为302的quercetin或3,3',4',5,7-pentahydroxyflavone,所述化合物具有如下通式结构:(f-q)其中,r可选自-oh,
ꢀ‑
o-glc,
ꢀ‑
o-gal,
ꢀ‑
o-glc-rha,
ꢀ‑
o-gal-rha6、化合物类别为f-74k的黄酮醇苷类化合物。其中,苷元结构是分子量为314的ermanin or 3,5-dihydroxy 7, 4
ʹ-dimerhoxyflavone,or 7, 4
ʹ-dimerhoxyl-kaempferol, 所述化合物具有如下通式结构:(f-74k)其中,r=糖基,可选自-oh,
ꢀ‑
o-gal,
ꢀ‑
o-gal-api。
[0058]
(二)瓜子金呫吨酮(xanthone)类化合物通过二次质谱能够确认所述瓜子金呫吨酮(xanthone)类化合物选自下式(ii-1)、(ii-2)和(ii-3)(ii-1,polygalaxanthone
ꢀⅲ
)(ii-2, polygalaxanthone
ꢀⅺ
)
(ii-3, polygalaxanthone viii)。
[0059]
(三)糖脂类化合物通过二次质谱能够确认所述糖脂类化合物的结构选自下式(iii-1)和(iii-2)(iii-1,3, 6
ʹ
ꢀ‑
disinapoyl sucrose)(iii-2,tenuifoliside c)(四)皂苷类化合物hplc和多级串联ms分析,能够确认本技术的瓜子金地上部分醇提物中包括polygalasaponin viii, polygalasaponin xxi , polygalasaponin x, polygalasaponin xxix等皂苷类化合物。
[0060]
瓜子金地上部分的醇提物除包含黄酮醇类和呫吨酮类等目标活性成分之外,还包含皂苷、糖脂等成分。因此,本发明人进步尝试通过大孔树脂、聚酰胺树脂等分离方法对上述瓜子金地上部分的醇提物进一步精制,以分离富集目标活性成分。
[0061]
制备实施例5:瓜子金地上部分醇提物的大孔树脂精制处理将制备实施例1所得提取浓缩液,以每小时1倍柱床体积的流速通过d101大孔吸附树脂柱,吸附完毕后,先用8倍树脂量的水洗脱除杂,再分别用2-5倍柱床体积的0%-25,25%-50%,50%-75%,75%-95%乙醇梯度洗脱,洗脱流速以每小时0.5-2倍柱床体积的进行,得到洗脱液;并将不同浓度乙醇洗脱液分别浓缩5-20倍使之相对密度为1.1-1.3克/毫升的洗脱浓缩液。
[0062]
使用hplc对所获得瓜子金全草醇提取浓缩液,经大孔吸附树脂柱乙醇梯度洗脱浓缩液成分分别进行指纹图谱分析。
[0063]
制备实施例6:瓜子金地上部分水提物的聚酰胺树脂精制处理将制备实施例3所得提取浓缩液,以每小时0.5-1倍柱床体积的流速通过聚酰胺树脂柱,吸附完毕后,先用2-8倍树脂量的水洗脱除杂,再分别用2-5倍柱床体积的0-25%、25%-50%、50%-75%、75%-95%乙醇梯度洗脱,洗脱流速以每小时0.5-2倍柱床体积的进行,得到洗
脱液;将上述不同浓度乙醇洗脱液分别浓缩5-20倍使之相对密度为1.1-1.3克/毫升的洗脱浓缩液。
[0064]
比较大孔树脂和聚酰胺树脂的分离效果,可以发现聚酰胺树脂能够更好地去除瓜子金提取物的皂苷成分,分离精制效果更佳。
[0065]
使用hplc对所获得瓜子金地上部分提取浓缩液经聚酰胺树脂柱乙醇梯度洗脱浓缩液成分分别进行指纹图谱分析。
[0066]
经hplc分析确定其中0-25%乙醇洗脱部分的橙红色洗脱浓缩液,有效成分(i)、(ii)、(iii)总含量为50%-90%。(如说明书附图3所示)。
[0067]
将此洗脱浓缩液经75℃减压干燥,粉碎,得到瓜子金地上部分的富集有效成分,用于药效对比实验。
[0068]
将瓜子金地上部分的富集有效成分经过hplc-ms分析,其中的ms分析包括正离子和负离子以及ms-ms,ms-ms-ms分析,并将分析结果与现有文献进行比对确认了如下表2的化合物结构。
[0069]
表2:瓜子金地上部分水提-聚酰胺树脂精制提取物的成分分析
基于上述分析,可以确认,瓜子金地上部分水提-聚酰胺精制提取物的主要成分包括化合物类别为f-7k、f-7q、f-74q、f-74k的黄酮醇类化合物,以及式(ii-1)呫吨酮化合物(polygalaxanthone
ꢀⅲ
)和糖脂化合物。
[0070]
其中,表2中含量占比为18.97%的化合物标识为f-7k-1,含量占比为33.71%的化合物标识为f-7q-1,含量占比为23.60%的化合物标识为f-74q-1,含量占比为4.81%的化合物表标识为化合物f-74k-1(远志醇b)。
[0071]
其中,上述化合物类别名称的含义与表1的含义完全相同。
[0072]
需要特别强调的是,由于提取瓜子金植物的具体部位的不同(全草、根茎、或茎叶)、产地来源的不同、以及瓜子金植物的制备的不同(市售的干燥草药、新鲜的瓜子金植
物)以及具体提取精制的工艺条件的不同,都可能导致所获得活性成分提取物中活性成分结构及含量存在不同程度的差异。本发明优选为新鲜的或者干燥的瓜子金地上部分经水提、聚酰胺柱醇/水梯度洗脱获得的活性成分提取物。
[0073]
制备实施列7:主要活性化合物的分离精制hplc-ms-ms在确定黄酮醇类化合物的母核以及在分子内有多个糖环存在的时候可以根据明显特征来判断是否是单糖链。但是对于分子量相同的糖环的某一个碳原子上的羟基的构型(比如是葡萄糖还是半乳糖)判别依据不足。当一条糖链上带两个以上糖环的糖的链接位置(比如是1-2链接,还是1-4链接,还是1-6链接)以及及糖的构型α还是β构型判据不足。为此,通过半制备hplc分离主要活性成分的纯化合物,结合核磁共振氢谱、碳谱、以及二维核磁共振确定其具体结构。
[0074]
通过半制备的hplc进行了纯化对实施例5制备的提取物进行进一步分离纯化,分别收集到了所述提取物中含量最高的三个组分的纯的单一化合物,即,获得了化合物f-7q-1、f-7k-1、f-74q-1的纯的单一化合物。
[0075]
半制备的hplc仪器及条件如下:hplc试验条件流动相:乙腈(a)、去离子水(b),二元梯度分离;半制备柱:19
×
250mm,c18流速:8ml
·
min-1;检测波长:330nm;柱温:室温;进样量:0.5ml。
[0076]
记录180min色谱图。
[0077]
对化合物f-7q-1、f-7k-1、f-74q-1分别进行了核磁共振和二维核磁共振的结构分析。分析结果如下:1、化合物f-7q-1的结构确认分子量:640,糖链 :316-162-162,化合物f-7q-1的二维核磁共振相关关键信息归纳如下表:no.δhδch-hcosyhmbc(h
→
c)2
‑‑
156.1
ꢀꢀ3‑‑
133.0
ꢀꢀ4‑‑
177.4
ꢀꢀ5‑‑
160.9
ꢀꢀ
66.34(1h,s)97.8 c-5,7,8,107
‑‑
164.9
ꢀꢀ
86.69(1h,s)92.0 c-6,7,9,109
‑‑
156.1
ꢀꢀ
10
‑‑
104.8
ꢀꢀ1ʹ
‑‑
119.9
ꢀꢀ2ʹ
7.57(1h,s)115.5 c-2,1
ʹ
,3
ʹ
,4
ʹ3ʹ
‑‑
145.4
ꢀꢀ4ʹ
‑‑
150.3
ꢀꢀ5ʹ
6.81(1h,d,j=8.4)115.3h-6
ʹ
c-1
ʹ
,3
ʹ6ʹ
7.72(1h,d,j=8.4)122.4h-5
ʹ
c-2,2
ʹ
,4
ʹ-och33.86(3h,s)56.1
ꢀꢀ
gal-1
ʹʹ
5.69(1h,d,j=7.6)98.4 c-3,3
ʹʹ2ʹʹ
3.79(m)80.9
ꢀꢀ3ʹʹ
3.59(m)73.4
ꢀꢀ4ʹʹ
3.64(m)67.6
ꢀꢀ5ʹʹ
3.35(m)75.9
ꢀꢀ6ʹʹ
3.26,3.42(m)59.9
ꢀꢀ
glu-1
ʹʹʹ
4.60(1h,d,j=7.7)104.4 c-2
ʹʹ2ʹʹʹ
3.09(m)74.5
ꢀꢀ3ʹʹʹ
3.18(m)76.8
ꢀꢀ4ʹʹʹ
3.21(m)69.5
ꢀꢀ5ʹʹʹ
3.23(m)76.6
ꢀꢀ6ʹʹʹ
3.51,3.56(m)60.6
ꢀꢀ
基于上述波谱分析数据,最终确认主要活性成分化合物f-7q-1确切空间结构式如下所示:(f-7q-1)f-7q-1的化合物名称为:rhamnetin 3-o-β-d-glucopyranosyl(1
→
2)-β-d-galactopyranoside,或 rhamnetin-3-o-(2
′′‑
o-β-d-glucopyranosyl)-β-d-galactopyranoside(2)化合物f-7k-1的结构确认分子量 :624,糖链 :300-162-162,化合物f-7k-1二维核磁共振相关关键信息归纳如下表:no.δhδch-hcosyhmbc(h
→
c)2
‑‑
156.2
ꢀꢀ3‑‑
133.0
ꢀꢀ4‑‑
177.6
ꢀꢀ5‑‑
161.0
ꢀꢀ
66.36(1h,d,j=2.2)97.9 c-5,7,8,107‑‑
165.0
ꢀꢀ
86.74(1h,d,j=2.2)92.2 c-6,7,9,109
‑‑
156.0
ꢀꢀ
10
‑‑
104.9
ꢀꢀ1ʹ
‑‑
120.2
ꢀꢀ2ʹ
,6
ʹ
8.13(2h,d,j=8.9)131.1h-3
ʹ
,5
ʹ
c-2,2
ʹ
,4
ʹ
,6
ʹ3ʹ
,5
ʹ
6.89(2h,d,j=8.9)115.5h-2
ʹ
,6
ʹ
c-1
ʹ
,3
ʹ
,4
ʹ
,5
ʹ4ʹ
‑‑
161.0
ꢀꢀ‑
och33.86(3h,s)56.1 c-7gal-1
ʹʹ
5.70(1h,d,j=7.6)98.3 c-3,3
ʹʹ2ʹʹ
3.78(m)80.5
ꢀꢀ3ʹʹ
3.58(m)73.4
ꢀꢀ4ʹʹ
3.64(m)67.6
ꢀꢀ5ʹʹ
3.34(m)75.9
ꢀꢀ6ʹʹ
3.27,3.43(m)59.9
ꢀꢀ
glu-1
ʹʹʹ
4.60(1h,d,j=7.8)104.3 c-2
ʹʹ2ʹʹʹ
3.08(m)74.4
ꢀꢀ3ʹʹʹ
3.18(m)77.0
ꢀꢀ4ʹʹʹ
3.21(m)69.7
ꢀꢀ5ʹʹʹ
3.34(m)76.6
ꢀꢀ6ʹʹʹ
3.51,3.56(m)60.8
ꢀꢀ
基于上述波谱分析数据,最终确认主要活性成分化合物f-7k-1确切空间结构式如下所示:(f-7k-1)化合物f-7k-1的化合物名称为:rhamnocitrin 3-o-β-d-glucopyranosyl(1
→
2)-β-d-galactopyranoside,或or rhamnocitrin-3-o-(2
′′‑
o-β-d-glucopyranosyl)-β-d-galactopyranoside3、化合物f-74q-1的结构确认分子量:624,糖链:330-162-132,标识:化合物f-74q-1二维核磁共振相关关键信息归纳如下表:
no.δhδch-hcosyhmbc(h
→
c)2
‑‑
155.7
ꢀꢀ3‑‑
133.8
ꢀꢀ4‑‑
177.6
ꢀꢀ5‑‑
161
ꢀꢀ
66.36(1h,d,j=2.1)97.9 c-5,7,8,107
‑‑
165.0
ꢀꢀ
86.74(1h,d,j=2.1)92.1 c-6,7,9,109
‑‑
156.2
ꢀꢀ
10
‑‑
105
ꢀꢀ1ʹ
‑‑
122.6
ꢀꢀ2ʹ
7.57(1h,d,j=2.2)115.3 c-2,1
ʹ
,3
ʹ
,4
ʹ3ʹ
‑‑
146.1
ꢀꢀ4ʹ
‑‑
150.2
ꢀꢀ5ʹ
6.98(1h,d,j=8.8)111.2h-5
ʹ
,6
ʹ
c-1
ʹ
,3
ʹ
,4
ʹ6ʹ
7.93(1h,dd,j=8.8,2.2)122.2h-5
ʹ
,6
ʹ
c-2,2
ʹ
,4
ʹ
7-och33.87(3h,s)56.1 c-74
ʹ-och33.86(3h,s)55.7 c-4gal-1
ʹʹ
5.62(1h,d,j=8.0)99.0 c-3,3
ʹʹ2ʹʹ
3.78(m)74.9
ꢀꢀ3ʹʹ
3.58(m)73.8
ꢀꢀ4ʹʹ
3.64(m)68.3
ꢀꢀ5ʹʹ
3.34(m)75.8
ꢀꢀ6ʹʹ
3.43,3.28(m)60.1
ꢀꢀ
api-1
ʹʹʹ
5.32(1h,d,j=1.0)108.8 c-2
ʹʹ
,2
ʹʹʹ
,3
ʹʹʹ2ʹʹʹ
3.80(m)76.1
ꢀꢀ3ʹʹʹ
‑‑
79.1
ꢀꢀ4ʹʹʹ
3.51(m),3.84(m)73.9
ꢀꢀ5ʹʹʹ
3.46(m),3.39(m)64.3
ꢀꢀ
基于上述波谱分析数据,最终确认主要活性成分化合物f-74q-1确切空间结构式如下所示:(f-74q-1)化合物f-74q-1的化合物名称:3,5,3
’‑
trihydroxy-7,4
’ꢀ‑
dimethoxyflavone-3-o-β-d-apiofranosyl(1
→
2)
ꢀ‑
β-d
‑ꢀ
galactopyranoside,或者polygalin c,或者远志醇c基于发明人的研究,发明人认为,分离获得的化合物f-7q-1、f-7k-1、f-74q-1作为
本发明的瓜子金提取物的主要成分,对实现所希望的药用效果起到了关键性的作用。这些化合物在所述分子结构中羰基的β位具备一个羟基取代基,该羟基与酮羰基共同作用,能够更有效地与泌尿系统中的含钙离子结石成分发生反应,从而更有效地降解或溶解泌尿系统的结石。因此,也可以以化合物f-7q-1、f-7k-1、f-74q-1的至少一种作为主要和必要的活性成分,制备相应的药物组合物,用于治疗或预防泌尿系统结石症、及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药。所述的药物组合物也以进一步包含药物上可接受的辅料、载体或赋形剂。
[0078]
二、药理活性实验例1、试验样品的制备
①
高剂量组试验样品:取制备实施例5中所制备的水提、聚酰胺柱0-25%乙醇梯度洗脱液浓缩干燥获得活性成分提取物。配制密度约1.2g/ml的溶液,以药典标准,吸光度法(以芦丁为标准物质做标准曲线)测定的有效物质浓度约130.4mg/ml。
[0079]
②
中等剂量组试验样品:将高剂量组样品稀释一倍,得中等剂量组试验样品。
[0080]
③
低剂量组试验样品:将中等剂量组样品稀释一倍,得低剂量组试验样品。
[0081]
④
阳性对照组试验样品:浓度为100 mg/ml的枸橼酸氢钾钠水溶液,每天3ml,折算300mg/d。
[0082]
2、动物实验2.1、实验动物及饲养条件36 只 sd 大鼠购自上海斯莱克,许可证号:scxk(沪)2017-0005,合格证号:20170005011248。饮用水为超纯水。实验动物房使用许可证号为syxk(浙)2015-0008。
[0083]
饲养环境:温度范围20~25℃,相对湿度范围 40~70%。实验前适应性喂养一周。
[0084]
2.2、 实验方案2.2.1 实验动物spf 级sd 雄性大鼠36 只,6-8 周龄,200~250g。
[0085]
2.2.3 模型制备sd 大鼠适应性饲养 7 天后,除正常组外其余各组均按 1%乙二醇饮水+2%氯化铵灌胃2ml/只造模给药,连续28 天。
[0086]
2.2.4 实验分组与处理将 36 只 sd 雄性大鼠按体重随机分成 6 组,每组 6 只。分为正常组,模型组,枸橼酸氢钾钠组,中药提取物(低、中、高)剂量组。造模过程中持续给药每日灌胃3ml,药物包括阳性对照药物和聚酰胺柱纯化后的部分。4 周后安乐死动物。
[0087]
2.2.5 肾脏在体剥离肾脏组织,一侧置冻存管于-80℃保存,用于组织匀浆检测ca2+浓度,试剂盒操作步骤同上;另一侧置于福尔马林溶液中固定,用于组织切片进行 he 染色。
[0088]
(1)石蜡切片制作步骤如下:
①
固定 ,
②
修块 ,
③
脱水 ,
④
透明 ,
⑤
浸蜡 ,
⑥
包埋 ,
⑦
切片 ,
⑧
烤片 ,
⑨
保存:装盒,常温保存。
[0089]
(2)he 染色步骤如下:
①
脱蜡复水 ,
②
染色 ,
③
脱水、透明、封固 ,
④
染色结果:细胞核呈蓝色,细胞浆呈粉红色,红细胞呈较鲜艳的红色。
[0090]
3、试验结果3.1. 大鼠尿液中草酸钙结晶阳性试验结果尿常规报告结果显示除正常组外,其余各组大鼠尿液中草酸钙结晶均呈阳性。
[0091]
3.2. 血清ca2+浓度试验结果血清中ca2+浓度各组别差异较小,与正常组相比,模型组与中剂量治疗组具有显著性差异;尿液中 ca2+浓度具有较大的差异,与正常组相比,低剂量治疗组与高剂量治疗组具有极显著性差异(p《0.01),(剂量组的剂量是多少,需要说清楚)与模型组相比,低剂量治疗组具有极显著性差异(p《0.01);肾组织中枸橼酸氢钾钠药组浓度最高,与模型组及正常组相比均具有极显著性差异(p《0.01);其余组别无显著性差异。
[0092]
血清中 cre 水平从高到低依次为模型组》中剂量治疗组》 枸橼酸氢钾钠药组》 低剂量治疗组》高剂量治疗组》正常组。与正常组相比,中剂量治疗组与高剂量治疗组具有显著性差异(p《0.05),其余组别无显著性差异。
[0093]
血清中 bun 水平从高到低依次为模型组》 低剂量治疗组组》 枸橼酸氢钾钠药组》 中剂量治疗组》高剂量治疗组》正常组,与正常组相比,各组别均具有极显著性差异(p《0.01);与模型组相比,除低剂量治疗组具有显著性差异(p《0.05), 其余各组别均具有极显著性差异(p《0.01)。
[0094]
3. 3. he镜下病变观察结果结果包括三部分的内容:草酸钙结晶聚集,肾小管扩张病变,肾间质慢性炎症细胞浸润此动物模型特点如下:四周时,模型动物血清bun含量明显升高。血p,ca含量无明显变化,24小时尿ox和ca排出量和肾组织ca含量均明显升高。肾脏肉眼观察肾脏肿大,切面苍白,其肾剖面用手触摸有明显细砂摩擦感,肾皮质和肾髓质分界不清。与正常组比较,模型组明显可见:草酸钙结晶聚集,肾小管上皮细胞肿胀、变性、坏死、官腔扩张,肾间质慢性炎症细胞浸润。
[0095]
如说明书附图10~15所示,he 镜下观察可见,与正常组比较,模型组肾小管明显扩张,并见大量棕黄色草酸钙结晶,局部肾间质有炎细胞浸润;与模型组比较,中、高剂量组肾小管扩张病变好转,棕黄色草酸钙结晶显著减少,肾间质无明显炎细胞浸润;低剂量组肾小管扩张病变有所好转,肾间质无明显炎细胞浸润,棕黄色草酸钙结晶无明显减少;枸橼酸氢钾钠组肾小管扩张病变好转,偶见肾间质炎细胞浸润,棕黄色草酸钙结晶无明显减少。
[0096]
肾脏病变评价表如下:表3. 3. 1 肾脏病变评价表组别肾小管扩张病变情况肾间质炎细胞浸润草酸钙结晶聚集正常组
‑‑‑
模型组++++++++枸橼酸氢钾钠组+++++低剂量组++-++中剂量组+-+
高剂量组+-+注:无病变表示为-,轻度病变为+,病变为++,显著病变为+++。
[0097]
基于上述动物药理试验结果,充分证明本发明的中、高剂量的瓜子金活性成分提取物(水提物经聚酰胺树脂柱0-25%乙醇洗脱后的化合物)在治疗肾结石的三个关键指标(草酸钙结晶聚集,肾小管扩张病变,肾间质慢性炎症细胞浸润)均明显优于同质量的枸橼酸氢钾钠,本发明的低剂量瓜子金活性成分提取物在草酸钙结晶聚集、肾间质慢性炎症细胞浸润的效果等指标上与枸橼酸氢钾钠相当,在抑制肾小管扩张病变等指标方面则显著优于枸橼酸氢钾钠。其药效水平达到了我国药品注册评审的要求,显示其在治疗泌尿系统结石症及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药具备极为良好的潜力和市场前景。
[0098]
有益效果本发明的药物在草酸钙结晶聚集、肾间质炎细胞浸润和肾小管扩张病变等典型试验指标的效果明显优于枸橼酸氢钾钠,其药效水平达到了我国药品评审的要求,显示其在治疗泌尿系统结石症及泌尿系统结石症导致的尿路感染或肾损伤、以及作为手术治疗泌尿系统结石症后的辅助用药具备极为良好的潜力和市场前景。
[0099]
相对于现有最广泛使用的临床药物枸橼酸氢钾钠而言,由于本发明的瓜子金提取物中说包含的活性成分(i)~(iii)不含钠钾离子,因此也不会导致类似枸橼酸氢钾钠那样的严重的高钾血症、心律失常、高血压等严重副作用,安全性更佳。
[0100]
相对于其他用于治疗泌尿系统结石症相关疾病的中草药和药物提取物而言,本发明的药用活性提取物的成分更简单、有效成分的结构更明确,质量更加稳定可控。
[0101]
另外,本发明的药用活性提取物优选从瓜子金地上茎叶部分提取,而避免了全草提取导致的药用植物生长周期过长的问题,成本更低廉、环保性更佳。
[0102]
综上所述,本发明的药物对泌尿系统结石症等相关疾病的疗效明确、副作用小(相当于或优于现有泌尿系统结石症主流药物枸橼酸氢钾钠)、成本低廉、工艺简便、安全有效、质量稳定可控、符合现代药品注册要求的泌尿系统结石症药物,具备极好的医药价值和经济价值。
