用于治疗ccr4阳性恶性肿瘤的经ccr4靶向性嵌合抗原受体修饰的t细胞
1.优先权要求
2.本技术要求于2019年5月24日提交的美国临时申请序列号62/852,934的权益。前述案的全部内容通过引用并入本文。
技术领域
3.本公开内容涉及淋巴瘤相关的c-c趋化因子受体4型(ccr4)特异性嵌合抗原受体(car)工程化t细胞、配制方法和作为针对ccr4阳性细胞有选择性的抗癌剂使用的方法。
4.发明背景
5.ccr4在恶性皮肤归巢t细胞上以高水平表达,并且其表面表达与增强的皮肤t细胞淋巴瘤(ctcl)细胞的皮肤归巢特征和不利的疾病结果密切相关(chang d-h,sui j,geng s,muvaffak a,bai m,fuhlbrigge rc,et al.humanization of an anti-ccr4 antibody that kills cutaneous t-cell lymphoma cells and abrogates suppression by t-regulatory cells.mol.cancer ther.2012;11:2451-61)。使用人源化可变重和(vh)和κ轻(vi)链部分靶向ccr4的car可以衍生自与莫格利珠单抗(mogamulizumab)不同的抗ccr4抗体(perera lp,zhang m,nakagawa m,et al.chimeric antigen receptor modified t cells that target chemokine receptor ccr4 as a therapeutic modality for t cell malignancies.am.j.hematol.2017;92(9):892-901)。
6.发明概述
7.本文描述了使用ccr4靶向性car t细胞(本文也称为ccr4 car t细胞)治疗多种癌症,例如皮肤t细胞淋巴瘤(ctcl)的方法。除了作为针对ccr4阳性细胞有选择性的抗癌剂使用的方法之外,本文还描述了减少调节性t细胞(treg)群的方法。不受理论的束缚,treg可以干扰期望的免疫应答,并且在此描述的方法可用于消除或减少ccr4阳性treg的数目。
8.本文描述了包含编码嵌合抗原受体(car)或多肽的核苷酸序列的核酸分子,其中嵌合抗原受体或多肽包含:靶向ccr4的scfv、间隔物、跨膜域、41-bb共刺激域和cd3ζ信号传导域。
9.在各种实施方案中:跨膜域选自:cd4跨膜域或其具有1-5个氨基酸修饰的变体、cd8跨膜域或其具有1-5个氨基酸修饰的变体、cd28跨膜域或其具有1-5个氨基酸修饰的变体;间隔物包含20-150个氨基酸且位于scfv和跨膜域之间;跨膜域是cd4跨膜域或其具有1-5个氨基酸修饰的变体;跨膜域是cd4跨膜域;嵌合抗原受体包含选自以下的跨膜域:cd4跨膜域或其具有1-2个氨基酸修饰的变体、cd8跨膜域或其具有1-2个氨基酸修饰的变体、cd28跨膜域或其具有1-2个氨基酸修饰的变体;间隔物包含选自由seq id no:2-12或其具有1-5个氨基酸修饰的变体组成的组的氨基酸序列;间隔物包含igg铰链区;间隔物包含10-50个氨基酸;4-1bb共刺激域包含seq id no:24的氨基酸序列或其具有1-5个氨基酸修饰的变体;cd3ζ信号传导域包含seq id no:21的氨基酸序列;3至15个氨基酸的接头位于4-1bb共刺激域和cd3ζ信号传导域或其变体之间;car或多肽包含seq id no:29的氨基酸序列或其
具有1-5个氨基酸修饰的变体;scfv包含seq id no:1的氨基酸序列;权利要求1的核酸分子。
10.本文还公开了:包含本文所述核酸分子的病毒载体;由包含本文所述的核酸分子的载体转导的人t细胞群(例如,包含中央记忆t细胞的群)。在一些实施方案中,载体是表达载体,其中ccr4 car或ccr4多肽的表达是在诱导型启动子的控制下。在一些实施方案中,ccr4 car或ccr4多肽的表达是在tet off系统的控制下。
11.本文还描述了在患者中治疗ccr4阳性癌症(包括,例如,外周t细胞淋巴瘤、成人t细胞淋巴瘤、间变性大细胞淋巴瘤、原发性皮肤t细胞淋巴瘤、肾细胞癌、肺癌、肝细胞癌和弥漫大b细胞淋巴瘤)的方法,其包括施用由包含本文所述的核酸分子的载体转导的自体或同种异体人t细胞群,其中t细胞淋巴瘤包括表达ccr4的细胞。在多个实施方案中:嵌合抗原受体或多肽局部或全身施用;表达ccr4的细胞是癌性t细胞;并且嵌合抗原受体或多肽通过单次或重复给药来施用。
12.在各种实施方案中:嵌合抗原受体或多肽包含:huccr4 scfv(例如,包含以下氨基酸序列且具有多达10个单氨基酸取代的scfv:qvqlvqsgaevvkpgasvkisckasgytftdhaihwvkqnpgqrlewigyfspgnddfkynerfkgkatltadtsastayvelsslrsedtavyfctrslnmaywgqgtlvtvssgstsgggsgggsggggssdivmsqspdslavslgervtlnckssqsllysgnqknylawyqqkpgqspklliywasaresgvpdrfsgsgsgtdftltissvqaedvavyycqqyysypltfgagtklelk(seq id no:1))。
13.在各种实施方案中:嵌合抗原受体或多肽包含:huccr4 scfv(例如,包含以下氨基酸序列且具有多达10个单氨基酸取代的scfv:qvqlvqsgaevkkpgasvkvsckasgytfasyymhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvsssgggsggggsggggsdivmtqspdslavslgeratinckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqylssytfgqgtkleik(seq id no:43))。
14.在各种实施方案中:嵌合抗原受体或多肽包含:huccr4 scfv(例如,包含以下氨基酸序列且具有多达10个单氨基酸取代的scfv:qvqlvqsgaevkkpgasvkvsckasgytfasyymhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvsssggggsdivmtqspdslavslgeratinckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqylssytfgqgtkleik(seq id no:44))。
15.在各种实施方案中:嵌合抗原受体或多肽包含:huccr4 scfv(例如,包含以下氨基酸序列且具有多达10个单氨基酸取代的的scfv:qvqlvqsgaevkkpgasvkvsckasgytfasyymhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvssggggsggggsdivmtqspdslavslgeratinckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqylssytfgqgtkleik(seq id no:45))。
16.还描述了含有表达car或多肽的载体的t细胞。在各种实施方案中:至少20%、30%或40%的转导的人t细胞是中央记忆t细胞;至少30%的转导的人t细胞是cd4+和cd62l+或cd8+和cd62l+;人t细胞群对患者是自体的;以及人t细胞群对患者是同种异体的。
17.ccr4靶向性car
18.本文所述的ccr4靶向性car或ccr4靶向性多肽包括ccr4靶向的scfv。在一些实施方案中,scfv包含通过柔性接头连接的以下氨基酸序列:
19.qvqlvqsgaevkkpgasvkvsckasgytfasyymhwmrqapgqglewigwinpgnvntkynekfkgra
tltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvsssgggsggggsggggsdivmtqspdslavslgeratinckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqylssytfgqgtkleik(seq id no:43)或包含以下序列
20.qvqlvqsgaevkkpgasvkvsckasgytfasyymhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvss(seq id no:32)和以下序列divmtqspdslavslgeratmsckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqylssytfgqgtkleik(seq id no:33)。
21.在一些实施方案中,scfv包含通过柔性接头连接的以下氨基酸序列:
22.qvqlvqsgaevkkpgasvkvsckasgytfasqwmhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstwyrpldywgqgtlvtvss(seq id no:34)和以下序列divmtqspdslavslgeratmsckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqyissytfgqgtkleik(seq id no:35)。
23.在一些实施方案中,scfv包含通过柔性接头连接的以下氨基酸序列:
24.qvqlvqsgaevkkpgasvkvsckasgytfasawmhwmrqapgqglewigwinpgnvntkynekfkgratltvdtstntaymelsslrsedtavyycarstyyrpldywgqgtlvtvss(seq id no:36)和以下序列divmtqspdslavslgeratmsckssqsilyssnqknylawyqqkpgqspklliywastresgvpdrfsgsgsgtdftltisslqaedvavyychqymssytfgqgtkleik(seq id no:37)。
25.在一些实施方案中,有用的柔性接头是序列gggs(seq id no:46)的1、2、3、4、5、6、7、8、9或10个重复。在一些实施方案中,有用的柔性接头是序列ggggs(seq id no:47)的1、2、3、4、5、6、7、8、9或10个重复。
26.有用的ccr4 car可以由以下项组成或包含以下项:seq id no:38、39或40的氨基酸序列(缺少信号序列的成熟car),或者ccr4 car或ccr4多肽可以由以下项组成或包含以下项:seq id no:29、30或31的氨基酸序列(具有gmcsfra信号序列的未成熟car)。car或多肽可以以包含信号序列,例如人gm-csf受体α信号序列(mllllvtslllcelphpafllip;seq id no:43)的形式表达。car或多肽可以与可用于监测表达的额外序列,例如,t2a跳跃序列和截短的egfrt或截短的cd19一起表达。因此,car或多肽可以包含seq id no:1、29、30、31、38、39、40、43、44或45的氨基酸序列或由seq id no:1、29、30、31、38、39、40、43、44或45的氨基酸序列组成,或者可以包含与seq id no:1、29、30、31、38、39、40、43、44或45至少95%、96%、97%、98%或99%相同的氨基酸序列或由与seq id no:1、29、30、31、38、39、40、43、44或45至少95%、96%、97%、98%或99%相同的氨基酸序列组成。car或多肽可以包含以下项或由以下项组成:seq id no:1、29、30、31、38、39、40、43、44或45中任一个的具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的氨基酸序列。car或多肽可以包含通过柔性接头连接的具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:32和具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:33。car或多肽可以包含通过柔性接头连接的具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:34和具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:35。car或多肽可以包含通过柔性接头连接的具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:36和具有多达1、2、3、4或5个氨基酸变化(优选保守氨基酸变化)的seq id no:37。
27.在一些实施方案中,编码氨基酸序列seq id no:1、29-40和43-45的核酸是经密码子优化的。
28.间隔物区
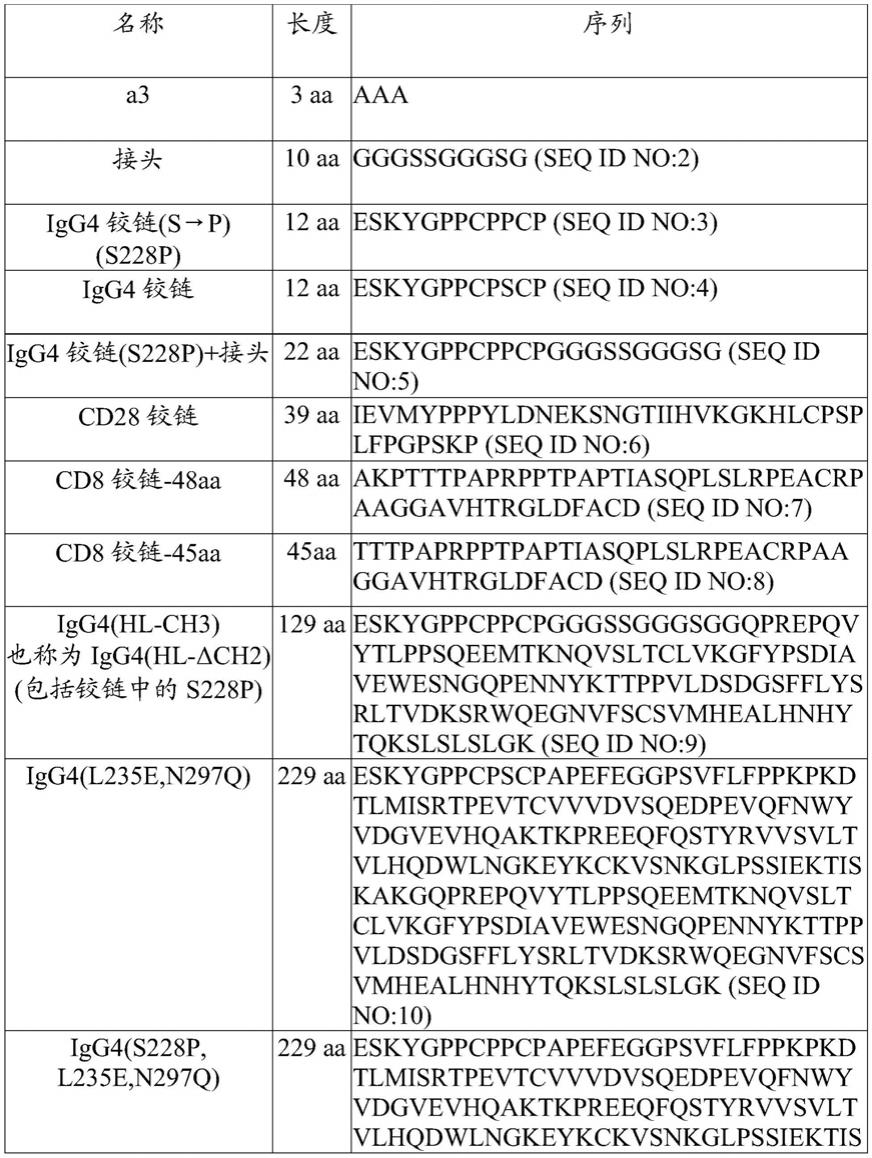
29.本文所述的car或多肽可以包括位于ccr4靶向域(即,ccr4靶向性scfv或其变体)和跨膜域之间的间隔物。可以使用多种不同的间隔物。它们中的一些包括人fc区的至少部分,例如人fc区的铰链部分或ch3域或其变体。下表1提供了可以用于本文所述的car中的各种间隔物。
30.表1:间隔物的实例
31.[0032][0033]
一些间隔物区包括免疫球蛋白(例如,igg1、igg2、igg3、igg4)铰链区的全部或部分,即落入免疫球蛋白的ch1和ch2域之间的序列,例如igg4fc铰链或cd8铰链。一些间隔区包括免疫球蛋白ch3域(称为ch3或δch2)或ch3域和ch2域两者。免疫球蛋白衍生序列可以包括一个或多个氨基酸修饰,例如1、2、3、4或5个取代,例如减少脱靶结合的取代。
[0034]
铰链/接头区还可包含具有序列eskygppcpscp(seq id no:4)或eskygppcppcp(seq id no:3)的igg4铰链区。铰链/接头区还可以包含序列eskygppcppcp(seq id no:3),接着是接头序列gggssgggsg(seq id no:2),接着是igg4 ch3序列gqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seq id no:12)。因此,整个接头/间隔区可以包含序列:eskygppcppcpgggssgggsggqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seq id no:11)。在一些情况下,与seq id no:11相比,间隔物具有1、2、3、4或5个单氨基酸变化(例如,保守变化)。在一些情况下,igg4 fc铰链/接头区以减少通过fc受体(fcr)结合的方式在两个位置(l235e;n297q)突变。
[0035]
跨膜域
[0036]
多种跨膜域可以用于。表2包括合适的跨膜域的实例。在存在间隔物的地方,跨膜域(tm)位于间隔物的羧基端。
[0037]
表2:跨膜域的实例
[0038][0039]
共刺激域
[0040]
共刺激域可以是任何适合与cd3ζ信号传导域一起使用的域。在一些情况下,共信号传导域是4-1bb共信号传导域,其包括与以下至少90%、至少95%、至少98%相同或与以下相同的序列:krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel(seq id no:24)。在一些情况下,与seq id no:24相比,4-1bb共信号传导域具有5个氨基酸变化(优选保守)中的1、2、3、4个。
[0041]
共刺激域位于跨膜域和cd3ζ信号传导域之间。表3包括合适的共刺激域的实例以及cd3ζ信号传导域的序列。
[0042]
表3:cd3ζ域和共刺激域的实例
[0043][0044]
在各种实施方案中:共刺激域选自下组:表3中描述的共刺激域或其具有1-5个(例如,1或2)个氨基酸修饰的变体、cd28共刺激域或其具有1-5(例如,1或2)个氨基酸修饰的变体、4-1bb共刺激域或其具有1-5(例如,1或2)个氨基酸修饰的变体和ox40共刺激域或其具有1-5(例如,1或2)个氨基酸修饰的变体。在某些实施方案中,存在4-1bb共刺激域或其具有1-5(例如,1或2)个氨基酸修饰的变体。在一些实施方案中,有两个共刺激域,例如cd28共刺激域或其具有1-5(例如,1或2)个氨基酸修饰(例如,取代)的变体和4-1bb共刺激域或其具有1-5(例如,1或2)个氨基酸修饰(例如,取代)的变体。在各种实施方案中,1-5(例如,1或2)个氨基酸修饰是取代。共刺激域是cd3ζ信号传导域的氨基端并且由2-10个,例如3个氨基酸(例如ggg)组成的短接头可以置于共刺激域和cd3ζ信号传导域之间。
[0045]
cd3ζ信号传导域
[0046]
cd3ζ信号传导域可以是适合与cd3ζ信号传导域一起使用的任何域。在一些情况下,cd3ζ信号传导域包括与以下至少90%、至少95%、至少98%相同或与以下相同的序列:
[0047]
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seq id no:21)。在某些情况下,与seq id no:21相比,cd3ζ信号具有5个氨基酸变化(优选保守)中的1、2、3、4个。
[0048]
截短的egfr或cd19
[0049]
cd3ζ信号传导域之后可以是核糖体跳跃序列(例如,legggegrgslltcgdveenpgpr;seq id no:27)和截短的egfr,其具有与以下至少90%、至少95%、至少98%相同或与以下相同的序列:lvtslllcelphpaflliprkvcngigigefkdslsinatnikhfknctsisgdlhilpvafrgd
sfthtppldpqeldilktvkeitgflliqawpenrtdlhafenleiirgrtkqhgqfslavvslnitslglrslkeisdgdviisgnknlcyantinwkklfgtsgqktkiisnrgensckatgqvchalcspegcwgpeprdcvscrnvsrgrecvdkcnllegeprefvenseciqchpeclpqamnitctgrgpdnciqcahyidgphcvktcpagvmgenntlvwkyadaghvchlchpnctygctgpglegcptngpkipsiatgmvgalllllvvalgiglfm(seq id no:28)。在一些情况下,与seq id no:28相比,截短的egfr具有5个氨基酸变化(优选保守)中的1、2、3、4个。或者,cd3ζ信号传导域之后可以是核糖体跳跃序列(例如,legggegrgslltcgdveenpgpr;seq id no:27)和截短的cd19r(也称为cd19t),其具有与以下至少90%、至少95%、至少98%相同或与以下相同的序列:
[0050]
mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppcvpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkr(seq id no:26)。
[0051]
氨基酸修饰是指蛋白质或肽序列中的氨基酸取代、插入和/或缺失。“氨基酸取代”或“取代”是指用另一种氨基酸替换亲本肽或蛋白质序列中特定位置处的氨基酸。可以进行取代,从而以非保守方式(即,通过将密码子从属于具有特定大小或特征的氨基酸分组的氨基酸改变为属于另一个分组的氨基酸)或以保守方式(即,通过将密码子从属于具有特定大小或特征的氨基酸分组的氨基酸改变为属于相同分组的氨基酸)改变所得蛋白质中的氨基酸。此类保守变化通常导致所得蛋白质的结构和功能中的较少变化。以下是各种氨基酸分组的实例:1)具有非极性r基团的氨基酸:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸;2)具有不带电荷的极性r基团的氨基酸:甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺;3)具有带电荷的极性r基团的氨基酸(在ph6.0下带负电荷):天冬氨酸、谷氨酸;4)碱性氨基酸(在ph6.0下带正电荷):赖氨酸、精氨酸、组氨酸(在ph6.0下)。另一分组可以是那些具有苯基的氨基酸:苯丙氨酸、色氨酸和酪氨酸。
[0052]
在某些情况下,ccr4 car或ccr4多肽可以使用载体产生,在该载体中car开放阅读框之后是t2a核糖体跳跃序列和截短的egfr(egfrt),其缺少细胞质信号传导尾。在这种排列中,egfrt的共表达提供了惰性、非免疫原性表面标志物,其容许获得基因修饰细胞的准确测量,并能够进行基因修饰细胞的阳性选择,以及过继转移后体内治疗性t细胞的高效细胞追踪。高效控制增殖以避免细胞因子风暴和脱靶毒性是t细胞免疫治疗成功的重要障碍。在治疗相关毒性的情况下,掺入ccr4 car慢病毒载体中的egfrt可以起自杀基因的作用以消融car+t细胞。
[0053]
本文所述的car或多肽可以通过本领域已知的任何手段产生,但优选使用重组dna技术产生。可以通过方便的本领域已知的分子克隆标准技术(基因组文库筛选、重叠pcr、引物辅助连接、定点诱变等)可以制备编码嵌合受体的几个区域的核酸并组装成完整的编码序列。所得编码区优选插入表达载体并用于转化合适的表达宿主细胞系,优选t淋巴细胞,并且最优选自体t淋巴细胞。
[0054]
从患者分离的各种t细胞亚组可以用用于表达car或多肽的载体转导。中央记忆t细胞是一种有用的t细胞亚组。通过使用,例如设备免疫磁性选择表达期望受体的细胞来选择cd45ro+/cd62l+细胞,可以从外周血单个核细胞(pbmc)中分离中央记忆
t细胞。富含中央记忆t细胞的细胞可以用抗cd3/cd28激活,用例如指导ccr4 car以及用于体内检测、消融和潜在的离体选择的非免疫原性表面标志物的表达的慢病毒载体转导。活化/遗传修饰的ccr4中央记忆t细胞可以在体外用il-2/il-15扩增,然后冷冻保存。制备car t细胞的额外方法可以在pct/us2016/043392中找到。
[0055]
制备有用的t细胞群的方法描述于例如wo 2017/015490和wo2018/102761中。在某些情况下,使用自然杀伤(nk)细胞可能是有用的,例如,衍生自外周血或脐带血的同种异体nk细胞。在其他情况下,nk细胞可以衍生自人胚胎干细胞(hesc)或诱导多能干细胞(ipsc)。
[0056]
除非另有定义,本文使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。本文描述了用于本发明的方法和材料;也可以使用本领域已知的其他合适的方法和材料。材料、方法和实例仅是说明性的而意图是限制性的。出于任何和所有目的,本文提及的所有出版物、专利申请、专利、序列、数据库条目和其他参考文献均通过引用整体并入。如有冲突,将以本说明书(包括定义)为准。
[0057]
本发明的其他特征和优点将从以下详细描述和附图以及权利要求书中显而易见。
[0058]
附图简述
[0059]
图1显示了描绘在间隔物区上不同的三个ccr4 car构建体的示意图。
[0060]
图2显示了ccr4 car设计的示意图:设计了三种不同的ccr4 car构建体。所有三个构建体都表达相同的经密码子优化的、人源化的ccr4单链可变片段。所有car构建体还表达cd4跨膜(tm)域、41bb共刺激域、cd3 zeta(ζ)域和单独的蛋白质(截短的egfr),以标记car构建体对细胞的成功转导。三个ccr4 car构建体在它们的间隔物上不同。
[0061]
图3a-3b显示了来自用ccr4 eq car以1:10e:t的48小时长期杀伤测定法(a)和再攻击(rechallenge)测定法(b)的结果。在再攻击测定法中,2天后以1:2的e:t将肿瘤细胞添加回来,以便重新建立1:2e:t。48hr后分析裂解。
[0062]
图4显示了来自ccr4 car t细胞实验的结果,其中egfrt用作追踪标记物并且其表达贯穿7天培养持续时间是稳定的。通过流式细胞术评估模拟物(未转导)和ccr4 car t细胞的egfr表达以检测car的转导。
[0063]
图5a-5b显示了不同t细胞亚群中ccr4表达的流式细胞术分析的结果。在cd8+(图5a)和cd4+(图5b)中,经由流式细胞术对经消减的pbmc(cd14-cd25-;也称为“dpbcm”)、初始记忆t细胞(tn/mem)和中央记忆t细胞(tcm)的t细胞群进行ccr4表达染色。
[0064]
图6a-6b显示了来自ccr4生长曲线的结果。(a)来自同一健康供体的泛t细胞具有三种不同的ccr4 car构建体,并在13天内追踪细胞的活细胞计数。(c)来自同一健康供体的经消减的pbmc(cd14-cd25-;也称为dpbcm)具有三种不同的ccr4 car构建体,并在13天内追踪细胞的活细胞计数。
[0065]
图7a-7d显示了ccr4 car2 t细胞杀伤表达ccr4的t细胞肿瘤系的能力。(a)示意图描绘了“杀伤”测定法,然后是“再攻击”测定法,证明了ccr4 car t细胞杀伤表达ccr4的t细胞肿瘤系的能力。(b)使用cem细胞(ccr4+肿瘤细胞系)的杀伤和再攻击测定法。(c)使用mt1细胞(ccr4+肿瘤细胞系)的杀伤和再攻击测定法。(d)使用lcl细胞,ccr4阴性b细胞肿瘤系的杀伤和再攻击测定法。
[0066]
图8a-8c显示了使用多种注射途径(ip,腹膜内;sc皮下;iv,静脉内)移植有表达ccr4的恶性t细胞系的三种小鼠模型中的存活曲线。
[0067]
图9a-9b显示了ccr4 car t细胞的体内效力。(a)示意图描绘了nsg小鼠中cem的sc移植。4天后,用car t细胞或模拟转导t细胞iv处理小鼠,并与仅肿瘤组比较。(b)监测用car或模拟转导t细胞iv处理的小鼠与仅肿瘤组相比的存活。
[0068]
图10a-10c显示了car1(ccr4 l car)(a;seq id no:29)car2(ccr4 eq car)(b;seq id no:30)和car3(ccr4δch2 car;也称为ccr4 ch3 car)(c;seq id no:31)的带注释的氨基酸序列。
[0069]
图11显示在用car t细胞或模拟转导t细胞iv处理的nsg小鼠中cem移植之后肿瘤生长的生物发光检测,并与仅肿瘤组进行比较。
[0070]
图12a-12b显示了ccr4 car t细胞在hut78小鼠模型中的体内效力。(a)在nsg小鼠中hut78的iv移植之后肿瘤生长的生物发光检测。10天后,用car t细胞或模拟转导t细胞iv处理小鼠。(b)监测用car或模拟转导t细胞iv处理的小鼠的存活。
[0071]
图13a-13e显示了诱导型car构建体。图13a显示了四种诱导型ccr4car构建体的简写。图13b显示了诱导型car1(具有cd19t的ccr4 eq)的质粒图谱。图13c显示了诱导型car2(具有cd19t的ccr4 ch3)的质粒图谱。图13d显示了诱导型car3(ccr4 eq)的质粒图谱。图13e显示了诱导型car4(ccr4 ch3;也称为ccr4δch2)的质粒图谱。
[0072]
图14a-14c显示了car1(ccr4 l car)(a;seq id no:38)car2(ccr4 eq car)(b;seq id no:39)和car3(ccr4δch2 car;也称为ccr4 ch3 car)(c;seq id no:40)的带注释的氨基酸序列(没有信号序列)。
[0073]
图15a-15b显示了在质粒图谱中使用的tta(a;seq id no:41)和t2a-cd19t(b;seq id no:42)的带注释的氨基酸序列。
[0074]
发明详述
[0075]
在本公开中,描述了具有人源化抗人ccr4 scfv抗原结合域和4-1bb胞内共刺激信号传导域的car的产生和抗肿瘤功效。ccr4 car t细胞针对多种表达ccr4的人t细胞癌症系展现出有力的抗原依赖性细胞毒性。ccr4 car t细胞在人白血病/淋巴瘤鼠肿瘤模型中的静脉内体内递送赋予了抗原阳性疾病的消除和总存活的延长。
[0076]
本公开还提供了治疗患有t细胞癌的受试者的方法,其包括非霍奇金淋巴瘤、外周t细胞淋巴瘤(ptcl)、间变性大细胞淋巴瘤、淋巴母细胞性淋巴瘤、前体t淋巴母细胞性淋巴瘤、血管免疫母细胞性t细胞淋巴瘤、皮肤t细胞淋巴瘤(ctcl)、蕈样肉芽肿病(mf)、塞扎里综合征(ss)等等。t细胞淋巴瘤涵盖多种病症,包括但不限于:(a)淋巴母细胞性淋巴瘤,其中恶性发生在来自胸腺的原始淋巴样祖细胞中;(b)成熟或外周t细胞新生物,包括t细胞幼淋巴细胞白血病、t细胞颗粒淋巴细胞白血病、nk细胞白血病、皮肤t细胞淋巴瘤(蕈样肉芽肿病和塞扎里综合征)、间变性大细胞淋巴瘤、t细胞型、肠病型t细胞淋巴瘤、成人t细胞白血病/淋巴瘤(包括与htlv-1相关的那些),以及血管免疫母细胞性t细胞淋巴瘤和皮下脂膜炎性(panniculitic)t细胞淋巴瘤;以及(c)外周t细胞淋巴瘤,其最初累及淋巴结副皮质,且永远不会长成真正的滤泡模式。
实施例
[0077]
在以下实施例中进一步描述本发明,实施例不限制权利要求书中描述的本发明的范围。
[0078]
材料和方法
[0079]
以下材料和方法用于本文所列的实施例中。
[0080]
细胞系
[0081]
cem(成人t细胞白血病系)、mt-1(成人t细胞白血病系)和lcl(由pbmc产生;engraftment of human central memory-derived effector cd8+t cells in immunodeficient mice.xiuli wang,et al.(2011)blood)细胞系在含有10%胎牛血清(fbs,hyclone)的rpmi-1640(lonza)(完全rpmi)中培养。293t细胞系在含有10%fbs、1x aa、25mm hepes(irvine scientific)和2mm l-谷氨酰胺(fisher scientific)的dulbecco改良eagles培养基(dmem,life technologies)(完全dmem)中培养。所有细胞均在37℃和5%co2下培养。hut78细胞在含有20%fbs的imdm(iscove改良dulbecco培养基;fisher scientific)中培养。
[0082]
dna构建体和慢病毒生产
[0083]
通过用携带在ef1α启动子的控制下的egfp/ffluc融合物的ephiv7慢病毒转导工程化改造肿瘤细胞以表达增强绿色荧光蛋白和萤火虫萤光素酶(egfp/ffluc),如先前所述(lenalidomide enhances the function of cs1 chimeric antigen receptor
–
redirected t cells against multiple myeloma(wang et al).clinical cancer research 2018)。car构建体中使用的人源化scfv序列获自靶向ccr4的单克隆抗体克隆h1567(chang d-h,sui j,geng s,muvaffak a,bai m,fuhlbrigge rc,et al.humanization of an anti-ccr4 antibody that kills cutaneous t-cell lymphoma cells and abrogates suppression by t-regulatory cells.mol.cancer ther.2012;11:2451-61)。
[0084]
使用改良的聚乙烯亚胺(pei)介导的转染方法(optimization of lentiviral vector production using polyethylenimine-mediated transfection.yong tang,et al.oncology letters.2015)生产慢病毒。简而言之,使用改良的pei方法用包装质粒和car慢病毒主链质粒转染293t细胞。3至4天后收集病毒上清液。通过高速离心浓缩上清液,并且将慢病毒团粒在磷酸盐缓冲盐水(pbs)-乳糖溶液(每100ml pbs 4g乳糖)中重悬,等分并储存在-80℃下。基于egfrt表达,使用jurkat细胞量化慢病毒滴度。
[0085]
t细胞分离、慢病毒转导和离体扩增
[0086]
根据希望之城内部审查委员会(irb)批准的方案,从知情同意的研究参与者(健康供体)获得白细胞单采术(leukapheresis)产品。在白细胞单采术当天,通过ficoll-paque(ge healthcare)上的密度梯度离心分离外周血单个核细胞(pbmc),然后在pbs/edta(miltenyi biotec)中清洗多次。细胞在室温(rt)下在旋转器上静置过夜,随后清洗并重悬于含有10%fbs的x-vivo t细胞培养基(lonza)(完全x-vivo)中。将多达5.0x109个pbmc与抗cd14和抗cd25微珠(miltenyi biotec)在室温下温育30分钟,并根据制造商的方案使用系统(miltenyi biotec)进行磁性消减,将这些称为经消减的pbmc(dpbmc)。dpbmc在cs5(stem cell technologies)中冷冻直至进一步加工。
[0087]
如先前所述(co-stimulatory signaling determines tumor antigen sensitivity and persistence of car t cells targeting psca+metastatic prostate cancer.priceman saul j,et al.2018.oncoimmunology)进行t细胞激活和转导。简而言
之,将新鲜解冻的dpbmc清洗一次并培养在含有100u/ml重组人il-2(rhil-2,novartis oncology)和0.5ng/ml重组人il-15(rhil-15,cellgenix)的完全x-vivo中。对于car慢病毒转导,在珠刺激后次日,将t细胞与cd3/cd28(life technologies)、硫酸鱼精蛋白(app pharmaceuticals)、细胞因子混合物(如上所述)和1-3复数或感染(moi)的期望慢病毒一起培养。然后将细胞培养于含有细胞因子的新鲜完全x-vivo中并且每2-3天用该完全x-vivo进行重新补充。7天后,磁性移除珠,并将细胞在含有细胞因子的完全x-vivo中进一步扩增,以达到期望的细胞产量。进一步扩增后,在体外功能测定法和体内肿瘤模型之前,将细胞冷冻在cs5中。通过流式细胞术验证car t细胞的纯度和表型。
[0088]
流式细胞术
[0089]
对于流式细胞术分析,将细胞重悬于facs缓冲液(含有2%fbs和1xaa的不具有ca2+、mg2+或酚红的hank平衡盐溶液(hbss-/-,life technologies)中)。将细胞与一抗在4℃下在黑暗中温育30分钟。对于二次染色,在将细胞与亮紫(brilliant violet)510(bv510)、异硫氰酸荧光素(fitc)、藻红蛋白(pe)、多甲藻素叶绿素蛋白复合物(percp)、percp-cy5.5、pe-cy7、别藻蓝蛋白(apc)或apc-cy7(或apc-efluor780)缀合抗体在4℃下在黑暗中温育30分钟之前,清洗细胞两次。使用了针对cd3(bd biosciences,克隆:sk7)、cd4(bd biosciences,克隆:sk3)、cd8(bd biosciences,克隆:sk1)、cd14(bd biosciences,克隆:mφp9)、cd19(bd biosciences,克隆:sj25c1)、cd25(bd biosciences,克隆:2a3)、小鼠cd45(biolegend,克隆:30-f11)、cd45(bd biosciences,克隆:2d1)、cd69(bd biosciences,克隆:l78)、cd137(bd biosciences,克隆:4b4-1)、muc1(biolegend、克隆16a)、生物素化蛋白-l(genscript usa)、ccr4(克隆,l291h4)和链霉亲合素(bd biosciences)的抗体。使用4’,6-二脒基-2-苯基吲哚(dapi,sigma)测定细胞活力。在macsquant分析仪10(miltenyi biotec)上进行流式细胞术,并用flowjo软件(v10,treestar)分析数据。
[0090]
体外肿瘤杀伤和再攻击测定法
[0091]
对于肿瘤杀伤测定法,在不存在外源细胞因子的情况下,在96孔板中将car t细胞和肿瘤靶标在完全x-vivo中以指定的效应物:肿瘤(e:t)比率共培养24至72h,并如上所述通过流式细胞术分析。通过比较gfp阳性肿瘤细胞计数相对于靶标与模拟(未转导)t细胞共培养时观察到的计数,计算出car t细胞的肿瘤杀伤。对于再攻击测定法,在完成杀伤测定法后24-72小时,在不存在外源细胞因子的情况下,在96孔板中将car t细胞和肿瘤靶标在完全x-vivo中以指定的效应物:肿瘤(e:t)比率再次共培养24至72h,并如上所述通过流式细胞术分析。
[0092]
体内肿瘤研究
[0093]
所有动物实验均依照希望之城机构动物护理和使用委员会批准的方案进行。对于体内肿瘤研究,将cem细胞(3.0x106)制备到150μl终体积的hbss-/-中并通过注射移植到6至8周龄的雌性或雄性nsg小鼠中。在一些实施方案中,移植包括皮下(s.c.)注射或静脉内(i.v.)注射。通过生物光子成像(xenogen,lagox)每周至少监测一次肿瘤生长,并用living image软件(xenogen)分析通量信号。对于成像,用悬浮于pbs的150μl d-荧光素钾盐(perkinelmer)以4.29mg/小鼠i.p.注射小鼠。一旦通量信号达到期望水平,第4天或第5天,在1x pbs中制备t细胞,并用150μl静脉内(i.v.)注射的3.0x106个模拟物或ccr4 car2t细
胞处理小鼠。在cem肿瘤模型中,从第4天开始检查i.v.ccr4 eq car t细胞处理的影响。使用人道终点来确定存活。在有痛苦迹象,诸如费劲或困难的呼吸、明显的体重减轻、受损的移动或垂死的证据时,对小鼠实施安乐死。在预定的时间点或处于垂死状态时,将小鼠实施安乐死并收获组织并进行加工用于如下所述的流式细胞术和/或免疫组织化学。
[0094]
通过肝素化毛细管(chasescientific)眶后(ro)出血,从异氟醚麻醉的小鼠收集外周血到含有肝素/pbs溶液(1000单位/ml,sagent pharmaceuticals)的聚苯乙烯管中。记录每次ro抽血的体积(约120μl/小鼠),用于每μl血液的细胞定量。根据制造商的方案,用1x红细胞裂解缓冲液(sigma)裂解红细胞(rbc),然后清洗、染色并通过流式细胞术进行分析,如上所述。
[0095]
实施例1:包含不同接头的ccr4 car t细胞的构建
[0096]
以下描述的研究显示ccr4 car可以在原代t细胞上稳定表达。
[0097]
设计了三种ccr4靶向性car构建体(图1和2)。所有三种构建体都表达相同的经密码子优化的、人源化的ccr4单链可变片段。car构建体还包括cd4跨膜域(tm)、41bb共刺激域、cd3ζ域。car与截短的egfr共表达,截短的egfr充当car构建体成功转导细胞的标志物。三种ccr4 car构建体在它们的接头中不同(图2)。不受理论束缚,构建体细胞外部分的不同长度可以提供car结合抗原和在抗原结合后传递活化信号的能力的差异。这些差异也可以导致ccr4表达肿瘤细胞的差异杀伤(图1)。
[0098]
如前所述(priceman sj,gerdts ea,tilakawardane d,kennewick kt,murad jp,park ak,jeang b,yamaguchi y,yang x,urak r,weng l,chang wc,wright s,pal s,reiter re,wu am,brown ce,forman sj.co-stimulatory signaling determines tumor antigen sensitivity and persistence of car t cells targeting psca+metastatic prostate cancer.oncoimmunology.2018;7(2):e1380764),使用ccr4 car慢病毒转导消减了cd14+和cd25+细胞的人健康供体衍生的外周血单个核细胞(dpbmc),以及其他细胞类型,诸如富集的t细胞(easysep human t cell isolation kit.stemcell technologies)。如上所述,使用egfrt作为追踪标志物,使用流式细胞术以显示car表达。所有三种ccr4 car构建体在t细胞中稳定表达(图4)。转导dpbmc细胞后第7天,细胞用抗cd3染色以标记t细胞,并且用抗egfr染色以标记ccr4 car构建体的成功掺入。ccr4 l car、ccr4 eq car和ccr4δch2 car均在转导后第7天稳定表达(图4),并且显示egfr的表达在转导开始后长达28天是稳定的(数据未显示)。
[0099]
实施例2:t细胞群中的ccr4表达
[0100]
以下描述的研究检查了ccr4 car t细胞在不同t细胞亚群,诸如pbmc(cd14-、cd25-)和泛t细胞中的扩增和活性。
[0101]
用于产生car t细胞的起始t细胞群可以影响car t细胞消除其靶细胞的效力。在14天的制造期间,细胞的增殖也可能有差异。
[0102]
我们用3种不同的ccr4 car构建体转导来自同一健康供体的不同t细胞群(图1),并在13天内追踪细胞的活细胞计数。我们发现ccr4 eq car和ccr4δch2 car总体上增殖最好(图6a-6b)。我们在用来自不同健康供体产生的ccr4 l car细胞的几项独立研究中在多种起始t细胞群中观察到ccr4 l car具有较差的增殖(数据未显示)。
[0103]
实施例3:验证ccr4 car t细胞在体外选择性靶向ccr4阳性细胞
[0104]
为了确定ccr4 car t细胞是否表现出针对cd33阳性癌细胞的活性,使ccr4 car t细胞在ccr4阳性或ccr4阴性癌细胞存在的情况下生长,并量化杀死的癌性细胞百分比。
[0105]
为了评估我们的ccr4 car t细胞的抗原依赖性活性,以1:2和1:10之间的e:t比与ccr4阳性和阴性肿瘤靶标进行了共培养测定,以确定它们的杀伤潜力。使用的ccr4阳性t细胞肿瘤系是mt-1和cem。使用的ccr4阴性细胞系是lcl,b细胞肿瘤细胞系。我们以每10个肿瘤细胞1个t细胞的比率(1:10e:t)共培养ccr4 eq car t细胞和肿瘤细胞。然后我们使用流式细胞术测试了48小时后对肿瘤细胞的杀伤(%特异性裂解)。
[0106]
48小时后,相对于cem肿瘤系(图7b,顶部)和mt-1肿瘤细胞系(图7c,顶部)中的模拟t细胞,用ccr4 eq car t细胞的抗原特异性t细胞介导的杀伤活性是明显的。ccr4 eq car2 t细胞在cem肿瘤细胞系(图7b,顶部)和mt-1肿瘤细胞系(图7c,顶部)中均具有达或接近100%裂解的持续杀伤。在1:10的e:t下的这些结果证明了ccr4 eq car t细胞的有力杀伤能力。ccr4 eq car t细胞显示出对ccr4阴性lcl细胞的最小杀伤(图7d,顶部)。ccr4 l car t细胞和ccr4δch2 car t细胞也杀死了ccr4+肿瘤细胞(数据未显示)。
[0107]
此外,为了测试如果受到再攻击,ccr4 eq car t细胞是否可以继续杀伤肿瘤细胞,我们将car t细胞和肿瘤细胞以1:2(1个t细胞:2个肿瘤细胞)的比率共培养48小时。48小时后,我们将额外的肿瘤细胞添加到共培养孔中,达到1:2的e:t,并且再48小时后,使用流式细胞术以确定肿瘤细胞的%特异性裂解。令人惊讶的是,我们发现即使在受到再攻击时,ccr4 eq car t细胞也能够杀伤ccr4+肿瘤系(图7b-7c,底部)。ccr4 l car t细胞和ccr4δch2 car t细胞在受到再攻击时也杀死ccr4+肿瘤细胞(数据未显示)。
[0108]
实施例4:体内恶性t细胞小鼠模型的建立
[0109]
为了评估cccr4 car t细胞在体内的治疗潜力,使用多种注射途径建立了三种小鼠模型。
[0110]
人道终点用于确定植入表达ccr4的恶性t细胞系的nsg小鼠的存活曲线。在有痛苦迹象,诸如腹水引起的腹部膨胀、费劲或困难的呼吸、明显的体重减轻、受损的移动或垂死的证据时,对小鼠实施安乐死。经由i.p.、s.c.和i.v.注射,用hut78、cem和mt-1全身或局部递送细胞来对小鼠移植(图8)。
[0111]
实施例5:验证在小鼠模型中体内递送的ccr4 car t细胞展现出有力的抗肿瘤活性并赋予小鼠以延长的寿命
[0112]
为了评估ccr4 car t细胞在cem模型中选择性靶向ccr4阳性细胞的体内功效,递送ccr4 car t细胞并随时间评估肿瘤大小和存活。
[0113]
cem细胞经慢病毒转导以表达萤火虫萤光素酶(ffluc),从而允许通过非侵入性光学成像追踪肿瘤生长。在肿瘤s.c.注射后第4天,通过全身性静脉内(i.v.)递送用模拟或ccr4 eq car2 t细胞(3.0x106)处理小鼠(图9a)。在经由i.v.递送用ccr4 eq car t细胞处理的小鼠中观察到迅速的抗肿瘤作用,在处理后1-2周达到最大抗肿瘤响应。小鼠中的抗肿瘤响应可持续3-4周,但最终在小鼠中观察到肿瘤复发。ccr4 eq car t细胞的递送显著延长了小鼠的存活(图9b和图11)。
[0114]
实施例6:验证在小鼠模型中体内递送的ccr4 car t细胞展现出有力的抗肿瘤活性并赋予小鼠以延长的寿命
[0115]
为了评估ccr4 car t细胞在播散模型中的体内功效,递送ccr4 car t细胞至
hut78小鼠模型,并随时间评估肿瘤大小和存活。
[0116]
hut78在具有20%fbs的imdm(iscove改良dulbecco培养基;fisher scientific)中培养。对于hut78体内模型,经由pbmc与抗cd4和抗cd8微珠(miltenyi biotech)的温育,从pbmc富集cd4和cd8细胞。使用的另一种t细胞群是通过pbmc的阴性选择产生的t细胞。还使用了来自stemcell的人t细胞分离试剂盒。
[0117]
对于体内肿瘤研究,以150μl hbss-/-的最终体积制备hut78细胞(1.0x106),并通过注射移植到6至8周龄的雌性或雄性nsg小鼠中。hut78动物模型是播散模型。在一些实施方案中,移植包括皮下(s.c.)注射或静脉内(i.v.)注射。hut78细胞经慢病毒转导以表达萤火虫萤光素酶(ffluc),以允许经由非侵入性光学成像追踪肿瘤生长。在肿瘤i.v.注射后第10天,通过全身静脉内(i.v.)用模拟物或ccr4 eq car2 t细胞(3.0x106)处理小鼠(图12a)。在治疗后用ccr4 eq car t细胞处理的小鼠中观察到抗肿瘤作用。ccr4 eq car t细胞的递送显著延长了小鼠的存活(图12b)。
[0118]
实施例7:诱导型ccr4 car t细胞
[0119]
在某些情况下,期望控制ccr4 car的表达。例如,在将载体引入t细胞群后,扩增细胞以制备足够数量的细胞以在治疗上使用。在此扩增阶段,可以期望减少或几乎消除ccr4 car的表达,例如,减少任何自相残杀(fratricide)。使用tet-off控制的系统可能是有用的(das et al.2016current gene therapy 16:156)。因此,用于表达ccr4 car的表达载体可以在诱导型启动子的控制下表达ccr4 car,该启动子包括tet操纵基因和最小启动子的几个拷贝。该载体还可以编码融合蛋白,其包括与tetr融合的vp16域的转录激活。在四环素或多西环素存在的情况下,ccr4 car的表达受到抑制。当四环素或多西环素不存在时,表达ccr4。因此,可以在ccr4 car表达受到抑制的条件下扩增携带编码ccr4 car的核酸的t细胞。当获得期望数目的细胞时,撤出四环素或多西环素以诱导表达。
[0120]
图13a描绘了四种诱导型ccr4 car构建体的示意图。图13b显示了诱导型car1(具有cd19t的ccr4 eq)的质粒图谱。图13c显示了诱导型car2(具有cd19t的ccr4 ch3)的质粒图谱。图13d显示了诱导型car3(ccr4 eq)的质粒图谱。图13e显示了诱导型car4(ccr4 ch3)的质粒图谱。
[0121]
其他实施方案
[0122]
应当理解,虽然本发明已经结合其详细描述进行了描述,但前述描述旨在说明而非限制本发明的范围,本发明的范围由所附权利要求书的范围限定。其他方面、优势和修改在所附权利要求书的范围内。
[0123]
出于任何和所有目的,所有参考文献以其整体并入本文。
