1.本发明涉及生物测定用微孔薄膜、生物测定用微孔薄膜形成用感光性树脂组合物和使用该树脂组合物的生物测定用微孔薄膜的制造方法。
背景技术:
2.为了诊断疾病、感染症等,作为用于迅速、高灵敏度地检测出核酸、蛋白质、病毒和细胞等的标记物的技术,有下述方法:将核酸、蛋白质、病毒和细胞等检测对象物质封入至微小容积的液滴中,通过使用了标记抗体的免疫学方法进行检测的“单分子酶测定”法。根据该方法,能够以一分子单位的灵敏度检测出检测对象物质(例如参照专利文献1中记载的发明)。
3.作为这种“单分子酶测定”法中使用的基材,例如使用聚二甲基硅氧烷等各种高分子树脂或硅橡胶等软质物质,通过热固化成型而得到基材(例如参照专利文献2中记载的发明)。
4.另外,提出了将聚苯乙烯、环烯烃聚合物等热塑性树脂进行热加压成型、注射成型而形成的生物测定板(参照专利文献3中记载的发明)。进而,对于生物测定板中应用的树脂而言,提出了不发生自身荧光的树脂(参照专利文献4中记载的发明)。
5.进而,为了酶处理、pcr反应中的芯片整面的调温均匀化,提出了将通过微注射成型而形成的贯通孔用薄膜进行封闭的微小容量的微孔芯片(参照专利文献5中记载的发明)。
6.现有技术文献
7.专利文献
8.专利文献1:日本特开2011-137830号公报
9.专利文献2:日本特开2004-309405号公报
10.专利文献3:日本特表2018-529968号公报
11.专利文献4:日本特开2005-134339号公报
12.专利文献5:日本特开2003-70456号公报
13.专利文献6:日本特开2008-44283号公报
技术实现要素:
14.发明要解决的问题
15.然而,专利文献2所记载的基材由于是热固化成型,因此,为了获得基材而需要长时间,生产率差。进而,因生产率低而在制造成本的方面不利。
16.另外,专利文献3所记载的生物测定板存在以下那样的问题。即,注射成型装置和注射成型中使用的模具价格昂贵,因此,通过注射成型而制造的生物测定板在制造成本的方面不利。因此,对于专利文献3所记载的生物测定板,从成本方面出发难以应对小批量的
生产。
17.另外,专利文献3所记载的生物测定板是具有某种程度的厚度的板状形状。这是因为:在基于注射成型的薄壁成型品的成型中,容易发生未向模具内完全填充树脂的填充不足问题。填充不足可通过提高注射压力来消除,但该情况下,成型品容易产生毛刺,成为不良的原因。为此,板需要某种程度以上的厚度。
18.进而,为了使生物测定板为薄壁,注射成型时的树脂填充路径变窄,因此存在生产率恶化的问题,难以实现某种程度以上的薄壁化。
19.综上所述,在基于注射成型的成型中,可以认为工业生产上能够实施的厚度的下限为300μm~400μm。由于生物测定板的厚度存在下限,因此,存在其成为利用了生物测定板的分析设备的小型化的阻碍这一问题。
20.另外,同样在专利文献3所记载的热加压成型中,由于需要高粘度的树脂的流动性,因此,出于与上述相同的理由,难以薄壁化。
21.并且,注射成型、热加压均在形成后需要冷却工序,制造需要长时间,因此,在制造成本和生产量的方面不利,产业上的利用限制大。
22.另外,“单分子酶测定”法是酶反应,因此容易受到温度环境的影响,尤其是,作为课题还可列举出存在于基材外周部的孔受到周围温度的影响而与其它孔相比推进(或延迟)反应的所谓边缘效应。
23.为了解决这些基于注射成型的薄壁化的课题,专利文献5所记载的发明中,在通过注射成型而形成具有贯通孔的板后,用薄膜封闭而得到微孔板。
24.然而,专利文献5所记载的微孔板也需要注射成型,因此,需要将具有贯通孔的板加厚,进而,无法缩小各个凹部间距离,无法提高“单分子酶测定”法所要求的平面内的凹部密度。
25.进而,对于生物测定用的基材而言,由于在核酸、蛋白质、病毒和细胞等的标记物检测中使用荧光,因此,要求生物测定用基材自身发出的荧光少的低自身荧光特性。然而,应用上述技术时,如上所述那样,由于成型品的厚度存在下限,因此存在如下课题:即便使用自身荧光特性低的材料,也无法进一步抑制某种程度以上的自身荧光特性。这是因为:基材的低自身荧光特性是通过材料固有的自身荧光特性与厚度的乘积而决定的。
26.另一方面,作为除注射成型之外的微细加工方法之一,可列举出使用了感光性树脂组合物的光压印技术(例如参照专利文献6所记载的发明)。但是,如上所述那样,对生物测定用基材要求低自身荧光特性,但未提示出由具有低自身荧光特性的感光性树脂构成的生物测定用基材。
27.进而,在上述光压印技术中,形成微细形状的基材薄膜是必须的,作为低自身荧光的树脂制基材薄膜,可列举出聚苯乙烯、环烯烃聚合物等。尤其是,环烯烃聚合物基材薄膜的透明性、低自身荧光特性优异,适合作为生物测定用基材,但与光压印技术中应用的感光性树脂的粘接性低,难以形成将环烯烃聚合物作为基材薄膜且与具有低自身荧光特性的感光性树脂构成的生物测定用基材。
28.本发明是鉴于上述课题而进行的,其目的在于,提供对于“单分子酶测定”法等所应用的生物测定用基材而言成本低且产业上的利用性高、并且能够表现出低自身荧光特性、容易实现孔的调温且能够抑制边缘效应的生物测定用微孔薄膜及其制造方法,以及生
物测定用微孔薄膜形成用感光性树脂组合物。
29.用于解决问题的方案
30.本发明的生物测定用微孔薄膜的特征在于,其至少由基材和树脂层构成,所述树脂层设置在前述基材的第一主表面上且表面具有微孔,前述基材和前述树脂层在波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下。
31.进而,本发明的生物测定用微孔薄膜中,优选的是:前述树脂层的波长300nm处的吸光系数为0.02μm-1
以下,该吸光系数为波长300nm~800nm的各波长处的吸光系数的最大值。
32.进而,本发明的生物测定用微孔薄膜中,前述树脂层优选为源自光聚合性单体和光聚合性低聚物的感光性树脂组合物的固化体。
33.尤其是,前述树脂层进一步优选为至少包含含氮光聚合性单体的感光性树脂组合物的固化体。
34.若为这种构成,则通过利用具有低自身荧光特性且粘度低的光聚合性单体的光压印法,从而得到适合于“单分子酶测定”法的具有微孔的生物测定用微孔薄膜。
35.另外,本发明的生物测定用微孔薄膜中,前述基材优选为聚对苯二甲酸乙二醇酯、聚碳酸酯、环烯烃聚合物、聚二甲基硅氧烷或聚苯乙烯。
36.另外,本发明的生物测定用微孔薄膜中,优选的是,前述基材和前述树脂层包含氮元素,前述树脂层的平均氮元素浓度(nf)高于前述基材的平均氮元素浓度(ns),前述基材在设置前述树脂层的前述第一主表面侧具有满足下述式(1)的氮元素浓度(ni)的区域。
37.nf》ni》ns
ꢀꢀ
式(1)
38.进而,本发明的生物测定用微孔薄膜中,优选的是:前述树脂层中,前述树脂层的表面的氟元素浓度(fs)与前述树脂层中的平均氟元素浓度(fb)之比优选满足下述式(2)。
39.1《fs/fb≤1500
ꢀꢀꢀꢀ
式(2)
40.本发明的生物测定用微孔薄膜形成用感光性树脂组合物的特征在于,其是包含(a)光聚合性单体、(b)光聚合性低聚物和(c)光聚合引发剂的生物测定用微孔薄膜形成用的感光性树脂组合物,前述(a)光聚合性单体的含量相对于前述感光性树脂组合物的重量为10~80重量%,前述(b)光聚合性低聚物的含量相对于前述感光性树脂组合物的重量为10~80重量%,前述(c)光聚合引发剂的含量相对于前述感光性树脂组合物的重量为0.5~10重量%,所述组合物在固化后的波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下。
41.进而,本发明的生物测定用微孔薄膜形成用感光性树脂组合物中,优选的是:前述(c)光聚合引发剂为α-羟基烷基苯酮系聚合引发剂。
42.进而,本发明的生物测定用微孔薄膜形成用感光性树脂组合物中,前述(a)光聚合性单体优选包含下述化学式(1)所示的含氟(甲基)丙烯酸酯。
43.化学式(1)
44.45.(化学式(1)中,r1表示下述化学式(2),r2表示下述化学式(3)。)
46.化学式(2)
[0047][0048]
(化学式(2)中,n为1以上且6以下的整数。)
[0049]
化学式(3)
[0050][0051]
(化学式(3)中,r为h或ch3。)
[0052]
另外,本发明的生物测定用微孔薄膜形成用感光性树脂组合物中,前述(a)光聚合性单体优选包含含有氮的光聚合性单体。
[0053]
进而,本发明的生物测定用微孔薄膜的制造方法的特征在于,具有如下工序:将前述生物测定用微孔薄膜形成用感光性树脂组合物涂布在规定的基材或母模上的工序;将前述感光性树脂组合物在前述基材与前述母模之间进行按压的工序;通过曝光使前述感光性树脂组合物发生固化而得到固化物的工序;以及,从前述母模上剥离前述固化物的工序。
[0054]
另外,本发明的生物测定用微孔薄膜的制造方法的特征在于,具有如下工序:将前述(a)光聚合性单体包含含有氮的光聚合性单体的生物测定用微孔薄膜形成用感光性树脂组合物至少涂布在规定基材上的工序;前述感光性树脂组合物向前述基材浸透的工序;在前述基材与前述母模之间进行按压的工序;通过曝光使前述感光性树脂组合物发生固化而得到固化物的工序;以及,从前述母模上剥离前述固化物的工序。
[0055]
本发明的生物测定用微孔薄膜应用于例如单分子酶测定法用途。
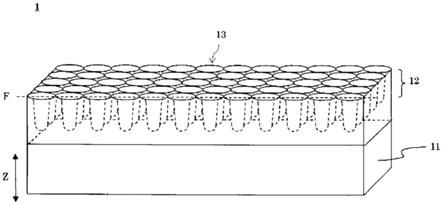
[0056]
发明的效果
[0057]
根据本发明,可提供与以往的基于注射成型的生物测定板相比具有低自身荧光特性、能够以低成本进行制造、容易实现孔的调温、能够抑制边缘效应的“单分子酶测定”法等中应用的生物测定基材,即生物测定用微孔薄膜。进而,可提供能够形成自身荧光特性低、容易进行标记物检测的生物测定用微孔薄膜的感光性树脂组合物;以及使用前述感光性树脂组合物的生物测定用微孔薄膜的制造方法。
附图说明
[0058]
图1是表示本实施方式的生物测定用微孔薄膜的例子的示意性立体图。
[0059]
图2是表示本实施方式的生物测定用微孔薄膜中的微孔的图形的一例的平面示意图。
[0060]
图3是表示本实施方式的生物测定用微孔薄膜中的微孔的图形的一例的平面示意图。
[0061]
图4是本实施例中的生物测定用微孔薄膜的与主表面垂直的方向的氮元素浓度分布的测定结果。
具体实施方式
[0062]
以下,针对本发明的一个实施方式(以下简写为“实施方式”),进行详细说明。需要说明的是,本发明不限定于以下的实施方式,可以在其主旨范围内进行各种变形来实施。表示数值范围的“~”的表述是包括下限值和上限值的含义。
[0063]
以下,针对本实施方式所述的生物测定用微孔薄膜及其制造方法,进行详细说明。此外,(甲基)丙烯酸酯是指丙烯酸酯或甲基丙烯酸酯。
[0064]
《生物测定用微孔薄膜》
[0065]
本实施方式的生物测定用微孔薄膜是表面具有微孔的微孔薄膜,所述微孔是微细凹陷结构,所述薄膜至少由基材和树脂层构成,所述树脂层设置在前述基材的第一主表面上,且表面具有微孔。
[0066]
另外,本实施方式中,构成基材和树脂层的树脂的特征在于,波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下。
[0067]
由于由基材和具有微孔的树脂层构成,因此,能够减薄孔薄膜整体的厚度且使面内的厚度均匀。通过具有基材而能够确保薄膜整体的厚度均匀性,因此,具有微孔的树脂层可以仅是仅够形成微孔的厚度,其结果,能够抑制孔薄膜整体的厚度不均。
[0068]
如上所述,“单分子酶测定”法是酶反应,因此容易受到温度环境的影响,尤其是,存在于基材外周部的孔受到周围温度的影响而与其它孔相比推进(或延迟)反应的所谓边缘效应成为课题。为了解决该课题,通过减薄孔薄膜而容易利用孔薄膜的背面侧的调温板进行调温,且相对地抑制基材外周部的边缘效应。进而,通过抑制孔薄膜整体的厚度不均来进一步抑制调温不均。
[0069]
尤其是,容易制成与以往的基于注射成型的成型板的下限厚度相比更薄的薄膜,因此,能够得到容易实现上述孔薄膜的调温且面内均匀性优异的效果。
[0070]
图1中,作为本发明的一个实施方式,示出生物测定用微孔薄膜的立体截面示意图。
[0071]
图1所示的例中,生物测定用微孔薄膜1呈现薄膜形状,具备基材11和设置在该基材11的第一主表面上且具有微孔的树脂层12。树脂层12包含从生物测定用微孔薄膜1的主表面(第一主表面)f朝着面内方向(朝着与第一主表面相反一侧的第二主表面(背面)方向)延伸的多个凹部13。多个凹部13在与生物测定用微孔薄膜1的主表面f垂直的厚度方向(z轴方向)上以从主表面f朝着下方(生物测定用微孔薄膜1内部)陷落的方式设置。多个凹部13分别以规定的间距排列。
[0072]
本实施方式中的微孔只要是适合于其用途的生物测定的微细凹陷结构,就没有特别限定,凹部优选为孔结构。
[0073]
孔结构的凹部的截面形状可以为长方形、正方形、梯形、以及它们的角部具有曲率的形状等、圆形。另外,孔结构的凹部的上表面平面形状可以为长方形、正方形、梯形、菱形、六边形、三角形、以及它们的角部具有曲率的形状等、圆形。
[0074]
进而,这些孔结构的凹部的图形排列适当根据用途来选择,没有特别限定。
[0075]
例如,可以是孔结构的凹部随机排列、在面内大致均等地形成的图形形状、或者周期性排列的图形形状中的任一者。尤其是,若是孔结构的凹部周期性排列而构成阵列的图形形状,则容易检测出“单分子酶测定”法中的对象物质,故而优选。
[0076]
图2是本实施方式所述的生物测定用微孔薄膜1的平面示意图。如图2所示那样,在包含微孔的树脂层12的主表面f形成的孔结构的凹部13彼此以相同的间距隔开规定间隔地排列,呈现四方配置。
[0077]
图3是表示本实施方式所述的生物测定用微孔薄膜1的其它例的平面示意图。如图3所示那样,在包含微孔的树脂层12的主表面f形成的孔结构的凹部13彼此以相同的间距隔开规定间隔地排列,呈现三方配置。
[0078]
本实施方式中的孔结构的凹部13的大小可选择适合其用途的生物测定的尺寸,没有特别限定,例如,孔结构的上表面平面形状为圆形时,其直径优选为50nm~100μm的范围,若直径为100nm~50μm的范围,则适合于rna~细胞检测的生物测定,故而优选。进而,若为200nm~10um的范围,则最适合于“单分子酶测定”,故而特别优选。
[0079]
另外,孔结构的深度优选为50nm~100μm的范围,若直径为100nm~50μm的范围,则出于与上述相同的理由,适合于生物测定,故而优选,进而,若为200nm~10um的范围,则与上述同样地最适合于“单分子酶测定”,故而特别优选。
[0080]
本实施方式中的各凹部13间的间距优选为200nm~400μm的范围,若为400nm~200μm的范围,则容易检测出生物测定中的对象物质,故而优选,若为800nm~40μm的范围,则“单分子酶测定”中的检测灵敏度达到最大,故而特别优选。
[0081]
此处,本实施方式中的各凹部间的间距是与最接近各孔的其它孔之间的中心间最短距离,在周期排列的图形形状中,是其周期间距,在孔结构的凹部随机配置的情况下,是各个最接近距离的平均值。
[0082]
本实施方式的生物测定用微孔薄膜中,基材11和包含微孔的树脂层12在波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下。
[0083]
〈吸光系数〉
[0084]
通过将吸光系数抑制至0.01μm-1
以下,从而能够得到使波长350nm~波长800nm处的自身荧光特性降低的微孔薄膜。荧光发光是吸收特定波长的激发光,并利用其能量发出与激发光相比更长波长的荧光的机理。因此,如果抑制吸光系数,则存在还能够抑制荧光特性的倾向。
[0085]
另一方面,如上所述,本实施方式的微孔薄膜中,由于具有微孔的树脂层的厚度薄,因此能够抑制薄膜的调温不均。为此,具有微孔的树脂层优选为包含光聚合性单体的感光性树脂组合物的固化体。需要说明的是,树脂层优选为源自光聚合性单体和光聚合性低聚物的感光性树脂组合物的固化体。然而,光聚合性单体因光照射而固化,因此,寻求用于光固化的波长的吸光系数高,与前述自身荧光特性的抑制相反。
[0086]
本发明人等经深入研究的结果发现:若具有微孔的树脂层在波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下,则即便是包含光聚合性单体的感光性树脂组合物的固化体,也能够抑制自身荧光特性。通过将光聚合后的固化体的吸光系数设为前述值,从而能够维持光聚合性单体的反应性,且能够抑制自身荧光特性。
[0087]
若波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下,则即便是包含光聚合性单体的感光性树脂组合物的固化体,也能够抑制自身荧光特性的详情尚不明确,但可如下推测。
[0088]
首先,由本发明人等的研究可以明确:微孔薄膜的自身荧光特性与波长350nm~波
长800nm的各波长处的吸光系数成比例。推测:为了荧光发光而需要吸收与荧光波长相比更短波长的光,所吸收的波长的光因特定的荧光转换效率而成为荧光。
[0089]
本实施方式的微孔薄膜由基材11和包含微孔的树脂层12构成。基材11使用通常的平坦薄膜,与现有技术的基于注射成型的成型品相比更薄,约为50μm~188μm的范围。
[0090]
另外,前述包含微孔的树脂层12的厚度是去除前述孔结构的凹部体积后的平均厚度与凹部底部的最薄部的厚度之和,约为10~15μm。
[0091]
根据上述内容,微孔薄膜的基材11使用具有与以往的在注射成型中使用的树脂相同的自身荧光特性的树脂时,若下述式(3)成立,则至少具有等于或低于现有技术的基于注射成型的最薄成型品的自身荧光特性。
[0092]
基材11的自身荧光特性+树脂层12的自身荧光特性
[0093]
《基于注射成型最薄厚度的自身荧光特性
ꢀꢀꢀ
式(3)
[0094]
自身荧光特性
∝
吸光系数
×
厚度
ꢀꢀꢀ
式(4)
[0095]
由式(3)、式(4)得到式(5)。
[0096]
树脂层12的吸光系数a《(基于注射成型的最薄成形品-基材11)
×
吸光系数b式(5)
[0097]
此处,吸光系数a、b分别为树脂层12、基材11或基于注射成型的最薄成形品的吸光系数。
[0098]
在满足式(5)的吸光系数a的树脂层12时,能够得到具有与以往的基于注射成型的生物测定板相比更低自身荧光特性的生物测定用微孔薄膜。
[0099]
进而,经本发明人等深入研究的结果,若树脂层12的波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下,则能够得到具有低自身荧光特性的生物测定用孔薄膜。
[0100]
另外,若树脂层12的波长350nm~波长800nm的各波长处的吸光系数为0.005μm-1
以下,则低自身荧光特性更低,因此,容易利用荧光进行生物标记物检测,故而优选,若为0.001μm-1
以下,则在微小孔体积且生物标记物的荧光强度少的“单分子酶测定”中,通过抑制由基材导致的背景信号,从而也能够降低检测灵敏度,故而特别优选。
[0101]
进而,本实施方式的生物测定用微孔薄膜中,优选的是:树脂层12的波长300nm处的吸光系数为0.02μm-1
以下,该吸光系数为波长300nm~800nm的各波长处的吸光系数的最大值。
[0102]
若为上述吸光系数的分布,则显示吸光系数的峰的波长至少为300nm以下,因此,本实施方式的生物测定用微孔薄膜中的树脂层12采用包含光聚合性单体的感光性树脂组合物的固化体时,能够得到具有良好的光固化特性和低自身荧光特性的生物测定用微孔薄膜,故而优选。
[0103]
树脂层12中,在前述波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下的基础上,若显示吸光系数的峰的波长为300nm以下,则能够获得具有低自身荧光特性的生物测定用微孔薄膜的理由推测如下。
[0104]
如上所述,荧光发光是吸收特定波长的激发光,且利用其能量发出与激发光相比更长波长的荧光的机理。形成生物测定用微孔薄膜的高分子的吸收以特定波长为中心而显示宽阔的吸收,因此,若在超过300nm的波长域具有吸收峰,则难以得到良好的低自身荧光特性,故不优选。
[0105]
本实施方式的生物测定用微孔薄膜中,树脂层12的波长300nm处的吸光系数为波
长300nm~800nm的各波长处的吸光系数的最大值,若为0.01μm-1
以下,则低自身荧光特性更低,因此,容易利用荧光进行生物标记物检测,故而优选,若为0.002μm-1
以下,则在微小孔体积且生物标记物的荧光强度少的“单分子酶测定”中,通过抑制由基材导致的背景信号,从而也能够降低检测灵敏度,故而特别优选。
[0106]
另外,若本实施方式的生物测定用微孔薄膜中的基材11在波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下,则能够维持光聚合性单体的反应性,且能够抑制自身荧光特性。
[0107]
需要说明的是,本说明书中,“吸光系数”由下述式(6)求出。
[0108]
吸光系数=吸光度/薄膜厚度(μm)
ꢀꢀ
式(6)
[0109]
进而,吸光度按照下述式(7)来计算。
[0110]
吸光度=-log(透光率)
ꢀꢀ
式(7)
[0111]
透光率利用一般的分光光度体系进行测定来求出,可列举出例如分光光度计uv-2500(岛津制作所公司制)。
[0112]
〈基材〉
[0113]
为了抑制上述那样的本实施方式的生物测定用微孔薄膜的边缘效应,本实施方式中的基材的厚度优选为10μm~300μm的范围,若为20μm以上,则在微孔薄膜的处理方面更为优选,若为200μm以下,则容易实现微孔薄膜的调温,故而更优选。
[0114]
另外,出于相同的理由,关于本实施方式的具有微孔的树脂层的厚度,孔底部的最薄部的厚度优选为1nm~10μm的范围,若为10nm~1μm的范围,则进一步抑制微孔薄膜的调温不均,故而更优选。
[0115]
作为基材的材料,只要波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下,就没有特别限定,玻璃、陶瓷等无机材料、塑料等有机材料均可使用。优选为具有弯曲性且连续生产率优异的薄膜形状,可以使用与薄膜、织物、无纺布等复合化而得的物质。例如,优选为聚对苯二甲酸乙二醇酯、聚碳酸酯、环烯烃聚合物、聚二甲基硅氧烷、聚苯乙烯。
[0116]
尤其是,环烯烃聚合物在紫外线~红外线区域中的透明性优异,该波长范围内的自身荧光特性也低,故而特别优选。可列举出由这种环烯烃聚合物形成的日本zeon公司制的zeonor film(注册商标)、jsr公司制的arton(注册商标)薄膜。
[0117]
本实施方式的生物测定用微孔薄膜中的基材的厚度只要能够在其表面形成具有微孔的树脂层,就没有特别限定,根据前述式(5),若至少比通常的基于注射成型的最薄成形品更薄,则能够得到本发明的下述效果:容易实现孔调温且能够抑制边缘效应,进而能够抑制自身荧光特性,容易实现标记物检测。
[0118]
出于上述理由,基材的厚度优选为300μm以下,若为200μm以下,则包括表面树脂层在内的微孔薄膜总厚比基于注射成型的最薄成形品更薄,因此能够抑制边缘效应,故而优选,若为190μm以下,则能够抑制自身荧光特性,故而更优选。
[0119]
〈树脂层〉
[0120]
作为形成构成本实施方式的生物测定用微孔薄膜中的具有微孔的树脂层的固化体的光聚合性单体,只要包含其的树脂层在波长350nm~波长800nm的各波长处的吸光系数为0.01μm-1
以下且能够进行光聚合,则可以为自由基聚合体系,也可以为阳离子聚合体系,没有特别限定,可以含有氟树脂。若含有氟树脂,则表现出表面拒液性,因此,促进在生物测
定中的微孔内形成微小液滴,故而优选。
[0121]
作为构成具有微孔的树脂层的能够进行光聚合的自由基聚合体系的树脂,可以使用例如树脂组合物,所述树脂组合物是作为光聚合性单体的(甲基)丙烯酸酯与光聚合性低聚物和光聚合引发剂的混合物。
[0122]
作为(甲基)丙烯酸酯,只要固化后的玻璃化转变温度为100℃以上,只要更优选为120℃以上,就没有特别限定,优选为具有丙烯酰基或甲基丙烯酰基的单体、具有乙烯基的单体、具有烯丙基的单体,更优选为具有丙烯酰基或甲基丙烯酰基的单体。此处,固化后的玻璃化转变温度是指相对于所使用的(甲基)丙烯酸酯的混合物的固化物的玻璃化转变温度。即,例如使用(甲基)丙烯酸酯a、(甲基)丙烯酸酯b、(甲基)丙烯酸酯c时,即便在固化后的(甲基)丙烯酸酯a、b、c的玻璃化转变温度分别为60℃、100℃、120℃的情况下,如果它们的混合物((甲基)丙烯酸酯a+(甲基)丙烯酸酯b+(甲基)丙烯酸酯c)在固化后的玻璃化转变温度为105℃,则采用105℃作为玻璃化转变温度。
[0123]
作为光聚合性单体,优选为具有多个聚合性基团的多官能性单体,从聚合性优异的方面出发,聚合性基团的数量优选为1~6的整数。另外,混合使用两种以上的聚合性单体时,聚合性基团的平均数优选为2~5。使用单一单体时,为了增加聚合反应后的交联点、获得固化物的物理稳定性(强度、耐热性等),优选聚合性基团的数量为3以上的单体。另外,在聚合性基团的数量为1或2的单体的情况下,优选与聚合性基团不同的单体组合使用。
[0124]
作为(甲基)丙烯酸酯单体的具体例,可列举出下述化合物。作为具有丙烯酰基或甲基丙烯酰基的单体,可列举出(甲基)丙烯酸、芳香族系的(甲基)丙烯酸酯[丙烯酸苯氧基乙酯、丙烯酸苄酯等]、烃系的(甲基)丙烯酸酯[丙烯酸硬脂酯、丙烯酸月桂酯、丙烯酸2-乙基己酯、丙烯酸烯丙酯、1,3-丁二醇二丙烯酸酯、1,4-丁二醇二丙烯酸酯、1,6-己二醇二丙烯酸酯、三羟甲基丙烷三丙烯酸酯、季戊四醇三丙烯酸酯、二季戊四醇六丙烯酸酯等]、包含醚性氧原子的烃系的(甲基)丙烯酸酯[丙烯酸乙氧基乙酯、丙烯酸甲氧基乙酯、丙烯酸缩水甘油酯、丙烯酸四氢糠酯、二乙二醇二丙烯酸酯、新戊二醇二丙烯酸酯、聚氧乙二醇二丙烯酸酯、三丙二醇二丙烯酸酯等]、包含官能团的烃系的(甲基)丙烯酸酯[丙烯酸2-羟基乙酯、丙烯酸2-羟基丙酯、4-羟基丁基乙烯基醚、丙烯酸n,n-二乙基氨基乙酯、丙烯酸n,n-二甲基氨基乙酯、甲基丙烯酸二甲基氨基乙酯等]、有机硅系的丙烯酸酯等。除此之外,可列举出eo改性甘油三(甲基)丙烯酸酯、ech改性甘油三(甲基)丙烯酸酯、po改性甘油三(甲基)丙烯酸酯、季戊四醇三丙烯酸酯、eo改性磷酸三丙烯酸酯、三羟甲基丙烷三(甲基)丙烯酸酯、己内酯改性三羟甲基丙烷三(甲基)丙烯酸酯、po改性三羟甲基丙烷三(甲基)丙烯酸酯、三(丙烯酰氧基乙基)异氰脲酸酯、eo改性三羟甲基丙烷三(甲基)丙烯酸酯、二季戊四醇六(甲基)丙烯酸酯、己内酯改性二季戊四醇六(甲基)丙烯酸酯、二季戊四醇羟基五(甲基)丙烯酸酯、烷基改性二季戊四醇五(甲基)丙烯酸酯、二季戊四醇聚(甲基)丙烯酸酯、双三羟甲基丙烷四(甲基)丙烯酸酯、烷基改性二季戊四醇三(甲基)丙烯酸酯、季戊四醇乙氧基四(甲基)丙烯酸酯、季戊四醇四(甲基)丙烯酸酯、二乙二醇单乙基醚(甲基)丙烯酸酯、二羟甲基二环戊烷二(甲基)丙烯酸酯、二(甲基)丙烯酸化异氰脲酸酯、1,3-丁二醇二(甲基)丙烯酸酯、1,4-丁二醇二(甲基)丙烯酸酯、eo改性1,6-己二醇二(甲基)丙烯酸酯、ech改性1,6-己二醇二(甲基)丙烯酸酯、烯丙氧基聚乙二醇丙烯酸酯、1,9-壬二醇二(甲基)丙烯酸酯、eo改性双酚a二(甲基)丙烯酸酯、po改性双酚a二(甲基)丙烯酸酯、改性双酚a二(甲基)丙烯酸酯、eo改性双
酚f二(甲基)丙烯酸酯、ech改性六氢邻苯二甲酸二丙烯酸酯、新戊二醇二(甲基)丙烯酸酯、羟基特戊酸新戊二醇二(甲基)丙烯酸酯、eo改性新戊二醇二丙烯酸酯、po改性新戊二醇二丙烯酸酯、己内酯改性羟基特戊酸酯新戊二醇、硬脂酸改性季戊四醇二(甲基)丙烯酸酯、ech改性丙二醇二(甲基)丙烯酸酯、ech改性苯二甲酸二(甲基)丙烯酸酯、聚(乙二醇-四亚甲基二醇)二(甲基)丙烯酸酯、聚(丙二醇-四亚甲基二醇)二(甲基)丙烯酸酯、聚丙二醇二(甲基)丙烯酸酯、有机硅二(甲基)丙烯酸酯、四乙二醇二(甲基)丙烯酸酯、三乙二醇二(甲基)丙烯酸酯、聚酯(二)丙烯酸酯、聚乙二醇二(甲基)丙烯酸酯、二羟甲基三环癸烷二(甲基)丙烯酸酯、新戊二醇改性三羟甲基丙烷二(甲基)丙烯酸酯、二丙二醇二(甲基)丙烯酸酯、三丙二醇二(甲基)丙烯酸酯、三甘油二(甲基)丙烯酸酯、eo改性三丙二醇二(甲基)丙烯酸酯、二乙烯基乙烯脲、二乙烯基丙烯脲、2-乙基-2-丁基丙二醇丙烯酸酯、(甲基)丙烯酸2-乙基己酯、2-乙基己基卡必醇(甲基)丙烯酸酯、(甲基)丙烯酸2-羟基乙酯、(甲基)丙烯酸2-羟基丙酯、(甲基)丙烯酸2-羟基丁酯、(甲基)丙烯酸2-甲氧基乙酯、(甲基)丙烯酸3-甲氧基丁酯、(甲基)丙烯酸4-羟基丁酯、丙烯酸二聚物、(甲基)丙烯酸苄酯、丁二醇单(甲基)丙烯酸酯、(甲基)丙烯酸丁氧基乙酯、(甲基)丙烯酸丁酯、(甲基)丙烯酸鲸蜡酯、eo改性甲酚(甲基)丙烯酸酯、(甲基)丙烯酸乙氧基化苯酯、(甲基)丙烯酸乙酯、二丙二醇(甲基)丙烯酸酯、(甲基)丙烯酸异戊酯、(甲基)丙烯酸异丁酯、(甲基)丙烯酸异辛酯、(甲基)丙烯酸环己酯、(甲基)丙烯酸二环戊酯、(甲基)丙烯酸异冰片酯、(甲基)丙烯酸二环戊氧基乙酯、(甲基)丙烯酸异肉豆蔻酯、(甲基)丙烯酸月桂酯、甲氧基二丙二醇(甲基)丙烯酸酯、甲氧基聚乙二醇(甲基)丙烯酸酯、甲氧基三乙二醇(甲基)丙烯酸酯、(甲基)丙烯酸甲酯、甲氧基三丙二醇(甲基)丙烯酸酯、新戊二醇苯甲酸酯(甲基)丙烯酸酯、壬基苯氧基聚乙二醇(甲基)丙烯酸酯、壬基苯氧基聚丙二醇(甲基)丙烯酸酯、(甲基)丙烯酸辛酯、对枯基苯氧基乙二醇(甲基)丙烯酸酯、ech改性苯氧基丙烯酸酯、苯氧基二乙二醇(甲基)丙烯酸酯、苯氧基六乙二醇(甲基)丙烯酸酯、苯氧基四乙二醇(甲基)丙烯酸酯、(甲基)丙烯酸苯氧基乙酯、聚乙二醇(甲基)丙烯酸酯、聚乙二醇-聚丙二醇(甲基)丙烯酸酯、聚丙二醇(甲基)丙烯酸酯、(甲基)丙烯酸硬脂酯、eo改性琥珀酸(甲基)丙烯酸酯、(甲基)丙烯酸叔丁酯、(甲基)丙烯酸三溴苯酯、eo改性三溴苯基(甲基)丙烯酸酯、三(十二烷基)(甲基)丙烯酸酯、异氰脲酸eo改性二丙烯酸酯和异氰脲酸eo改性三丙烯酸酯、ε-己内酯改性三(丙烯酰氧基乙基)异氰脲酸酯、双三羟甲基丙烷四丙烯酸酯等。作为具有烯丙基的单体,可列举出对异丙烯基苯酚,作为具有乙烯基的单体,可列举出苯乙烯、α-甲基苯乙烯、丙烯腈、乙烯基咔唑等。需要说明的是,eo改性是指环氧乙烷改性,ech改性是指表氯醇改性,po改性是指环氧丙烷改性。另外,例如作为双酚a系,也可以采用在双酚a的两端分别加成平均各2摩尔的环氧丙烷和平均各6摩尔的环氧乙烷而得的聚亚烷基二醇的二甲基丙烯酸酯、在双酚a的两端分别加成平均各5摩尔的环氧乙烷而得的聚乙二醇的二甲基丙烯酸酯(新中村化学工业公司制、nk ester bpe-500)、以及在双酚a的两端分别加成平均各2摩尔的环氧乙烷而得的聚乙二醇的二甲基丙烯酸酯(新中村化学工业公司制、nk ester bpe-200)。可列举出例如1,6-己二醇二(甲基)丙烯酸酯、1,4-环己二醇二(甲基)丙烯酸酯、聚丙二醇二(甲基)丙烯酸酯、聚乙二醇二(甲基)丙烯酸酯、2-二(对羟基苯基)丙烷二(甲基)丙烯酸酯、甘油三(甲基)丙烯酸酯、三羟甲基丙烷三(甲基)丙烯酸酯、聚氧丙基三羟甲基丙烷三(甲基)丙烯酸酯、聚氧乙基三羟甲基丙烷三丙烯酸酯、季戊四醇四(甲基)丙烯酸酯、二季戊四醇五(甲基)丙烯酸酯、三羟甲基丙烷三缩水
甘油醚三(甲基)丙烯酸酯、双酚a二缩水甘油醚二(甲基)丙烯酸酯、β-羟基丙基-β
’‑
(丙烯酰氧基)丙基邻苯二甲酸酯、苯氧基聚乙二醇(甲基)丙烯酸酯、壬基苯氧基聚乙二醇(甲基)丙烯酸酯、壬基苯氧基聚亚烷基二醇(甲基)丙烯酸酯、聚丙二醇单(甲基)丙烯酸酯等。作为氨基甲酸酯化合物,可列举出例如通过六亚甲基二异氰酸酯、甲苯二异氰酸酯或2,2,4-三甲基六亚甲基二异氰酸酯等二异氰酸酯化合物与一分子中具有羟基和(甲基)丙烯酰基的化合物(丙烯酸2-羟基丙酯、低聚丙二醇单甲基丙烯酸酯等)的反应而得到的氨基甲酸酯化合物等。具体而言,有六亚甲基二异氰酸酯与低聚丙二醇单甲基丙烯酸酯(日本油脂公司制、blemmer pp1000)的反应物。
[0125]
另外,本实施方式中,作为构成具有微孔的树脂层的能够光聚合的自由基聚合系的树脂组合物,还优选包含含氮光聚合性单体。具体而言,优选以5重量%~40重量%的范围含有属于n-乙烯基化合物的单体。此处,作为特别优选使用且属于n-乙烯基化合物的单体,可列举出n-乙烯基甲酰胺、n-乙烯基乙酰胺、n-乙烯基吡咯烷酮和n-乙烯基己内酰胺中的至少1个以上。通过配混这些n-乙烯基化合物类,从而能够提高具有微孔的树脂层与基材薄膜的密合性,且能够维持低自身荧光特性。
[0126]
另外,通过含有前述含氮光聚合性单体,从而在聚合后自模具脱模的脱模性也良好,故而优选。
[0127]
为了发挥上述效果,这些含氮光聚合性单体的含量优选为5重量%以上。另外,通过为40重量%以下,从而能够抑制自聚合物中渗出那样的低聚合度低聚物的副产,另外,还能够抑制具有微孔的树脂层的过度吸湿,本实施方式的生物测定用微孔薄膜的耐湿特性提高,故而优选。若这些含氮光聚合性单体的含量为15重量%~38重量%的范围,则上述密合性提高,故而优选,若为25重量%~35重量%的范围,则特别优选。
[0128]
本实施方式的组合物中,除此之外,可以含有单官能单体。
[0129]
作为其例子,可列举出丙烯酸苯氧基乙酯、丙烯酸四氢糠酯、丙烯酸异冰片酯、丙烯酸2-羟基乙酯、丙烯酸4-羟基丁酯、丙烯酸异丁酯、丙烯酸叔丁酯、丙烯酸异辛酯、丙烯酸2-甲氧基乙酯、甲氧基三乙二醇丙烯酸酯、丙烯酸2-乙氧基乙酯、丙烯酸3-甲氧基丁酯、丙烯酸乙氧基乙酯、丙烯酸丁氧基乙酯、乙氧基二乙二醇丙烯酸酯、丙烯酸2-羟基乙酯、乙基二甘醇丙烯酸酯、环状三羟甲基丙烷甲缩醛单丙烯酸酯、酰亚胺丙烯酸酯、丙烯酸异戊酯、乙氧基化琥珀酸丙烯酸酯、丙烯酸三氟乙酯、ω-羧基聚己内酯单丙烯酸酯、丙烯酸苄酯、丙烯酸甲基苯氧基乙酯、丙烯酸环己酯、丙烯酸4-叔丁基环己酯、己内酯改性四氢糠基丙烯酸酯、丙烯酸三溴苯酯、乙氧基化三溴苯基丙烯酸酯、丙烯酸2-苯氧基乙酯、丙烯酰基吗啉、苯氧基二乙二醇丙烯酸酯、丙烯酸2-羟基-3-苯氧基丙酯、1,4-环己烷二甲醇单丙烯酸酯、丙烯酸2-(2-乙氧基乙氧基)乙酯、丙烯酸硬脂酯、二乙二醇单丁基醚丙烯酸酯、丙烯酸月桂酯、丙烯酸异癸酯、3,3,5-三甲基环己醇丙烯酸酯、丙烯酸异辛酯、丙烯酸辛基/癸基酯、丙烯酸十三烷基酯、己内酯丙烯酸酯、乙氧基化(4)壬基苯酚丙烯酸酯、甲氧基聚乙二醇(350)单丙烯酸酯、甲氧基聚乙二醇(550)单丙烯酸酯等,不限定于它们。这些单体可根据需要组合使用两种以上。
[0130]
上述光聚合性单体的配混量相对于感光性树脂组合物的重量优选为10~95重量%、进一步优选为20~92重量%。需要说明的是,光聚合性单体的配混量更优选设为10~80重量%。若为该范围,则具有低粘度和充分的固化硬度,通过光压印法能够得到适合于“单分子酶测定”法的具有微细孔的生物测定用微孔薄膜。
[0131]
前述树脂层含有氟树脂时,若树脂层的表面的氟元素浓度(fs)与前述树脂层中的平均氟元素浓度(fb)之比满足下述式(2),则如上述那样作为生物测定用基材是优选的。
[0132]
1《(fs/fb)≤15000
ꢀꢀꢀꢀꢀ
式(2)
[0133]
通过将树脂层的表面(微孔结构附近)的氟浓度设为树脂层的平均氟浓度以上,从而树脂层的表面因自由能低而表现出表面拒液性,促进在微孔内形成微小液滴。这是因为:若在生物测定用微孔薄膜上涂布检查液,则检查液会进入至微小孔内,但由于表面的拒液性,液滴会在微孔内和薄膜最表面被断开。作为结果,仅在微小孔内残留检查液。尤其是,作为需要微小液滴的“单分子酶测定”法用基材是适合的。
[0134]
另一方面,若树脂层的氟浓度高,则与基材的粘接性降低,故不优选,因此,在基材附近能够保持高自由能,能够进一步维持粘接性。
[0135]
尤其是,若为20≤(fs/fb)≤200的范围,则树脂层表面部的氟元素浓度(fs)充分高于树脂层的平均氟浓度(fb),能够有效地减少树脂层表面的自由能。另外,通过使树脂层中的平均氟浓度(fb)相对性地低于树脂层表面部的氟元素浓度(fs),从而树脂层自身的强度提高,且在树脂层中的基材附近,能够保持高自由能,因此,与基材的密合性提高,故而优选。
[0136]
另外,如果为26≤(fs/fb)≤189的范围,则能够进一步降低树脂表面的自由能,故而优选。进而,如果为30≤(fs/fb)≤160的范围,则使树脂表面的自由能减少,且能够维持树脂的强度,故而优选,如果为31≤(fs/fb)≤155,则更优选。如果为46≤(fs/fb)≤155,则能够进一步表现出上述效果,故而优选。
[0137]
本实施方式中的感光性树脂组合物中,优选在包含上述光聚合性单体的基础上,包含下述化学式(1)所示的含氟(甲基)丙烯酸酯,相对于感光性树脂组合物的重量,优选为0.1~20重量%。
[0138]
化学式(1)
[0139][0140]
(化学式(1)中,r1表示下述化学式(2),r2表示下述化学式(3)。)
[0141]
化学式(2)
[0142][0143]
(化学式(2)中,n为1以上且6以下的整数。)
[0144]
化学式(3)
[0145][0146]
(化学式(3)中,r为h或ch3。)
[0147]
如果为0.1重量%以上,则脱模性优异,如果为20重量%以下,则对于基材的密合性优异,故而优选。尤其是,若为0.5~10重量%,则能够兼顾光纳米压印法中的脱模性和对
于基材的密合性,故而优选。
[0148]
此外,在上述范围之中,通过使含氟(甲基)丙烯酸酯为0.8重量份以上,从而能够提高树脂层表面部(微孔表面)的氟元素浓度(fs),故而更优选,通过为6重量份以下,从而能够降低树脂中的平均氟元素浓度(fb),能够提高树脂层的微孔的强度与基材界面的密合力,故而更优选。进而,如果为1重量份~6重量份的范围,则能够进一步降低树脂表面的自由能,微孔中的微小液滴形成变得良好,故而优选。
[0149]
本说明书中,“树脂层的表面部”表示树脂层的微孔的表面部,是指:在与树脂层的表面正交的厚度方向上,自树脂层的表面侧起约1%~10%这一范围的部分或者2nm~20nm这一范围的部分。另外,本实施方式中,树脂层的表面部的氟元素浓度(fs)采用通过后述xps法而求出的值。本实施方式中,根据xps法中的x射线的侵入长度、即数nm的深度处的测定值,作为氟元素浓度(fs)。
[0150]
另一方面,本说明书中,“树脂中的平均氟元素浓度(fb)”采用由投料量计算的值、或者能够由气相色谱质谱分析仪(gc/ms)进行分析的值。即,是指构成树脂层的树脂中包含的氟元素浓度。例如,通过将形成为薄膜状的由光聚合性混合物的固化物构成的树脂层的树脂部分物理剥离而得到切片,并利用烧瓶燃烧法来分解该切片,接着实施离子色谱分析,从而能够鉴定树脂中的平均氟元素浓度(fb)。
[0151]
本实施方式的生物测定用微孔薄膜中,优选的是:树脂层的平均氮元素浓度(nf)高于基材的平均氮元素浓度(ns),前述基材在设置前述树脂层的前述第一主表面侧具有满足下述式(1)的氮元素浓度(ni)的区域。
[0152]
nf》ni》ns式(1)
[0153]
另外,基材优选在设置树脂层的第一主表面侧具有氮元素浓度朝着与第一主表面相反一侧的第二主表面递减的区域。
[0154]
通过从具有微孔的树脂层与基材的界面(第一主表面)朝着背面(第二主表面)的方向、换言之、在界面的基材侧内部存在氮元素浓度(ni)的分布,从而具有微孔的树脂层与基材的粘接性变得良好。尤其是,透明性、低自身荧光特性优异,适合作为生物测定用基材,但与感光性树脂的粘接性低,与环烯烃聚合物基材薄膜的粘接性良好,故而优选。
[0155]
若在界面的基材侧内部存在上述那样的氮元素浓度(ni)的分布,则与基材、尤其是环烯烃聚合物基材薄膜的粘接性良好的明确机理尚不知晓,但推测如下。
[0156]
换言之,可以认为:在基材的内部,含氮光聚合性单体从与树脂层的界面浸透,并在基材的内部发生聚合,由此与表面的树脂层形成分子链网络,产生牢固的界面粘接力。根据本发明人等的详细研究已明确:尤其是含氮光聚合性单体的浸透力强,产生牢固的粘接力。
[0157]
若递减的氮元素浓度(ni)的层厚度为1nm以上且100nm以下,则表现出良好的粘接性,优选的是:若为1nm以上且500nm以下,则由含氮光聚合性单体的固化实现的粘接增强固化得以增强,故而优选,若为1nm以上且2000nm以下,则不存在由含氮光聚合性单体的浸透导致的雾度,粘接性进一步增强,故而更优选。像这样,将递减的氮元素浓度(ni)的层厚度的下限值设为1nm,但为了表现出粘接性,更优选为10nm以上,为了表现出稳定的粘接性,进一步优选为50nm以上。
[0158]
另外,本说明书中,“具有微孔的树脂中的平均氮元素浓度(nf)”采用由投料量计
算的值、或者能够由气相色谱质谱分析仪(gc/ms)进行分析的值。即,是指构成树脂层的树脂中包含的氮元素浓度。例如,通过将形成为薄膜状的由光聚合性混合物的固化物构成的树脂层的树脂部分物理剥离而得到切片,并利用烧瓶燃烧法来分解该切片,接着实施离子色谱分析,从而能够鉴定树脂中的平均氮元素浓度(nf)。
[0159]
另外,同样地,在本说明书中,“基材的平均氮元素浓度(ns)”采用能够由气相色谱质谱分析仪(gc/ms)进行分析的值。即,是指基材中包含的氮元素浓度。例如,通过利用烧瓶燃烧法来分解从基材中物理剥离出的切片,接着实施离子色谱分析,从而能够鉴定基材中的平均氮元素浓度(ns)。
[0160]
进而,在本说明书中,从具有微孔的树脂层与基材的界面朝着第二主表面(背面)的方向存在的氮元素浓度(ni)采用在沿着与前述主表面垂直的方向切割的截面中测定前述具有微孔的树脂层与基材这两者的界面的氮元素浓度而得到的值。作为测定方法,可列举出edx(能量色散型x射线光谱法)、eels(电子能量损失谱法)。
[0161]
另外,还可列举出如下方法:将界面利用2度~5度左右的极低角倾斜切削法进行切割,并利用tof-sims(飞行时间型二次离子质谱分析法)对所露出的界面附近进行测定。根据该方法,能够得到将界面附近的氮元素浓度在厚度方向上进行延伸的信息,因此,能够以良好的精度测定深度方向的氮元素浓度,故而优选。
[0162]
本实施方式中的能够光聚合的自由基聚合系树脂中,优选在包含上述光聚合性单体的基础上,还包含光聚合性低聚物,可以使用具有烯属不饱和双键的低聚物。作为其例子,可列举出芳香族氨基甲酸酯低聚物、脂肪族氨基甲酸酯低聚物、环氧丙烯酸酯低聚物、聚酯丙烯酸酯低聚物、脂肪族氨基甲酸酯丙烯酸酯低聚物、其它的特殊低聚物。
[0163]
作为其市售品,可列举出日本化学合成公司制的uv-2000b、uv-2750b、uv-3000b、uv-3010b、uv-3200b、uv-3300b、uv-3700b、uv-6640b、uv-8630b、uv-7000b、uv-7610b、uv-1700b、uv-7630b、uv-6300b、uv-6640b、uv-7550b、uv-7600b、uv-7605b、uv-7610b、uv-7630b、uv-7640b、uv-7650b、ut-5449、ut-5454;sartomer公司制的cn902、cn902j75、cn929、cn940、cn944、cn944b85、cn959、cn961e75、cn961h81、cn962、cn963、cn963a80、cn963b80、cn963e75、cn963e80、cn963j85、cn964、cn965、cn965a80、cn966、cn966a80、cn966b85、cn966h90、cn966j75、cn968、cn969、cn970、cn970a60、cn970e60、cn971、cn971a80、cn971j75、cn972、cn973、cn973a80、cn973h85、cn973j75、cn975、cn977、cn977c70、cn978、cn980、cn981、cn981a75、cn981b88、cn982、cn982a75、cn982b88、cn982e75、cn983、cn984、cn985、cn985b88、cn986、cn989、cn991、cn992、cn994、cn996、cn997、cn999、cn9001、cn9002、cn9004、cn9005、cn9006、cn9007、cn9008、cn9009、cn9010、cn9011、cn9013、cn9018、cn9019、cn9024、cn9025、cn9026、cn9028、cn9029、cn9030、cn9060、cn9165、cn9167、cn9178、cn9290、cn9782、cn9783、cn9788、cn9893;daicel-cytec公司制的ebecryl(注册商标)210、ebecryl220、ebecryl230、ebecryl270、krm8200、ebecryl5129、ebecryl8210、ebecryl8301、ebecryl8804、ebecryl8807、ebecryl9260、krm7735、krm8296、krm8452、ebecryl4858、ebecryl8402、ebecryl9270、ebecryl8311、ebecryl8701等,也可以将它们组合使用。
[0164]
另外,通过合成而得到的低聚物可以单独使用或组合使用。
[0165]
上述单体的配混量相对于感光性树脂组合物的重量优选为10~80重量%、进一步优选为20~80重量%。若为该范围,则能够抑制在光压印法中得到的固化物的厚度不均,能
够通过光纳米压印法而得到适合于“单分子酶测定”法的具有微细孔的生物测定用微孔薄膜。
[0166]
〈光聚合引发剂〉
[0167]
作为本实施方式中的能够光聚合的自由基聚合系树脂中包含的光聚合引发剂,没有特别限定,可以使用公知的光聚合引发剂,优选波长350nm~波长800nm的各波长处的光吸收少。光聚合引发剂因光而引发自由基反应或离子反应,优选为引发自由基反应的光聚合引发剂。作为光聚合引发剂,可列举出下述的光聚合引发剂。
[0168]
作为光聚合引发剂,可列举出具有肟酯结构的光聚合引发剂(以下也称为“肟系光聚合引发剂”)、具有α-氨基烷基苯酮结构的光聚合引发剂(以下也称为“α-氨基烷基苯酮系光聚合引发剂”)、具有α-羟基烷基苯酮结构的光聚合引发剂(以下也称为“α-羟基烷基苯酮系聚合引发剂”)、具有酰基氧化膦结构的光聚合引发剂(以下也称为“酰基氧化膦系光聚合引发剂”)、具有n-苯基甘氨酸结构的光聚合引发剂(以下也称为“n-苯基甘氨酸系光聚合引发剂”)等。
[0169]
其中,若为α-羟基烷基苯酮系聚合引发剂,则容易使固化后的波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下,波长300nm处的吸光系数为0.02μm-1
以下,成为波长300nm~800nm的各波长处的吸光系数的最大值,故而特别优选。
[0170]
作为光聚合引发剂的市售品,可列举出1-[4-(苯硫基)]-1,2-辛二酮-2-(o-苯甲酰基肟)(商品名:irgacure(注册商标)oxe-01、basf公司制)、1-[9-乙基-6-(2-甲基苯甲酰基)-9h-咔唑-3-基]乙酮-1-(o-乙酰基肟)(商品名:irgacure oxe-02、basf公司制)、2-(二甲基氨基)-2-[(4-甲基苯基)甲基]-1-[4-(4-吗啉基)苯基]-1-丁酮(商品名:omnirad(注册商标)379eg、igm resins b.v.公司制)、2-甲基-1-(4-甲基噻吩基)-2-吗啉代丙烷-1-酮(商品名:omnirad 907、igm resins b.v.公司制)、2-羟基-1-{4-[4-(2-羟基-2-甲基-丙酰基)苄基]苯基}-2-甲基丙烷-1-酮(商品名:omnirad 127、igm resins b.v.公司制)、2-苄基-2-二甲基氨基-1-(4-吗啉代苯基)-丁酮-1(商品名:omnirad 369、igm resins b.v.公司制)、2-羟基-2-甲基-1-苯基丙烷-1-酮(商品名:omnirad 1173、igm resins b.v.公司制)、1-羟基环己基苯基酮(商品名:omnirad 184、igm resins b.v.公司制)、2,2-二甲氧基-1,2-二苯基乙烷-1-酮(商品名:omnirad 651、igm resins b.v.公司制)、肟酯系的光聚合引发剂(商品名:lunar 6、dksh japan公司制)等。
[0171]
上述光聚合引发剂的含量相对于感光性树脂组合物的重量优选为0.5~10重量%,进一步优选为1.0~5重量%。若为该范围,则容易使固化后的波长350nm~800nm的各波长处的吸光系数为0.01μm-1
以下,能够得到本实施方式的生物测定用微孔薄膜。
[0172]
《生物测定用微孔薄膜的制造方法》
[0173]
本实施方式的生物测定用微孔薄膜的制造方法没有特别限定,可以选择利用光压印法自规定母模进行转印而实现的制造方法。
[0174]
母模的表面具备期望的微孔的反转形状图形,作为材质,可列举出石英玻璃、紫外线透射玻璃、蓝宝石、金刚石、聚二甲基硅氧烷等有机硅材料;氟树脂、硅、sio2、al、sic、镍、铬等,可以各自层叠并复合化。为了提高转印时的脱模性,也可以进行脱模处理。
[0175]
尤其是,通过对母模实施脱模处理,从而母模表面的自由能降低。因此,通过在将树脂层中的平均氟浓度(fb)保持得较低的状态下进行转印,从而使本实施方式所述的含氟
(甲基)丙烯酸酯向母模表面有效地偏析,用以降低由母模/感光性树脂混合物/基材构成的体系整体的能量,因此,能够增大fs/fb。因此,不仅转印时的脱模性是适合的,所得的微孔薄膜作为生物测定用基材也适合。
[0176]
另外,从对母模实施的脱模处理的耐久性的观点出发,作为脱模处理剂,优选为硅烷偶联系脱模剂。作为市售的脱模剂的例子,可列举出daikin industry公司制的optool dsx、durasurf hd1100、hd2100;住友3m公司制的novec等。
[0177]
以下,针对本实施方式的生物测定用微孔薄膜的制造方法进行说明。
[0178]
〈工序1〉
[0179]
工序1:在基材或母模上涂布感光性树脂组合物。
[0180]
作为涂布树脂组合物的方法,可列举出流延法、灌注法、旋涂法、辊涂法、棒涂法、流延法、浸涂法、模涂法、langmuir-brodgett法、喷涂法、气刀涂布法、流涂法、帘涂法等。光固化性树脂组合物的涂布厚度优选为50nm~5mm,更优选为100nm~200μm,进一步优选为100nm~100μm。
[0181]
基材大于母模时,可以将树脂组合物涂布于基材整面,也可以以仅在按压母模的范围内存在树脂组合物的方式将树脂组合物涂布于基材的一部分。另外,也可以在母模侧涂布树脂组合物。
[0182]
将树脂组合物涂布于基材后,通过预烘烤,在包含溶剂的情况下,能够促进溶剂的馏去或内部添加的含氟聚合性(甲基)丙烯酸酯的表面偏析。含氟聚合性(甲基)丙烯酸酯优选为上述记载的化学式(1)的含氟(甲基)丙烯酸酯。通过使内部添加的含氟聚合性(甲基)丙烯酸酯向表面偏析,从而在按压母模时,含氟聚合性(甲基)丙烯酸酯被有效地填充至母模的微细结构内部,不仅能够抑制母模的劣化,还能够大幅提高所得树脂层的表面氟元素浓度(fs)除以整体(bulk)的氟元素浓度(fb)而得到的值fs/fb,能够提高脱模性。温度优选为25℃~120℃,更优选为40℃~105℃,进一步优选为50℃~105℃,最优选为60℃~105℃。预烘烤时间优选为30秒~30分钟,更优选为1分钟~15分钟,进一步优选为3分钟~10分钟。
[0183]
优选实施使基材与树脂组合物的粘接性提高的处理。例如,优选对基材的要进行粘接的面实施用于与树脂组合物进行化学键合、浸透等物理键合的易粘接涂布、底漆处理、电晕处理、等离子体处理、uv/臭氧处理、高能量射线照射处理、表面粗糙化处理、多孔化处理等。
[0184]
〈工序2〉
[0185]
工序2:向基材浸透感光性树脂组合物的工序
[0186]
对基材涂布树脂组合物后,通过设置向基材浸透感光性树脂组合物的浸透工序,从而与固化后的树脂组合物的粘接性提高,故而优选。本实施方式中的浸透工序只要树脂组合物略微浸透至基材表面附近的内部即可,可列举出例如对基材涂布树脂组合物后,放置规定时间的方法。作为浸透工序的条件,温度优选为15℃~120℃,更优选为20℃~105℃,进一步优选为25℃~105℃。作为浸透工序的时间,优选为1分钟~30分钟,若为2分钟~15分钟,则感光性树脂组合物的固化后的粘接性变得良好,故而优选,若为3分钟~10分钟,则能够抑制基材界面的雾度增加,故而更优选。尤其是,作为光聚合性单体,通过将包含含有氮的光聚合性单体的感光性树脂组合物涂布于基材,并使其浸透,从而能够有效地提高
基材与树脂层的界面处的粘接力。
[0187]
〈工序3〉
[0188]
工序3:将感光性树脂组合物在基材与母模之间进行按压的工序
[0189]
优选以不混入气泡的方式将柔软性高的基材从端部轻轻地覆盖在母模上,在恒定压力下进行按压。按压时的加压压力优选超过0mpa且为10mpa以下,更优选为0.01mpa~5mpa,进一步优选为0.01mpa~1mpa。
[0190]
〈工序4〉
[0191]
工序4:通过曝光而使光固化性树脂组合物发生固化,得到固化物的工序
[0192]
母模的透光性低时,优选从基材侧进行曝光。另一方面,母模对于紫外波长的光的透射率高时,例如,在合成石英材质的情况下,优选从基材侧或母模侧中的至少一侧的面进行曝光,若从基材侧和母模侧这两面进行曝光则更为优选。为了防止由氧导致的聚合阻碍,曝光时的气氛可以设为氮气气氛下或氩气气氛下。
[0193]
作为所使用的曝光光源,优选为金属卤化物灯、高压汞灯、化学灯、uv-led。从抑制长时间曝光时的放热的观点出发,优选利用将可见波长以上的波长滤除的过滤器(包括带通滤波器)。作为累积光量,在波长365nm处优选为300mj/cm2以上,出于获得反应率高的固化物(e)的目的,优选为800mj/cm2以上,更优选为800mj/cm2~6000mj/cm2,为了防止由光导致的树脂劣化性,特别优选为800mj/cm2~3000mj/cm2。
[0194]
不取决于固化物的厚度,350nm~450nm处的总透光率优选为50%以上,在进行有效的光反应的方面,更优选为70%以上。固化物的厚度超过0nm且为50μm时,350nm~450nm处的总透光率优选为50%以上、更优选为70%以上。
[0195]
〈工序5〉
[0196]
工序5:从母模上剥离固化物的工序
[0197]
母模具有柔软性时,优选从模具面侧或基材面侧中的至少一者以恒定速度进行剥离。作为剥离方法,优选为线剥离。例如,在母模的刚性高的材质的情况下,尤其在无机材质的情况下,若从母模侧进行剥离,则由局部地进行面剥离导致的剥离面积变高,担心固化物的破损。因此,优选从具有柔软性的基材侧进行剥离。关于剥离速度,从特定方向以恒定速度、以超过0m/min且为5m/min以下的速度进行线剥离时,从能够降低固化物的破损风险的观点出发是优选的。
[0198]
另外,优选在固化后~剥离前的期间内实施加热处理。通过在该过程中实施加热处理,从而能够减少未反应基团,脱模变得容易,进而,母模的耐久性提高。温度优选为50℃~120℃,更优选为50℃~105℃,进一步优选为60℃~105℃。加热时间优选为30秒~30分钟,更优选为30秒~15分钟,进一步优选为1分钟~10分钟。
[0199]
另一方面,可以在剥离后进行加热处理。通过在剥离后进行加热处理,从而促进未反应基团的反应,故而优选。温度优选为50℃~120℃,更优选为50℃~105℃,进一步优选为60℃~105℃。加热时间优选为30秒~30分钟,更优选为30秒~15分钟,进一步优选为1分钟~10分钟。
[0200]
实施例
[0201]
以下,根据用于明确本发明效果的实施例,更详细地说明本发明。需要说明的是,本发明完全不限定于以下的实施例。
[0202]
[残膜厚度测定]
[0203]
利用扫描型电子显微镜(以下记作sem)观察,测定所制作的微孔薄膜的树脂层的厚度和孔底部的最薄壁部的厚度。首先,将试样切成适当大小后,进行常温切割,并载置于试样台。接着,对观察面涂布2nm左右的os,作为显微镜检查用试样。以下示出使用装置和显微镜检查条件。
[0204]
装置:hitachi s-5500
[0205]
加速电压:10kv
[0206]
mode:normal(常规)
[0207]
[氟元素浓度测定]
[0208]
利用x射线光电子能谱法(以下记作xps),测定树脂层的表面氟元素浓度。xps中的x射线向样品表面侵入的长度为数nm,非常浅,因此,采用xps的测定值作为树脂层表面的氟元素浓度(fs)。将微孔薄膜切成约2mm见方的小片,盖上1mm
×
2mm的切槽型掩膜,在下述条件下供于xps测定。
[0209]
xps测定条件
[0210]
使用设备:thermo fisher escalab250
[0211]
激发源:mono.alkα15kv
×
10ma
[0212]
分析尺寸:约1mm(形状为椭圆)
[0213]
读取区域
[0214]
survey scan(全面扫描):0~1100ev
[0215]
narrow scan(精密扫描):f 1s、c 1s、o 1s、n 1s
[0216]
pass energy(通能)
[0217]
survey scan(全面扫描):100ev
[0218]
narrow scan(精密扫描):20ev
[0219]
另一方面,为了测定构成微孔薄膜的树脂层的树脂中的平均氟元素浓度(fb),利用烧瓶燃烧法来分解已物理剥离的切片,接着实施离子色谱分析,由此测定树脂层中的平均氟元素浓度(fb)。
[0220]
[氮元素浓度测定]
[0221]
微孔薄膜的与主表面垂直的截面方向的氮元素浓度如下测定:利用切片机从表面平行倾斜2度~5度地制作切削面,并利用tof-sims(飞行时间型二次离子质谱分析法)对所露出的界面层进行测定。此外,为了去除来自切片机刀刃的成分污染,通过gcib溅射对切削面进行清洁。
[0222]
tof-sims测定条件
[0223]
使用设备:nano tof(ulvac-phi公司制)
[0224]
一次离子:bi
3++
[0225]
加速电压:30kv
[0226]
电流值:约0.2na(以dc计)
[0227]
冲孔:无
[0228]
分析面积:50mm
×
50mm
[0229]
累积时间:20分钟
[0230]
检测离子:负离子
[0231]
中和:电子枪
[0232]
[自身荧光特性]
[0233]
微孔薄膜的自身荧光利用下述条件进行测定,荧光量根据预先制作的标准物质的标准曲线以相应的标准物质浓度的形式来评价。
[0234]
使用设备:synergy htx读盘器(biotek公司制)
[0235]
光源:钨灯
[0236]
激发光过滤器:340nm~380nm
[0237]
荧光过滤器:440nm~480nm
[0238]
标准物质:hoechst33342(同人化学公司制)
[0239]
以0μg~0.3125μg制作标准曲线。
[0240]
[吸光系数]
[0241]
由下述式(6)求出“吸光系数”。
[0242]
吸光系数=吸光度/薄膜厚度(μm)
ꢀꢀ
式(6)
[0243]
如果是树脂层的吸光系数,则吸光度和薄膜厚度是“树脂层的吸光度和树脂层的厚度”,如果是基材的吸光系数,则吸光度和薄膜厚度是“基材的吸光度和基材的厚度”。
[0244]
进而,吸光度按照下述式(7)来计算。
[0245]
吸光度=-log(透光率)
ꢀꢀ
式(7)
[0246]
透光率可以利用一般的分光光度体系进行测定来求出,本实验中,使用分光光度计uv-2500(岛津制作所公司制)。
[0247]
[实施例1]
[0248]
φ4μm、高度4μm的圆柱状凸部以6μm的间距进行了三方排列的镍制平板状模具使用harves公司制的durasurf(注册商标)2101z实施脱模处理。
[0249]
将n-乙烯基吡咯烷酮、氨基甲酸酯低聚物(sartomer公司制cn991)和omnirad184(igm resins b.v.公司制)以重量份计为50:50:5的比例进行混合,滴加在模具的微细凹凸结构面上。
[0250]
接着,在用事先实施了表面等离子体处理的环状烯烃树脂薄膜(jsr公司制arton(注册商标)、t188μm)夹住混合液的同时,使用手动辊进行延展。从薄膜面侧进行uv曝光后,进行固化,同与环状烯烃树脂薄膜进行了一体化的树脂层一起从模具上剥离,得到树脂层与基材经一体化的生物测定用微孔薄膜。
[0251]
在所得微孔薄膜表面,φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,树脂层的厚度包括孔深度在内为4.2μm且均匀,孔底部的最薄壁部的厚度=0.2μm,薄膜总厚为192μm且均匀。由于薄且均匀,因此,在“单分子酶测定”法中,容易利用调温板进行调温,调温不均受到抑制,预测会抑制边缘效应。
[0252]
环状烯烃树脂薄膜和所得的生物测定用微孔薄膜的树脂层的350nm~800nm的吸光系数在350nm处达到最大,分别为0.001μm-1
、0.005μm-1
。
[0253]
另外,微孔薄膜的树脂层的300nm~800nm的吸光系数在300nm处达到最大,为0.015μm-1
。
[0254]
另外,自身荧光特性相当于0.005μg的hoechst33342。
[0255]
[实施例2]
[0256]
与实施例1相同的平板状模具使用harves公司制的durasurf 2101z,实施脱模处理。
[0257]
将含氟丙烯酸酯(daikin industry公司制optool dac hp、固体成分为20%)、三羟甲基丙烷三丙烯酸酯(东亚合成公司制m350)、氨基甲酸酯低聚物(sartomer公司制cn991)和omnirad184(igm resins b.v.公司制)以重量份计为17:50:50:5的比例进行混合,并滴加在模具的微细凹凸结构面上。
[0258]
接着,在用事先实施了表面等离子体处理的环状烯烃树脂薄膜(jsr公司制arton(注册商标)、t188μm)夹住混合液的同时,使用手动辊进行延展。从薄膜面侧进行uv曝光后,进行固化,同与环状烯烃树脂薄膜进行了一体化的树脂层一起从模具上剥离,得到树脂层与基材经一体化的生物测定用微孔薄膜。
[0259]
在所得微孔薄膜表面,φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,树脂层的厚度包括孔深度在内为4.2μm且均匀,孔底部的最薄壁部的厚度=0.2μm,薄膜总厚为192μm且均匀。由于薄且均匀,因此,在“单分子酶测定”法中,容易利用调温板进行调温,调温不均受到抑制,预测会抑制边缘效应。
[0260]
环状烯烃树脂薄膜和所得的生物测定用微孔薄膜的树脂层的350nm~800nm的吸光系数在350nm处达到最大,分别为0.001μm-1
、0.008μm-1
。
[0261]
另外,微孔薄膜的树脂层的300nm~800nm的吸光系数在300nm处达到最大,为0.02μm-1
。
[0262]
另外,自身荧光特性相当于0.006μg的hoechst33342。
[0263]
进而,用xps测定所得微孔薄膜表面的结果,表面的氟元素浓度(fs)与树脂中的平均氟元素浓度(fb)之比fs/fb为48。表面拒液性高,适合作为“单分子酶测定”法中的基材。
[0264]
[实施例3]
[0265]
与实施例1相同的平板状模具使用harves公司制的durasurf 2101z,实施脱模处理。
[0266]
将n-乙烯基吡咯烷酮、氨基甲酸酯低聚物(sartomer公司制cn991)、三羟甲基丙烷三丙烯酸酯(东亚合成公司制m350)和omnirad184(igm resins b.v.公司制)以重量份计为33:20:47:5的比例进行混合。
[0267]
接着,在事先实施了表面等离子体处理的环状烯烃树脂薄膜(日本zeon公司制、zeonor film(注册商标)、t188μm)上滴加感光性树脂混合物,用旋涂机均匀涂开。其后,静置5分钟,作为向基材浸透感光性树脂混合物的浸透工序。
[0268]
接着,使用与实施例1同样的表面具有微细凹凸结构的模具,在模具的微细凹凸结构面上滴加感光性树脂混合物。
[0269]
接着,在用事先实施了表面等离子体处理的环状烯烃树脂薄膜(日本zeon公司制zeonor film zf-14、t188μm)夹住混合液的同时,使用手动辊进行延展。从薄膜面侧进行uv曝光后,进行固化,同与环状烯烃树脂薄膜进行了一体化的树脂层一起从模具上剥离,得到树脂层与基材经一体化的生物测定用微孔薄膜。
[0270]
在所得微孔薄膜表面,φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,树脂层的厚度包括孔深度在内为4.2μm且均匀,孔底部的最薄壁部的厚度=0.2μm,薄膜总
厚为192μm且均匀。由于薄且均匀,因此,在“单分子酶测定”法中,容易利用调温板进行调温,调温不均受到抑制,预测会抑制边缘效应。
[0271]
环状烯烃树脂薄膜与所得生物测定用微孔薄膜的树脂层的350nm~800nm的吸光系数在350nm处达到最大,分别为0.0002μm-1
、0.003μm-1
。
[0272]
另外,微孔薄膜的树脂层的300nm~800nm的吸光系数在300nm处达到最大,为0.005μm-1
。
[0273]
另外,自身荧光特性相当于0.0025μg的hoechst33342,显示低自身荧光,适合作为生物测定用微孔薄膜。进而,具有微细凹凸结构的表面树脂与基材薄膜的粘接性良好。
[0274]
另外,测定所得生物测定用微孔薄膜的氮元素浓度的与主表面垂直的方向的氮元素浓度(图4)。图4中,相对于自与基材的界面起的距离而示出将微孔薄膜的树脂层的氮元素浓度设为100%时的基材中的氮元素浓度比。
[0275]
用作基材的环状环烯烃树脂薄膜原本几乎不含氮元素,基材中的平均氮元素浓度(ns)约为0。但是,氮元素浸透至环状环烯烃树脂薄膜的表面,将具有微细凹凸结构的表面的光固化树脂中的氮元素浓度(nf)设为100%时,从光固化树脂层与环状烯烃树脂薄膜的界面起朝向基材内部为532nm的位置处的氮元素浓度(ni)为5%。由此可知:其满足nf》ni》ns。
[0276]
[实施例4]
[0277]
使用与实施例1相同的平板状模具,将n-乙烯基吡咯烷酮、氨基甲酸酯低聚物(sartomer公司制cn991)、三羟甲基丙烷三丙烯酸酯(东亚合成公司制m350)和omnirad184(igm resins b.v.公司制)以重量份计为33:10:57:5的比例进行混合,除此之外,利用与实施例3相同的方法,将zeonor film作为基材,得到生物测定用微孔薄膜。
[0278]
在所得微孔薄膜表面,φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,树脂层的厚度包括孔深度在内为4.2μm且均匀,孔底部的最薄部的厚度=0.1μm,薄膜总厚为192μm且均匀。由于薄且均匀,因此,在“单分子酶测定”法中,容易利用调温板进行调温,调温不均受到抑制,预测会抑制边缘效应。
[0279]
环状烯烃树脂薄膜与所得生物测定用微孔薄膜的树脂层的350nm~800nm的吸光系数在350nm处达到最大,分别为0.0002μm-1
、0.0004μm-1
。
[0280]
另外,微孔薄膜的树脂层的300nm~800nm的吸光系数在300nm处达到最大,为0.0007μm-1
。
[0281]
另外,自身荧光特性相当于0.001μg的hoechst33342,显示低自身荧光,适合作为生物测定用微孔薄膜。进而,具有微细凹凸结构的表面树脂与基材薄膜的粘接性良好。
[0282]
另外,测定所得生物测定用微孔薄膜的氮元素浓度的与主表面垂直的方向的氮元素浓度(图4)。图4中,相对于自与基材的界面起的距离而示出将微孔薄膜的树脂层的氮元素浓度设为100%时的基材中的氮元素浓度比。
[0283]
用作基材的环状环烯烃树脂薄膜原本几乎不含氮元素,基材中的平均氮元素浓度(ns)约为0。但是,氮元素浸透至环状环烯烃树脂薄膜的表面,将具有微细凹凸结构的表面的光固化树脂中的氮元素浓度(nf)设为100%时,从光固化树脂与环状烯烃树脂薄膜的界面起朝向基材内部为1188nm的位置处的氮元素浓度(ni)为5%。由此可知:其满足nf》ni》ns。
[0284]
[比较例1]
[0285]
与实施例1相同的平板状模具使用harves公司制的durasurf 2101z实施脱模处理。
[0286]
将含氟丙烯酸酯(daikin industry公司制optool(注册商标)dac hp、固体成分为20%)、三羟甲基丙烷三丙烯酸酯(东亚合成公司制m350)、氨基甲酸酯低聚物(sartomer公司制cn991)、omnirad184(igm resins b.v.公司制)和omnirad369(igm resins b.v.公司制)以重量份计为17:50:50:5:2的比例进行混合,并滴加在模具的微细凹凸结构面上。
[0287]
接着,在用pet薄膜(东洋纺公司制cosmoshine a4100、t188μm)夹住混合液的同时,使用手动辊进行延展。从薄膜面侧进行uv曝光后,将模具与薄膜进行剥离,得到生物测定用微孔薄膜。
[0288]
在所得微孔薄膜表面,φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,树脂层的厚度包括孔深度在内为4.2μm且均匀,孔底部的最薄壁部的厚度=0.2μm,薄膜总厚为192μm且均匀。
[0289]
pet薄膜和所得生物测定用微孔薄膜的树脂层的350nm~800nm的吸光系数在350nm处达到最大,分别为0.002μm-1
、0.07μm-1
。
[0290]
另外,300nm的光不会透过,无法测定吸光系数。
[0291]
另外,自身荧光特性相当于0.22μg的hoechst33342,自身荧光特性强,因此无法与标记物的荧光进行分离,因此无法检测出标记物,不适合于“单分子酶测定”法。
[0292]
[比较例2]
[0293]
准备赋形出与实施例1相同的凹凸图形的注射成型模具,通过注射成型,使用cop树脂(jsr公司制arton f4520),形成孔板。与实施例1同样地,注射树脂层的表面图形如下:表面φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,薄膜总厚厚达400μm。
[0294]
由于较厚,因此,在“单分子酶测定”法中,难以利用调温板进行调温,预测会发生边缘效应。
[0295]
另外,自身荧光特性相当于0.01μg的hoechst33342。
[0296]
[比较例3]
[0297]
准备与比较例2相同的注射成型模具,通过注射成型,使用cop树脂(日本zeon公司制zeonor 1020r),形成孔板。与实施例1同样地,表面图形如下:表面φ4μm、深度4μm的圆筒状孔以6μm的间距进行了三方排列,薄膜总厚厚达300μm。
[0298]
由于较厚,因此,在“单分子酶测定”法中,难以利用调温板进行调温,预测会发生边缘效应。
[0299]
另外,自身荧光特性相当于0.004μg的hoechst33342。
[0300]
以下,表1中,针对实施例1~实施例4和比较例1~比较例3的材质、吸光系数和效果等进行了总结。
[0301]
如表1所示那样,实施例1、实施例2、实施例3和实施例4中,树脂层的波长350nm~800m的各波长处的吸光系数均为0.01μm-1
以下。需要说明的是,构成样品中使用的基材的树脂在波长350nm~800m的各波长处的吸光系数均为0.01μm-1
以下,300nm的吸光系数为0.02μm-1
以下。并且,在任意实施例中,均能够获得等于或低于根据比较例2、比较例3的以往的生物测定板的低自身荧光特性。
[0302]
[表1]
[0303][0304]
需要说明的是,本发明不限定于上述实施方式,能够各种变更来实施。上述实施方
式中,针对附图中图示的大小、形状等,不限定于此,可以在发挥本发明效果的范围内适当变更。
[0305]
根据本实施方式,可提供一种生物测定用微孔薄膜,其是具有与以往的基于注射成型的生物测定板相比更低的自身荧光特性、能够以低成本进行制造、容易实现孔的调温、能够抑制边缘效应的在“单分子酶测定”法等中应用的生物测定基材。进而,可提供能够形成自身荧光特性低、容易检测出标记物的生物测定用微孔薄膜的感光性树脂组合物以及使用前述感光性树脂组合物的生物测定用微孔薄膜的制造方法,可简便地应用于工业实用上的用途。
[0306]
本技术基于2019年7月2日申请的日本特愿2019-123981。将其内容全部援引至此。
