一种快速鉴定苹果炭疽叶枯病的snp分子标记
技术领域:
1.本发明属于苹果分子育种技术领域,具体涉及一种利用kasp分型技术快速鉴定苹果炭疽叶枯病的snp分子标记,能够有效的对苹果杂种实生苗进行早期抗病筛选,提高苹果抗病育种的效率。
背景技术:
2.苹果gls是近年来影响我国苹果产业发展比较严重的一类病害,主要引起
‘
嘎拉’和
‘
金冠’等苹果主栽品种的叶片干枯脱落和造成果实坏死性病斑,造成苹果品质降低,并影响次年生产(王冰等,2014)。苹果炭疽病最初于1970年在美国发生,但因病害不严重并未引起人们重视(taylor et al.,1971)。1988年,在巴西南部的
‘
嘎拉’苹果栽培园gls大面积爆发,成为造成巴西苹果产业严重经济损失的主要病害。经leite等人研究鉴定,将该病命名为 glomerella leaf spot(leite et al.,1988),在我国被称为苹果炭疽叶枯病。
3.因此,选育抗炭疽叶枯病品种势在必行,利用传统育种结合分子标记辅助选择育种是一条有效手段。
4.分子标记辅助选择育种(molecular marker-assisted selection,mas)是利用与目标性状紧密连锁的分子标记直接对表型进行选择。snp(single nucleotide polymorphism)即单核苷酸多态性,是两个dna序列中的某个位点由于单个核苷酸的变化而引起的多态性。snp标记的优点在于数量多,分布广,相对稳定,通过基因分型,可以在早期(苗期)快速鉴定抗病品种和感病品种。与通过表现型间接对基因型进行选择的传统育种方法相比,mas育种能有效结合基因型与表型鉴定结果,避免选育过程中的盲目性和不可预测性,从而显著提高选择的准确性和育种效率。
5.kasp(kompetitive allele specific pcr),即竞争性等位基因特异性pcr,基于引物末端碱基的特异匹配对指定的snps(single nucleotide polymorphisms,单核苷酸多态性)及 indels(insertions and deletions,插入和缺失)进行双等位基因判定。因kasp技术对检测样本纯度及浓度(1-10ng dna即可加入反应)要求不高,且具有高准确度、灵活性及低成本的特性。具体表现有支持低、中、高通量的样本研究,无需合成昂贵的特异性荧光标记引物或探针。 kasp技术已被广泛应用于农业方向和医学方面,如动植物的品种改良,疾病筛查及预测、个体化用药及预后等。例如中国专利cn201510807650.1公开了一种基于kasp技术开发的用于棉花杂交种鉴定的核心snp标记,这些snp标记分布于棉花四倍体基因组26条染色体上,每条染色体各1个snp标记,共26个snp标记,基于这套核心snp标记,可实现对棉花杂交种进行高通量的snp分型检测;中国专利cn201710297282.x公开了一套基于kasp 技术开发的用于水稻产量基因分型的引物组合,所述水稻产量基因包括gn1a、nal1、ghd7、 hd1、ghd7.1和ghd8,所述引物组合的序列分别如seq id no:1-18所示,利用本发明提供的成套kasp功能标记及其引物组合能够快速检测水稻种质中产量基因功能等位基因的组合方式,检测结果准确可靠,操作简单,成本低,能够实现水稻育种材料重要产量功能基因的检测,为水稻高产新品种选育、改良提供科学指导;中国专利cn201810030833.0
公开了一组基于kasp技术开发的用于甘蓝杂交种鉴定的核心snp标记及其应用,所述核心snp标记包含bol01~bol50 snp标记中的任意一种或更多种,或全部;基于所述核心snp标记,可实现对甘蓝杂交种的高通量snp分型检测。在现有技术中尚未发现涉及本技术的快速鉴定方法和使用的分子标记,所以使用本发明可以在苹果育种过程中对杂种后代在苗期进行早期抗病筛选,进而早期淘汰感病后代植株,大大提高苹果抗病育种效率。
技术实现要素:
6.本发明的目的在于克服现有技术存在的缺点,寻求提供一种利用kasp分型技术快速鉴定苹果炭疽叶枯病的snp分子标记,能够有效的对苹果杂种实生苗进行早期抗病筛选,淘汰感病后代植株,达到提高苹果抗病育种效率的目的。
7.为了实现上述发明目的,本发明提供一种快速鉴定苹果炭疽叶枯病的snp分子标记,所述snp分子突变位点位于15号染色体7309212bp处。
8.所述snp突变位点的突变碱基和氨基酸为:a突变成t;异亮氨酸变为苯丙氨酸。
9.所述snp突变位点的类型为:感病树体碱基为杂合t/a和纯合t/t,抗病树体的碱基为纯合a/a。
10.本发明还提供快速鉴定苹果炭疽叶枯病的snp分子标记的引物,用于kasp反应的snp 位点的特异性引物包括引物a1、引物a2和引物c,3个引物的脱氧核糖核苷酸序列为:
11.引物a1:gaaggtgaccaagttcatgctcgaactccaatttaataagtgatgcaa (seq id no.1);
12.引物a2:gaaggtcggagtcaacggattcgaactccaatttaataagtgatgcat (seq id no.2);
13.引物c:acttctaaagaagatatagacccgagatc(seq id no.3);
14.引物终浓度为10μm,将引物a1:引物a2:引物c按照体积比12:12:30的比例混合加入反应体系。
15.本发明所述的kasp反应体系,包括5μl 10ng/μl dna样品、5μl 2
×
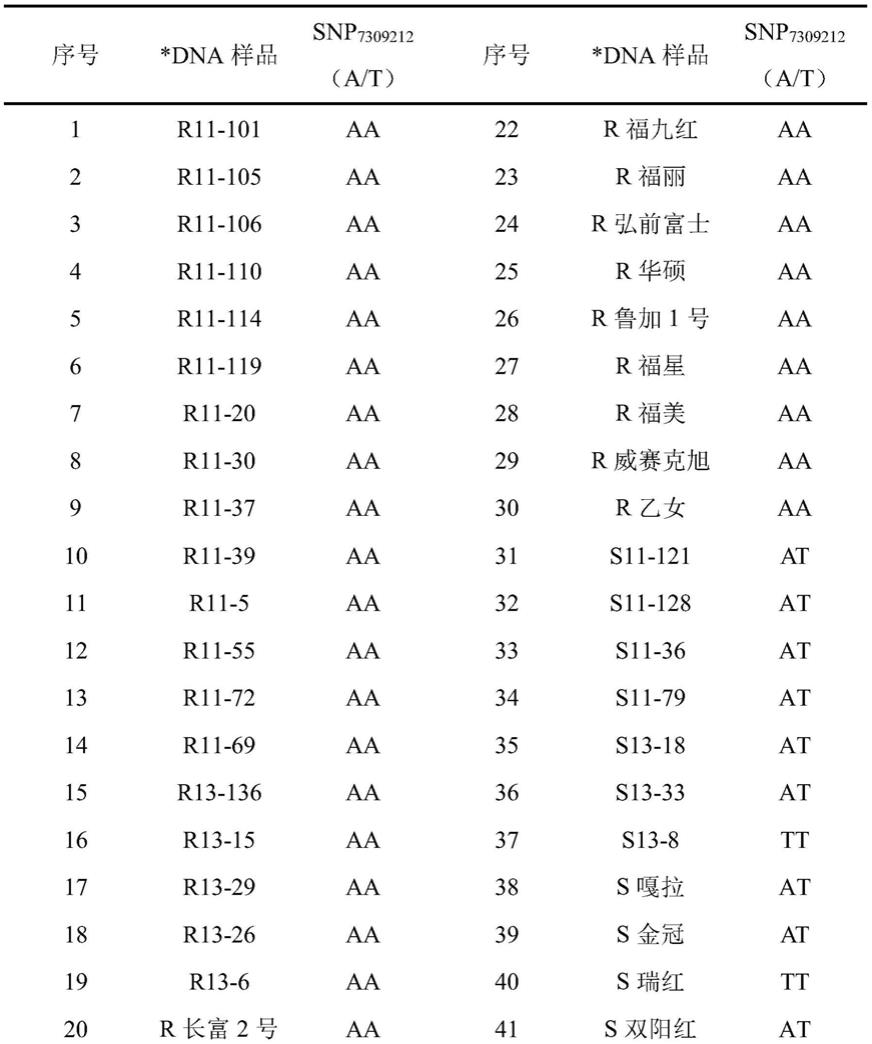
master mix和0.14μl 混合引物,在每个96孔板上设置无模板对照;kasp反应程序为:预变性阶段94℃持续15 min;变性阶段94℃持续20s,然后复性延伸阶段61℃60s 10个循环,每个循环降低0.6℃;最后变性阶段94℃20s,55℃60s,26个循环。
16.本发明与现有技术相比,通过使用kasp技术可以简单快速的检测snp位点的分型情况,进而鉴定苹果的抗病和易感病植株,用于苹果育种过程中杂种实生苗的早期抗病鉴定筛选,该发明成本低,鉴定错误率低,鉴定效率高,为抗病苹果选育提供了一种快速有效的方法,将大大缩短苹果的育种年限、提高育种效率。
附图说明:
17.图1为本发明实施例2涉及的kasp分型技术鉴定感病和抗病植株在snp
7309212
位点的基因型分布图。
18.图2为本发明实施例3涉及的不同苹果品种(系)接种c.fructicola的抗病表型结果示意图。
19.图3为本发明实施例3涉及的不同苹果品种(系)接种c.fructicola后叶片菌斑直
径结果示意图。
具体实施方式:
20.下面通过具体实施例并结合附图对本发明作进一步说明。
21.实施例1:
22.本实施例涉及用于快速鉴定苹果炭疽叶枯病的snp分子位点的筛选试验。
23.以2009年种植在青岛农业大学胶州育种基地的
‘
金冠’和
‘
富士’及
‘
金冠
’ב
富士’苹果的f1代群体中20株极端抗和20株极端感炭疽菌叶枯病的单株为材料,进行全基因组重测序(whole genome re-sequencing,wgr),使用苹果参考基因组gddh13 v 1.进行比对,对获得的变异位点进行过滤筛选,利用过滤得到的snp标记在抗病和感病群体间进行全基因组关联分析(gwas),在苹果基因组的17条染色体上,其中第15号染色体表现出最强烈的关联信号,结合已公开的申请人前期构建的遗传图谱,锁定了苹果基因组第15号染色体7309212bp 处snp突变位点。snp
7309212
突变位点的突变碱基和氨基酸为:a突变成t;异亮氨酸变为苯丙氨酸。突变位点的类型为:感病树体碱基为杂合t/a和纯合t/t,抗病树体的碱基为纯合 a/a。
24.实施例2:
25.本实施例涉及利用kompetitive allele specific pcr(kasp)分型技术快速鉴定不同苹果品种(系)感病和抗病植株,具体步骤如下:
26.(1)选取试验材料:
27.以课题组2009年定植在青岛农业大学胶州育种基地的
‘
富士’(抗病)和
‘
金冠’(感病) 杂交f1后代分离群体中26个单株及生产栽培16个品种(表1)合计共42个品种(系)为鉴定材料。
28.(2)dna提取:
29.利用植物基因组dna提取试剂盒(天根)提取待鉴定苹果叶片样品dna。通过1%琼脂糖凝胶电泳和紫外成像仪检测dna样品完整性。dna浓度要求10~30ng/μl, a260/280=1.8~2.0,a260/230=1.8~2.0。
30.(3)利用kasp技术snp
7309212
位点进行基因分型:
31.利用申请人在先通过gwas筛选得到的snp分子突变位点进行特异引物设计,进而快速鉴定炭疽叶枯病抗病和感病植株;该snp突变位点位于苹果基因组第15号染色体 7309212bp处;snp
7309212
突变位点的突变碱基和氨基酸为:a突变成t;异亮氨酸变为苯丙氨酸。突变位点的类型为:感病树体碱基为杂合t/a和纯合t/t,抗病树体的碱基为纯合a/a。
32.(4)确定引物序列:针对snp
7309212
突变位点,利用primer 5软件设计了3条特异性引物用于pcr反应,引物a1的5’端加上gaaggtgaccaagttcatgct序列接头,引物a2 的5’端加上gaaggtcggagtcaacggatt序列接头,所用引物序列为:
33.引物a1:gaaggtgaccaagttcatgctcgaactccaatttaataagtgatgcaa (seq id no.1);
34.引物a2:gaaggtcggagtcaacggattcgaactccaatttaataagtgatgcat (seq id no.2);
35.引物c:acttctaaagaagatatagacccgagatc(seq id no.3)。
36.snp
7309212
位点的特异性引物所用引物终浓度为10μm,将引物a1:引物a2:引物c按照体积比12:12:30的比例混合加入反应体系。
37.(5)确定反应体系:按照lgc公司kompetitive allele specific pcr(kasp)指南 (www.lgcgenomics.com)进行操作确定kasp反应体系:kasp反应体积为10.14μl,包括 5μl 10ng/μl dna样品、5μl 2
×
master mix和0.14μl混合引物,注意在每个96孔板上设置无模板对照(no-template control,ntc)。
38.(6)确定kasp反应程序为:预变性阶段94℃持续15min;变性阶段94℃持续20s,然后复性延伸(61℃~55℃)阶段持续60s,设置10个循环,每循环降低0.6℃;最后变性阶段(94℃,20s,55℃,60s)持续26个循环。使用kraken软件分析结果数据。
39.(7)基因分型分析:利用kasp技术对42个苹果样本的snp
7309212
位点进行基因分型分析,结果如图1和表1所示。图1中每个圆点代表每个待测样品。结果显示,snp
7309212
位点存在3种基因型。在没有dna模板的情况下,ntc(黑色圆点)作为对照的信号非常弱,说明ntc没有与其他基因型聚在一起。30个基因型为纯合aa(蓝色圆点)的抗病植株聚在一起,2个基因型为tt(红色圆点)的感病材料和10个基因型为ta(绿色圆点)感病材料聚在一起(图1,表1)。蓝色圆点的待测样品均为抗病苹果材料,红色圆点和绿色圆点的待测样品来自感病苹果材料。由分型结果可以看出,snp
7309212
位点在苹果抗感病材料中的分型效果明显,感病和抗病植株均可以明显区分开来,鉴定效率可达100%。
40.表1snp
7309212
位点在
‘
富士’和
‘
金冠’杂交后代f1群体及栽培品种的基因型分布
[0041][0042][0043]
*dna样品名称前面加“r”或“s”表示该样品材料是“抗病”或“感病”材料,r或s之后的数字为品系代号。
[0044]
实施例3:
[0045]
本实施例涉及利用室内叶片接种鉴定法检测kasp分型技术对不同苹果品种(系)炭疽叶枯病抗性鉴定的准确性。
[0046]
(1)试验材料和方法
[0047]
本实施例以2009年种植在青岛农业大学胶州育种基地的
‘
富士
’ב
金冠’和
‘
金冠
’ב
富士’的杂种后代f1群体两组杂种后代分别26个和10个以及生产栽培品种21个,共计57个品种(系) 为试材,进行接种炭疽菌c.fructicola,鉴定不同苹果品种(系)对炭疽叶
枯病的感病及抗病情况。
[0048]
炭疽菌c.fructicola菌种的培养及悬浮孢子液的配制:
[0049]
将收集到的
‘
嘎拉’苹果炭疽菌叶枯病病叶在25℃室内保湿培养3d,从病叶上产生的分生孢子中,挑取单孢,在pda培养基中培养,获得纯培养菌株,并在5℃冰箱中保存。接种前将保存的菌种转接到pda培养基中,25℃活化,待菌落长满培养皿的2/3时,用接种环刮除气生菌丝,25℃继续培养2~3d,直至培养基中长出橘黄色分生孢子角。
[0050]
用接种环挑取适量分生孢子角,放入盛有无菌蒸馏水的烧杯中摇匀,用血球计数板检测孢子悬浮液浓度,调至104个
·
ml-1
备用。孢子悬浮液现配现用,放置时间不超过1h。
[0051]
分生孢子萌发力测定:
[0052]
在洁净的单凹载玻片上滴一滴苹果炭疽病菌孢子悬浮液,然后盖上盖玻片,放入底面盛有少许水的培养皿中,盖上皿盖,放入25℃培养箱中培养12小时。显微镜下观察孢子的萌发力。孢子平均萌发力在20%以上均为可用。
[0053]
离体接种鉴定方法如下:从供试苹果树上剪取一年生健壮的新梢,每个材料取4个枝条 (2个用于接种鉴定,2个用作对照),剪除枝条两端,保留顶部4个完全展开的叶片。用 0.6%的次氯酸钠对叶片表面消毒,然后用无菌水冲洗,沥干,用小型喷雾器将摇匀后的分生孢子悬浮液均匀喷洒到叶片正反两面,至叶片刚刚开始流水为止。将接种及喷有无菌蒸馏水的枝条(对照)均匀分插到两个孔穴盘上,置于装有适量蒸馏水的泡沫箱内,加盖密封保湿,置于25℃恒温培养箱内暗培养。4天后进行抗性鉴定和数据记录,将叶片上无病斑的定为“抗病”,记为(r),把有病斑的定为“感病”,记为(s)。卡方检验采用spss13.0软件进行分析。
[0054]
(2)试验结果
[0055]
叶片发病结果见表2、图2和图3。采用十字交叉法对叶片病斑面积的统计分析,按照苹果种质资源的抗病性划分标准(吴建圆等,2017)。
[0056]
从叶片离体接种鉴定的结果看,利用kasp分型技术鉴定结果与室内叶片接种病原菌的结果完全一致,证明kasp分型技术鉴定苹果炭疽叶枯病抗性的方法是有效的。
[0057]
表2叶片离体接种c.fructicola后不同苹果品种(系)抗性统计
[0058]
[0059][0060]
[0061]
实施例4:
[0062]
本实施例涉及kasp分型技术的对照方法:snp突变位点的普通pcr扩增方法鉴定不同苹果品种(系)炭疽叶枯病抗性。
[0063]
为了比较kasp分型技术鉴定炭疽叶枯病抗性的效率和准确性,采取snp
7309212
突变位点的pcr扩增方法鉴定不同苹果品种(系)炭疽叶枯病抗性。
[0064]
(1)试验材料和方法
[0065]
本实施例以2009年栽植在青岛农业大学胶州育种基地的
‘
富士
’ב
金冠’和
‘
金冠
’ב
富士’的杂种后代f1群体分别21和13个以及生产栽培品种21,共计55个品种(系)为试材,提取叶片dna为模板,采用自主设计的特异引物(snp-f:agattgatactcagagactg(seqid no.4);snp-r:caatgaaggtccaggaagaa(seq id no.5))作为反应引物,设置反应体系为50μl的pcr扩增程序。反应体系包括25μl accurate taq enzyme、2μl模板、各2μl snp-f/r引物和19μl ddh2o。样品混匀放入pcr仪进行扩增,扩增程序为:预变性 95℃持续5min;变性(95℃,30s)、退火(55℃,30s)和延伸(72℃,30s)阶段循环次数为35;最后72℃,10min,4℃,保存。pcr结束后通过1%琼脂糖凝胶电泳检查目的条带的完整性,选择条带完好的反应液送至上海生工生物有限公司测序,最后比较snp
7309212
测序结果和峰图。
[0066]
(2)试验结果
[0067]
经pcr共获得55个不同苹果抗病性样本的snp
7309212
测序结果,如表3所示。表3结果显示,55个苹果品种(系)中,有37个样品的基因型为aa(突变位点处为单峰,测序碱基结果为a,判定基因型为纯合aa),18个样品在基因型为at(突变位点处为双峰,测序碱基结果为a和t,判定基因型为杂合at),根据申请人前期的研究结果,基因型为aa是抗病品种(系),基因型为at是感病材料。根据叶片接种实验以及田间观察,55个样品中有3个出现错误,即扩增的基因型与实际品种抗感病结果不符,3个分别为鲁加1号为抗病品种,基因型应该为aa,本方法扩增的基因型为at;13-26为抗病品种,基因型应该为aa,本方法扩增的基因型为at;双阳红为感病品种,基因型应该为at,本方法扩增的基因型为 aa。
[0068]
从以上结果可以看出,使用snp突变位点的pcr扩增方法鉴定不同苹果品种(系)炭疽叶枯病抗性,55个样品中有3个出现错误,鉴定准确度为94.5%,鉴定准确度不及kasp 分型技术。
[0069]
表3不同苹果品种(系)snp
7309212
突变位点的基因型:
[0070]
[0071]
[0072][0073]
注:测序峰图突变位点处为单峰,测序碱基结果为a,判定基因型为纯合aa;测序峰图突变位点处为双峰,测序碱基结果为a和t,判定基因型为杂合at。
[0074]
本实施例的应用结果说明,使用该技术可以对苹果杂种苗进行早期苹果炭疽叶枯病抗性快速鉴定,鉴定速度快,鉴定准确性高,大大节省育种时间,提高育种效率,应用环境友好。
