1.本发明属于药物化学技术领域,特别是涉及到贝母素乙衍生物的化学结构及合成方法和应用。
背景技术:
2.肝癌是指来源于肝细胞和肝胆管细胞的恶性肿瘤,是我国常见的恶性肿瘤。肝癌的致病因素有很多,如乙肝病毒、丙肝病毒,还有酒精和药物因素引起的肝硬化,然后肝硬化逐步转变为肝癌。
3.原发性支气管肺癌简称肺癌,英文名lung cancer,是指原发于气管、支气管和肺的恶性肿瘤。肺癌为支气管源性癌,包括鳞癌、腺癌、小细胞癌和大细胞癌几种主要类型。因绝大多数起源于支气管黏膜上皮,源于支气管腺体或肺泡上皮细胞者较少。肺癌的发病率和死亡率正在迅速上升,而且是世界性的趋势。
4.贝母素乙是平贝母的主要有效化合物之一,具有抗炎、镇咳、镇静、抑制结直肠癌细胞的增殖和抗肺癌等作用。贝母素乙属于生物碱类化合物,易溶于有机溶剂,难溶于水,生物利用度低等特点。因此,需要通过改变贝母素乙的结构来提高活性的目的。
技术实现要素:
5.本发明所要解决的技术问题是:提供贝母素乙衍生物及其制备方法和应用,通过改变贝母素乙的结构获得贝母素乙衍生物,其抗肿瘤功效优于贝母素乙。
6.贝母素乙衍生物,其特征是:其结构式为
[0007][0008]
其中,a环为含取代基六元环,r为不同类型的取代基。
[0009]
所述贝母素乙衍生物包括以下a~j十种结构式,
[0010]
[0011][0012]
所述r基团为r构型或者s构型。
[0013]
所述r和r2选自如下基团,氢、氟、烷基、醛基、硝基、氨基、含氟烷基、巯基、烷氧基、苄氧基。
[0014]
所述r和r2的取代基为羟基、烷氧基羰基、芳烷氧基羰基、氨基羰基、二烷基磷酰基、二芳基磷酰基、酰基。
[0015]
贝母素乙衍生物的制备方法,其特征是:制备所述的贝母素乙衍生物,先将有机酸和4-二甲氨基吡啶dmap溶于有机溶剂中,室温静置10min后,加入贝母乙素,最后加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐edc
·
hcl,置于室温条件下反应4h~8h,反应结束后,蒸除溶剂,再经硅胶柱层析纯化得到贝母乙素衍生物。
[0016]
所述有机溶剂为二氯甲烷。
[0017]
所述有机酸为氨基酸衍生物,包括3-呋喃甲酸、2-萘甲酸、3-吲哚乙酸、boc-缬氨酸、boc-亮氨酸、boc-色氨酸、boc-甘氨酸、boc-异亮氨酸、boc-苯丙氨酸、boc-丙氨酸。
[0018]
所述反应物的质量之比为,贝母乙素:有机酸:4-二甲氨基吡啶dmap:1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐edc
·
hcl=1:1.5:1.5:1.5。
[0019]
贝母素乙衍生物的应用,其特征是:应用权利要求1的贝母素乙衍生物抑制肝癌细胞hepg2和a549肺癌细胞的生长。
[0020]
通过上述设计方案,本发明可以带来如下有益效果:本发明中的10种贝母素乙衍生物为首次获得,且其制备方法具有简单,安全,转化率高,副产物少等优点。此外本发明通过体外细胞活性实验发现大部分衍生物具有良好的抑制癌细胞生长的作用。其中衍生物b
对肝癌细胞作用较强。衍生物c对肺癌细胞作用较强。说明具有良好的发展前景,为以后的研究奠定了理论基础。
附图说明
[0021]
以下结合附图和具体实施方式对本发明作进一步的说明:
[0022]
图1为本发明贝母素乙衍生物a的
13
c-nmr谱。
[0023]
图2为本发明贝母素乙衍生物a的1h-nmr谱。
[0024]
图3为本发明贝母素乙衍生物b的
13
c-nmr谱。
[0025]
图4为本发明贝母素乙衍生物b的1h-nmr谱。
[0026]
图5为本发明贝母素乙衍生物c的
13
c-nmr谱。
[0027]
图6为本发明贝母素乙衍生物c的1h-nmr谱。
[0028]
图7为本发明贝母素乙衍生物d的
13
c-nmr谱。
[0029]
图8为本发明贝母素乙衍生物d的1h-nmr谱。
[0030]
图9为本发明贝母素乙衍生物e的
13
c-nmr谱。
[0031]
图10为本发明贝母素乙衍生物e的1h-nmr谱。
[0032]
图11为本发明贝母素乙衍生物f的
13
c-nmr谱。
[0033]
图12为本发明贝母素乙衍生物f的1h-nmr谱。
[0034]
图13为本发明贝母素乙衍生物g的
13
c-nmr谱。
[0035]
图14为本发明贝母素乙衍生物g的1h-nmr谱。
[0036]
图15为本发明贝母素乙衍生物h的
13
c-nmr谱。
[0037]
图16为本发明贝母素乙衍生物h的1h-nmr谱。
[0038]
图17为本发明贝母素乙衍生物i的
13
c-nmr谱。
[0039]
图18为本发明贝母素乙衍生物i的1h-nmr谱。
[0040]
图19为本发明贝母素乙衍生物j的
13
c-nmr谱。
[0041]
图20为本发明贝母素乙衍生物j的1h-nmr谱。
具体实施方式
[0042]
以下通过该类若干化合物制备实例的实施方式和附图对本发明的上述内容作进一步的详细说明,但不应将此理解为本发明上述主题的范围仅限于下述的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
[0043]
实施例一、贝母素乙衍生物a的
13
c-nmr谱和1h-nmr谱,如图1和图2所示,
[0044][0045]
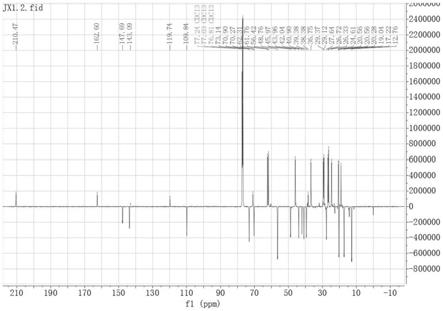
其制备方法为:将3-呋喃甲酸(16.81mg,0.15mmol)和dmap(24.43mg,0.2mmol),溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得47.816mg白色粉末,收率为80%。1h-nmr(400mhz,cdcl3)δppm:8.00(dd,j=1.6,0.8hz,1h,3'-h),7.42(t,j=1.7hz,1h,5'-h),6.73(dd,j=1.9,0.8hz,1h,4'-h),4.87(tt,j=11.4,4.8hz,1h,3-h),1.07(d,j=7.0hz,3h,27-h),1.03(s,3h,21-h),0.82(s,3h,19-h)。
13
c-nmr(151mhz,cdcl3)δppm:210.49(c-6),162.61(c-1'),147.69(c-4'),143.67(c-3'),119.74(c-2'),109.84(c-5'),73.14(c-3),70.91(c-20),70.27(c-22),62.32(c-26),61.77(c-18),56.51(c-5),56.42(c-9),48.77(c-17),45.98(c-7),43.96(c-14),42.05(c-8),40.90(c-12),39.39(c-13),38.38(c-10),36.76(c-1),29.37(c-11),29.12(c-24),27.64(c-25),26.72(c-4),26.34(c-2),24.61(c-15),20.56(c-16),20.28(c-21),19.04(c-23),17.23(c-27),12.76(c-19)。分子量:523.33。
[0046]
实施例二、贝母素乙衍生物b的
13
c-nmr谱和1h-nmr谱,如图3和图4所示,
[0047][0048]
其制备方法为:将2-萘甲酸(25.83mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得53.74mg淡黄色粉末,收率为78.12%。.1h nmr(600mhz,cdcl3)δppm:8.60(t,1h,3'-h),8.05(dd,j=8.6,1.7hz,1h,9'-h),7.97(m,1h,8'-h),7.88(m,1h,4'-h),7.86(s,1h,7'-h),7.59(m,1h,5'-h),7.54(m,1h,6'-h),4.99(1h,tt,3-h),1.10(s,3h,27-h),0.98(s,3h,21-h),0.88(m,3h,19-h).
13
c nmr(151mhz,cdcl3)δppm:209.61(c-6),166.26(c-1'),135.52(c-11'),132.51(c-10'),
131.04(c-3'),129.41(c-4'),128.17(c-6'),128.08(c-8'),127.82(c-7'),127.74(c-2'),126.59(c-5'),125.30(c-9'),73.42(c-3),71.27(c-20),70.09(c-22),61.87(c-26),60.35(c-18),56.74(c-9),56.51(c-5),48.12(c-17),45.63(c-7),43.86(c-14),41.05(c-8),40.64(c-12),39.91(c-13),38.40(c-10),36.58(c-1),29.71(c-2),29.38(c-11),28.71(c-24),28.58(c-24),27.00(c-25),26.72(c-4),26.34(c-2),24.89(c-15),21.07(c-16),19.84(c-21),19.20(c-23),18.24(c-27),12.90(c-19)。分子量:583.37。
[0049]
实施例三、贝母素乙衍生物c的
13
c-nmr谱和1h-nmr谱,如图5和图6所示,
[0050][0051]
其制备方法为:将3-吲哚乙酸(26.27mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得54.78mg淡黄色粉末,收率为78%。1h-nmr(300mhz,cdcl3)δppm:7.62(dd,j=7.9,1.2hz,1h,8'-h),7.35(m,1h,5'-h),7.20(m,1h,4'-h),7.17(dd,j=11.2,1.8hz,1h,6'-h),7.13(dd,j=8.1,7.0hz,1h,7'-h),4.62(tt,j=11.4,4.8hz,1h,3-h),1.09(d,j=7.8hz,3h,27-h),1.04(s,3h,21-h),0.77(s,3h,19-h)。
13
c nmr(151mhz,cdcl3)δppm:210.49(c-6),171.49(c-1'),136.11(c-10'),127.27(c-9'),122.98(c-4'),122.16(c-6'),119.61(c-7'),118.93(c-8'),111.17(c-5'),108.59(c-3'),73.42(c-3),70.94(c-20),70.37(c-22),62.18(c-26),61.73(c-18),56.42(c-9),56.35(c-5),48.71(c-17),45.92(c-7),43.93(c-14),41.93(c-8),40.85(c-12),39.21(c-13),38.33(c-10),36.70(c-1),31.69(c-2'),29.31(c-11),29.04(c-24),27.58(c-25),26.61(c-4),26.19(c-2),24.56(c-15),20.52(c-16),20.40(c-21),18.99(c-23),17.25(c-27),12.70(c-19)。分子量:586.38。
[0052]
实施例四、贝母素乙衍生物d的
13
c-nmr谱和1h-nmr谱,如图7和图8所示,
[0053][0054]
其制备方法为:将boc-缬氨酸(32.58mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得59.02mg白色粉末,收率为78.12%。1h-nmr(300mhz,cdcl3)δppm:4.77(m,1h,3-h),4.21(m,1h,2'-h),2.22(d,j=11.8hz,1h,8'-h),1.47(s,9h,5',6',7'-h),1.09(d,j=7.0hz,3h,27-h),1.04(s,3h,21-h),0.98(d,j=6.8hz,3h,10'-h),0.91(d,j=6.8hz,3h,9'-h),0.81(s,3h,19-h)。
13
c-nmr(151mhz,cdcl3)δ210.34(c-6),171.82(c-1'),155.69(c-3'),79.69(c-4'),73.96(c-3)70.89(c-20),70.27(c-22),62.28(c-26),61.75(c-18),58.55(c-2'),56.40(c-9),56.38(c-5),48.76(c-17),45.95(c-7),43.96(c-14),41.97(c-8),40.87(c-12),39.35(c-13),38.33(c-10),36.71(c-1),31.36(c-8'),29.71(c-5'),29.36(c-11),29.08(c-24),28.34(c-6'),28.09(c-7'),27.63(c-25),26.66(c-4),26.19(c-2),24.59(c-15),20.55(c-16),20.29(c-21),19.02(c-23),17.54(c-10',c-9'),17.22(c-27),12.72(c-19)。分子量:628.45。
[0055]
实施例五、贝母素乙衍生物e的
13
c-nmr谱和1h-nmr谱,如图9和图10所示,
[0056][0057]
其制备方法为:将boc-色氨酸(39.79mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得65.75mg白色粉末,收率为79.45%。1h-nmr(400mhz,cdcl3)δppm:7.59(s,1h,10'-h),7.35(s,1h,7'-h),7.19(m,1h,5'-h),7.12(m,1h,8'-h),7.03(d,j=2.3hz,2h,8',9'-h),4.64(m,1h,3-h),4.31(t,j=
6.7hz,1h,2'-h),3.27(t,j=7.3hz,2h,3'-h),1.43(s,9h,14',15',16'-h),1.08(d,j=7.0hz,3h,27-h),1.03(3h,s,21-h),0.74(s,3h,19-h)。
13
c nmr(151mhz,cdcl3)δppm::210.63(c-6),171.78(c-1'),155.20(c-12'),136.14(c-6'),127.86(c-11'),122.85(c-5'),122.15(c-8'),119.58(c-9'),119.03(c-10'),111.14(c-7'),110.38(c-4'),79.73(c-13'),74.10(c-3),70.89(c-20),70.30(c-22),62.24(c-26),61.74(c-18),60.28(c-2'),56.54(c-9),56.34(c-5),48.78(c-17),45.95(c-7),43.96(c-14),41.91(c-8),40.86(c-12),39.31(c-13),38.28(c-10),36.64(c-1),,29.36(c-11),29.04(c-24),28.59(c-14'),28.36(c-3'),28.19(c-15'),28.10(c-16'),27.63(c-25),26.44(c-4),25.98(c-2),24.34(c-15),20.54(c-16),20.34(c-21),19.03(c-23),17.21(c-27),12.67(c-19)。分子量:715.46。
[0058]
实施例六、贝母素乙衍生物f的
13
c-nmr谱和1h-nmr谱,如图11和图12所示,
[0059][0060]
其制备方法为:将boc-亮氨酸(34.69mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得59.02mg白色粉末,收率为76.11%。1h-nmr(600mhz,cdcl3)δppm:4.86(d,j=8.8hz,1h,2'-h),4.72(dd,j=10.9,5.7hz,3-h),1.56(s,1h,9'-h),1.44(s,9h,5',6',7'-h),1.07(d,j=7.0hz,3h,27-h),1.02(3h,s,21-h),0.95(m,6h,10',11'-h),0.79(s,3h,19-h)。
13
c-nmr(151mhz,cdcl3)δppm:210.46(c-6),173.01(c-1'),155.43(c-3'),79.73(c-4'),73.89(c-3),70.90(c-20),70.27(c-22),62.28(c-26),61.75(c-18),60.41(c-9),56.38(c-5),52.20(c-2'),48.76(c-17),45.96(c-7),43.96(c-14),41.96(c-8),40.88(c-12),39.35(c-13),38.35(c-10),36.71(c-1),29.37(c-11),29.09(c-24),28.34(c-5',6',7'),27.63(c-25),26.59(c-4),26.06(c-2),24.84(c-9'),24.60(c-15),22.92(c-11'),21.89(c-10'),20.55(c-16),20.30(c-21),19.04(c-23),17.22(c-27),12.73(c-19)。分子量:642.46。
[0061]
实施例七、贝母素乙衍生物g的
13
c-nmr谱和1h-nmr谱,如图13和图14所示,
h),1.07(d,j=7.0hz,3h,27-h),1.02(s,3h,21-h),0.92(m,6h,10',11'-h),0.83
–
0.80(s,1h),0.79(s,3h,19-h)。
[0067]
13
c-nmr(151mhz,cdcl3)δppm:210.26(c-6),171.76(c-1'),155.53(c-3'),79.67(c-4'),73.98(c-3),70.89(c-20),70.32(c-22),62.24(c-26),61.74(c-18),57.93(c-2'),56.40(c-5),48.76(c-17),45.94(c-7),43.96(c-14),41.96(c-8),40.86(c-12),39.29(c-13),38.33(c-10),38.19(c-8'),36.72(c-1),29.35(c-11),29.07(c-24),28.35(c-5',6',7'),27.62(c-25),26.70(c-4),26.19(c-2),25.16(c-9'),24.58(c-15),20.54(c-16),20.35(c-21),19.02(c-23),17.21(c-27),15.49(c-11'),12.72(c-19),11.73(c-10')。分子量:644.48。
[0068]
实施例九、贝母素乙衍生物i的
13
c-nmr谱和1h-nmr谱,如图17和图18所示,
[0069][0070]
其制备方法为:将boc-甘氨酸(24.92mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得52.91mg白色粉末,收率为77.93%。1h nmr(600mhz,cdcl3)δppm:4.75(dt,j=11.5,6.3hz,1h,3-h),4.15
–
4.03(m,1h),3.91(dd,j=18.3,5.8hz,1h,2'-h),1.44(s,9h,5',6',7'-h),1.08(m,3h,27-h),1.03(s,3h,21-h),0.78(s,3h,19-h)。
13
c nmr(151mhz,cdcl3)δppm:210.11(c-6),169.76(c-1'),155.66(c-3'),79.94(c-4'),74.25(c-3),70.90(c-20),70.38(c-22),62.18(c-26),61.73(c-18),56.34(c-5),48.73(c-17),45.89(c-7),43.95(c-14),42.66(c-2'),41.92(c-8),40.85(c-12),39.21(c-13),38.28(c-10),36.64(c-1),29.32(c-11),29.02(c-24),28.32(c-5',6',7'),27.59(c-25),26.53(c-4),26.14(c-2),24.55(c-15),20.51(c-16),20.42(c-21),19.12(c-23),17.21(c-27),12.67(c-19)。分子量:713.30。
[0071]
实施例十、贝母素乙衍生物j的
13
c-nmr谱和1h-nmr谱,如图19和图20所示,
[0072][0073]
其制备方法为:将boc-苯丙氨酸(39.64mg,0.15mmol)和dmap(24.43mg,0.27mmol)溶于二氯甲烷中,搅拌10min后加入贝母乙素(42.96mg,0.1mmol)和edci(38.34mg,0.2mmol),搅拌溶解后,置于室温6h。减压浓缩后,硅胶薄层制备板纯化,得63.49mg白色粉末,收率为76.92%。1h-nmr(600mhz,cdcl3)δppm:7.29(t,j=7.4hz,2h,11',12'-h),7.23(t,j=7.3hz,1h,13'-h),7.15(m,2h,10',14'-h),4.70(tt,j=11.2,4.8hz,1h,3-h),4.53(q,j=6.7hz,1h,2'-h),1.41(s,9h,5',6',7'-h),1.07(d,j=7.0hz,3h,27-h),1.02(s,3h,21-h),0.77(s,3h,19-h)。
13
c nmr(151mhz,cdcl3)δppm:210.17(c-6),171.29(c-1'),155.06(c-3'),136.00(c-9'),129.43(c-11',12'),128.51(c-10',14'),126.99(c-13'),79.83(c-4'),74.25(c-3),70.89(c-20),70.31(c-22),62.25(c-26),61.75(c-18),56.36(c-5),54.51(c-2'),48.76(c-17),45.94(c-7),43.95(c-14),41.96(c-8),40.87(c-12),39.30(c-13),38.39(c-9'),38.29(c-10),36.66(c-1),29.36(c-11),29.06(c-24),28.32(c-5',6',7'),27.62(c-25),26.54(c-4),26.10(c-2),24.58(c-15),20.54(c-16),20.34(c-21),19.03(c-23),17.21(c-27),12.69(c-19)。分子量:676.45。
[0074]
对上述10种贝母素乙衍生物进行细胞活性测试:
[0075]
实验原理:hepg2为肝癌组织细胞的一种,通过给药后,观察细胞生长情况,判断药物是否具有抗肝癌作用。a549为人肺癌细胞的一种,通过给药后,观察细胞生长情况,判断药物是否具有抗肺癌作用。
[0076]
实验方法:hepg2细胞和a5549细胞在完全培养基(含有10%新生小牛血清和90%不完全培养基)中培养,并置于37℃,5%co2气氛中。我们选择对数生长期细胞进行实验,向细胞中加入贝母素乙及其衍生物(6.25、12.5、25、50、100μg/ml)200μl。24小时后,向细胞中加入10μlmtt(5mg/ml),4h后,用酶标仪在490nm处测定od值,计算细胞抑制率。细胞抑制率%=(a阴性对照-a实验)/a阴性对照
×
100%。
[0077]
实验结果:如表1所示,总结了不同浓度的贝母素乙衍生物的抑制率和半抑制浓度值。其中,与贝母乙素23.14
±
0.51(μg/ml)相比,衍生物b的半抑制浓度值为14.44
±
0.42(μg/ml)。这表明衍生物b对hepg2细胞具有较强的的细胞毒性。根据表2所示,衍生物c的半数致死量为5.39
±
0.24,与贝母素乙相比对a549细胞毒性增强。
[0078]
表1贝母素乙及其衍生物对hegp2细胞的作用(抑制率%,均值
±
标准差,n=5)
[0079][0080]
与空白组相比,*p《0.05,**p《0.01,***p《0.001.
[0081]
表2贝母乙素及其衍生物对对a549细胞的作用(抑制率%,均值
±
标准差,n=5)。
[0082][0083][0084]
与空白组相比,*p《0.05,**p《0.01,***p《0.001.
[0085]
综上所述,化合物b和化合物c的抗肿瘤活性强于贝母素乙。
