使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸进行等位基因特异性扩增
1.相关申请的交叉引用
2.本技术要求19.05.14提交的美国临时专利申请第62/000,114号的优先权,其通过引用全文纳入本文。
3.序列表
4.序列表仅以电子形式与本技术一同提交,其通过引用纳入本文。序列表文本文件"14-21013-wo(260947.00251)_sl.txt"创建于2015年5月18日,大小为13,144字节。
背景技术:
5.dna和rna中的微小差异可导致包括人类在内的生物体的总体身体健康和健康状态的巨大差异。例如,细菌基因组中的单碱基改变可导致抗生素抗性,以及人类基因组中的一个单碱基改变可导致癌症进展。随着基因组学领域的成熟和随之而来的许多核酸生物标志物序列和分子的发现,存在来自生物技术工业的发展可区分单碱基改变的可靠、稳健、廉价和精确的核酸试验的强烈需求。具体地,已开发等位基因特异性的许多基于pcr的试验。
6.用于选择性检测稀有突变的基于pcr的方法可大体分类为两类方法:(a)等位基因特异性引物,和(b)利用等位基因特异性阻断剂的非等位基因特异性引物。
7.等位基因特异性引物的示例包括扩增阻碍突变系统(arms)、等位基因特异性阻断剂pcr(asb-pcr)、和竞争性等位基因特异性taqman pcr(castpcr)。(b)的示例包括pna阻断剂pcr和低变性温度共扩增pcr(cold-pcr)。
8.本发明之前,等位基因特异性引物通常在检测已知单碱基突变时具有优势(更高的突变敏感性),而非等位基因特异性引物与等位基因特异性阻断剂通常用于检测多重紧密簇集的突变(热点)或未知突变序列。
9.等位基因特异性pcr引物例如arms、asb-pcr、castpcr通常在引物的最3’端具有等位基因特异性核苷酸。等位基因特异性pcr引物使用dna聚合酶的识别力来特异延伸合适配对的碱基,但是受到下述限制:当发生不正确的dna聚合酶延伸事件时,作为引物一部分的稀有等位基因核苷酸被纳入模板,随后扩增循环变得不再特异。等位基因特异性pcr引物仅在第一不正确扩增事件之前具有特异性。用非等位基因特异性引物进行等位基因特异性检测需要精确的变性温度控制以及对更小序列的受限分析。用非等位基因特异性引物进行等位基因特异性检测的突变敏感性低并且更易于受到聚合酶导入错误的影响。
10.因此,需要具有等位基因扩增特异性更高和突变敏感性改善的非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物。因此,开发适合检测大量变体中少量靶标的新方法是诊断应用的前提条件。因此,本发明提供非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物,从而提供用于疾病诊断应用例如癌症诊断等的更精确且高效的工具。
技术实现要素:
11.本发明涉及重叠非等位基因特异性引物寡核苷酸和等位基因特异性阻断剂寡核苷酸的组合物,用于等位基因特异性扩增。
12.本发明提供包含阻断剂和第一引物寡核苷酸的寡核苷酸组合物。所述阻断剂寡核苷酸包含具有靶中性子序列和阻断剂可变子序列的第一序列。然而,在一些示例中,若待测靶核酸用于检测插入时,阻断剂寡核苷酸可不包含阻断剂可变子序列。阻断剂可变子序列在其3’和5’端被所述靶中性子序列侧接,并且与该靶中性子序列连续。所述第一引物寡核苷酸足以诱导酶促延伸;本文中,第一引物寡核苷酸包含第二序列。所述第二序列与该靶中性子序列的5’端重叠至少5个核苷酸;从而所述第二序列包含重叠子序列和非重叠子序列。第二序列不包含与阻断剂可变子序列同源的任何序列。
13.本发明还涉及扩增靶序列的方法。所述方法包括获取样品,所述样品含一或多拷贝的第一核酸和至少一拷贝的第二核酸,所述第一核酸含变体序列;所述第二核酸含所述靶序列。靶序列和变体序列各自包含同源子序列和可变子序列。所述可变子序列还含至少一个核苷酸。所述靶序列的可变子序列是靶特异性子序列并且所述变体序列的可变子序列是非靶特异性子序列。
14.获取样品后,将阻断剂寡核苷酸引入样品。所述阻断剂寡核苷酸包含具有靶中性子序列和阻断剂可变子序列的第一序列。所述靶中性子序列与所述同源子序列的部分互补并且所述阻断剂可变子序列与所述非靶特异性子序列互补。此外,阻断剂可变子序列在其3’和5’端被所述靶中性子序列侧接,并且与该靶中性子序列连续。
15.之后,将第一引物寡核苷酸引入所述样品。所述第一引物寡核苷酸足以诱导酶促延伸。第一引物寡核苷酸包含第二序列,所述第二序列与所述同源子序列的第二部分互补。此外,所述第二序列与该靶中性子序列的5’端重叠至少5个核苷酸;从而所述第二序列包含重叠子序列和非重叠子序列。所述第二序列不包含任何与所述可变子序列互补的序列。
16.下一步,向所述样品引入dna聚合酶、三磷酸核苷、和基于聚合酶的核酸扩增所需的一种或多种试剂;和在足以实现核酸扩增的条件下使样品反应。
17.本发明的一个优势是改善的突变敏感性,其匹配和/或超过等位基因特异性引物方案。
18.本发明的另一优势是具有显著温度(8℃)稳健性的简单的2步热循环方案。
19.本发明的另一优势是提供便宜的dna引物和阻断剂试剂而无需复杂的骨架或核苷酸修饰。
20.本发明的另一优势是与高保真酶相容。
21.本发明的另一优势是等位基因特异性阻断剂与变体的结合比与靶标的结合更强,从而相比结合至变体的阻断剂,非等位基因特异性引物更有利于替代结合至靶标的阻断剂。使用非等位基因特异性引物的优势是伪扩增的变体导致扩增产物(扩增子)承载变体序列而不是靶序列。因此,每个循环都产生(compound)特异性。
22.此概况以简化形式提供本发明的引导描述、某些方面、优势和新特性,后续详细描述中进一步阐明。本概述并不旨在标识所要求保护的主题的关键特征或必要特征,也不旨在用于限制所要求保护的主题的范围。
23.附图的简要说明
24.当结合附图进行阅读时,将更好地理解前面的发明内容以及下面的示例性实施方式的详细说明。为了图示本发明,附图中显示本发明的示例性构建。然而,本发明并不局限于本文所述的具体方法和手段。
25.图1显示用于本发明所述等位基因特异性扩增的非等位基因特异性引物和等位基因特异性阻断剂的示意图。
26.图2显示本发明所述引物和阻断剂的热动力学设计的示意图。
27.图3显示根据本发明序列的δg
°
值计算的示意图。图3以出现顺序分别公开了seq id no 1,33,1,34,2,33,2,和34。
28.图4显示根据实施例1所述的人基因组dna的稀有等位基因检测的示意图。图4以出现顺序分别公开了seq id no 3-4,35,32,36,和32。
29.图5显示根据实施例2所述的稀有温度稳健性的示意图。图5以出现顺序分别公开了seq id no 5-6和37-38。
30.图6a显示根据实施例3所述的增加的引物设计灵活性的示意图。
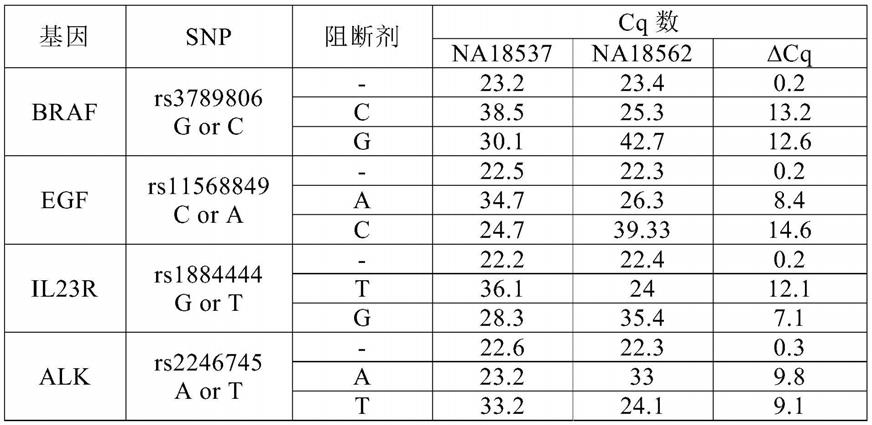
31.图6b显示根据实施例3所述扩增人snp rs3789806的4组引物与阻断剂对的核酸序列的示意图。图6b以出现顺序分别公开了seq id no 5-12和39-40。
32.图7a显示根据实施例4所述具有固定δδg
°
=2kcal/mol的δg
°
rxn1
的效果模拟的示意图。
33.图7b(i)显示根据实施例4所述的对smad7 rs4939827实验验证的示意图。图7b(i)以出现顺序分别公开了seq id no 3,13-16,4,17,和35-36。
34.图7b(ii)显示根据实施例4所述的对smad7 rs4939827实验验证的示意图。图7b(i)以出现顺序分别公开了seq id no 3,18-23,36,和35。
35.图8显示根据实施例5的具有3’非同源区域的阻断剂的示意图。图8以出现顺序分别公开了seq id no 5,24,和37-38。
36.图9a显示根据实施例6的使用探针的多重化的示意图。
37.图9b显示根据实施例6的使用探针的多重化的示意图。
38.图10显示根据实施例7的用于引物和阻断剂的保护剂的示意图。
39.图11a显示根据实施例8的缺失(stag2 rs200841330)检测的示意图。图11a以出现顺序分别公开了seq id no 25-26和41-42。
40.图11b显示根据实施例8的插入(stag2 rs200841330)检测的示意图。图11b以出现顺序分别公开了seq id no 25,43,42,和41。
41.图12显示根据实施例9所述的上游阻断剂的示意图。图12以出现顺序分别公开了seq id no 27-28和44-45。
42.图13显示根据实施例10的真菌核糖体rna编码dna的特异扩增的示意图。
43.图14显示根据实施例11的双重nasp的示意图。图14以出现顺序分别公开了seq id no 29,10,46-49,和30-31。
44.发明详述
45.将就具体实施方式并参照某些附图对本发明进行描述,但本发明并不受此限制,仅由权利要求书限定。描述的附图仅是说明性的且是非限制性的。在附图中,一些元素的尺寸可能被夸大或扭曲且未按比例尺绘画以用于说明目的。除非特别指明,本发明的元件在
首次出现时用“一”或“一个”表示,在第二次或后续出现时用“该”或“所述”表示。
46.在此将参照附图更完整地描述本发明,它们显示了本发明的一些而非全部的实施方式。实际上,本发明可以以多种不同的形式实施,不应被看作仅限于本发明所述的实施方式;而是,提供这些实施方式用以使本公开内容满足所有法律要求。
47.定义
48.除非另外定义,本文中所使用的所有技术和科学术语具有本领域普通技术人员通常所理解的同样含义。
49.如本文所用,术语“阻断剂寡核苷酸”指长度为约12至约100核苷酸的至少一种连续链,并且若在本文中如此述及,其还可在其3’端包括功能性基团或核苷酸序列,其在扩增过程(例如聚合酶链式反应)期间阻止酶促延伸。
50.如本文所用,术语“引物寡核苷酸”指含长度为约12至约100核苷酸的至少一种连续链的分子,其足以在扩增过程(例如聚合酶链式反应)期间允许酶促延伸。
51.如本文所用,术语“靶中性子序列”指与靶核酸和变体核酸中的序列互补的核苷酸序列。例如,用于扩增的待靶向的所需核酸序列(靶序列)可存在于含核酸分子的样品中,该核酸分子除了可变区域(可变核酸)之外具有含靶序列的主要同源序列,在一些示例中该可变区域仅为与靶核酸不同的单核苷酸。在本实施例中,靶中性子序列与两个核酸共有的同源序列的至少一部分互补,但不是所述可变区域。因此,本文所述术语“阻断剂可变子序列”指阻断剂寡核苷酸的核苷酸序列,其与变体核酸的可变区域互补。
52.本文所用术语“重叠子序列”指引物寡核苷酸的至少5个核苷酸的核苷酸序列,其与本文所述组合物中所用的阻断剂寡核苷酸的一部分同源。引物寡核苷酸的重叠子序列可与阻断剂寡核苷酸的靶中性子序列的任何部分同源,无论是阻断剂可变子序列的5’还是3’端。因此,术语“非重叠子序列”指不是重叠子序列的引物寡核苷酸序列。
53.如本文所用,术语“靶序列”指携带所需待扩增、鉴定或分离的等位基因(例如单核苷酸多态性)的核酸的核苷酸序列。如本文所用,术语“变体序列”指不携带所需等位基因的核酸的核苷酸序列。例如,在一些情况中,变体序列携带野生型等位基因而靶序列携带突变等位基因。因此,在一些情况中,变体序列和靶序列来自基因组中的常见基因座,从而各序列可基本同源,除了携带所需等位基因的区域、两者之间存在差异的核苷酸或组或多个核苷酸。
54.本发明涉及一种寡核苷酸组合物。在本发明一个实施方式中,寡核苷酸组合物包含用于等位基因扩增的等位基因特异性阻断剂寡核苷酸和非等位基因特异性引物寡核苷酸。
55.在本发明另一个实施方式中,寡核苷酸组合物包括阻断剂寡核苷酸和第一引物寡核苷酸。所述阻断剂寡核苷酸包含具有靶中性子序列和阻断剂可变子序列的第一序列。阻断剂可变子序列在其3’和5’端被所述靶中性子序列侧接,并且与该靶中性子序列连续。换句话说,阻断剂可变子序列可将靶中性子序列分为两部分,一部分至阻断剂可变子序列的3’端,另一部分至5’端。所述第一引物寡核苷酸足以诱导酶促延伸;这里所述第一引物寡核苷酸包含第二序列。所述第二序列与该靶中性子序列重叠至少5个核苷酸;从而所述第二序列包含重叠子序列和非重叠子序列。第二序列不包括阻断剂可变子序列。因此,引物寡核苷酸可表征为非等位基因特异性引物。重叠区域可与所述阻断剂寡核苷酸的靶中性子序列的
一部分在所述阻断剂可变子序列的5’侧或所述阻断剂可变子序列的3’侧同源。如图1所示,引物寡核苷酸重叠子序列与所述阻断剂的靶中性子序列在阻断剂可变子序列(在阻断剂上示为“c”)的5’侧同源。本文中,靶中性子序列是所述阻断剂在阻断剂可变子序列c的任一侧的部分。图12显示一个示例,其中引物的重叠子序列与阻断剂的靶中性子序列的部分同源,其是阻断剂可变子序列c的3’端。
56.在本发明的另一实施方式中,阻断剂寡核苷酸在3’端或3’端附近还包含功能基团或非互补序列区,其阻止酶促延伸。在一个示例中,阻断剂寡核苷酸的功能基团选自但不限于3-碳间隔子或双脱氧核苷酸。
57.所述第二序列产生杂交标准自由能(δg
°
pt
)并且所述第一序列产生杂交标准自由能(δg
°
bt
),满足下述条件:
58.+2kcal/mol≥δg
°
pt-δg
°
bt
≥-8kcal/mol
59.所述非重叠子序列产生杂交标准自由能(δg
°3),满足下述条件:
[0060]-4kcal/mol≥δg
°3≥-12kcal/mol
[0061]
在一个示例中,第二序列与靶中性子序列的5’端重叠约5个核苷酸至约40个核苷酸。在另一个示例中,第二序列与靶中性子序列的5’端重叠约7个核苷酸至约30个核苷酸。
[0062]
在一个示例中,所述阻断剂寡核苷酸的浓度比所述第一引物寡核苷酸的浓度高约2-约10,000倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比所述第一引物寡核苷酸的浓度高约5-约1,000倍。
[0063]
在本发明另一实施方式中,寡核苷酸组合物还包含足以诱导酶促延伸的第二引物寡核苷酸。所述第二引物寡核苷酸包含第三序列,其中所述第三序列不与所述第一序列或第二序列重叠,并且其是靶中性的并且足以伴随所述第一引物寡核苷酸使用以通过聚合酶链式反应来扩增核酸区域。
[0064]
在本发明另一实施方式中,寡核苷酸组合物还包含第二阻断剂寡核苷酸。所述第二阻断剂寡核苷酸包括第四序列,其具有第二靶中性子序列和第二阻断剂可变子序列。第二阻断剂可变子序列与靶核酸的非等位基因特异性子序列具有相同序列,鉴于其通常涉及用于结合靶标的反义序列。第二阻断剂可变子序列在其3’和5’端被第二靶中性子序列侧接,并且与该第二靶中性子序列连续。所述第三序列与第二靶中性子序列的5’端重叠至少5个核苷酸;从而所述第三序列包含第二重叠子序列和第二非重叠子序列。
[0065]
在本发明的另一实施方式中,第二阻断剂寡核苷酸在3’端或3’端附近还包含第二功能基团或第二非互补序列区,其阻止酶促延伸。在一个示例中,第二阻断剂寡核苷酸的第二功能基团选自但不限于3-碳间隔子或双脱氧核苷酸。
[0066]
所述第三序列产生杂交标准自由能(δg
°
pt2
)并且所述第四序列产生杂交标准自由能(δg
°
bt2
),满足下述条件:
[0067]
+2kcal/mol≥δg
°
pt2-δg
°
bt2
≥-8kcal/mol
[0068]
所述第二非重叠子序列产生杂交标准自由能(δg
°6),满足下述条件:
[0069]-4kcal/mol≥δg
°6≥-12kcal/mol。
[0070]
在一个示例中,第三序列与第二靶中性子序列的5’端重叠约5个核苷酸至约40个核苷酸。在另一个示例中,第三序列与第二靶中性子序列的5’端重叠约7个核苷酸至约30个核苷酸。
[0071]
在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为约12核苷酸至约100核苷酸。在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为约15核苷酸至约90核苷酸。在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为约20核苷酸至约80核苷酸。在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为约20核苷酸至约70核苷酸。在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为约20核苷酸至约60核苷酸。在上述实施方式的任一中,引物寡核苷酸和阻断剂寡核苷酸的各自长度可为21、22、23、24、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50核苷酸。
[0072]
在一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约2-约10,000倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约5-约1,000倍。.在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约10-约900倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约20-约800倍。.在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约30-约700倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约40-约600倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约50-约500倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约60-约400倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约70-约300倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约80-约200倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比所述第二引物寡核苷酸的浓度高约90-约100倍。
[0073]
在本发明的另一实施方式中,寡核苷酸组合物还包含聚合酶链式反应所需的试剂。
[0074]
在本发明另一实施方式中,寡核苷酸组合物还包含多种核苷三磷酸。
[0075]
在本发明另一实施方式中,寡核苷酸组合物还包含dna聚合酶或rna聚合酶。
[0076]
在本发明另一实施方式中,寡核苷酸组合物还包含聚合酶链式反应所需的试剂、多种核苷三磷酸、dna酶。
[0077]
在本发明另一实施方式中,阻断剂可变子序列是单核苷酸。
[0078]
本发明还涉及扩增靶序列的方法。所述方法包括步骤(a)获取样品,所述样品含一或多拷贝的第一核酸和至少一拷贝的第二核酸,所述第一核酸含变体序列;所述第二核酸含所述靶序列。靶序列和变体序列各自具有同源子序列和可变子序列。可变子序列还可包含至少一个核苷酸,但可包含2-5个核苷酸。所述靶序列的可变子序列是靶特异性子序列并且所述变体序列的可变子序列是非靶特异性子序列。
[0079]
所述方法还包含步骤(b)将阻断剂寡核苷酸引入样品,其中所述阻断剂寡核苷酸包含具有靶中性子序列和阻断剂可变子序列的第一序列。所述靶中性子序列与所述同源子序列的部分互补并且所述阻断剂可变子序列与所述非靶特异性子序列互补。此外,阻断剂可变子序列在其3’和5’端被所述靶中性子序列侧接,并且与该靶中性子序列连续。
[0080]
所述方法还包含步骤(c)将第一引物寡核苷酸引入样品。所述第一引物寡核苷酸足以诱导酶促延伸。所述第一引物寡核苷酸包含第二序列。此外,所述第二序列与所述同源
子序列的第二部分互补,并且与所述靶中性子序列重叠至少5个核苷酸,从而所述第二序列包含重叠子序列和非重叠子序列。所述第二序列不包含任何与所述可变子序列互补的序列。
[0081]
所述方法还包含步骤(d)向所述样品引入dna聚合酶、三磷酸核苷、和基于聚合酶的核酸扩增所需的一种或多种试剂;和然后(e)在足以实现核酸扩增的条件下使样品反应。
[0082]
在本发明的一个实施方式中,阻断剂寡核苷酸在3’端或3’端附近还包含功能基团或非互补序列区,其阻止酶促延伸。在一个示例中,功能基团选自但不限于3-碳间隔子或双脱氧核苷酸。
[0083]
所述第二序列产生杂交标准自由能(δg
°
pt
)并且所述第一序列产生杂交标准自由能(δg
°
bt
),满足下述条件:
[0084]
+2kcal/mol≥δg
°
pt-δg
°
bt
≥-8kcal/mol
[0085]
所述非重叠子序列产生杂交标准自由能(δg
°3),满足下述条件:
[0086]-4kcal/mol≥δg
°3≥-12kcal/mol
[0087]
在一个示例中,第二序列与阻断剂的靶中性子序列的5’端重叠约5个核苷酸至约40个核苷酸(即“重叠子序列”)。换句话说,第二序列包含重叠子序列,其与位于阻断剂的阻断剂可变子序列的5’侧的阻断剂的靶中性子序列的5个核苷酸至约40个核苷酸同源。在另一个示例中,第二序列与靶中性子序列的5’端重叠约7个核苷酸至约30个核苷酸。在另一示例中,第二序列包含重叠子序列,其与位于阻断剂的阻断剂可变子序列的3’侧的阻断剂的靶中性子序列的部分同源。
[0088]
在一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约2-约10000倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约5-约1,000倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约10-约500倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约20-约250倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约40-约125倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约50-约100倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约300-约400倍。在另一个示例中,所述阻断剂寡核苷酸的浓度比被引入所述样品的第一引物寡核苷酸的浓度高约500-约600倍。
[0089]
在本发明的另一实施方式中,dna聚合酶是热稳定dna聚合酶。
[0090]
在本发明的另一实施方式中,所述方法包括通过将样品暴露于至少10个循环而足以实现核酸扩增的条件。各循环包括至少2个不同温度暴露,一个温度暴露至少85℃,一个温度暴露不高于75℃。
[0091]
在本发明的另一实施方式中,所述方法还包含将选自下组的酶引入所述样品的步骤:切口酶、重组酶、解旋酶、rna酶、逆转录酶或其任何组合。
[0092]
在本发明的另一实施方式中,所述方法还包含向所述样品引入第二引物寡核苷酸的步骤。所述第二引物寡核苷酸包含第三序列。此外,所述第三序列不与所述可变子序列重叠。此外,所述第三序列是靶中性的并且足以与所述第一引物寡核苷酸使用以扩增含所述靶序列的核酸区域。
[0093]
在本发明的另一实施方式中,所述方法还包含向所述样品引入第二阻断剂寡核苷酸的步骤。所述第二阻断剂寡核苷酸包括第四序列,所述第四序列具有第二靶中性子序列和第二阻断剂可变子序列。此外,所述第二阻断剂可变子序列是所述阻断剂可变子序列的互补序列。此外,第二阻断剂可变子序列在其3’和5’端被第二靶中性子序列侧接,并且与该第二靶中性子序列连续。此外,所述第三序列与第二靶中性子序列的5’端重叠至少5个核苷酸;从而所述第三序列包含第二重叠子序列和第二非重叠子序列。
[0094]
在本发明的另一实施方式中,第二阻断剂寡核苷酸在3’端或3’端附近还包含第二功能基团或第二非互补序列区,其阻止酶促延伸。在一个示例中,第二功能基团选自但不限于3-碳间隔子或双脱氧核苷酸。
[0095]
所述第三序列产生杂交标准自由能(δg
°
pt2
)并且所述第四序列产生杂交标准自由能(δg
°
bt2
),满足下述条件:
[0096]
+2kcal/mol≥δg
°
pt2-δg
°
bt2
≥-8kcal/mol
[0097]
所述第二非重叠子序列产生杂交标准自由能(δg
°6),满足下述条件:
[0098]-4kcal/mol≥δg
°6≥-12kcal/mol
[0099]
在一个示例中,第三序列与第二靶中性子序列的5’端重叠约5个核苷酸至约40个核苷酸。在另一个示例中,第三序列与第二靶中性子序列的5’端重叠约7个核苷酸至约30个核苷酸。
[0100]
在一个示例中,所述第二阻断剂寡核苷酸的浓度比被引入所述样品的第二引物寡核苷酸的浓度高约2-约10000倍。在另一个示例中,所述第二阻断剂寡核苷酸的浓度比被引入所述样品的第二引物寡核苷酸的浓度高约5-约1,000倍。
[0101]
在本发明的另一实施方式中,用于扩增靶序列的方法还包含从样品移出等分试样;和重复上述步骤(b)-(e)的步骤。
[0102]
图1显示用于等位基因特异性扩增的非等位基因特异性引物和等位基因特异性阻断剂的示意图。核酸试剂混合物包含两种寡核苷酸酸物质,一种引物(引物寡核苷酸)和变体特异性阻断剂(阻断剂寡核苷酸),它们一起作用,以联合基于聚合酶的扩增方法来实现可靠的稀有靶标扩增。阻断剂可在3'端用不可延伸的修饰方式进行修饰,例如双脱氧核苷酸或3-碳接头。引物和阻断剂的序列基于其与靶核酸序列和变体核酸序列的杂交的热力学进行合理设计。在一些实施方式中,阻断剂以比引物显著更高的浓度存在,从而靶标和变体核酸序列的大多数在结合引物之前结合阻断剂。引物与阻断剂-靶标或阻断剂-变体分子短暂结合,并且具有替代阻断剂结合靶标或变体的可能性。由于阻断剂序列对变体靶标特异,其从变体上的取代(displacement)的热力学有利性低于其从靶标上的取代。因此,非等位基因特异性引物以比扩增变体序列更高的产量/效率扩增靶序列。引物的非等位基因特异性性质表示其虚假扩增含变体等位基因而不是靶等位基因的变体序列,从而后续扩增循环也表现出对靶标的扩增偏好。
[0103]
变体特异性阻断剂的高浓度导致阻断剂非常可能在引物有机会结合前与靶标和变体先结合。引物通过不与阻断剂重叠的独特区域起始与靶标阻断剂或变体阻断剂复合物的结合,并且后续可能通过无酶的链取代过程来换置阻断剂。
[0104]
图2显示引物和阻断剂的热力学设计的示意图。引物和阻断剂的序列经合理设计以实现所需的反应热力学。这里,引物、阻断剂、靶标和变体核酸序列再分为包含连续核苷
酸的区域,在图2中用数字1-8表示。引物与靶标之间的杂交标准自由能(δg
°
pt
)和阻断剂与靶标之间的杂交标准自由能(δg
°
bt
)满足:
[0105]
+2kcal/mol≥δg
°
pt-δg
°
bt
≥-8kcal/mol
[0106]
满足上述不等式的引物和阻断剂系统在引物结合靶标和引物结合变体之间的每循环杂交产量上显著不同,产生靶特异性扩增。
[0107]
无酶链取代过程通过引物结合与阻断剂结合的相对热力学指导。阻断剂与变体的杂交(结合标准自由能δg
°
bv
)比与靶标的杂交更有利(结合标准自由能δg
°
bt
,δg
°
bt
》δg
°
bv
,因为更负的δg
°
表示更强的有利性)。在本发明的另一实施方式中,引物阻断剂与变体的杂交(结合标准自由能δg
°
pv
)和与靶标的杂交等同有利(结合标准自由能δg
°
pt
,δg
°
pv
=δg
°
pt
)。
[0108]
引物取代阻断剂结合靶标的反应的标准自由能δg
°
rxn1
=δg
°
pt-δg
°
bt
,其比引物取代阻断剂结合变体的反应的标准自由能δg
°
rxn2
=δg
°
pv-δg
°
bv
更负。为了实现本发明的优良性能,引物和阻断剂通常应设计为δg
°
rxn1
≤0和δg
°
rxn2
≥0。然而,由于阻断剂和引物的相对浓度会影响反应的平衡分配和有效热力学,对δg
°
rxn1
和δg
°
rxn2
的指导并非绝对。
[0109]
图3显示从序列计算δg
°
值的示意图。计算不同区域相互作用的δg
°
有不同常规模式;图3所示为基于最邻近模型的示例性能量计算。δg
°
1-5
、δg
°
4-7
和δg
°
4-8
术语进一步包含杂交起始的标准自由能(δg
°
init
),和邻接第六区域的额外碱基堆叠。用其他方法计算的标准自由能δg
°
可得到相同的δg
°
pt
、δg
°
pv
、δg
°
bt
和δg
°
bv
值。虽然不同个体区域的热力学(例如δg
°
3-6
)可能不同。所示示例旨在显示本发明所用的δg
°
计算方法,并非旨在提示用于试验的序列;所列序列对于稳定结合来说可能太短。本领域技术人员已知根据引物序列、阻断剂序列、靶序列、变体序列、操作温度和操作缓冲液条件计算δg
°
pt
、δg
°
pv
、δg
°
bt
和δg
°
bv
。
[0110]
图4显示本发明探针和阻断剂设计和两个人类储存样品na18537和na18562的smad7基因座周围的子序列。引物/阻断剂组的设计经设计用于特异扩增smad7单核苷酸多态性(snp)的a变体。阻断剂设计为与含smad7 snp的g变体的变体模板完美互补,并且在3’末端用3-碳接头(c3)功能化,阻止taq dna聚合酶的酶促延伸。反向引物结合正向引物的3’端,并且对两种等位基因均不特异。为了方面解释用于描述引物和阻断剂的各种子序列的术语,寡核苷酸可如下描述。阻断剂寡核苷酸含靶中性子序列,其包含胞嘧啶核苷酸的5’端和3’端的序列,其被描绘为与所述序列的剩余部分的匹配错位—该示例中的胞嘧啶核苷酸代表所述阻断剂的阻断剂可变子序列。引物寡核苷酸的重叠子序列包含与位于阻断剂可变子序列(胞嘧啶)5’侧的阻断剂序列同源的序列。
[0111]
图5显示引物-阻断剂对在退火/延伸温度范围56℃-66℃时靶向人snp rs3789806(c/g)c等位基因的性能。
[0112]
图6a和6b显示具有更多设计空间以避免不需要的相互作用的引物设计。
[0113]
图7a和7b显示通过设计δg
°
rxn1
来控制等位基因特异性pcr行为。图7a中的模拟表明,当设计引物和阻断剂从而使δg
°
rxn1
更加正时,δcq值更大。然而,在更加正的δg
°
rxn1
值处,靶标的扩增也减慢,得到较大的cq值。模拟假定固定δδg
°
为2kcal/mol。上半图显示δg
°
rxn1
(星)和δg
°
rxn2
(点)的不同值在杂交产量中的预期效果。下半图显示针对各引物和阻
断剂对的靶标和变体的模拟扩增曲线。在所有所述情况中,阻断剂与引物的浓度比为20:1。图7b(i)和图7b(ii)显示δg
°
rxn1
在扩增选择性上效果的实验结果。通过加长或缩短阻断剂的3’端来实现不同δg
°
rxn1
值。如预期所示,对靶标和变体来说,更加正的δg
°
rxn1
产生较大的cq。观察到最佳中等δg
°
rxn1
产生最大的δcq和靶标的相对小的cq延迟(cq《28)。与模拟不同,δcq不随着δg
°
rxn1
而单调增加。引物-二聚体的形成和非特异性扩增产生cq上限。
[0114]
pcr过程的动态模拟表示如下:
[0115]
tfn+1=tfn+pn
·
[pn/(pn+bn)+y(δg
°
rxn1)
·
bn/(pn+bn)]
·
trn
[0116]
trn+1=trn+rn
·
tfn
[0117]
vfn+1=vfn+pn
·
[pn/(pn+bn)+y(δg
°
rxn2)
·
bn/(pn+bn)]
·
vrn
[0118]
vrn+1=vrn+rn
·
vfn
[0119]
其中tfn是在第n循环时靶标的正向引物的标准化浓度、trn是在第n循环时靶标的反向引物的标准化浓度、vfn是在第n循环时变体的正向引物的标准化浓度、vrn是在第n循环时变体的反向引物的标准化浓度、pn是在第n循环时正向引物的标准化浓度、bn是在第n循环时阻断剂的标准化浓度、rn是在第n循环时反向引物的标准化浓度、y(δg
°
)是给定δg
°
反应标准自由能下的取代反应的杂交产量。模拟结果示于图7a。
[0120]
图8显示在3’端具有非同源序列而不是不可延伸化学功能化的阻断剂。因为非同源序列不结合靶标或变体的下游区域,所以非同源区域能有效阻止酶促延伸。靶标cq和δcq值与实施例1所示的那些相似,表明与功能基团例如3-碳间隔子或双脱氧核苷酸类似,3’端的非同源序列能有效阻止酶促延伸。此处fp、rp、和b分别代表正向引物、反向引物和阻断剂(用于正向引物)。
[0121]
在标准阻断pcr中,仅正向引物有偏向地扩增靶序列,而反向引物对靶标和变体的扩增大致等同。如果正向引物和反向引物都偏向以仅扩增靶序列,那么扩增特异性还可得到改善(以及突变敏感性的大约平方级的改善)。为了实现双重靶特异性扩增,正向引物和反向引物设计为以短距离相隔,从而它们与变体特异阻断剂重叠。在限制中,引物结合区域由单核苷酸分开,其相同性在靶标和变体之间不同。正向和反向变体特异阻断剂彼此部分互补,因为它们结合靶标的互补链,并且都跨越变异区域。阻断剂设计为,尽管其仅部分互补,但在操作条件下大多数阻断剂分子彼此不杂交。
[0122]
图9a和9b各显示设计用于人braf rs3789806和il23r rs1884444snp的引物-阻断剂系统在相同反应中多重化。靶向阻断剂结合区域的相应下游的引物经设计且用作读取机制。
[0123]
图10显示引物或阻断剂与其他引物、阻断剂或模板的非特异性结合产生非特异性扩增。下图提供抑制引物和阻断剂的非特异性结合的保护剂设计。保护剂寡核苷酸与引物和阻断剂序列部分互补。存在化学计量过量的保护剂使得引物和阻断剂均位部分双链。阻断剂具有新区域11,其序列与核酸序列上的区域5不互补,并且保护剂具有新区域10,其序列与区域11互补。
[0124]
图11a和11b各显示用于检测缺失和插入的引物和阻断剂设计。引物为非靶向特异的,该方法还可用于检测碱基数量不确定或位置不确定的缺失或插入。
[0125]
图12显示本发明的较次实施方式,将引物置于snp位置的3’端并将阻断剂置于引物的5’端。该实施方式仅在第一循环产生杂交特异性,从而δcq比优选设计更小。
[0126]
图13证实在同源人dna大幅过量时,3种病原体真菌物种的真菌18s dna子序列的选择性扩增。由于真菌18s子序列及其同源人子序列在多个区域不同,针对正向引物和反向引物设计相应的阻断剂物以使扩增特异性最大化。
[0127]
图14描述就正向引物和反向引物的靶特异性扩增的应用,使用两组变体等位基因阻断剂,各引物使用一种。阻断剂彼此部分互补,但在操作条件下并不会彼此发生优势杂交。阻断剂和引物经设计使得正向引物不能延伸反向阻断剂,并且反向引物不能延伸正向阻断剂。图14显示初步实验结果。
[0128]
引物和阻断剂组合可应用至核酸的其他酶促扩增试验,包括但不限于切口酶扩增反应(near)、环介导等温扩增(lamp)和滚环扩增(rca)。
[0129]
本发明尤其适用于检测大幅过量变体中的小量靶标。对于本发明的癌症诊断检测,变体可指野生型dna序列,并且靶标可指癌症dna序列。对于本发明的感染性疾病诊断检测,变体可指病原体dna序列,并且靶标可指同源人dna序列。
实施例
[0130]
实施例1
[0131]
图4显示本发明实施例1的探针和阻断剂设计和两个人类储存样品na18537和na18562的smad7基因座周围的子序列。选择smad7基因座中健康人单核苷酸多态性(snp)rs4939827(c/t)用于概念验证。t等位基因作为靶标和c等位基因变体经任意指定。人储库基因组dna样品na18562(c等位基因的纯合子)和na18537(t等位基因的纯合子)购自相应的核苷酸序列从1000基因组网站获取。为了防止不需要的聚合,阻断剂在3’端用c3间隔子修饰。qpcr试验结果区分0.1%靶标(99.9%变体)与0%靶标(100%变体)。通过混合0.1%na18537和99.9%na185620.1%来制备0.1%靶标样品。100%变体和100%靶标之间的定量循环的平均差异(δcq)为14.8,100%变体(图中称为wt)和0.1%靶标之间的定量循环的平均差异为4.2。所有试验在bio-rad cfx96
tm qpcr仪器中的96孔板中进行。各孔中,在bio-rad itaq
tm
green supermix中混合200nm引物、2μm阻断剂和20ng人基因组dna。在3分钟的95℃初始处理后,进行65循环的95℃10秒变性步骤和60℃30秒的退火/延伸步骤。图5-12中所示的示例性实验使用相似方案。
[0132]
表-1
二聚体的形成和非特异性扩增。使用200nm的各种引物和2μm阻断剂,并且其他实验条件与实施例1所述相同。
[0141]
实施例5
[0142]
图8显示本发明实施例5所示的在3’端具有非同源性序列而不是非可延伸化学功能化的阻断剂。因为非同源序列不结合靶标或变体的下游区域,所以非同源区域能有效阻止酶促延伸。使用400nm的各种引物和4μm阻断剂,并且其他实验条件与实施例1所述相同。靶标cq和δcq值与实施例1所示的那些相似,表明与功能基团例如3-碳间隔子或双脱氧核苷酸类似,3’端的非同源序列能有效阻止酶促延伸。在图8中,fp、rp、和b分别代表正向引物、反向引物和阻断剂(用于正向引物)。
[0143]
实施例6
[0144]
图9a和9b显示本发明的实施例6.为了我们非等位基因特异性引物和等位基因特异性阻断剂的实时pcr实施方式,还需要非等位基因特异性的反向引物。green supermix和用于该实验,二者的结果之间没有显著差异。设计用于人braf rs3789806和il23r rs1884444snp的引物-阻断剂系统在相同反应中经多重化。靶向阻断剂结合区域的相应下游的引物经设计并且用作读取机制。braf rs3789806扩增子的探针用fam荧光团、iowa black fq淬灭剂、和内部zen淬灭剂修饰,并且il23r rs1884444扩增子的探针用cy5荧光团和iowa black rq淬灭剂修饰。图9a显示braf rs3789806 g等位基因和il23r rs1884444 t等位基因的多重检测的扩增结果。碱基鉴定表示阻断剂抑制何种等位基因(变体)。图9b显示对braf rs3789806 c等位基因和il23r rs1884444 g等位基因的多重检测。在各实验中,基因组dna样品与400nm各种引物、4μm各种阻断剂和200nm各种探针在bio-rad iq supermix中混合。qpcr方案与实施例所示相同。
[0145]
实施例7
[0146]
图10显示本发明实施例7所示的引物或阻断剂与其他引物、阻断剂或模板的非特异性结合。实施例7导致非特异性扩增。下图提供抑制引物和阻断剂的非特异性结合的保护剂设计。阻断剂具有新区域11,其序列与核酸序列上的区域5不互补,并且保护剂具有新区域10,其序列与区域11互补。
[0147]
实施例8
[0148]
图11a和11b显示本发明实施例8所示的用于检测缺失和插入的引物和阻断剂设计。del rs200841330用于显示概念验证结果。使用400nm的各种引物和4μm阻断剂,并且其他实验条件与实施例1所述相同。由于引物为非等位基因特异的,该方法还可用于检测碱基数量不确定或位置不确定的缺失或插入。
[0149]
实施例9
[0150]
图12显示本发明的实施例9所示的将引物置于snp位置的3’端并将阻断剂置于引物的5’端。实施例9仅在第一循环产生杂交特异性,从而δcq比优选设计更小。引物浓度为400nm,阻断剂浓度为4μm。实验条件与实施例1所示相同。
[0151]
实施例10
[0152]
图13显示本发明实施例10所示的在同源人dna大幅过量时,3种病原体真菌物种的
真菌18s dna子序列的选择性扩增。由于真菌18s子序列及其同源人子序列在多个区域不同,针对正向引物和反向引物设计相应的阻断剂物以使扩增特异性最大化。3种真菌物种的18s子序列的gblock片段(经验证的400bp双链dna序列,idt)和人中的一致序列用于该实验。各真菌dna gblock片段的60,000拷贝(0.1%)、60拷贝(0.0001%)和0拷贝(100%人)与60,000,000拷贝的人dna分别混合。在所有情况中,结果检测稀有序列低至1百万中的1份。使用200nm的各种引物和1μm的各种阻断剂,并且其他实验条件与实施例1所述相同。
[0153]
实施例11
[0154]
图14显示本发明的实施例11。图14描述就正向引物和反向引物的等位基因特异性扩增的应用;使用两组变体等位基因阻断剂,各引物使用一种。阻断剂彼此部分互补,但在操作条件下并不支持彼此发生优势杂交。阻断剂和引物经设计使得正向引物不能延伸反向阻断剂,并且反向引物不能延伸正向阻断剂。图14显示初步实验结果。
[0155]
以上本发明的具体实施方式的描述是为了阐述和说明的目的。对这些示例性实施方式进行选择和描述,以更好地解释本发明的原理及其实施,使得本领域其它技术人员能够更好地利用本发明和各种实施方式和各种改良,使其适用于预期的特定用途。
