1.本发明涉及环境微生物技术领域,具体涉及一种复合菌剂及其应用。
背景技术:
2.我国是抗生素生产和使用大国,抗生素菌渣的产生量约2.0x106吨,占全球总量70%。2016年抗生素菌渣被收入修改后的《国家危险废物名录》,由于抗生素菌渣含有一定量的抗生素残留,不合理的处理方法对环境和生态会造成污染和危害。
3.运用传统方法处理抗生素菌渣,处理成本高且容易产生二次污染,在焚烧的过程中会产生含有氯的烟气、so2、甚至是二噁英等有害气体。我国是制药大国,每年产生几百万吨的抗生素废渣,因此迫切寻找一个高效、环保的处理方法。
4.堆肥是一种传统又经济环保的方法,是一种广泛应用的好氧发酵技术,通过好氧微生物的新陈代谢,复杂的有机物被分解,可以将有机废物转化为有价值的有机土壤改良剂。利用堆肥技术,通过添加发酵菌和抗生素降解菌,对抗生素菌渣进行无害化处理,堆肥成品可资源化用作有机肥,实现减量化、无害化、资源化。
5.目前,国内外微生物发酵菌剂的研究均偏重于以芽孢杆菌、曲霉菌等常温和中温菌株进行微生物菌剂的开发,但其对成分复杂的抗生素菌渣等危险废弃物腐熟周期长、效率差且易产生二次污染。而关于堆肥用超高温嗜热菌剂的报道不多,尤其是针对堆肥制备具有良好适应性和功能性的超高温嗜热菌剂产品更是少有研究。
技术实现要素:
6.本发明的目的是提供一种腐熟周期短、降解效率好的复合菌剂及其在降解土霉素菌渣中的应用。
7.本发明采用如下技术方案:一种复合菌剂,其包括普通高温放线菌cx40-2、里氏木霉、热反硝化地芽孢杆菌和草炭土;其制备方法为:(1)将普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌经过培养获得发酵液;(2)按照普通高温放线菌cx40-2发酵液、里氏木霉发酵液和热反硝化地芽孢杆菌发酵液的体积比为1∶1~4∶1~3进行配比,获得复合菌液;(3)将复合菌液按照每600ml复合菌液加入1000g草炭土进行混合,风干后得到复合菌剂。
8.进一步的,所述普通高温放线菌(thermoactinomyces vulgaris)cx40-2的保藏号为cgmcc no.23620。
9.进一步的,所述热反硝化地芽孢杆菌(geobacillus thermodenitrificans)的保藏号为cgmcc no.23318。
10.进一步的,步骤(2)中,所述普通高温放线菌cx40-2发酵液、里氏木霉发酵液和热反硝化地芽孢杆菌发酵液的体积比为1∶4∶3。
11.进一步的,步骤(1)中,将普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌分别经活化、一级种子培养、二级种子培养以及扩大培养后得到发酵液。
12.进一步的,所述复合菌剂的有效活菌数大于3
×
108cfu/g。
13.一种上述复合菌剂在处理土霉素菌渣中的应用。
14.一种上述复合菌剂用于处理土霉素菌渣的方法,其包括如下步骤:(a)含水率为6~10%的玉米秸秆经粉碎至1~2 cm;(b)将含水率为50~70%的土霉素菌渣与粉碎后的玉米秸秆按照质量比为2~3∶1进行混合,得到发酵原料;(c)在发酵原料中添加复合菌剂,所述复合菌剂的添加量为发酵原料质量的0.2~0.3%,得到混合物料;(d)调整混合物料的含水率为50~65%进行堆肥发酵35~45天;发酵期间每周进行一次翻堆操作。
15.本发明的有益效果在于:本发明提供的普通高温放线菌cx40-2具有极端高温活性,能在90℃的高温下保持生长,且其适宜生长温度范围较广,可在40-90℃保持较高活性。同时,本发明提供的普通高温放线菌cx40-2具有很强的对抗外界有害因子(酸碱和盐度)或不良刺激的能力,能够在较宽的ph(4.0-11.0)环境中生存并保持较高活性,且提高了菌渣中抗生素残留去除率。
16.本发明的复合菌剂中包括普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌,具有协同作用,用于成分复杂的抗生素菌渣等危险废弃物的腐熟发酵中时,可显著提高堆肥温度、延长发酵的高温期,可使整个腐熟周期缩短至40天,使抗生素残留去除率最高达到91%。
附图说明
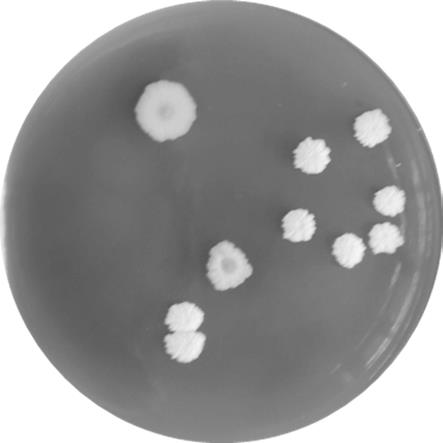
17.图1为本发明的普通高温放线菌cx40-2的菌落形态图。
18.图2为热反硝化地芽孢杆菌最佳投加量实验图。
19.图3为里氏木霉最佳投加量实验图。
20.图4为普通高温放线菌cx40-2最佳投加量实验图。
21.图5为1∶1∶1复合菌剂与空白试验处理后菌渣抗生素残留量对比图。
22.图6为1∶1∶1复合菌剂与市售菌剂处理后菌渣抗生素残留量对比图。
23.图7为本发明的复合菌剂处理后菌渣抗生素残留量对比图。
具体实施方式
24.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
25.实施例11.1菌株的分离
从河北省石家庄市餐厨垃圾堆肥厂堆肥产物样品,在60℃条件下,用稀释涂平板的方法通过lb培养基(配方:胰蛋白胨10g/l、酵母提取物5g/l、nacl10g/l)进行分离,得到21个菌株,将其进行5次平板传代后,获得稳定遗传的单克隆菌株,并在-80℃进行保存。
26.将分离的21个单克隆菌株用脱脂乳固体培养基(配方:0.36g/lkh2po4、0.5g/lmgso4·
7h2o、0.014g/lzncl2、1.07g/lna2hpo4·
7h2o、0.16g/lnacl、0.002g/lcacl2、0.002g/lfeso4、4g/l脱脂乳粉、20g/l琼脂,ph7.0~7.4,121℃高压灭菌15min),在60℃恒温箱中培养72h,根据培养基菌落的透明圈指数(透明圈直径d/菌落直径d≥3),分离筛选耐高温、分泌蛋白且活性高的菌株,获得17株具有耐高温、高活性蛋白酶的菌株,于-80℃保存。
27.1.2 土霉素抗性菌株的筛选(a)样品预处理:取上述样品装入已灭菌并盛装有无菌水的容器中,密封后均匀震荡30min,静置悬浮液,取上清液离心后取上层菌液为菌悬液,备用。
28.(b)富集培养:分别取菌悬液2ml接种于200ml液体培养基中,置于60℃恒温培养箱中培养48h,得到扩大菌种培养液。
29.(c)梯度稀释:将1ml菌液和配制好的9ml生理盐水(0.8%nacl)混合,即配制成稀释梯度为10-1
的菌液,再取稀释梯度为10-1
的菌液1ml与9ml生理盐水混匀配制成稀释梯度为10-2
的菌液,依此类推,直至得到10-2
~10-5
的稀释液。
30.1.3土霉素标准曲线的测定分别取 100mg/ml的注射用硫酸土霉素的水溶液50
µ
l、150
µ
l、200
µ
l、250
µ
l、300
µ
l、350
µ
l、400
µ
l、450
µ
l于土霉素降解菌的筛选及其降解性的初步测定10ml容量瓶中,向容量瓶内分别加入 2ml naoh(1mol/l),沸水浴中加热10分钟,取出冷却至室温后分别加入 2ml hcl(1mol/l)并摇匀,然后分别加入2%的硫酸硫酸氢铵溶液。混匀后用蒸馏水定容至刻度,再用紫外分光光度计检测 od
528 值。
31.1.4土霉素降解菌的筛选将筛选得到的土霉素抗性菌培养过夜后,次日按5%接种量转接于100ml lb液体培养基中,培养一段时间后加入100mg/ml的土霉素使其最终浓度为300
µ
g/ml,20h后分别取 5ml菌液8000rpm离心10min,然后取 3ml利用紫外分光光度法测定菌液中残留土霉素的浓度。
32.1.5土霉素降解菌初步鉴定革兰氏染色,为革兰氏阳性菌。
33.1.6土霉素降解菌降解活性的测定过夜培养菌液土霉素降解菌,按5%接种量转入盛有100ml液体lb培养基的三角瓶内,培养5h,分别加入100mg/ml的土霉素,使其最终浓度分别为300
µ
g/ml、500
µ
g/ml、900
µ
g/ml、1200
µ
g/ml,50℃、120rpm摇床培着,6h开始取样,每隔 3h取一次样,每次取样2ml,测定菌液中剩余的土霉素含量。
34.检测菌渣的降解情况,有6株具有耐高温、高活性蛋白酶的菌株的抗生素降解率。菌渣降解率如表1所示,将其中土霉素降解最佳的菌株cx40-2,于-80℃保存。所述菌渣降解率(%)=(w
0-wi)/w0×
100%,w0代表接种菌株前培养基中菌渣的干质量(g);wi代表培养结束后培养基中菌渣的干质量(g)。
35.表1
ꢀ
。
36.1.7菌株cx40-2的16s rrna鉴定取-80℃保存的cx40-2菌株在lb固体培养基上60℃培养2天。观察菌落形态,菌落表面粗糙不透明,污白色或微黄色,如图1所示;显微镜观察细胞形态,细胞呈杆状,直径0.6 ~1.0
µ
m,长1.5 ~2.0
µ
m,芽孢中生,椭圆。
37.提取cx40-2菌株的基因组dna,以cx40-2菌株的基因组dna为模版,用16srrna通用引物的上游引物27f:5
´‑
agagtttgatcctggctc-3
´
和下游引物1492r:5
´‑
ggttaccttgttacgactt-3
´
进行pcr扩增。pcr扩增程序为:95℃预变性5min;95℃变性30s,55℃退火45s,72℃延伸60s,30个循环;72℃延伸10min。电泳检测扩增产物纯度和大小,将扩增长度正确的pcr产物送上海生工进行测序,测序序列如seq id no.1所示,并在ncbi进行blast比较分析,根据blast结果,该cx40-2菌株与普通高温放线菌thermoactinomyces vulgaris的16srrna基因序列的相似性为99.72%。
38.综合菌落形态及和16srrna序列,可以确定本发明cx40-2菌株属于普通高温放线菌thermoactinomycesvulgaris,命名为普通高温放线菌cx40-2,并于2021年10月18日保存于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏号为cgmccno.23620。
39.1.8普通高温放线菌cx40-2的生理特征鉴定将-80℃保存的普通高温放线菌cx40-2划线接种于lb平板上,分别在40℃、45℃、50 ℃、55℃、60℃、65℃、70℃和75℃的温度条件下培养3d,观察不同温度条件下菌株cx40-2的生长状况,结果如表2所示。
40.表2不同温度下cx40-2的生长状况。
41.注:+表示可以生长(固体培养基上有菌落),++生长状况良好(固体培养基上的菌
落数在10-50个),+++生长旺盛(固体培养基上的菌落数大于50个)。
42.由表2可知,普通高温放线菌cx40-2能在高温条件下的lb培养基上生长良好,属于耐高温菌。
43.取上述1ml的cx40-2的lb培养液,分别接种至ph为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0、10.0和11的纤维素刚果红固体培养基上,60℃培养3d,观察不同温度条件下cx40-2的生长状况,结果如表3所示。
44.表3不同ph下cx40-2的生长状况。
45.注:+表示可以生长(固体培养基上有菌落),++生长状况良好(固体培养基上的菌落数在10-50个),+++生长旺盛(固体培养基上的菌落数大于50个)。
46.由表3可知,普通高温放线菌cx40-2能在极端ph条件下的纤维素刚果红培养基上生长良好,属于耐酸碱菌。
47.实施例22.1复合菌种的选择里氏木霉为市售产品,购自北京科展生物科技有限公司,id号为63606,产品编号为c262。
48.热反硝化地芽孢杆菌的保藏号为cgmccno.23318,保藏于中国微生物菌种保藏管理委员会普通微生物中心。
49.依照实施例1的1.6节中的方法,测定里氏木霉以及热反硝化地芽孢杆菌对土霉素降解菌降解活性,如下表4所示,结果表明,三种菌株均表现出对土霉素的降解活性。
50.表4。
51.2.2复合菌种的共同培养将三种菌种进行共同培养,探究菌种之间是否会产生拮抗或营养竞争的情况。
52.实验方法为:配置lb固体培养基,灭菌,等培养基温度降至50℃时,使用灭菌的移液枪,移取0.1ml某一种菌液(每20ml培养基)至还未成型的固体培养基,混匀后制作平板培养基,水平静置凝固、备用;然后将,将另一种菌点接于已经制作好的固体培养基上,放入培养箱中进行培养;培养48h 后观察是否有抑菌圈形成。菌种两两组合后进行共同培养后的结果如表5所示。
53.表5菌株亲和性试验结果。
54.注:+表示有抑菌圈形成,-表示无抑菌圈形成表5可知,普通高温放线菌cx40-2、里氏木霉、热反硝化地芽孢杆菌的菌落相互接触,未产生抑菌圈。因此判定三种菌剂之间不存在相互抑制生长的影响。
55.实施例3将普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌制备复合菌剂,具体方法如下。
56.(1)普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌分别进行培养,分别获得不同菌种的发酵液。
57.a、普通高温放线菌cx40-2的培养菌种活化:将-80℃保存的cx40-2菌株划线接种于高氏一号平板上,50℃培养24h。
58.一级种子培养:用接种环刮去lb平板上的菌落并接种于装有豆饼粉液体培养基的三角瓶中,60℃、200r/min摇床培养24h。
59.二级种子发酵:将上述一级种子培养液按10%的接种量接种于装有10l的豆饼粉液体培养基的种子罐中,60℃、200rpm/min发酵1d。
60.扩大培养:将得到的二级种子发酵液按5%的接种量接种于装有50l的豆饼粉液体培养基的发酵罐中,60℃、200rpm/min发酵2d。
61.b、里氏木霉的培养菌种活化:将-80℃保存的里氏木霉菌株划线接种于pda培养基上,37℃培养24h。
62.一级种子培养:将接种于装有pda液体培养基的三角瓶中,37℃、140r/min摇床培养24h。
63.二级种子发酵:将上述一级种子培养液按10%的接种量接种于装有10l的pda液体培养基的种子罐中,60℃、140rpm/min发酵1d。
64.扩大培养:将得到的二级种子发酵液按5%的接种量接种于装有50l的pda液体培养基的发酵罐中,60℃、140rpm/min发酵2d。
65.c、热反硝化地芽孢杆菌的培养菌种活化:将-80℃保存的热反硝化地芽孢杆菌菌株划线接种于lb平板上,50℃培养24h。
66.一级种子培养:用接种环刮去lb平板上的菌落并接种于装有lb液体培养基的三角瓶中,60℃、140r/min摇床培养24h。
67.二级种子发酵:将上述一级种子培养液按10%的接种量接种于装有10l的lb液体培养基的种子罐中,60℃、140rpm/min发酵1d。
68.扩大培养:将得到的二级种子发酵液按5%的接种量接种于装有50l的lb液体培养基的发酵罐中,60℃、140rpm/min发酵2d。
69.(2)普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌的发酵液配比将三株菌获得的发酵液按不同比例混合,考察投加不同比例菌株的混合菌液中土霉素降解菌降解活性的变化。
70.通过单因素实验,确定普通高温放线菌cx40-2、里氏木霉、热反硝化地芽孢杆菌的最佳投加量。根据极差的大小确定优化比例顺序,先对极差的因素进行单因素实验。控制极差较低的两个因素在均值最高的水平作为固定条件,在将极差最大的因素在以均值最高的水平为中心点,上下各取两个数值设置5个梯度进行实验,以5个不同投加量的混合菌液的土霉素降解菌降解活性确定最佳菌液投加量,以此方法以此对三株菌的最佳投加量进行确定。
71.表6正交试验因素水平表。
72.表7正交试验计划表。
73.表8 正交试验结果。
74.三株菌株混合后对于均高于单菌株,说明三菌株之间在土霉素降解菌降解土霉素上具有较好的协同作用。根据土霉素降解率结果,普通高温放线菌cx40-2∶里氏木霉∶热反硝化地芽孢杆菌的体积比为1∶3∶2时最高。
75.单因素实验应根据极差的大小确定优化比例顺序为热反硝化地芽孢杆菌、普通高温放线菌cx40-2、里氏木霉。热反硝化地芽孢杆菌的投加量是混合菌液体系影响降解土霉素的主要因素,正交实验确定其投加量为2ml时降解率最佳。
76.确定热反硝化地芽孢杆菌的优化浓度设置为1.50ml、1.75ml、2.00ml、2.25ml、2.50ml,实验结果如图2。随着热反硝化地芽孢杆菌的投加量增加,混合菌液的降解土霉素的速率上升,在2.25 ml时,降解率最高。确定热反硝化地芽孢杆菌的最佳投加量是2.25 ml。
77.初步确定混合菌液中普通高温放线菌cx40-2、里氏木霉、热反硝化地芽孢杆菌的比例为1∶3∶2.25,继续经过普通高温放线菌cx40-2、里氏木霉的单因素实验确定普通高温放线菌cx40-2、里氏木霉和热反硝化地芽孢杆菌最佳体积比例为1∶4∶3。如图3和图4所示。此时混合菌剂中对于抗生素降解率达到42.09%。
78.(3)将复合菌液按照每600ml复合菌液加入1000g草炭土进行混合,风干后得到复合菌剂。
79.实施例4根据gb20287-2006中的规定,适用于堆肥的菌剂的有效活菌数需要≥1
×
108cfu/ml,所以需要对自制的菌剂进行菌数的测定。
80.测定方法:称取已制备好的1∶4∶3比例的复合菌剂10g。放入到250ml锥形瓶中,加入90ml的无菌水,静置20min,之后在振荡摇床上以200rpm/min的转速振荡30min。用移液枪吸取0.5ml的菌液,至于45ml的无菌水中,按照10∶1的比例依次进行稀释。
81.取10-7
、10-8
、10-9
三个梯度、用移液枪分别吸取这三个梯度的菌液0.1ml,将菌液打入固体培养基平板上,用涂布棒进行涂布。之后放入30℃培养箱中进行培养,时间48h。
82.培养结束之后,选取有效平板(菌落数在30至300之间),进行计数。通过计数法测定,复合菌剂的有效活菌数为3
×
108cfu/g,符合gb20287-2006中的规定。
83.实施例5以土霉素菌渣和玉米秆秸为原料,利用实施例3中的固体菌剂进行堆肥。
84.原料预处理:板框压滤前的土霉素菌渣(含水率74.68%),玉米秸秆(含水率10.67%),菌渣经过粉碎处理,将玉米秸秆打碎至长度1~2 cm;然后与粉碎后的菌渣按照质量比为3∶1(菌渣∶玉米秸秆)混合,接种复合菌剂,接种量为发酵原料质量的0.2%;混合后原料的初始c/n比为20~25,含水率为60%;每周进行一次翻堆操作。
85.本实验建立六组平行实验,包括分别以普通高温放线菌cx40-2、里氏木霉、热反硝化地芽孢杆菌三种发酵液体积比为1∶1∶1、1∶2∶2、1∶3∶2、1∶4∶3的比例复合制备复合菌剂,空白实验以及市售产品(南华千牧生物菌肥发酵剂),各菌剂分别添加进土霉素菌渣与玉米秸秆共堆肥。结果如图6~图7所示。
86.本发明的四种复合菌剂发酵第二天温度就分别达到65.12℃、66.3℃、69.72℃、73.6℃,最高温度达到了76.7℃,高温期维持时间为14天,抗生素残留的去除率分别达到68%、77%、82%、91%,本发明的复合菌剂在35-40天时即可使堆肥达到完全腐熟,较空白实验的堆肥时间缩短15d左右。
87.发酵过程结束之后,发酵产物经微生物检测,其大肠杆菌和蛔虫卵的杀灭率均达到100%。
88.发酵产物呈松散状态且没有任何氨臭味,含水率为30%,种子发芽指数为108%,无渗滤液产生。
89.种子发芽指数通过如下方法进行测定:取10g堆肥样品,放入250ml锥形瓶中,加入100ml蒸馏水,之后放入摇床振荡,150rpm/min,30min。取其上清液,过滤后吸取5ml 滤液于铺有滤纸的培养皿中,滤纸上放置20颗小白菜种子,25℃下避光培养48h 后,测定种子的跟长,上述实验设置5组重复,同时用去离子水做空白对照。
90.计算公式:f=(a1×ꢀ
a2)/(b1×ꢀ
b2)
×
100式中:f——种子发芽指数,%;a1——样品滤液培养种子的发芽率,%;a2——样品滤液培养种子的根长,mm;b1——去离子水种子的发芽率,%;b2——去离子水种子的根长,mm。
91.本发明提供的利用所述固体菌剂进行土霉素菌渣堆肥的方法中,在堆肥原料中接入菌剂,可进一步缩短腐熟时间,在保持较高无害化处理的条件下,可使整个腐熟周期缩短至40天,使抗生素残留去除率最高达到91%。
