一种具有p-o-c-p结构的双磷化物的制备方法
技术领域
1.本发明属于有机合成领域,具体涉及一种双磷化物的高效制备方法,进一步的为一种具有p-o-c-p结构的双磷化物的制备方法。
背景技术:
2.分子中具有p-o-c-p结构的双磷化物是一类重要的有机膦分子。其在人类生产、生活的多个领域均有广泛的应用。例如,在有机合成领域,其可以作为关键合成中间体用以制备功能有机分子(cn104418887a);在生物化学领域,双磷化物mifobate(sr-202)是一种已经商业化的、高效的pparγ(过氧化物酶体增殖物激活受体γ)拮抗剂,其在不影响pparα,pparβ或fxr的转录活性的基础上可以选择性的抑制噻唑烷二酮(tzd)诱导的pparγ转录活性(rieusset,j.;etal.molecularendocrinology.2002,16,2628;wu,h.s.;etal.actapharmacolsin.2007,28,417);尤其在材料学领域,双磷化物既可以作为优良的牙科材料(ep3225228a1),还能作为一类高效的有机磷阻燃剂被广泛的用于聚合物阻燃领域(wang,x.;etal.progressinorganiccoatings,2011,71,72;cn110229190a)。
3.目前,制备具有p-o-c-p结构的双磷化物主要通过磷试剂与酰基膦、α-羟基磷等试剂反应来进行合成,无论是酰基膦还是α-羟基膦类试剂,都需要预先通过一步或者多步反应进行制备,这无疑增加了制备双磷化产物的合成步骤,导致其制备成本高、经济性低;除此之外,大部分酰基膦化合物,尤其是酰基二芳基膦的化学性质极不稳定,室温下就容易分解,因此这也增加了其作为底物制备双磷化物的操作难度。
4.因此,开发操作简单、安全高效、经济性好的合成方法,用以制备具有p-o-c-p结构的双磷化物无论在实际生产或者科学研究领域中都将具有良好的应用前景。
技术实现要素:
5.为解决上述技术问题,本发明提供一种含有p-o-c-p结构的双磷化物,以及提供一种催化合成的方法用以制备上述含有p-o-c-p结构的双磷化物。本发明的制备方法反应体系简单、原料便宜易得、安全高效、便于操作,而且具有广泛的反应底物适用性,除了多种含羰基的化合物(酸酐、酰氯、酯、过氧化物)均能应用于该方法外,多种磷试剂也能进行反应,通过该方法可以一锅法一步合成多种含有p-o-c-p结构的双磷化合物。
6.实现本发明的技术方案如下:
7.一种具有p-o-c-p结构的双磷化物的制备方法,所述的方法以含羰基的化合物、磷试剂为起始原料,于氮气氛围中,在催化量碱的作用下,按摩尔比,所述含羰基的化合物:磷试剂:碱的比例为1:2~5:0.1~0.5,加入有机溶剂使所述磷试剂的浓度为0.05-0.3mol/l,于反应温度60-120℃下反应6~16小时,然后通过经柱层析制备得到具有结构通式(i)的双磷化合物,
[0008][0009]
其中,式i中r1、r2为芳基;
[0010]
所述含羰基的化合物选自下列结构式ii~v中的任意一种:
[0011][0012]
所述含羰基的化合物选自结构ii时,r选自c1-c8的直链烷基、甲氧基甲基、三氟甲基、五氟乙基、异丙基、异丁基、苯基、对甲基苯基、对甲氧基苯基、对氟苯基、对氯苯基中的任意一种;
[0013]
所述含羰基的化合物选自结构简式iii时,r选自烷基或者芳基;
[0014]
所述含羰基的化合物选自结构简式iv时,r选自三氟甲基,r3选自甲基或者乙基;
[0015]
所述含羰基的化合物选自结构简式v时,r选自苯基或者正十一烷基。
[0016]
优选,所述含羰基的化合物选自乙酸酐、丙酸酐、丁酸酐、己酸酐、甲氧基乙酸酐、三氟乙酸酐、五氟丙酸酐、异戊酸酐、异丁酸酐、苯甲酸酐、4-甲基苯甲酸酐、4-甲氧基苯甲酸酐、4-氟苯甲酸酐、4-氯苯甲酸酐、乙酰氯、苯甲酰氯,三氟乙酸乙酯、过氧化月桂酰、过氧化苯甲酰中的任意一种。
[0017]
优选,所述二芳基氧化磷选自二苯基氧化磷、二(4-甲基苯基)氧化磷、二(4-甲氧基苯基)氧化磷、二(4-叔丁基苯基)氧化磷、二(4-氟苯基)氧化磷、二(4-溴苯基)氧化磷、二(4-三氟甲基苯基)氧化磷、二(3-甲基苯基)氧化磷、二(3,5-二甲基苯基)氧化磷、二(2-萘基)氧化磷中的任意一种;
[0018]
优选,所述碱选自吡啶、2,6-二氯吡啶、dmap(4-二甲氨基吡啶)、dbu(1,8-二氮杂双环[5.4.0]十一碳-7-烯)、碳酸钠、碳酸氢钠、磷酸钾中的任意一种,优选为dmap。
[0019]
优选,所述有机溶剂选自甲苯、乙腈、四氢呋喃(thf)、1,4-二氧六环中的任意一种,进一步优选为甲苯。
[0020]
优选,所述含羰基的化合物:磷试剂:碱的投料摩尔比为1:2~5:0.1~0.5,进一步优选为1:3:0.2。
[0021]
优选,所述磷试剂的浓度为0.05~0.3mol/l,优选为0.1mol/l。
[0022]
与现有技术相比,本发明的有益效果:
[0023]
1、本发明所用反应试剂不仅安全稳定、易于保存,而且价格低廉、绿色环保,避免了使用稳定性差、不易保存、毒性较大的酰基磷、磷酰氯作为原料;本发明中所用的含羰基化合物(酸酐、酰氯、酯、过氧化物)、磷试剂(二芳基氧化磷)普遍易得、毒性低、稳定性好,尤其是本发明所用的碱性促进剂(dmap),不仅稳定、低毒,而且成本十分廉价(dmap:99%,1kg,150元),这使得本发明绿色环保、经济性高,生产安全性高,适合大规模生产。
[0024]
2、本发明中只需要催化量(20mol%)的dmap就能促进磷试剂与含羰基类化合物(酸酐、酰氯、酯、过氧化物)的双磷化反应,因此反应具有高效性和经济性;目前,在已报道的双磷化物的制备反应中,均需要加入比反应底物过当量的促进剂来完成反应([1]sun,
y.w.;etal.tetrahedron,2012,68,9924;[2]r
á
dai,z.;etal.mendeleevcommun.,2019,29,153;[3]hosseini,a.;etal.phosphorus,sulfur,andsilicon,2011,186,225),因此使用催化量的碱性促进剂来高效的实现该类双磷化反应对本领域的技术人员来说,预先是难以想到的,同时也是本发明的创新之处。
[0025]
3、本发明所用的底物(含羰基化合物、磷试剂以及碱性试剂)都是商品化试剂,均可以购买得到,与传统合成方法相比,无需增加额外的合成步骤对底物进行预制备,因此本发明在缩短了合成步骤的同时,避免了大量有毒副产物的生成,节约了反应成本,具有较高的步骤经济性和原子经济性。
[0026]
4、本发明制得的大部分具有p-o-c-p结构的双磷化物为首次报道,而且分子中具有p-o-c-p结构的双磷化物是一类重要的有机膦分子,在人类生产、生活的多个领域均有广泛的应用,尤其能作为一类高效的有机磷阻燃剂被广泛的用于聚合物阻燃领域。
具体实施方式
[0027]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。实施例一:
[0028]
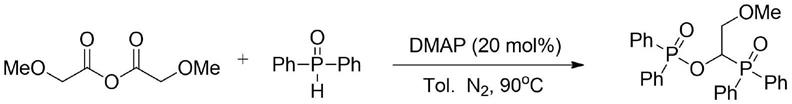
以乙酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0029][0030]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)二苯基膦酸乙酯,产率为85%。
[0031]1h nmr(500mhz,cdcl3):δ7.97-7.93(m,2h),7.79-7.76(m,2h),7.70-7.66(m,2h),7.56-7.50(m,3h),7.46-7.39(m,7h),7.28-7.24(m,4h),5.46-5.42(m,1h),1.52(dd,j=6.9hz,14.5hz,3h).
[0032]
下面将列举后续实施例二至二十七证明本发明制备方法的普适性。
[0033]
实施例二:
[0034]
以丙酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0035][0036]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和丙酸酐(26.0mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)丙基二苯基膦酸酯,产率为76%。
[0037]1h nmr(500mhz,cdcl3):δ7.96-7.92(m,2h),7.79-7.75(m,2h),7.72-7.68(m,2h),7.51-7.48(m,2h),7.46-7.7.36(m,8h),7.30-7.7.26(m,2h),7.22-7.18(m,2h),5.43-5.38
(m,1h),2.05-1.93(m,2h),0.85(t,j=7.5hz,3h).
[0038]
实施例三:
[0039]
以丁酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0040][0041]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和丁酸酐(31.6mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)二苯基膦酸丁酯,产率为72%。
[0042]1h nmr(500mhz,cdcl3):δ7.95-7.91(m,2h),7.78-7.74(m,2h),7.71-7.67(m,2h),7.51-7.48(m,2h),7.46-7.7.35(m,8h),7.30-7.7.26(m,2h),7.22-7.18(m,2h),5.49-5.44(m,1h),1.92-1.85(m,2h),1.36-1.21(m,2h),0.66(t,j=7.4hz,3h).
[0043]
实施例四:
[0044]
以甲氧基乙酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0045][0046]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和甲氧基乙酸酐(32.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(甲氧基)甲基二苯基膦酸酯,产率为78%。
[0047]1h nmr(500mhz,cdcl3):δ7.95-7.91(m,2h),7.84-7.80(m,2h),7.74-7.69(m,2h),7.54-7.36(m,10h),7.28-7.18(m,4h),5.68-5.63(m,1h),3.82-3.78(m,1h),3.73-3.68(m,1h),2.85(s,3h).
[0048]
实施例五:
[0049]
以三氟乙酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0050][0051]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和三氟乙酸酐(42.0mg,0.2mmol),将反应置于120℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)-2,2,2-三氟乙基二苯基膦酸酯,产率为52%。
[0052]
1h nmr(500mhz,cdcl3):δ7.92-7.83(m,4h),7.74-7.70(m,2h),7.55-7.50(m,2h),7.46-7.32(m,8h),7.30-7.26(m,2h),7.22-7.19(m,2h),6.01-5.93(m,1h).
[0053]
实施例六:
[0054]
以五氟丙酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0055][0056]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和五氟丙酸酐(62.0mg,0.2mmol),将反应置于120℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)-2,2,3,3,3-五氟丙基二苯基膦酸酯,产率为46%。
[0057]
1h nmr(500mhz,cdcl3):δ7.91-7.81(m,4h),7.73-7.69(m,2h),7.50-7.47(m,2h),7.41-7.33(m,8h),7.30-7.27(m,2h),7.22-7.19(m,2h),6.18-6.10(m,1h).
[0058]
实施例七:
[0059]
以3-甲基丁酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0060][0061]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和3-甲基丁酸酐(37.2mg,0.2mmol),将反应置于120℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)-3-甲基丁基二苯基膦酸酯,产率为71%。
[0062]
1h nmr(500mhz,cdcl3):δ7.95-7.91(m,2h),7.80-7.76(m,2h),7.72-7.67(m,2h),7.50-7.46(m,2h),7.42-7.28(m,10h),7.21-7.17(m,2h),5.56-5.52(m,1h),1.93-1.85(m,1h),1.67-1.60(m,1h),1.53-1.46(m,1h),0.73(d,j=6.5hz,3h),0.63(d,j=6.6hz,3h).
[0063]
实施例八:
[0064]
以异丁酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0065][0066]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和异丁酸酐(31.6mg,0.2mmol),将反应置于120℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)-2-甲基丙基二苯基膦酸酯,产率为42%。
[0067]
1h nmr(500mhz,cdcl3):δ7.92-7.87(m,2h),7.83-7.73(m,4h),7.50-7.39(m,6h),7.35-7.23(m,6h),5.54(dd,j1=2.7hz,j2=11.6hz,1h),2.35-2.26(m,1h),1.00(d,j=6.9hz,3h),0.85(d,j=7.0hz,3h).
[0068]
实施例九:
[0069]
以苯甲酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0070][0071]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和苯甲酸酐(45.2mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(苯基)甲基二苯基膦酸酯,产率为75%。
[0072]
1h nmr(500mhz,cdcl3):δ8.03-7.99(m,2h),7.62-7.53(m,3h),7.49-7.24(m,13h),7.17-7.08(m,5h),7.02(t,j=7.7hz,2h),6.30(dd,j1=2.5hz,j2=10.4hz,1h).
[0073]
实施例十:
[0074]
以4-甲基苯甲酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0075][0076]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和4-甲基苯甲酸酐(50.8mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(对甲苯基)二苯基膦酸甲酯,产率为80%。
[0077]
1h nmr(500mhz,cdcl3):δ8.02-7.98(m,2h),7.64-7.60(m,2h),7.54-7.51(m,1h),7.47-7.38(m,6h),7.35-7.29(m,5h),7.27-7.22(m,2h),7.16-7.12(m,2h),7.06(d,j=7.1hz,2h),6.82(d,j=7.9hz,2h),6.27(dd,j1=2.3hz,j2=10.2hz,1h),2.18(s,3h).
[0078]
实施例十一:
[0079]
以4-甲氧基苯甲酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0080][0081]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和4-甲氧基苯甲酸酐(57.2mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(4-甲氧基苯基)甲基二苯基膦酸酯,产率为77%。
[0082]
1h nmr(500mhz,cdcl3):δ8.03-7.99(m,2h),7.62-7.52(m,3h),7.49-7.37(m,6h),7.34-7.29(m,5h),7.27-7.22(m,2h),7.17-7.12(m,4h),6.56(d,j=8.7hz,2h),6.26(dd,j1=1.9hz,j2=10.1hz,1h),3.69(s,3h).
[0083]
实施例十二:
[0084]
以4-氟苯甲酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0085][0086]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和4-氟苯甲酸酐(52.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(4-氟苯基)甲基二苯基膦酸酯,产率为76%。
[0087]
1h nmr(500mhz,cdcl3):δ8.03-7.99(m,2h),7.62-7.54(m,3h),7.50-7.38(m,6h),7.35-7.30(m,5h),7.28-7.24(m,2h),7.18-7.15(m,4h),6.70(t,j=8.7hz,2h),6.30(dd,j1=2.2hz,j2=10.1hz,1h).
[0088]
实施例十三:
[0089]
以4-氯苯甲酸酐和二苯基氧化磷为原料,反应式和实验步骤如下:
[0090][0091]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和4-氯苯甲酸酐(58.8mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(4-氯苯基)(二苯基磷酰基)甲基二苯基膦酸酯,产率为76%。
[0092]
1h nmr(500mhz,cdcl3):δ8.03-7.99(m,2h),7.62-7.54(m,3h),7.50-7.38(m,6h),7.35-7.30(m,5h),7.28-7.24(m,2h),7.18-7.15(m,4h),6.70(t,j=8.7hz,2h),6.30(dd,j1=2.2hz,j2=10.1hz,1h).
[0093]
实施例十四:
[0094]
以乙酸酐和二(4-氟苯基)氧化磷为原料,反应式和实验步骤如下:
[0095][0096]
取二(4-氟苯基)氧化磷(142.8mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-氟苯基)膦酸酯,产率为87%。
[0097]1h nmr(500mhz,cdcl3):δ7.93-7.88(m,2h),7.81-7.69(m,4h),7.35-7.30(m,2h),7.19-7.12(m,6h),7.01-6.97(m,2h),5.52-5.46(m,1h),1.49(dd,j1=7.0hz,j2=14.6hz,3h).
[0098]
实施例十五:
[0099]
以乙酸酐和二(4-溴苯基)氧化磷为原料,反应式和实验步骤如下:
[0100][0101]
取二(4-溴苯基)氧化磷(214.7mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-溴苯基)膦酸酯,产率为95%。
[0102]1h nmr(500mhz,cdcl3):δ7.73-7.69(m,2h),7.63-7.52(m,10h),7.45-7.43(m,2h),7.16-7.12(m,2h),5.52-5.46(m,1h),1.50(dd,j1=7.0hz,j2=14.7hz,3h).
[0103]
实施例十六:
[0104]
以乙酸酐和二(4-三氟甲基苯基)氧化磷为原料,反应式和实验步骤如下:
[0105][0106]
取二(4-三氟甲基苯基)氧化磷(202.8mg,0.6mmol),dmap(4.9mg,0.04mmol)加入
至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-三氟甲基苯基)膦酸酯,产率为98%。
[0107]1h nmr(500mhz,cdcl3):δ8.09-7.89(m,6h),7.77-7.74(m,4h),7.68-7.66(m,2h),7.55-7.47(m,4h),5.81-5.75(m,1h),1.59(dd,j1=7.0hz,j2=14.7hz,3h).
[0108]
实施例十七:
[0109]
以乙酸酐和二(4-甲氧基苯基)氧化磷为原料,反应式和实验步骤如下:
[0110][0111]
取二(4-甲氧基苯基)氧化磷(157.3mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-甲氧基苯基)膦酸酯,产率为74%。
[0112]1h nmr(500mhz,cdcl3):δ7.84(dd,j1=8.8hz,j2=10.6hz,2h),7.68-7.56(m,4h),7.20(dd,j1=8.8hz,j2=12.1hz,2h),6.97-6.89(m,6h),6.74(dd,j1=2.7hz,j2=8.8hz,2h),5.33-5.29(m,1h),3.84(d,j=3.5hz,6h),3.81(d,j=7.2hz,6h),1.50(dd,j1=7.0hz,j2=14.5hz,3h).
[0113]
实施例十八:
[0114]
以乙酸酐和二(4-甲基苯基)氧化磷为原料,反应式和实验步骤如下:
[0115][0116]
取二(4-甲基苯基)氧化磷(138.1mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-甲基苯基)膦酸酯,产率为66%。
[0117]1h nmr(500mhz,cdcl3):δ7.82(dd,j1=8.1hz,j2=10.9hz,2h),7.64(dd,j1=8.1hz,j2=11.2hz,2h),7.54(dd,j1=8.1hz,j2=12.2hz,2h),7.28-7.12(m,8h),7.04-7.02(m,2h),5.38-5.31(m,1h),2.39(s,6h),2.36(s,3h),2.34(s,3h),1.50(dd,j1=
7.0hz,j2=14.5hz,3h).
[0118]
实施例十九:
[0119]
以乙酸酐和二(4-叔丁基苯基)氧化磷为原料,反应式和实验步骤如下:
[0120][0121]
取二(4-叔丁基苯基)氧化磷(188.5mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(4-氟苯基)磷酰)乙基双(4-叔丁基苯基)膦酸酯,产率为76%。
[0122]1h nmr(500mhz,cdcl3):δ7.92(dd,j1=8.4hz,j2=10.7hz,2h),7.73(dd,j1=8.4hz,j2=11.0hz,2h),7.58(dd,j1=8.4hz,j2=12.0hz,2h),7.53-7.48(m,4h),7.41-7.39(m,2h),7.28-7.25(m,2h),7.17-7.13(m,2h),5.35-5.28(m,1h),1.51(dd,j1=7.0hz,j2=14.6hz,3h),1.34(d,j=2.1hz,18h),1.31(s,9h),1.28(s,9h).
[0123]
实施例二十:
[0124]
以乙酸酐和二(2-萘基)氧化磷为原料,反应式和实验步骤如下:
[0125][0126]
取二(2-萘基)氧化磷(181.3mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二(萘-2-基)磷酰)乙基二(萘-2-基)膦酸酯,产率为67%。
[0127]1h nmr(500mhz,cdcl3):δ8.69(d,j=13.2hz,1h),8.43(d,j=13.3hz,1h),8.34(d,j=14.4hz,1h),7.98-7.75(m,12h),7.68-7.47(m,9h),7.39-7.34(m,2h),7.28-7.25(m,1h),7.10-7.06(m,1h),5.81-5.78(m,1h),1.68(dd,j1=7.0hz,j2=14.5hz,3h).
[0128]
实施例二十一:
[0129]
以乙酸酐和二(3-甲基苯基)氧化磷为原料,反应式和实验步骤如下:
[0130][0131]
取二(3-甲基苯基)氧化磷(138.1mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二间甲苯基磷酰基)二间甲苯基膦酸乙酯,产率为79%。
[0132]1h nmr(500mhz,cdcl3):δ7.80(d,j=11.6hz,1h),7.75-7.71(m,1h),7.62(d,j=11.7hz,1h),7.55-7.53(m,2h),7.48-7.44(m,1h),7.34-7.27(m,6h),7.23-7.10(m,3h),7.03-6.99(m,1h),5.44-5.38(m,1h),2.34(s,6h),2.33(s,3h),2.23(s,3h),1.52(dd,j1=7.0hz,j2=14.5hz,3h).
[0133]
实施例二十二:
[0134]
以乙酸酐和二(3,5-二甲基苯基)氧化磷为原料,反应式和实验步骤如下:
[0135][0136]
取二(3,5-二甲基苯基)氧化磷(154.9mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和乙酸酐(20.4mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(双(3,5-二甲基苯基)磷酰)乙基双(3,5-二甲基苯基)膦酸酯,产率为31%。
[0137]1h nmr(500mhz,cdcl3):δ7.58(d,j=11.4hz,2h),7.40(d,j=11.5hz,2h),7.33(d,j=12.7hz,2h),7.11(s,3h),7.02(s,1h),6.92(d,j=12.9hz,2h),5.46-5.40(m,1h),2.30(s,6h),2.27(s,12h),2.17(s,6h),1.50(dd,j1=7.0hz,j2=14.4hz,3h).
[0138]
实施例二十三:
[0139]
以苯甲酰氯和二苯基氧化磷为原料,反应式和实验步骤如下:
[0140][0141]
取二苯基氧化磷(121.2mg,0.6mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中依次加入2ml甲苯和苯甲酰氯(28.0mg,0.2mmol),将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物(二苯基磷酰基)(苯基)甲基二苯基膦酸酯,产率为71%。
=6.9hz,3h).
[0158]
实施例二十七:
[0159]
以过氧化苯甲酰和二苯基氧化磷为原料,反应式和实验步骤如下:
[0160][0161]
取二苯基氧化磷(121.2mg,0.6mmol),过氧化苯甲酰(48.4mg,0.2mmol),dmap(4.9mg,0.04mmol)加入至10ml反应管中,使用双排管将反应管中空气置换为氮气,置换三次,然后向其中加入2ml甲苯,将反应置于90℃的油浴中反应11小时。反应结束后,浓缩反应液,以体积比2:1的石油醚和乙酸乙酯混合液为洗脱剂,柱层析分离得到产物1-(二苯基磷酰基)十二烷基二苯基膦酸酯,产率为45%。
[0162]1h nmr(500mhz,cdcl3):δ8.03-7.99(m,2h),7.62-7.53(m,3h),7.49-7.24(m,13h),7.17-7.08(m,5h),7.02(t,j=7.7hz,2h),6.30(dd,j1=2.5hz,j2=10.4hz,1h).
[0163]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种等同变换,这些等同变换均属于本发明的保护范围。同时,需要说明的是本专利受到国家自然科学基金(22001225)和山东省自然科学基金(zr2020mb021)的资助,本专利是上述资助项目的研究成果之一。
