一种n取代的噻唑杂环类化合物及其应用
技术领域
1.本发明属于医药化学领域,涉及一种n取代的噻唑杂环类化合物及其应用,尤其涉及2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮及其作为芳香烃受体拮抗剂的应用。
背景技术:
2.二噁英类化合物是环境中普遍存在的持久性有机污染物,具有半挥发性、生物累积性、持久性和毒性等特点。主要产生于工业生产和垃圾焚烧的过程中,由于其稳定的化学结构和较高的脂溶性,广泛地分布于空气、土壤和水体等自然环境中。食物链富集是该类化合物在人体赋存的主要途径,严重危害人类健康,在世界范围内一直备受关注,针对其毒性效应和致毒机制的研究是学术界的研究重点。因此针对二噁英类物质的毒性效应的阻断及其机制研究是我国环境健康研究的重点。
3.作为“斯德哥尔摩国际公约”的缔约国之一,我国目前正在逐步削减二噁英等持久性有机污染物的排放,从污染源着手降低人们的暴露风险,但是既往暴露的效应仍然会长期存在。因此从生物体出发,开展毒性拮抗或阻断方面的研究对于其公共健康负面效应的防控具有重要的意义。有研究表明利用芳香烃受体(ahr)拮抗剂来阻断二噁英类的致毒效应的研究已经取得了初步进展,并广泛的应用于二噁英毒理机制的研究中。但这类拮抗剂对二恶英效应的阻断作用具有配体依赖性,部分阻断ahr信号通路后,二噁英类污染物是否还会激活其他的致毒信号通路尚无定论;不仅如此,关于此类化合物对人体其他方面的生物效应研究还有待深入。因此,对现有的具有较高生物安全性的药物进行衍生化设计并筛选具有对抗二噁英类物质毒性效应的化合物是一种行之有效的方法。五元噻唑类杂环化合物是含氮杂环的重要组成成分,在农药,医药等领域得到了广泛的使用。该类化合物作为ahr拮抗剂具有生物安全性高,配体结合特异性强等特点,可广泛的应用于二噁英类化合物所引起的毒性效应阻断研究。
4.针对上述内容,要寻找以芳香烃受体为靶点来阻断二噁英类毒效应的化合物,首先需要确定该化合物是否可以阻断二噁英类化合物对芳香烃受体信号通路的激活,通过检测该化合物是否可以通过信号通路阻断由二噁英同系物中的最毒化合物2,3,7,8-四氯二苯并-对-二噁英(2,3,7,8-tcdd)对下游相关基因(cyp1a1、cyp1b1等)和相关蛋白表达水平(cyp1a1、cyp1b1等)上调的方法即可确认该化合物是否是芳香烃受体拮抗剂。通过阻断tcdd激活芳香烃受体信号通路,可以维持下游靶基因(如cyp1a1、cyp1a2、cyp1b1等)的相关外源物质代谢酶的稳态,降低过度代谢外源性毒物过程中产生的大量自由基,减少细胞核基因的突变可能,从而保护机体不过度代谢外源性毒性,维持细胞稳态。同时间接促进机体对二噁英类污染物的外排。鉴于此,确定化合物是否为芳香烃受体拮抗剂对寻找以芳香烃受体为靶点的二噁英类致毒效应阻断剂尤为重要。经权威机构检索查新,2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮及其作为芳香烃受体拮抗剂的应用尚未见文献报道。
技术实现要素:
5.针对目前对阻断二噁英类污染物毒效应的研究需求,本发明的目的在于提供一个新型噻唑杂环类衍生物,即2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮以及该化合物作为芳香烃受体拮抗剂的应用。
6.为实现上述目的,本发明提供如下技术方案:
7.一种n取代的噻唑杂环类化合物,所述化合物是2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮,其结构如式(i)所示:
[0008][0009]
本发明还提供了2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮的制备方法,所述方法包括如下步骤:
[0010]
1)制备n-异丙基苯硫脲:将异硫氰酸苯酯与异丙胺在甲醇中加热回流,反应结束后用乙酸乙酯萃取,萃取液经洗涤、减压去除溶剂后得到n-异丙基苯硫脲;
[0011]
2)制备2-苯亚氨基-n-异丙基噻唑-4-酮:将步骤1)得到的n-异丙基苯硫脲与氯代乙酸乙酯在乙醇中在无水乙酸钠存在下在搅拌下加热反应,得到沉淀,所得沉淀经重溶、乙酸乙酯和水萃取、重结晶得到产物2-苯亚氨基-n-异丙基噻唑-4-酮;
[0012]
3)制备2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮:将步骤2)得到的2-苯亚氨基-n-异丙基噻唑-4-酮与对二甲氨基苯甲醛在乙醇中在哌啶存在下在搅拌条件下加热回流,获得沉淀,所得沉淀经洗涤并在加热下在质量比为1:2的乙醇:石油醚混合液中重溶,冷却至室温,重结晶得到最终产物2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮。
[0013]
本发明进一步提供了一种2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮的应用,所述化合物是用作用于阻断芳香烃受体信号通路的芳香烃受体拮抗剂。
[0014]
本发明还更进一步提供了一种用于阻断芳香烃受体信号通路的制剂,所述制剂中包含的活性成分是2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮。
[0015]
与现有技术相比,本发明的有益效果是:本发明提供了一种新型的n取代噻唑杂环类化合物即2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮化合物及其作为芳香烃受体拮抗剂的应用,预示该化合物有望成为以芳香烃受体为靶点的阻断二噁英类致毒效应的潜在药物,在科研和药物研发领域都具有很大的开发应用前景。
附图说明
[0016]
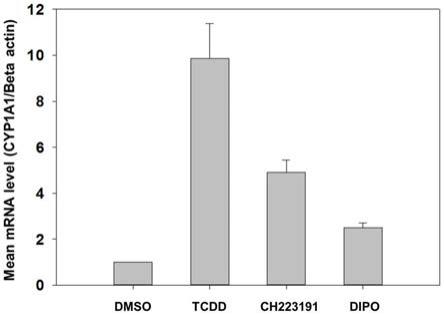
图1为hepawt细胞中dipo(10μm)对cyp1a1基因表达的影响,
[0017]
其中,tcdd(1nm)和ch223191(10μm)为阳性对照,dmso(0.1%)为阴性对照,dipo剂量为10μm;
[0018]
图2为hepawt细胞中dipo(10μm)对cyp1a1蛋白表达的影响,
[0019]
其中,tcdd(1nm)和ch223191(10μm)为阳性对照,dmso(0.1%)为阴性对照,dipo剂量为10μm。
具体实施方式
[0020]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0021]
在本发明的描述中,需要说明的是,术语“上”、“下”、“内”、“外”“前端”、“后端”、“两端”、“一端”、“另一端”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性。
[0022]
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“设置有”、“连接”等,应做广义理解,例如“连接”,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
[0023]
针对目前对阻断二噁英类污染物毒效应的研究需求,本发明提供了一种新型噻唑杂环类衍生物,即2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮,本发明还公开了该化合物作为芳香烃受体拮抗剂的应用。
[0024]
本发明所述n取代的噻唑杂环类化合物是2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮,简称dipo,2-phenylimino-n-isopropyl-4((dimethylamino)benzylidene)thiazolidin-4-one,其化学结构如式(ⅰ)所示。
[0025][0026]
上述式(ⅰ)化合物的制备方法,是由异硫氰酸苯酯为起始原料,通过与异丙胺反应生成取代苯硫脲,再经过与氯代乙酸乙酯的关环反应,形成n取代的噻唑杂环,最后与取代苯甲醛发生缩合反应得到最终产物,其具体步骤见实施例1。
[0027]
本发明所述n取代的噻唑杂环类化合物可以用作芳香烃受体拮抗剂,其中所述化合物是2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮。
[0028]
为了更好的理解本发明的实质及发明所述化合物的作用,下面结合dipo化合物的实验及结果,进一步阐述其作为芳香烃受体拮抗剂在阻断tcdd致毒效应中的应用。
[0029]
采用小鼠肝癌细胞hepawt作为研究对象,利用细胞生物学和分子生物学的方法对dipo阻断tcdd引起的芳香烃受体靶基因cyp1a1的上调表达影响进行研究。
[0030]
hepawt细胞的制备:以常规方法培养hepawt细胞,待细胞密度达到培养皿80%之上时,收集生长状态良好的且处于对数期的细胞,备用。
[0031]
1.实时荧光定量聚合酶链式反应(rt-pcr):用10μm的dipo化合物预处理细胞,1小
时后加入1nmol的tcdd,根据cyp1a1基因水平的表达量变化,在转录水平上阐述该化合物对芳香烃受体信号通路的影响(图1)。显示2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮可以抑制tcdd引起的cyp1a1基因表达量上调。
[0032]
2.蛋白印迹法(western blot):用10μm的dipo化合物预处理细胞,1小时后加入1nmol的tcdd,根据cyp1a1蛋白水平的表达量变化,在蛋白翻译水平上阐述该化合物对芳香烃受体信号通路的影响(图1)。显示2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮可以抑制tcdd引起的cyp1a1蛋白表达量上调。
[0033]
通过上述实验及其结果,可以得到以下结论:
[0034]
本发明所述的2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮能显著阻断由tcdd引起的cyp1a1相关基因和蛋白表达的上调,阻断tcdd激活芳香烃受体信号通路,及激活后引起的毒效应。提示这类含n取代的噻唑杂环芳香烃受体拮抗剂对阻断二噁英类化合物的致毒效应具有重要意义。
[0035]
本发明公开的新型n取代噻唑杂环类化合物即2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮化合物及其作为芳香烃受体拮抗剂的应用预示该化合物有望成为以芳香烃受体为靶点的阻断二噁英类致毒效应的潜在药物,在科研和药物研发领域都具有很大的开发应用前景。
[0036]
实施例1
[0037]
2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮的制备,合成路线如(ⅱ)所示:
[0038][0039]
[1]将6.75g(50mmol)异硫氰酸苯酯溶于25ml甲醇溶液中,加入3.54g(60mmol)异丙胺,搅拌条件下回流加热至80℃,混合物变澄清,反应12小时候后,薄层色谱法(tlc)监测反应,反应结束后,将混合物冷却到室温,有黏稠的油状液体出现,用乙酸乙酯萃取,萃取液用10%盐酸溶液,氯化钠饱和溶液,去离子水依次洗涤,萃取液减压蒸除溶剂,得到n-异丙基苯硫脲。
[0040]
[2]将n-异丙基苯硫脲1.16g(6.0mmol),无水乙酸钠2.48g(30mmol),溶解于20ml乙醇中,搅拌条件下,加入氯代乙酸乙酯1.28ml(12mmol),在60℃下加热6个小时,tlc检测反应,反应结束后冷却到室温,出现沉淀。将反应液过滤,滤饼用乙醇洗涤,得到部分粗产物,滤液减压蒸馏,然后用乙酸乙酯和水萃取,合并有机相得到更多的粗产物。粗产物在乙
酸乙酯中重结晶,得到产物2-苯亚氨基-n-异丙基噻唑-4-酮。
[0041]
[3]称取2-苯亚氨基-n-异丙基噻唑-4-酮1.17g(5mmol)溶于30ml乙醇中,加入对二甲氨基苯甲醛0.91g(6mmol),哌啶1ml,搅拌条件下回流加热至60℃,反应24小时。反应通过tlc监测,反应完毕后冷却到室温,在反应过程中有大量沉淀生成,经过分析表征,沉淀即为产物2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮。将反应液过滤,用乙酸乙酯,乙醇,石油醚依次进行洗涤得粗产物,将粗产物在加热条件下重新溶解于乙醇:石油醚(1:2)溶液中,室温冷却,重结晶得到最终产物。
[0042]
产物为淡黄色粉末,收率76.5%;1hnmr(400mhz,dmso-d6):δ(ppm)=7.72(m,1h),7.45-6.71(m,9h),4.41(m,1h),3.06(s,6h),1.41(d,6h);esi-ms:m/z366.1(m+1)。
[0043]
实施例2
[0044]
2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮化合物抑制tcdd(1nmol)引起的cyp1a1基因表达量上调。
[0045]
1.将hepawt细胞以1
×
104/ml的密度接种至直径60mm的细胞培养皿中。24h后,先将2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮(10μmol),ch223191(10μmol,经典ahr小分子抑制剂)分别加至两个培养皿中,1小时后再加入tcdd 1nmol,另外两个培养皿中分别加入dmso为阴性对照、tcdd(1nmol)为阳性对照,在37℃含5%co2的条件下作用24h。
[0046]
2.rna的提取:收集细胞,弃掉培养基,用预热的pbs溶液冲洗2遍。加入适量的裂解液裂解细胞,用移液器缓慢地吹打几次。将裂解物转移到放在2ml收集管中的离心柱内13000rpm离心1分钟。弃下清,将离心柱放入新2ml收集管内。
[0047]
向离心柱内加入700μlwash buffer 1(已加无水乙醇),13000rpm离心1分钟。弃下清,向离心柱内加入600μlwash buffer 2(已加无水乙醇),13000rpm离心1分钟。弃下清,向离心柱内加入250μlwash buffer 2(已加无水乙醇),13000rpm离心2分钟。
[0048]
洗脱:将离心柱放入新的1.5ml离心管内,取40-50μl无核酸酶的水滴加到离心柱的膜中央,13000rpm离心1分钟,获得样品的总rna溶液,做好标记后冰浴待用或-70℃长期保存。
[0049]
3.rna的纯化
[0050]
dnase i消化rna样品,去除可能含有的基因组dna。用无rna酶的水将经过dnase i消化的rna样品(rna≤45μg)的体积调整为200μl。随后加700μlbuffer rlt,充分混匀。加500μl无水乙醇,用移液器轻轻吸打数次混匀后,取700μl得到的溶液过柱,轻轻盖上管盖,室温10,000rpm离心15秒,去除收集管中的液体。重复,将剩余样品过柱,每次所加的样品体积≤700μl。将柱子转移到新的2ml收集管后,加500μlbuffer rpe洗柱子,轻轻盖上管盖,室温10,000rpm离心15秒,去除收集管中的液体,将柱子放回收集管中。加500μl 80%乙醇到柱子中,轻轻盖上管盖,室温10,000rpm离心2分钟,将收集管及液体丢弃。将柱子转移到一新的2ml收集管,打开柱子的盖子,最大转速离心5分钟,将收集管及液体丢弃。洗脱,将柱子转移到一新的1.5ml收集管,取14μl无rna酶的水悬空加到柱子的膜中央,轻轻盖上盖子,最大转速离心1分钟洗脱rna。
[0051]
4.测定总rna的浓度并评价其提取质量。
[0052]
使用仪器nanodrop 2000c前用无核酸酶的水调零,测定rna的浓度及其在260nm和
280nm出的紫外吸收。rna提取质量参考a260/a280的比值,适宜比值范围为1.8至2.1。
[0053]
5.cdna的合成
[0054]
将总rna浓度调平后,使用第一链cdna合成试剂盒将总rna逆转录成cdna:
[0055]
a.将无菌无核酸酶的pcr管置于冰上,将下述反应物依次加入:
[0056][0057]
b.将上述混合物放入pcr仪中,65℃孵育5分钟,4℃孵育10分钟,期间配制并加入:
[0058]
5xreactionbuffer4μlrna酶抑制剂(ri)1μl10mmdntpmix2μl逆转录酶(rt)1μl总体积20μl
[0059]
c.混合,短暂离心。放入pcr仪中,25℃孵育5分钟,42℃孵育60分钟,70℃孵育5分钟终止反应。做好标记后冰浴待用或-30℃长期保存。
[0060]
6.qpcr分析
[0061]
a.按下表配制pcr反应混合液(反应液配制可在室温进行),
[0062][0063]
b.qpcr时,取10μl rt-pcr产物加260μl h2o配成270μl cdna工作液,按上表配pcr反应混合液:二步法配制,对于10μl体系,若有m个样品,先将mix 5μl
×
(6m+10)与一对primers 0.25μl
×
(6m+10)预混合(一般每个样品设5-6个技术重复),分装到5ml离心管,用电子枪依次将下述液体加入反应管中(mix+primers)5.5μl+(cdna工作液)4.5μl。
[0064]
c.贴好封膜,短暂离心60s。
[0065]
所得结果见图1,2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮化合物抑制tcdd(1nmol)引起cyp1a1基因表达量上调。
[0066]
实施例3
[0067]
2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮化合物抑制tcdd(1nmol)引起cyp1a1蛋白表达量上调。
[0068]
收取细胞中蛋白
[0069]
将hepawt细胞以1
×
104/ml的密度接种至直径60mm的细胞培养皿中。24h后,先将2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮(10μmol),ch223191(10μmol,经典ahr小分子抑制剂)分别加至两个培养皿中,1小时后再加入tcdd 1nmol,另外两个培养皿中分别加入dmso为阴性对照、tcdd(1nmol)为阳性对照,在37℃含5%co2的条件下作用24h。
[0070]
将皿内培养液弃去,用4℃预冷好的pbs洗涤三遍。将pbs弃净后把皿置于冰上,加入4mlpbs。用细胞刮下细胞。显微镜下观察剩余细胞量。将pbs用无菌软管吸入无菌15ml离心管中,5min,1000g,4℃条件下离心。离心,去除上清液,获得细胞团。加3ml冷pbs,用枪吹散。类似洗涤重复三遍。
[0071]
将上清液去除干净,每管加50μl裂解液(1ml ripa+10μl protein inhibitor cocktail+1μl 0.3%pmsf),用枪吹散,移到置于冰上的1.5ml离心管内,细胞被冰上裂解30min,每隔10min涡旋一次。将裂解完毕的液体,进行离心(1300rpm,10min,4℃)。取上清,于-80℃条件下保存。应用bca蛋白浓度测定法对细胞裂解液中的蛋白浓度进行定量。
[0072]
2.电泳部分
[0073]
a)丙烯酰胺凝胶的制备
[0074]
根据需分离的蛋白分子量确定所需胶的浓度。在小烧杯中依次加入高纯水,sds,丙烯酰胺,tris-base(分离胶为ph 8.8,浓缩胶为ph 6.8),混匀,迅速加入ap,temed,混匀,迅速加入玻璃板间,液封。待30min胶凝固后,按上述顺序配置浓缩胶(tris-base,ph 6.8),除净液封水,灌入浓缩胶至其溢出玻璃板,小心插入点样梳,如有空隙,补胶,待其凝固。
[0075]
b)电泳
[0076]
浓缩胶凝固后会与分离胶间形成一个清晰界面,将胶板取下,放入玻璃板,使电极、胶构成回路。将胶、电极放入电解槽内,将电解槽放入电泳盒内。将1
×
电泳缓冲液倒入内槽至溢出,使外槽电泳液面高于内槽的铂丝。小心拔出点样梳,使电泳缓冲液充满每个点样孔。将准备好的样品和蛋白质marker,依次小心加入每个点样孔。将电泳槽的盖子盖好。60v电泳30min左右,至溴酚蓝被压缩成细线进入分离胶,继而用120v电泳90min,当溴酚蓝(约10kda)到达胶底部时停止电泳。
[0077]
c)电转
[0078]
取出胶板,小心打开,切除浓缩胶及溴酚蓝以下部分,量尺寸,切角做标记,置于电转缓冲液中,浸泡15min。电转所用海绵、滤纸也用电转缓冲液浸泡15min。根据胶的尺寸,剪取pvdf膜。依次用甲醇15s,milliq水2min,放于电转缓冲液中浸泡15-60min。注意赶气泡,关好夹子。插入电转槽,放上准备好的冰盒,放在外槽内,倒入电转液,盖上盖子。蛋白荷负电,使蛋白从低电势的胶转移至高电势的膜上。电转时间90min,电压70v。
[0079]
d)免疫印迹
[0080]
电转完毕后,打开夹子,将pvdf膜置于摇床上,依次浸于甲醇中10s,定性滤纸干燥15min,甲醇10s,丽春红染色2-5min,水洗可见条带,作为中间检测电转是否成功。根据预染的protein marker切膜,做好标记,tbs/t洗3次,每次5min。将膜至于封闭液中,室温下在摇床上摇1h。将膜置于相应的一抗稀释液中,室温下摇1h,于4℃过夜。膜用tbs/t洗3次,每次5min。之后,将膜置于二抗稀释液中,室温孵育1h。弃二抗,膜用tbs/t洗3次,每次5min。
[0081]
e)分析
[0082]
利用双色红外激光成像系统(odyssey infrared imaging,li-cor)对膜进行拍摄,并用软件imagej software分析条带结果。
[0083]
所得结果见图2,化合物2-苯亚氨基-n-异丙基-5-(4-二甲氨基苯亚甲基)噻唑-4-酮抑制tcdd(1nmol)引起cyp1a1蛋白表达量上调。
[0084]
本发明未详述之处,均为本领域技术人员的公知技术。
[0085]
最后所要说明的是:以上具体实施方式仅用以说明本发明的技术方案而非限制,尽管参照实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改和等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
