nmr进行检测,依据所得浓度-峰强度线性拟合结果得出待测样品中各生物硫醇中的含量。
8.进一步,本发明利用氟标签进行了生物硫醇混合物体系中生物硫醇的区分,如下:
9.将氟标签溶于dmf溶液中,配制为浓度为100mm的母液,取5μl氟标签加入到分别含有0.2mm的gsh、cys、hcy以及na2s的磷酸盐缓冲液(50mm,ph 7.5)中,得到含有1mm氟标签的检测体系;反应2h后,采集
19
f-nmr。接着取5μl氟标签加入浓度均为0.2mm的gsh、cys、hcy以及na2s的混合体系中;反应2h后,采集
19
f-nmr。
10.进一步地,上述所述样品gsh、cys、hcy以及na2s均配制于超纯水中,母液浓度为100mm。
11.本发明提供了一种复杂体系如混合物中生物硫醇的定量检测方法,如下:
12.首先将
19
f标签与含有不同浓度生物硫醇的标准样品分别进行反应,得到浓度与产物峰强度的标准曲线。在含有不同浓度的四种生物硫醇的混合体系中,向其中加入5μl氟标签,得到含有1mm氟标签的检测体系,于25℃反应4h后,反应完全,采集
19
f-nmr。样品测试多组,每组重复3次。根据标准曲线以及测得的混合样品中的产物峰强度可以分别计算出混合样品中实际的样品浓度。
13.进一步地,上述定量研究中,所用核磁参数为:采集次数(ns)为128次,采样温度为25℃,数据点数(td)为16k,弛豫延迟时间(d1)为2s。
14.进一步地,上述所选生物硫醇浓度为0.05-0.50mm。
15.进一步地,上述步骤中所用方法进一步检测了
19
f标签的检测限度可低至2μm。
16.本发明提供了一种检测活细胞内外gsh的方法,如下:
17.hek293t、hela细胞贴壁生长培养,置于含有10ml dmem培养基(10%胎牛血清+1%青-链霉素)的10cm培养皿,于37℃,5%co2中培养。其中hek293t细胞为正常细胞,hela细胞为肿瘤细胞。当细胞覆盖90%时,移除培养基,并用pbs洗两次,胰酶消化,将细胞收集,计数。将收集的细胞重悬于pbs中,向其中加入一定量氟标签至终浓度为1mm,采集不同时间的
19
f-nmr谱图。
18.进一步地,上述重悬细胞所用pbs中补加了0.5%的葡萄糖。
19.本发明提供了一种细胞裂解物中gsh水解途径的检测方法,如下:
20.按上述方法进行hela细胞培养并收集,计数。将收集的细胞用裂解缓冲液裂解细胞,裂解完成后,得到细胞裂解物,向细胞裂解物中加入终浓度为0.1mm的
19
f标签,采集不同时间的
19
f-nmr谱图。
21.进一步地,上述所用细胞裂解液为商品化细胞裂解液,其配方为20mm tris-hcl(ph 7.4),150mm氯化钠,1%np-40,5%甘油,2.5mm焦磷酸钠,1mmβ-甘油磷酸钠,1mm乙二胺四乙酸。
22.本发明具有如下优点以及效果:
23.本发明构建了一种有效的核磁分析方法,该方法通过
19
f标签与生物硫醇之间的共价作用来区分并定量不同生物硫醇分子。该方法具有较低检测限,良好的可重复性以及无背景干扰。该方法进一步可应用于检测细胞内生物硫醇,并利用该方法我们观测到了细胞裂解液中gsh的降解,具有广泛的应用前景。
附图说明
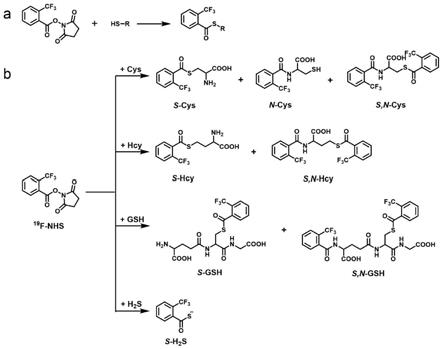
24.图1(a)为本发明中氟标签与生物硫醇的反应机制示意图,(b)为本发明中氟标签与生物硫醇反应产物分析。
25.图2为本发明中氟标签与不同生物硫醇分子反应后的
19
f-nmr谱图;
26.图3为本发明中根据浓度与信号强度绘制得到的标准曲线;
27.图4为本发明中混合体系中浓度定量结果;
28.图5为本发明中
19
f标签检测生物硫醇混合体系中检测限度;
29.图6为本发明中
19
f标签检测细胞样品中生物硫醇的氟谱图;
30.图7为本发明中
19
f标签对细胞存活率的测试;
31.图8为本发明中
19
f标签检测hela细胞裂解物中gsh随时间的变化图。
具体实施方式
32.以下结合附图实施例对本发明进行进一步阐释。
33.实施例1,氟标签的合成:
34.将2-(三氟甲基)苯甲酸(3.8g,20mmol)、n-羟基琥珀酰亚胺(2.3g,20mmol)、n,n'-二环己基二亚胺(4.5g,22mmol)混合在40ml二氯甲烷中。得到的溶液在室温下搅拌4h,然后过滤。蒸发滤液,用正己烷和乙醚洗涤,得到目标化合物2-三氟甲基苯甲酸琥珀亚胺酯为白色固体(5.0g,产率82%左右)。1h nmr(400mhz,cdcl3):δ8.13(d,j=7.4hz,1h),7.87(d,j=7.5hz,1h),7.79-7.69(m,2h),2.92(s,4h)。
13
c nmr(101mhz,cdcl3):δ168.83,161.07,133.34,132.01,131.46,130.16(q),127.27(q),125.14,122.72(q),25.67。
35.实施例2,氟标签与不同生物硫醇的反应表征:
36.将氟标签(100mm)溶于dmf溶液中,取5μl氟标签加入到分别含有0.2mm的gsh、cys、hcy以及na2s的磷酸盐缓冲液(50mm,ph 7.5)中,得到含有1mm氟标签的检测体系,氟标签与生物硫醇的反应机制,见附图1;同样取5μl氟标签加入浓度均为0.2mm的gsh、cys、hcy以及na2s的混合体系中;反应2h后,采集
19
f-nmr谱图,与氟标签与单个生物硫醇反应谱图对比,见附图2。
37.实施例3,混合体系中生物硫醇的同时定量研究:
38.1)使用实施例2中的方法得到氟标签与不同浓度生物硫醇的峰强度与浓度之间关系的标准曲线,见附图3。其中测试生物硫醇的浓度为0.05mm-0.50mm。
39.2)配制三组含有不同浓度的生物硫醇的待测样品,样品1:0.2mm gsh,0.15mm na2s,0.05mm hcy,0.15mm cys;样品2:0.05mm gsh,0.10mm na2s,0.15mm hcy,0.20mm cys;样品3:0.10mm gsh,0.10mm na2s,0.10mm hcy,0.10mm cys,加入5μl氟标签,反应4h,反应完全,每组样品重复三次。根据所测的待测样品的产物峰强度与标准曲线,反算出测得浓度并与加入的实际浓度进行对比,结果见附图4,结果表明利用该方法测得的生物硫醇各组分的含量与实际浓度具有高度一致性,该方法具有较好的准确性。
40.3)配制终浓度为2μm的gsh、cys、hcy、na2s的四种生物硫醇混合物与
19
f标签反应,采集氟谱,结果见附图5,结果表明该方法能够对浓度低至2μm的样品进行检测分析。
41.实施例4,氟标签在不同细胞内生物硫醇的检测结果:
42.hek293t,hela细胞贴壁生长培养,置于含有10ml dmem培养基(10%胎牛血清+1%
青-链霉素)的10cm培养皿,于37℃,5%co2中培养。细胞覆盖90%时,移除培养基,并用pbs洗两次,胰酶消化,将细胞收集,计数。将收集的细胞重悬于pbs(含有0.5%葡萄糖)中,向其中加入一定量氟标签至终浓度为1mm,采集不同时间的
19
f-nmr谱图,见附图6。正常细胞(hek293t)中只有gsh与
19
f标签的产物生成,而肿瘤细胞(hela)中除gsh与
19
f标签反应产物生成外,还有cys-gly二肽与
19
f标签生成产物以及cys与
19
f标签生成产物。
43.实施例5,氟标签对细胞的毒性测试:
44.按照实施例4中步骤进行hela细胞培养与收集,并将细胞重悬于pbs(含有0.5%葡萄糖)中,向其中加入终浓度为1mm的
19
f标签,将样品置于室温6h后,进行台盼蓝(0.4%)染色,染色结果如附图7所示,细胞存活率在95%以上,说明本发明中
19
f标签对细胞是较为安全的。
45.所述染色比例为细胞:台盼蓝为9:1,染色时间为3min。
46.实施例6,细胞裂解物内gsh的代谢路径研究:
47.按照实施例4中进行hela细胞培养并收集,计数。将收集的细胞用裂解缓冲液裂解细胞,于0℃裂解15分钟,得到细胞裂解物,向细胞裂解物中加入终浓度为1mm的
19
f标签,采集不同时间的
19
f-nmr谱图,结果见附图8。结果表明利用本发明中
19
f标签可以观测到裂解物中gsh的水解途径。
