微注射方法以及应用
1.本技术是基于申请人于2019年11月13日向中国国家知识产权局提交的发明专利申请“基于hnpy的基因过表达嵌合动物模型构建方法及其应用”(申请号2019111075856)的分案申请。
技术领域
2.本发明属于生物技术领域,涉及在动物体内进行微注射的方法以及其应用。
背景技术:
3.在各类科学研究机构、医学院校、医疗卫生机构中,时常涉及生物学及相关科学研究、实验,动物活体检测,以及医疗手术等过程中,往往需要对动物进行精准的为注射。现有技术中公开了大量微注射装置,能够对准确给出的注射位置、注射剂量进行精准控制。比如中国专利申请201810996345.5公开了一种微量注射泵,包括泵体和驱动装置,泵体内设有供液腔、进液通道和出液通道,进液通道与供液腔的底部一端连通,出液通道与供液腔的底部另一端连通,进液通道的末端设有进液管,出液通道的末端设有出液管,进液管上设有进口单向阀,出液管上设有出口单向阀,驱动装置包括外壳、顶盖、压电陶瓷驱动器、驱动座、连接臂、驱动杆和弹性压膜,连接臂连接在驱动座与外壳之间,驱动座的上端开设有压电陶瓷启动器的安装槽,顶盖设置在驱动座的顶部,驱动杆的上端与驱动座的下端连接,驱动杆的下端与弹性压膜的一端面连接,弹性压膜的另一端面与供液腔围合形成泵腔。本发明具有振动抑制能力好,注射量精准的优点。
4.但是,这些现有技术方案都重在微注射设备和仪器的设计,对于具体到某一具体的应用中,如何对需要注射的目标予以准确确定,并按照预订的设计,实现有效注射,以达到相应的预期效果,一直是相关领域棘手的问题。
技术实现要素:
5.针对上述不足,本发明所要解决的技术问题在于,分别提供可实现动物体内部器官精准注射的方法,实现对动物体内器官、组织的精准微注射;以及相关应用。
6.微注射方法,包括,定位,通过扫描设备对动物体内需要进行注射的目标位置予以精准定位,并给出相应的坐标值;试剂注射,所述目标的坐标转换为微注射系统所的坐标,并基于所述坐标,调整所述注射系统的注射针头,并将所述注射系统中的试剂按照设定剂量注射到所述目标中。
7.如权利要求1所述的方法,其特征在于,所述定位步骤包括,设置定位标识,在所述动物体外设置与所述动物体内目标所在肢体无相对移动的定位标识;扫描,通过扫描获得动物体内目标及所述定位标识的显相,基于所述显相中的所述定位标识和所述目标的位置关系,对所述动物体内的所述目标予以精准定位。
8.进一步地,固定,将所述动物通过动物定位仪进行固定。
9.以及,所述定位标识为颗粒物;所述定位标识包括,第一定位标识、第二定位标识,其中,第一定位标识,固定在所述定位仪水平位上,用于确认扫描时的水平面及扫描基线;所述水平位与所述动物肢体无相对位移;所述第一定位标识为三颗颗粒物,其在所述水平位内呈直角三角形分布;第二定位标识,设置在动物体体表,用于确定基准点;所述第二定位标识为一颗颗粒物,其在所述体表位置固定;基于所述定位标识确定的所述基准点和扫描基线确定所述动物体内的目标位置坐标值。
10.优选地,所述定位标识根据所述扫描所使用的扫描设备成像特点选定,所述定位标识与所述动物体上和所述定位标识接触的部位在扫描设备的扫描显相中呈现不同的成像特征。
11.优选地,所述扫描设备为核磁共振仪,所述定位标识为脂肪颗粒。
12.优选地,所述扫描设备为ct,所述定位标识为金属颗粒。
13.优选地,所述定位步骤具体包括,设置基准点,在猕猴头骨骨缝点放置一颗鱼肝油颗粒,作为基准点;固定,将猕猴通过耳棒及舌板固定于磁共振兼容性脑定位仪内;确定扫描基线,在所述定位仪水平位上分别黏贴三颗鱼肝油颗粒,用于确认扫描时的水平面,及扫描基线;所述三颗鱼肝油颗粒在所述水平位内呈直角三角形分布;优选地,所述设置基准点步骤包括,扫描,用核磁共振仪对头部戴所述定位仪的所述猕猴进行扫描,获得磁共振显相,通过所述显相,基于所述鱼肝油颗粒确定的所述基准点和/或扫描基线确定所述猕猴大脑组织的目标位置坐标值。
14.麻醉,方法:全麻;通道:静脉留置针建立通道,生理盐水封管;麻醉药剂量:氯胺酮2mg缓推;之后以1.5mg氯胺酮据睫反射或尾部及四肢反射情况维持量直至实验结束;剃毛,剔除头部毛发,暴露整个颅脑头皮层;开创,以所述猕猴眉弓后方3cm处为坐标进针点,碘伏消毒范围3cm至5cm,以所述点为中心做一约4cm的冠状切口,剥离骨膜充分暴露顶状骨及坐标点,在所述猕猴头骨骨缝点位置钻一小孔,在所述小孔放置所述鱼肝油颗粒,作为基准点。
15.优选地,所述基准点作为核磁共振仪扫描的基准点,坐标为(0,0,0),基于所述精准点坐标,确定所述器官的三维坐标参数;通过所述核磁共振仪扫描时,所述鱼肝油颗粒在所述显相为白色成像,根据位于所述精准点的白色成像,确定所述显相中的所述基准点坐标。
16.优选地,所述扫描步骤包括,采用3.0t磁共振头线圈进行扫描,获得薄层轴位t1及t2图像,矢状位t1成像,扫描数据为:te100-120,tr3800-6000;层厚2mm;层间距0;fov=280
×
280mm;参考所述磁共振显相和对照图谱确定所述目标的精准位置;
确定坐标进针点以及测量计算出靶点坐标值,并在该靶点前后,左右及上下1mm出选择6个靶点,进而完成所述目标的准确定位。
17.优选地,所述动物为猕猴,所述注射的目标为猕猴的大脑室旁核,所述试剂注射步骤具体包括,开孔:小心将所述猕猴带定位仪从磁共振仪器内取下,注意保证头部在定位仪中不发生位移;以注射原点为中心开一大小约6mm至8mm的骨窗充分暴露脑膜;开孔过程中注意用生理盐水降温,同时在接近骨膜时减轻颅骨钻力度,防止瞬间贯穿颅骨及脑膜,造成皮层损伤。最后用针或者镊子将所剩颅骨薄层揭去,暴露脑膜;注射载体试剂:装配机械臂,微量注射泵及注射针头;注射后磁共振成像扫描,导出成像数据图;缝合切口:消毒创面及周围3到5cm,明胶海绵填塞开孔骨创部,缝合头皮;清理缝合创面,及时补充生理盐水与抗生素。
18.优选地,所述注射载体试剂进一步包括,通过定位臂将注射针针头正好放置于颅骨鱼肝油颗粒的正中心位置,此时定位仪的坐标仪上所得x, y, 及z 数值为注射原点坐标;实际注射点的坐标,通过在原点坐标上加减上一步磁共振扫描所换算得到的室旁核与原点在前后及深度上的距离而产生;按照此坐标进行定位臂的移动及进针操作,如果在进针点正下方有明显的血管,则稍向前或者后移动一定距离避开血管再下针,将此距离记下;每个位点注射时间:2分钟/
µ
l载体试剂,每个位点留针7-8min;缓缓拔出注射器需要3-4min。
19.微注射方法,包括,1)麻醉:全麻,通道:静脉留置针建立通道,生理盐水封管,麻醉药剂量:氯胺酮2mg缓推;之后以1.5mg氯胺酮据睫反射或尾部及四肢反射情况维持量直至实验结束;首次氯胺酮用量可以加大;2)剔除头部毛发,暴露整个颅脑头皮层;3)开创:以眉弓后方3cm处为坐标进针点,碘伏消毒范围3cm至5cm,以点为中心做一冠状状切口约4cm,剥离骨膜充分暴露顶状骨及点坐标;在猕猴头骨骨缝点位置钻一小孔,用于放置一颗鱼肝油颗粒,作为下面核磁共振仪扫描基点(原点:0,0,0);所述的鱼肝油颗粒目的在于利用油脂在mri上会形成与猴脑部组织不同的成像特征,所述鱼肝油为白色成像,以便于作为参照点进行定位;4)固定:将猕猴通过耳棒及舌板固定于磁共振兼容性脑定位仪内;5)mri扫描及靶点计算:猕猴戴定位仪进行磁共振扫描;采用3.0t磁共振头线圈进行扫描,获得薄层轴位t1及t2图像,矢状位t1成像,扫描数据为:te100-120,tr3800-6000;层厚2mm;层间距0;fov=280
×
280mm;在猕猴头骨骨缝点位置小孔,放置一颗鱼肝油颗粒,作为基点,用于确认注射部位坐标;在定位仪水平位上黏贴三颗鱼肝油颗粒,呈直角三角形放置,用于确认扫描时的水平面,及扫描基线,扫描范围从颅底至颅顶,包含所有磁共振定位点;参考猕猴脑磁共振显相和对照图谱确定双侧室旁核;确定坐标进针点以及测量计算出靶点坐标值,并在该靶点前后,左右及上下1mm出选择6个靶点,进而完成下丘脑室旁核准确
定位;6)开孔:小心将猕猴带定位仪从磁共振仪器内取下,过程中注意保证头颅在定位仪中不发生位移;以注射原点为中心开一大小6mm至8mm的骨窗充分暴露脑膜;开孔过程中注意用生理盐水降温,同时在接近骨膜时减轻颅骨钻力度,防止瞬间贯穿颅骨及脑膜,造成皮层损伤;最后用针或者镊子将所剩颅骨薄层揭去,暴露脑膜;7)注射载体试剂:装配机械臂,微量注射泵及注射针头;通过定位臂将注射针针头正好放置于颅骨鱼肝油颗粒的正中心位置,此时坐标仪上所得x, y, 及z 数值为注射原点坐标;实际注射点的坐标,通过在原点坐标上加减上一步磁共振扫描所换算得到的室旁核与原点在前后及深度上的距离而产生;按照此坐标进行定位臂的移动及进针操作,如果在进针点正下方有明显的血管,则稍向前或者后移动一定距离避开血管再下针,将此距离记下;每个位点注射时间:2分钟/
µ
l 载体试剂体积,每个位点留针7-8min;缓缓拔出注射器需要3-4min;注射的载体试剂中,载体颗粒浓度为109个/
µ
l,使得进入室旁核中的载体颗粒数量是室旁核的细胞数量的2倍以上,以确保过表达的实现;7)注射后磁共振成像扫描,导出成像数据图;8) 缝合切口;消毒创面及周围3-5cm,明胶海绵填塞开孔骨创部,缝合头皮;清理缝合创面,及时补充生理盐水与抗生素。
20.如前所述的方法用于在猕猴/动物体内精准位置进行试剂注射。
21.如前所述的应用,所述试剂中含有转基因/基因编辑载体。
22.如前所述的方法在基因嵌合工程猴模型,或,基因嵌合动物模型构建中的应用。
23.如前所述的方法在工程猴模型,或,动物模型构建中的应用。
24.用于对动物/猕猴大脑组织进行药物/试剂精准注射。
25.通过本发明的上述技术方案,可以基于所述的多个鱼肝油颗粒确定的基准点和扫描基线,对猕猴脑部组织以及其他动物内部器官、组织等的准确定位,定位精度可以超过毫米(mm)级。同时,所述技术方案不会对猕猴等动物体,甚至动物活体构成大的损伤,甚至无损情况下的内部组织的准确定位,具有生物风险低,安全性高,可控性强等特点。具体地,由于所述鱼肝油颗粒(或者其他脂肪颗粒)为脂肪成分,其在核磁共振显相(显像)中会形成与猴脑部组织(含与其密切接触的头骨、皮肤等)不同的成像特征,所述鱼肝油为白色成像,而猴脑组织等为不同等级的灰度图像,甚至是黑色(如图8所示),足以实现有效的区分,以便于作为基准点进行定位参照。同时,黏贴在所述定位仪上的鱼肝油颗粒,也会在核磁共振显相中具有与定位仪不同的成像特征,实现对扫描基线的定位确定。此外,成直角三角形分布,只有当所述显相中的三颗白点分布呈现直角三角形时,说明扫描方向与所述水平面(扫描基线)垂直;三颗白点在一条直线时,所述扫描方向与所述水平面(扫描基线)平行;同时,直角三角形分布,也可作为后续定位坐标的参考系设置。类似地,当然,也可以根据不同的场景和扫描设备,选用其他的材料作为定位参照点,比如ct等时,采用金属颗粒等,实现上述相同或类似的技术效果。基于所述精准的定位,借助微注射仪器,实现精准的微注射。
附图说明
26.为了更清楚地描述本发明所涉及的相关技术方案,下面将其涉及的附图予以简单说明,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
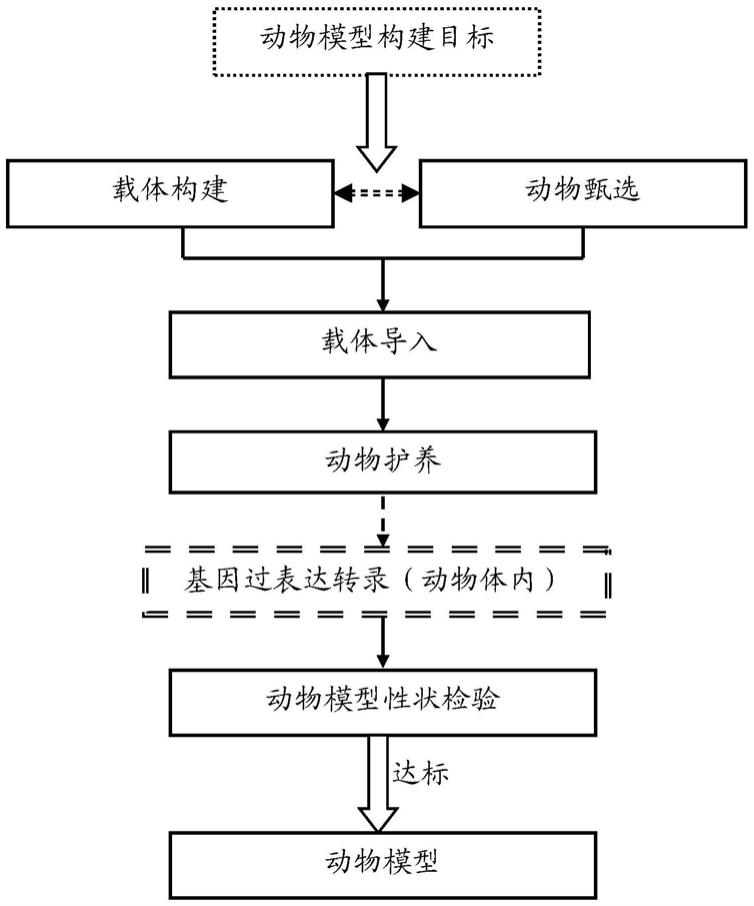
27.图1为嵌合动物模型构建方法流程图;图2为载体注射过程流程图;图3为载体结构及载体导入示意图,其中(a)为构建的lenti-hnpy慢病毒表达载体结构示意图(图中只给出了特异性部分),(b)为不含hnpy的lenti对照载体结构示意图,(c)核磁共振扫描的猕猴双侧室旁核病毒注射示意图;图4为载体注射位点示意图;图5为病毒注射后猕猴室旁核的荧光图片一(背景是细胞核标记hoechst染色);图6为病毒注射后猕猴室旁核的荧光图片二(背景是细胞核标记hoechst染色);图7为病毒在小鼠大脑的表达荧光图片;图8为实验猕猴的核磁共振扫描图片;图9为hnpy在猕猴室旁核过表达引起实验猕猴体重增加变化曲线图;图10为病毒注射后对猕猴摄食行为、摄食量和血清胰岛素的影响,其中a-d为病毒注射7个月后的变化曲线;图11为人源npy在猕猴室旁核过表达对实验猕猴体温和其它代谢指标的影响;图12为病毒注射后猕猴血液的npy水平,agrp和瘦素变化情况。
28.附图标记说明:图中,大脑1,室旁核2,注射位点3,注射器4,载体注射进针点31,辅助注射进针点32。
具体实施方式
29.为了便于本领域的技术人员对本发明的进一步理解,并清楚地认识本技术所记载的技术方案,完整、充分地公开本发明的相关技术内容,下面结合附图对本发明的具体实施方式进行详细的描述,显而易见地,所描述的具体实施方式仅仅以列举方式给出了本发明的一部分实施例,用于帮助理解本发明及其核心思想。
30.基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,和/或在不背离本发明精神及其实质的情况下,即使对各个步骤的顺序进行了改变,以及根据本发明做出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明保护的范围。
31.本发明涉及的相关术语定义或补充说明如下:npy:即神经肽y,全称神经肽酪氨酸,英文neuropeptide y,缩写npy。npy是由36个氨基酸残基组成的多肽,属胰多肽家族,广泛分布于哺乳动物中枢和外周神经系统,是含量最丰富的神经肽之一。通过与不同的受体结合,在体内产生不同的作用。npy基于“npy基因”进行合成得到的酪氨酸,但是在本技术中,为了简化描述,在不同特别说明的情况下用npy表示“npy基因”的基因名。
32.hnpy:即人源npy,全称人源神经肽酪氨酸(也有采用“人源神经肽y”的用法),英文human neuropeptide y,缩写hnpy。在本技术文件中,如果没有特别指明的情况下,所述的
npy就是hnpy的简称。当然,可以应用其他npy实现本实验的技术方案,基于相应的生物学特性,同样能够达到相同或类似效果。但是,在本发明中,作为优选方案,为获得与临床(人类)相关的拟人动物模型,所以选择了人源npy;当然,也可以基于其他方面的需要,从而选用需要的npy。hnpy基于“hnpy基因”进行合成得到的酪氨酸,但是在本技术中,为了简化描述,在不同特别说明的情况下用hnpy表示“hnpy基因”的基因名。
33.agrp:全称豚鼠相关蛋白(也有采用“agouti相关蛋白”的用法),英文agouti-related protein,缩写agrp。agrp基于“agrp基因”进行合成得到的蛋白,但是在本技术中,为了简化描述,在不同特别说明的情况下用agrp表示“agrp基因”的基因名。
34.hagrp:即人源agrp,全称人源豚鼠相关蛋白(也有采用“人源agouti相关蛋白”的用法),英文human agouti-related protein,缩写hagrp。在本技术文件中,如果没有特别指明的情况下,所述的agrp就是hagrp的简称。类似hnpy在本发明的选择,当然可以应用其他agrp实现本实验的技术方案,达到相同或类似效果。但是,在本发明中,作为优选方案,为获得与临床(人类)相关的拟人动物模型,所以选择了人源agrp;当然,也可以基于其他方面的需要,从而选用需要的agrp。hagrp基于“hagrp基因”进行合成得到的蛋白,但是在本技术中,为了简化描述,在不同特别说明的情况下用hagrp表示“hagrp基因”的基因名。
35.pvn:全称下丘脑室旁核,英文paraventricular nucleus of the hypothalamus,缩写pvn,也有缩写为pvh,但是pvn更常用,本技术中采用pvn的缩写方式。
36.血凝素,英文hemagglutinin,缩写ha。
37.flag-tag,即flag标签,flag 对应的是一个8个氨基酸的肽段dykddddk(peptide sequence dykddddk), 其作用是对靶蛋白进行标记。在蛋白表达和定位研究中, 可以通过基因工程技术手段将所要研究的目的基因和flag-tag基因序列连接起来,可以连接在目的蛋白的c端或n端, 然后将整合后的基因转入细胞中或胚胎干细胞抑或受精卵中. 后续检测主要通过flag-tag这段肽链形成的免疫决定簇与其单克隆抗体的特异性结合来实现. 检测手段有免疫荧光(immunofluorescence), 免疫印记(western blotting)等。
38.动物模型(即动物疾病模型),动物疾病模型主要用于实验生理学、实验病理学和实验治疗学(包括新药筛选)研究。人类疾病的发展十分复杂,以人本身作为实验对象来深入探讨疾病发生机制,推动医药学的发展来之缓慢,临床积累的经验不仅在时间和空间上都存在局限性,而且许多实验在道义上和方法上也受到限制。而借助于动物模型的间接研究,可以有意识地改变那些在自然条件下不可能或不易排除的因素,以便更准确地观察模型的实验结果并与人类疾病进行比较研究,有助于更方便、更有效地认识人类疾病的发生发展规律,研究防治措施。
39.人类疾病的动物模型(animal model of human disease)是指各种医学科学研究中建立的具有人类疾病模拟表现的动物。
40.嵌合动物模型(即嵌合基因动物模型,也可称为基因嵌合动物模型,本技术中统一使用前者),作为一种非种系遗传 (non-germline)动物模型,通过有目的地对动物局部组织或器官的基因(体细胞中的基因)进行改造,诱导表型产生,形成相关病理模型(动物模型)。嵌合动物模型是可稳定遗传动物模型的延续与补充。在本技术中所使用的基因改造技术为基因过表达,属于转基因技术的手段之一。当然,也可以使用其他基因改造技术来实现。此外,本发明公开了基于基因过表达的非人灵长类嵌合基因动物模型,尤其是基于基因
过表达的嵌合基因工程猴。
41.动物行为,指动物所做的动作、活动,包括动物的位置移动、肢体运动、进食、求偶、争斗和体色变化等等;是为了满足动物的基本生存和繁衍的需要,适应体内、体外环境变化的一切反应的总和。动物的一切行为基本取决于三个因素:外界和内部刺激、动物的感觉器官与神经系统的功能状态和动物机体的结构与生理特性。
42.动物行为模型,基于动物行为所建立的动物模型,包括通过外在、内部的各种刺激(比如物理刺激、化学刺激、生物刺激等)、干预等,使得动物的行为按照模型构建者的需要进行发展,并基于所述行为的改变,对动物的生理等发生影响,从而构建出满足模型构建者要求的动物疾病模型。本发明所公开了基于相应的特定目的基因实现特定动物行为模型的构建,基于相同的原理,本领域技术人员完全能够根据需要选取其他合适的目的基因,采用本发明所公开的技术方案,实现其动物行为模型的建立。
43.基因过表达:基因过表达是利用转基因技术,使得某个特定基因表达超出原有水平。基因过表达的基本原理是通过人工构建的方式获得含上游调控元件的目的基因质粒,通过转基因的操作将上述质粒转导进细胞或组织器官,实现目的基因的大量转录和翻译,从而实现基因产物的过表达。基因过表达不涉及基因编辑,其是把载体携带的基因(目的基因)随机插入到染色体中,独立于原有基因序列,单独就上述目的基因片段进行转录,以使得细胞中的目的基因的表达超出正常水平,但是这种片段是游离于原有dna之外的。比如本技术中的目的基因hnpy基因被大量导入猕猴,使得这部分目的基因被转录超出其自身的原有水平,从而形成相应的病理模型。
44.本发明通过上述技术方案有效构建相应的动物模型,以及构建所述动物模型的方法,并基于所述动物模型、方法所实现的相关应用。由于在所有引起肥胖流行的因素中,过量摄食是主要的原因,发明人在研究中发现,下丘脑是大脑中的主要控制摄食的区域,下丘脑参与了感知营养与能量水平,调控食物摄取与能量消耗,进而维持正常的代谢平衡。下丘脑中的多个神经核团,如弓状核,室旁核,腹内侧核,和下丘脑外侧区等,参与调节能量代谢平衡。这些神经核中的神经元,通过不同的化学信号分子,如递质,细胞因子,神经肽等,进行摄食调控,但是,如何在采用可控且有效的技术方案,批量化地建立性状稳定的动物模型存在诸多难点和障碍,也导致现有的研究和探索中,都无法采用简单的方案转用等予以实现。本发明发明人经过反复的理论分析和实验,发现,由于下丘脑中的npy主要来源于弓状核中的神经元,npy神经元的轴突直接投射到室旁核,而且室旁核是npy神经元的主要靶区,因此从弓状核到室旁核的神经信号通路在调控摄食行为中发挥了重要作用。基于上述发现,以及相关的研究和实验构建了通过(转基因)技术在下丘脑实现npy的过表达,构建了相应的动物模型,尤其是构建了嵌合基因动物模型,并基于非人灵长类动物——猕猴,构建了非人灵长类嵌合基因动物模型,尤其是嵌合基因工程猴模型;基于所述技术方案,也可以用于构建动物行为模型。
45.在技术方案的具体实现方面,本发明中,作为优选的技术方案,利用核磁共振扫描技术,精准地将分别包含特异性表达的hnpy慢病毒(lenti-hnpy)注射到年轻实验猕猴的双侧室旁核。实验结果发现hnpy过表达猕猴的体重和摄食行为均显著增加(改变其饮食行为,促进食量增加,从而导致体重增加)。显然,本发明的非遗传性嵌合基因工程猕猴模型作为临床转化肥胖模型,可用于肥胖研究,以及探索针对肥胖的新的临床治疗策略;当然,也可
以进一步转化为糖尿病模型。
46.此外,作为本发明的发明点之一,本发明提供了嵌合基因动物模型,并对使用载体的基因序列进行了优化,尤其是对于所使用的目的基因hnpy等进行了优化(具体参见lenti-hnpy序列表),以改善嵌合基因动物模型的构建效果,尤其是对于嵌合基因工程猴模型的构建具有显著效果。
47.下面以举例的方式给出本发明具体实现和应用的部分实例:本发明的发明人在实现本发明的过程中发现,为解决因肥胖发生率的逐渐提高,而影响男女老少大众健康的问题,需要不断开发新的肥胖治疗手段,以及研究相关致病机理等,需要利用合适的动物模型进行临床前研究。目前,已经大量将狗、猪、小鼠和大鼠的动物模型用于研究肥胖,及与肥胖相关的健康问题。为了构建相应的动物模型,现有技术中,有喂食引起的动物模型和基因工程模型。啮齿类动物模型研究,极大推动了对人类肥胖病因的探索。然而,啮齿类动物实验的发现在进行临床转化过程中往往是失败的,如何实现更有效的临床前动物研究模型是当前需要解决的技术问题。因为遗传学和生理学上与人的相似性,非人灵长类模型将是更好的进行有价值的转化医学模型,将成为链接啮齿类动物实验与人类临床的桥梁。本发明提供了通过慢病毒介导的人源npy/agrp在室旁核的过表达,所实现的动物模型的构建,具体地是在猕猴室旁核的过表达,所实现的猕猴动物模型的构建。所述动物模型、猕猴可以作为相关病理研究、新药筛选等。具体地,本发明通过如下实施例予以实现。
48.如图1所示,根据动物模型构建目标的需要,进行动物甄选、载体构建,将载体导入动物、动物护养,载体中的目的基因在动物体内(细胞中)实现基因过表达的转录,使得动物形成满足动物模型构建目标的性状,通过对动物模型性状进行检验,满足构建模板的动物成为相应的动物模型。具体说明如下:在本技术中,为了构建调控摄食行为的嵌合基因工程猴模型,以猕猴作为对象,选择hnpy作为目的基因,通过转基因技术——基因过表达——对猕猴的室旁核进行相应的基因改造,实现发明目的。
49.一、动物甄选采用猕猴,当然可以根据需要选择其他类型的动物,在本发明中,为了实现遗传学和生理学上与人的相似性,选择非人灵长类模型将是更好的进行有价值的转化医学模型,更好地模拟人类的相关病理模型。在本发明中,考虑到猴子的自发肥胖是在成年时期逐渐产生与发展的。为了探究对幼年猕猴进行基因工程改造是否会导致实验动物肥胖,本发明的发明人选择1岁半左右的雄性猕猴进行实验(选择其他年龄段猕猴也可以,优选为1-2岁猕猴)。为了便于实验的对照,在本发明的实验过程中选用1岁龄雄性猕猴。当然,选择其它灵长类或者其它年龄段的猕猴或灵长类也可以实现本发明。并且基于本发明的技术思想,可以根据不同应用,采用不同的甄选标准、条件。
50.在本发明的验证实验中,采用了24只1岁龄雄性猕猴作为实验对象,其中8只注射对照病毒(作为对照组),8只注射npy基因过表达病毒lenti-hnpy(用以构建嵌合基于动物模型),8只注射agrp基因过表达病毒lenti-hagrp(用以构建嵌合基于动物模型),本技术只对相应类型基因过表达病毒的实验对象进行讨论,在此全部给出相关信息,以进一步确保给出本发明实验过程的完整性和客观性。后续的操作条件及步骤(包含所需各类器械、药
品、试剂等的用量也是基于前述实验对象的类型和数量来确定的,其均可以根据不同的对象进行适应型调整和变化),均以此为基础进行说明,但是,所述实验对象的选择并不代表对本发明技术方案的局限,尤其是不是对本发明及本发明应用范围和保护范围的限制,仅仅便于进行科学、客观的对比和实验,用以说明本发明的科学性、可行性、实用性,以及相应的技术效果。
51.二、载体构建(病毒制备)。
52.具体应用中作为优选方案,确定基因过表达使用lenti病毒为基础构建载体(当然,也可以根据应用的需要,选择相应的其他病毒为基础构建载体)。同时由于本发明的发明所定位的器官为大脑,所以使用对大脑神经元有更强侵染性的亚型病毒。如图3所示,在验证本发明的实验中,所使用到的病毒载体名称如下:过表达目的基因的lenti病毒载体: lenti-hsyn-npy-2a-mcherry(简称:lenti-hnpy)(如图3(a)所示);lenti-hsyn-agrp-2a-mcherry(简称:lenti-hagrp);病毒载体序列见本技术所附的相应序列表。在没有特别指明的情况下,本技术所述的载体或病毒均为过表达目的基因的lenti病毒载体。
53.对照病毒载体:lenti-hsyn-mcherry(如图3(b)所示),采用与上述lenti-hnpy、lenti-hagrp相同的慢病毒,其差异点在于,没有包含目的基因hnpy、hagrp。在实际应用中,所述对照病毒载体并无实际意义,在本技术中,该载体的注射,目的在于与注射前述病毒载体lenti-hnpy、lenti-hagrp的猕猴进行对照,用以检验本发明的实际技术效果。
54.病毒载体中的元件作用说明:lenti 为名称前缀,用于区分病毒类型,如lenti(即为lenti病毒);hsyn为驱动不同基因表达的启动子名称;npy, agrp等为目的基因或者sgrna名称;2a为两个基因之间的连接序列;mcherry为荧光蛋白基因,形成荧光检测标记,用于指示病毒在体表达位置;flag,ha通常与目的基因融合表达,是用于检测目的基因的标签序列。需要说明的是,由于书写习惯问题,在本技术中对于所述载体的各个元件,以及除计量单位(国际单位)外,没用特殊说明时,大小写均表示相同的含义。
55.慢病毒(lentivirus,一般简称lenti)是一种应用广泛的转基因载体,对于分裂和非分裂的哺乳动物细胞,都能有效地传递外源遗传物质,并最终整合进细胞基因组。本发明以lenti慢病毒为载体,将目的基因传递到需要改造的体细胞基因中。图3(a)示意性地给出了相应载体的lenti-npy慢病毒表达载体结构(图中只给出了特异性部分的相关元件,没有绘制出其他元件,完整结构是在闭环质粒中。)进一步地,为了安全和有效性验证,病毒在使用前均应该经过小鼠在体表达测试实验,具体测试实验方式系现有公知的技术方案。图7给出了上述病毒(lenti-hnpy病毒载体)在小鼠大脑的表达荧光图片。图片显示了,人源npy慢病毒在小鼠大脑高表达,该病毒能够实现达到基因改造的目的,并且具有安全性。
56.如图3(a)所示,本发明首先构建的synapsin(中文名为:神经元突触素,缩写syn)为启动子驱动的flag-标记hnpy 和ha-标记hagrp的慢病毒表达载体( flag和ha是两个常用的标签,为了在将来实验中区分npy和agrp两个目标蛋白,验证本发明的实验中hnpy、hagrp使用了不同的标签,以便于区分hnpy和hagrp的过表达情形,具体应用中可选取其他标签,或者将二者进行交换,即所述的flag,ha可以根据需要选择其他标签。当然,应用中也
可以不需要相关标签)。为了检测载体的表达效率,通过把两个慢病毒载体分别注射进小鼠大脑去检测表达效率(该环节不是必备环节,在具体应用中可以省略)。显微注射三周后,本发明的发明人获得小鼠大脑的冰冻切片,检测了与npy或agrp共表达的mcherry红色荧光信号。结果显示,两个慢病毒均能在小鼠海马神经齿状回区域产生大量红色荧光信号(如图7所示),小鼠下丘脑注射后4
‑ꢀ
6周后,lenti-hnpy病毒显示高水平表达的hnpy。显然,这两个慢病毒能用于猕猴大脑注射的下一步实验操作。作为优选,本发明采用了hsynapsin(human synapsin)-启动子,其中文名为人神经元突触蛋白启动子,缩写hsyn(大小写均可)。具体地,在图3(a)、(b)所示的载体的特征部分结构中,ltr(long terminal repeat 的缩写,中文长末端重复序列,是存在于ltr反转录转座子(ltrs)两侧翼的长末端重复序列,是质粒的一部分),为病毒载体中的固定序列;hsynapsin为启动子;hnpy为需要过表达的目的基因;2a为联接胎,用于共表达mcherry;mcherry是一种红色荧光蛋白,用于指示病毒表达情况;wpre为转录增强元件。图3(a)、(b)是以线性质粒方式所表达的载体结构,而闭环质粒将此线性质粒两端的ltr连起来即可。
57.每个基因的表达受自身相关的调控元件的控制,常见的调控元件包括:1,启动子(promoter),本发明中的启动子是hsynapsin(即human synapsin,缩写hsyn);2,增强子(enhancer)(图中没有给出)。
58.为了保证病毒能被精准地显微注射到室旁核,在病毒注射前本发明的发明人利用核磁共振技术确定每只猕猴室旁核的定位(如图8所示)。表达hnpy或hagrp或对照红色mcherry荧光蛋白的三种慢病毒,分别被注射到两侧室旁核(如图3(c)、图4所示)。
59.通过分析安乐死的一只猕猴的脑片,本发明的发明人发现agrp慢病毒的表达能在室旁核区域被检测到,且表达效率高(如图5、6所示)。图5所示的病毒注射后猕猴室旁核的荧光图片(背景是细胞核标记hoechst染色),图中左侧为猕猴脑部结构示意图,右侧4张图片为猕猴pvn部位依次的切片荧光图。因为实验原因(降低实验成本和成活猕猴的管理,只是做了lenti-hagrp载体的切片,用以检测实验的状态),事实上,由于采用相同的慢病毒,lenti-hnpy载体也具有相同的表达。
60.包含上述lenti-hagrp载体、lenti-hnpy载体的载体试剂中,lenti-hagrp载体或lenti-hnpy载体的载体颗粒浓度为109个/
µ
l。
61.所述载体及包含载体的载体试剂可以按照常规标准规程进行制备,所述导入的载体是以载体试剂的方式注入猕猴的室旁核2中。所使用到相关试剂等也为现有公知的试剂即可制备。
62.三、载体导入将所述载体导入到猕猴的体内,尤其是脑部的适当位置。所述导入可以采用诸如直接注射、显微注射、介入方式导入等现有技术手段来实现,也可以采取未来出现的新型导入手段。在本发明中,优选采用如下精准定位导入方案,具体地包括:所需仪器:核磁共振仪(英文缩写mri,如3.0t,也可用其他规格)、猴用脑定位仪、脑定位仪操作臂、微量注射泵、颅钻、手术灯、手术器械、猕猴专用转运车(台)等。
63.试剂、药物及消毒液:前述获得的载体,比如lenti-hnpy, lenti-hagrp过表达病毒,pbs若干、生理盐水、若干氯胺酮0.1g/支、若干咪达唑仑10mg/支、若干尼可刹米0.375 mg/支、若干鱼肝油φ5mm、生理盐水0.9%(250ml)、若干碘伏消毒液500ml/瓶、注射兽用抗生
素。上述除了相关载体病毒外,其他药物作为辅助,可以根据需要选配。
64.耗材:手术衣、手术帽、口罩若干、无菌手术手套十副、备皮包24个、清创缝合包24个、明胶止血海绵24包、七号留置针24具、空针(1ml
×
24具,2ml
×
24具,20ml
×
24具)。
65.步骤(如图1,并结合图2所示):1. 麻醉1)方法:全麻,通道:静脉留置针建立通道,生理盐水封管,麻醉药剂量:氯胺酮2mg缓推。之后以1.5mg氯胺酮据睫反射或尾部及四肢反射情况维持量直至实验结束。(首次氯胺酮用量可以加大)。
66.2)剔除头部毛发,暴露整个颅脑头皮层。
67.3)开创:以眉弓后方3cm处为坐标进针点(坐标点),碘伏消毒范围3cm至5cm,以点为中心做一冠状状切口约4cm,剥离骨膜充分暴露顶状骨及坐标点位置。在猕猴头骨骨缝点位置钻一小孔,用于放置一颗鱼肝油颗粒,作为下面mri扫描基点(原点:0,0,0)。所述的鱼肝油颗粒目的在于利用油脂在核磁共振仪(mri)上会形成与猴脑部组织不同的成像特征(鱼肝油为白色成像),以便于作为参照点进行定位,当然,也可以根据不同的场景和扫描设备,选用其他的材料作为定位参照点,比如ct等时,采用金属颗粒等。图8给出了部分实验猕猴核磁共振扫描图片。实验猕猴编号c1406067的原始扫描图片丢失。图中实验猕猴头顶的白色亮点是矿物油药片(鱼肝油颗粒),即白色箭头所指示的部位,图中白色箭头为便于展示,后续人为添加的标记,用于确定实验动物的室旁核三维坐标参数。
68.4)固定:将猕猴通过耳棒及舌板固定于磁共振兼容性脑定位仪内。
69.5)mri扫描及靶点计算:猕猴戴定位仪进行磁共振扫描。采用3.0t磁共振头线圈进行扫描,获得薄层轴位t1及t2图像,矢状位t1成像,扫描数据为:te100-120,tr3800-6000;层厚2mm;层间距0;fov=280
×
280mm;在猕猴头骨骨缝点位置小孔,放置一颗鱼肝油颗粒,作为基点,用于确认注射部位坐标。在定位仪水平位上黏贴三颗鱼肝油颗粒,呈直角三角形放置,用于确认扫描时的水平面,及扫描基线,扫描范围从颅底至颅顶,包含所有磁共振定位点。参考猕猴脑磁共振显相(即显像)和对照图谱确定双侧室旁核。确定坐标进针点以及测量计算出靶点坐标值,并在该靶点前后,左右及上下1mm出选择6个靶点,进而完成下丘脑室旁核准确定位。改进后整个过程约1-1.5hr。
70.该步骤的目的在于确定每个个体准确注射部位,因为个体差异,每个个体的相应器官和操作部位的准确位置是不同的。对于可以其他对象,以及其他可以直观展现的部位,可以采用其他测量方式,或者直接操作。
71.同时,上述1)-5)目的在于便于猕猴的固定、进行注射位置的准确定位和操作,所述技术方案也可用其他方式实现,也可根据需要进行替换或省略。
72.6)开孔:小心将猕猴带定位仪从磁共振仪器内取下,过程中注意保证头颅在定位仪中不发生位移。以注射原点为中心开一大小约6mm至8mm的骨窗充分暴露脑膜。开孔过程中注意用生理盐水降温,同时在接近骨膜时减轻颅骨钻力度,防止瞬间贯穿颅骨及脑膜,造成皮层损伤。最后用针或者镊子将所剩颅骨薄层揭去,暴露脑膜。
73.整个钻孔过程时间约为:10-15min/孔。7)注射试剂:装配机械臂,微量注射泵及注射针头。
74.以其中一只实验猕猴为例如下:
通过定位臂将注射针针头正好放置于颅骨鱼肝油颗粒的正中心位置,此时坐标仪上所得x, y, 及z 数值为注射原点坐标。
75.实际注射点的坐标,通过在原点坐标上加减上一步磁共振扫描所换算得到的室旁核与原点在前后及深度上的距离而产生。按照此坐标进行定位臂的移动及进针操作,如果在进针点正下方有明显的血管,则稍向前或者后移动一定距离避开血管再下针,将此距离记下。
76.每个位点注射时间:2分钟/
µ
l 病毒体积(即载体试剂),每个位点留针7-8min。 缓缓拔出注射器需要3-4min。由于注射的病毒(载体)试剂中,载体颗粒浓度为109个/
µ
l,使得进入室旁核2中的载体颗粒数量显著大于室旁核2的细胞数量,并且是细胞数量的2倍以上,以确保过表达的实现。
77.为了便于理解,特以举例方式给出如下的参照,以下所示具体坐标数值只是示意性的说明,具体实施时,需要根据具体情况核对并记录相关数据。
78.原位坐标:x=7.08 cm,y=-2.19cm,z=6.32cm;右:x=1mm,y=-2.19cm,z=6.32cm;左:x=1mm,y=-2.19cm,z=6.32cm(30cm实标)如图4所示,其为整个猕猴大脑分别以矢状面及冠状面将猴脑大意分为上下左右四部分的示意图(图中虚线作为四个部分的所以信息分界):载体注射进针点31位于正中,分居于改点四周的辅助注射进针点32包括,左上(a点),右下(c点),右上(d点),左下(b点)。
79.载体注射进针点31:注射2
µ
l载体;a点:注射紫色染色剂2
µ
l;x=7.38 cm,y=0.29cm,z=3.32cm;原点修正:x=7.08 cm,y=-2.19cm,z=6.68cm。
80.b点:注射油脂5
µ
l;x=7.08-0.1=6.98cm;y=-2.19cm,z=6.68-2.8=3.88cm。
81.c点:注射绿色染色剂2
µ
l;原点修正:x=7.08cm,y=-2.19cm,z=5.85cmc点坐标:x=7.38cm,y=0.09cm,z=5.85-3.0=2.85cmd点:注射调控病毒2
µ
lx=6.98cm,y=-2.19cm,z=皮下0.4cm。
82.8)注射后磁共振成像扫描(导出成像数据图,用于后续分析验证实验结果)。
83.9) 缝合切口消毒创面及周围3到5cm,明胶海绵填塞开孔骨创部,缝合头皮。清理缝合创面,及时补充生理盐水与抗生素。
84.需要特别注意的是,麻醉前猕猴的饮食:禁食8小时禁饮6小时;麻醉期间严密观察猕猴的呼吸,心率,专人观察若有异情立即抢救;切口注意止血及开孔时注意颅内容物因压力或体位改变引起的外流;转运猕猴途中应密切观察猕猴的生命体征;整个实验过程注意猕猴的保暖及外界温度的恒定;操作迅速精准,不耽误实验每一步的进程,熟练每-项操作固定读数以及用药;切记勿将碘伏消毒液误入颅内;扫描过程中及时记录及磁共振成像的
记录;术后的护理专人看护记录;尤其是避免术后感染,以后还需要特定人员观测相关行为。
85.在实际应用中,除了采用上述方式,还可以采用直接定位注射,无需对头骨进行开创,比如采用定位高速钢针,在进行消毒、麻醉的情况下高速扎入,并注射病毒等,或者采用其他现有技术或新技术进行相关的操作。
86.需要说明的是,上述病毒显微注射的导入技术方案虽然存在利用医疗设备、器械及药物对猕猴头部局部做创伤性处理,目的是在尽可能减少对猕猴伤害,以及尽可能降低其它药物等对猕猴影响的情况下,准确地将载体导入到猕猴脑部的适当位置(如室旁核),但是所述处理并不涉及疾病的诊断和治疗。
87.四、动物护养(护理与喂养)。
88.如图2所示,对于采用上述开切创口的方式实现的载体导入,应将导入载体后的猕猴送入观察室,待猕猴完全苏醒,及生命体征正常平稳,创口无出血等,即开始给予抗生素处理,最好可以注射,具体注射计量可以根据现有技术公开的方案予以实施。在猕猴伤口愈合过程中,采用现有技术方案对其进行相应的创口处理,并可根据需要使用药物,促进其伤口愈合。后续,对猕猴采用现有普通的饲养方式进行喂养,并注意猕猴的生命体征变化情况,做好相应的观察记录。猕猴经过两周的精心照料,即可基本完全从恢复过来。在进行载体注射后,在猕猴复苏和伤口愈合期间,必须实时监控(bw监控)猕猴的状态,在载体注射后两周(第14日)左右以后,即可采用常规方式予以管理和饲养。
89.对于其它方式导入载体的猕猴,应该送入观察室进行相应的观察,待其生命体征正常平稳。
90.五、基因过表达转录载体导入猕猴室旁核2中后,因生物活性,注射的lenti-hnpy载体转录到室旁核2体细胞中的基因中,实现室旁核2中hnpy的过表达,诱导表型产生,形成相关病理模型。其实现形式包括:hnpy游离于原有目标dna外,且不随机整合插入染色组dna,只是在细胞进行瞬时表达,随着细胞分裂,过表达基因片段hnpy逐渐被稀释,但是因为脑细胞的不可再生性,hnpy不会被稀释,确保了嵌合基因动物模型性状的稳定性。或者,hnpy游离于原有目标dna外,但是随机整合插入染色组dna,过表达的基因片段可以在细胞分裂时被传递到分裂形成的新细胞中(对于其他可再生组织或器官也会发生作用,并在一定程度上保持嵌合基因动物模型性状的稳定性)。由于本发明的发明人的过表达是在体细胞中进行的,而不是生殖细胞,不会遗传给下一代动物,有利于该动物自身遗传特性的稳定性不受影响;当然也可以对其后代再次构建其他嵌合基因动物模型,而不受上一代构建的嵌合基因动物模型的影响。
91.当然,过表达基因片段随机整合插入染色组dna,根据插入位点的位置,及插入位点是否有功能,决定是否会导致插入位点相关基因或元件的功能缺失或增益。但是,由于其原理是随机的,故通常把过程定义为转基因操作,而不是基因编辑。相对来说,基因编辑是定点,在实验开始前就可以预测编辑后的结果。
92.六、动物模型性状检验通过分析安乐死的一只猕猴的脑片,本发明的发明人发现agrp慢病毒的表达能在室旁核区域被检测到,且表达效率高(如图5、6所示)。图5所示的病毒注射后猕猴室旁核的
荧光图片(背景是细胞核标记hoechst染色),图中左侧为猕猴脑部结构示意图,右侧4张图片为猕猴pvn部位依次的切片荧光图。因为实验原因(降低实验成本和成活猕猴的管理,只是做了lenti-hagrp载体的切片,用以检测实验的状态),事实上,由于采用相同的慢病毒,lenti-hnpy载体也具有相同的表达。
93.进一步地,结合图9-12所示的实验结果详细说明如下。
94.关于hnpy过表达对实验猕猴体重的影响如下:病毒显微注射实验完成后,实验猕猴经过两周的精心照料,基本完全恢复过来。本发明的发明人对每只实验猕猴,每两周进行一次体重秤量。此前在成年大鼠中的实验结果显示,病毒介导的npy在室旁核的过表达将导致体重增加。当实验猕猴在2周岁时,与对照组猕猴相比,npy过表达组猕猴的体重显著增加。有趣的是,npy组实验猕猴在病毒注射后的第6个月,就表现出明显的体重增加。如图9所示的hnpy在猕猴室旁核过表达引起实验猕猴体重增加变化曲线图,每月的体重变化图表显示病毒注射6个月后,npy组实验猕猴重量开始显著增加。箭头表示,实验中的三个采血时期。统计学分析,*p 《 0.05, **p 《 0.01, ****p 《 0.0001。数据:平均值标准误(误差条为平均s.e.m.(标准误差),即平均值标准误差,下同)。
95.对于hnpy过表达对实验猕猴摄食行为和体温的影响如下:图10给出了病毒注射后第7个月(对前3天进行了分析)对猕猴摄食行为、摄食量和血清胰岛素的影响情况显示,病毒注射后第7个月,npy组实验猕猴的摄食时间与摄食量都增加(图中a、b);运动行为和睡眠时间不受病毒注射影响(图中c、d)。npy组实验猕猴的血糖浓度没有改变,而在病毒注射后第10月,血清胰岛素水平增加;在病毒注射后第12月后,血清胰岛素的水平恢复正常(图中e、f)。数据:平均值标准误。图11的d中,给出了病毒注射后第7月,对照组,npy实验组连续监测三天体温变化,均没有明显差异。
96.通过录像记录分析和摄食监控,检测了人源npy过表达对实验猕猴摄食行为的影响。如图9所示,病毒注射7个月后,与对照猕猴比较,npy过表达实验组猕猴的体重显著增加;如图10所示,在连续3天的录像记录时期,npy过表达实验组猕猴的摄食时间与食物摄取量都在增加。另外,同期npy过表达组实验猕猴的运动量和睡眠时间与对照组相似(图10c,d),提示npy组实验猕猴的体重增加和摄食时间的延长是npy在下丘脑室旁核过表达的引起的,与运动能力变化不相关。本发明的发明人进一步测量了实验动物的体温,发现与对照组猕猴比较,npy或agrp过表达组实验猕猴体温在病毒注射后7个月未见异常(图11e)。
97.关于hnpy过表达对实验猕猴内分泌和代谢生化指标的影响如下:图11给出的hnpy在猕猴室旁核过表达对实验猕猴体温和其它代谢指标的影响情况,其中:a,病毒注射前甘油三酯,胆固醇,高密度脂蛋白,低密度脂蛋白,非酯化脂在对照组,npy实验组实验组中的浓度。b,病毒注射后第10月,甘油三酯,胆固醇,高密度脂蛋白,低密度脂蛋白,非酯化脂在对照组,npy实验组和agrp实验组中的浓度。c,病毒注射后第12月,甘油三酯,胆固醇,高密度脂蛋白,低密度脂蛋白,非酯化脂在对照组,npy实验组和agrp实验组中的浓度。
98.本发明的发明人分别在病毒注射前(0点),npy或agrp病毒注射后的第10和第12月时期,采集的实验猕猴的血清,分析了部分内分泌和代谢生化指标。如图10的e所示,在三个时期,npy或agrp组实验猕猴的血糖水平正常;在注射后的第10月,npy组实验猕猴的血清胰
岛素浓度显著高于对照组;然而,第12月,随着在冬季npy组实验猕猴体重变化不显著,血清胰岛素的浓度变化亦不显著(如图10f)。在所有三个时期,与其体重无明显差别一致。血清胰岛素浓度的变化与实验动物的体重相关。其它血液生化指标检测结果显示,甘油 三 酯,胆固醇,高密度脂蛋白,低密度脂蛋白,非酯化脂在过表达中实验猕猴血清中的浓度未见异常,不受npy过表达的影响。
99.检测了慢病毒介导hnpy在室旁核过表达对年轻猕猴体重,摄食行为和内分泌代谢指标的影响。人源npy在实验猕猴室旁核的过表达,在病毒注射后的第6月,引起体重,摄食时间和食物摄取量的增加。这个发现,与在大鼠中的实验结果一致。然而,人源agrp在实验猕猴室旁核的过表达,在病毒注射后的第19月,引起体重增加;这个发现不同于agrp在啮齿类动物实验结果。由于分别表达hnpy的慢病毒在动物体内的表达水平接近,本发明的发明人分析在猕猴发育早期,hnpy对体重的调控通过不同的机制,导致hnpy在不同时期调控介导猕猴体重变化。
100.病毒注射10月后产生npy组实验猕猴体重增加,伴随着血清胰岛素水平的增高。当npy组实验猕猴体重在冬季下降到与对照组猕猴类似时,血清胰岛素水平也回复正常。这一发现与已知的人的体重降低是血液胰岛素水平的决定因素一致。以前的研究中,有关npy过表达对血糖浓度和体温的影响不尽一致。本发明的发明人的研究,在病毒注射前后没有观察到。
101.关于hnpy组实验猕猴的血糖浓度与体温与对照组有差异如下:本发明的发明人没有观察到其它血液生化指标,如甘油三酯,胆固醇,高密度脂蛋白,低密度脂蛋白,非酯化脂等在过表达中实验猕猴血清中的浓度异常。这一观察与已报道的npy长期灌注对脂肪酸的影响是暂时的结果一致。
102.此外,图12给出了病毒注射后猕猴血液的npy水平,agrp和瘦素变化情况,经向方差分析与事后测试显示,在病毒注入后第10 、12、19月,血液的npy水平,agrp和瘦素在注射了lenti-hnpy的猕猴中都没有改变(数据:平均值标准误),可见,在室旁核2中注射的lenti-hnpy只是对猕猴局部组织的基因发生了影响,构成了嵌合基因动物模型。
103.总之,本发明的发明人的实验数据显示,在年轻猕猴的室旁核过表达hnpy将导致体重增加。摄食行为,摄食量,血清胰岛素水平的变化,与实验猕猴的体重变化正相关。在将来的研究中,本发明的发明人还需要继续探讨和分析人源npy或agrp在室旁核过表达对实验动物的长期影响。显然,非遗传性的嵌合基因工程猴是很好的转化医学动物模型,能为包括防治包括肥胖/神经系统疾病等疾病提供新临床治疗手段。
104.本发明提供的技术方案(包括方法、动物模型等)能够用于研究防治包括肥胖/神经系统疾病、糖尿病等疾病的致病机理、临床治疗手段、相关治疗药物的验证与试验及临床前的其他相关研究、探索针对肥胖、糖尿病等疾病新的临床治疗策略等。以及按照特定需求进行其他动物的饲养,比如增加试验动物体重、促进动物进食等,以提供动物养殖的效率和质量,并且由于所改造的基因在特定组织或器官,不涉及动物的其他组织或器官,不会引起公众对转基因技术在食品领域安全性的顾虑。
105.由于本发明所操作的器官是大脑。大脑神经细胞不具有继续分裂再生的能力,所以理论上在大脑中进行基因敲除后不会有新的细胞进行替代,敲除或过表达的效果应该是永久的,不会因为机体的自我修复能力而丧失相关模型的特性,相关性状稳定性、持续性
好,可再现程度高。同时,上述方案获得的动物模型,由于没有对其个体基因进行修饰或编辑(对于病理模型发生本身的部位),没有引入其他因素,减少了其他不可控因素的影响,确保相关研究和实验的科学性和准确性。操作中,所述的病毒载体数量远大于对应位置组织或器官的脑细胞数量,可以确保对应区域的全部脑细胞都被感染,从而实现对其干扰。从而实现在局部脑区或神经核的基因过表达,形成嵌合基因动物模型。
106.同传统的可遗传基因编辑动物模型相比,嵌合动物模型具有周期短、表型外显率高、同步性高、可重复性高、大规模批量获取容易、成本低等多种优势。而且实现的技术手段可以多样化,比如,通过局部注射基因改造后的干细胞,或基因改造后的载体(如病毒)等,在动物机体局部造成基因改造,诱导表型产生。此外,诸如以肿瘤疾病为代表的细胞特异性疾病通常都是在局部基因突变前提下发生的,病变细胞处于周围正常细胞微环境中。显然,全身性可遗传基因突变动物模型不能完全模拟细胞特异性疾病发生的实际生理状态下的进程。而嵌合动物模型可以真正模拟细胞特异性疾病在正常生理微环境中的发生与发展,而不是传统模型的非正常突变背景。更重要的是,这一方案解决了建立种系遗传基因工程猴费用高、时间长、数量少、难度大等的制约。尤其是针对不少人类疾病是器官、组织、细胞异质性局部病变的特性,可以利用相关基因技术在相关动物组织、器官体细胞中进行精确的基因改造,建立嵌合动物模型。因此,本发明的所述的技术方案可以广泛应用于不同动物模型的构建,适应面广。
107.本发明的技术方案可应用于多种模型,可以根据需要进行相关模型的建立(利用该技术方案,在选择恰当的病毒载体及基因片段,对相应的部位、器官、组织按照本技术方案进行操作,即可以实现)。
108.该模型特点主要是:a,在成年灵长类中进行;b,本发明是局部基因改造,可以是单一基因位点,也可以是多个基因位点组合;c,本发明的模型可以用于临床药物的筛选。
109.需要说明的是,本技术是以“申请人于2018年11月13日向中国国家知识产权局提交的申请号为201811343685.4,发明名称为
‘
动物模型构建方法、动物养殖方法、动物模型及其应用’之申请”作为优先权基础。在本技术中,为了使得相关表述更为清楚、准确、完整,部分术语和描述方式与上述作为优先权基础的表达方式略有差异,但是,作为本领域技术人员足以进行判别,并能够使得本技术的相关内容被得到支撑。
110.说明书和权利要求中,如果文中描述的一种方法包含一系列步骤,在此出现的这些步骤的顺序不一定是执行这些步骤的唯一顺序,并且某些提到的步骤可忽略和/或可将没有在此描述的某些其它步骤加入该方法中。此外,术语“包含”、“包括”、“具有”及其任意变形,用来涵盖非排他性的包含,这样包含一系列要素的一种过程、方法、物件或装置不一定仅限制于那些要素,而是可包含没有特别列出的或这些过程、方法、物件或装置所固有的其它要素。
111.以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
