1.本发明属于微生物发酵加工领域,具体涉及一种利用益生菌发酵法提高百合多糖抗氧化能力的方法。
背景技术:
2.兰州百合(lilium davidii var.unicolor salisb)是百合科(liliaccae)百合属(lilium)川百合的一个变种,是我国唯一的“药食同源”甜百合,是甘肃省重要的“独一份”“甘味”特色农产品。兰州百合鳞茎扁圆形,且瓣大肉厚、洁白如玉、含糖量高、粗纤维少、肉质细腻、味醇香甜,含有较丰富的多糖、蛋白质、果胶质等多种营养成分,有很高的食用、药用、保健和观赏价值。兰州百合多糖(lp)是兰州百合的主要功能成分之一,其多糖含量可达干重的21.9%~31.2%,特别是在加工过程中剥离的外层鳞片,多糖含量高于其它部位鳞片5-10个百分点,可进一步进行深度开发利用。研究发现百合多糖具有抗氧化、免疫调节、抗疲劳、降血糖和抗肿瘤等多种生物活性。专利(cn101088509a)公开了以百合多糖为主要药效成分的营养保健口服液具有免疫调节、抗氧化、抗衰老、降血糖等多种功效,对免疫功能低下、年老体衰者有强身健体之保健作用,对糖尿病患者有保健和辅助治疗作用。益生菌发酵法的新兴果蔬加工技术,对百合浆汁进行生物转化,并开发富含功能性多糖的百合饮品及其多糖制品,是兰州百合综合利用的重要途径。
3.多糖的生物活性与其物理化学性质和结构密切相关,目前主要通过物理、化学和生物学等方法来修饰或者改造多糖,以提高它们的生物活性。微波、超声波等物理方法可改变分子的范德华键、氢键,最终改变了多糖结构,但是这些方法普遍存在设备要求高、能耗大、条件可控性差等缺点。化学修饰可以通过引入取代基或依赖强酸、强碱和自由基等可控化学降解过程来改变多糖的结构,提高活性,但此类方法反应剧烈、生物安全性差等特点在很大程度上限制了其在食品和医药领域的应用。微生物转化改性法因其特异性强,效率高,无副作用、便于工业化等优点已被用于制备抗生素、合成一些重要功能性物质等。例如专利(cn103436571b)公开了一种提高百合多糖活性的生物修饰制备方法,采用复合酶(β-甘露聚糖酶和β-葡聚糖酶)法对百合多糖(403.3kda)进行生物修饰(即酶法可控降解)。修饰后经分离纯化,产物百合多糖的分子量为8.0kda~70.0kda。修饰后的百合多糖活性显著提高,与底物相比,对巨噬细胞增殖活性增加40.5~77.2%。专利(cn109535271a)公开了一种抗氧化兰州百合多糖片段的制备方法,包括对兰州百合粗总多糖的制备、兰州百合总多糖的纯化、兰州百合总多糖分级纯化、兰州百合多糖片段制备,得到具有抗氧化活性的百合多糖片段。解决了百合总多糖成分复杂,分子量大,抗氧化成分不明确,不易提取等问题,通过本发明制备出的抗氧化活性的兰州百合多糖片段,对三种自由基dpph
·
、o
2-·
和abts+
·
均具有良好的清除作用,可有效避免机体组织和细胞的损坏,降低心血管疾病、癌症、老年痴呆症、类风湿关节炎等疾病的产生。
4.发明人发现,每年在百合售卖时,都会将百合外层的残次鳞片剔除,上述鳞片属于非商品外层鳞片,剔除后堆积丢弃造成了大量资源浪费。发明人从上述非商品外层鳞片中
提取百合多糖,发现提取到的百合多糖存在成分复杂,分子量较大,生物活性低等问题,故发明人应用微生物转化法对残次百合鳞片得到的多糖进行改性,以提高其生物活性。
技术实现要素:
5.针对上述技术问题,本发明的首要目的是提供一种利用益生菌发酵法提高百合多糖抗氧化能力的方法,包括以下步骤:
6.(1)湿法超微粉碎:取食用百合的非商品外层鳞茎,清洗,加水粉碎打浆,湿法超微粉碎;得到的百合浆更均匀细腻,没有分层结块,且无絮状沉淀产生。
7.(2)酶解处理:将步骤(1)得到百合浆用纤维素酶和果胶酶进行酶解处理;百合中含有较多纤维性成分,使用酶解处理,一方面可以促进营养成分被乳酸菌吸收利用,另一方面也有助于多糖成分的溶出;
8.(3)微波杀菌:将步骤(2)得到的百合浆分装于发酵容器中,百合浆与发酵容器体积比应为1:8-1:1.5v/v,用0.1m的柠檬酸或碳酸氢钠溶液调节体系ph值为4.5-7.5,采用微波杀菌,同时对步骤(2)中加入的酶进行灭活;可以防止百合浆中的微生物与乳酸菌争抢营养物质,导致乳酸菌生长不良,发酵效果不好;
9.(4)乳酸菌接种发酵:将植物乳杆菌和/或嗜酸乳杆菌接种于液体培养基中,扩大培养,得到种子培养液,并加入到步骤(3)得到的百合浆中,搅拌均匀,发酵;
10.(5)微波辅助提取:将步骤(4)中发酵完成的百合浆发酵液进行微波处理,终止发酵,并提取发酵液中的多糖成分;
11.(6)分离干燥:将步骤(5)得到的发酵液,过滤、离心、减压浓缩、冷冻干燥,得到百合多糖;
12.步骤(1)中粉碎的部位是百合鳞片,通常以加工过程产生的外层鳞片为主,加入蒸馏水的体积与百合鳞茎质量比应为1:15-1:1v/w,粉碎打浆时间应为0.5-3min,湿法超微粉碎时间应为5-15min。
13.优选的,步骤(2)所述的纤维素酶和果胶酶添加比例应为1:1-1:5,添加用量为每克百合原料使用50-250u、酶解时间为30-60min、酶解温度为35-60℃。
14.优选的,步骤(3)中微波灭菌功率应为500-900w,灭菌时间应为60-150s。
15.优选的,步骤(4)中所述的益生菌为植物乳杆菌和/或嗜酸乳杆菌;将益生菌菌株接种于mrs肉汤培养基中,37℃条件下,培养18-72h进行活化,活化种子培养液的菌浓度应为6.0-10log cfu/ml,种子液接种体积应占发酵体系的0.5%-3%v/v,发酵温度应为25-40℃,发酵时间应为12-96h。
16.优选的,步骤(5)中,加入蒸馏水的体积应为发酵液的0-5倍,微波处理功率应为400-900w,微波时间应为2-40min,处理次数应为1-3次。
17.优选的,步骤(6)中离心速度应为3500-5000r/min,离心时间应为10-20min。
18.优选的,步骤(6)中减压浓缩温度应为50-70℃,真空度应为0.6-0.9mpa,百合多糖浓缩液的体积应为浸提液的30%-60%v/v。
19.优选的,步骤(6)中,冷冻温度为-50℃~-65℃,真空度为1-10pa,抽真空时间为48-60h。
20.本发明的有益效果是:
①
本发明以百合加工过程中产生的非商品鳞片为原料,采
用益生菌发酵的技术,可以获得益生菌发酵百合浆,从上述百合浆中提取百合多糖,减少了百合非商品鳞片的浪费,也降低了百合非商品鳞片丢弃对环境的污染;
②
未发酵的百合多糖,成分主要是葡萄糖和甘露糖,葡萄糖占比60.8%,甘露糖占比39.2%,经过所述方法得到的百合多糖成分为葡萄糖,不再含有甘露糖,葡萄糖的比例从60.8%升高到100%,升高了64.5%;百合多糖的成分更加单一,性质更加稳定;
③
通过所述的方法得到的百合多糖,糖环的基本结构未发生改变,且热稳定性更好,还具有更高的dpph自由基、超氧阴离子自由基清除能力和还原力;
④
上述微生物转化法有效克服了传统的物理改性和化学改性过程中过程复杂、成本高、化学品毒性大等缺点,提供了一种利用微生物转化法改变百合多糖结构,降低分子量,提高溶解度和抗氧化能力的方法,在温和、可控条件下,实现了百合多糖结构的绿色化精确修饰。
附图说明
21.图1发酵前后百合多糖的分子量
22.图2发酵前后百合多糖红外光谱(ft-ir)和热重分析(tga)
23.图3发酵前后百合多糖的单糖组成分析gc-ms色图谱
24.图4发酵前后百合多糖的抗氧化能力
具体实施方式
25.下面结合具体的实施例对本发明的技术方案进行详细的说明,但是应当说明的是,本发明的保护范围并不限于以下实施例。本发明以下实施例中,使用的培养基包括mrs肉汤培养基,均是本领域技术人员常规使用的培养基,在本实验中,上述培养基是发明人从试剂公司购买所得。
26.应理解,上述简述和下文的详述为示例性且仅用于解释,而不对本文发明主题做任何限制。
27.实施例一、益生菌发酵法制备百合浆
28.(1)取食用百合的非商品鳞片,清洗后,加入与百合鳞片质量比为1:10(v/w)的蒸馏水,用破壁机粉碎打浆3min,再湿法超微粉碎5min。
29.(2)将步骤(1)得到百合浆用纤维素酶和果胶酶进行酶解处理,纤维素酶和果胶酶添加比例为1:2,添加用量应为每克百合原料使用100u、酶解时间应为60min、酶解温度应为40℃。
30.(3)将步骤(2)得到的百合浆按照与发酵容器体积比为1:6(v/v)的量分装于发酵容器中,用0.1m的柠檬酸或氢氧化钠溶液调节体系ph值为6.5,采用微波杀菌及灭酶活,微波功率500w,灭菌时间应为150s。
31.(4)将植物乳杆菌和/或嗜酸乳杆菌接种于mrs肉汤培养基中,37℃条件下,培养18h进行活化,活化种子培养液的菌浓度应为6.0log cfu/ml;将种子液接种于步骤(3)所得百合浆中,接种量占发酵体系的1.5%(v/v),发酵温度应为28℃,发酵时间应为96h。
32.(5)将步骤(4)所得百合浆发酵液进行微波杀菌,微波功率为500w,微波时间为2min,处理次数为1次。
33.本实施例制备得到了一种含有丰富多糖成分的百合浆,同时,发明人发现,使用非
商品外层鳞片制备得到的百合浆的多糖含量要比内层商品鳞片制备得到的百合浆的多糖含量高10%。
34.实施例二、益生菌发酵法制备百合多糖
35.应当说明的是,本实施例制备百合多糖可以直接使用实施例一制备得到的百合浆。也可重新从百合的非商品鳞片发酵开始,且本实施例在制备百合多糖的时还添加了酶解处理,可以将百合鳞片中含有的纤维成分酶解,有利于益生菌菌株的生长,也有利于多糖成分的溶解,具体如下:
36.(1)取食用百合的非商品鳞片,清洗后,加入与百合鳞片质量比为1:8(v/w)的蒸馏水,用破壁机粉碎打浆2min,再湿法超微粉碎10min。
37.(4)将步骤(1)得到百合浆用纤维素酶和果胶酶进行酶解处理,纤维素酶和果胶酶添加比例为1:3,添加用量应为每克百合原料使用200u、酶解时间应为30min、酶解温度应为55℃。
38.(5)将步骤(2)得到的百合浆按照与发酵容器体积比为1:1.5(v/v)的量分装于发酵容器中,用0.1m的柠檬酸或氢氧化钠溶液调节体系ph值为6.0,采用微波杀菌及灭酶,微波功率700w,灭菌时间应为120s。
39.(4)将植物乳杆菌和/或嗜酸乳杆菌接种于mrs肉汤培养基中,37℃条件下,培养36h进行活化,活化种子培养液的菌浓度应为7.0log cfu/ml;将种子液接种于步骤(3)所得百合浆中,接种量占发酵体系的2.5%(v/v),发酵温度应为35℃,发酵时间应为48h。
40.(5)将步骤(4)所得百合浆发酵液中加入5倍的蒸馏水,进行微波杀菌及多糖提取,微波功率为700w,微波时间为30min,处理次数为3次。
41.(6)将步骤(5)处理过的提取液进行过滤,滤液在5000r/min转速条件下离心15min,上清液在65℃减压浓缩至浸提液体积的40%(v/v),冷冻干燥,得到百合多糖。
42.实施例三、益生菌发酵法获取百合多糖
43.(1)取食用百合的非商品鳞片,清洗后,加入与百合鳞片质量比为1:3(v/w)的蒸馏水,用破壁机粉碎打浆0.5min,再湿法超微粉碎15min。
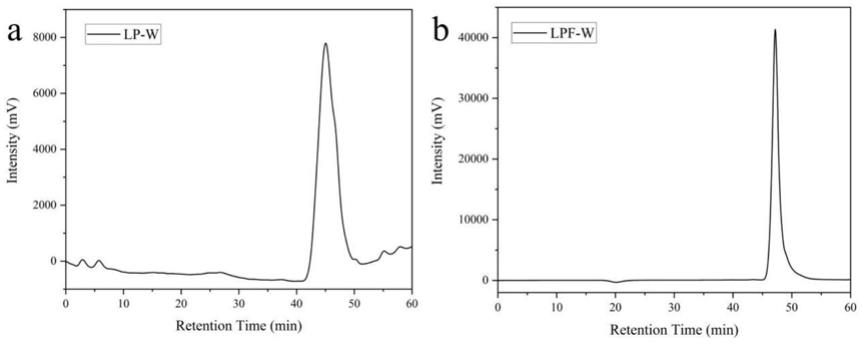
44.(2)将步骤(1)得到的百合浆按照与发酵容器体积比为1:3(v/v)的量分装于发酵容器中,用0.1m的柠檬酸或氢氧化钠溶液调节体系ph值为5.0,采用微波杀菌及灭酶,微波功率900w,灭菌时间应为75s。
45.(3)将植物乳杆菌和/或嗜酸乳杆菌接种于mrs肉汤培养基中,37℃条件下,培养60h进行活化,活化种子培养液的菌浓度应为9log cfu/ml;将种子液接种于步骤(2)所得百合浆中,接种量占发酵体系的1.0%(v/v),发酵温度应为37℃,发酵时间应为24h。
46.(4)将步骤(3)所得百合浆发酵液中加入2.5倍的蒸馏水,进行微波杀菌及多糖提取,微波功率为900w,微波时间为40min,处理次数为2次。
47.(5)将步骤(4)处理过的提取液进行过滤,滤液在4000r/min转速条件下离心20min,上清液在55℃减压浓缩至浸提液体积的50%(v/v),冷冻干燥,得到百合多糖。
48.本实施例制备百合多糖时还没有酶解处理的步骤,得到的百合多糖的浓度,成分以及生物活性均不如实施例二制备得到的百合多糖。
49.实施例四、常规方法提取百合多糖
50.(1)取食用百合的非商品鳞片,清洗后,加入与百合鳞片质量比为1:8(v/w)的蒸馏
水,用破壁机粉碎打浆2min,再湿法超微粉碎10min。
51.(2)将步骤(1)得到百合浆用纤维素酶和果胶酶进行酶解处理,纤维素酶和果胶酶添加比例为1:3,添加用量应为每克百合原料使用200u、酶解时间应为30min、酶解温度应为55℃。
52.(3)将步骤(2)所得百合浆中加入5倍的蒸馏水,进行微波辅助多糖提取,微波功率为700w,微波时间为30min,处理次数为3次。
53.(4)将步骤(3)处理过的提取液进行过滤,滤液在5000r/min转速条件下离心15min,上清液在65℃减压浓缩至浸提液体积的40%(v/v),冷冻干燥,得到百合多糖。
54.实施例五、不同方法制备得到的百合多糖性质分析
55.应当说明的是,本实施例研究百合多糖的特性,使用的是实施例二制备得到的百合多糖。
56.1.发酵前后百合多糖的分子量
57.兰州百合多糖的分子量通过高效凝胶渗透色谱法(hpgpc)测定,以不同相对分子质量的葡聚糖作为标准品,制作标准曲线,测定多糖的纯度及相对分子质量。
58.未发酵兰州百合多糖(lp-w)和发酵后百合多糖(lpf-w)的两个组分的分子量测定结果如图1所示,从各色谱图上可知色谱图均为单一组分峰,表明lp-w和lpf-w是均一组分的多糖。发酵后百合多糖lp的重均分子量(mw)从4.334
×
103da降至1.684
×
103da,数均分子量(mn)从3.915
×
103da降至1.553
×
103da,分散系数(mw/mn)从1.107降至1.084,lpf-w的分散系数小于lp-w。这些结果表明,通过植物乳杆菌发酵能够改变兰州百合多糖的分子量,而且发酵后兰州百合多糖的组分更加均一。
59.2.发酵前后百合多糖红外光谱(ft-ir)和热重分析(tga)
60.以kbr压片法进行百合多糖红外光谱分析。精密称取2mg经充分干燥的兰州百合多糖组分lp-w和lpf-w,与200mg烘干的kbr混匀后研磨并压制成片,以thermo nicolet is10红外光谱仪在400~4000cm-1
波数范围内扫描,分辨率为4cm-1
。
61.lp-w和lpf-w在4000~500cm-1
范围内的红外吸收光谱图为图2a。从图中可以看出,lp-w和lpf-w均显示多糖的特征吸收峰:3200~3600cm-1
之间强而宽的吸收峰是o-h的伸缩振动吸收峰;2900~3000cm-1
之间是甲基或亚甲基c-h的伸缩振动峰;1700cm-1
~1600cm-1
之间的红外吸收归属于coo-基团的c=o非对称伸缩振动引起的;在1050cm-1
出现的强吸收峰是由糖环中c-o-c的伸缩振动引起的。多糖的α型差向异构体c-h取平伏键,在844
±
8cm-1
之间有吸收,而β型c-h直立键在891
±
7cm-1
之间有较弱吸收。lp-w在921cm-1
和854cm-1
处有吸收,这提示单糖结构中具有甘露糖,并且为α型差向异构体;lpf-w在879cm-1
之间有较弱吸收,表明其为β型差向异构体。上述结果表明,经微生物转化以后,糖环的基本结构未发生改变。
62.tga分析采用pyris diamond热重分析仪(美国perkin elmer)进行。样品(3mg)在n2气氛下以10℃/min的升温速率从25℃加热到800℃,参比物为al2o3。
63.热稳定性是高分子聚合物的一个重要性质,而多糖的热行为对其可能的应用有着重要的影响。lp-w和lpf-w的热稳定性测量数据如图2b所示。可以看出,发酵前后得到的lp具有相似的tga曲线,lp-w和lpf-w的失重分别约为7%和12%,这可能是由于多糖中的水分蒸发所致。在第二阶段,随着温度的升高,lp-w和lpf-w的失重迅速,失重率分别为68%和
54%。在这个阶段,样品开始发生剧烈的降解和解聚反应,这主要是由于长链的断裂和分解引起的。在第三阶段,随着分解过程的结束,多糖的失重率降低。在780℃时,lp-w和lpf-w的残留量分别为2.9%和8.6%。综合分析表明,lp-w和lpf-w具有良好的热稳定性,发酵后的lpf-w热稳定性较好。这些与温度有关的质量损失的差异可能是由于百合多糖经过发酵以后导致结构发生变化造成的。
64.3.发酵前后百合多糖的单糖组成分析
65.通过对标准单糖的衍生化,使用气相色谱-质谱联用仪(gc-ms)进行分析,如图3为标准单糖的保留时间。
66.lp-w和lpf-w经过三氟乙酸(tfa)完全水解,糖腈乙酸化衍生处理后,衍生物由gc-ms进样分析,色谱图结果如图3所示:lp-w由甘露糖和葡萄糖组成,其摩尔比为39.2%:60.8%;发酵后lpf-w只由葡萄糖组成,不再存在甘露糖,葡萄糖的比例从60.8%升高到100%,升高了64.5%,说明益生菌发酵过程对lp中的甘露糖具有一定的水解作用。
67.4.发酵前后百合多糖的抗氧化能力
68.由图4可知,在多糖的测定浓度范围内,同浓度的lpf-w较lp-w具有更高的dpph自由基、超氧阴离子自由基清除能力和还原力,且呈现一定的浓度依赖关系。由于lp-w和lpf-w两种百合多糖在理化特性和结构方面存在诸多差异,如分子量、单糖组成、糖苷键连接方式等,这些都是影响其抗氧化活性的重要因素。
69.综上所述,本发明以百合加工过程中产生的残次百合鳞茎为原料,采用植物乳杆菌发酵的技术,对百合浆汁进行生物转化,通过一步发酵法改性得到特定结构的百合多糖,减少资源浪费;经过微生物转化法得到的百合多糖,组分更加均一,发酵后的百合多糖中的成分是葡萄糖,不再存在甘露糖,葡萄糖的比例从60.8%升高到100%,升高了64.5%;糖环的基本结构未发生改变,且热稳定性更好,还具有更高的dpph自由基、超氧阴离子自由基清除能力和还原力;上述微生物转化法有效克服了传统的物理改性和化学改性过程中过程复杂、成本高、化学品毒性大等缺点,提供了一种利用微生物转化法改变百合多糖结构,降低分子量,提高溶解度和抗氧化能力的方法,在温和、可控条件下,实现了百合多糖结构的绿色化精确修饰。
