1.本发明涉及生物医药技术领域,具体涉及一种巨噬细胞焦亡模型及其构建方法和应用。
背景技术:
2.矽肺(pulmonary silicosis)是指由于长期吸入游离二氧化硅(silicon dioxide,sio2)粉尘所引起的以肺部弥漫性炎症和纤维化改变为主要特征的全身性疾病,该病是我国目前最常见、危害最严重的一种职业病,但其发病机制尚未完全阐明。肺泡巨噬细胞(alveolarmacrophage,am)是肺部免疫防御的主要参与者之一,负责吞噬经呼吸道途径进入机体的外来异物,在矽肺发病进程中发挥重要作用。游离sio2粉尘进入肺泡腔后,首先被活化的am吞噬,而后产生活性氧(reactive oxygen species,ros)并释放炎性细胞因子,其中部分趋化因子诱导炎细胞聚集,在肺间质形成局部炎症微环境,并造成以转化生长因子-β(transforming growth factor-β,tgf-β)为主的促炎细胞因子高表达,进而触发肺成纤维细胞增殖和转分化为肌成纤维细胞。源源不断的刺激造成成纤维细胞-肌成纤维细胞稳态右倾,过多的肌成纤维细胞合成胶原蛋白并分泌至肺间质,最终形成矽性蛋白沉积,病理切片表现为典型的矽结节。尽管当前研究对矽肺的发病机制已有初步揭示,但相关精细化调控进程尚未理清,如介导巨噬细胞粉尘吞噬是否存在受体等中间媒介、巨噬细胞吞噬粉尘后的信号传递级联反应、尘细胞的最终归宿等。
3.作为机体天然免疫反应的一部分,巨噬细胞依赖模式识别受体(patternrecognition receptor,prr)如tlr4、marco等识别sio2粉尘,tlr4触发一系列信号转导反应,活化核转录因子κb(nuclearfactor kappa b,nf-κb),促进合成白细胞介素-1β(interleukin-1β, il-1β)、白细胞介素-18(il-18)前体。此外,在吞噬sio2粉尘的过程中,am通过细胞内信号途径可激活nod样受体热蛋白结构域相关蛋白3(nod-like receptorpyrin domain-containing protein 3,nlrp3)炎性小体并活化caspase-1,对pro-il-1β等前体及gsdmd进行切割, gsdmd的p30片段在细胞膜上打孔,使胞内il-1β等炎性细胞因子释放,诱发炎症,这一过程称为细胞焦亡。近年来,许多研究通过建立体内外模型探讨巨噬细胞与sio2粉尘之间的关系,申请号为 202010351763.6的中国专利申请中公开了一种光控肿瘤细胞焦亡系统的制备方法,其中公开了利用介孔二氧化碳纳米颗粒诱导肿瘤细胞焦亡的方法和步骤;在申请号为202110763400.8的中国专利申请中公开了富马酸二甲酯在制备抑制二氧化硅晶体诱导的巨噬细胞焦亡药物及治疗矽肺病药物中的应用,其中记载了利用二氧化硅晶体诱导巨噬细胞产生细胞焦亡的方法和步骤。上述专利前者利用介孔二氧化硅作为载体诱导肿瘤细胞焦亡,并未探讨二氧化硅粉尘的焦亡诱导作用,后者证明富马酸二甲酯对《5μm晶体二氧化硅诱导的原代巨噬细胞焦亡的抑制作用,且存在二氧化硅剂量单一、粒径覆盖范围狭窄、实验缺乏阳性对照、焦亡信号中间生物标志检测不完整等缺陷。
技术实现要素:
4.本发明针对上述现有技术中的缺陷提供了一种巨噬细胞焦亡模型及其构建方法和应用。本发明重点在于明确二氧化硅粉尘对巨噬细胞焦亡诱导的能力,以系列浓度微米和纳米二氧化硅粉尘干预巨噬细胞,对nlrp3信号通路的上、中、下游靶点全方位检测,同时设置 atp焦亡阳性对照,在有效克服既有专利缺陷的同时,提出了二氧化硅粉尘的精确干预剂量和时间,量化了焦亡诱导效率。
5.一种巨噬细胞焦亡模型的构建方法,包括:
6.1)将对数期的巨噬细胞置于dmem高糖培养基中预处理,所述 dmem高糖培养基中添加有脂多糖(lps);
7.2)预处理后,向所述dmem高糖培养基中加入纳米二氧化硅粉尘或微米二氧化硅粉尘,继续培养适当时间,即得巨噬细胞焦亡模型。
8.在根据本发明的一个实施方案中,还包括加入抑制剂干预细胞焦亡状态;所述抑制剂选自ros清除剂或nlrp3抑制剂中的一种或两种;优选地,所述ros清除剂为n-乙酰半胱氨酸(nac);所述nlrp3 抑制剂为mcc950;更优选地,在预处理细胞前加入mcc950并处理1h;或者在加入sio2前加入nac处理细胞30min。
9.在根据本发明的一个实施方案中,步骤1)中所述dmem高糖培养基含体积分数为10%胎牛血清(fbs)和1%青霉素-链霉素双抗。
10.在根据本发明的一个实施方案中,步骤1)中所述dmem高糖培养基中的lps浓度为1μg/ml。
11.在根据本发明的一个实施方案中,步骤2)中dmem高糖培养基中所述纳米二氧化硅粉尘的浓度为100μg/ml;微米二氧化硅粉尘的浓度为750μg/ml。
12.在根据本发明的一个实施方案中,所述纳米二氧化硅粉尘的粒径为20nm,微米二氧化硅粉尘的粒径为0.5-10μm。
13.在根据本发明的一个实施方案中,步骤1)中所述预处理时间为 6小时。
14.在根据本发明的一个实施方案中,步骤2)所述继续培养时间为 4小时。
15.本发明的另一方面还提供了根据上述的构建方法构建得到的巨噬细胞焦亡模型。
16.本发明进一步提供了上述的巨噬细胞焦亡模型在制备用于治疗矽肺病药物中的应用。
17.本发明的上述技术方案的有益效果如下:
18.上述方案中,提出了二氧化硅粉尘诱导巨噬细胞焦亡的精确干预剂量。
19.给出了不同剂量二氧化硅粉尘诱导巨噬细胞焦亡的最佳作用时间。
20.量化了不同粒径的二氧化硅粉尘诱导巨噬细胞焦亡的效率。
21.评估了nlrp3信号通路上、中、下启动情况。
22.本发明提供的方法可在10h内成功诱导巨噬细胞焦亡,先后添加lps和二氧化硅粉尘的步骤更符合细胞焦亡的激发和激活两阶段特点,联合使用lps+不同粒径二氧化硅粉尘能够最大限度还原职业暴露场景下导致细胞焦亡的真实状况,成功体外构建巨噬细胞焦亡模型有利于了解粉尘诱发的各类肺疾病机制,尤其在解析尘肺病、肺癌等发生、启动过程方面有重要价值,对发现疾病干预靶点、特效药物制备、临床治疗等有重要意义。
附图说明
23.图1为不同浓度sio2粉尘在不同暴露时长下对巨噬细胞活性的影响的图谱;其中,a为不同浓度的纳米sio2粉尘的图谱;b为不同浓度的微米sio2粉尘的图谱;
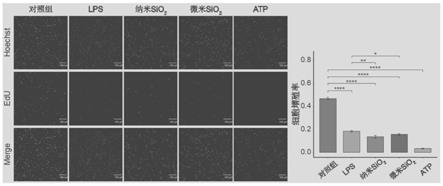
24.图2为既定浓度纳米和微米sio2粉尘暴露4h对巨噬细胞增殖能力的影响的图谱;
25.图3为不同浓度sio2粉尘在不同暴露时长下对巨噬细胞培养上清ldh水平影响的图谱;其中,a为不同浓度的纳米sio2粉尘的图谱;b为不同浓度的微米sio2粉尘的图谱;
26.图4为既定浓度纳米和微米sio2粉尘暴露4h对巨噬细胞完整性影响评估图;
27.图5为透射电镜下既定浓度纳米和微米sio2粉尘暴露4h的巨噬细胞(2000x)图谱;
28.图6为sio2粉尘暴露诱导巨噬细胞焦亡相关蛋白表达水平检测结果图谱;
29.图7为流式细胞术评估既定浓度sio2粉尘暴露4h对巨噬细胞焦亡水平结果图谱;其中,a为western blot电泳图;b-i分别为蛋白的相对表达水平;
30.图8为mcc950抑制nlrp3后sio2粉尘诱导巨噬细胞焦亡相关蛋白表达水平检测结果图谱;其中,a为western blot电泳图;b-g 分别为nlrp3信号通路靶点基因的相对表达水平。
具体实施方式
31.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
32.试剂与仪器
33.高糖细胞培养基(dmem)、辣根过氧化物酶标记的羊抗兔igg 二抗、甘油醛-3-磷酸脱氢酶(gapdh)抗体(塞维尔,中国);
34.胎牛血清(fbs,bi,以色列);
35.青霉素-链霉素双抗(索莱宝,中国);
36.sio2粉尘、nlrp3抑制剂mcc950(sigma,美国);
37.nlrp3抗体、caspase-1抗体、asc抗体、il-1β抗体(abclonal,中国);
38.脂多糖(lps)、cck-8试剂盒、乳酸脱氢酶细胞毒性检测试剂盒、calcein/pi细胞活性与细胞毒性检测试剂盒、edu-555细胞增殖检测试剂盒、活性氧检测试剂盒、ros清除剂n-乙酰半胱氨酸(nac)(beyotime,中国);
39.共聚焦高内涵成像系统(moleculardevices,美国)、化学发光凝胶成像系统(proteinsimple,美国)、多功能微孔板酶标仪(biotekinstruments,美国)、co2恒温培养箱(thermo fisher,美国)。
40.实施例1细胞培养
41.小鼠巨噬细胞系raw264.7-asc购自invivogen(美国)。配制含体积分数为10%fbs和1%双抗的dmem高糖培养基,将细胞置于 37℃、5%co2培养箱内,每2~3d传代1次。取生长良好的对数期细胞进行后续实验。
42.实施例2细胞分组及处理
43.将raw264.7-asc巨噬细胞以2
×
104个/孔的密度接种于96孔板中,设空白对照组、lps组(1μg/ml lps)、纳米sio2组(1μg/mllps+100μg/ml纳米sio2)、微米sio2组(1μg/ml lps+750μg/ml微米sio2)和阳性对照组(1μg/ml lps+3mmatp)。除空白对照组外,其他组均
以含1μg/ml lps的dmem高糖培养基预处理6h,然后加入sio2或atp继续培养4h。
44.配制抑制剂对细胞进行干预:mcc950(10μm)在加入lps前预处理细胞1h;nac(10mm)在加入sio2前预处理细胞30min。
45.实施例3cck-8法检测细胞活性
46.参考实施例2对细胞施加干预的操作步骤,加入cck-8试剂(10 μl/孔)后将细胞于培养箱内孵育2h,使用多功能微孔板酶标仪在 450nm处检测光密度(od)值。
47.cck-8结果如图1所示,与对照组相比,纳米和微米sio2粉尘及atp暴露均可有效下调巨噬细胞活性(p<0.05),其中,atp组细胞活性最弱。不同粉尘浓度或暴露时间之间比较提示,sio2粉尘下调巨噬细胞活性不呈时间或剂量依赖关系。参考细胞焦亡阳性对照 atp组同时间段数据,本研究以50μg/ml纳米sio2粉尘和500μg/ml 微米sio2粉尘干预巨噬细胞4h诱导焦亡,制备焦亡巨噬细胞模型。
48.实施例4edu染色检测细胞增殖能力
49.参考实施例2对细胞施加干预的操作步骤,使用37℃预热的 2
×
edu工作液等体积加入96孔板中,孵育细胞2h,按说明书步骤对细胞进行固定、通透和洗涤,之后每孔加入50μl click反应液,室温避光孵育30min。吸除click反应液,洗涤细胞3次,每孔加1
×
hoechst 33342溶液100μl,室温避光孵育10min,置共聚焦高内涵成像系统进行拍摄并分析。
50.结果如图2所示,经定量分析,lps、纳米sio2粉尘、微米sio2粉尘、atp暴露均可降低细胞增殖率,atp组细胞增殖能力最弱,且粉尘组较lps组细胞增殖水平低(p<0.05)。
51.实施例5试剂盒法检测细胞上清ldh水平
52.参考实施例2对细胞施加干预的操作步骤,使用多孔板离心机以 400g离心5min。取各孔的上清液120μl分别加入到新的96孔板中,每孔加入60μl ldh工作液,混匀,室温避光孵育30min,使用多功能微孔板酶标仪在490nm处测定吸光度,并以620nm作为参考波长进行双波长测定。
53.实施例6calcein/pi荧光双染检测细胞破裂状况
54.参考实施例2对细胞施加干预的操作步骤,吸除培养液,每孔加入100μl calceinam/pi检测工作液,37℃避光孵育30min,置共聚焦高内涵成像系统进行拍摄并分析。
55.实施例7dcfh-da荧光探针法检测细胞内ros含量
56.参考实施例2对细胞施加干预的操作步骤,吸除培养液,每孔加入100μl稀释好的dcfh-da,37℃孵育20min,以无血清细胞培养基洗涤细胞三次,使用多功能微孔板酶标仪检测荧光强度(激发波长 488nm,发射波长525nm)。
57.正常生理情况下,ldh仅存在于细胞膜完整的活细胞内。因此,通过检测细胞培养上清ldh水平能够反应细胞破溃状况。与对照组相比,纳米和微米sio2粉尘及atp暴露均可上调巨噬细胞上清液 ldh水平(p<0.05),其中atp组浓度最高,纳米粉尘组与之接近(图3)。此外,calcein/pi荧光双染能够有效标识活细胞和凋亡细胞,该技术手段的实现主要依赖于细胞膜破溃小孔。实验发现,sio2粉尘及atp暴露后,calcein着色活细胞数目降低,pi阳性细胞所占比例升高(p<0.05),尤以atp组和纳米粉尘暴露组升高幅度最大,但 pi阳性细胞比例在lps干预组与对照组间无统计学差异(p》0.05)(图4)。透射电子显微镜下粉尘暴露组巨噬细胞表面出现明显破溃迹象(图5)。由实施例6和7的结果可以确定sio2粉尘暴露
破坏了巨噬细胞完整性。
58.实施例8western blot检测细胞焦亡相关蛋白表达
59.将raw264.7-asc细胞以2
×
107个/孔的密度接种于6孔板中,参考步骤1.3进行分组与处理后,吸除培养液,用4℃预冷的pbs洗涤细胞3次,每孔加入150μl含蛋白酶抑制剂(pmsf)的ripa裂解液,冰上裂解3min,超声破碎,离心,按bca蛋白检测试剂盒说明书步骤定量检测蛋白。于十二烷基硫酸钠聚丙烯酰胺凝胶(sds-page)电泳,转膜,加5%脱脂奶粉室温封闭1h,tbst洗膜3次,每次10min,一抗4℃孵育过夜,抗体稀释比例均为1:2000。次日tbst洗涤3次后加入二抗(1:3000),室温孵育1h。tbst洗膜3次后用ecl化学发光法检测蛋白信号并显影,用image j 1.52软件对蛋白的相对表达水平进行定量分析。
60.westernblot结果显示(图6),lps、纳米、微米sio2粉尘及atp 暴露均可上调巨噬细胞焦亡相关标志nlrp3、asc、gsdmd-fl、 gsdmd-nt、pro-caspase-1、p20、pro-il-1β、cleaved-il-1β蛋白表达水平(p<0.05),其中阳性对照组(atp组)除nlrp3和pro-caspase-1 外其他蛋白表达水平最高,纳米和微米粉尘暴露组次之。与对照组相比,lps组除nlrp3和全长gsdmd(gsdmd-fl)外其他蛋白表达水平均无统计学差异(p》0.05)。相较于atp阳性对照组,流式细胞术提示纳米sio2粉尘诱导巨噬细胞焦亡能力与之相当(图7)。
61.实施例9统计学分析
62.所得数据使用excel 2019汇总形成数据库,r 3.6.3软件进行统计分析。经检验符合正态分布的计量资料以均数
±
标准差表示,两组样本间差异比较采用单样本t检验。检验水准α=0.05。
63.nlrp3是细胞焦亡的关键分子和生物标志,通过调控其表达水平可为评估sio2诱导的细胞提供更充要证据。以mcc950抑制 nlrp3表达后,与mcc950未处理组相比,sio2粉尘干预后nlrp3、 asc、pro-caspase-1、p20、pro-il-1β、cleaved-il-1β蛋白表达水平下降。其中,纳米sio2暴露组asc蛋白表达水平虽下降,但差异无统计学意义(p》0.05),如图8所示。
64.以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
