一种诊断als的标志物组合、检测试剂、试剂盒及其用途
技术领域
1.本发明涉及体外诊断技术领域,具体涉及一种诊断als的标志物组合、检测试剂、试剂盒及其用途。
背景技术:
2.肌萎缩侧索硬化(amyotrophic lateral sclerosis,als)是一种病因不明,发病后进展迅速,而又缺乏有效治疗手段的严重致死性神经系统变性疾病,是运动神经元病中最常见和最严重的类型。该病主要累及青壮年,多为40岁后起病;患者一旦发病,其生存期一般不超过5年。目前其发病机制仍不清楚,因此进一步探讨疾病进展过程中的早期生物标记物和重要分子调控机制,对于als的早期诊断、干预、开发新的有效药物或探究新的治疗方法显得十分迫切和重要。
3.目前关于als疾病诊断及判断预后较为可靠的生物标志包括脑脊液中的磷酸化神经微丝蛋白、tau蛋白、chit1、chi3l1、chi3l2,以及血液中的磷酸化神经微丝蛋白、肌酸激酶、免疫活化相关的细胞因子包括tnf-α、il-1β、il-2等。通过腰椎穿刺获取脑脊液中的标志物对于als患者来说,常常会带来更大的疾病风险,例如因为营养不良而恢复延迟、有创操作带来的应激反应、腰椎穿刺后引起的低颅压头痛等。而通过血液获取的生化分子(例如tnf-α、il-1β、il-2、肌酸激酶等)通常能够在其他神经退行性疾病中发现,不具有疾病特异性。
技术实现要素:
4.为了解决上述技术和临床问题,本发明提供了一种诊断als的标志物组合、检测试剂、试剂盒及其用途。基于外周血选择诊断标志物检测als,本发明的标志物组合相较于外周血中的其他生物标志物,具有特异性高的优势。
5.第一方面,本发明提供了一种诊断als的标志物组合,所述标志物组合包括以下mirna:hsa-mir-501-3p、hsa-mir-30b-5p和hsa-mir-199a-3p。
6.在本发明一较佳实施方案中,所述标志物组合还包括以下至少一种mirna:hsa-mir-103a-2-5p、hsa-mir-34a-3p、hsa-mir-1306-3p和has-mir-181d-5p。
7.第二方面,本发明提供了一种诊断als的检测试剂,所述试剂为能够检测第一方面所述标志物组合的试剂。
8.在本发明一较佳实施方案中,所述检测试剂为pcr用试剂或者测序用试剂。
9.第三方面,本发明提供了一种诊断als的试剂盒,所述试剂盒包含第二方面所述的检测试剂。
10.第四方面,本发明提供了第一方面所述的标志物组合、第二方面所述的检测试剂或第三方面所述的试剂盒在制备诊断als的诊断剂中的用途。
11.本发明的有益效果:本发明中的标志物组合不用抽取患者脑脊液,对als患者来说,可避免腰椎穿刺所带来的感染、愈合不良、低颅压头痛等并发症;相较于外周血中的其
他生物标志物,具有特异性高的优势,有助于临床医生早期对als患者的诊断和治疗。
12.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
13.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实施例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
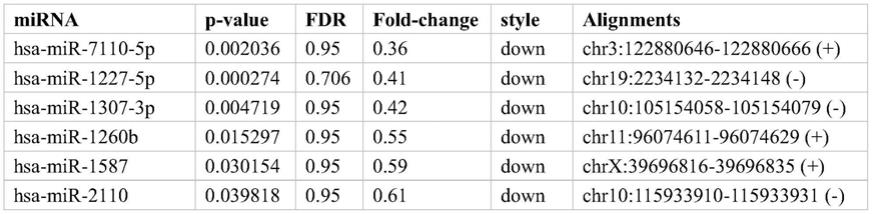
14.图1为sod1-als与健康对照组血浆外泌体中差异表达的mirna;
15.图2为c9orf72-als与健康对照组血浆外泌体中差异表达的mirna;
16.图3为从microarray生物芯片检测到rt-qpcr验证的实验思路流程图;
17.图4为sals和健康对照组血浆外泌体中hsa-mir-199a-3p的表达水平;
18.图5为sod1基因突变患者和健康对照组血浆外泌体中hsa-mir-1306-3p,hsa-mirna-34a-3p的表达水平;
19.图6为机器学习的支持向量机模型对als诊断的auc。
具体实施方式
20.试验例1
21.1、被测对象
22.在四川大学华西医院就诊的3例sod1基因突变所致的als患者、3例c9orf72基因突变所致的als患者以及3例年龄性别等相匹配的健康对照者,被测对象在实验前均已经知情并同意。
23.2、方法
24.收集上述对象的外周血标本,进行microarray生物芯片mirna的检测,具体包括如下步骤:
25.首先进行使用qiazol及氯仿法对样本总rna抽提,可得到30ul的rna溶液;为确保后续检测质量,继而会对样本总rna质检,其中包括rna浓度、纯度以及完整性的检测;rna质量检测符合标准后,对rna进行poly(a)加尾处理,使用flashtag
tm
生物素hsr rna标记试剂盒(美国affymetrix)进行标记,在48℃,60rpm的条件下样本与affymetrix基因芯片杂交16个小时;杂交完成后在affymetrixgenechip command consoleflution control软件的洗脱站barcode中扫描芯片并进行洗脱,洗脱完成后,进行芯片扫描生成dna数据。该芯片阵列包括2578个人类成熟mirna探针组和2025个人类pre-mirna(mirna前体茎环)探针组。
26.对sod1及c9orf72基因突变的als患者及健康对照患者血浆中外泌体的mirna进行初步筛查,采用affymetrix mirna4.0芯片,分析了3例携带sod1基因突变、3例携带c9orf72突变的als及3例健康对照血浆中神经细胞来源的外泌体mirna表达。
27.3、结果
28.与正常对照对比,在sod1-als中发现25个差异表达的mirna(其中13个上调,12个下调)(如图1所示);在c9orf72-als患者发现27个差异表达的mirna(其中20个上调,7个下调)(如图2所示),其中mir-1915-3p在sod1-als患者和c9orf72-als患者中均表达升高。
29.结合生物信息学功能预测、mirna组织表达数据库及als的病理生理特征等,根据以下标准选择了差异表达的mirna,见表1、表2。
30.标准:1)与其他组织相比,在脑组织中呈现较高水平的表达;2)mirna的靶基因是否包括tardbp、fus、sqstm1(p62)、ubqln2(fals和sals常见病理聚集蛋白)和神经丝蛋白(nefl、nefm和nefh);3)在sod1-als及c9orf72-als中共同差异表达的mirna;4)在患者和健康对照者中表达差异较为明显的mirna(log2(差异倍数(fold change))》1.2以及p值《0.05)。
31.表1sod1-als患者与健康对照组血浆外泌体中差异表达的mirna
[0032][0033][0034]
表2c9orf72-als与健康对照组血浆外泌体中差异表达的mirna
[0035][0036][0037]
为了验证上述基因芯片(microarray)结果,我们对上述有差异性表达的mirnas在大样本的als患者中进行了反转录-荧光定量实时pcr(rt-qpcr)验证。
[0038]
试验例2、反转录-荧光定量实时pcr(rt-qpcr)试验
[0039]
1、被测对象
[0040]
在华西医院就诊的65例散发性als(sals)患者、16例基因突变(包括8例sod1-als、8例c9orf72-als)的als患者和61例健康对照者。被测对象在实验前均已经知情并同意。
[0041]
2、方法
[0042]
收集患者基线资料并进行静脉穿刺采血,在采血后2小时内,通过ficoll-paque plus(ge healthcare life sciences,编号17-1440-02)离心分离外周血浆,使用exorneasy midi kit(qiagen,货号77144)进行血浆外泌体中mirna的提取,mircury lna mirna pcr starter kit(qiagen,货号339306)及mircury lna sybr green pcr kit(qiagen,货号339346)逆转录成cdna模板并进行荧光定量pcr来检测mirna的相对表达量。qpcr体系为10ul,包括1ul pcrprimermix、5ul 2
×
mircury sybr green master mix、3ul经1:60稀释的cdna模板,0.05ulroxreferencebuffer和0.05ul无核酶水(表3)。pcr反应在quantstudio 3(applied biosystems by thermo fisher scientific)中完成。反应在96
孔光学板中95℃孵育2分钟,接着进入95℃15秒、56℃60秒荧光扩增的40个循环,每个样品做3重复,并进行熔融曲线分析,以验证pcr循环结束时预期pcr产物的特异性生成(表4)。选取mirna-16作为内参,cel-mirna-39作为外参,将mirnas的表达变化与内外参进行归一化,用2-δδct法计算差值。以所有对照组δct的平均数据作为校准(δδct=0,2-δct)。具体流程请见图3。
[0043]
表3逆转录qpcr体系组成(总反应体系:10ul)
[0044]
组成部分体积pcr primer mix1ul2
×
mircury sybr green master mix5ulcdnatemplate(经1:60稀释)3ulrox reference buffer0.05ul无核酶水0.05ul
[0045]
表4mirna相对表达量测定的pcr反应条件
[0046][0047]
3、结果
[0048]
与健康对照相比,散发性als血浆外泌体中hsa-mir-199a-3p和hsa-mir-30b-5p,表达显著升高(mann-whitney u test:p值分别为0.0003,0.0474,详情请见图4);hsa-mir-501-3p,hsa-mir-103a-2-5p在散发性als中也有上调的趋势(mann-whitney u test的p值分别为p=0.0533,p=0.0720)。
[0049]
此外,与散发性als(sals)或健康对照人群(hc)相比,hsa-mir-34a-3p在sod1突变的als中表达降低。hsa-mir-1306-3p在sod1和c9orf72突变的als人群中均发现表达降低(salsvs.sod1:p=0.0021,sals vs.c9orf72:p=0.0032,sod1 vs.hc:p=0.002,c9orf72 vs.hc:p=0.0032,详情请见图5)。此外hsa-mir-501-3p、has-mir-181d-5p、has-mir-103a-2-5p表达升高时具有较高的患als的风险。hsa-mir-199a-3p,hsa-mir-501-3p和hsa-mir-30b-5p对als的诊断具有较高的特异性,是als初筛诊断的重要标志物;
[0050]
试验例3
[0051]
纳入hsa-mir-501-3p、hsa-mir-30b-5p,hsa-mir-199a-3p 3种mirna作为诊断因素,采用机器学习的支持向量机模型,对数据实施5折交叉验证,即所有样本(65例sals患者和61例健康对照)随机平均分成5份,每一份轮流当做验证组,其余4份组成训练组,共进行5次建模。
[0052]
支持向量机分类器的代码为:svm(group~.,data=traindata);traindata为训
练组mirna相对表达量;所述预测函数的代码为:predict(svm,newdata=validationdata),validationdata为验证组mirna相对表达量。表5显示了每次交叉验证svm模型的性能。
[0053]
通过5折交叉验证后可得到诊断als的曲线下面积在训练组可达0.841
±
0.011,验证组达到0.796
±
0.070(详情请见图6),这说明上述3种mirna是诊断als的有效产品。
[0054]
表5支持向量机模型在测试集中5折交叉验证的性能。
[0055]
交叉验证的次数aucaccuracysensitivityspecificity10.8740.8330.7690.90920.8460.8400.8460.83330.7760.6250.3850.90940.6920.5200.3080.7550.7900.750.6920.818mean
±
sd0.796
±
0.0700.714
±
0.1390.6
±
0.2400.844
±
0.067
