1.本发明涉及分子生物学与生物化学技术领域,具体涉及一种单磷酸腺苷化酶及其制备方法和应用。
背景技术:
2.蛋白翻译后修饰是指在蛋白氨基酸残基上加载特定基团或移除某些氨基酸。蛋白翻译后修饰既可在某些蛋白特定氨基酸残基加上不同的基团(如磷酸、乙酰基、甲基或多糖等),也可以是对肽链(如启始密码子甲硫氨酸或信号肽)的剪切。通过修饰可改变蛋白功能、结构、稳定性、定位或影响蛋白与其他分子的互作,从而调控细胞代谢和生理;修饰的基团可以是小分子,也可以是小蛋白;有可逆的修饰,也有不可逆的修饰;修饰的结果可能有利于细菌生长,也可能不利的。翻译后修饰是生物进化中用于调控蛋白活性、亲和性和稳定性的保守机制,在基因表达、蛋白质降解、系统免疫、信号传递等过程中发挥重要作用。
3.蛋白翻译后修饰种类多样,uniprots数据库收录480多种修饰。主要修饰类型有泛素化、类泛素化、乙酰化、脂化、烷化、消去化、豆蔻酰化、s-十六酰基化、adp-核糖基化、糖基化、质子化、磷酸化和单磷酸核苷化等。
4.单磷酸腺苷化(ampylation或adenylylation)广泛参与dna复制和分离、细胞分裂、蛋白质翻译、蛋白折叠等过程,并参与病原细菌致病性、真核生物细胞信号转导和运输等,是重要的蛋白质翻译后修饰。催化单磷酸腺苷化的酶有dna/rna连接酶、泛素化e1类酶、谷氨酰胺合成酶、腺苷转移酶和fic蛋白酶。fic蛋白介导的单磷酸腺苷化是指由一类含有保守fic(filamentation induced by cyclic adenosine monophosphate,fic)结构域或蛋白结构与fic相似的酶,以三磷酸腺苷(atp)为底物转移单磷酸腺苷(adenosine monophosphate,amp),并与靶标蛋白丝氨酸、苏氨酸或酪氨酸侧链羟基共价结合的反应。生物信息学分析表明,fic蛋白含有保守基序hxfx(d/e)(a/g)n(k/g)r(x为任意氨基酸,下同)或gx12dxd。据蛋白质数据库pfam统计(截止2021年2月,pf02661),现已从5206个物种中发现11775条含有fic基序的蛋白序列,这些序列广泛存在于病毒、类病毒、古细菌、细菌、真菌和动物中,但尚未在植物中发现fic蛋白。研究表明,不同fic蛋白间仅在活性中心部位较为保守,其他结构域则差异较大,作用机制也略有差异。多数已报道的fic蛋白以atp为供体,amp化修饰靶标蛋白;部分fic蛋白能可以三磷酸尿苷(utp)、二磷酸胞苷胆碱(cdp-choline)、三磷酸鸟苷(gtp)为供体,分别ump化、磷酸胆碱化(cp化)或gmp化修饰靶标蛋白。因此,也将该修饰称为单磷酸核苷化(nmpylation)。目前,虽然已明确少数几个病原细菌外泌型fic蛋白的催化机制,但细菌的非外泌型fic蛋白的功能尚不清楚。
5.鉴于上述情况,有必要研究一种单磷酸腺苷化酶及其制备方法和应用以解决上述技术问题。
技术实现要素:
6.本发明的目的在于克服现有技术中的不足,提供一种单磷酸腺苷化酶及其制备方
法和应用,特别是修饰dna拓扑异构酶的亚基gyrb、pare蛋白、抑制dna拓扑异构酶水解atp的活性、抑制dna拓扑异构酶负超螺旋和松弛dna活性中的应用;且本发明提供的单磷酸腺苷化酶的制备方法简单、发酵周期短、纯化成本低、且制备量大。
7.为了实现上述目的,本发明采用如下技术方案:
8.本发明的第一个方面是这样实现的,一种单磷酸腺苷酶的表达载体,所述表达载体由一种含表达所述单磷酸腺苷酶的基因序列组成,表达所述单磷酸腺苷酶的基因序列包括荧光假单胞菌fic蛋白fic-1或耶尓森氏菌ypk0608;或与所述单磷酸腺苷化酶的蛋白结构相似的变体或片段;所述单磷酸腺苷化酶的基因通过pcr扩增获得或通过人工合成获得。
9.优选地,所述荧光假单胞菌fic蛋白fic-1的核苷酸序列如seq id no.1所示,所述荧光假单胞菌fic蛋白fic-1的氨基酸序列如seq id no.2所示;所述耶尓森氏菌ypk0608的核苷酸序列如seq id no.3所示,所述耶尓森氏菌ypk0608的氨基酸序列如seq id no.4所示。
10.优选地,所述表达载体为原核表达载体、真核表达载体、昆虫表达载体、酵母表达载体或植物表达载体。
11.本发明的第二个方面是这样实现的,一种单磷酸腺苷化酶的制备方法,包括如下步骤:
12.(1)将权利要求1-3任一项所述的表达载体转化宿主细胞进行表达;
13.(2)利用诱导剂诱导表达目的蛋白;
14.(3)获得成熟发酵液后添加蛋白酶抑制剂,经物理破碎后提取单磷酸腺苷化酶。
15.即,将单磷酸腺苷化酶基因连接至表达载体,获得含有单磷酸腺苷化酶基因的重组载体;将所述重组载体转入表达菌株获得含有所述单磷酸腺苷化酶的转化体;将所述转化体接种至改良的lb培养液中扩大培养,随后添加诱导剂诱导表达单磷酸腺苷化酶,获得成熟发酵液后添加蛋白酶抑制剂,经物理破碎提取单磷酸腺苷化酶。
16.优选地,步骤(1)所述宿主细胞为细菌表达系统、昆虫表达系统、酵母表达系统、哺乳动物表达系统或植物表达系统。
17.优选地,所述细菌表达系统为大肠杆菌bl21(de3)、生防荧光假单胞菌2p24、耶尓森氏菌ypiii。
18.优选地,步骤(2)中所述诱导剂为iptg。
19.本发明的第三个方面还提供了上述单磷酸腺苷化酶制备方法获得的单磷酸腺苷化酶。
20.本发明的第四个方面还提供了上述单磷酸腺苷化酶在体外单磷酸腺苷化修饰dna拓扑异构酶的亚基gyrb、pare蛋白中的应用,
21.本发明的第五个方面还提供了上述单磷酸腺苷化酶在抑制dna拓扑异构酶水解atp的活性、抑制dna拓扑异构酶负超螺旋和松弛dna活性中的应用。
22.综上所述,相比于现有技术,本发明的有益效果在于:
23.1、本发明提供了一种单磷酸腺苷化酶,将其克隆至诱导表达载体,并转入大肠杆菌后借助宿主菌的dna复杂、转录和蛋白翻译系统,进行诱导表达,可在一天内实现单磷酸腺苷化酶的大量生产,为该蛋白的纯化提供基础材料。
24.2、本发明提供的单磷酸腺苷化酶具有高酶活。通过用放射性同位素标记atp检测
时仅需30s曝光即可在x光片上显示极强的信号,说明本发明提供的单磷酸腺苷化酶活性较高。
25.3、本发明提供的单磷酸腺苷化酶可以实现离体条件下,单磷酸腺苷化修饰dna拓扑异构酶的gyrb亚基和pare亚基,为含有单磷酸腺苷基团的dna拓扑异构酶的制备提供新方法。
26.4、表达本发明提供的单磷酸腺苷化酶,还可以抑制dna拓扑异构酶负超螺旋和松弛dna的活性。gyrb或pare亚基内的atpase结构域在dna拓扑异构酶的水解atp过程中起着关键作用。
27.5、本发明提供的单磷酸腺苷化酶特异修饰atpase内的酪氨酸而改变dna拓扑异构酶的活性。因此,可以利用本发明提供的单磷酸腺苷化酶、dna拓扑异构酶,制备松弛状态的dna,为松弛状态的dna的制备提供新方法。
28.6、本发明所提供的单磷酸腺苷化酶制备方法简单、发酵周期短、纯化成本低、且制备量大,便于大批量生产。
附图说明
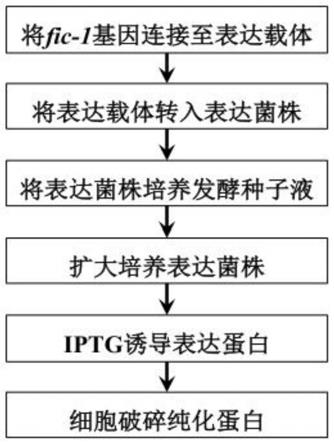
29.图1为本发明单磷酸腺苷化酶的制备流程图;
30.图2为本发明单磷酸腺苷化酶的纯化;
31.图3为本发明单磷酸腺苷化酶修饰靶标蛋白gyrb;
32.图4为本发明单磷酸腺苷化酶修饰dna拓扑异构酶的atpase中的保守酪氨酸;
33.图5为本发明单磷酸腺苷化酶抑制靶标蛋白gyrb水解atp的活性;
34.图6为本发明单磷酸腺苷化酶影响靶标蛋白gyrb的dna拓扑异构酶活性。
具体实施方式
35.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有开展创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.对于相关领域普通技术人员已知的技术、方法和设备可能不作详细讨论,但在适当情况下,所述技术、方法和设备应当被视为授权说明书的一部分。此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
37.实施例1:
38.本实施例1的核心在于提供单磷酸腺苷化酶基因的克隆。
39.如图1所示,单磷酸腺苷化酶基因的克隆主要包括细菌活化与培养、dna提取、pcr扩增与检测、酶切、连接、转化及测序分析等步骤。具体详述如下:
40.s1:细菌活化与培养
41.用无菌枪头从-80℃冰箱中挑取少许生防荧光假单胞菌(p.fluorescens)2p24,划线于la平板(每升培养基含5g nacl、10g胰蛋白胨、5g酵母粉、16g琼脂粉,ph=7.2),置于28℃、黑暗条件下培养48h,挑取单菌落于盛有2.5mllb培养液(每升培养基含5g nacl、10g胰
蛋白胨、5g酵母粉,ph=7.2)的无菌离心管内,置于28℃、180r/min气浴摇床培养24h。
42.s2:dna提取
43.取1.0ml培养液于1.5ml离心管内,于12000r/min离心2min收集菌体。采用细菌基因组dna提取试剂盒(货号:d3107,广州捷倍斯生物科技有限公司)提取总dna,并用nanodrop核酸浓度测定仪(thermo fisher scientific)测量dna浓度。
44.s3:pcr扩增与检测
45.取步骤s2中的dna 50-100ng,用引物扩增fic-1基因,所用引物具体为:
46.fic-1-nde i-f(5
’‑
attcatatgcctgacaaatatggggtcg-3’),如seq id no.5所示;
47.fic-1-sal i-r(5
’‑
attgtcgacagcttgaatcgcctgcccga-3’),如seq id no.6所示.
48.pcr扩增的反应体系为50μl,反应体系由24μl 2
×
es taq mastermix(dye)、24μl ddh2o、1.0μl 10μm fic-1-nde i-f、1.0μl 10μm fic-1-nde i-f和1-2μl基因组dna组成;pcr反应条件为94℃预变性2min,扩增循环包括94℃变性30s、58℃退火30s、72℃延伸30s,扩增30个循环,最后72℃延伸5min。pcr扩增结束得pcr产物后,取5μlpcr产物,上样于1.0%的琼脂糖凝胶的胶孔中,在140v恒压下分离30min,并在含有5μg/ml的eb核酸染液中染色10-20min;置于凝胶成像仪上获取基因扩增情况,若为荧光假单胞菌2p24的fic-1基因,则在约为600bp处有一目的条带;经琼脂糖凝胶电泳确认扩增条带的特异性后,用pcr产物纯化试剂盒(zymo research,no.d4004)纯化dna。
49.s4:酶切、连接与转化
50.将纯化的dna经nde i和sal i双酶切后,与相同的酶双酶切后的pet-22b(+)载体连接。pcr产物的酶切体系为100μl,包括10μl 10
×
cutsmart buffer、88μl dna、1μlnde i和1μl sali,将酶切体系混匀后置于37℃酶切3h。载体pet-22b(+)酶切反应体系为50μl,包括5μl 10
×
cutsmart buffer、38μl ddh2o、5μl dna(100ng/μl)、1.0μlnde i和1.0μl sali,将酶切体系混匀后置于37℃酶切3h。后用dna纯化试剂盒(zymo research,no.d4004)分别纯化回收pcr片段和载体酶切后的dna。将pcr片段和载体片段以摩尔比按3:1的量加入10μl连接体系中,再加入1μl t4 ligation buffer、0.5μlt4 ligase,用ddh2o补足至10μl,混匀后置于16℃过夜连接。取5μl连接产物转化dh5α感受态细胞,37℃温浴60min,取100μl菌液涂布于含有氨苄青霉素(100μg/ml)的la平板,37℃过夜培养,菌落pcr验证后挑取阳性克隆制备穿刺管,送生工生物工程(上海)有限公司测序分析核苷酸一致性。
51.实验结果:经基因扩增、检测、纯化、酶切、连接和转化,送测序公司分析克隆的正确性,结果表明检测的阳性克隆中含有携带fic-1基因的表达载体pet-22b(+),所连接的fic-1基因不包含终止密码子tga外,其余序列与生防荧光假单胞菌2p24基因组dna上的fic-1基因相同,将含有fic-1基因的pet-22b(+)命名为pet-22b(+)::fic-1表达载体,用于后续蛋白表达与纯化。
52.实施例2
53.本实施例2的核心在于提供单磷酸腺苷化酶的表达与纯化。
54.单磷酸腺苷化酶须经小量诱导表达,验证蛋白是否能表达、表达情况及其大小的分析,确认无误后再经大量诱导表达。单磷酸腺苷化酶的表达与纯化详述如下:
55.步骤1:蛋白表达
56.将表达载体pet-22b(+)::fic-1热击转化化学感受态细胞bl21(de3),涂板后37℃
恒温培养箱放置20h,取单菌落接种摇培小量诱导,确认蛋白表达后挑取单菌落接种至含100μg/ml氨苄青霉素的12.5ml液体lb培养基中,37℃摇培6~8h,转接至盛有500ml液体lb培养基的2l三角瓶中(含100μg/ml氨苄青霉素),摇培90~105min,当od
600
在0.4~0.6时,取1od菌体作为未诱导对照,置于-20℃。在三角瓶中加入终浓度为1mm iptg,18℃诱导16~18h后收集菌体。
57.步骤2:蛋白纯化
58.溶液配制:
59.磷酸缓冲液:1l含50mm nah2po4、300mm nacl,ph 8.0,置于4℃;
60.蛋白裂解液:400ml磷酸缓冲液、10mm咪唑、5mm苯甲脒、1mm苯甲基磺酰氟,用磷酸缓冲液定容至500ml,置于4℃;
61.漂洗缓冲液:50mm nah2po4、300mm nacl和20mm咪唑,ph 8.0;
62.蛋白洗脱液:50mm nah2po4、300mm nacl,ph 8.0,100~500mm咪唑;
63.透析液:磷酸缓冲液、10%甘油、1mm dtt。
64.蛋白纯化:
65.因fic-1基因编码的蛋白fic-1末端含有pet-22b(+)载体上自有的his6标签蛋白,故可用ni
+
珠子纯化。取25ml预冷的磷酸缓冲液,加入10mm咪唑,5mm苯甲脒和1mm苯甲基磺酰氟的蛋白酶抑制剂,重悬浮收集的菌体,置于冰上放置10min,置于超声波细胞破碎仪破碎细胞(90w,12min,时间间隔5s),镜检观察细菌破碎情况,待多数细胞破碎后,加入0.5%triton 100,混匀后转移至4℃预冷的35ml圆底离心管,4℃ 12,000r/min离心15min,转移上清至另一预冷的离心管中,置于12,000r/min离心10min。同时,量取25ml无菌水悬浮破碎组织,取80μl于1.5ml离心管中,标记后,置于-20℃。离心期间可漂洗活化ni
+
珠子,通常每250ml菌体中的蛋白可用1ml 50%的ni
+
结合,依蛋白表达差异而增减。取2ml 50%ni
+
珠子加至50ml离心管内,量取20ml预冷的蛋白裂解缓冲液,颠倒混匀后,4,000r/min离心5min,小心移除上清,再加入20ml缓冲液,再次离心后弃上清。将二次离心后的蛋白上清液与珠子混合,4℃结合2h。将带有滤膜的蛋白纯化柱放置于4℃,用漂洗缓冲液平衡2个柱体积。将蛋白溶液与珠子的混合物灌入柱子,并收集滤液,取80μl放入1.5ml离心管内,置于-20℃。用3个柱体积的漂洗缓冲液漂洗蛋白结合的珠子。配制20ml蛋白洗脱液。用塞子封好蛋白纯化柱的底部,加入1.5ml蛋白洗脱液,4℃放置10min,其间可旋转柱子使洗脱液充分接触柱子和蛋白。移除塞子,用1.5ml离心管接取蛋白溶液。盖上塞子,加入1.5ml蛋白洗脱液,放置5min,接取蛋白溶液,可反复洗脱3~5次。用考马斯亮蓝法(bradford法)测定蛋白a
595
值,检测蛋白溶液浓度,一般a
595
值在1λ以内则不再洗脱。从每管洗脱的蛋白溶液中取出80μl,置于1.5ml离心管中冻于-20℃。将剩余的蛋白溶液分别转移至10kda或30kda蛋白透析袋中,封口后放入透析液中过夜透析。次日取出蛋白溶液,用考马斯亮蓝法测定蛋白浓度,吸取20μg蛋白溶液置于4℃或-80℃保存。取出实验过程中冻存的样品,加入20μl 5x蛋白上样缓冲液,混匀后瞬时离心,100℃金属浴变性5min。12,000r/min离心3min,10μl蛋白样品经sds-page电泳分离蛋白,考马斯亮蓝染色后,分析纯化结果。用于测定atp水解活性的蛋白则用20mm tris、150mm nacl缓冲液纯化,其他溶液组分和操作步骤与用磷酸缓冲液提取的方法相同。
66.实验结果:经sds-page蛋白胶分离检测各组分中的fic-1含量,结果如图2所示。结
sumo::pfpare
y109a
表达载体;
82.5、pet-sumo载体具有卡那霉素抗性,筛选阳性克隆时使用50μg/ml的卡那霉素;
83.6、加入iptg诱导蛋白表达前,菌体od
600
为0.6-0.8。
84.结果与分析:结果如图4a,当反应体系中含有fic-1和ecgyrb时,ecgyrb能被fic-1单磷酸腺苷化修饰,fic-1
h135a
突变体不能修饰ecgyrb;当定点突变第109为酪氨酸时,ecgyrb不能被fic-1修饰,说明fic-1单磷酸腺苷化修饰ecgyrb蛋白的第109位酪氨酸,fic-1单磷酸腺苷化修饰ecgyrb的活性以来fic-1中第135位组氨酸。
85.ecgyrb蛋白的tyr
109
氨基酸在其他细菌中较为保守,在荧光假单胞菌2p24菌株的pfgyrb蛋白中为第111位,为检测荧光假单胞菌pfgyrb被修饰位点是否与ecgyrb相同,克隆了pfgyrb基因,突变与ecgyrb中修饰位点对应的酪氨酸位点(pfgyrb
y111a
),pfgyrb野生型和突变体分别与fic-1共孵育。结果表明,fic-1也能修饰pfgyrb,修饰信号极强,pfgyrb
y111a
突变体还有微弱的被修饰信号。这可能是突变主要位点后其他非特异位点也被修饰,这在fic自修饰和对靶标修饰中较为常见,也常见于其他蛋白翻译后修饰。此外,fic-1有很强的自修饰能力,与fic-1共纯化的内源ecgyrb也被修饰,当fic-1与大量靶标蛋白结合时,自修饰能力明显减弱,含有靶标蛋白时,fic-1自修饰信号减弱,不论其与野生型gyrb或修饰位点突变体共孵育时,均有不同程度的减弱,(图4a和图4b)。上述结果说明fic-1修饰ecgyrb第109位酪氨酸,其对应于荧光假单胞菌pfgyrb的tyr
111
。
86.细菌中存在与gyrb同源的另一蛋白pare,gyrb和pare两者蛋白结构组成相似,均含有n端atpase结构域,因荧光假单胞菌或大肠杆菌gyrb上被修饰的酪氨酸位点在其对应的pare中也保守。因此突变pfpare或ecpare保守酪氨酸,将纯化的野生型pare及其可能的修饰位点突变体分别与fic-1或其失活突变体孵育,然后进行放射自显影分析。结果表明,野生型ecpare能被fic-1单磷酸腺苷化修饰,突变假定的修饰位点后修饰信号明显减弱,但仍可检测到微弱的修饰信号,这与fic-1修饰pfgyrb
y111a
时也有非特异位点被修饰类似(图4c和图4d)。用fic-1修饰荧光假单胞菌pfpare时同样可检测到很强的修饰信号,突变假定的修饰位点后,pfpare
y109a
突变体不能被修饰,说明pfpare有且仅有第109位酪氨酸被fic-1修饰。此外,与fic-1蛋白共纯化的ecgyrb在含fic-1的反应中始终被修饰,这与之前的实验结果相一致。
87.综上所述,荧光假单胞菌来源的fic-1能单磷酸腺苷化修饰荧光假单胞菌gyrb、pare的保守酪氨酸tyr
111
和tyr
109
(大肠杆菌中对应为tyr
109
和tyr
105
)。
88.实施例5
89.本实施例5的核心在于提供单磷酸腺苷化酶影响靶标蛋白水解atp的活性。
90.实施例5除以下实验和结果不同外,其余操作步骤与实施例1、2相同。
91.1、蛋白纯化是将磷酸缓冲液替换为tris-hcl缓冲液(20mm tris、150mm nacl)纯化;
92.2、水解atp活性分析:实验使用atpase/gtpase活性分析试剂盒(sigma-aldrich,catalog numbermak113)检测蛋白ecgyrb水解atp活性。用焦磷酸标样建立标准曲线,得出线性方程。实验在96孔板中室温(22℃)进行反应。30μl反应体系含40mm tris、80mm nacl、8mm mgac2和1mm edta,ph 7.5,5μg gyrb,有需要时加入1.5μg fic-1或fic-1
h135a
,设置不加任何蛋白和只加单一蛋白的反应对照。
93.3、fic-1浓度梯度抑制gyrb或pare水解活性实验与上述方法相同。将不同浓度的fic-1蛋白与gyrb或pare预先混合,加入10μl 4mmatp起始反应,室温放置30min,加入200μl孔雀绿终止反应,室温放置30min,620nm波长检测吸光值,根据线性方程计算游离磷酸。
94.结果与分析:fic-1修饰gyrb和pare的n端atp水解区域,且修饰位点tyr
109
能与atp的腺苷n3结合,单磷酸腺苷化修饰该位点是否影响其atp水解活性,进而影响dna促旋酶活性?为检测fic-1修饰对gyrb水解atp活性的影响,tris缓冲液纯化fic蛋白和gyrb,检测修饰对atp水解能力的影响。结果见图5a,fic-1和fic-1
h135a
有低背景的游离磷酸;含gyrb反应体系中形成的游离磷酸与fic蛋白差异明显,含修饰位点突变体(gyrb
y109a
)反应中游离磷酸形成极显著减少;野生型gyrb中加入fic-1有相同结果,随着fic-1加入量的增加,游离磷酸形成依次递减(图5b);加入突变体(fic-1
h135a
)不能降低atp水解能力(图5a)。上述结果说明,fic-1单磷酸腺苷化修饰gyrb抑制其atp水解活性,抑制活性依赖fic结构域的保守组氨酸,gyrb修饰位点突变体也能破坏其活性。
95.实施例6
96.本实施例6的核心在于提供单磷酸腺苷化酶抑制靶标蛋白的dna超螺旋活性
97.实施例6除以下实验和结果不同外,其余操作步骤与实施例1、2相同。
98.1、以假结核耶尓森氏菌ypiii为模板,pcr扩增ypk0608、ypgyrb、ypgyra、yppare、ypparc基因,并将基因克隆至pet-sumo载体;
99.2、用引物扩增ypk0608基因,所用引物具体为:
100.ypk0608-f(5
’‑
attggatccatgacaaaaaaaacagtacacag-3’),如seq id no.7所示;
101.ypk0608-r(5
’‑
attgtcgacctagcgggcgaggccaac-3’),如seq id no.8所示;
102.3、以荧光假单胞菌2p24基因组dna为模板,pcr扩增pfgyra、pfparc,并将基因克隆至pet-sumo载体;
103.4、dna拓扑异构酶iiadna gyrase和dna拓扑异构酶iv的超螺旋dna活性检测方法如下:
104.质粒phsg399转化大肠杆菌dh5a,手工提取的质粒dna用作负超螺旋dna。经dna拓扑异构酶i(neb,lot:0081308)处理得到松弛的dna,用于dna促旋酶活性测定。dna促旋酶a(his
6-sumo-gyra)和b(his
6-sumo-gyrb)亚基,拓扑异构酶a(his
6-sumo-parc)和b(his
6-sumo-pare),分别以1:1摩尔比混合后置于冰上30min,dna促旋酶和拓扑异构酶iv母液浓度为10pm。20μl反应液含35mm tris-hcl,24mm kcl,4mm mgcl2,2mm dtt,1.75mmatp,5mm亚精胺,0.1mg/ml bsa,6.5%甘油,ph 7.5。反应体系中加入50pm fic或fic突变体蛋白,10pmdna促旋酶或拓扑异构酶iv,设置不加蛋白和只加dna促旋酶或拓扑异构酶iv为对照。混匀后置于30℃水浴锅孵育1h,加入0.3μg松弛或超螺旋dna,混匀后30℃反应1h,5mm edta终止反应,1.2%琼脂糖凝胶于3v/cm电泳6~8h分离dna,置于eb染液缸染色10min,凝胶成像仪分析。
105.结果与分析:dna促旋酶向dna链引入负超螺旋需要gyrb亚基水解atp提供能量,fic-1修饰gyrb结合atp的关键结合位点,影响其atp水解能力,可能影响负超螺旋能力。为检测其可能性,将gyrb和gyra等摩尔比例混匀,与fic-1或fic-1
h135a
突变体预处理1h(反应体系中含atp),加入松弛dna,反应1h,1.2%琼脂糖凝胶电泳分离dna,eb染色后分析dna螺旋状态。结果表明见图6a,荧光假单胞菌dna促旋酶与其他促旋酶一样能超螺旋松弛状态的
质粒dna,而fic-1预处理的反应中dna促旋酶超螺旋能力明显受影响,fic-1
h135a
突变体无影响。上述结果说明fic-1修饰gyrb,抑制dna促旋酶负超螺旋dna。分析fic蛋白单磷酸腺苷化pare对拓扑异构酶iv(pftopo iv)松弛dna能力影响,结果见图6c,虽然fic-1可单磷酸腺苷化修饰pare,但对拓扑异构酶iv松弛活性影响有限,fic-1
h135a
突变体无影响。
106.假结核耶尔森菌fic蛋白ypk0608对dna gyrase的影响结果见图6b,结果表明ypk0608不影响dnagyrase负超螺旋dna的活性;但用ypk0608处理拓扑异构酶iv(yptopo)时,结果见图6d,yptopo松弛dna的活性受抑制,而ypk0608
h141a
不影响yptopo松弛dna的活性。
107.上述结果说明单磷酸腺苷化酶fic-1、ypk0608分别通过单磷酸腺苷化修饰靶标蛋白gyrb和pare,影响dnagyrase的dna负超螺旋活性、topo iv松弛超螺旋dna的活性。
