1.本公开的一个实施方式涉及细胞支架材料、细胞培养支撑体、以及细胞的培养方法。
背景技术:
2.细胞培养是在基材上接种细胞并添加培养基来进行的。为了提高基材与细胞的粘附性,已知有在基材上涂敷细胞支架材料的方法。
3.近年来,对于正在扩大的再生医疗而言,正在研究将以ips细胞等为代表的干细胞在生物体外进行细胞培养并增殖,应用于动物或人等的体内。细胞培养时,虽然一边传代细胞一边使细胞增殖,但优选细胞的分化被抑制而细胞增殖。若一部分细胞分化,则会妨碍细胞增殖的进行,特别是在大量培养中有时会抑制细胞增殖。另外,在培养系统中存在分化阶段不同的细胞的情况下,需要分离特定分化阶段的细胞,但纯度高地对细胞进行分离在技术上是困难的。
4.另外,细胞培养时使用蛋白成分作为培养基、支架材料等。若该蛋白混入最终培养的细胞制品中,则有时会成为抗原。另外,在蛋白来源于动物和人的情况下,批次间偏差大,有时会对细胞的稳定培养造成影响。因此,对在无血清培养基中培养细胞的需求提高。其中,尤其要求有适合于细胞、特别是干细胞在无血清培养基中的培养的细胞支架材料。
5.迄今为止,在干细胞的培养中,将层粘连蛋白、纤连蛋白等作为细胞支架材料进行了研究,但尚未获得充分的性能。
6.日本特开2018-068192号公报中公开了在两亲性嵌段共聚物的嵌段间具有由芳香环和氢键单元构成的结构的化合物作用于细胞的增殖、形态控制。专利文献1中,作为具体的化合物,列举了在聚乙二醇(peg)与聚l-乳酸(plla)、聚ε-己内酯(pcl)或三亚甲基碳酸酯(ptmc)的嵌段共聚物的嵌段间具有n-(4-(脲基甲基)苄基)苯甲酰胺的结构的化合物。
7.日本特开2018-068192号公报中提出了将该化合物作为细胞伸展-增殖调节剂添加到培养基中来使用的方案。
技术实现要素:
8.发明所要解决的课题
9.日本特开2018-068192号公报中仅公开了在培养基中添加的细胞伸展-增殖调节剂的用途,对于细胞支架材料没有进行充分研究。
10.对于细胞支架材料,要求在具备基材与细胞的粘附性的同时,不对细胞的增殖造成不良影响。此外,在使用了细胞支架材料的细胞培养中,有时希望在抑制分化的同时使细胞增殖。
11.作为本公开的一个目的,提供一种可抑制细胞分化、促进细胞增殖的细胞支架材料、细胞培养支撑体、以及细胞的培养方法。
12.用于解决课题的手段
13.用于实现上述课题的具体手段如下。
14.〔1〕一种细胞支架材料,其包含具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物。
15.〔2〕根据〔1〕所述的细胞支架材料,其中,所述聚碳酸酯结构单元(b)包含至少1个具有烷氧基烷基氧基羰基作为取代基的单元。
16.〔3〕根据〔1〕或〔2〕所述的细胞支架材料,其中,所述聚碳酸酯结构单元(b)包含至少1个具有甲氧基乙基氧基羰基作为取代基的单元。
17.〔4〕根据〔1〕所述的细胞支架材料,其中,所述聚碳酸酯结构单元(b)包含至少1个由下述通式(i)表示的单元。
18.〔化学式编号1〕
[0019][0020]
(通式(i)中,x为氢原子或碳原子数为5以下的烷基。)
[0021]
〔5〕根据〔4〕所述的细胞支架材料,其中,所述通式(i)中,x为甲基。
[0022]
〔6〕根据〔1〕~〔5〕中任一项所述的细胞支架材料,其中,所述共聚物为一端或两端部为聚乳酸结构单元(a)的嵌段共聚物。
[0023]
〔7〕根据〔6〕所述的细胞支架材料,其中,所述共聚物为ab型、aba型或abab型的嵌段共聚物。
[0024]
〔8〕根据〔7〕所述的细胞支架材料,其中,所述共聚物为aba型嵌段共聚物。
[0025]
〔9〕根据〔1〕~〔8〕中任一项所述的细胞支架材料,其中,所述聚乳酸结构单元(a)为聚d-乳酸结构单元或聚l-乳酸结构单元。
[0026]
〔10〕一种细胞培养支撑体,其包含〔1〕~〔9〕中任一项所述的细胞支架材料和基材。
[0027]
〔11〕一种细胞的培养方法,其包含下述步骤:
[0028]
准备〔1〕~〔9〕中任一项所述的细胞支架材料;
[0029]
将所述细胞支架材料配置在培养系统中;以及
[0030]
在所述细胞支架材料的存在下培养细胞。
[0031]
〔12〕根据〔11〕所述的细胞的培养方法,其中,所述培养系统由无血清培养基构成。
[0032]
发明效果
[0033]
根据本公开的一个实施方式,能够提供可抑制细胞分化、促进细胞增殖的细胞支架材料、细胞培养支撑体、以及细胞的培养方法。
附图说明
[0034]
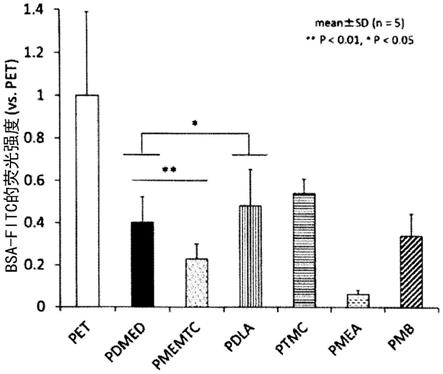
图1是表示使用了涂敷有各聚合物的支撑体的情况下的荧光标记bsa的荧光强度的图表。
[0035]
图2是使用涂敷有各聚合物的支撑体培养的人正常成纤维细胞的荧光差显微镜照
片,为从细胞培养开始起(a)1小时后、(b)1天后、(c)2天后、(d)3天后、(e)7天后。
[0036]
图3是表示使用了涂敷有各聚合物的支撑体的人正常成纤维细胞培养时细胞数相对于细胞培养时间的图表。
[0037]
图4是表示使用了涂敷有各聚合物的支撑体的人正常成纤维细胞在培养时fgf-2浓度相对于细胞培养时间的图表。
具体实施方式
[0038]
以下,对本公开的一个实施方式进行说明,但本公开并不限定于以下的例示。
[0039]
作为一个实施方式的细胞支架材料,其包含具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物。
[0040]
根据一个实施方式,能够抑制细胞分化、促进细胞增殖。
[0041]
进一步对其进行说明:构成本公开的细胞支架材料的聚乳酸结构单元和聚碳酸酯结构单元均具有对细胞的粘附性和高的生物亲和性。另一方面,聚乳酸结构单元具有疏水性的性质,聚碳酸酯结构单元为非水溶性,但与聚乳酸结构单元相比具有亲水性的性质。基于这些性质,由于各结构单元的特性,本共聚物具有在保持对细胞的粘附能力的状态下进行自组织化的倾向。推测该结构上的特性在作为细胞支架材料使用时起到抑制细胞分化且促进增殖的作用。但是,并不受该理论的限制。
[0042]
一个实施方式的细胞支架材料优选包含具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物。该共聚物优选由结构单元(a)和结构单元(b)构成嵌段共聚物。
[0043]
在一个实施方式的共聚物中,聚乳酸结构单元(a)是指由聚乳酸结构构成的结构单元,其可以是包含多个乳酸单元的结构单元。
[0044]
作为聚乳酸结构单元(a),例如可举出聚d-乳酸结构单元、聚l-乳酸结构单元、聚dl-乳酸结构单元。优选聚乳酸结构单元(a)为聚d-乳酸结构单元或聚l-乳酸结构单元,更优选为聚d-乳酸结构单元。在共聚物中含有2个以上的聚乳酸结构单元(a)的情况下,共聚物的1分子中所含的聚乳酸结构单元(a)可以全部相同,也可以全部或部分不同,但优选全部相同。
[0045]
在一个实施方式的共聚物中,聚碳酸酯结构单元(b)是指由聚碳酸酯结构构成的结构单元,其可以是包含多个碳酸酯单元的结构单元。
[0046]
作为聚碳酸酯结构单元,可以是主链上具有碳酸酯键的聚合物的结构单元的脂肪族聚碳酸酯结构单元或芳香族聚碳酸酯结构单元中的任一种,但优选是脂肪族聚碳酸酯结构单元。
[0047]
作为脂肪族聚碳酸酯结构单元,例如可举出聚碳酸亚乙酯结构单元、聚碳酸亚丙酯结构单元、聚三亚甲基碳酸酯结构单元等、它们的共聚物的结构单元、或向它们导入侧链而得到的衍生物的结构单元等。作为芳香族聚碳酸酯结构单元,例如可举出聚芳基碳酸酯结构单元等、或它们的衍生物等。作为聚芳基碳酸酯结构单元,例如可举出聚苯基碳酸酯结构单元等。
[0048]
在共聚物中含有2个以上聚碳酸酯结构单元(b)的情况下,共聚物的1分子中所含的结构单元(b)可以全部相同或全部或部分不同,但优选全部相同。
[0049]
构成聚碳酸酯结构单元(b)的碳酸酯单元可以具有取代基。聚碳酸酯结构单元(b)
优选具有至少1个具有烷氧基烷基氧基羰基的碳酸酯单元作为取代基。该具有取代基的碳酸酯单元只要在聚碳酸酯结构单元(b)中含有1个以上即可,相对于构成聚碳酸酯结构单元(b)的碳酸酯单元的全部单元,可以含有80摩尔%以上,也可以碳酸酯单元的全部单元具有该取代基。
[0050]
烷氧基烷基氧基羰基优选通过与主链的碳酸酯键的碳原子直接键合而导入。
[0051]
另外,烷氧基烷基氧基羰基中,烷氧基可以为直链或支链,优选为碳原子数为5以下的烷氧基,更优选为碳原子数为3以下的烷氧基,进一步优选为乙氧基或甲氧基,特别优选为甲氧基。
[0052]
另外,烷氧基烷基氧基羰基中,存在于烷氧基与羰基之间的亚烷基可以为直链或支链,优选碳原子数为5以下,更优选碳原子数为3以下,进一步优选为亚丙基或亚乙基,特别优选为亚乙基。
[0053]
具体而言,烷氧基烷基氧基羰基可举出甲氧基乙基氧基羰基、甲氧基丙基氧基羰基、乙氧基乙基氧基羰基、乙氧基丙基氧基羰基等,特别优选甲氧基乙基氧基羰基。
[0054]
在共聚物中,作为聚碳酸酯结构单元(b)的取代基,通过具有烷氧基烷基氧基羰基、例如甲氧基乙基氧基羰基,能够进一步提高对细胞的粘附性,另外,在细胞增殖中能够进一步抑制细胞的分化。考虑通过含有该取代基,容易在非水溶性的结构单元的分子链之间采取包含水分子的层结构,在聚碳酸酯结构单元(b)的部分中细胞得以稳定地保持,细胞的增殖得到进一步促进,另外,细胞的分化得到进一步抑制,但并不受该理论的限制。
[0055]
作为聚碳酸酯结构单元(b)的优选的一例,优选包含至少1个由下述通式(ii)表示的碳酸酯单元。
[0056]
[化学式编号2]
[0057][0058]
通式(ii)中,m为氢原子、碳原子数为5以下的直链或支链的烷基、或由-l-z表示的基团,m和m’各自独立地为0~5的整数,满足m+m’=1~7,y为由-l-z表示的基团,l为具有亚烷基、醚键、酯键、单键、-c(=o)或它们的组合的2价基团,z为具有链状醚基、环状醚基、具有缩醛结构的基团、烷氧基、烷氧基烷基、或它们的组合的1价基团。
[0059]
聚碳酸酯结构单元(b)可以是由多个通式(ii)表示的碳酸酯单元聚合而成的单元。这种情况下,由通式(ii)表示的单元的聚合度例如可以为2~2000。
[0060]
聚碳酸酯结构单元中,由通式(ii)表示的碳酸酯单元可以包含至少1个,也可以包含2个以上,相对于聚碳酸酯结构单元中所含的碳酸酯单元的全部单元可以包含80摩尔%以上。此外,聚碳酸酯结构单元中所含的碳酸酯单元可以全部为由通式(ii)表示的单元。
[0061]
另外,在聚碳酸酯结构单元中包含多个由通式(ii)表示的单元的情况下,多个由通式(ii)表示的单元全部可以相同也可以不同,或者也可以部分不同。
[0062]
通式(1)中,作为m,可以为氢原子、碳原子数为5以下、优选为3以下、进一步优选为2以下的直链或支链的烷基、或由-l-z表示的基团。例如可举出氢原子、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、仲丁基、戊基、异戊基、仲戊基、叔戊基。另外,由-l-z表示的基
团如后述的y所说明的那样。作为m,其中优选甲基或乙基,更优选甲基。
[0063]
另外,m和m’各自独立地为0~5的整数,优选满足m+m’=1~7。此外,优选满足m+m’=1~4,更优选为m=m’=1。在m=m’=1的情况下,聚碳酸酯结构单元的主链成为聚三亚甲基碳酸酯的骨架。
[0064]
另外,y是由-l-z表示的基团,l和z分别如下所述。
[0065]
l为主链与z的连接基团,可以为具有亚烷基、醚键、酯键、单键、-c(=o)或它们的组合的2价基团,其中,优选具有醚键、酯键、单键、-c(=o)或它们的组合的2价基团,更优选具有酯键或-c(=o)-的2价基团。
[0066]
z可以为具有链状醚基、环状醚基、具有缩醛结构的基团、烷氧基、烷氧基烷基、或它们的组合的1价基团,其中优选链状醚基或烷氧基烷基。
[0067]
作为链状醚基,例如优选具有乙二醇、丙二醇等亚烷基二醇或其聚合物的结构。
[0068]
作为z的具体例,在下述通式(iii)中,r为亚乙基或亚丙基,r’为氢原子或碳原子数为5以下的直链或支链的烷基,n为1~30的整数。
[0069]-(r-o)
n-r’(iii)
[0070]
通式(iii)中,r优选为亚乙基。另外,r’优选为甲基或乙基,更优选为甲基。另外,n优选为1~5,更优选为1或2。
[0071]
更优选z为烷氧基烷基,例如可举出甲氧基乙基、甲氧基丙基、乙氧基乙基、乙氧基丙基、丙基氧基乙基、丙基氧基丙基等,其中,优选甲氧基乙基。
[0072]
作为由-l-z表示的基团的具体例,例如可举出-och3、-och2ch3、-och2ch2ch3、-ch2och3、-ch2och2ch3、-ch2och2ch2ch3、-ch2ch2och3、-ch2ch2och2ch3、-ch2ch2och2ch2ch3、-ch2och2ch2och3、-ch2och2ch2och2ch3、-ch2och2ch2och2ch2ch3、-ch2ch2och2ch2och3、-ch2ch2och2ch2och2ch3、-ch2ch2och2ch2och2ch2ch3、-c(=o)och3、-c(=o)och2ch3、-c(=o)och2ch2ch3、-c(=o)och2ch2och3、-c(=o)och2ch2ch2och3、-c(=o)och2ch2och2ch3、-c(=o)och2ch2ch2och2ch3、-c(=o)och2ch2och2ch2ch3、-c(=o)och2ch2ch2och2ch2ch3等。其中,优选-c(=o)och3、-c(=o)och2ch3、-c(=o)och2ch2ch3、-c(=o)och2ch2och3、-c(=o)och2ch2ch2och3、-c(=o)och2ch2och2ch3、-c(=o)och2ch2ch2och2ch3、-c(=o)och2ch2och2ch2ch3、或-c(=o)och2ch2ch2och2ch2ch3。更优选-c(=o)och2ch2och3、-c(=o)och2ch2ch2och3、-c(=o)och2ch2och2ch3、-c(=o)och2ch2ch2och2ch3、-c(=o)och2ch2och2ch2ch3、或-c(=o)och2ch2ch2och2ch2ch3。特别优选-c(=o)och2ch2och3。
[0073]
作为聚碳酸酯结构单元(b)的更具体的优选的一例,优选包含至少1个由下述通式(i)表示的碳酸酯单元。
[0074]
[化学式编号3]
[0075][0076]
通式(i)中,x为氢原子或碳原子数为5以下的烷基。
[0077]
x中,碳原子数为5以下的烷基可以是直链或支链。另外,x优选为甲基或乙基,更优
选为甲基。
[0078]
聚碳酸酯结构单元(b)可以是多个由通式(i)表示的碳酸酯单元聚合而成的单元。这种情况下,由通式(i)表示的单元的聚合度例如可以为2~2000。
[0079]
聚碳酸酯结构单元中,由通式(i)表示的碳酸酯单元可以包含至少1个,也可以包含2个以上,相对于聚碳酸酯结构单元中所含的碳酸酯单元的全部单元,优选包含80摩尔%以上。此外,聚碳酸酯结构单元中所含的碳酸酯单元可以全部为由通式(i)表示的单元。
[0080]
另外,在聚碳酸酯结构单元中包含多个由通式(i)表示的单元的情况下,多个由通式(i)表示的单元可以全部彼此相同也可以不同,或者也可以部分不同。
[0081]
一个实施方案的共聚物可以是包含聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的嵌段共聚物。这种情况下,嵌段共聚物的嵌段结构优选至少一个端部为聚乳酸结构单元(a)。即,嵌段共聚物的嵌段结构优选一端或两端部为聚乳酸结构单元(a)。例如,可举出ab型、aba型、abab型等,优选为aba型。
[0082]
嵌段共聚物的嵌段结构中,通过一端或两端部为聚乳酸结构单元(a),聚乳酸结构单元(a)具备对基材的粘附性,因此能够使细胞支架材料更稳定地附着于基材。
[0083]
此外,考虑如aba型那样,通过两端部为聚乳酸结构单元(a),在嵌段共聚物的两端部,聚乳酸结构单元(a)粘附于基材,中间部分的聚碳酸酯结构单元(b)从基材浮起,嵌段共聚物附着于基材。通过该构成,能够在浮起的聚碳酸酯结构单元(b)的部分处捕获细胞,同时进一步提高细胞对基材的粘附性。
[0084]
作为嵌段共聚物的一例,为下述由通式(iv)表示的共聚物。更具体而言,优选下述由通式(iv)表示的共聚物。
[0085]
[化学式编号4]
[0086][0087]
在通式(iv)中,x与上述通式(i)相同,因此省略说明。通式(iv)中,a、b、c和d是根据共聚物的分子量而适当确定的数值,可以彼此相同也可以部分或全部不同。例如,优选满足a=d和b=c中的一个或二者,更优选a=d且b=c。
[0088]
在通式(v)中,a、b、c和d与上述通式(iv)相同,因此省略说明。
[0089]
一个实施方式的共聚物的1分子的数均分子量(mn)优选为5,000~100,000,更优选为10,000~80,000,进一步优选为12,500~70,000,特别优选为15,000~50,000。
[0090]
一个实施方式的共聚物的1分子的分子量分布(mw/mn)没有特别限定,例如为2.0以下,优选为1.5以下,更优选为1.2以下。
[0091]
聚乳酸结构单元(a)的数均分子量(mn)优选为1,000~50,000,更优选为3,000~
40,000,进一步优选为4,000~35,000,更进一步优选为5,000~30,000。
[0092]
另外,聚乳酸结构单元(a)的分子量分布(mw/mn)没有特别限定,优选为1.0~10,更优选为1.0~8,进一步优选为1.05~5。
[0093]
聚碳酸酯结构单元(b)的数均分子量(mn)优选为2,000~50,000,更优选为5,000~40,000,进一步优选为6,000~35,000,特别优选为7,000~20,000。
[0094]
另外,聚碳酸酯结构单元(b)的分子量分布(mw/mn)没有特别限定,优选为1.0~10,更优选为1.0~8,进一步优选为1.05~5。
[0095]
在此,聚乳酸结构单元(a)的数均分子量为1个嵌段的数均分子量,在嵌段共聚物中包含2个以上的聚乳酸结构单元(a)的嵌段的情况下,优选分别满足该范围。聚碳酸酯结构单元(b)也同样。
[0096]
另外,数均分子量(mn)和重均分子量(mw)可以使用用标准聚苯乙烯校正过的凝胶渗透色谱(gpc)来进行测定。另外,分子量分布可以由重均分子量(mw)与数均分子量(mn)之比(mw/mn)求出。
[0097]
在一个实施方式的共聚物中,优选构成聚乳酸结构单元(a)的全部单元为乳酸单元。另外,在一个实施方式的共聚物中,优选构成聚碳酸酯结构单元(b)的全部单元为碳酸酯单元。
[0098]
在一个实施方式的共聚物中,相对于构成共聚物整体的单体单元的全部单元,构成聚乳酸结构单元(a)的单体单元的全部单元优选为10摩尔%以上,更优选为30摩尔%以上,进一步优选为40摩尔%以上。
[0099]
另外,在另一个实施方式的共聚物中,相对于构成共聚物整体的单体单元的全部单元,构成聚乳酸结构单元(a)的单体单元的全部单元优选为90摩尔%以下,更优选为70摩尔%以下,进一步优选为60摩尔%以下。
[0100]
相对于构成共聚物整体的单体单元的全部单元,构成聚乳酸结构单元(a)的单体单元的全部单元优选为10~90摩尔%,更优选为30~70摩尔%,进一步优选为40~60摩尔%。
[0101]
在一个实施方式的共聚物中,相对于构成共聚物整体的单体单元的全部单元,构成聚碳酸酯结构单元(b)的单体单元的全部单元优选为10摩尔%以上,更优选为30摩尔%以上,进一步优选为40摩尔%以上。
[0102]
另外,在另一个实施方式的共聚物中,相对于构成共聚物整体的单体单元的全部单元,构成聚碳酸酯结构单元(b)的单体单元的全部单元优选为90摩尔%以下,更优选为70摩尔%以下,进一步优选为60摩尔%以下。
[0103]
相对于构成共聚物整体的单体单元的全部单元,构成聚碳酸酯结构单元(b)的单体单元的全部单元优选为10~90摩尔%,更优选为30~70摩尔%,进一步优选为40~60摩尔%。
[0104]
在一个实施方式的共聚物中,构成聚乳酸结构单元(a)的单体单元的全部单元数与构成聚碳酸酯结构单元(b)的单体单元的全部单元数以摩尔比计,优选为10:90~90:10,更优选为30:70~70:30,进一步优选为40:50~50:40。
[0105]
在一个实施方式的共聚物中,相对于构成共聚物整体的单体单元的全部单元,构成聚乳酸结构单元(a)的单体单元的全部单元及构成聚碳酸酯结构单元(b)的单体单元的
全部单元的合计单元优选为80摩尔%以上,更优选为90摩尔%以上。此外,一个实施方式的共聚物也可以由聚乳酸结构单元(a)和聚碳酸酯结构单元(b)构成。
[0106]
在此,在一个实施方式的共聚物为嵌段共聚物且嵌段共聚物中包含2个以上的聚乳酸结构单元(a)的嵌段的情况下,优选构成2个以上的聚乳酸结构单元(a)的嵌段的单体单元的全部单元的合计量满足上述的范围。聚碳酸酯结构单元(b)也同样。
[0107]
以下,对一个实施方式的共聚物的合成方法的一个例子进行说明。另外,一个实施方式的共聚物并不限定于通过以下的合成方法得到的共聚物。
[0108]
共聚物可以通过准备聚乳酸和聚碳酸酯并使聚乳酸和聚碳酸酯键合来合成。
[0109]
另外,也可以准备聚碳酸酯,使乳酸、乳酸丙交酯或它们的组合作为单体聚合并键合在聚碳酸酯的一端或两端来进行合成。
[0110]
另外,也可以准备聚乳酸,使作为单体的碳酸酯聚合并键合在聚乳酸的一端或两端来进行合成。
[0111]
另外,也可以使用乳酸和碳酸酯进行无规聚合,或者也可以使用聚合试剂进行嵌段共聚。
[0112]
作为聚乳酸,可以单独使用聚d-乳酸、聚l-乳酸、聚dl-乳酸等,或者将它们组合使用,优选使用聚d-乳酸或聚l-乳酸作为单一成分,更优选使用聚d-乳酸作为单一成分。
[0113]
聚乳酸的数均分子量优选根据要导入嵌段共聚物的结构单元(a)的目标分子量来适当设定。
[0114]
作为构成聚乳酸的单体成分,例如可举出乳酸、乳酸丙交酯、及乳酸与乳酸丙交酯的组合等。
[0115]
作为构成聚乳酸的单体成分的乳酸,可以单独使用d-乳酸、l-乳酸、dl-乳酸等,或者将它们组合使用,优选使用d-乳酸或l-乳酸作为单一成分,更优选使用d-乳酸作为单一成分。
[0116]
作为单体成分乳酸丙交酯,可以单独使用d-乳酸丙交酯、l-乳酸丙交酯、dl-乳酸丙交酯等,或者将它们组合使用,优选使用d-乳酸丙交酯或l-乳酸丙交酯作为单一成分,更优选使用d-乳酸丙交酯作为单一成分。
[0117]
作为单体成分,可以将乳酸和乳酸丙交酯组合使用,也可以分别单独使用。
[0118]
作为聚碳酸酯,可以单独使用脂肪族聚碳酸酯、芳香族聚碳酸酯,或者将它们组合使用。
[0119]
作为聚碳酸酯,可以优选使用包含至少1个具有烷氧基烷基氧基羰基作为取代基的碳酸酯单元的聚碳酸酯衍生物,进一步优选该取代基为甲氧基乙基氧基羰基。
[0120]
另外,作为聚碳酸酯,优选使用包含至少1个由通式(ii)表示的碳酸酯单元的聚碳酸酯衍生物。此外,优选使用包含至少1个由通式(i)表示的碳酸酯单元的聚碳酸酯衍生物。作为由通式(ii)表示的碳酸酯单元,优选具有烷氧基烷基氧基羰基作为取代基的碳酸酯单元。另外,作为由通式(i)表示的碳酸酯单元,优选具有甲氧基乙基氧基羰基作为取代基的碳酸酯单元。
[0121]
聚碳酸酯的数均分子量优选根据要导入嵌段共聚物的聚碳酸酯结构单元(b)的目标分子量来适当设定。
[0122]
作为构成聚碳酸酯的单体成分的碳酸酯,优选脂肪族碳酸酯,例如可举出碳酸亚
乙酯、碳酸亚丙酯、三亚甲基碳酸酯等、或它们的衍生物等。它们可以单独使用或将2种以上组合使用。更优选具有由通式(ii)表示的结构的碳酸酯、或其环状体即环状碳酸酯。另外,可以使用后述的三亚甲基碳酸酯衍生物。
[0123]
聚乳酸或聚乳酸的单体成分与聚碳酸酯或聚碳酸酯的单体成分的共聚优选通过溶液聚合进行,根据需要,可以在合成体系中添加聚合引发剂、聚合催化剂等来进行。
[0124]
作为聚合溶剂,例如可举出二氯甲烷、氯仿、二乙基醚、四氢呋喃(thf)、甲苯等。
[0125]
作为聚合引发剂,例如可举出1-芘丁醇、月桂醇、癸醇、硬脂醇等醇系聚合引发剂;1,8-二氮杂双环[5,4,0]十一碳-7-烯(dbu)、二甲基氨基吡啶(dmap)、三亚乙基二胺(dabco)、(+)-金雀花碱、(-)-金雀花碱等环状胺聚合引发剂等。
[0126]
作为聚合催化剂,例如可举出1-(3,5-双(三氟甲基)苯基)-3-环己基-2-硫脲(tu)等二官能基化硫代脲等。
[0127]
聚合优选在室温至不影响合成体系的温度的范围内,更具体而言,在室温至50℃的范围内,在大气气氛或非活性气氛、优选氮气气氛等非活性气氛下,优选进行1分钟~12小时,更优选进行30分钟~6小时。
[0128]
聚合反应的结束可以根据单体成分等是否存在于反应体系来进行判断,可以通过1h-nmr、tlc等方法进行确认。聚合反应充分进行后,通过加入反应终止剂可以结束聚合反应。作为反应终止剂,例如可举出乙酸、盐酸、硫酸、苯甲酸等。
[0129]
以下,对具有烷氧基烷基氧基羰基作为取代基的聚碳酸酯衍生物的合成方法进行说明。该聚碳酸酯衍生物可以通过将在环状碳酸酯的骨架中导入有作为侧链导入聚合物的官能团的单体进行开环聚合而得到。
[0130]
作为更具体的例子,对包含由通式(ii)表示的碳酸酯单元的聚碳酸酯衍生物的合成方法进行说明。
[0131]
例如,为了将通式(ii)中具有m=m’=1的单元的聚三亚甲基碳酸酯的衍生物聚合,可以使用在三亚甲基碳酸酯的碳原子上导入有由m表示的基团和由y表示的基团的三亚甲基碳酸酯衍生物作为单体。m和y如上述通式(ii)中说明的那样。
[0132]
作为三亚甲基碳酸酯的衍生物的具体例,例如可举出5-甲基-5-(2-甲氧基乙基氧基羰基)-1,3-二噁烷-2-酮、5-甲基-5-(2-乙氧基乙基氧基羰基)-1,3-二噁烷-2-酮、5-甲基-5-[2-(2-甲氧基乙氧基)乙基氧基羰基]-1,3-二噁烷-2-酮、4-甲基-4-(2-甲氧基乙基氧基羰基)-1,3-二噁烷-2-酮、4-甲基-4-(2-乙氧基乙基氧基羰基)-1,3-二噁烷-2-酮、4-甲基-4-[2-(2-甲氧基乙氧基)乙基氧基羰基]-1,3-二噁烷-2-酮等。
[0133]
在具有由通式(ii)表示的单元的聚碳酸酯衍生物的合成中,在环状碳酸酯的骨架中导入有作为侧链导入聚合物的官能团的单体的开环聚合没有特别限定,可以通过各种方法进行。例如,开环聚合可以使用各种聚合引发剂利用阳离子聚合反应、阴离子聚合反应等,根据需要也可以使用聚合催化剂等。聚合溶剂、聚合引发剂、聚合催化剂没有特别限制,可以使用在上述共聚物的合成中说明过的物质。
[0134]
更详细而言,可以按照日本特开2014-161675号公报中记载的方法进行合成。
[0135]
一个实施方式的细胞支架材料可以含有上述一个实施方式的共聚物作为单一成分。
[0136]
另外,一个实施方式的细胞支架材料也可以在添加于溶剂的状态下作为细胞支架
材料组合物提供。作为溶剂,可举出水、有机溶剂、或它们的混合溶剂。作为水,除了作为溶剂使用的水以外,也可以是一个实施方式的共聚物的中间水。作为有机溶剂,可举出二氯甲烷、甲醇等。细胞支架材料组合物根据需要可以进一步含有后述的培养基用添加剂、其他的添加成分等。
[0137]
另外,根据一个实施方式,能够提供包含上述一个实施方式的细胞支架材料和基材的细胞培养支撑体。
[0138]
一个实施方式的细胞培养支撑体能够起到抑制细胞分化且促进增殖的作用,因此可适合用于通过培养使特定分化阶段的细胞增殖。
[0139]
支撑体中所含的基材的形状没有特别限制,可以为选自平面平板、曲面平板、球体、块体等中的1种以上。
[0140]
具体而言,作为基材,可以没有特别限制地使用作为细胞培养基材使用的基材,例如可以使用培养皿、平底孔板、圆底孔板等孔板;玻璃皿等细胞容器;微珠、微载体、三维块体;细胞片等。
[0141]
作为基材的材料,没有特别限定,优选对细胞不显示毒性的材料。例如可举出聚对苯二甲酸乙二醇酯等酯系树脂、(甲基)丙烯酸系树脂、环氧系树脂、氨基甲酸酯系树脂、苯乙烯系树脂、硫醇系树脂、硅酮系树脂等树脂;纯镍、钛、铂、金、钨、铼、钯、铑、钌等金属;不锈钢、钛/镍、镍钛诺(nitinol)、钴铬、铂铱合金等合金;玻璃、陶瓷等。
[0142]
另外,也可以适用于将进行了细胞培养的基材直接移植到生物体的再生医疗。作为适合再生医疗用的基材,可举出例如硅酮、聚醚嵌段酰胺(pebax)、聚氨酯、硅酮-聚氨酯共聚物、陶瓷、胶原蛋白、羟基磷灰石、尼龙、聚对苯二甲酸乙二醇酯、gore-tex(注册商标)等超高分子量聚乙烯、聚氯乙烯、其他生物体来源材料等生物相容性材料;聚丙交酯(pla)、聚乙交酯(pga)、聚己内酯(pcl)、以及它们的共聚物、phb-phv系聚(烷酸)类、聚酯类、淀粉、纤维素、壳聚糖等天然高分子、其衍生物等生物降解性材料等。
[0143]
细胞培养支撑体可以通过对基材赋予细胞支架材料而得到。
[0144]
例如可以在将细胞支架材料溶解于有机溶剂后,以液体组合物的状态赋予基材。
[0145]
作为溶剂,可以使用二氯甲烷、甲醇等。另外,液体组合物除了细胞支架材料以外,还可以进一步包含后述的培养基用添加剂、其他添加成分等。相对于液体组合物总量,细胞支架材料优选为0.05~10质量%,更优选为0.1~1质量%。
[0146]
作为液体组合物向基材赋予的方法,没有特别限定,例如可举出使用旋涂机的方法等。
[0147]
作为细胞支架材料向基材的赋予量,可以根据基材的种类、细胞支架材料的种类、成为培养对象的细胞的种类、赋予的方法等适当调整。细胞支架材料向基材的赋予量以每单位面积的固体成分量计,例如可以为0.05μg/mm2~500μg/mm2。在采用使用了旋涂机的赋予方法的情况下,以每单位面积的固体成分量计,例如可以设为0.01μg/mm2~10μg/mm2,可以设为0.05μg/mm2~5μg/mm2,或者可以设为0.1μg/mm2~3.0μg/mm2。
[0148]
在对基材赋予细胞支架材料之前,也可以用除一个实施方式的共聚物以外的其他聚合物进行处理。作为其他聚合物,例如可举出(甲基)丙烯酸系树脂等。其他聚合物优选适当添加溶剂,以液体状赋予基材。通过在基材与细胞支架材料之间夹设其他聚合物,能够进一步提高支架材料对基材的密合性。
[0149]
一个实施方式的细胞培养支撑体可以配置于成为增殖对象的细胞的培养系统。具体而言,可以将细胞培养支撑体预先配置于培养基中,将成为对象的细胞接种于该培养基,或者可以向对象细胞所存在的培养系统供给细胞培养支撑体。由此,对象细胞与细胞培养支撑体接触,对象细胞粘附于细胞培养支撑体而生长。其结果,通过使用一个实施方式的细胞培养支撑体,能够抑制对象细胞分化且促进增殖。
[0150]
以下,对一个实施方式的细胞的培养方法进行说明。
[0151]
一个实施方式的细胞的培养方法可以包含准备细胞支架材料的工序、将细胞支架材料配置于培养系统的工序、以及在细胞支架材料的存在下培养细胞的工序。
[0152]
在此,对于细胞支架材料,可以使用上述一个实施方式的细胞支架材料。由此,能够抑制细胞分化、促进细胞增殖,大量生产未分化的细胞。
[0153]
在准备细胞支架材料的工序中,准备上述一个实施方式的细胞支架材料。此时,细胞支架材料可以以含有细胞支架材料作为一个成分的上述的组合物的形态提供,或者也可以以含有细胞支架材料和基材的细胞培养支撑体的形态提供。
[0154]
在将细胞支架材料配置于培养系统的工序中,适当选择与提供细胞支架材料的方式相应的配置方法,将细胞支架材料配置于培养系统。例如,作为包含细胞支架材料组合物或平板形状的基材的细胞培养支撑体,可以在细胞接种前预先将细胞支架材料配置于培养系统。作为其他方法,可以预先将对象细胞接种于培养系统,在其后的培养系统中,作为细胞支架材料组合物或微珠形状的细胞培养支撑体,可以配置细胞支架材料。
[0155]
在进行细胞培养的工序中,在细胞支架材料的存在下,进行成为对象的细胞的培养。
[0156]
作为可成为培养对象的细胞,例如可以使用原代培养细胞、培养细胞株、重组培养细胞株等。对于细胞的来源没有特别限定,例如可举出人、黑猩猩、猴、牛、马、猪、狗、猫、兔、大鼠、小鼠、仓鼠等哺乳类;鸡等鸟类等。另外,也可以使用使种类不同的2个以上的细胞杂交而成的细胞。
[0157]
作为细胞所来源的器官、组织,没有特别限定,例如可举出血细胞/淋巴系统、血管系统、脑-神经系统、骨髓、肌肉组织、胸腺、唾液腺、口腔、食管、胃、肝脏、胆囊、脾脏、小肠、大肠、直肠、皮肤、角膜、肺、肺、甲状腺、哺乳器官、子宫、子宫颈、卵巢、睾丸、胰脏、肾脏、肾上腺皮质、膀胱、胎盘、脐带、胚胎、胎儿、尾、间充质干细胞、癌细胞等。
[0158]
另外,作为可培养的细胞,可以优选使用干细胞。例如,可举出胚胎干细胞(es细胞)、人工多能干细胞(ips细胞)、胚胎肿瘤细胞(ec细胞)、胚胎生殖干细胞(eg细胞)、核移植es细胞、体细胞来源es细胞等具有分化多能性的干细胞;造血干细胞、骨髓来源间充质干细胞、脂肪组织来源间充质干细胞、脐带来源间充质干细胞、其他间质来源干细胞、muse细胞、神经干细胞等组织干细胞;肝脏、胰腺、脂肪组织、骨组织、软骨组织、神经组织等各种组织中的前体细胞、成纤维细胞等各种干细胞。
[0159]
作为细胞的培养,可以根据细胞的种类直接使用在成为对象的细胞的培养中通常使用的条件。
[0160]
作为细胞培养中使用的培养基,只要是细胞能够生存、增殖的培养基即可,没有特别限定,可以根据所培养的细胞的种类适当选择。
[0161]
作为培养基,可以是血清培养基或无血清培养基中的任一种,但一个实施方式的
细胞支架材料可以优选用于无血清培养基中的培养。
[0162]
作为无血清培养基,例如可举出eagle培养基、dulbecco改良eagle培养基(低葡萄糖或高葡萄糖)、eagle mem培养基、αmem培养基、imdm培养基、ham’s f10培养基、ham’s f12培养基、rpmi1640培养基等、或它们的混合培养基。
[0163]
血清培养基可以通过在无血清培养基中添加血清来制备。在无血清培养基中添加血清的情况下,例如可以使用胎牛血清(fbs)、马血清、人血清等血清等。在添加血清的情况下,血清的浓度优选为30%以下。
[0164]
培养基中可以根据需要添加添加剂。作为添加剂,例如可举出维生素a、维生素b1、维生素b2、维生素b6、维生素b12、维生素c、维生素d等维生素;叶酸等辅酶;甘氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、异亮氨酸、亮氨酸等氨基酸;作为乳酸等碳源的糖或有机酸;egf、fgf、pfgf、tgf-β等生长因子;il-1、il-6等白细胞介素;tnf-α、tnf-β、瘦蛋白等细胞因子;转铁蛋白等金属转运蛋白;铁离子、硒离子、锌离子等金属离子;β-巯基乙醇、谷胱甘肽等sh试剂;白蛋白等蛋白等。
[0165]
细胞的培养方法没有特别限定,可以使用适于各细胞的方法。通常,细胞的培养可以在30~40℃的范围内、优选37℃的温度、70~100%的范围内、优选95~100%的范围内的湿度、2%~7%co2、优选5%co2环境下进行。细胞传代的时期及方法也没有特别限定,可以使用适于各个细胞的方法。
[0166]
培养的方式可以是细胞的附着容易的二维培养,也可以是在培养系统中使细胞浮游的三维培养。培养的方式可根据细胞的种类、培养基组成等适当选择。
[0167]
另外,根据一个实施方式,可以提供包含上述一个实施方式的细胞支架材料、基材以及培养基的细胞培养试剂盒。在该试剂盒中,也可以将一个实施方式的细胞支架材料、基材、培养基分别保存于不同的容器。另外,也可以使用具备一个实施方式的基材和细胞支架材料的细胞支架支撑体,将细胞培养支撑体和培养基分别保存于不同的容器。另外,该试剂盒中也可以包含要培养的细胞。另外,在该试剂盒中,也可以具备培养中使用的器具等。一个实施方式的细胞支架材料、细胞支架材料支撑体如上所述。
[0168]
另外,根据一个实施方式,可以提供具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物用于细胞支架材料的用途。
[0169]
另外,根据一个实施方式,可以提供一种具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物在制造细胞支架材料中的用途。
[0170]
在此,关于具有聚乳酸结构单元(a)和聚碳酸酯结构单元(b)的共聚物,直接援引关于上述一个实施方式的细胞支架材料中的共聚物所记述的事项。例如,在本共聚物中,聚碳酸酯结构单元(b)可以含有至少1个具有烷氧基烷基氧基羰基的单元作为取代基,另外,聚碳酸酯结构单元(b)也可以含有至少1个上述由通式(i)表示的单元。另外,在本共聚物中,聚乳酸结构单元(a)可以是聚d-乳酸结构单元或聚l-乳酸结构单元。此外,本共聚物也可以是aba型嵌段共聚物。也可以是它们的任意组合。在一例中,在本共聚物中,聚碳酸酯结构体(b)含有至少1个具有烷氧基烷基氧基羰基的单元作为取代基,或者含有至少1个上述由通式(i)表示的单元,聚乳酸结构单元(a)为聚d-乳酸结构单元或聚l-乳酸结构单元。该一例的共聚物的aba可为嵌段共聚物。
[0171]
实施例
[0172]
以下,通过实施例对本发明具体地进行说明,但本公开并不限定于这些实施例。
[0173]“物性的评价方法”[0174]
实施例中得到的产物的分子量、结构的确认、聚合的进行度通过以下的步骤进行评价。
[0175]
(1)分子量
[0176]
数均分子量(mn)及重均分子量(mw)通过在chromaster gpc分析系统(株式会社日立high-tech science制)上连接gpc柱(株式会社日立化成techno service制“gelpack gl-r420、r430、r440”),将thf作为洗脱液、以1.75ml/min进行洗脱来测定。
[0177]
(2)分子量分布([mw/mn])
[0178]
分子量分布使用通过上述(1)的方法求出的重均分子量(mw)和数均分子量(mn)的值,作为其比(mw/mn)求出。
[0179]
(3)nmr测定
[0180]
关于单体及聚合物的结构分析,使用nmr测定装置(日本电子株式会社制、jeol 500mhz jnm-ecx)进行1h-nmr测定。其中,化学位移以cdcl3(1h:7.26ppm)为基准。
[0181]“试剂”[0182]
2,2-双(羟甲基)丙酸(bis-mpa:98%)、2-甲氧基乙醇(99.8%)、amberlyst-15(注册商标)(干燥,湿度≤1.5%)购自sigma-aldrich japan株式会社,直接使用。乙酸乙酯(99.5%)、二氯甲烷(dcm:99.5%)、吡啶(99.5%)、氯化铵(98.5%)、碳酸氢钠(99.5~100.3%)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu:99.0%)、苯甲酸(99.5%)、二乙基醚(99.0%)、己烷(95.0%)、三亚甲基碳酸酯(tmc:98.0%)、甲醇(99.8%)、四氢呋喃(thf:99.5%)、(+)-金雀花碱(sp)、2-丙醇(99.7%)购自关东化学株式会社。脱水等级的thf、dcm由关东化学株式会社制溶剂供给系统供给(水分量《10ppm)。盐酸(35.0~37.0质量%)、硫酸镁(95.0%)购自富士胶片和光纯药株式会社,三光气(98%)、苄醇、2-甲氧基乙基丙烯酸酯(>98.0%)、1,4-二噁烷(>99.0%)、2,2-偶氮双(异丁腈)(aibn>98.0%)从东京化成工业株式会社购入,直接使用。1-(3,5-双(三氟甲基)苯基)-3-环己基-2-硫脲(tu)参考已报道的方法进行合成。单体类、tu溶解于thf中,用cah2(氢化钙)进行干燥。dbu使用用cah2进行减压蒸馏得到的产物。
[0183]
d-乳酸丙交酯(d-lactide)购自purac公司。
[0184]
lipidure(注册商标)-cm5206(以下也记作pmb)购自日油株式会社。
[0185]“合成例1:聚乳酸-聚碳酸酯嵌段共聚物(pdmed)的合成”[0186]
《2-甲氧基乙基2,2-双(羟基甲基))丙酸酯(me-mpa)的合成》
[0187]
[化学式编号5]
[0188][0189]
将bis-mpa(30.0g,0.224mol)、离子交换树脂amberlyst-15(注册商标)(6.00g)加入2-甲氧基乙醇(300ml,3.82mol)中,在90℃下加热、搅拌48小时。然后,从反应溶液中滤掉
离子交换树脂,将得到的滤液在减压下浓缩。然后,进行真空干燥,得到作为淡黄色油状物质的me-mpa(41.4g,收率为96.3%)。1h-nmr(400mhz,cdcl3):δ4.35(t,j=4.8hz,2h),3.85(d,j=12hz,2h),3.73(d,j=12hz,2h),3.63(t,j=5.0hz,2h),3.39(s,3h),1.11(s,3h)
[0190]
《2-(2-甲氧基乙基氧基羰基))-2-甲基三亚甲基碳酸酯(memtc)的合成》
[0191]
[化学式编号6]
[0192][0193]
将me-mpa(20.0g,0.104mol)和吡啶(50.5ml,0.624mol)加入到二氯甲烷(dcm)(120ml)中,在干冰-2-丙醇(ipa)浴中冷却至-75℃。接着,滴加三光气(15.4g,0.0520mol)的dcm溶液(160ml),在-75℃的冷却下搅拌1小时,然后在室温下搅拌2小时。反应结束后,加入饱和氯化铵水溶液(200ml)搅拌30分钟,进一步用1n盐酸水溶液(200ml)将有机相依次用饱和碳酸氢钠水溶液(200ml)、饱和食盐水(200ml)和离子交换水(200ml)洗涤2次。得到的有机相用硫酸镁干燥后,在减压下浓缩、干燥。然后,用柱色谱(乙酸乙酯)进行精制,得到作为无色粘性液体的memtc(14.1g,收率为46.2%)。1h-nmr(400mhz,cdcl3):δ4.68(d,j=11hz,2h),4.32(t,j=9.5hz,2h),4.20(d,j=11hz,2h),3.57(t,j=4.8hz,2h),3.33(s,3h),1.31(s,3h)
[0194]
《聚[2-(2-甲氧基乙基氧基羰基))-2-甲基三亚甲基碳酸酯(pmemtc)的合成》
[0195]
[化学式编号7]
[0196][0197]
氮气气氛下在手套箱内,将memtc(0.433g,1.99mmol)、tu(15.0mg,0.041mmol)和dbu(6.1mg,0.040mmol)在dcm(2ml)中、在室温下搅拌。反应2小时后,利用1h-nmr确认单体的消耗,加入数滴作为终止剂的苯甲酸,搅拌一夜。然后,将反应溶液在2-丙醇(60ml)中再沉淀,在真空下使其干燥,得到无色且具有粘性的聚合物pmemtc(0.325g,收率为75.1%)。gpc:mn 8700,mw/mn 1.11;1h-nmr(400mhz,cdcl3):δ4.30(m,6h),3.58(t,j=4.8hz,2h),3.36(s,3h),1.27(s,3h)
[0198]
《pdla-pmemtc-pdla(pdmed)的合成》
[0199]
[化学式编号8]
[0200][0201]
氮气气氛下在手套箱内,将pmemtc(0.16g,0.734mmol)溶解于dcm(480mg)中,加入少量氢化钙作为干燥剂,搅拌1h。然后,从注射器过滤器中通过进行过滤,滴加到装有(+)-金雀花碱((+)-sparteine,sp)(3.44mg,1.49mmol)的小瓶中。将tu(5.8mg,1.49mmol)和d-丙交酯(dla:77.1mg,0.535mmol)溶解于dcm(240mg)中,与最初制备的溶液混合,在室温下搅拌。反应2小时后,利用1h-nmr确认单体的消耗,加入数滴作为终止剂的苯甲酸,搅拌数小时。然后,将反应溶液在2-丙醇(30ml)中再沉淀,在真空下使其干燥,得到白色固体pdla-pmemtc-pdla(pdmed)(0.132g,收率为55%)。gpc:mn 18000,mw/mn 1.10;1h-nmr(400mhz,cdcl3):δ5.26-5.12(q,2h),4.30(m,6h),3.58(t,j=4.8hz,2h),3.36(s,3h),1.70-1.50(d,6h),1.27(s,3h)
[0202]“合成例2:聚乳酸(pdla)的合成”[0203]
将tu(5.8mg,1.49mmol)和d-丙交酯(77.1mg,0.535mmol)溶解于dcm(240mg)中,在室温下搅拌。反应2小时后,将反应溶液在2-丙醇(30ml)中再沉淀,在真空下使其干燥,得到白色固体pdla。
[0204]“合成例3:ptmc(聚三亚甲基碳酸酯)的合成”[0205]
将苄醇(4.32mg,0.04mmol)、三亚甲基碳酸酯(2.01g,20mmol)、dbu(182.4mg,1.4mmol)和tu(447.1mg,1.4mmol)溶解于dcm(20ml)中,搅拌。24小时后,加入苯甲酸停止反应,将反应溶液在2-丙醇中再沉淀后,将上清液离心分离。将得到的粘性体溶解于dcm中并回收,用蒸发器浓缩后,使其干燥,得到ptmc。
[0206]“合成例4:pmea(聚(2-甲氧基乙基)丙烯酸酯)的合成”[0207]
将15g的丙烯酸2-甲氧基乙酯(130.14g/mol,115mmmol)溶解于60g的1,4-二噁烷,进行30分钟氮气鼓泡。然后,将作为引发剂的15mg的aibn(0.091mmol)溶解于少量的1,4-二噁烷中,一边进行氮气鼓泡一边在75℃下进行6小时聚合。然后,通过将聚合溶剂滴加到正己烷1000ml中,将通过聚合生成的聚合物作为沉淀物回收。将得到的副产物在thf/正己烷体系中重复进行3次沉淀操作,进行精制。将精制后的聚合物溶解于thf中并回收,用蒸发器浓缩后,在60℃下真空干燥30小时,得到pmea。
[0208]“细胞培养的评价方法”[0209]
作为聚合物,使用合成例1中得到的pdmed、合成例1的中间体即pmemtc、合成例2中得到的pdla、合成例3中得到的ptmc、合成例4中得到的pmea、pmb(日油株式会社制“lipidure(注册商标)-cm5206”),进行以下的评价。
[0210]
(1)细胞支架材料的制备
[0211]
将以直径15mm冲裁成圆形的厚度125μm的pet膜(三菱化学株式会社制“diafoil、t100e125 e07”)在甲醇中浸渍一夜,进行脱脂处理。然后,将各聚合物溶解于dcm或甲醇中,调整为0.2质量%的浓度。将该溶液利用2度旋涂机将100μl涂敷于上述已处理的pet膜上,在室温下静置一天后,浸渍于纯水中一夜进行洗涤。将其干燥后,在洁净工作台内,用光斑uv照射装置(ushio电机株式会社制“sp-11”)以4w/cm2的输出照射聚合物涂敷pet膜(以下称为支撑体)10分钟进行灭菌。另外,作为对照,准备进行脱脂处理后不涂敷聚合物的未处理的支撑体(pet支撑体)。
[0212]
(2)模型蛋白吸附实验
[0213]
将以直径15mm冲裁成圆形的厚度125μm的pet膜(三菱化学株式会社制“diafoil、t100e125 e07”)在甲醇中浸渍一夜,进行脱脂处理。在基板的背面将0.1质量%的bsa(牛血清白蛋白)溶解于含有1质量%tritonx-100的磷酸缓冲液(pbs ph为7.4)中,用2度旋涂机涂敷100μl,在室温下静置一天后,将其浸渍于纯水中一夜进行洗涤,将其干燥,由此防止对pet的非特异性吸附。然后,将各聚合物溶解于dcm或甲醇中,调整为0.2质量%的浓度。将该溶液利用2度旋涂机将100μl涂敷于上述已处理的pet膜的表面上,在室温下静置一天后,浸渍于纯水中一夜进行洗涤。
[0214]
将得到的支撑体沉入细胞培养用的24孔平板(corning公司制“coster24wells”)中,以0.1w/v%将荧光标记bsa(fitc标记)溶解于pbs中,添加500μl/孔,在37℃下摇动(倾斜角:6
°
,30r/min)60min。作为对照,使用未涂敷聚合物的未处理的支撑体(pet支撑体),同样地进行处理。
[0215]
摇动后,用pbs洗涤,用荧光显微镜(株式会社keyence制“bz-x”)观察吸附的状态,根据荧光强度评价吸附量。将其结果示于图1。图1是以pet支撑体的荧光强度为基准,相对地表示使用涂敷有各聚合物的支撑体时的荧光标记bsa的荧光强度的图表。
[0216]
(3)细胞培养实验
[0217]
(3-1)人正常成纤维细胞
[0218]
将在上述(1)细胞支架材料的制备中制备的pdmed支撑体、pmb支撑体、pet支撑体放置于24孔组织培养用平板的各孔的底面。另外,准备不设置支撑体的孔。在各孔中,以5
×
103cells/cm2的播种密度播种人皮肤正常成纤维细胞(nhdf)。在各孔中添加向eagle mem培养基中添加10%胎牛血清(fbs)而制备的培养基。
[0219]
将该平板在37℃、5%co2气氛下培养。从细胞培养开始1小时后、1天后、2天后、3天后、7天后分别观察细胞的状况,同时取出1000μl培养上清液,以7000rpm离心分离1分钟,取出500μl上清液,供试于fgf-2(成纤维细胞生长因子2)的定量评价。
[0220]
(i)细胞增殖的评价方法
[0221]
使用荧光差显微镜(奥林巴斯株式会社制“mxv10”),观察细胞增殖的状态,并且计测细胞数。图2是利用荧光显微镜观察的照片,是从细胞开始起的(a)1小时后、(b)1天后、(c)2天后、(d)3天后、(e)7天后的照片。图3中示出细胞数相对于细胞培养时间的图表。
[0222]
(ii)细胞分化抑制的评价方法
[0223]
用人fgf-2测定elisa试剂盒(r&d system公司制)测定在各细胞培养时间采集的培养上清液。图4中示出fgf-2的浓度相对于细胞培养时间的图表。
[0224]
从各培养时间的细胞观察可知,使用了pdmed的平板(以下称为pdmed孔)的细胞增殖数少于使用了作为空白的pet的平板(以下称为pet孔),但维持大致良好的增殖。另一方面,可知使用了pmb的平板(以下称为pmb孔)的细胞不粘附而几乎无助于细胞的增殖。观察细胞的形状时,在pet孔中大幅伸展并增殖,另外,当细胞密度上升时,则确认到属于成纤维细胞的特征的块状的增殖。即使在pdmed孔中细胞的伸展少、细胞密度上升,也确认到细胞在粘附于支撑体的同时不会成为块状而进行增殖。
[0225]
由fgf-2的定量结果可知,在细胞不粘附于支撑体的pmb孔中,培养初期大量释放fgf-2。pet孔因增殖的状况不同,因子的释放有较大差异,特别是在第7天成为块状,因此没有因子的释放。另一方面可知,pdmed孔在培养中进行了稳定的因子的释放。
[0226]
由细胞增殖的观察启示了,pdmed不进行属于作为人成纤维细胞的功能的块状增殖而仅优先发生增殖。这从fgf-2的稳定的释放也可清楚。
[0227]
(3-2)ips细胞
[0228]
通过与上述(1)细胞支架材料的制备同样的方法,使支撑体的直径为50mm,准备pdmed支撑体、pmb支撑体、作为对照的未处理的pet支撑体、作为对照的层粘连蛋白(株式会社nippi制“imatrix511”)支撑体。将各支撑体设置于60mm培养皿(iwaki公司制“3010-060”)的底面。在各培养皿(分别称为“pdmed培养皿”、“pmb培养皿”、“pet培养皿”、“imatrix培养皿”)中,以2.5
×
104cells/培养皿的量接种京都大学来源的无饲养层ips细胞。
[0229]
向各培养皿中添加培养基(ajinomoto healthy supply株式会社制“stemfitak02”),在37℃、5%co2气氛下进行培养。将细胞培养7天后,使用倒立型显微镜(奥林巴斯株式会社制“ckx31sf”)观察细胞的状况,并且通过facs(流式细胞仪)对未分化细胞进行分离定量。另外,与上述(3-1)同样地,获得从培养第1天起7天的培养上清液,供于il-6(白细胞介素-6)和tnfα(肿瘤坏死因子α)的定量评价。各评价用elisa试剂盒(r&d system公司制)进行。
[0230]
表1中示出培养第7天的未分化细胞率和培养第5天的il-6和tnfα的浓度。
[0231]
未分化细胞率(%)越接近100(%),则意味着细胞的分化越受到抑制。另外,il-6的浓度越接近0,则意味着细胞的分化越受到抑制。此外,tnfα的浓度越接近0,则意味着细胞的分化越受到抑制。
[0232]
表1
[0233]
项目petpmbpdmedimatrix未分化细胞率(%)97.198.899.890.2il-6(pg/ml)0.060.33检出限以下9.58tnfα(pg/ml)检出限以下检出限以下检出限以下1.20
[0234]
il-6作为与分化诱导相关的细胞因子而已知。根据该实验结果,在作为对照的imatrix培养皿中,存活细胞的未分化细胞率比其他低,培养第5天的il-6和tnfα的释放也与其他相比极高。由此可知,在imatrix培养皿中,细胞的分化未被充分抑制。
[0235]
另外,在pmb培养皿及pet培养皿中,培养第7天的未分化细胞率低于pdmed培养皿,另外,也确认到培养第5天的il-6的释放。需要说明的是,关于pmb培养皿,在培养第2天确认到约2pg/ml的tnfα的释放(未示出数据)。由此可知,即使在pmb培养皿及pet培养皿中,细胞的分化也未被充分抑制。
[0236]
与此相对,在pdmed培养皿中,培养第7天的未分化细胞率高,并且在从培养第1天至第5天之间未见各细胞因子的释放。由此可知,在使用pdmed作为细胞支架材料的情况下,能够抑制细胞的分化并有助于增殖。
[0237]
本技术的公开与2019年6月27日申请的日本特愿2019-120033号所记载的主题相关联,这些所有的公开内容通过引用而援引于此。除了已经叙述的内容以外,应注意,只要不脱离本公开的新颖且有利的特征,也可以对上述实施方式进行各种修正或变更。因此,这样的全部的修正、变更包含在所附的权利要求书的范围内。
