1.本发明涉及液晶显示材料领域,具体涉及具有负介电各向异性的液晶化合物、液晶组合物及液晶显示器件。
背景技术:
2.目前,液晶化合物的应用范围拓展的越来越广,其可应用于多种类型的显示器、电光器件、传感器等中。用于上述显示领域的液晶化合物的种类繁多,其中向列相液晶应用最为广泛。向列相液晶已经应用在无源tn、stn矩阵显示器和具有tft有源矩阵的系统中。
3.对于薄膜晶体管技术(tft-lcd)应用领域,近年来市场虽然已经非常巨大,技术也逐渐成熟,但人们对显示技术的要求也在不断的提高,尤其是在实现快速响应,降低驱动电压以降低功耗等方面。液晶材料作为液晶显示器重要的光电子材料之一,对改善液晶显示器的性能发挥重要的作用。
4.随着tft-lcd的不断发展,宽视角模式已成为行业内追求的目标,目前主流的宽视角技术主要采用va垂直取向、ips面内开关及ffs边缘场开关等显示类型。这些显示模式,广泛采用具有负介电各向异性的液晶介质。对于用于这些模式的液晶介质,对其响应时间的要求越来越高。而液晶介质的响应时间受到粘度、清亮点t
ni
(℃)、弹性系数、折光率等多个因素的影响,如何获得这些因素综合作用下的响应时间提高的液晶化合物是本领域亟待解决的问题之一。
技术实现要素:
5.本发明针对上述现有技术存在的问题,进行了深入的研究后发现,采用本发明的式i所示的以二苯并噻吩或二苯并呋喃为核心结构,并且通过连接基团在二苯并噻吩或二苯并呋喃的两侧键合有数量相等的环己基、芳香环、杂芳基等环状基团的液晶化合物,能够获得在维持一定水平的负型介电常数的基础上具有提高的响应时间的新型液晶化合物,由此完成了本发明。
6.对于液晶介质,根据显示模式的不同,液晶介质的响应时间与g1/k
11
或者g1/k
33
相关。进一步,本发明人等研究发现,除了g1、k
11
、k
33
等因素之外,液晶介质的响应时间还与清亮点t
ni
(℃)、折光率δn相关,具体地,在va(vertical alignment,垂直取向)或者ps-va(polymer stabilized vertical alignment,聚合物稳定垂直取向)模式下,液晶介质的响应时间与g1/(k
33
*
△
n*
△
n*t
ni
)的值相关,而在ffs(fringe field switching,边缘场开关)、ips(in-plane switching,平面转换)、ps-ffs(polymer stabilized fringe field switching,聚合物稳定边缘场开关)、ps-ips(polymer stabilized in-plane switching,聚合物稳定平面转换)等模式下,液晶介质的响应时间与g1/(k
11
*
△
n*
△
n*t
ni
)的值相关。在本技术中,将g1/(k
33
*
△
n*
△
n*t
ni
)、g1/(k
11
*
△
n*
△
n*t
ni
)的值称为响应指标值。前述响应指标值越小,表明液晶介质的响应时间越快。本发明的具有负介电各向异性的液晶化合
物在维持一定水平的负型介电常数的基础上具有小的响应指标值从而具有提高的响应时间。
7.本发明包括下述的技术方案:
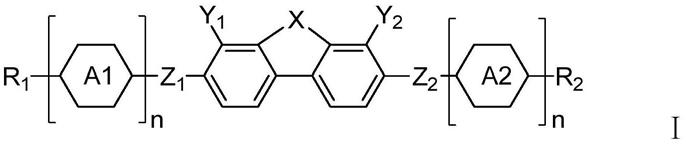
8.一方面,本发明提供一种具有负介电各向异性的液晶化合物,所述化合物具有下述的式ⅰ所示的结构:
[0009][0010]
式i中,r1、r2各自独立地表示氢原子、c1~c8的直链烷基、c1~c8的直链烷氧基、c2~c8的直链烯基、c2~c8的直链烯氧基,其中一个或两个不相邻的-ch
2-任选被-o-取代,任意h任选被f原子取代;
[0011]
各自独立地选自下述的基团组成的组:
[0012][0012][0013]
z1、z2各自独立地表示-c2h
2-、-c2h
4-、-c2h2ch2o-、-och2c2h
2-、-ch2o-、-och
2-、-c2h2ch2s-、-sch2c2h
2-、-ch2s-、-sch
2-、-o-、-s-、-cf2o-、-ocf
2-、-c≡c-、-ooc-、或者-coo-、当z1、z2表示-ch2o-、-c2h
2-、-c2h
4-、-c2h2ch2o-、或者-och2c2h
2-时,任意h任选被f取代;
[0014]
y1、y2表示-f-、-och2f-、-ochf
2-、-ocf
3-或者不同时表示-f-;
[0015]
n表示0、1、2或者3。
[0016]
本发明另一方面提供一种液晶组合物,其含有前述的本发明的具有负介电各向异性的液晶化合物。
[0017]
本发明的又一方面提供一种液晶显示器件,其含有前述的本发明的具有负介电各向异性的液晶化合物或者前述的本发明的液晶组合物。
[0018]
发明效果
[0019]
与现有技术相比,本发明的具有负介电各向异性的液晶化合物在维持一定水平的负型介电常数的基础上具有小的响应指标值从而具有更快的响应时间。通过在本发明的液晶组合物中使用本发明的具有负介电各向异性的液晶化合物,在本发明的液晶显示器件中含有使用了本发明的液晶化合物的液晶组合物,能够使得显示装置的响应时间更快。
附图说明
[0020]
图1为本发明的实施例1中制备的化合物b(s)[f,ot]-2o-o5溶于cdcl3的1h核磁共振光谱图。
[0021]
图2为本发明的实施例1中制备的化合物b(s)[f,ot]-2o-o5的溶于cdcl3的
13
c核磁共振光谱图。
具体实施方式
[0022]
以下将结合具体实施方案来说明本发明。需要说明的是,下面的实施例为本发明的示例,仅用来说明本发明,而不用来限制本发明。在不偏离本发明主旨或范围的情况下,可进行本发明构思内的其他组合和各种改良。
[0023]
[具有负介电各向异性的液晶化合物]
[0024]
本发明的具有负介电各向异性的液晶化合物具有下述的式ⅰ所示的结构:
[0025][0026]
式i中,r1、r2各自独立地表示氢原子、c1~c8的直链烷基、c1~c8的直链烷氧基、c2~c8的直链烯基、或者c2~c8的直链烯氧基,其中一个或两个不相邻的-ch
2-任选被-o-取代,任意h任选被f原子取代;
[0027]
各自独立地选自下述的基团组成的组:
[0028][0029]
z1、z2各自独立地表示-c2h
2-、-c2h
4-、-c2h2ch2o-、-och2c2h
2-、-ch2o-、-och
2-、-c2h2ch2s-、-sch2c2h
2-、-ch2s-、-sch
2-、-o-、-s-、-cf2o-、-ocf
2-、-c≡c-、-ooc-或者-coo-,当z1、z2表示-ch2o-、-c2h
2-、-c2h
4-、-c2h2ch2o-、或者-och2c2h
2-时,其中任意h任选被f取代;
[0030]
y1、y2表示-f-、-och2f-、-ochf
2-、-ocf
3-或者不同时表示-f-;
[0031]
n表示0、1、2或3。
[0032]
作为前述的“c1~c8的直链烷基”,可以列举出例如,甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基等。
[0033]
作为前述的“c1~c8的直链烷氧基”,可以列举出例如,甲氧基、乙氧基、正丙氧基、正丁氧基、正戊氧基、正己氧基、正庚氧基、正辛氧基等。
[0034]
作为前述的“c2~c8的直链烯基”,可以列举出例如,乙烯基、1-丙烯基、2-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、1-己烯基、2-己烯基、3-己烯基、1-庚烯基、2-庚烯基、3-庚烯基、1-辛烯基、2-辛烯基、3-辛烯基。
[0035]
作为前述的“c2~c8的直链烯氧基”,可以列举出例如,乙烯氧基、1-丙烯氧基、2-丙烯氧基、1-丁烯氧基、2-丁烯氧基、3-丁烯氧基、1-戊烯氧基、2-戊烯氧基、1-己烯氧基、2-己烯氧基、3-己烯氧基、1-庚烯氧基、2-庚烯氧基、3-庚烯氧基、1-辛烯氧基、2-辛烯氧基、3-辛烯氧基等。
[0036]
前述的“一个或两个不相邻的-ch
2-任选被-o-取代”是指,前述的c1~c8的直链烷基、c1~c8的直链烷氧基、c2~c8的直链烯基、c2~c8的直链烯氧基中的任意-ch
2-任选被取代为-o-,但是相邻的-ch
2-不会同时被取代。
[0037]
前述的“任意h任选被f原子取代”,是指,对于f取代的个数没有任何的限定,可以为单氟取代、多氟取代、或者全氟取代。
[0038]
优选地,前述r1、r2各自独立地表示氢原子、c1~c5的直链烷基、c1~c5的直链烷氧基、c2~c5的直链烯基、或者、c2~c5的直链烯氧基,其中一个或两个不相邻的-ch
2-任选被-o-取代,任意h任选被f原子取代。
[0039]
前述的“c1~c5的直链烷基”,可以列举出例如,甲基、乙基、正丙基、正丁基、正戊基。优选为甲基、乙基或者正丙基。
[0040]
作为前述的“c1~c5的直链烷氧基”,可以列举出例如,甲氧基、乙氧基、正丙氧基、正丁氧基、正戊氧基。优选为甲氧基、乙氧基或者正丙氧基。
[0041]
作为前述的“c2~c5的直链烯基”,可以列举出例如,乙烯基、1-丙烯基、2-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基。优选为乙烯基、1-丙烯基、3-丁烯基、或者、3-戊烯基。
[0042]
作为前述的“c2~c5的直链烯氧基”,可以列举出例如,乙烯氧基、1-丙烯氧基、2-丙烯氧基、1-丁烯氧基、2-丁烯氧基、3-丁烯氧基、1-戊烯氧基、2-戊烯氧基、3-戊烯氧基。优选为乙烯氧基、1-丙烯氧基、3-丁烯氧基、或者、3-戊烯氧基。
[0043]
前述的c1~c5的直链烷基、c1~c5的直链烷氧基、c2~c5的直链烯基、或者、c2~c5的直链烯氧基中,一个或两个不相邻的-ch
2-任选被-o-取代,任意h任选被f原子取代。
[0044]
式i中,n表示0、1、2、或者3,从获得更小的响应指标值从而具有更快的响应时间等方面考虑,n优选为0、1或者2,进一步优选为n=0或者2。
[0045]
本发明的具有负介电各向异性的液晶化合物中,优选地,其选自下述的式ia~izk、ia-izk所示化合物组成。
[0046]
[0047]
[0048]
[0049]
[0050]
[0051]
[0052]
[0053]
[0054]
[0055][0056]
其中,r1、r2的定义与前述相同。
[0057]
进一步,本发明的具有负介电各向异性的液晶化合物优选为选自下述的式ia-1~izk-4、ia-1~izk-4所示的化合物组成的组,其中,alkyl各自独立地表示c1~c8的直链烷基、alkenyl各自独立地表示c2~c8的直链烯基,
[0058]
[0059]
[0060]
[0061]
[0062]
[0063]
[0064]
[0065]
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072]
[0073]
[0074]
[0075]
[0076]
[0077]
[0078]
[0079]
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091]
[0092]
[0093]
[0094][0095]
[液晶化合物的制备方法]
[0096]
下面,对本发明的具有负介电各向异性的液晶化合物的制备方法进行说明。
[0097]
需要理解的是,本发明的具有负介电各向异性的液晶化合物的制备方法,并非限于下述说明的制备方法。本领域技术人员可以采用其他的适宜的方法进行制备。
[0098]
另外,下述的说明中对于式i所述的部分化合物进行说明,对于其他的化合物,本领域技术人员可以参照下述的说明并结合本领域的常规技术手段来获得。
[0099]
采用包括如下制备步骤的方法制备前述式ⅰa所示的液晶化合物,其中,r1、r2的定义与前述相同。
[0100][0101]
步骤ia1:溴苯酚与r1取代苯硼酸进行铃木反应,生成联苯化合物(a);
[0102][0103]
步骤ia2:将前述的联苯化合物(a)于强碱下反应,生成单边r1氧基取代的三氟甲氧基化氟化氧芴(b);
[0104][0105]
步骤ia3:将前述步骤ia2获得的单边r1氧基取代的三氟甲氧基化氟化氧芴(b)与
锂试基反应,后续与硼酸酯反应、水解、氧化生成酚基,获得带有酚基的单边r1氧基取代的三氟甲氧基化氟化氧芴(c);
[0106][0107]
步骤ia4:将酚基的单边r1氧基取代的三氟甲氧基化氟化氧芴(c)与带有r2溴(或碘)化合物于碱性条件反应生成两边对称或不对称的氧基三氟甲氧基化氟化氧芴(ia);
[0108][0109]
采用包括如下制备步骤的方法制备前述式ⅰa所示的液晶化合物,其中,r1、r2的定义与前述相同。
[0110][0111]
步骤ia1:三氟甲氧基苯硼酸与带有r1氧基取代溴苯进行铃木反应,得到联苯化合物(a);
[0112][0113]
步骤ia2:将前述的联苯化合物(a)、三级胺与三氟甲磺酸酐反应,把酚基转换成三氟甲磺酸基生成联苯化合物(b);
[0114][0115]
步骤ia3:将前述步骤ia2获得的联苯化合物(b)与硫醇反应,在钯金属催化下进行耦合反应,得到具有硫醚的联苯化合物(c-2);
[0116][0117]
步骤ia4:将前述步骤ia3获得的具有硫醚的联苯化合物(c-2)在强碱下反应,获得单边对位r1氧基取代的三氟甲氧基化氟化硫芴(d);
[0118][0119]
步骤ia5:将单边对位r1氧基取代的三氟甲氧基化氟化硫芴(d)与锂试剂反应,后续与硼酸酯反应、水解、氧化合成出酚基,获得带有酚基的单边r1氧基取代的三氟甲氧基化氟化硫芴(e);
[0120][0121]
步骤ia6:将带有酚基的单边r1氧基取代的三氟甲氧基化氟化硫芴(e)与带有r2溴(或碘)化合物于碱性条件反应生成两边对称或不对称的甲氧基三氟甲氧基化氟化硫芴(ia)。
[0122][0123]
以上,示出了前述的式ia、式ia所示化合物的制备方法。对于其他化合物的制备,本领域技术人员能够参照前述制备方法,根据本领域的技术常识,改变前述制备方法中的反应原料进行制备,没有特别的限定。
[0124]
[液晶组合物]
[0125]
本发明液晶组合物中含有本发明的具有负介电各向异性的液晶化合物。
[0126]
本发明的液晶组合物中,可以含有一种或者多种本发明的负介电各向异性的液晶化合物,每一种本发明的负介电各向异性的液晶化合物的含量按照重量百分含量计算可以为例如20%以下。从低温溶解性、可靠性等方面考虑,优选为15%以下的范围。含有多种本发明的负介电各向异性的液晶化合物时,本发明的负介电各向异性的液晶化合物的含量的
thf与4ml水溶解后,加入含有0.48g(2-氟-3-(三氟甲氧基)苯基)硼酸(2.13mmole)、0.036g双(二亚苄基丙酮)钯(0)(0.06mmole)与32.0mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.09mmole)的8ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以乙酸乙酯-水进行萃取、收集有机层,随后将有机层以无水硫酸镁除水、减压浓缩。将浓缩物进行管柱层析,得到0.49g透明液体状的化合物a1。
[0140]1h-nmr(500mhz,cd2cl2,ppm):9.58(s,1h)、7.43(d,1h)、7.37(d,1h)、7.21(t,1h)、7.04(d,1h)、6.87(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0141]
取0.5g化合物a1(1.50mmole)于氮气下以8ml thf溶解后,将反应瓶放入冰浴中冷却,之后加入0.12g dmap(1.65mmole)与0.42g三氟甲磺酸酐(1.50mmole)。在冰浴下反应30分钟后,接着在室温下反应至隔日。反应完毕后,将反应液进行减压浓缩,得到的浓缩液进行管柱层析,得到0.42g微黄色液体状化合物b1。
[0142]1h-nmr(500mhz,cd2cl2,ppm):7.61(d,1h)、7.43(d,1h)、7.3(d,1h)、7.21(t,1h)、7.04(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0143]
取0.6g化合物b1(1.28mmole)、0.17g 3-巯基丙酸乙酯(1.28mmole)、0.18g碳酸钾(1.28mmole)、64mg双[(2-二苯基膦基)苯基]醚(0.12mmole)与35mg双(二亚苄基丙酮)钯(0)(0.06mmole)于反应瓶内,并且将气体置换成氮气,之后加入甲苯进行回流反应至隔天。反应完毕后降温,将反应液以硅胶短管柱过滤、减压浓缩,得到化合物c1。
[0144]1h-nmr(500mhz,cdcl3,ppm):7.44(m,2h)、7.21(t,1h)、7.07(m,2h)、4.05(m,4h)、3.17(t,2h)、2.61(t,2h)、1.34(t,3h)、1.07(t,3h)。
[0145]
将化合物c1的浓缩液加入含有0.158g叔丁醇钾(1.4mmole)的12ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到白色固体状化合物d1。
[0146]1h-nmr(500mhz,cdcl3,ppm):8.13(d,1h)、7.82(d,1h)、7.41(t,1h)、7.11(d,2h)、4.07(q,2h)、1.34(t,3h)。
[0147]
取0.6g化合物d1(1.81mmole)与0.2g t-buok(1.81mmole)溶解在12ml thf中,将反应瓶降温至-78℃后加入1.26ml的含有1.5m己烷的正丁基锂(1.9mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.197g硼酸三甲酯(1.9mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.53g白色固体状化合物e1。
[0148]1h-nmr(500mhz,cdcl3,ppm):9.48(s,1h)、7.82(d,1h)、7.56(d,1h)、7.11(d,1h)、6.98(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0149]
取0.6g化合物e1(1.73mmole)、0.29g 1-溴戊烷(1.9mmole)与0.26g碳酸钾(1.9mmole)溶解在15ml thf中,接着加热至回流反应到隔天。反应完成后,用乙酸乙酯与水进行萃取、收集有机层减压浓缩、进行管柱层析,得到0.63g白色固体状化合物f。
[0150]
制备得到的化合物f的质谱、核磁共振谱数据如下。根据测试结果,化合物f为b(s)[f,ot]-2o-o5所示结构。将得到的b(s)[f,ot]-2o-o5的1h核磁共振光谱图、
13
c核磁共振光谱图分别示于附图1附图2中。
[0151]
ms(ei,m/z):304,387,416。
[0152]1h-nmr(500mhz,cdcl3,ppm):7.82(d,1h)、7.73(d,1h)、7.13(d,2h)、4.06(m,4h)、1.77(m,2h)、1.39(m,4h)、1.34(t,3h)、0.90(t,3h)。
[0153]
13
c-nmr(500mhz,cdcl3,ppm):146.0、145.5、141.8、129.6、126.5、126.1、123.0、122.4、119.4、116.1、69.0、64.6、29.3、28.1、22.7、14.8、14.1。
[0154]
实施例2
[0155]
b[f,ot]-2o-o5
[0156][0157]
合成路线:
[0158][0159]
取0.5g 6-溴代-3-乙氧基-2-氟苯酚(2.13mmole)与0.44g碳酸钾于氮气下以6ml thf与4ml水溶解后,加入含有0.48g(2-氟-3-(三氟甲氧基)苯基)硼酸(2.13mmole)、0.036g双(二亚苄基丙酮)钯(0)(0.06mmole)与32mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.09mmole)的8ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以乙酸乙酯(ea)-水进行萃取、收集有机层,随后将有机层以无水mgso4除水、减压浓缩。将浓缩物进行管柱层析,得到0.49g透明液体状化合物a2。1h-nmr(500mhz,cd2cl2):9.58(s,1h)、7.43(d,1h)、7.37(d,1h)、7.21(t,1h)、7.04(d,1h)、6.87(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0160]
将0.49g化合物a2(1.47mmole)加入含有0.18g叔丁醇钾(1.61mmole)的15ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到白色固体状化合物b2。
[0161]1h-nmr(500mhz,cdcl3,ppm):7.15(d,1h)、7.05(d,1h)、6.70(t,1h)、6.62(d,2h)、3.98(q,2h)、1.33(t,3h)。
[0162]
取0.6g化合物b2(1.91mmole)溶解在13ml thf中,将反应瓶降温至-78℃后加入
1.34ml的含1.5m正丁基锂的己烷(2.01mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.209g硼酸三甲酯(2.01mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.53g白色固体状化合物c2。1h-nmr(500mhz,cdcl3,ppm):9.48(s,1h)、7.61(d,1h)、7.35(d,1h)、6.96(d,1h)、6.83(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0163]
取0.6g化合物c2(1.82mmole)、0.30g 1-溴戊烷(2.0mmole)与0.27g碳酸钾(2.0mmole)溶解在15ml thf中,接着加热至回流反应到隔天。反应完成后,用乙酸乙酯与水进行萃取、收集有机层减压浓缩、进行管柱层析,得到0.63g白色固体状化合物d2。
[0164]
制备得到的化合物d2进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物d2为b[f,ot]-2o-o5所示结构。
[0165]
ms(ei,m/z):300,372,401。
[0166]1h-nmr(500mhz,cdcl3,ppm):7.61(d,1h)、7.52(d,1h)、6.96(d,2h)、4.06(m,4h)、1.77(m,2h)、1.39(m,4h)、1.34(t,3h)、0.90(t,3h)。
[0167]
13
c-nmr(500mhz,cdcl3,ppm):146.7、145.1、145.0、141.9、131.1、130.3、128.8、120.0、117.1、113.8、113.0、112.4、106.4、69.0、64.6、29.3、28.1、22.7、14.8、14.1。
[0168]
实施例3
[0169]
b(s)[ot,ot]-2o-o5
[0170][0171]
合成路线:
[0172][0173]
取0.6g化合物1-乙氧基-2-氟-3-(三氟甲氧基)苯(2.68mmole)溶解在18ml thf中,将反应瓶降温至-78℃后加入1.9ml的1.5m正丁基锂的己烷(2.81mmole),之后回温至0
℃反应30分钟。接着在-78℃下加入0.292g硼酸三甲酯(2.81mmole)后,将反应温度回到室温反应1hr。接着在0℃下加入3.2ml的1.0m hcl,室温下搅拌半小时。反应液用乙酸乙酯与水进行萃取,收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.65g产物a3。
[0174]1h-nmr(500mhz,cdcl3,ppm):7.41(m,1h)、6.73(d,1h)、4.2(s,2h)、4.13(m,2h)、1.42(m,3h)。
[0175]
取0.5g2-溴-6-(三氟甲氧基)苯酚(1.95mmole)与0.4g碳酸钾(2.92mmol)于氮气下以5ml thf与4ml水溶解后,加入含有0.52g a3(2.13mmole)、0.034g双(二亚苄基丙酮)钯(0)(0.058mmole)与58mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.162mmole)的7ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以ea-水进行萃取、收集有机层,随后将有机层以无水硫酸镁除水、减压浓缩。将浓缩物进行管柱层析,得到0.55g产物b3。
[0176]1h-nmr(500mhz,cd2cl2,ppm):10.44(s,1h)、7.50(m,2h)、7.00(m,3h)、4.13(q,2h)、1.42(t,3h)。
[0177]
取0.5g化合物b3(1.25mmole)于氮气下以6ml dcm溶解后,将反应瓶放入冰浴中冷却,之后加入0.17g dmap(1.38mmole)与0.35g三氟甲磺酸酐(1.25mmole)。在冰浴下反应30分钟后,接着在室温下反应至隔日。反应完毕后,将反应液进行减压浓缩,得到的浓缩液进行管柱层析,得到0.4g产物c3。
[0178]1h-nmr(500mhz,cd2cl2,ppm):7.74(d,1h)、7.43(m,2h)、7.11(d,1h)、6.77(d,1h)、4.13(q,2h)、1.42(t,3h)。
[0179]
取0.6g化合物c3(1.13mmole)、0.15g ethyl 3-mercaptopropionate(1.13mmole)、0.16g碳酸钾(1.138mmole)、57mg双[(2-二苯基膦基)苯基]醚(0.106mmole)与32mg双(二亚苄基丙酮)钯(0)(0.056mmole)于反应瓶内,并且将气体置换成氮气,之后加入甲苯进行回流反应至隔天,生成化合物d3。反应完毕后降温,将反应液以硅胶短管柱过滤、减压浓缩,后续直接进行下一步反应。1h-nmr(500mhz,cdcl3,ppm):7.35(m,3h)、7.20(dd,1h)、6.77(d,1h)、4.13(m,4h)、3.17(t,2h)、2.61(t,2h)、1.42(t,3h)、1.07(t,3h)。
[0180]
将0.5g化合物d3(0.97mmole)加入含有0.12g叔丁醇钾(1.07mmole)的10ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到白色固体状化合物e3。
[0181]1h-nmr(500mhz,cdcl3,ppm):7.66(d,1h)、7.52(d,1h)、7.32(dd,1h)、7.04(d,1h)、6.89(d,1h)、4.14(q,2h)、1.42(t,3h)。
[0182]
取0.6g化合物e3(1.56mmole)溶解在11ml thf中,将反应瓶降温至-78℃后加入1.1ml的1.5m正丁基锂的己烷(1.58mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.16g硼酸三甲酯(1.58mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.4g产物f3。
[0183]1h-nmr(500mhz,cdcl3,ppm):9.48(s,1h)、7.61(d,1h)、7.35(d,1h)、6.96(d,1h)、6.83(d,1h)、4.07(q,2h)、1.34(t,3h)。
[0184]
取0.6g化合物f3(1.46mmole)、0.24g 1-溴己烷(1.46mmole)及0.22g碳酸钾(1.61mmole)溶解在15ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层
减压浓缩,将得到的浓缩液进行管柱层析,得到0.49g产物g3。
[0185]
制备得到的化合物g3进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物g3为b(s)[ot,ot]-2o-o5所示结构。
[0186]
ms(ei.m/z):382,411,482。
[0187]1h-nmr(500mhz,cdcl3,ppm):7.73(d,2h)、7.13(d,2h)、4.13(m,4h)、1.82(m,2h)、1.39(m,7h)、1.03(t,3h)。
[0188]
13
c-nmr(500mhz,cdcl3):146.0、145.5、141.8、137.1、129.6、126.8、126.5、122.4、116.1、69.0、64.9、29.3、28.1、22.7、14.8、13.8。
[0189]
实施例4
[0190]
b[ot,ot]-2o-o5
[0191][0192]
合成路线:
[0193][0194]
取0.6g化合物1-乙氧基-2-氟-3-(三氟甲氧基)苯(2.68mmole)溶解在18ml thf中,将反应瓶降温至-78℃后加入1.9ml的含1.5m正丁基锂的己烷(2.81mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.292g硼酸三甲酯(2.81mmole)后,将反应温度回到室温反应1hr。接着在0℃下加入3.2ml的1.0m hcl,室温下搅拌半小时。反应液用乙酸乙酯与水进行萃取,收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.65g产物a4。
[0195]1h-nmr(500mhz,cdcl3,ppm):7.41(m,1h)、6.73(d,1h)、4.2(s,2h)、4.13(m,2h)、1.42(m,3h)。
[0196]
取0.5g 2-溴-6-(三氟甲氧基)苯酚(1.95mmole)与0.4g碳酸钾(2.92mmol)于氮气下以5ml thf与4ml水溶解后,加入含有0.52g(2-氟-3-(三氟甲氧基)苯基)硼酸(2.13mmole)、0.034g双(二亚苄基丙酮)钯(0)(0.058mmole)与58mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.162mmole)的7ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以ea-水进行萃取、收集有机层,随后将有机层以无水mgso4除水、减压浓缩。将浓缩物进行管柱层析,得到0.55g产物b4。1h-nmr(500mhz,cd2cl2,ppm):10.44(s,1h)、7.50(m,2h)、7.00(m,3h)、4.13(q,2h)、1.42(t,3h)。
[0197]
将0.5g化合物b4(1.25mmole)加入含有0.15g叔丁醇钾(1.37mmole)的13ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到产物c4。1h-nmr(500mhz,cdcl3):7.66
(d,1h)、7.52(d,1h)、7.32(t,1h)、6.89(d,1h)、4.13(q,2h)、1.42(t,3h)。
[0198]
取0.6g化合物c(1.58mmole)溶解在11ml thf中,将反应瓶降温至-78℃后加入1.1ml的含1.5m正丁基锂的己烷(1.66mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.17g硼酸三甲酯(1.66mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.44g产物d4。
[0199]1h-nmr(500mhz,cdcl3,ppm):9.48(s,1h)、7.52(d,1h)、7.35(d,1h)、6.89(m,2h)、4.13(q,2h)、1.42(t,3h)。
[0200]
取0.6g化合物d4(1.51mmole)、0.25g 1-溴己烷(1.51mmole)及0.23g碳酸钾(1.66mmole)溶解在15ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.42g产物e4。
[0201]
制备得到的化合物e4进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物e4为b[ot,ot]-2o-o5所示结构。
[0202]
ms(ei,m/z):380,395,466。
[0203]1h-nmr(500mhz,cdcl3,ppm):7.52(m,2h)、6.89(m,2h)、4.13(m,4h)、1.77(m,2h)、1.42(m,7h)、1.1(t,3h)。
[0204]
13
c-nmr(500mhz,cdcl3):150.0、146.7、145.1、130.3、128.8、120.0、113.8、112.4、106.4、69.0、64.9、29.3、28.1、22.7、15.1、14.3。
[0205]
实施例5
[0206]
cob(s)[f,ot]oic-3-3
[0207][0208]
合成路线:
[0209][0210]
取0.5g 2-溴-6-氟苯酚(2.62mmole)与0.54g碳酸钾(3.93mmol)于氮气下以7ml thf与5ml水溶解后,加入含有0.99g(2-氟-4-((4-丙基环己基)甲氧基)-3-(三氟甲氧基)苯
基)硼酸(2.62mmole)、45mg双(二亚苄基丙酮)钯(0)(0.079mmole)与77mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.215mmole)的7ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以ea-水进行萃取、收集有机层,随后将有机层以无水硫酸镁除水、减压浓缩。将浓缩物进行管柱层析,得到0.93g产物a5。
[0211]1h-nmr(500mhz,cd2cl2,ppm):9.58(s,1h)、7.59(d,1h)、7.43(d,1h)、7.08(m,2h)、6.77(d,1h)、3.86(d,2h)、1.94(m,1h)、1.64~1.21(m,13h)、0.98(t,3h)。
[0212]
取0.5g化合物a5(1.12mmole)于氮气下以6ml dcm溶解后,将反应瓶放入冰浴中冷却,之后加入0.15g dmap(1.23mmole)与0.31g三氟甲磺酸酐(1.12mmole)。在冰浴下反应30分钟后,接着在室温下反应至隔日。反应完毕后,将反应液进行减压浓缩,得到的浓缩液进行管柱层析,得到0.58g产物b5。
[0213]1h-nmr(500mhz,cd2cl2,ppm):7.83(d,1h)、7.513(m,3h)、6.77(d,1h)、3.86(d,2h)、1.94(m,1h)、1.63~1.20(m,13h)、0.89(t,3h)。
[0214]
取0.6g化合物b5(1.04mmole)、0.14g 3-巯基丙酸乙酯(1.04mmole)、0.14g碳酸钾(1.04mmole)、53mg双[(2-二苯基膦基)苯基]醚(0.098mmole)与30mg双(二亚苄基丙酮)钯(0)(0.052mmole)于反应瓶内,并且将气体置换成氮气,之后加入甲苯进行回流反应至隔天,生成化合物d5。反应完毕后降温,将反应液以硅胶短管柱过滤、减压浓缩,后续直接进行下一步反应。1h-nmr(500mhz,cdcl3,ppm):7.44(m,2h)、7.28(m,2h)、4.01(q,2h)、3.86(d,2h)、3.17(t,2h)、2.61(t,2h)、1.94(m,1h)、1.62~1.21(m,13h)、1.07(t,3h)、0.92(t,3h)。
[0215]
将0.5g化合物c5(0.89mmole)加入含有0.11g叔丁醇钾(0.98mmole)的9ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到白色固体d5。
[0216]1h-nmr(500mhz,cdcl3,ppm):8.22(d,1h)、7.73(d,1h)、7.49(m,1h)、7.13(m,2h)、3.86(d,2h)、1.94(m,1h)、1.61~1.18(m,13h)、0.89(t,3h)。
[0217]
取0.6g化合物d5(1.36mmole)溶解在9ml thf中,将反应瓶降温至-78℃后加入1.0ml的含1.5m正丁基的己烷(1.43mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.15g硼酸三甲酯(1.43mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.43g产物e5。
[0218]1h-nmr(500mhz,cdcl3,ppm):9.0(s,1h)、7.73(m,2h)、7.13(d,1h)、6.96(d,1h)、3.86(d,2h)、1.94(m,1h)、1.61~1.18(m,13h)、0.86(t,3h)。
[0219]
取0.6g化合物e5(1.31mmole)、0.29g 1-(溴甲基)-4-丙基环己烷(1.31mmole)及0.20g碳酸钾(1.45mmole)溶解在13ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.55g产物f5。
[0220]
制备得到的化合物f5进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物f5为cob(s)[f,ot]oic-3-3所示结构。
[0221]
ms(ei,m/z):316,455,594。
[0222]1h-nmr(500mhz,cdcl3,ppm):7.82(d,1h)、7.73(d,1h)、7.11(d,2h)、3.86(d,4h)、1.94(m,2h)、1.62~1.28(m,26h)、0.89(t,6h)。
[0223]
13
c-nmr(500mhz,cdcl3,ppm):146.0、141.9、141.7、137.1、135.1、129.6、127.5、126.8、123.0、122.4、119.4、116.1、75.2、74.9、38.7、37.1、29.3、27.7、26.5、20.5、14.4。
[0224]
实施例6
[0225]
cvob(s)[f,ot]oic-3-3
[0226][0227]
取0.6g实施例5的化合物e5(1.31mmole)、0.32g 1-(3-溴丙-1-烯-1-基)-4-丙基环己烷(1.31mmole)及0.20g碳酸钾(1.45mmole)溶解在13ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.57g产物。
[0228]
制备得到的化合物进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物为cvo(s)[f,ot]oic-3-3所示结构。
[0229]
ms(ei,m/z):316,475,614。
[0230]1h-nmr(500mhz,cdcl3,ppm):7.76(m,2h)、7.13(d,1h)、7.04(d,1h)、5.77(m,1h)、5.52(m,1h)4.68(d,2h)、4.01(d,2h)、2.48(m,1h)、1.94(m,1h)、1.65~1.24(m,26h)、0.91(t,6h)。
[0231]
13
c-nmr(500mhz,cdcl3,ppm):148.0、144.9、141.8、137.1、135.8、134.2、129.6、129.1、127.9、126.8、122.9、119.8、116.1、75.2、64.3、38.7、37.1、33、29.7、27.7、26.5、21.1、15.5。
[0232]
实施例7
[0233]
pob(s)[f,ot]oic-3-3
[0234][0235]
取0.6g实施例5化合物e5(1.31mmole)、0.28g 1-(溴甲基)-4-丙苯(1.31mmole)及0.20g碳酸钾(1.45mmole)溶解在13ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.54g产物。
[0236]
制备得到的化合物进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物为pob(s)[f,ot]oic-3-3所示结构。
[0237]
ms(ei,m/z):316,449,588。
[0238]1h-nmr(500mhz,cdcl3,ppm):7.86(m,1h)、7.76(d,1h)、7.38(d,2h)、7.13(m,4h)、5.16(s,1h)、3.86(d,2h)、2.61(t,2h)、1.94(m,1h)、1.64-1.29(m,15h)、0.86(m,3h)。
[0239]
13
c-nmr(500mhz,cdcl3,ppm):149.2、146.2、141.9、140.9、134.0、129.6、128.3、172.7、126.9、126.1、123、122.3、119.4、116.5、74.9、71.1、38.7、37.1、29.3、28.3、27.2、24.1、20.5、14.4、13.3。
[0240]
实施例8
[0241]
cq(s)[f,ot]qic-3-3
[0242][0243]
合成路线:
[0244][0245]
取0.6g 1-(二氟(4-丙基环己基)甲氧基)-3-氟-2-(三氟甲氧基)苯(1.62mmole)溶解在11ml thf中,将反应瓶降温至-78℃后加入1.1ml的含1.5m正丁基锂的环己烷(1.7mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.17g硼酸三甲酯(1.7mmole)后,将反应温度回到室温反应1hr。接着在0℃下加入2ml的1.0m hcl,室温下搅拌半小时。反应液用乙酸乙酯与水进行萃取,再用碳酸氢钠水溶液调至碱性、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.61g产物a8。
[0246]1h-nmr(500mhz,cdcl3,ppm):7.41(m,1h)、6.73(d,1h)、4.2(s,2h)、3.34(m,1h)、1.63~1.20(m,14h)、0.89(t,3h)。
[0247]
取0.5g 2-溴-6-氟苯酚(2.62mmole)与0.54g碳酸钾(3.93mmol)于氮气下以7ml thf与5ml水溶解后,加入含有1.09g化合物a8(2.62mmole)、45mg双(二亚苄基丙酮)钯(0)(0.079mmole)与77mg catacxium a(di(1-adamantyl)-n-butylphosphine,二(1-金刚烷基)-正丁基膦,c
24h39
p,0.215mmole)的7ml thf溶液,接着进行回流反应至隔日。隔日待反应温度回到室温后,将反应液以ea-水进行萃取、收集有机层,随后将有机层以无水硫酸镁除水、减压浓缩。将浓缩物进行管柱层析,得到1.00g产物b8。1h-nmr(500mhz,cd2cl2):9.58(s,1h)、7.59(d,1h)、7.43(d,1h)、7.08(m,1h)、6.77(d,1h)、3.34(m,1h)、1.61~1.28(m,13h)、1.02(t,3h)。
[0248]
取0.5g化合物b(1.04mmole)于氮气下以6ml dcm溶解后,将反应瓶放入冰浴中冷却,之后加入0.14g dmap(1.14mmole)与0.29g三氟甲磺酸酐(1.04mmole)。在冰浴下反应30分钟后,接着在室温下反应至隔日。反应完毕后,将反应液进行减压浓缩,得到的浓缩液进行管柱层析,得到0.57g产物c8。
[0249]1h-nmr(500mhz,cd2cl2,ppm):7.83(d,1h)、7.513(m,3h)、6.77(d,1h)、3.34(m,1h)、1.63~1.20(m,13h)、0.89(t,3h)。
[0250]
取0.6g化合物c8(0.98mmole)、0.13g 3-巯基丙酸乙酯(0.98mmole)、0.14g碳酸钾
(0.98mmole)、50mg双[(2-二苯基膦基)苯基]醚(0.092mmole)与28mg双(二亚苄基丙酮)钯(0)(0.049mmole)于反应瓶内,并且将气体置换成氮气,之后加入甲苯进行回流反应至隔天,生成化合物d8。反应完毕后降温,将反应液以硅胶短管柱过滤、减压浓缩,后续直接进行下一步反应。1h-nmr(500mhz,cdcl3,ppm):7.44(m,2h)、7.28(m,2h)、6.77(d,1h)、4.01(q,2h)、3.34(m,1h)、3.17(t,2h)、2.61(t,2h)、1.61~1.28(m,13h)、1.07(t,3h)、0.91(t,3h)。
[0251]
将0.5g化合物d8(0.84mmole)加入含有0.10g叔丁醇钾(0.94mmole)的9ml甲苯溶液,之后加热回流反应至隔夜。反应完毕、待温度降温后,使用乙酸乙酯与水进行萃取、收集有机层减压浓缩。将得到的浓缩液进行管柱层析,得到白色固体e8。
[0252]1h-nmr(500mhz,cdcl3,ppm):8.22(d,1h)、7.73(d,1h)、7.49(m,1h)、7.13(m,2h)、3.36(m,1h)、1.61~1.19(m,13h)、0.93(t,3h)。
[0253]
取0.6g化合物e8(1.05mmole)溶解在7ml thf中,将反应瓶降温至-78℃后加入0.74ml的含1.5m正丁基锂的己烷(1.1mmole),之后回温至0℃反应30分钟。接着在-78℃下加入0.12g硼酸三甲酯(1.1mmole)后,将反应温度回到室温反应1hr。之后加入1ml醋酸与0.5ml 30%h2o2,接着继续搅拌至隔日。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.36g产物f8。
[0254]1h-nmr(500mhz,cdcl3,ppm):9.0(s,1h)、7.73(m,1h)、7.65(d,1h)、7.13(d,1h)、6.96(d,1h)、3.34(m,1h)、1.61~1.19(m,13h)、0.89(t,3h)。
[0255]
取0.6g化合物f8(1.22mmole)、0.31g 1-(溴二氟甲基)-4-丙基环己烷(1.22mmole)及0.19g碳酸钾(1.34mmole)溶解在12ml thf中,回流8小时。反应液用乙酸乙酯与水进行萃取、收集有机层减压浓缩,将得到的浓缩液进行管柱层析,得到0.57g产物g8。
[0256]
制备得到的化合物g8进行质谱、核磁共振谱测试,测试得到的数据如下。根据测试结果,化合物为cqb(s)[f,ot]qic-3-3所示结构。
[0257]
ms(ei,m/z):316,491,666。
[0258]1h-nmr(500mhz,cdcl3,ppm):7.82(d,1h)、7.73(d,1h)、7.11(m,2h)、3.34(m,2h)、1.63~1.21(m,26h)、0.92(m,6h)。
[0259]
13
c-nmr(500mhz,cdcl3,ppm):146.0、145.5、141.9、141.2、130.7、130.4、129.6、126.5、126.1、123.0、122.4、119.4、116.1、42.2、37.1、29.3、26.5、20.5、15.2、14.1。
[0260]
对于下述的表1所示的前述实施例及对比例的各化合物,在下述条件下测定t
ni
、δn、δε、k
11
、k
33
、g1等,其物理性能测试结果示于后述的表2中,根据这些测试结果计算得到的响应指标值g1/(k
11
*
△
n*
△
n*t
ni
)、g1/(k
33
*
△
n*
△
n*t
ni
)示于后述的表3中,在va(vertical alignment,垂直取向)或者ps-va(polymer stabilized vertical alignment,聚合物稳定垂直取向)模式下,液晶介质的响应时间与指标g1/(k
33
*
△
n*
△
n*t
ni
)相关,而在ffs(fringe field switching,边缘场开关)、ips(in-plane switching,平面转换)、ps-ffs(polymer stabilized fringe field switching,聚合物稳定边缘场开关)、ps-ips(polymer stabilized in-plane switching,聚合物稳定平面转换)等模式下,液晶介质的响应时间与响应指标值g1/(k
11
*
△
n*
△
n*t
ni
)相关。前述的响应指标值越小,表明响应时间越快。
[0261]
t
ni
代表液晶单体由向列相相变至澄清相的温度,通过mp-90设备测量;
[0262]
δn表示光学各向异性,δn=n
e-no,其中,no为寻常光的折射率,ne为非寻常光的
折射率,测试条件:589nm、25
±
0.2℃。
[0263]
δε表示介电各向异性,δε=ε
∥-ε
⊥
,其中,ε
∥
为平行于分子轴的介电常数,ε
⊥
为垂直于分子轴的介电常数,测试条件:25℃、instec:alct-ir1、18微米垂直盒;
[0264]k11
为扭曲弹性常数,k
33
为展曲弹性常数,测试条件为:25℃、instec:alct-ir1、18微米垂直盒。
[0265]
gamma1(mpa.s)为旋转粘滞系数,简写为“g1”,测试条件为:25℃、instec:alct-ir1、18微米垂直盒。
[0266]
表1:实施例及对比例的各化合物
[0267][0268]
表2:实施例及对比例的各化合物的物理性能测试结果
[0269][0270]
表3:实施例及对比例的各化合物的响应指标值
[0271]
物理特性(25℃)清亮点t
ni
(℃)g1/(k
11
*
△
n*
△
n*t
ni
)g1/(k
33
*
△
n*
△
n*t
ni
)对比例64.511.2010.16实施例191.64.424.59实施例246.55.228.18实施例381.05.565.90实施例442.57.599.68实施例5265.74.315.78实施例6275.53.584.51实施例7215.74.706.02实施例8210.43.434.54
[0272]
通过表3中实施例1~8以及对比例的响应指标指的对比可以看出,实施例1~10的液晶化合物的响应指标值g1/(k
11
*
△
n*
△
n*t
ni
)、g1/(k
33
*
△
n*
△
n*t
ni
)相对于对比例降低,尤其是g1/(k
11
*
△
n*
△
n*t
ni
)降低显着。
[0273]
从表2可以看出,实施例的1~8的液晶化合物的g1值虽然要高于对比例,但是由于其清亮点t
ni
(℃)相对于对比例1显着提高,并且弹性系数k11(pn)、k33(pn)相对于对比例1显着提高,从而有助于响应指标值的降低。
[0274]
本发明可用其他的不违背本发明的精神或主要特征的具体形式来概述。因此,无论从哪一点来看,本发明的上述实施方案都只能认为是对本发明的说明而不能限制本发明,权利要求书指出了本发明的范围,而上述的说明并未指出本发明的范围,因此,在与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在本发明的权利要求书的范围内。
