1.本发明涉及液晶材料领域,特别涉及一种二氟亚甲氧基类液晶化合物及其合成方法。
背景技术:
2.液晶是一类介于常规液体性质和固体晶体性质之间的物质,其既有液体的可流动性和连续性,又具有晶体的有序排列和各向异性。现在,液晶在光电显示领域的应用快速发展,液晶显示技术已成为平板显示产业的主流,基本取代了阴极射线显示。液晶材料是液晶显示的关键性专用光电材料之一,能赋予液晶显示器件的各种优良性能。此外,液晶材料还被广泛应用到电子传感器、航空航天等高新技术领域。
3.现在的液晶材料要求具备良好的化学、物理和热稳定性,低粘度,对电场和电磁场辐射的稳定性,较宽的向列相温度范围,适当的折射率、合适的各项介电异性,较快的响应速度以及较高的电压保持率等性能。由于氟原子的原子半径小,且氟原子的引入能影响分子的偶极矩,因此末端含氟的液晶材料相较于其它基团取代的液晶材料具有更小的介电各向异性。此外,中心桥键引入氟原子能够有效降低分子的加宽效应,增大分子的介电常数,且能降低分子的熔点,制得低熔点的液晶分子材料。中国专利201510065153.9和201310250122.1均报道了一些末端含氟以及中心桥键含氟的液晶分子结构,显示了较好的性能。随着高端液晶材料在市场上的需求量不断增大,需要开发更多的新型含氟液晶化合物。
技术实现要素:
4.本发明要解决的技术问题在于提供一种二氟亚甲氧基类液晶化合物及其合成方法。
5.本发明所述的二氟亚甲氧基类液晶化合物,其结构如式(i)所示:(i)式(i)中r1为ch3或h;r2、r3和r4为f或h,且其中至少有一个为f。
6.进一步地,其结构式选自下述式(i-1)至式(i-6)中的一种:6)中的一种:
式(i-1)至式(i-6)中,r1为ch3或h;r2、r3和r4为f或h,且其中至少有一个为f。
7.本发明所述二氟亚甲氧基类液晶化合物,按照如下方法制备:氮气氛围中,在碱的存在下,在二(三苯基膦)二氯化钯的催化下,式(ii)所示的中间体和式(iii)所示的苯硼酸在甲苯中于回流温度下充分反应,经后处理得式(i)所示的二氟亚甲氧基类液晶化合物:(ii)(iii)式(ii)中,r2、r3和r4为f或h,且其中至少有一个为f;式(iii)中,r1为ch3或h。
8.上述反应中,所述的碱可以是碳酸钠、醋酸钠、碳酸氢钠、碳酸铯、碳酸钾等,优选碳酸钾;所述的中间体(ii)︰苯硼酸(iii)︰二(三苯基膦)二氯化钯︰碳酸钾的投料物质的量比为1︰1.5~2.5︰0.01~0.05︰1.5~3.5;所述的溶剂甲苯用量为中间体(ii)质量的5~20倍;所述反应时间推荐为4~16小时。
9.所述的后处理可以采用如下步骤:反应结束后,反应液中加水搅拌,然后用二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,收集含目标化合物的洗脱液,蒸除溶剂即得式(i)所示的二氟亚甲氧基类液晶化合物。
10.本发明所述的中间体(ii)可按照如下方法制备:氮气氛围下,在甲苯和正庚烷的混合溶剂中,加入4-溴-2,6-二氟苯甲酸和1,3-丙二硫醇,升温至40~60℃,滴加三氟甲磺酸,滴加完毕后,升温共沸带水以除去反应中生成的水,结束后,将反应体系降至室温,滴加甲基叔丁基醚,滴完后继续降温至-5~5℃,搅拌0.5~1小时,分离出反应体系中析出的固体。将上述析出的固体溶于二氯甲烷中,氮气氛围下,降温至-80~-60℃,滴加三乙胺和式(iv)所示氟代苯酚的混合物,滴完后反应1~3小时,随后滴加三乙胺三氢氟酸盐和溴素,反应0.5~1.5小时后,升温至室温,再经后处理得式(ii)所示的中间体;(iv)式(iv)中,r2、r3和r4为f或h,且其中至少有一个为f。
11.在上述制备中间体(ii)的反应中,所述的4-溴-2,6-二氟苯甲酸︰1,3丙二硫醇︰三氟甲磺酸︰三乙胺︰氟代苯酚(iv)︰三乙胺三氢氟酸盐︰溴素的投料物质的量比为1︰1~1.5︰1~1.5︰0.8~1.3︰1~1.5︰4~6︰4~6;所述的溶剂甲苯和正庚烷用量分别为4-溴-2,6-二氟苯甲酸质量的4~6倍;所述共沸带水时间为3~7小时;所述的甲基叔丁基醚用量为4-溴-2,6-二氟苯甲酸质量的5~7倍;所述的用于溶解析出固体的二氯甲烷用量为4-溴-2,6-二氟苯甲酸质量的8~14倍。
12.所述的后处理可以采用如下步骤:反应结束后,反应液中加入饱和碳酸氢钠溶液,调节ph至7~8,然后二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,蒸除溶剂即得式(ii)所示的中间体。
13.综上所述,本发明所述二氟亚甲氧基类液晶化合物的合成方法的总体反应式可表示如下:
具体推荐所述二氟亚甲氧基类液晶化合物的合成方法按照如下步骤进行:(1)氮气氛围下,在甲苯和正庚烷的混合溶剂中,加入4-溴-2,6-二氟苯甲酸和1,3丙二硫醇,升温至40~60℃,滴加三氟甲磺酸,滴加完毕后,升温共沸带水3~7小时以除去反应中生成的水,结束后,将反应体系降至室温,滴加甲基叔丁基醚,滴完后继续降温至-5~5℃,搅拌0.5~1小时,分离出反应体系中析出的固体。将上述析出的固体溶于二氯甲烷中,氮气氛围下,降温至-80~-60℃,滴加三乙胺和式(iv)所示氟代苯酚的混合物,滴完后反应1~3小时,随后滴加三乙胺三氢氟酸盐和溴素,反应0.5~1.5小时后,升温至室温,反应液中加入饱和碳酸氢钠溶液,调节ph至7~8,然后二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,蒸除溶剂即得式(ii)所示的中间体。所述的4-溴-2,6-二氟苯甲酸︰1,3丙二硫醇︰三氟甲磺酸︰三乙胺︰氟代苯酚(iv)︰三乙胺三氢氟酸盐︰溴素的投料物质的量比为1︰1~1.5︰1~1.5︰0.8~1.3︰1~1.5︰4~6︰4~6。
14.(2)氮气氛围中,在碳酸钾的存在下,在二(三苯基膦)二氯化钯的催化下,步骤(1)得到的中间体(ii)和式(iii)所示的苯硼酸在甲苯中于回流温度下反应4~16小时,反应结束后,反应液中加水搅拌,然后用二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,收集含目标化合物的洗脱液,蒸除溶剂即得式(i)所示的二氟亚甲氧基类液晶化合物。所述的中间体(ii)︰苯硼酸(iii)︰二(三苯基膦)二氯化钯︰碳酸钾的投料物质的量比为1︰1.5~2.5︰0.01~0.05︰1.5~3.5本发明的二氟亚甲氧基类液晶化合物,具有较高的光学各向异性和介电各向异性,较高清亮点,低熔点,低粘度,可用于制备液晶混合物,应用前景广阔。
15.(四)具体实施方式下面通过具体实施方式对本发明作进一步说明,但本发明的保护范围并不限于此。
16.下述实施例所用的氟代苯酚(iv)的结构式分别如式(iv-1)~(iv-3)所示;所用的苯硼酸(iii)的结构式分别如式(iii-1)和(iii-2)所示:
制得的中间体(ii)的结构式分别如式(ii-1)~(ii-3)所示:对应制得的二氟亚甲氧基类液晶化合物的结构式分别如式(i-1)~(i-6)所示:6)所示:实施例1 5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1)的制备氮气氛围下,将4-溴-2,6-二氟苯甲酸(10mmol)和1,3丙二硫醇(13mmol)溶于15ml甲苯和15ml正庚烷的混合溶液中,随后升温至50℃,滴加三氟甲磺酸(13mmol),滴加完毕后,升温共沸带水4小时以除去反应中生成的水,结束后,将反应体系降至室温,滴加20ml甲基叔丁基醚,滴完后继续降温至0℃,搅拌0.5小时,分离出反应体系中析出的固体。将上述析出的固体溶于20ml二氯甲烷中,氮气氛围下,降温至-70℃,滴加3,4,5-三氟苯酚(iv-1,11mmol)和三乙胺(12mmol)组成的混合物,滴完后反应2小时,随后滴加三乙胺三氢氟酸盐(50mmol)以及溴素(50mmol),反应1小时后,升温至室温,反应液中加入饱和碳酸氢钠溶液,调节ph至7~8,然后二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,蒸除溶剂即得5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1),白色固体,收率为45%。
[0017]1h nmr (500 mhz, cdcl3) δ: 7.21 (d, j = 8.6 hz, 2h), 6.98-6.92 (m, 2h);ms (ei), m/z: 388.0 [m
+
], 240.9 [m
+
,100%]。
[0018]
实施例2 5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,3-二氟苯(ii-2)的制备反应步骤同实施例1,所不同的是3,4,5-三氟苯酚改为3,5-二氟苯酚(iv-2),制得5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,3-二氟苯(ii-2),白色固体,收率为44%。
[0019]1h nmr (500 mhz, cdcl3) δ: 7.70 (d, j = 8.4 hz, 2h), 6.84 (dd, j = 7.5 hz, 2h), 6.84-6.70 (m, 1h); ms (ei), m/z: 370.0 [m
+
], 241.0 [100%]。
[0020]
实施例3 4-((2,6-二氟-4-溴苯基)二氟甲氧基)-氟苯(ii-3)的制备反应步骤同实施例1,所不同的是3,4,5-三氟苯酚改为4-氟苯酚(iv-3),制得4-((2,6-二氟-4-溴苯基)二氟甲氧基)-氟苯(ii-3),黄色液体,收率为46%。
[0021]1h nmr (500 mhz, cdcl3) δ: 6.84-6.70 (m, 1h) 7.19 (d, j = 8.3 hz, 2h), 7.06 (d, j = 8.3 hz,1h), 7.02-7.00 (m, 1h), 6.98-6.95 (m, 1h); ms (ei), m/z: 351.9 [m
+
], 241.0 [100%]实施例4 4'-(二氟(3,4,5-三氟苯氧基)甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-1)的制备往3ml甲苯溶液中,加入5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1,1mmol)、2,4,6-三甲基苯硼酸(iii-1,2mmol)、二(三苯基膦)二氯化钯(0.03mmol)和碳酸钾(2.5mmol),氮气氛围下,回流反应12小时,反应结束后,反应液中加水搅拌,然后用二氯甲烷萃取,分离出有机层,减压蒸除溶剂,再进行柱层析分离,以石油醚为洗脱剂,收集含目标化合物的洗脱液,蒸除溶剂即得4'-(二氟(3,4,5-三氟苯氧基)甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-1),白色固体,熔点55.3℃,收率为44%。
[0022]1h nmr (500 mhz, cdcl3) δ: 7.03-7.01 (m, 2h), 6.97 (s, 2h), 6.84 (d, j = 9.7 hz, 2h), 2,35 (s, 3h), 2.04 (s, 6h); ms (ei), m/z: 428.4 [m
+
], 281.3 [100%]。
[0023]
实施例5 4'-((3,5-二氟苯氧基)二氟甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-2)的制备反应步骤同实施例4,所不同的是5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1)改为5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,3-二氟苯(ii-2),制得4'-((3,5-二氟苯氧基)二氟甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-2),白色固体,熔点63.2℃,收率为40%。
[0024]1h nmr (500 mhz, cdcl3) δ: 6.97 (s, 2h), 6.92 (d, j = 7.3 hz, 2h), 6.84 (d, j = 10.0 hz, 2h), 6.77-6.72 (m, 1h), 2.35 (s, 3h), 2.05 (s, 6h); ms (ei), m/z: 410.4 [m
+
], 281.3 [100%]。
[0025]
实施例6 4'-(二氟(4-氟苯氧基)甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-3)的制备反应步骤同实施例4,所不同的是5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1)改为4-((2,6-二氟-4-溴苯基)二氟甲氧基)-氟苯(ii-3),制得4'-(二氟(4-氟苯氧基)甲基)-3',5'-二氟-2,4,6-三甲基-1,1'-联苯(i-3),白色固体,熔点75.3℃,收率为42%。
[0026]1h nmr (500 mhz, cdcl3) δ: 7.37 (m, 1h), 7.17 (d, j = 8.3 hz, 1h), 7.11 (m, 1h), 7.09 (m, 3h), 6.84 (d, j = 9.7 hz, 2h), 2.37 (s, 3h), 2.06 (s, 6h); ms (ei), m/z: 392.4 [m
+
], 281.3 [100%]。
[0027]
实施例7 4'-(二氟(3,4,5-三氟苯氧基)甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-4)的制备反应步骤同实施例4,所不同的是2,4,6-三甲基苯硼酸(iii-1)改为2,4-二甲基苯硼酸(iii-2),制得4'-(二氟(3,4,5-三氟苯氧基)甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-4),白色固体,熔点48.9℃,收率为82%。
[0028]1h nmr (500 mhz, cdcl3) δ: 7.14 (s, 1h), 7.10 (s, 2h), 7.03-6.96 (m, 4h), 2.39 (s, 3h), 2.28 (s, 3h); ms (ei), m/z: 414.3 [m
+
], 267.3 [100%]。
[0029]
实施例8 4'-((3,5-二氟苯氧基)二氟甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-5)的制备反应步骤同实施例4,所不同的是5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1)改为5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,3-二氟苯(ii-2),2,4,6-三甲基苯硼酸(iii-1)改为2,4-二甲基苯硼酸(iii-2),制得4'-( (3,5-二氟苯氧基)二氟甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-5),白色固体,熔点51.4℃,收率为76%。
[0030]1h nmr (500 mhz, cdcl3) δ: 7.14 (s, 1h), 7.11 (s, 2h), 6.97 (d, j = 10.2 hz, 2h), 6.91 (dd, j = 7.45 hz, 2h), 6.76-6.72 (m, 1h), 2.39 (s,3h), 2.28 (s, 3h); ms (ei), m/z: 396.3 [m
+
], 267.3 [m
+
, 100%]。
[0031]
实施例9 4'-(二氟(4-氟苯氧基)甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-6)的制备反应步骤同实施例4,所不同的是5-((2,6-二氟-4-溴苯基)二氟甲氧基)-1,2,3-三氟苯(ii-1)改为4-((2,6-二氟-4-溴苯基)二氟甲氧基)-氟苯(ii-3),2,4,6-三甲基苯硼酸(iii-1)改为2,4-二甲基苯硼酸(iii-2),制得4'-(二氟(4-氟苯氧基)甲基)-3',5'-二氟-2,4-二甲基-1,1'-联苯(i-6),白色固体,熔点61.3℃,收率为85%。
[0032]1h nmr (500 mhz, cdcl3) δ: 7.38-7.33 (m, 1h), 7.16-7.09 (m, 5h), 7.01-6.96 (m, 3h), 2.39 (s, 3h), 2.29 (s, 3h); ms (ei), m/z: 378.3 [m
+
,10%], 267.3 [100%]。
[0033]
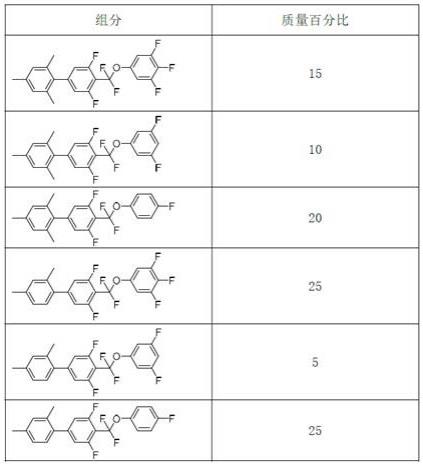
实施例10 二氟亚甲氧基类液晶化合物的性能按表1组成液晶组合物,该组合物的清亮点为108℃;光学各向异性δn为0.1033(589nm,20℃);介电各向异性δε为17.2(1khz, 25℃);粘度γ1为80 mpa
•
s。
[0034]
表1 添加本发明化合物的液晶组合物中各组分的质量百分比
