1.本发明涉及鲜黄精冻干速释制剂的制备方法,属于药品、保健品技术领域。
背景技术:
2.黄精为百合科(liliaceae)黄精属polygonatum mill.多年生草本植物,是我国传统中药,在中国广泛分布于东北、华北、安徽等地。《中国药典》记载黄精为滇黄精p.kingianum coll.et hemsl.、黄精p.sibiricum red.或多花黄精p.cyrtonema hua的干燥根茎;甘、平;归脾、肺、肾经;具有补气养阴、健脾、润肺、益肾的作用;用于脾胃气虚、体倦乏力、胃阴不足、口干食少、肺虚燥咳、劳嗽咳血、精血不足、腰膝酸软等。黄精在抗衰老、调节免疫力、调血脂、改善记忆力、抗肿瘤、抗菌等方面显示出潜在的药用价值,已被国家列为药食两用中药。
3.黄精中含有多种重要活性成分,主要包括多糖、甾体皂苷、木脂素、黄酮及生物碱、挥发油成分等。其中多糖和甾体皂苷类成分在黄精中量较大,为其主要药效成分。黄精的药理作用主要具有增强免疫力、神经保护、抗糖尿病、抗疲劳、抗癌、抗骨质疏松。目前市场上应用的黄精(药典品)基本是干制黄精和经过多重炮制品,少见黄精鲜品应用。黄精传统炮制方法包括九蒸九晒、酒制、烘干等,提取的方法包括水煎煮、有机溶剂提取,超临界提取挥发脂溶成分等,这些黄精加工方法不可避免会使黄精挥发油、多糖等成分损失。目前市场上经过上述技术处理的炮制饮片已经提取的产品(提取物)其主要成分多糖含量基本损失超过50%以上,挥发油损失90%以上,将会极大影响黄精药效发挥效果。
4.目前关于黄精炮制加工和提取工艺相关文献,中国专利cn102389526 b黄精的真空冷冻干燥方法,文献新农业,2019.1黄精真空冷冻干燥工艺优化研究,两篇文献均是采用黄精药材直接冻干而成,没有对其有效成分进行提取,不涉及本发明相关技术。目前未发现鲜黄精低温、不加热、不使用有机溶媒的提取方法以及制备鲜黄精冻干制剂方法和文献报道。
技术实现要素:
5.本发明就是为了解决上述技术问题,而提供了鲜黄精冻干速释制剂的制备方法,采用此方法制备的鲜黄精冻干速释制剂具有明显骨架结构形状,崩解释放速度快、生物利用度高、营养成分损耗小、易于被人体吸收、多糖挥发油成分流失较少的特点。
6.为了解决上述技术问题,本发明是通过下述技术方案实现的:
7.鲜黄精冻干速释制剂的制备方法,包括如下步骤:取鲜黄精切片、斩拌为粒状,通入液氮冷冻,进行超低温粉碎,出料加入1~5倍鲜黄精重量的纯水,搅拌均匀,封装后装入超高压设备釜中,升压至400~600mpa,维持提取10~15分钟,得黄精提取液,进行高压均质,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-45℃~-55℃,保持2~6小时,抽真空,然后将板层温度从-40℃到25℃缓慢升温,压盖封装,制成鲜黄精冻干速释制剂。
8.优选的,上述在加入纯水时还可以加入0.005~0.05倍鲜黄精重量的骨架物质。
9.优选的,上述骨架物质可以是甘露醇、海藻糖、环糊精、黄原胶中的一种。
10.优选的,上述高压均质压力为20~30mpa。
11.优选的,上述超低温粉碎至100~300目。
12.优选的,上述抽真空至1~5pa。
13.优选的,上述缓慢升温时间为38~42小时。
14.优选的,上述通入氮冷冻至-40℃~-50℃。
15.由于采用上述技术方案,使得本发明具有如下优点和效果:
16.本发明鲜黄精冻干速释的制剂制备方法,不同于传统炮制与提取方法,没有通过晾晒、烘干、蒸制、酒制炮制过程,也没有通过水煎煮、有机溶媒传统加热提取等破坏黄精多糖、挥发油营养成分的步骤,本发明采用新鲜药材,进行超低温冷冻粉碎结合超高压提取,对黄精细胞壁破壁,使黄精有效成分溶出,再进行高压均质进一步对黄精细胞进行提取,可以较多保留黄精成分,黄精的有效成分损失少,尤其是挥发性成分保留更多,黄精滋味更为浓厚,对比传统加热提取方法,大幅度提高了有效成分含量,差异十分显著,从而显著提高了药效和营养价值。本发明创新利用黄精溶出的多糖、淀粉、蛋白质作为骨架,可制备成速释的黄精口服制剂,经查新未见使用上述方法提取黄精在内植物或制备冻干制剂。本发明口腔冻干制剂具有明显骨架结构形状,孔隙率高,在口腔中可迅速崩解和溶解,通过口腔黏膜、咽和食管生物膜吸收进入血液,能有效避免肝脏首过效应。本发明方法制备的黄精制剂在服用时不需用水,能在口腔中迅速溶解,具有口感良好,服用方便、吸收快、生物利用度高等特点,为老人、儿童及吞咽功能不好和取水不便的患者提供了方便。
17.本发明鲜黄精冻干速释制剂比市售制剂如胶囊和普通片的崩解速度有较大提高,本发明制备的鲜黄精冻干速释制剂的一般在5秒以内能快速的溶化,更加有利于吸收。
18.本发明方法制备的鲜黄精冻干速释制剂具有明显骨架结构形状,崩解速度快、生物利用度高、营养成分损耗小、易于被人体吸收、吸收速度快,黄精蛋白、多糖、挥发油成分流失较少的特点。
具体实施方式
19.下面结合实施例对本发明进行进一步描述。以下实施例仅为本发明的几个具体实施例,但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。
20.下述实施例和试验例中的方法,如无特别说明,均为常规方法。
21.实施例1
22.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-40℃,进行超低温粉碎至100目,出料加入25重量份的纯水,搅拌均匀,封装后装入超高压设备釜中,升压至500mpa,维持提取10分钟,得黄精提取液,进行高压均质,压力为20mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-52℃,保持3小时,抽真空至1pa,然后将板层温度从-40℃到25℃缓慢升温40小时,压盖封装,制成鲜黄精冻干速释制剂。
23.实施例2
24.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-50℃,进行超低温粉碎至
200目,出料加入20重量份的纯水,搅拌均匀,封装后装入超高压设备釜中,升压至450mpa,维持提取15分钟,得黄精提取液,进行高压均质,压力为30mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-55℃,保持4小时,抽真空至2pa,然后将板层温度从-40℃到25℃缓慢升温38小时,压盖封装,制成鲜黄精冻干速释制剂。
25.实施例3
26.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-40℃,进行超低温粉碎至300目,出料加入30重量份的纯水及0.2重量份甘露醇,搅拌均匀,封装后装入超高压设备釜中,升压至600mpa,维持提取15分钟,得黄精提取液,进行高压均质,压力为25mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-50℃,保持2小时,抽真空至5pa,然后将板层温度从-40℃到25℃缓慢升温39小时,压盖封装,制成鲜黄精冻干速释制剂。
27.实施例4
28.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-45℃,进行超低温粉碎至100目,出料加入15重量份的纯水及0.05重量份黄原胶,搅拌均匀,封装后装入超高压设备釜中,升压至400mpa,维持提取12分钟,得黄精提取液,进行高压均质,压力为30mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-45℃,保持5小时,抽真空至3pa,然后将板层温度从-40℃到25℃缓慢升温41小时,压盖封装,制成鲜黄精冻干速释制剂。
29.实施例5
30.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-45℃,进行超低温粉碎至200目,出料加入10重量份的纯水及0.5重量份海藻糖,搅拌均匀,封装后装入超高压设备釜中,升压至550mpa,维持提取14分钟,得黄精提取液,进行高压均质,压力为25mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-48℃,保持2小时,抽真空至4pa,然后将板层温度从-40℃到25℃缓慢升温42小时,压盖封装,制成鲜黄精冻干速释制剂。
31.实施例6
32.取鲜黄精10重量份切片、斩拌为粒状,通入液氮冷冻至-40℃,进行超低温粉碎至300目,出料加入50重量份的纯水及0.3重量份环糊精,搅拌均匀,封装后装入超高压设备釜中,升压至500mpa,维持提取10分钟,得黄精提取液,进行高压均质,压力为20mpa,得到均质液体,将黄精均质液灌装至冻干瓶中,放入冷冻干燥机中,速冻至-55℃,保持6小时,抽真空至2.5pa,然后将板层温度从-40℃到25℃缓慢升温40小时,压盖封装,制成鲜黄精冻干速释制剂。
33.以下通过试验数据进一步说明本发明的特点和效果,下述试验例中,未特殊说明的试验方法,均为常规方法。
34.试验例1:粗多糖含量的测定。
35.本发明实施例1-6方法制备的鲜黄精冻干速释制剂的效果主要通过对比检测本发明黄精制剂成分与按照常规方法制备的黄精制剂中含有的活性成分总量确定。采用苯酚-硫酸法测定粗多糖含量。
36.样品提取:取上述实施例1-6方法制备的鲜黄精冻干速释制剂、对照样品1以及对
照样品2适量,置于100ml容量瓶中,加水80ml左右,于沸水浴中加热1h,冷却至室温后补加水至刻度(v1),混匀后过滤,弃去初滤液,收集余下滤液供沉淀粗多糖。
37.对照样品1,取上述鲜黄精,按照常规方法加水煎煮,烘干得对照样品1。
38.对照样品2,取上述鲜黄精,按照传统干制炮制方法制备饮片,按照常规方法加水煎煮,烘干得对照样品2。
39.沉淀粗多糖:准确吸取上述滤液2.0ml(v2)于15ml具塞离心管中,加入无水乙醇8.0ml,混匀,于4℃冰箱静置4h以上,以4000r/min离心5min,弃去上清液,残渣用80%(v/v)乙醇洗涤,离心后弃去上清液,反复操作3次。残渣用水溶解并定容至25ml(v3)。
40.葡萄糖对照品溶液的配制:准确称取干燥至恒重的葡萄糖对照品0.1000g加水溶解,并定容至10ml,此溶液1ml含10mg葡萄糖,用前稀释100倍为使用液(0.1mg/ml)。准确吸取葡萄糖使用液0、0.10、0.20、0.40、0.60、0.80、1.00ml(相当于葡萄糖0、0.01、0.02、0.04、0.06、0.08、0.1mg)置于25ml比色管中,补加水至2.0ml,加入5%苯酚溶液1.0ml,在涡旋混合器上混匀,小心加入浓硫酸10ml,在涡旋混合器上小心混匀,置沸水浴中2min,冷却至室温,用分光光度计在485nm波长处以试剂空白为参比,1cm比色皿测定吸光度值。以葡萄糖质量为横坐标,以吸光值为纵坐标,绘制标准曲线。
41.测定:取一定体积(v4,ml)v3溶液,按标准曲线的测定方法测定其吸光值,从标准曲线上查出葡萄糖含量,计算样品中粗多糖含量。结果见表1。
42.计算:
[0043][0044]
式中:
[0045]
x——样品中粗多糖的含量(以葡萄糖计),g/100g;
[0046]
m1——从标准曲线上查得的粗多糖的毫克数,mg;
[0047]
m2——样品质量,g;
[0048]
v1——样品提取液总体积,ml;
[0049]
v2——沉淀粗多糖所用样品提取液体积,ml;
[0050]
v3——粗多糖溶液体积,ml;
[0051]
v4——测定用样品体积,ml。
[0052]
表1 鲜黄精冻干速释制剂粗多糖
[0053]
样品项目粗多糖提取率(g/100g)实施例126.3实施例225.1实施例325.3实施例430.2实施例529.5实施例630.6对照样品19.5对照样品28.8
[0054]
试验例2:挥发油检测方法。
[0055]
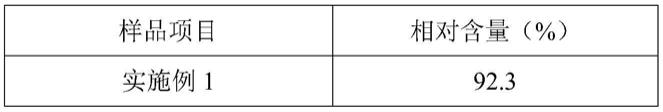
取本发明实施例1-6方法制备的鲜黄精冻干速释制剂(按鲜黄精计)、鲜黄精、水煎法提取黄精(按鲜黄精计)、乙醇提取黄精(按鲜黄精计)一定量,置于挥发油提取器中,立即进行水蒸气常压蒸馏8h,馏出物移至分液漏斗中,用石油醚萃取2次,合并石油醚层,经无水硫酸钠干燥,过滤减压浓缩得到具有黄精特殊香味的油状物,用有机溶剂稀释之后,进气相色谱仪检测。色谱条件为:色谱柱:hp-5(30m
×
0.25mm,0.25μm)毛细管柱;柱温:起始温度50℃,保持2min,以10℃/min升温至250℃,保持15min;进样口:250℃;载气:氮气;检测器:fid;检测器温度:280℃;流速:1ml/min;分流比:50:1;进样量:1μl。采用面积归一化法进行计算挥发油的相对含量(峰面积总和/鲜黄精峰面积总和
×
100%)。
[0056]
经检测,水煎法提取黄精、乙醇提取黄精中部分挥发油成分的含量明显低于鲜黄精,而实施例1-6鲜黄精冻干速释制剂中挥发油含量与鲜黄精中挥发油含量相近,说明采用冷冻干燥方法加工,挥发油成分流失较少。试验结果见表2。
[0057]
表2 鲜黄精冻干速释制剂挥发油
[0058][0059][0060]
试验例3:免疫试验(cona诱导的小鼠脾淋巴细胞转化试验-mtt法)。
[0061]
完全培养液:rpmi1640培养液过滤除菌,用前加入10%小牛血清,1%谷氨酰胺(200mmol/l),青霉素(100u/ml),链霉素(100μg/l)及5
×
10-5
mol/l的2-巯基乙醇,用无菌的1mol/l的hcl或1mol/l的naoh调ph至7.0-7.2,即完全培养液。
[0062]
cona液:用双蒸水配制成100μg/ml的溶液,过滤除菌,在低温冰箱(-20℃)保存。
[0063]
无菌hank’s液:用前以3.5%的无菌nahco3调ph7.2-7.4。
[0064]
mtt液:将5mgmtt溶于1ml ph7.2的pbs中,现配现用。
[0065]
酸性异丙醇溶液:96ml异丙醇中加入4ml 1mol/l的hcl,临用前配制。
[0066]
雌性balb/c小鼠20~22g,随机分组,小鼠分别灌胃给予实施例1鲜黄精冻干速释制剂低剂量组(折合成干药材2.17g/kg)、实施例1高剂量组(折合成干药材6.52g/kg)、水煎法提取黄精低剂量组(折合成干药材2.17g/kg)、水煎法提取黄精高剂量组(折合成干药材6.52g/kg)、对照组(生理盐水)、模型组(生理盐水),每日1次,连续10天,从第8天起,除正常
对照组外,每组动物都腹腔注射环磷酰胺(用量为60mg/kg,0.2ml/d),连续3天,造模。于试验第11天,将小鼠放血致死,无菌取脾,置于盛有适量无菌hank’s液平皿中,用镊子轻轻将脾磨碎,制成单个细胞悬液,经200目滤网将过滤,用hank’s液洗2次,每次离心10min(1000r/min)。最后将细胞悬液浮于1ml完全培养液中,用台酚兰染色计数活细胞(应在95%以上),调整细胞浓度为3
×
106个/ml。
[0067]
将每一份脾细胞悬液分两孔加入24孔培养板中,每孔1ml,一孔加75μl cona液(相当于7.5μg/ml),另一孔作为对照,置5%co2,37℃co2培养箱中培养72h。培养结束前4h,每孔轻轻吸去上清液0.7ml,加入0.7ml不含小牛血清的rpmi1640培养液,同时加入mtt(5mg/ml)50μl/孔,继续培养4h。培养结束后,每孔加入1ml酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔作3个平行孔,用酶标仪,以570nm波长测定光密度值。用加cona孔的光密度值减去不加cona孔的光密度值代表淋巴细胞的增殖能力,受试物组的光密度差值显著高于对照组的光密度差值,即可判定该项试验结果阳性。
[0068]
试验结果表明,实施例1鲜黄精冻干速释制剂的低剂量组、高剂量组以及水煎法提取黄精组低剂量组、高剂量组的淋巴细胞增殖能力均高于免疫抑制组,且具有显著性差异(p<0.05),与对照组相比差异不显著(p>0.05),结果见表3。
[0069]
表3 黄精不同制剂对小鼠脾淋巴细胞转化试验的影响
[0070]
组别淋巴细胞增殖能力对照组0.141
±
0.022模型组0.074
±
0.028实施例1低剂量组0.157
±
0.021实施例1高剂量组0.168
±
0.023水煎法提取黄精低剂量组0.144
±
0.034水煎法提取黄精高剂量组0.152
±
0.024
[0071]
试验例4:免疫试验(小鼠腹腔巨噬细胞吞噬鸡红细胞试验)。
[0072]
鸡红细胞悬液制备:取鸡血置于有玻璃珠的锥形瓶中,朝一个方向充分摇动,以脱纤维。用生理盐水洗涤2~3次,离心(2000r/min,10min),去上清,用生理盐水配置成20%(v/v)的鸡红细胞悬液。
[0073]
昆明种小鼠随机分为每组10只,分别灌胃给予实施例6鲜黄精冻干速释制剂低剂量组(折合成干药材2.17g/kg)、实施例6高剂量组(折合成干药材6.52g/kg)、水煎法提取黄精低剂量组(折合成干药材2.17g/kg)、水煎法提取黄精高剂量组(折合成干药材6.52g/kg)、对照组(生理盐水)、模型组(生理盐水),每日1次,连续10天,试验第8、9、10天,除正常对照组外,所有动物均腹腔注射60mg/kg环磷酰胺0.2ml致小鼠免疫抑制。第12天,每鼠腹腔注射20%鸡红细胞悬液1ml。间隔30min,颈椎脱臼处死动物,将其仰位固定于鼠版上,正中剪开腹壁皮肤,经腹腔注入生理盐水2ml,转动鼠版1min。然后吸出腹腔洗液1ml,平均分滴于2片载玻片上,放入垫有湿纱布的搪瓷盒内,移至37℃孵箱温育30min。孵毕,于生理盐水中漂洗,以除去未贴片细胞。晾干,以1:1丙酮甲醇溶液固定,4%(v/v)gienmsa-磷酸缓冲液染色3min,再用蒸馏水漂洗晾干。油镜下计数巨噬细胞,每张片计数100个。
[0074][0075][0076]
试验结果表明,实施例6鲜黄精冻干速释制剂的低剂量组、高剂量组以及水煎法提取黄精组的高剂量组小鼠吞噬鸡红细胞吞噬率对于对照组和模型组均有显著的影响(p《0.05),且对照组和模型组相比无显著的影响(p》0.05)。实施例6高剂量组小鼠吞噬鸡红细胞吞噬指数对于对照组和模型组均有显著的影响(p《0.05),且对照组和模型组相比无显著的影响(p》0.05),结果见表4。
[0077]
表4 黄精不同制剂对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
[0078]
组别吞噬率(%)吞噬指数对照组16.1
±
2.90.234
±
0.035模型组15.7
±
1.60.228
±
0.005实施例6低剂量组21.9
±
3.3*0.314
±
0.068实施例6高剂量组30.3
±
4.4*0.558
±
0.053*水煎法提取黄精低剂量组21.9
±
4.8*0.292
±
0.059水煎法提取黄精高剂量组22.3
±
3.8*0.313
±
0.074
[0079]
试验例5:速释崩解试验。
[0080]
本发明实施例1-6方法制备的鲜黄精冻干速释制剂的崩解时限测试方法根据2015版《中华人民共和国药典》第四部,崩解时限检查法进行测定。将不锈钢管固定于支架上,浸入1000ml杯中,杯内盛有温度为37℃
±
1℃的水约900ml,启动仪器。升降的支架上下移动距离为10mm
±
1mm,往返频率为每分钟30次。取制剂样品1片,置上述不锈钢管中进行检查,全部崩解并通过筛网,记录崩解时间。如有少量轻质上漂或黏附与不锈钢管贝壁或筛网,但无硬心者,可作符合规定论。崩解时间结果见表5。
[0081]
表5 鲜黄精冻干速释制剂崩解时间
[0082]
样品项目崩解时间(s)实施例13实施例24实施例35实施例44实施例54实施例63。
