sirna输送载体及其制备方法和应用
技术领域
1.本发明涉及生物医药技术领域,具体地,涉及一种sirna输送载体及其制备方法和应用。
背景技术:
2.免疫疗法是当前肿瘤治疗领域最具前景的方向之一,然而,临床上该疗法的响应率较低,仅为10-30%。究其根源,除了肿瘤本身免疫原性弱,难以激发免疫系统产生有效的抗肿瘤免疫反应之外,肿瘤组织中免疫(杀伤性t)细胞浸润不足,导致免疫抑制的肿瘤微环境也是免疫疗法响应率低的重要原因。因此,促进瘤内t细胞浸润及增强肿瘤免疫原性,是提高肿瘤免疫治疗应答率的重要突破口。
3.已有研究发现,p21活化激酶4(p21-activated kinase 4,pak4)是肿瘤阻止杀伤性t细胞浸润,实现免疫逃逸的关键靶点,pak4可促进β-catenin蛋白磷酸化及核转移,激活wnt/β-catenin通路,从而导致瘤内t细胞浸润不足。因此,抑制pak4是促进瘤内t细胞浸润,解除肿瘤免疫抑制状态的关键。
4.sirna药物是最具战略前景的生物制药技术之一,近年来其获批上市的速度呈加速趋势,目前已有四款sirna药获得fda批准,分别是alnylam公司的onpattro、givlaari、oxlumo及leqvio,且预计在未来几年里将会有更多sirna药物进入市场。sirna药物可从mrna水平阻止致病蛋白的表达,具有效率高、特异性好及长效等优势。
5.目前针对抑制pak4表达的sirna的设计开发,以及如何将该sirna安全高效地输送到肿瘤部位作用靶点是促进瘤内t细胞浸润、提高肿瘤免疫治疗应答率的研究重点。
技术实现要素:
6.本发明的目的是为了克服现有技术存在的问题,提供一种sirna输送载体及其制备方法和应用,该载体能够提高肿瘤免疫原性、促进瘤内免疫浸润、增敏肿瘤免疫治疗。
7.为了实现上述目的,本发明第一方面提供一种sirna输送载体,该sirna输送载体包括载药纳米核心和包裹在所述载药纳米核心外周的外泌体,所述载药纳米核心为载有sirna的光激活聚合物所形成的纳米核心。
8.优选地,所述外泌体、所述光激活聚合物与所述sirna的质量比为2.5-100:5-25:1,优选为10-50:8-20:1;
9.优选地,所述sirna输送载体的平均粒径为100-200nm。
10.优选地,所述载药纳米核心为光激活聚合物与sirna通过静电相互作用形成的复合物;
11.优选地,所述光激活聚合物的制备过程包括:将聚乙烯亚胺与酮缩硫醇进行交联聚合形成交联物,将所述交联物与光敏剂混合进行酰胺反应后,进行透析、干燥;
12.优选地,所述聚乙烯亚胺、光敏剂与酮缩硫醇的摩尔量比值为4-6:2.5-5:1;
13.优选地,所述光敏剂为含羧基的二氢卟吩类光敏剂,更优选地,所述光敏剂选自二
氢卟吩e6、二氢卟吩e4及两者组合形成的复合型光敏剂中的至少一种;
14.优选地,所述交联聚合的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h;所述酰胺反应的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h。
15.优选地,所述sirna为pak4 sirna;
16.优选地,所述pak4 sirna含有完全反向互补的正义链和反义链,所述正义链和所述反义链的核苷酸序列分别为如seq id no.1和seq id no.2、seq id no.3和seq id no.4、seq id no.5和seq id no.6、seq id no.7和seq id no.8或seq id no.9和seq id no.10中的任意一对所示。
17.优选地,所述外泌体分离自间充质干细胞、肿瘤细胞、肿瘤干细胞、nk细胞和巨噬细胞中的至少一种。
18.本发明第二方面提供一种sirna输送载体的制备方法,包括以下步骤:
19.(1)将sirna与光激活聚合物进行孵育,形成载药纳米核心;
20.(2)将步骤(1)得到的所述载药纳米核心与外泌体混合后挤出,使得所述外泌体包裹在所述载药纳米核心的外周。
21.优选地,所述外泌体、所述光激活聚合物与所述sirna的质量比为2.5-100:5-25:1,优选为10-50:8-20:1;
22.优选地,所述sirna输送载体的平均粒径为100-200nm。
23.优选地,所述光激活聚合物的制备过程包括:将聚乙烯亚胺与酮缩硫醇进行交联聚合形成交联物,将所述交联物与光敏剂混合进行酰胺反应后,进行透析、干燥;
24.优选地,所述聚乙烯亚胺、光敏剂与酮缩硫醇的摩尔量比值为4-6:2.5-5:1;
25.优选地,所述光敏剂为含羧基的二氢卟吩类光敏剂,更优选地,所述光敏剂选自二氢卟吩e6、二氢卟吩e4及两者组合形成的复合型光敏剂中的至少一种;
26.优选地,所述交联聚合的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h;所述酰胺反应的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h;
27.优选地,所述sirna为pak4 sirna;
28.优选地,所述外泌体分离自间充质干细胞、肿瘤细胞、肿瘤干细胞、nk细胞和巨噬细胞中的至少一种。
29.优选地,步骤(1)中所述孵育的条件包括:温度为10-40℃,时间为10-20min;
30.步骤(2)中所述混合的条件包括:温度为10-40℃,吹打次数为10-20次。
31.本发明第三方面提供上述的sirna输送载体和上述的制备方法制得的sirna输送载体在制备用于肿瘤免疫治疗药物中的应用;
32.优选地,所述肿瘤免疫治疗药物为用于抑制肿瘤细胞中pak4基因表达的药物、用于阻断肿瘤细胞中wnt/β-catenin信号通路的药物和用于促进肿瘤的瘤内免疫浸润的药物中的至少一种。
33.通过上述技术方案,本发明的有益效果为:
34.1、本发明提供的sirna输送载体可实现sirna诱导的肿瘤免疫浸润与光动力免疫治疗在抗肿瘤机制上的有机互补,同时提高肿瘤组织中杀伤性t细胞的活性和数量,在解除
肿瘤免疫逃逸、增敏肿瘤免疫治疗方面具有良好的应用前景;该sirna输送载体在负载pak4 sirna时,可实现对肿瘤组织的靶向作用,从源头上有效沉默肿瘤pak4的表达,使得已激活的t细胞能够长驱直入肿瘤,浸润肿瘤组织。
35.2、本发明提供的sirna输送载体采用光激活聚合物作为sirna的载体,且光激活聚合物中含有光敏剂,将光敏剂与sirna进行结合治疗,能够在激光照射下诱导肿瘤细胞发生免疫原性死亡,增强肿瘤免疫原性,激活树突细胞和肿瘤特异的杀伤性t细胞;
36.3、本发明中sirna输送载体的制备方法采用自下而上与自上而下相结合的仿生手段,促进外泌体包裹载药纳米核心,充分利用聚合物材料高效包载sirna、光响应释放及光免疫治疗等特性,以及外泌体良好的生物相容性、稳定性和肿瘤趋向性,从而形成优势互补,使得sirna输送载体可有效提高肿瘤免疫原性、促进瘤内免疫浸润、增敏肿瘤免疫治疗。
附图说明
37.图1是实施例1中光激活聚合物(pa)的氢谱核磁(1h nmr)图;
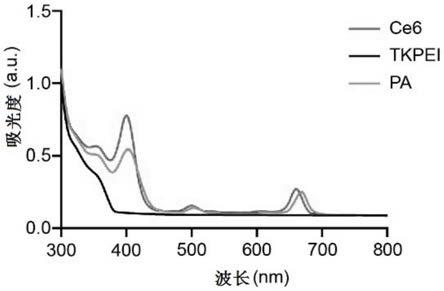
38.图2是实施例1中光激活聚合物(pa)的紫外-可见光谱扫描图,ce6及tkpei设为对照;
39.图3是实施例1中外泌体的结构检测图,其中3a为外泌体的蛋白标志物电泳图、3b为外泌体的nta粒径分布图、3c为外泌体的透射电镜图(scale bar(左):100nm,(右):50nm);
40.图4是实施例1中pas及pasev光照前后的透射电镜外观图及粒径大小,其中4a为sirna输送载体(pasev)的透射电子显微镜观察图,其中pas为未包裹外泌体的纳米复合物内芯的对照组,scale bar(左及右):500nm,(中):50nm;4b为包裹前的pas及包裹后的pasev的粒径及电位结果;
41.图5是实施例1中激光共聚焦检测纳米复合物内芯与外泌体(evs)的共定位情况,scale bar:10μm,其中nucleus为细胞核,merged为nucleus、pas、evs三种通道荧光合并得到的共聚焦图片;
42.图6是pak4 mrna表达水平和蛋白表达水平的检测结果,其中6a为测试例1中荧光定量pcr检测小鼠b16f10和小鼠ct26细胞中pak4 mrna的表达水平,6b为测试例2中western blot检测小鼠b16f10和小鼠ct26细胞中蛋白的表达水平;
43.图7是测试例3中体外检测pasev诱导小鼠b16f10细胞发生免疫原性死亡级联反应;其中7a和7b为激光共聚焦检测crt外翻及hmgb1释放,scale bar:10μm;7c为流式检测crt外翻;7d为elisa检测hmgb1释放;7e为atp检测试剂盒检测atp释放,7a中nucleus为细胞核,membrane为细胞膜,merged为nucleus、membrane、crt三种通道荧光合并得到的共聚焦图片,7b中nucleus为细胞核,merged为bf、nucleus、hmgb1三种通道荧光合并得到的共聚焦图片;
44.图8是测试例4中pasev的肿瘤趋向性及血液中的稳定性结果,其中8a为静脉给药后小鼠活体成像结果,8b和8c为肿瘤与主要器官的荧光成像及其定量结果,8d和8e为静脉给药后不同时间点所取血样的荧光定量及图像;
45.图9是测试例5中pasev体内协同抗肿瘤效果的结果,其中9a为pasev在小鼠b16f10肿瘤模型中的协同抗肿瘤效果,9b为pasev在小鼠ct26肿瘤模型中的协同抗肿瘤效果;
72h,冻干,即得光激活聚合物(pa)。
58.根据本发明,为了提升光激活聚合物对sirna的负载效果,以及对光动力免疫疗法的促进作用,优选地,所述聚乙烯亚胺、光敏剂与酮缩硫醇的摩尔量比值为4-6:2.5-5:1。
59.根据本发明,所述光敏剂的物质种类没有特别的限定,只要能够与聚乙烯亚胺、酮缩硫醇形成相应的光激活聚合物即可。优选地,所述光敏剂为含羧基的二氢卟吩类光敏剂,进一步优选地,所述光敏剂选自二氢卟吩e6、二氢卟吩e4及二者组合形成的复合型光敏剂中的至少一种。上述物质均为本领域的常规选择,均可以通过商购获得。
60.根据本发明,优选地,所述交联聚合的条件包括:温度为10-40℃,具体可以为10℃、20℃、30℃、40℃,或上述任意两个数值所构成的范围中的任意值;搅拌速率为100-200rpm,具体可以为100rpm、120rpm、140rpm、160rpm、100rpm、200rpm,或上述任意两个数值所构成的范围中的任意值;时间为24-48h,具体可以为24h、30h、36h、42h、48h,或上述任意两个数值所构成的范围中的任意值;所述酰胺反应的条件包括:温度为10-40℃具体可以为10℃、20℃、30℃、40℃,或上述任意两个数值所构成的范围中的任意值;搅拌速率为100-200rpm具体可以为100rpm、120rpm、140rpm、160rpm、100rpm、200rpm,或上述任意两个数值所构成的范围中的任意值;时间为24-48h,具体可以为24h、30h、36h、42h、48h,或上述任意两个数值所构成的范围中的任意值。
61.根据本发明,sirna输送载体可以负载输送任意一种能够用于抗肿瘤的sirna。优选地,所述sirna为针对pak4设计的sirna,即pak4 sirna。
62.根据本发明,优选地,所述pak4 sirna含有完全反向互补的正义链和反义链,sirna正义链的核苷酸序列如seq id no.1所示,sirna反义链的核苷酸序列如seq id no.2所示;
63.seq id no.1:5
’‑
cagcaugagcagaaguuca-3’,
64.seq id no.2:5
’‑
ugaacuucugcucaugcugau-3’;
65.或者,sirna正义链的核苷酸序列如seq id no.3所示,sirna反义链的核苷酸序列如seq id no.4所示;
66.seq id no.3:5
’‑
gcccaaaucuucgagggau-3’,
67.seq id no.4:5
’‑
aucccucgaagauuugggccu-3’;
68.或者,sirna正义链的核苷酸序列如seq id no.5所示,sirna反义链的核苷酸序列如seq id no.6所示;
69.seq id no.5:5
’‑
gcaggcccuuuaacacaua-3’,
70.seq id no.6:5
’‑
uauguguuaaagggccugcca-3’;
71.或者,sirna正义链的核苷酸序列如seq id no.7所示,sirna反义链的核苷酸序列如seq id no.8所示;
72.seq id no.7:5
’‑
gacgugaacugcucuucaa-3’,
73.seq id no.8:5
’‑
uugaagagcaguucacgucuu-3’;
74.或者,sirna正义链的核苷酸序列如seq id no.9所示,sirna反义链的核苷酸序列如seq id no.10所示;
75.seq id no.9:5
’‑
ggaugaacgaggaacagau-3’,
76.seq id no.10:5
’‑
aucuguuccucguucauccug-3’。
77.根据本发明,为了进一步提高sirna对pak4的抑制效果和稳定性,对sirna的正义链和反义链进行稳定化修饰,包括:按照5'末端到3'末端的方向,正义链的第5、7、8、9位的核苷酸为氟代修饰的核苷酸,正义链中其余位置的核苷酸为甲氧基修饰的核苷酸,反义链的第2、6、8、9、14、16位的核苷酸为氟代修饰的核苷酸,反义链中其余位置的核苷酸为甲氧基修饰的核苷酸;正义链的5'末端端部第1个核苷酸和第2个核苷酸之间、第2个核苷酸和第3个核苷酸之间,以及反义链的5'末端端部第1个核苷酸和第2个核苷酸之间、第2个核苷酸和第3个核苷酸之间,3'末端端部第1个核苷酸和第2个核苷酸之间、第2个核苷酸和第3个核苷酸之间均具有修饰基团的磷酸酯基。
78.修饰后的sirna序列信息如表1所示:
79.表1
[0080][0081][0082]
根据本发明,优选地,所述外泌体分离自间充质干细胞、肿瘤细胞、肿瘤干细胞、nk细胞和巨噬细胞中的至少一种。
[0083]
根据本发明,外泌体的具体制备方法包括:将细胞进行原代培养后,利用差速离心法、超滤离心法等方法提取外泌体。示例性地,外泌体的提取过程为:在0-10℃的低温下,以100-800g离心力除去培养液中的细胞及较大的碎片;在0-10℃的低温下,以1000-10000g离心力除去培养液中其余细胞碎片;在0-10℃的低温下,以100000-200000g离心力离心1.5-4h收集外泌体。
[0084]
第二方面,本发明提供一种sirna输送载体的制备方法,包括以下步骤:
[0085]
(1)将sirna与光激活聚合物进行孵育,形成载药纳米核心;
[0086]
(2)将步骤(1)得到的所述载药纳米核心与外泌体混合后挤出,使得所述外泌体包裹在所述载药纳米核心的外周。
[0087]
根据本发明,优选地,所述外泌体、所述光激活聚合物与所述sirna的质量比为2.5-100:5-25:1,优选为10-50:8-20:1。
[0088]
根据本发明,优选地,所述sirna输送载体的平均粒径为100-200nm。
[0089]
根据本发明,优选地,所述光激活聚合物的制备过程包括:将聚乙烯亚胺与酮缩硫醇进行交联聚合形成交联物,将所述交联物与光敏剂混合进行酰胺反应后,进行透析、干燥。
[0090]
根据本发明,优选地,所述聚乙烯亚胺、光敏剂与酮缩硫醇的摩尔量比值为4-6:2.5-5:1。
[0091]
优选地,所述光敏剂为含羧基的二氢卟吩类光敏剂,进一步优选地,所述光敏剂选自二氢卟吩e6、二氢卟吩e4及二者组合形成的复合型光敏剂中的至少一种。
[0092]
根据本发明,优选地,所述交联聚合的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h;所述酰胺反应的条件包括:温度为10-40℃,搅拌速率为100-200rpm,时间为24-48h。
[0093]
根据本发明,优选地,所述sirna为pak4 sirna。
[0094]
根据本发明,优选地,所述外泌体分离自间充质干细胞、肿瘤细胞、肿瘤干细胞、nk细胞和巨噬细胞中的至少一种。
[0095]
根据本发明,为了促进光激活聚合物对sirna的负载效果,以及对光动力免疫疗法的促进作用,优选地,步骤(1)中所述孵育的条件包括:温度为10-40℃,具体可以为10℃、20℃、30℃、40℃,或上述任意两个数值所构成的范围中的任意值;时间为10-20min,具体可以为10min、12min、14min、16min、18min、20min,或上述任意两个数值所构成的范围中的任意值;步骤(2)中所述混合的条件包括:温度为10-40℃,具体可以为10℃、20℃、30℃、40℃,或上述任意两个数值所构成的范围中的任意值;吹打次数为10-20次,具体可以为10次、12次、14次、16次、18次、20次,或上述任意两个数值所构成的范围中的任意值。
[0096]
第三方面,本发明提供上述的sirna输送载体和上述的制备方法制得的sirna输送载体在制备用于肿瘤免疫治疗药物中的应用;
[0097]
根据本发明,优选地,所述肿瘤免疫治疗药物为用于抑制肿瘤细胞中pak4基因表达的药物、用于阻断肿瘤细胞中wnt/β-catenin信号通路的药物和用于促进肿瘤的瘤内免疫浸润的药物中的至少一种。
[0098]
根据本发明,优选地,所述肿瘤细胞为小鼠黑色素瘤b16f10细胞和小鼠结肠癌ct26细胞。
[0099]
本发明提供的sirna输送载体,在负载运输pak4 sirna时,还可用于诱导肿瘤细胞发生免疫原性死亡,协同抑制肿瘤生长等方面。
[0100]
以下将通过实施例对本发明进行详细描述。
[0101]
以下实施例中,小鼠巨噬细胞raw 264.7、小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26购自中国医学科学院基础医学研究所,转染试剂2000购自invitrogen公司,逆转录试剂盒购自南京诺唯赞生物科技股份有限公司,pcr反应体系的试剂购自翌圣生物科技股份有限公司,bca蛋白检测试剂盒、细胞核蛋白提取试剂盒和atp检测试剂盒购自上海碧云天生物技术有限公司,酶联免疫吸附检测(elisa)试剂盒购自南京金益佰生物科技有限公司。
[0102]
实施例1
[0103]
(1)将0.2mol酮缩硫醇(tk)与0.6mol的edc和0.6mol的nhs溶于dmf中,然后将溶有1mol聚乙烯亚胺(pei)的dmf溶液逐滴加入,在温度为25℃、搅拌速率为150rpm的条件下搅拌36h进行交联聚合形成交联物(tkpei),最后将已被edc和nhs活化的0.8mol二氢卟吩e6(ce6)逐滴加入上述交联物中,在温度为25℃、搅拌速率为150rpm的条件下搅拌36h后,经透析50h,冻干,得到光激活聚合物(pa);通过核磁共振和紫外-可见光谱对pa的结构进行确证,结果见图1和图2,pa的氢谱核磁(1h nmr)图(图1)表明tk成功与pei交联,pa的紫外-可见光谱扫描图(图2)表明pa中含ce6的特征吸收峰,综上所述光激活聚合物pa被成功合成;
[0104]
(2)将小鼠巨噬细胞raw 264.7培养在含10%无外泌体血清和1%青霉素链霉素的dmem培养基中,于温度为37℃、含5%co2的饱和湿度环境中培养48h,收集细胞培养液;将细胞培养液在5℃的低温下,以500g离心力除去培养液中的细胞及较大碎片;在5℃的低温下,以5000g离心力除去培养液中其余杂质及碎片;在5℃的低温下,以150000g离心力离心3h收集外泌体evs;用bca蛋白检测试剂盒对外泌体的蛋白浓度进行定量,通过检测外泌体蛋白标志物、粒径大小及外观对其进行结构确证,结果如图3所示,本发明提取的外泌体为经典的茶托状结构,粒径在40-150nm,峰粒径为126.7nm,并高表达外泌体标志性蛋白cd9、cd63及cd81,不含外泌体的阴性标志性蛋白calnexin和apob100,综上所述,外泌体被成功提取;
[0105]
(3)将步骤(1)得到的光激活聚合物与sirna(序列如表1中所示的sipak4(1))以质量比10:1混合后在温度为25℃的条件下共孵育15min,以形成pa/sirna复合物(pas),将复合物与步骤(2)得到的外泌体混合后(外泌体与光激活聚合物的质量比为1:1),在温度为25℃下反复吹打10次,然后用脂质体挤出器挤出,通过200nm的碳酸酯膜11-21次,得到sirna输送载体(pasev);
[0106]
采用透射电镜观察pas及pasev光照前后的外观,通过动态光散射法检测pasev的粒径大小,结果见图4;为进一步考察外泌体是否包裹在复合物(pas)表面,用dio膜染料对外泌体通过进行标记,通过共聚焦显微镜观察外泌体与pas的共定位情况,结果见图5(为了更好地显示位置结构特征,以彩色图片表示)。
[0107]
如图4a所示,步骤(3)得到的sirna输送载体(pasev)为核壳结构,以pa/sirna复合物(pas)为内芯,外泌体为包覆在复合物表面的外膜,光照后pas和pasev的结构均发生降解;如图4b所示,膜包裹后纳米粒的粒径有所增加,电位有所下降,即由pas的99nm增加到pasev的119nm,电位由16mv降到-7mv;如图5所示,入胞后外泌体和复合物内芯pas均分布在细胞核周围,且pas与外泌体evs具有很好的共定位效果,综合该结果与图4的透射电镜及动
态光散射结果可知,外泌体包裹在复合物内芯的表面。
[0108]
实施例2
[0109]
(1)将0.2mol酮缩硫醇(tk)与0.6mol的edc和0.6mol的nhs溶于dmf中,然后将溶有0.8mol聚乙烯亚胺(pei)的dmf溶液逐滴加入,在温度为10℃、搅拌速率为200rpm的条件下搅拌24h进行交联聚合形成交联物,最后将已被edc和nhs活化的0.5mol二氢卟吩e6(ce6)逐滴加入上述交联物中,在温度为10℃、搅拌速率为200rpm的条件下搅拌24h后,经透析50h,冻干,得到光激活聚合物(pa);
[0110]
(2)将小鼠巨噬细胞raw 264.7培养在含10%无外泌体血清和1%青霉素链霉素的dmem培养基中,于温度为37℃、含5%co2的饱和湿度环境中培养48h,收集细胞培养液;将细胞培养液在0℃的低温下,以800g离心力除去培养液中的细胞及较大碎片;在0℃的低温下,以10000g离心力除去培养液中其余杂质及碎片;在0℃的低温下,以200000g离心力离心1.5h收集外泌体evs;
[0111]
(3)将步骤(1)得到的光激活聚合物与sirna(序列如表1中所示的sipak4(2))以质量比8:1混合后在温度为10℃的条件下共孵育20min,以形成pa/sirna复合物(pas),将复合物与步骤(2)得到的外泌体混合后(外泌体与光激活聚合物的质量比为1:1),在温度为10℃下反复吹打15次,然后用脂质体挤出器挤出,通过150nm的碳酸酯膜11-21次,得到sirna输送载体(pasev)。
[0112]
实施例3
[0113]
(1)将0.2mol酮缩硫醇(tk)与0.6mol的edc和0.6mol的nhs溶于dmf中,然后将溶有1.2mol聚乙烯亚胺(pei)的dmf溶液逐滴加入,在温度为40℃、搅拌速率为100rpm的条件下搅拌48h进行交联聚合形成交联物,最后将已被edc和nhs活化的1mol二氢卟吩e6(ce6)逐滴加入上述交联物中,在温度为40℃、搅拌速率为100rpm的条件下搅拌48h后,经透析50h,冻干,得到光激活聚合物(pa);
[0114]
(2)将小鼠巨噬细胞raw 264.7培养在含10%无外泌体血清和1%青霉素链霉素的dmem培养基中,于温度为37℃、含5%co2的饱和湿度环境中培养48h,收集细胞培养液;将细胞培养液在10℃的低温下,以100g离心力除去培养液中的细胞及较大碎片;在10℃的低温下,以1000g离心力除去培养液中其余杂质及碎片;在10℃的低温下,以100000g离心力离心4h收集外泌体evs;
[0115]
(3)将步骤(1)得到的光激活聚合物与sirna(序列如表1中所示的sipak4(3))以质量比20:1混合后在温度为40℃的条件下共孵育10min,以形成pa/sirna复合物(pas),将复合物与步骤(2)得到的外泌体混合后(外泌体与光激活聚合物的质量比为2:1),在温度为37℃下反复吹打18次,然后用脂质体挤出器挤出,通过200nm的碳酸酯膜11-21次,得到sirna输送载体(pasev)。
[0116]
测试例1荧光定量pcr检测肿瘤细胞中pak4 mrna表达水平
[0117]
(1)在6孔板内加入含10%胎牛血清和1%青霉素链霉素的dmem培养基,将小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26以2
×
105/孔接种于6孔板中,在温度为37℃、co2含量为5体积%的培养箱中过夜培养;将培养基换成opti-mem培养基,将实施例1得到的pas和pasev按照如下分组进行转染:pbs,sipak4(1),pas
sinc
ev l+,pasev l-,pas l+及pasev l+,其中pbs组为以pbs缓冲液作为转染底物的空白组,pas
sinc
ev为将实施例1中的sipak4
(1)替换为无基因抑制功能的sinc制得的输送载体组,l+为光照组,即660nm激光(0.2w/cm2)照射1-2min,l-为不经过光照处理组;转染过程按照转染试剂2000说明书进行,sirna终浓度分别为100nm,最后收集细胞,用预冷pbs洗3遍,加入trizol提取总rna;
[0118]
其中,无基因抑制功能的sinc核苷酸序列如下:
[0119]
sinc正义链(seq id no.15):ccuugaggcauacuucaaadtdt,
[0120]
sinc反义链(seq id no.16):uuugaaguaugccucaaggdtdt;
[0121]
(2)采用逆转录试剂盒将每组细胞的总rna逆转录为cdna,具体操作如下,首先配制下列反应体系以去除基因组dna,即4
×
g dna wiper mix:4.0μl;total rna:1000ng,无核酸酶水加至16μl,混匀后获得的混合物于42℃孵育2min,然后将5
×
qrt supermix ii:4μl加入上述的混合物中,混匀后,于50℃孵育15min,85℃孵育5sec,即可;
[0122]
(3)逆转录完成后,配制pcr反应体系:qpcrgreen master mix:10μl;pcr forward primer(10μm):0.5μl;pcr reverse primer(10μm):0.5μl;cdna模板:1μl;无核酸酶水加至20μl;
[0123]
pcr所用的引物序列如下:
[0124]
pak4基因:
[0125]
上游(seq id no.11):5
’‑
cgccaagccgatgagtaac-3’,
[0126]
下游(seq id no.12):5
’‑
agggccttagcacagagttt-3’;
[0127]
gapdh基因
[0128]
上游(seq id no.13):5
’‑
aactttggcattgtggaagggctc-3’,
[0129]
下游(seq id no.14):5
’‑
tggaagagtgggagttgctgttga-3’;
[0130]
pcr循环程序为:(1)95℃,5min,1cycle;(2)95℃,10s,40cycle;(3)55℃,20s,40cycle;(4)72℃,20s,40cycles;(5)95℃,1s,1cycle。
[0131]
以gapdh基因为内参,采用pcr仪检测pak4基因及gapdh基因的ct值,最后将pbs处理组设为对照,以对照组细胞中pak4 mrna的表达量为100%,计算出每组细胞中vegf mrna的相对百分含量,结果见图6a。
[0132]
测试例2 western blot考察pak4蛋白表达水平
[0133]
按照测试例1中的步骤(1)所示的方法转染小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26,转染结束后,用ripa(含1%pmsf)裂解细胞,用bca蛋白检测试剂盒对蛋白浓度进行定量;将蛋白进行sds-page电泳,转膜,5%脱脂牛奶封闭,与pak4一抗于4℃过夜孵育,结束后用tbst缓冲液(2.42g tris,8g nacl,1ml吐温20溶解于1l超纯水中)洗膜,室温孵育二抗,继续用tbst缓冲液洗膜,将ecl发光液均匀地涂抹于pvdf膜,用5200multi天能凝胶成像系统成像,结果见图6b。
[0134]
如图6a和6b所示,以市售转染试剂lipofectamine 2000作为阳性对照,在小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26两种细胞中,pasev经激光照射后,可有效抑制pak4 mrna及蛋白的表达。
[0135]
测试例3体外考察pasev诱导免疫原性细胞死亡级联反应
[0136]
3.1免疫荧光检测crt外翻及hmgb1释放
[0137]
在6孔板内加入含10%胎牛血清和1%青霉素链霉素的dmem培养基,将小鼠黑色素瘤细胞b16f10以1
×
105/孔接种于共聚焦专用小皿中,在温度为37℃、co2含量为5体积%的
培养箱中过夜培养;将培养基换成opti-mem培养基,将实施例1得到的pas和pasev按照如下分组进行转染:pbs,pas l-,pas l+,pasev l-及pasev l+,其中l+为光照组,即转染4h后用660nm激光(0.2w/cm2)照射2min,转染过程按照转染试剂2000说明书进行,细胞继续培养2h,sirna终浓度分别为100nm,细胞用预冷pbs洗3遍,4%多聚甲醛固定,封闭液封闭1h后分别与crt抗体和hmgb1抗体室温孵育1h,清洗,用alexa fluor 488标记的二抗室温孵育1h后,清洗;用hoechst 33342染细胞核,crt外翻组用dir染细胞膜后,用共聚焦显微镜进行观察,结果见图7a和7b。
[0138]
3.2流式检测crt外翻
[0139]
将小鼠黑色素瘤细胞b16f10以1
×
105/孔接种于12孔板中,按照上述3.1中的方法进行转染,然后采用crt抗体孵育1h,清洗,与alexa fluor 488标记的二抗室温孵育1h,清洗后,收集细胞进行流式检测,结果见图7c。
[0140]
3.3 elisa检测细胞上清液中hmgb1的释放
[0141]
将小鼠黑色素瘤细胞b16f10以1
×
105/孔接种于12孔板中,按照上述3.1中的方法进行转染,转染结束后收集细胞上清,根据酶联免疫吸附检测(elisa)试剂盒说明书检测细胞培养液中hmgb1的浓度,结果见图7d。
[0142]
3.4细胞上清液中atp检测
[0143]
将小鼠黑色素瘤细胞b16f10以1
×
105/孔接种于12孔板中,按照上述3.1中的方法进行转染,转染结束后收集细胞上清,根据atp检测试剂盒说明书检测细胞培养液中atp水平,结果见图7e。
[0144]
如图7a和7c所示,pas l+和pasev l+处理细胞后可引起crt由胞内外翻到细胞表面,而对应的无光照处理组则无crt外翻现象;与pas l-和pasev l-相比,pas l+和pasev l+可引起hmgb1的释放量增加为原来的1.6及1.9倍(图7b和7d);相应地,与对应的无光照处理组,pas l+和pasev l+可显著增加atp的释放量(图7e)。综上所述,pasev l+可有效引起肿瘤细胞发生免疫原性死亡。
[0145]
测试例4 pasev的肿瘤趋向性及血液稳定性
[0146]
4.1 pasev的肿瘤趋向性
[0147]
将小鼠黑色素瘤细胞b16f10细胞以1
×
106个/只接种于c57bl/6j小鼠(雌,6-8周)皮下,建立小鼠b16f10肿瘤模型,待肿瘤体积长至200mm3,将小鼠随机分为3组,包括pbs组(以pbs为药物),pas组(以实施例1得到的pas为药物)和pasev组(以实施例1得到的pasev为药物);静脉注射给药后,于1,4,8,12,24及48h用活体成像仪观察肿瘤部位pa的荧光,结果见图8a(为了更好地显示活体成像效果,以彩色图片表示),于48h将小鼠处死,取肿瘤及心、肝、脾、肺及肾等主要脏器进行活体成像,并进行荧光强度的定量分析,结果见图8b和8c(为了更好地显示荧光效果,图8b以彩色图片表示)。
[0148]
4.2 pasev的血液稳定性
[0149]
将正常的c57bl/6j小鼠(雌,6-8周)小鼠随机分两组,分别静脉注射实施例1得到的pas及实施例1得到的pasev,同时以静脉注射pbs的小鼠作为对照,于给药后0.5,1,2,3,8及12h分别收集10μl血样用于活体成像,观察pa的荧光信号,并对荧光强度进行定量分析,结果见图8d和8e(为了更好地显示荧光效果,图8e以彩色图片表示)。
[0150]
如图8a所示,静脉注射4h后,pasev在肿瘤部位的荧光信号显著高于pas;游离肿瘤
及主要器官的成像结果显示48h后,pasev在肿瘤部位的荧光强度是pas的7.9倍(图8b和8c),表明与pas相比,pasev具有更好的肿瘤趋向性。如图8d和8e所示,静脉注射后pas很快被清除,而pasev则具有更好的血液循环稳定性,采用单室模型计算,pasev的半衰期约为3.9h,显著高于pas的0.9h。
[0151]
测试例5 pasev体内协同抗肿瘤效果
[0152]
将小鼠黑色素瘤细胞b16f10以1
×
106个/只接种于c57bl/6j小鼠(雌,6-8周)皮下,建立小鼠b16f10肿瘤模型,待肿瘤体积长至80mm3,将小鼠随机分为6组,包括pbs组(以pbs缓冲液为药物),sipak4组(以表1所示的sipak4(1)为药物),pas
sinc
ev l+组(以实施例1中的sipak4(1)替换为无基因抑制功能的sinc制得的输送载体为药物、进行光照处理),pasev l-组(以实施例1得到的pasev为药物、无光照处理),pas l+组(以实施例1得到的pas为药物、进行光照处理)和pasev l+组(以实施例1得到的pasev为药物、进行光照处理),小鼠每隔一天尾静脉给予不同的制剂一次,共给药四次;每次给完药后6-8h,采用660nm激光(功率:0.2w/cm2)对光照组光照10min,每隔一天检测肿瘤大小,计算肿瘤体积,结果见图9a。
[0153]
在小鼠结肠癌细胞ct26肿瘤模型中,将小鼠结肠癌细胞ct26细胞分别以0.5
×
106个/只和1
×
106个/只分别接种于balb/c小鼠(雌,6-8周)左右两侧背部皮下,分组以及给药方式同小鼠黑色素瘤细胞b16f10肿瘤模型,仅对小鼠右侧肿瘤(近端瘤)进行光照处理,每隔两天检测肿瘤大小,计算肿瘤体积,结果见图9b。
[0154]
如图9a所示,在pbs组与sipak4处理组中,肿瘤的生长速率无明显区别;阴性sirna组(pas
sinc
ev l+)、无光照组(pasev l-)和无外泌体包裹组(pas l+)与pbs组比均不同程度地抑制肿瘤生长;与其他组相比,pasev l+的抑瘤效果最好。在ct26的近端和远端肿瘤中也观察到相似的抑瘤效果(图9b),这表明pasev l+协同pak4沉默和光免疫治疗,增强了抗肿瘤疗效。
[0155]
测试例6 pasev诱导体内icd效应
[0156]
按照测试例5的方法分别建立小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26的肿瘤模型并给药,给药14和21天后分别取b16f10和右侧ct26肿瘤组织,制备冰冻切片样品,切片,分别用crt及hmgb1抗体进行免疫荧光染色,最后用共聚焦显微镜观察肿瘤组织中crt及hmgb1表达情况,结果见图10(为了更好地显示表达效果,以彩色图片表示)。
[0157]
如图10所示,与pbs、sipak4、pasev l-及pas l+组相比,pasev l+可显著增加crt的表达和hmgb1的释放,pas
sinc
ev l+与pasev l+组相当,该结果表明pasev l+在体内可有效诱导肿瘤发生免疫原性细胞死亡。
[0158]
测试例7流式检测肿瘤组织内部cd8
+
t细胞浸润
[0159]
按照测试例5的方法分别建立小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26的肿瘤模型并给药,给药14和21天后分别取b16f10和右侧ct26肿瘤组织,将其撵过细胞筛,制备单细胞悬液,然后与cd3、cd4及cd8流式抗体于4℃孵育30min,清洗离心后用流式进行检测,结果见图11(为了更好地显示检测效果,以彩色图片表示)。
[0160]
如图11所示,pasev l+处理后,肿瘤组织中杀伤性(cd8
+
)t细胞的比例增加约10.4倍,且与pas
sinc
ev l+,pasev l-及pas l+相比,pasev l+处理组可更有效地促进瘤内杀伤性(cd8
+
)t细胞的浸润,揭示其可引发更有效的抗肿瘤免疫反应。
[0161]
测试例8免疫荧光检测肿瘤组织内部cd8
+
t细胞浸润
[0162]
按照测试例5的方法分别建立小鼠黑色素瘤细胞b16f10和小鼠结肠癌细胞ct26的肿瘤模型并给药,给药14和21天后分别取b16f10和右侧ct26肿瘤组织,制备冰冻切片样品,切片,用cd8
+
t细胞的抗体进行免疫荧光染色,最后用共聚焦显微镜观察整个肿瘤组织内部cd8
+
t细胞的荧光信号,结果见图12(为了更好地显示荧光效果,以彩色图片表示)。
[0163]
如图12所示,pas
sinc
ev l+,pasev l-及pas l+组与pbs及sipak4组相比,肿瘤组织杀伤性(cd8
+
)t细胞的浸润均得到一定程度的改善。值得注意的是,pas
sinc
ev l+虽可增加肿瘤周围杀伤性t细胞的数量,但其肿瘤内部的浸润量却显著低于pasev l+处理组。由此可见,pasev l+可显著促进杀伤性(cd8
+
)t细胞浸润到小鼠b16f10和ct26肿瘤组织内部。综上所述,本发明的sirna输送载体在解除小鼠黑色素瘤和小鼠结肠癌的免疫逃逸及增敏肿瘤免疫治疗方面具有良好的应用前景。
[0164]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
