用于治疗纤维化癌症的方法
1.本技术是申请号为201480062728.5的专利申请的分案申请。
2.相关申请的交叉引用
3.本技术要求2013年10月8日提交的美国临时专利申请序列号61/888,269、2014年5月13日提交的美国临时专利申请序列号61/992,807、2014年5月29日提交的美国临时专利申请序列号62/004,828和2014年5月29日提交的美国临时专利申请序列号62/004,836的优先权和利益,所述美国临时专利申请序列号的公开内容以其整体通过引用并入本文。
4.序列表
5.本技术含有已经以ascii形式电子提交且在此以其整体通过引用并入的序列表。所述ascii拷贝,在2014年10月6日生成,被命名为104112-0022-wo1_sl.txt,且大小为7,604字节。
6.发明背景
7.某些癌症和增殖病症的特征在于代替正常组织的肿瘤之内和周围的致密结缔组织的生长。此类纤维化癌症难以治疗,因为化疗剂经常无法穿透癌细胞周围的致密纤维基质。在其它癌症诸如骨髓纤维化中,纤维化代替健康器官组织导致器官功能不足,其有助于癌症的症状。尽管存在侵入性治疗方案,但纤维化癌症对化疗剂的耐受性已经导致不良的临床后果。因此,仍然需要开发用于治疗纤维化癌症的新型治疗策略。
8.发明概述
9.在某些方面,本公开提供用于在患者中治疗纤维化癌症或改善抗癌治疗剂的效力的方法,其包括向有需要的患者施用治疗有效量的血清淀粉样蛋白p(sap)激动剂。
10.在某些方面,本公开提供用于在患者中治疗纤维化癌症或改善抗癌治疗剂的效力的方法,所述方法包括向有需要的患者施用治疗有效量的一种或多种sap激动剂以及一种或多种额外的活性剂。
11.在一些实施方案中,所述sap激动剂选自抗-fcγri抗体、抗-fcγrii抗体、抗-fcγriii抗体、交联的抗-fcγr抗体、聚集的igg抗体或交联的igg抗体。
12.在一些实施方案中,所述sap激动剂选自小分子、核酸或多肽。
13.在一些实施方案中,所述sap激动剂是sap多肽,诸如糖基化的人sap多肽。通过实例的方式,所述sap激动剂可以包含sap多肽,诸如糖基化的人sap多肽,诸如糖基化不同于分离自人血清的sap的糖基化的人sap多肽(例如,包含n-连接的寡糖链的人sap,其中所述寡糖链的至少一个分支以α2,3-连接的唾液酸部分终止)。在某些实施方案中,所述sap激动剂是重组人sap(例如,rhsap)。在某些实施方案中,所述sap激动剂包含本领域中也被称为prm-151的重组人sap。duffield(2010)drug news&perspectives,23(5):305-315。任选地,rhsap可以在cho细胞中或在另一种合适的细胞系中制备。在某些实施方案中,任何本文描述的方法包括施用被称为prm-151的重组人sap。
14.在一些实施方案中,所述sap激动剂是包含n-连接的寡糖链的糖基化的人sap多肽,其中所述寡糖链的至少一个分支以α2,3-连接的唾液酸部分终止。在一些实施方案中,所述寡糖链的所有唾液酸化分支以α2,3-连接的唾液酸部分终止。在一些实施方案中,所述
diftitox)、右雷佐生、多西他赛、阿霉素、表阿霉素、依托泊苷、氟达拉滨、氟尿嘧啶(5-fu)、吉西他滨、戈舍瑞林、氢化可的松、羟基脲、伊达比星、异环磷酰胺、干扰素α、伊立替康cpt-11、拉帕替尼、来那度胺、亮丙瑞林、氮芥/氮芥/氮芥/hn2(mechlorethamine/chlormethine/mustine/hn2)、巯嘌呤、甲氨蝶呤、甲基泼尼松龙、丝裂霉素、米托坦、米托蒽醌、奥曲肽、奥普瑞白介素、奥沙利铂、紫杉醇、帕米膦酸钠、培门冬酶、培非格司亭、peg干扰素、培美曲塞、喷司他丁、苯丙氨酸氮芥、普卡霉素/光神霉素、泼尼松、泼尼松龙、丙卡巴肼、雷洛昔芬、罗米司亭、沙格司亭、链佐星、他莫昔芬、替莫唑胺、坦罗莫司、替尼泊苷、沙利度胺、硫鸟嘌呤、thiophosphoamide/塞替派、噻替派、拓扑替康盐酸盐、托瑞米芬、维甲酸、戊柔比星、长春碱、长春新碱、长春地辛、长春瑞滨、伏立诺他、唑来膦酸及其组合。在某些实施方案中,所述方法包括施用所述sap激动剂和额外的抗癌治疗剂,所述额外的抗癌治疗剂是化疗剂,诸如单一化疗剂或两种或更多种化疗剂的组合。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,需要治疗的患者是具有单独化疗难治、不响应或次优响应的癌症的患者,且所述方法改善对化疗的效力和/或响应性。在某些实施方案中,需要治疗的患者是先前已经经历来自单独化疗的治疗益处、但用单独化疗治疗的治疗益处已经达到稳定或基本上达到稳定、或此类治疗不再有效或有效性正在降低的患者。在某些实施方案中,有需要的患者是具有胰腺癌的患者。
22.在一些实施方案中,所述基于抗体的药剂选自、但不限于:阿仑单抗、贝伐单抗、西妥昔单抗、夫芮木单抗、吉妥单抗奥佐米星、替伊莫单抗、伊匹单抗、奥法木单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥单抗、曲妥单抗dm1及其组合。在某些实施方案中,所述方法包括施用所述sap激动剂和额外的抗癌治疗剂,所述额外的抗癌治疗剂是基于抗体的药剂。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,需要治疗的患者是具有单独的特定基于抗体的药剂难治、不响应或次优响应的癌症的患者,且所述方法改善对该药剂的效力和/或响应性。在某些实施方案中,需要治疗的患者是先前已经经历来自单独的基于抗体的药剂的治疗益处、但用单独的基于抗体的药剂治疗的治疗益处已经达到稳定或基本上达到稳定、或此类治疗不再有效或有效性正在降低的患者。在某些实施方案中,所述组合适应于治疗单独的基于抗体的药剂不适应的患者。
23.在一些实施方案中,所述酪氨酸激酶抑制剂选自、但不限于:阿西替尼、巴非替尼、博舒替尼、西地尼布、克唑替尼、达沙替尼、埃罗替尼、吉非替尼、伊马替尼、拉帕替尼、来那替尼、尼罗替尼、帕唑帕尼、帕纳替尼、quizartinib、瑞格非尼、索拉非尼、舒尼替尼、凡德他尼、瓦他拉尼及其组合。在某些实施方案中,所述方法包括施用所述sap激动剂和额外的抗癌治疗剂,所述额外的抗癌治疗剂是酪氨酸激酶抑制剂。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,需要治疗的患者是具有特定酪氨酸激酶抑制剂难治、不响应或次优响应的癌症的患者,且所述方法改善对该药剂的效力和/或响应性。在某些实施方案中,需要治疗的患者是先前已经经历来自单独的酪氨酸激酶抑制剂的治疗益处、但用单独的酪氨酸激酶抑制剂治疗的治疗益处已经达到稳定或基本上达到稳定、或此类治疗不再有效或有效性正在降低的患者。在某些实施方案中,所述组合适应于治疗单独的酪氨酸激酶抑制剂不
适应的患者。
24.在一些实施方案中,所述免疫调节剂选自、但不限于:沙利度胺、来那度胺、泊马度胺、甲氨蝶呤、来氟米特、环磷酰胺、环孢素a、米诺环素、硫唑嘌呤、他克莫司、甲基泼尼松龙、霉酚酸酯、雷帕霉素、咪唑立宾、脱氧精胍菌素、布喹那、5,6-二甲基咕吨酮-4-乙酸(dmxaa)、乳铁蛋白、聚au、聚i:聚c12u、聚-iclc、咪喹莫特、瑞喹莫德、未甲基化的cpg二核苷酸(cpg-odn)和ipilumumab。在某些实施方案中,所述方法包括施用所述sap激动剂和额外的抗癌治疗剂,所述额外的抗癌治疗剂是免疫调节剂。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,需要治疗的患者是具有特定酪氨酸激酶抑制剂难治、不响应或次优响应的癌症的患者,且所述方法改善对该药剂的效力和/或响应性。在某些实施方案中,需要治疗的患者是先前已经经历来自单独的免疫调节剂的治疗益处、但用单独的免疫调节剂治疗的治疗益处已经达到稳定或基本上达到稳定、或此类治疗不再有效或有效性正在降低的患者。在某些实施方案中,所述组合适应于治疗单独的免疫调节剂不适应的患者。
25.在一些实施方案中,所述酪氨酸激酶抑制剂是janus激酶抑制剂,其选自、但不限于:ac-430、azd1480、baricitinib、bms-911453、cep-33779、cyt387、glpg-0634、incb18424、来他替尼、ly2784544、ns-018、pacritinib、鲁索替尼、tg101348(sar302503)、托法替尼、vx-509、r-348、r723及其组合。在某些实施方案中,所述方法包括施用所述sap激动剂和额外的抗癌治疗剂,所述额外的抗癌治疗剂是janus激酶抑制剂。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化的sap多肽,诸如糖基化不同于纯化自血清的人sap的sap多肽。在某些实施方案中,所述janus激酶抑制剂是鲁索替尼。在某些实施方案中,所述sap激动剂包含sap多肽,且所述janus激酶抑制剂包含鲁索替尼。在某些实施方案中,需要治疗的患者是具有特定janus激酶抑制剂难治、不响应或次优响应的癌症的患者,且所述方法改善对该药剂的效力和/或响应性。在某些实施方案中,需要治疗的患者是先前已经经历来自单独的janus激酶抑制剂的治疗益处、但用单独的janus激酶抑制剂治疗的治疗益处已经达到稳定或基本上达到稳定、或此类治疗不再有效或有效性正在降低的患者。在某些实施方案中,所述组合适应于治疗单独的janus激酶抑制剂不适应的患者。在某些实施方案中,所述癌症是骨髓纤维化。
26.在一些实施方案中,所述生物剂选自、但不限于:il-2、il-3、红细胞生成素、g-csf、非格司亭、干扰素α、硼替佐米及其组合。
27.在一些实施方案中,所述抗癌治疗剂选自、但不限于:ab0024、azd1480、at-9283、bms-911543、cyt387、依维莫司、吉维司他、伊美司他、来他替尼、ly2784544、ns-018、口服砷、pacritinib、帕比司他、聚乙二醇干扰素α-2a、泊马度胺、pracinostat、鲁索替尼、tak-901、和tg101438(sar302503)。
28.在一些实施方案中,所述抗癌治疗剂是鲁索替尼。
29.在某些实施方案中,需要治疗的患者是未经治疗的,且在开始用sap激动剂治疗前先前尚未用另一种抗癌治疗剂治疗。一旦开始疗法,它在某些实施方案中是用sap激动剂的单一疗法,且在其它实施方案中是与一种或多种额外的抗癌治疗剂的联合疗法。
30.在一些实施方案中,共同配制所述sap激动剂和一种或多种额外的活性剂(例如,额外的抗癌治疗剂)。在一些实施方案中,同时施用所述sap激动剂和一种或多种额外的活性剂。在一些实施方案中,在彼此产生患者中的重叠疗效的时间内施用所述sap激动剂和一种或多种额外的活性剂。当同时或在彼此产生重叠疗效的时间内施用所述sap激动剂和所述一种或多种额外的活性剂时,所述药剂可以通过相同或不同的施用途径(例如,口服相比于输注)施用。
31.在一些实施方案中,所述癌症选自、但不限于骨髓纤维化、胃癌、胰脏癌、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、毛细胞白血病、多发性骨髓瘤、成神经管细胞瘤、骨髓性白血病和急性淋巴细胞性白血病。
32.在一些实施方案中,所述癌症是骨髓纤维化。在一些实施方案中,所述骨髓纤维化是原发性骨髓纤维化、真性红细胞增多后骨髓纤维化或基本性血小板增多后骨髓纤维化。
33.在一些实施方案中,所述癌症是胰腺癌。
34.在某些实施方案中,任何上述或下述(例如,任何上述或下述癌症)的治疗是用sap单一疗法,诸如本文所述的sap单一疗法。在其它实施方案中,任何上述或下述(例如,任何上述或下述癌症)的治疗是用包含sap激动剂和额外的抗癌剂的联合疗法,诸如本文所述的联合疗法。在某些实施方案中,需要治疗的受试者是未经治疗的,且用sap激动剂、诸如包含单独或与额外的抗癌剂组合的sap多肽的sap激动剂治疗,是接受的第一抗癌疗法。在其它实施方案中,需要治疗的受试者已经具有一种或多种先前的用一种或多种非sap疗法进行治疗。在某些实施方案中,受试者已经具有一种或多种先前的非sap治疗,且已经(i)没有响应,或(ii)最初响应,但不再响应,或(iii)初始响应之后现在正在具有渐降的响应性。无论所述受试者是否已经停止对额外的抗癌剂响应,在某些实施方案中,本公开考虑连续施用与sap激动剂诸如如本文所述的sap激动剂组合的该抗癌剂。
35.在某些实施方案中,所述方法包括治疗纤维化癌症,诸如治疗本文所述的癌症中的任一种,而不诱导或导致治疗相关的骨髓抑制。换言之,在某些实施方案中,本公开的方法不诱导或导致与例如开始治疗前观察到的骨髓抑制相比骨髓抑制的恶化。骨髓抑制可以根据编码不良事件的常用术语(common terminology for coding of adverse events,ctcae)在第0级-第5级的量度上进行评价(参见national cancer institute common terminology criteria for adverse events v4.0,nci,nih,dhhs.2009年5月29日nih出版物#09-7473)。在一些实施方案中,骨髓抑制的一种或多种量度,诸如贫血,没有由于治疗而恶化(例如,从第3级至第4级不良事件;从第2级至第3级不良事件)。
36.在某些实施方案中,本公开的用sap激动剂治疗具有支持用作单一疗法或联合疗法的安全性概况。
37.在某些实施方案中,治疗包括根据给药时间表,诸如本文所述的任何给药时间表,施用所述sap激动剂。在某些实施方案中,施用和/或治疗有效量在本领域中被理解为包括根据剂量和给药时间表施用,所述剂量和给药时间表有效地产生治疗益处,如临床研究方案、完整处方信息、研究者手册中或通过本领域中的专家通常理解的对具有各自疾病的患者有益的量度的改善所定义。在某些实施方案中,所述sap激动剂,无论单独还是作为联合疗法的部分施用,都可以根据提供每周少于一次施用的给药时间表进行施用。在某些实施方案中,此类较不频繁的给药在初始负荷阶段之后发生,在初始负荷阶段中,例如,在治疗
周期的第一周过程中,多次施用所述sap激动剂。
38.在某些实施方案中,治疗改善器官功能(例如,治疗效力包括器官功能的改善;sap激动剂单独或组合施用且改善器官功能)。在某些实施方案中,所述器官是骨髓,且器官功能的改善通过评价以下进行评估:血红蛋白和/或血小板的改善(例如,这些度量中的一种或两种的改善表明器官功能的改善;在血小板的情况下,血小板的改善是指遭受低血小板水平之苦的受试者中血小板增加;在血红蛋白的情况下,血红蛋白的改善是指遭受低血红蛋白水平之苦的受试者中血红蛋白增加)。在某些实施方案中,治疗恢复正常组织,诸如通过减少纤维化(例如,治疗效力包括正常组织的恢复)。在某些实施方案中,恢复正常组织通过评价骨髓纤维化进行评估。
39.本公开考虑本发明的任何特征的所有合适的组合,诸如本文所述的任何方面和实施方案的组合。例如,本公开考虑任何前述方面和实施方案可以彼此和/或与本文公开的任何实施方案进行组合。例如,使用功能和/或结构特征的任何组合描述的sap激动剂可以单独或以联合疗法用于本文描述的任何方法中以治疗本文描述的任何病况、患者群体或患者亚群。
40.附图简述
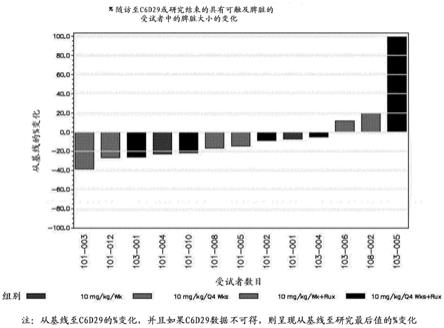
41.图1是描绘随访至c6d29(周期6,第29天)或研究结束的具有可触及脾脏(palpable spleen)的受试者中的脾脏大小的百分数变化的瀑布图。y-轴表明脾脏大小从基线的百分数变化。评估的受试者显示于x-轴上。如从图1显而易见,在来自各处理组(例如,两个不同的给药时间表上的单一疗法和联合疗法)的至少一个患者中观察到甚至在该时间段内脾脏大小从基线的降低。
42.图2描绘随访至c6d29(周期6,第29天)或研究结束的受试者中的mpn-saf总症状评分(tss)的百分数变化的瀑布图。y-轴表明mpn-saf tss从基线的百分数变化。评估的受试者显示于x-轴上。如从图2显而易见,在来自各处理组(例如,两个不同的给药时间表上的单一疗法和联合疗法)的至少一个患者中观察到甚至在该时间段内临床评价从基线的改善。
43.图3显示具有趋势线的散点图,其描绘用prm-151作为单一疗法治疗的24-30周过程中患者101-005中的(a)血红蛋白响应、(b)血小板响应、(c)mpn-saf总症状评分(tss)和(d)脾脏大小响应。在治疗过程中,该患者经历血红蛋白和血小板的增加和mpn-saf tss评分和脾脏大小的降低,如在所示时段中所评价。
44.图4a显示在基线(图4a的左小图)和用prm-151作为单一疗法治疗三个月之后(图4a的右小图)来自患者101-005的骨髓活检样品的网硬蛋白染色。在治疗过程中,该患者经历骨髓纤维化从第2级降低到第0级,如在这两个时间点所评价。图4b显示在基线(图4b的左小图)和用prm-151治疗三个月之后(图4b的中小图)和用prm-151治疗6个月之后(图4b的右小图)来自患者108-003的骨髓活检样品的网硬蛋白染色。在治疗过程中,该患者经历骨髓纤维化从第3级降低到第2级,然后从第2级降低到第1级,如在这三个时间点所评价。
45.发明详述
46.综述
47.本发明提供用于使用sap多肽或sap激动剂作为单一药剂或与抗癌治疗剂组合治疗纤维化癌症和癌症相关的纤维化的新型治疗方案。
48.本发明基于以下发现:sap多肽或sap激动剂可以作为单一药剂有效地治疗一些纤
维化癌症,且可以保证策略的组合治疗一些纤维化癌症。各种癌症和增殖性病况的特征在于致密纤维组织的存在。本发明基于以下发现:可以保证策略的组合治疗纤维化癌症和癌症相关的纤维化。治疗性干预的一个目标是防止或降低纤维化组织的过度积累以允许抗癌治疗剂接近癌细胞。治疗性干预的另一个目标是通过防止或降低过量纤维化组织而恢复正常器官功能。
49.导致纤维化的事件的调节涉及至少两个主要事件。一个是纤维细胞的增殖和分化。纤维细胞是衍生自外周血单核细胞的成纤维细胞样细胞的独特群体,其通常进入组织损伤部位以促进血管生成和创伤愈合。纤维细胞在肿瘤、特别是肿瘤中的基质组织的形成是重要的。纤维细胞分化自cd14+外周血单核细胞,并且可以分化自其它pbmc细胞。sap、il-12、层粘连蛋白-1、抗-fcγr抗体、交联的igg和/或聚集的igg的存在可以抑制或至少部分延缓该过程。
50.第二个主要事件是纤维化组织的形成和维持。可以通过单核细胞分化为纤维细胞、成纤维细胞、巨噬细胞或肌成纤维细胞,成纤维细胞的招募和增殖,新细胞外基质的形成和新血管组织的生长来形成和维持纤维化组织。在病理纤维化诸如以下慢性炎症、损伤、恶性肿瘤或特发性纤维化中,它是可以导致组织损伤和破坏的这种过量纤维化组织。
51.最近,已经表明,血清淀粉样蛋白p(sap)或五聚环蛋白-2(ptx-2)可以用作治疗剂以治疗各种病症,包括纤维化相关的病症、超敏性病症、自身免疫性病症、粘膜炎和炎性病症诸如由微生物感染引起的病症。参见,例如,美国专利号8,247,370和8,497,243和美国专利申请号12/720,845和12/720,847。sap与fcγr的结合提供纤维细胞、纤维细胞前体、肌成纤维细胞前体和/或造血单核细胞前体分化的抑制性信号。sap和sap激动剂作为纤维化的治疗性处理的用途描述于美国专利号7,763,256和8,247,370,其在此通过引用并入。在本文描述的任何方法的某些实施方案中,所述方法包括施用sap,诸如包含sap多肽的sap(参见实施例)。在某些实施方案中,所述sap是重组人sap,也被称为重组人五聚环蛋白-2,诸如在cho细胞中产生的重组人sap。在某些实施方案中,所述sap多肽包含人sap多肽,诸如糖基化不同于纯化自人血清的sap的糖基化的人sap多肽。
52.本发明提供用于治疗纤维化癌症或癌症相关的纤维化的方法。该方法通常涉及施用作为单一药剂或与有效量的抗癌治疗剂组合的有效量的抗纤维化剂,诸如sap多肽或sap激动剂。所述sap多肽或sap激动剂和抗癌治疗剂可以靶向至不同的细胞群体。例如,所述sap多肽或sap激动剂可以靶向至参与调节纤维化的细胞,而所述抗癌治疗剂靶向至癌细胞。在所选实施方案中,这些组分可以作为组合的组合物配制或施用,或者可以分开和/或独立施用,例如,全身性施用或施用至目标位置。所述方法包括用于治疗癌症相关的纤维化或纤维化癌症(例如,纤维化癌症诸如骨髓纤维化、乳房、子宫、胰腺或结肠的癌症,包括纤维样瘤、纤维瘤、纤维腺瘤和纤维肉瘤)的方法。
53.在一些实施方案中,sap多肽或sap激动剂的有效量是,当单独或在联合疗法中施用时,与用所述sap多肽或sap激动剂治疗前个体中的纤维化的程度相比使纤维化有效降低至少约10%、且更优选至少约15%、20%、25%、30%、35%、40%、45%或甚至至少约50%或更多的量。在某些实施方案中,所述sap多肽或sap激动剂是包含sap多肽的sap,且根据给药时间表施用,且当单独或在联合疗法中施用时,与用sap治疗前个体中的纤维化的程度相比使纤维化有效降低至少约10%、且更优选至少约15%、20%、25%、30%、35%、40%、45%或
甚至至少约50%或更多。
54.在其它实施方案中,本发明提供涉及施用sap多肽或sap激动剂和抗癌治疗剂的协同组合的方法。如本文所使用,sap多肽或sap激动剂和抗癌治疗剂的“协同组合”是与治疗结果的增量改善相比治疗或预防性处理更有效的组合剂量,所述治疗结果的增量改善可以由(i)当以相同剂量作为单一疗法施用时sap多肽或sap激动剂的治疗或预防益处和(ii)当以相同剂量作为单一疗法施用时抗癌剂的治疗或预防益处的仅仅累加组合预测或预期。
55.此处显示,施用sap多肽或sap激动剂,在一个实例中所述sap激动剂包含糖基化的sap多肽(例如,包含糖基化的sap多肽、诸如糖基化不同于纯化自人血清的sap的糖基化的糖基化的sap多肽的sap;重组人sap,诸如重组人五聚环蛋白-2或prm-151),导致纤维化癌症(例如骨髓纤维化)症状、体检结果和血细胞计数异常(包括贫血、血小板减少、血小板增多和白细胞增多)相对于疗法开始时的基线水平的改善。还显示,施用sap多肽或sap激动剂诸如包含糖基化的sap多肽的sap激动剂(例如,包含糖基化的sap多肽、诸如糖基化不同于纯化自人血清的sap的糖基化的糖基化的sap多肽的sap;重组人sap,诸如重组人五聚环蛋白-2或prm-151)和抗癌治疗剂(例如jak激酶抑制剂,诸如鲁索替尼)的组合导致纤维化癌症(例如骨髓纤维化)症状、脾肿大和血细胞计数异常(包括贫血、血小板减少、血小板增多和白细胞增多)相对于基线水平的改善。本公开的方法也基于以下发现:本公开的sap多肽或sap激动剂单独和与另一种抗癌治疗剂组合均被良好耐受,而没有sap治疗诱导或与sap治疗相关的临床显著的骨髓抑制的证据(例如,没有治疗相关的骨髓抑制的证据)。事实上,在某些实施方案中,在治疗之后实现表明骨髓抑制的量度诸如贫血的改善。不仅联合疗法是有效的,而且它可以适于单独额外的抗癌治疗剂的益处已经开始消退的患者。此外,该联合疗法也导致用单独抗癌治疗剂治疗的患者中经常经历的一些副作用的改善。在该情况下,对于在将sap添加至其治疗方案前正在用鲁索替尼(janus激酶抑制剂)单独治疗的患者,我们观察到贫血和血小板减少的改善,如相对于添加sap前那些患者中经历的那些副作用(例如,相对于用janus激酶抑制剂单独治疗)血红蛋白水平和血小板计数增加所评价。这些结果不仅表明sap作为针对纤维化癌症的单一疗法或联合疗法的效力,而且表明使用sap以扩大用于其它治疗剂的治疗窗口和患者群体,以便为可用治疗失败或不充分的患者和患者亚群提供治疗方式,并且改善可用治疗的安全性概况,同时自身具有治疗效力。此外,此处显示,施用作为单一药剂或作为联合疗法的部分的sap多肽或sap激动剂,诸如包含糖基化的sap多肽的sap,导致器官纤维化的减少,导致器官功能的恢复和纤维化癌症症状的改善。sap精确靶向基本纤维化病理的能力验证了其治疗和逆转宽范围的纤维化癌症中的纤维化的广泛潜能。
56.定义
57.除非另有定义,否则本文使用的所有技术和科学术语一般具有与本领域普通技术人员通常理解相同的含义。通常,本文使用的命名法以及细胞培养、分子遗传学、有机化学和核酸化学和杂交中使用的实验程序是本领域众所周知且通常使用的。使用标准技术用于核酸和肽合成。通常根据本领域的常规方法和各种一般参考文献进行技术和程序(例如sambrook等人,1989,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,cold spring harbor,n.y.),其在该文献中通篇提供。
58.冠词“一个/种(a)”和“一个/种(an)”在本文用于指一个/种或多个/种(即至少一
个/种)该冠词的语法客体。通过实例的方式,“一个/种”意指一个/种元件或多个/种元件。
59.如本文所使用,术语“约”意指所用数字的数值的正或负10%。因此,约50%意指在45%-55%的范围内。
60.如本文所使用,术语“基本上”意味着很大程度上、但不完全是指定的内容。例如,关于核苷酸序列的术语“基本上类似的”表明,该序列与相同的蛋白或肽的另一报道序列在很大程度是相同的;然而,该核苷酸序列可以包括任何数目的不影响所得蛋白的结构或功能的变异或突变。
[0061]“施用”,当与治疗剂结合使用时,是指将治疗剂直接施用于目标组织内或上,或者将治疗剂施用于患者,由此所述治疗剂积极影响其靶向的组织。因此,如本文所使用,术语“施用”,当与sap多肽或sap激动剂结合使用时,可以包括、但不限于通过例如静脉内注射(例如,其可以是静脉内输注)全身地将sap多肽或sap激动剂提供给受试者,由此治疗剂到达目标组织。“施用”组合物可以通过例如静脉内、皮下、肌内或病灶内注射、口服施用、局部施用,或通过这些方法与其它已知技术组合而实现。此类组合技术包括加热、辐射、超声波和使用递送剂。当施用多于一种不同的治疗剂时,该药剂可以通过相同或不同的施用途径和/或在相同或不同时间进行施用。如本领域中所理解,药剂可以根据给药时间表施用。
[0062]“提供”,当与治疗剂结合使用时,意指将治疗剂直接施用至目标组织中或上,或将治疗剂施用于患者,由此所述治疗剂积极影响其靶向的组织。
[0063]
术语“改善”用于表示本发明改变将其所提供至、应用于或施用于的组织的特征和/或机体属性。术语“改善”也与疾病状态结合使用,使得当疾病状态得到“改善”时,与患病状态相关的症状或机体特征得到减少、降低或消除。
[0064]
如本文所使用,“分离的”意指通过人干预从天然状态改变或移除。例如,活动物中天然存在的sap不是“分离的”,但合成的sap多肽,或与其天然状态的共存物质部分或完全分开的sap多肽是“分离的”。分离的sap多肽可以基本上纯化的形式存在,或者可以存在于非天然环境,诸如,例如,其中已经递送sap多肽的细胞。
[0065]
术语“模拟物”、“肽模拟物(peptide mimetic)”和“肽模拟物(peptidomimetic)”在本文中可互换使用,并且通常是指模拟选定的天然肽或蛋白功能结构域(例如,结合基序或活性位点)的三级结合结构或活性的肽、部分肽或非肽分子。这些肽模拟物包括重组或化学修饰的肽,以及非肽剂诸如小分子药物模拟物,如下文进一步描述。
[0066]
如本文所使用,术语“核酸”是指多核苷酸,诸如脱氧核糖核酸(dna),以及,当适当时,核糖核酸(rna)。该术语应该被理解为包括,作为等效物,从核苷酸类似物制备的rna或dna的类似物,以及,当适用于所描述的实施方案时,包括单链(诸如有义或反义)和双链多核苷酸。
[0067]“任选的”或“任选地”意指随后描述的事件或情况可发生或可不发生,且该描述包括其中所述事件发生的情况和其中其不发生的情况。
[0068]
术语“肽”、“蛋白质”和“多肽”在本文中可互换使用。术语“纯化的蛋白质”是指一种或多种蛋白质的制备物,其优选分离自在细胞或细胞裂解物中通常与该蛋白质结合的其它蛋白质,或以其它方式基本上不含在细胞或细胞裂解物中通常与该蛋白质结合的其它蛋白质。术语“基本上不含其它细胞蛋白”或“基本上不含其它污染性蛋白”定义为涵盖各蛋白质的个别制备物,其包含小于20%(以干重计)污染性蛋白,优选包含小于5%污染性蛋白。
可以使用本领域众所周知的克隆的基因将各蛋白质的功能形式制备为纯化的制备物。“纯化的”意指所述分子在基本上不存在其它生物大分子、诸如其它蛋白质(特别是可能实质上遮蔽、减少、混淆或改变组分蛋白的特征的其它蛋白质,其作为纯化的制备物,或在主题重构混合物中发挥作用)的情况下存在。如本文所使用的术语“纯化的”优选意指存在至少80%干重、更优选85%干重、更优选95%-99%干重、最优选至少99.8%干重的相同类型的生物大分子(但是可以存在水、缓冲液和其它小分子,尤其是具有小于5000的分子量的分子)。如本文所使用的术语“纯的”优选具有与刚刚上述“纯化的”相同的数值限制。
[0069]“药学上可接受的”、“生理可耐受的”及其语法变体,当它们是指组合物、载体、稀释剂和药剂或制剂的其它成分时,可以互换使用,并且表明该物质能够施用而不对其接受者产生不期望的生理作用诸如恶心、眩晕、皮疹、胃部不适或其它有害影响。
[0070]“药学上可接受的盐”包括酸加成盐和碱加成盐两者。“药学上可接受的酸加成盐”是指保持游离碱的生物有效性和特性并且不是生物学上或以其它方式不期望并且与无机酸诸如盐酸、氢溴酸、硫酸、硝酸、碳酸、磷酸等形成的那些盐。有机酸可以选自脂族、环脂族、芳族、芳脂族、杂环、羧酸和磺酸类的有机酸,诸如甲酸、乙酸、丙酸、乙醇酸、葡萄糖酸、乳酸、丙酮酸、草酸、苹果酸、顺丁烯二酸、丙二酸、丁二酸、反丁烯二酸、酒石酸、柠檬酸、天冬氨酸、抗坏血酸、谷氨酸、邻氨基苯甲酸、苯甲酸、肉桂酸、扁桃酸、双羟萘酸、苯乙酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。
[0071]
如本文所使用,术语“药学上可接受的盐、酯、酰胺和前药”是指在合理的医学判断范围内适合用于与患者的组织接触而没有不当的毒性、刺激、过敏反应等、与合理的利益/风险比相称,且有效用于其预期用途的化合物的那些羧酸盐、氨基酸加成盐、酯、酰胺和前药,以及当可能时,本发明的化合物的两性离子形式。
[0072]
如本文所使用,术语“治疗剂”意指用于治疗、对抗、减轻、预防或改善患者的不希望的病况或疾病的药剂。部分地,本发明的实施方案涉及癌症、骨髓增殖性疾病或细胞异常增殖的治疗。
[0073]
组合物的“治疗有效量”或“有效量”是经计算以实现期望结果的预定量。本方法涵盖的活性当适当时包括医学治疗性和/或预防性治疗。根据本发明施用以获得治疗性和/或预防性效果的化合物的具体剂量,当然,将通过病例周围的具体情况来确定,所述具体情况包括例如所施用的化合物、施用途径和所治疗的病况。本发明的化合物的治疗有效量通常是这样的量,其使得当其在生理上可耐受的赋形剂组合物中施用时,它是足够的。治疗有效量可以根据给药时间表施用。
[0074]“n-连接的”寡糖是通过天冬酰胺、通过天冬酰胺-n-乙酰葡萄糖胺键的方式连接至肽骨架的那些寡糖。n-连接的寡糖也被称作“n-聚糖”。天然存在的n-连接的寡糖具有man[(α1,6-)-(man(α1,3)]-man(β1,4)-glcnac(β1,4)-glcnac(β1,n)的共同五糖核心。它们的差异在于外周糖诸如n-乙酰葡萄糖胺、半乳糖、n-乙酰半乳糖胺、岩藻糖和唾液酸的分支(也称作触角)的存在和数目。任选地,该结构还可以含有核心岩藻糖分子和/或木糖分子。
[0075]
术语“唾液酸”是指九碳羧化糖家族的任何成员。唾液酸家族的最常见成员是n-乙酰-神经氨酸(经常简称为neu5ac、neuac或nana)。该家族的第二个成员是n-羟乙酰基-神经氨酸(neu5gc或neugc),其中neuac的n-乙酰基被羟化。第三个唾液酸家族成员是2-酮-3-脱氧-nonulosonic acid(kdn)(nadano等人(1986)j.biol.chem.261:11550-11557;kanamori
等人,j.biol.chem.265:21811-21819(1990))。还包括9-取代的唾液酸,诸如9-o-c1c
6-酰基-neu5ac,如9-o-乳酰基-neu5ac或9-o-乙酰基-neu5ac,9-脱氧-9-氟-neu5ac和9-叠氮基-9-脱氧-neu5ac。关于唾液酸家族的综述,参见,例如,varki,glycobiology 2:25-40(1992);sialic acids:chemistry,metabolism and function,r.schauer,编(springer-verlag,new york(1992))。
[0076]“遗传工程改造的”或“重组的”细胞是具有对于细胞的遗传物质的一个或多个修饰的细胞。此类修饰包括但不限于:遗传物质的插入、遗传物质的缺失和染色体外遗传物质的插入,无论此类物质是否是稳定维持的。
[0077]
如本文所使用,术语“修饰的糖”是指在本发明的方法中酶促地添加至肽的氨基酸或糖基残基上的天然或非天然存在的碳水化合物。修饰的糖选自多种酶底物,包括但不限于:糖核苷酸(单、双和三磷酸酯),活化的糖(例如,糖基卤化物、糖基甲磺酸酯),以及既未活化又非核苷酸的糖。“修饰的糖”可能被“修饰基团”共价官能化。有用的修饰基团包括、但不限于:水溶性和水不溶性的聚合物、治疗部分、诊断部分和生物分子。选择用修饰基团官能化的位置,使得其不阻止“修饰的糖”被酶促地添加至肽或肽的糖基残基。
[0078]
sap多肽和sap激动剂
[0079]
本公开的一个方面提供可用于治疗纤维化癌症和癌症相关的纤维化的sap多肽或sap激动剂。sap激动剂涵盖增加或以其它方式模拟内源性sap信号传导的所有化合物和组合物,包括增加sap活性的化合物。在整个本公开内容中,提及“sap多肽或sap激动剂”或“本公开的sap多肽或sap激动剂”。除非另有指明,否则此类提及考虑使用本文公开的任何sap激动剂,包括使用重组sap,诸如包含含有人sap的sap多肽的五聚sap,其中所述sap多肽具有不同于分离自人血清的sap的糖基化的糖基化。本发明考虑在本文描述的任何方法中使用本文公开的任何sap多肽和sap激动剂,包括单独或作为联合疗法使用。
[0080]
sap
[0081]
sap或五聚环蛋白-2是由五个相同的亚基或“原聚体”构成的哺乳动物中天然存在的血清蛋白,所述亚基或“原聚体”非共价地结合于圆盘样复合物中。sap属于蛋白质的五聚环蛋白超家族,其特征在于该环式五聚结构。经典的短五聚环蛋白包括sap以及c-反应性蛋白(osmand,a.p.,等人,proc.nat.acad.sci.,74:739-743,1997)。长五聚环蛋白包括五聚环蛋白-3。sap通常在肝脏中合成,并且具有二十四小时的生理半衰期。人sap(hsap)在血浆中以近似20-40μg/ml作为同五聚体循环。人sap亚基的序列公开于seq id no:1中,其对应于gene bank登记号np_001630的氨基酸20-223(未描绘信号序列)。
[0082]
先前研究表明,sap在免疫应答的起始和解决阶段具有重要作用。hsap在针对微生物的固有免疫和细胞碎片的清除和吞噬作用中发挥功能,并且似乎在创伤愈合和纤维化的调节中发挥作用。这些功能可以涉及(i)以ca
2+-依赖的方式结合至与微生物和细胞碎片相关的配体,如上所指定,和各种胞外基质蛋白,(ii)结合至clq,用于通过促进c3b和ic3b的调理作用而活化补体,(iii)结合至fcγ受体以起始直接调理作用和随后的吞噬作用或内吞作用,和(iv)随后调节单核细胞功能和分化。因此,hsap分子定位于损伤和修复的位点,并且可以通过结合这些分子靶向和/或集中于这些位置。
[0083]
hsap的3d结构已经通过x-射线晶体学测定,并且也已经报道与不同配体复合的几种晶体结构。hsap的五聚体结构具有5重旋转对称,并且相当刚性的,具有孔。所述hsap五聚
体的直径为近似且中央孔的直径为和深度为各原聚体由两片中排列的反向平行的β-链构成,具有果冻卷(jellyroll)拓扑学的疏水性核心。hsap五聚体具有2个面,a面具有五个α螺旋,每个原聚体上一个,b面具有5组双钙结合位点。b面被认为提供钙依赖性配体结合面,并且已经鉴定了结合b面的几种钙依赖性配体,包括磷酰乙醇胺、dna、硫酸乙酰肝素、硫酸皮肤素和硫酸葡聚糖、层粘连蛋白和iv型胶原。hsap的a面也似乎结合分子诸如clq并且可以通过结合至fcγ受体而介导吞噬作用。各原聚体均可以在asn32(单一位点)糖基化。
[0084]
n-和c-末端是溶剂可接近的且位于各原聚体分子的内边缘上。n-末端位于各原聚体的外边缘上和由5个原聚体形成的环的周长上。c-末端位于更朝向五聚体环的内周长和孔,但朝向a面向外。一个原聚体内的n-和c-末端相距约末端似乎不参与亚基相互作用,且它们远离在asn32连接的聚糖链。hsap的亚基非共价地保持在一起,其中各亚基的近似15%表面参与这些相互作用。这些广泛的相互作用负责hsap五聚体的相当大的稳定性。
[0085]
本文描述的实施方案涵盖的sap包括来自任何来源的sap,诸如,例如,人sap,或来自其它脊椎动物或哺乳动物来源的同工型或类似物。sap进一步涵盖具有通过例如位点定向诱变引入的天然ptx-2氨基酸序列的修饰的sap分子。此类修饰可以改变分子的特定氨基酸和/或其它特征,同时保留分子的一般五聚五聚环蛋白性质。“sap”可以用于涵盖sap五聚体和sap原聚体两者。“sap五聚体”或“五聚体sap”是指至少包括五个sap原聚体的蛋白质复合物,且“sap原聚体”是指sap五聚体的一个个别蛋白质单元。在本公开的任何方面和实施方案的某些实施方案中,本发明包括施用sap激动剂,其中所述sap激动剂包含sap五聚体,所述sap五聚体包含含有seq id no:1中所示的氨基酸序列的sap多肽。在某些实施方案中,所述sap多肽包含重组人sap。示例性重组人sap包含prm-151。在某些实施方案中,所述sap激动剂包含重组sap。重组制备一般地蛋白质和具体地人五聚环蛋白-2的方法是本领域已知的。可以选择用于重组表达的合适细胞,诸如昆虫或哺乳动物细胞。
[0086]
人sap多肽上的聚糖结构的修饰可以相对于分离自人血清的野生型sap的对应样品增加sap多肽的生物学活性。分离自人血清的sap仅含有α2,6-连接的唾液酸残基。相反,在cho细胞中产生的重组人sap(rhsap)仅含有α2,3-连接的唾液酸残基。在体外的基于细胞的生物测定中,α2,3-连接的唾液酸sap多肽表明比分离自人血清的野生型sap(即,α2,6-连接的唾液酸)一致更高的活性。本发明的变体sap多肽由于它们增加的生物学功效而作为治疗剂将更加有效。例如,更有效的sap变体相对于分离自人血清的野生型sap可需要更少的给药和/或更低频率的给药。本公开提供变体人sap多肽及其制备方法两者。具体而言,本公开包括用于体外和体内添加、缺失或修饰糖残基以产生具有期望的糖基化模式的人sap多肽的方法和组合物。
[0087]
变体sap多肽
[0088]
本公开部分地提供变体血清淀粉样蛋白p(sap)多肽,其用于治疗纤维化癌症和癌症相关的纤维化。具体而言,本发明的sap变体包括糖基化的人sap多肽,其包含一个或多个n-连接或o-连接的寡糖链,各寡糖链独立地具有一、二、三、四或五个分支,所述分支以α2,3-连接的唾液酸部分终止。在一些实施方案中,n-连接或o-连接的寡糖链的所有唾液酸化分支都终止于α2,3-连接的部分。本发明的其它sap变体包括糖基化的人sap多肽,其含有n-连接或o-连接的寡糖链,与源自人血清的野生型sap多肽相比,所述寡糖链具有少至少
20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、75%、80%、85%或甚至至少95%的α2,6-连接的唾液酸部分。在一些实施方案中,n-连接或o-连接的寡糖链基本上不含α2,6-连接的唾液酸部分。本发明的糖变体sap多肽可以包含具有一个或多个分支(例如,具有双触角、三触角、四触角、五触角等结构)的n-连接的寡糖或o-连接的链。在一些实施方案中,本发明的sap多肽包含n-连接或o-连接的寡糖链,其中寡糖链的一、二、三、四或五个分支基本上不含半乳糖和n-乙酰葡萄糖胺。本发明的某些sap多肽具有n-连接或o-连接的寡糖链,所述寡糖链基本上不含半乳糖和和n-乙酰葡萄糖胺。在一些实施方案中,本发明的sap多肽包含n-连接或o-连接的寡糖链,其中寡糖链的一、二、三、四或五个分支含有一个或多个甘露糖残基。在某些实施方案中,本发明的sap多肽包含n-连接的寡糖,所述寡糖具有以下五糖核心:man[(α1,6)-(man(α1,3)]-man(β1,4)-glcnac(β1,4)-glcnac(β1,n)-asn。该五糖核心也可以包含一个或多个岩藻糖或木糖残基。在某些实施方案中,本发明的sap多肽包含n-连接的寡糖链,其中寡糖链的一、二、三、四或五个分支具有结构neunac2α3galβ4glcnacβ2manα6。本发明的sap多肽还可以包含n-连接的寡糖链,其中所有分支具有结构neunac2α3galβ4glcnacβ2manα6。
[0089]
本发明的变体sap多肽可以包含一个或多个“修饰的”糖残基。修饰的糖在允许连接修饰部分或基团的任何位置被取代,然而其仍然允许糖作为用于将修饰的糖偶联至sap肽的酶的底物发挥功能。修饰基团可以通过酶促方式、化学方式及其组合连接至糖部分,从而产生修饰的糖,例如修饰的半乳糖、岩藻糖或唾液酸。适合用于本发明的修饰基团以及用于将这些修饰基团缀合至糖残基的方法描述于下文部分。
[0090]
在一些实施方案中,本发明的sap多肽可以包含与seq id no:1的氨基酸序列至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%相同的氨基酸序列,如使用基于brutlag等人(comp.app.biosci.,6:237-245(1990))的算法的fastdb计算机程序所测定。在具体实施方案中,用于计算氨基酸比对的百分数同一性和相似性的参数包含:matrix=pam 150,k-元组=2,错配罚分=1,连接罚分=20,随机组长度=0,截止评分=1,缺口罚分=5和缺口大小罚分=0.05。
[0091]
与seq id no:1共享至少95%同一性的多肽可以包括在这些发散区域中具有保守取代的多肽。术语“sap多肽”涵盖功能片段和包含上述任一者的融合蛋白。通常,sap多肽将在水溶液中在生物相关的温度、ph水平和摩尔渗透性浓度是可溶的。非共价地结合在一起以形成五聚体sap复合物的sap原聚体可以具有相同的氨基酸序列和/或翻译后修饰,或者,可替代地,单一复合物内的各个sap原聚体可以具有不同的序列和/或修饰。术语sap多肽包括包含任何天然存在的sap多肽及其任何变体(包括突变体、片段和融合物)的多肽。本发明的sap多肽可以是重组多肽。在优选实施方案中,本发明的sap多肽是人sap多肽。
[0092]
在一些实施方案中,提供药物组合物,其包含本发明的变体sap多肽,或其功能片段。在一些方面,sap变体的氨基酸序列可以与seq id no:1相差一个或多个保或非保守取代。在其它方面,sap变体的氨基酸序列可以与seq id no:1相差一个或多个保守取代。如本文所使用,“保守取代”是物理上或功能上类似于对应的参考残基的残基,即,保守取代及其参考残基具有相似的大小、形状、电荷、化学性质,包括形成共价键或氢键的能力等。优选的保守取代是满足dayhoff等人,atlas of protein sequence and structure 5:345-352(1978&supp.)中对于接受的点突变定义的标准的取代。保守取代的实例为以下组内的取
代:(a)缬氨酸、甘氨酸;(b)甘氨酸、丙氨酸;(c)缬氨酸、异亮氨酸、亮氨酸;(d)天冬氨酸、谷氨酸;(e)天冬酰胺、谷氨酰胺;(f)丝氨酸、苏氨酸;(g)赖氨酸、精氨酸、甲硫氨酸;和(h)苯丙氨酸、酪氨酸。关于哪些氨基酸变化可能是表型上沉默的额外指导可见bowie等人,science247:1306-1310(1990)。
[0093]
变体sap多肽及其保留生物学功能的片段可用于本文描述的药物组合物和方法中。在一些实施方案中,变体sap多肽或其片段结合fcγri、fcγriia和/或fcγriiib。在一些实施方案中,变体sap多肽或其片段抑制纤维细胞、纤维细胞前体、肌成纤维细胞前体和/或造血单核细胞前体分化中的一种或多种。sap变体可以通过修饰sap多肽的结构来生成,以实现诸如增强治疗效力或稳定性(例如,离体保质期和体内针对蛋白水解降解的抗性)的目的。
[0094]
在某些方面,本公开的变体sap多肽除了天然存在于sap多肽中的任何修饰之外可以进一步包含翻译后修饰。此类修饰包括但不限于:乙酰化、羧化、糖基化(例如o-连接的寡糖、n-连接的寡糖等)、磷酸化、脂化和酰化。作为结果,修饰的sap多肽可以含有非氨基酸元件,诸如聚乙二醇、脂质、多糖或单糖和磷酸酯。
[0095]
产生具有改变的n-糖基化的变体hsap多肽的方法描述于美国专利申请号12/794,132,其在此通过引入并入。
[0096]
在某些方面,本文描述的sap多肽的一种或多种修饰可以增强sap多肽的稳定性。例如,此类修饰可以增强sap多肽的体内半衰期或减少sap多肽的蛋白水解降解。
[0097]
在某些方面,本发明的变体sap多肽包括融合蛋白,其具有人sap多肽的至少一部分和一个或多个融合结构域或异源部分。此类融合结构域的众所周知的实例包括、但不限于聚组氨酸、glu-glu、谷胱甘肽s转移酶(gst)、硫氧还蛋白、蛋白a、蛋白g和免疫球蛋白重链恒定区(fc)、麦芽糖结合蛋白(mbp)或人血清白蛋白。可以将融合结构域选择为用于赋予期望的特性。例如,一些融合结构域特别可用于通过亲和层析分离融合蛋白。为了亲和纯化的目的,使用用于亲和层析的相关基质,诸如谷胱甘肽-、淀粉酶-和镍-或钴-缀合的树脂。作为另一个实例,可以将融合结构域选择为促进sap多肽的检测。此类检测结构域的实例包括多种荧光蛋白(例如gfp)以及“表位标签”,其通常是针对其的特异性抗体可得的短肽序列。众所周知的针对其的特异性单克隆抗体容易可得的表位标签包括flag、流感病毒血凝素(ha)和c-myc标签。在一些情况下,融合结构域具有蛋白酶切割位点,其允许相关蛋白酶部分地消化融合蛋白,从而从其中释放重组蛋白。然后可以通过随后的层析分离从融合结构域分离释放的蛋白质。在一些情况下,sap多肽可以与在体内使sap多肽稳定化的异源结构域融合。“稳定化”意指增加血清半衰期的任何事项,而无论这是因为减少破坏、减少肝脏和/或肾脏对其的清除,还是其它药代动力学效应。已知与免疫球蛋白的fc部分和血清白蛋白的融合体赋予增强的稳定性。
[0098]
应理解,融合蛋白的不同元件可以与期望的功能性一致的任何方式排列。例如,sap多肽可以置于异源结构域的c-末端,或者,可替代地,异源结构域可以置于sap多肽的c-末端。sap多肽和异源结构域无需在融合蛋白中邻近,可以在任一结构域的c-或n-末端或结构域之间包括额外的结构域或氨基酸序列(例如接头序列)。
[0099]
本发明的sap多肽可以包含一个或多个“修饰的”糖残基。可以通过酶促方式、化学方式或其组合将修饰基团连接至糖部分,从而产生修饰的糖,例如修饰的半乳糖、岩藻糖或
唾液酸。当使用修饰的唾液酸时,这些方法中可以使用唾液酸转移酶或转唾液酸酶(trans-sialidase)。可以在允许连接修饰部分、但仍然允许糖作为用于将修饰的糖偶联至肽的酶的底物发挥功能的任何位置取代糖。
[0100]
通常,通过使用反应性基团将糖部分和修饰基团连接在一起,所述反应性基团通常通过连接方法转化为新的有机官能团或非反应性种类。糖反应性官能团可以位于糖部分上的任何位置。可用于实施本发明的反应性基团和反应类型通常是生物缀合化学领域中众所周知的那些。与反应性糖部分一起可用的目前受欢迎的反应类型是在相对温和条件下进行的反应。这些包括、但不限于亲核取代(例如胺和醇与酰基卤、活性酯的反应),亲电子取代(例如,烯胺反应)和对碳-碳以及碳-杂原子多键的加成(例如迈克尔反应,diels-alder加成)。这些和其它有用的反应描述于,例如,smith和march,advanced organic chemistry,第5版,john wiley&sons,new york,2001;hermanson,bioconjugate techniques,academic press,san diego,1996;和feeney等人,modification of proteins;advances in chemistry series,vol.198,american chemical society,washington,d.c.,1982。
[0101]
悬于糖核或修饰基团的有用的反应性官能团包括、但不限于:(a)羧基及其多种衍生物(例如,n-羟基琥珀酰亚胺酯、n-羟基苯并三唑酯、酰基卤、酰基咪唑、硫酯、对硝基苯基酯、烷基、烯基、炔基和芳香酯);(b)羟基,其可以转化为酯、醚、醛等;(c)卤代烷基,其中卤化物可以随后被亲核基团替换,所述亲核基团诸如,例如胺、羧酸阴离子、硫醇阴离子、负碳离子或醇盐离子,由此导致新基团在卤素原子的官能团上的共价连接;(d)亲二烯体基团,其能够参与diels-alder反应,诸如例如马来酰亚胺基团;(e)醛或酮基团,使得可能经由羰基衍生物诸如例如亚胺、腙、缩氨基脲或肟的形成或经由诸如grignard加成或烷基锂加成而随后衍生化;(f)磺酰基卤化物基团,用于与胺进行后续反应,例如,形成硫胺类;(e)硫醇基,其可以例如被转化为二硫化物或与烷基和酰基卤反应;(h)胺或巯基,其可以例如被酰基化、烷基化或氧化;(i)烯类,其可以进行例如环式加成、酰化、迈克尔加成、复分解反应,heck反应等;(j)环氧化物,其可以与例如胺和羟基化合物反应。
[0102]
可以选择反应性官能团,使得它们不参与或干扰组装反应性糖核或修饰基团必需的反应。或者,可以通过保护基的存在保护反应性官能团免于参与反应。本领域技术人员理解如何保护特定官能团,使得其不干扰所选组的反应条件。对于可用保护基的实例,参见例如greene等人,protective groups in organic synthesis,john wiley&sons,new york,1991。
[0103]
在一些实施方案中,修饰的糖是活化的糖。可用于本发明中的活化的修饰的糖通常是已经通过合成改变以包括活化的离去基团的糖苷。如本文所使用,术语“活化的离去基团”是指在酶调节的亲核取代反应中容易被取代的那些部分。许多活化的糖是本领域已知的。参见,例如vocadlo等人,carbohydrate chemistry and biology,vol.2,ernst等人编,wiley-vch verlag:weinheim,germany,2000;kodama等人,tetrahedron lett.34:6419(1993);lougheed,等人,j.biol.chem.274:37717(1999))。此类离去基团的实例包括氟、氯、溴、甲苯磺酸盐、甲磺酸盐、三氟甲磺酸酯等。用于本发明中的优选的活化的离去基团是在空间上不显著阻碍糖苷向受体的酶促转移的离去基团。因此,活化的糖苷衍生物的优选实施方案包括糖基氟化物和糖基甲磺酸酯,其中糖基氟化物是特别优选的。在糖基氟化物
中,α-半乳糖基氟化物、α-甘露糖基氟化物、α-葡萄糖基氟化物、α-岩藻糖基氟化物、α-木糖基氟化物、α-唾液酸基氟化物、α-n-乙酰葡萄糖胺氟化物、α-n-乙酰半乳糖胺氟化物、β-半乳糖基氟化物、β-甘露糖基氟化物、β-葡萄糖基氟化物、β-岩藻糖基氟化物、β-木糖氟化物、β-唾液酸基氟化物、β-n-乙酰葡萄糖胺氟化物和β-n-乙酰半乳糖胺氟化物是最优选的。
[0104]
在一些方面,修饰的糖残基缀合至一种或多种水溶性聚合物。许多水溶性聚合物是本领域技术人员已知的,并且可用于实施本发明。术语“水溶性聚合物”涵盖物质,诸如糖(例如葡聚糖,淀粉,透明质酸,聚(唾液酸)、乙酰肝素,肝素等);聚(氨基酸);核酸;合成的聚合物(例如,聚(丙烯酸)、聚(酯),例如,聚(乙二醇));肽、蛋白质等。可以使用任何水溶性聚合物实施本发明,唯一条件是:该聚合物必须包括可以连接缀合物的剩余物的点。
[0105]
用于活化水溶性聚合物和糖以及用于将糖和聚合物缀合至多种种类的方法和化学法描述于文献中。用于活化聚合物的通常使用的方法包括:使用溴化氰、高碘酸盐、戊二醛、双环氧化物、表氯环氧丙烷、二乙烯基砜、碳二亚胺、磺酰基卤化物、三氯三嗪等活化官能团(参见r.f.taylor,(1991),protein immobilisation,fundamentals and applications,marcel dekker,n.y.;s.s.wong,(1992),chemistry of protein conjugation and crosslinking,crc press,boca raton;g.t.hermanson等人,(1993),immobilized affinity ligand techniques,academic press,n.y.;dunn,r.l.,等人,编polymeric drugs and drug delivery systems,acs symposium series vol.469,american chemical society,washington,d.c.1991)。
[0106]
在一些方面,修饰的糖残基缀合至一种或多种水不溶性聚合物。在一些实施方案中,缀合至水不溶性聚合物可用于以受控方式递送治疗肽。多聚体药物递送系统是本领域已知的。参见,例如dunn等人,编polymeric drugs and drug delivery systems,acs symposium series vol.469,american chemical society,washington,d.c.1991。本领域技术人员将认识到,基本上任何已知的药物递送系统都适用于本发明的缀合物。
[0107]
代表性水不溶性聚合物包括、但不限于:聚膦腈、聚(乙烯醇)、聚酰胺、聚碳酸酯、聚烯烃、聚丙烯酰胺、聚亚烷基二醇、聚亚烷基氧化物、聚亚烷基对苯二甲酸酯、聚乙烯醚、聚乙烯酯、聚乙烯卤化物、聚乙烯吡咯烷酮、聚乙交酯、聚硅氧烷、聚氨酯、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸乙酯)、聚(甲基丙烯酸丁酯)、聚(甲基丙烯酸异丁酯)、聚(甲基丙烯酸己酯)、聚(甲基丙烯酸异癸酯)、聚(甲基丙烯酸月桂酯)、聚(甲基丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸异丙酯)、聚(丙烯酸异丁酯)、聚(丙烯酸十八烷酯)、聚乙烯、聚丙烯、聚(乙二醇)、聚(环氧乙烷)、聚(对苯二甲酸乙二醇酯)、聚(乙酸乙烯酯)、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮、普朗尼克类和聚乙烯基酚,及其共聚物。
[0108]
本文讨论的这些和其它聚合物可以容易获得自商业来源,诸如sigma chemical co.(st.louis,mo.),polysciences(warrenton,pa.),aldrich(milwaukee,wis.),fluka(ronkonkoma,n.y.),and biorad(richmond,calif.),或者另外使用标准技术从获得自这些供应商的单体合成。可用于本发明的缀合物中的代表性生物可降解的聚合物包括、但不限于:聚丙交酯、聚乙交酯及其共聚物,聚(乙烯对苯二甲酸酯)、聚(丁酸)、聚(戊酸)、聚(丙交酯-共-己内酯)、聚(丙交酯-共-乙交酯)、聚酐、聚原酸酯、及其共混物和共聚物。特别有用的是形成凝胶的组合物,诸如包括胶原和普郎尼克类的组合物。
[0109]
在一个优选实施方案中,一个或多个修饰的糖残基缀合至一个或多个peg分子。
[0110]
在某些方面,修饰的糖缀合至生物分子。本发明的生物分子可以包括、但不限于功能性蛋白质、酶、抗原、抗体、肽、核酸(例如单一核苷酸或核苷,寡核苷酸,多核苷酸和单链和更高链的核酸),血凝素,受体或其组合。
[0111]
一些优选的生物分子基本上是无荧光的,或发射极小量的荧光,使得它们不适于在测定中用作荧光标志物。其它生物分子可以是荧光的。
[0112]
在一些实施方案中,所述生物分子是靶向部分。如本文所使用,“靶向部分”和“靶向试剂”是指将选择性定位于身体的特定组织或区域的种类。在一些实施方案中,所述生物分子被选择为将本发明的sap多肽引导至特定的细胞内区室,从而相对于递送至组织的非衍生肽的量增强肽递送至该细胞内区室的递送。分子决定簇的特定识别、靶向剂或缀合物的分子大小、离子相互作用、疏水相互作用等调节定位。将药剂靶向至特定组织或区域的其它机制是本领域技术人员已知的。
[0113]
在一些实施方案中,修饰的糖包括治疗部分。本领域技术人员将认识到,治疗部分与生物分子的类别之间存在重叠,即,许多生物分子具有治疗特性或潜力。
[0114]
可用的治疗部分的类型包括,例如非甾族抗炎药物;甾族抗炎药物;佐剂;抗组胺药;镇咳药;止痒药;抗胆碱能药;镇吐药和止恶心药;减食欲药;中枢兴奋药;抗心律失常药物;β-肾上腺素能阻滞药;强心药;抗高血压药;利尿药;血管扩张药;血管收缩药;抗溃疡药;麻醉药;抗抑郁药;强安定剂和镇静剂;抗精神病药物;和抗微生物药物。
[0115]
可用于实施本发明的其它药物部分包括抗肿瘤药、杀细胞试剂、抗雌激素类和抗代谢物。该类型中还包括用于诊断(例如成像)和治疗两者的基于放射性同位素的药剂,以及缀合的毒素。
[0116]
所述治疗部分也可以是激素、肌肉松弛药、镇痉剂、骨活化剂、内分泌调节剂、糖尿病调节剂、雄激素、抗利尿药或降钙药。
[0117]
其它可用的修饰部分包括:免疫调节药物、免疫抑制剂等。具有抗炎活性的基团,诸如舒林酸、依托度酸、酮洛芬和酮咯酸,也是有用的。与本发明结合使用的其它药物将是本领域技术人员显而易见的。
[0118]
通过本公开的方法产生的改变的n-糖基化sap多肽可以是均质的(即,sap多肽的样品在特定n-聚糖结构上是单一的)或基本上均质的。“基本上均质”意指至少约25%(例如,至少约27%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、或至少约95%、或至少约99%)的sap多肽含有相同的特定n-聚糖结构。
[0119]
在一些实施方案中,本发明的变体sap多肽对于体外抑制单核细胞分化为纤维细胞的ic
50
是分离自人血清的野生型sap的对应样品的ic
50
的小于1/2、小于1/3、小于1/4、小于1/10、或小于1/100。在一些实施方案中,本发明的变体sap多肽对于体外抑制单核细胞分化为纤维细胞的ic
50
是分离自人血清的野生型sap的相应样品的小于一半。存在许多完全确立的用于测定外周血单核细胞(pbmc)或单核细胞关于纤维细胞分化对于sap的响应性的方法。这些方法可用于确定本发明的任何sap变体多肽相比于源自人血清的sap、任何其它sap变体多肽或其它纤维细胞抑制剂或活化剂的样品的相对功效。适合用于这些方法中的pbmc或单核细胞可获得自多种组织培养系。或者,用于纤维细胞分化测定的合适细胞可以获得自包含pbmc或单核细胞的任何生物样品。生物样品可以获得自血清、血浆、健康组织或纤维
化组织。通常,通过将培养基中的pbmc或单核细胞与多种浓度的sap多肽孵育来进行纤维细胞分化测定,以确定纤维细胞分化的程度。sap的浓度可以范围为0.0001μg/ml至1mg/ml,在一些实施方案中是0.001μg/ml、1.0μg/ml、5μg/ml、10μg/ml、15μg/ml、20μg/ml、25μg/ml、30μg/ml、35μg/ml、40μg/ml、45μg/ml、50μg/ml、100μg/ml、200μg/ml、300μg/ml或500μg/ml。在一些测定中,培养基中可以补充1-100ng/ml hmcsf;hmcsf的优选浓度是25ng/ml。本领域技术人员可以确定pbmc和单核细胞已经分化为纤维细胞的指示。通常,纤维细胞在形态上确定为粘附细胞,具有延长的纺锤形状,并存在椭圆形细胞核。在一些测定中,固定细胞并用hema3染色,然后通过直接计数法计数纤维细胞,例如使用倒置显微镜。本领域技术人员将纤维细胞分化的量解读为细胞对于sap的响应性的指示。如本公开的实施例所示,纤维细胞分化的较大抑制表明较大程度的sap响应性。测量纤维细胞分化的替代方法涉及测定纤维细胞特异性细胞表面标志物或分泌的因子(例如细胞因子(诸如il-1ra,ena-78/cxcl-5,pai-1)、纤连蛋白、胶原-1)的表达。检测和/或定量细胞表面标志物或分泌的因子的方法是本领域众所周知的,包括但不限于使用针对一种或多种纤维细胞特异性标志物的免疫反应性抗体的多种基于elisa和facs的技术。如本公开的实施例中所描述,测量巨噬细胞衍生的趋化因子(mdc)的表达是测定纤维细胞分化的有效方法。
[0120]
用于检测和/或表征sap多肽的n-糖基化(例如,改变的n-糖基化)的方法包括dna测序仪辅助的(dsa)、荧光团辅助的碳水化合物电泳(face)或表面增强的激光解吸附/电离-飞行时间-质谱(seldi-tof ms)。例如,分析可以采用dsa-face,其中,例如,将糖蛋白变性,随后固定于例如膜上。然后使用合适的还原剂诸如二硫苏糖醇(dtt)或β-巯基乙醇还原糖蛋白。可以使用酸诸如碘代乙酸羧化蛋白的巯基。接下来,可以使用酶诸如n-糖苷酶f从蛋白释放n-聚糖。任选地,可以通过还原性胺化重构和衍生化n-聚糖。然后可以浓缩衍生的n-聚糖。适合于n-聚糖分析的仪器包括,例如,abi377dna测序仪(applied biosystems)。可以使用例如3.1软件(applied biosystems)进行数据分析。任选地,可以使用一种或多种酶进一步处理分离的甘露糖蛋白以证实它们的n-聚糖状态。示例性酶包括,例如,α-甘露糖苷酶或α-1,2甘露糖苷酶。n-聚糖分析的额外方法包括,例如,质谱(例如,maldi-tof-ms),正相高压液体色谱(hplc),反相和离子交换色谱(例如,当聚糖未被标记时,使用脉冲的电流计检测;如果聚糖被适当标记,则使用紫外吸收或荧光)。还参见callewaert等人(2001)glycobiology 11(4):275-281和freire等人(2006)bioconjug.chem.17(2):559-564,其各自的公开内容通过引用以其整体并入本文。
[0121]
作为sap激动剂的抗-fcγr抗体
[0122]
在本发明的一个方面,提供一种或多种模拟sap信号传导的化合物。在一些实施方案中,所述sap信号传导激动剂是抗-fcγr抗体,其中所述抗体选自能够分别结合至fcγri、fcγriia或fcγriii的抗-fcγri、抗-fcγriia和抗-fcγriii抗体的类别。抗-fcγr抗体是结合至igg抗体的fc部分的受体(fcγr)的igg抗体。抗-fcγr抗体通过其可变区、而不通过其恒定(fc)区结合。抗-fcγr抗体可以包括抗体的任何同种型。抗-fcγr抗体可以与或不与额外抗体或其它方式进一步交联或聚集。该过程起始与fcγr活化一致的细胞内信号传导事件。在一些实施方案中,所述sap信号传导激动剂可以是交联的fcγr。
[0123]
聚集的fc结构域和含有fc的抗体
[0124]
在一些实施方案中,所述sap信号传导激动剂是交联或聚集的igg。交联或聚集的
igg可以包括能够通过其fc区结合目标fcγr的任何igg,条件是至少两个此类igg抗体与彼此物理连接。
[0125]
交联或聚集的igg可以包括完整抗体或其部分,优选在纤维化疾病的抑制中有功能的部分。例如,它们可以包括能够交联fcγr的任何抗体部分。这可以包括聚集或交联的抗体或其片段,诸如聚集或交联的完整抗体,f(ab')2片段,和可能甚至fc片段。
[0126]
抗体的聚集或交联可以通过任何已知的方法诸如热或化学聚集来完成。任何水平的聚集或交联可以是足够的,尽管增加的聚集可以导致增加的纤维化病症抑制。抗体可以是多克隆或单克隆的,诸如从杂交瘤细胞产生的抗体。组合物和方法可以采用抗体的混合物,诸如多种单克隆抗体的混合物,所述抗体可以与类似物或不同抗体交联或聚集。
[0127]
sap肽模拟物
[0128]
在某些实施方案中,所述sap激动剂包括肽模拟物。如本文所使用,术语“肽模拟物”包括化学修饰的肽和含有非天然存在的氨基酸、拟肽等的肽样分子。用于鉴定肽模拟物的方法是本领域众所周知的,并且包括筛选含有潜在肽模拟物的文库的数据库。例如,剑桥结构数据库(cambridge structural database)含有具有已知晶体结构的超过300,000种化合物的集合(allen等人,acta crystallogr.section b,35:2331(1979))。当目标分子的晶体结构不可用时,可以使用例如concord生成结构(rusinko等人,j.chem.inf.comput.sci.29:251(1989))。另一个数据库,可用化学目录(available chemicals directory)(molecular design limited,informations systems;san leandro calif.),含有商业可用的约100,000种化合物,且也可以进行搜索以鉴定sap多肽的潜在肽模拟物。
[0129]
增加sap活性
[0130]
在一些实施方案中,sap激动剂增加sap活性。可以通过经由,例如,增加sap转录、增加翻译、增加sap分泌、增加sap rna稳定性、增加sap蛋白稳定性或减少sap蛋白降解而增加sap的浓度来增加sap活性。也可以通过经由例如减少sap内源性结合伴侣而特别增加sap的“有利浓度”或者未结合的形式来增加sap活性。
[0131]
fcγr交联剂
[0132]
在一些实施方案中,基于纤连蛋白的支架结构域蛋白可以用作sap激动剂以交联fcγr。基于纤连蛋白的支架结构域蛋白可以包含纤连蛋白iii型结构域(fn3),特别是纤连蛋白iii型第十结构域(
10
fn3)。
[0133]
为了交联fcγr,可以如美国专利号7,115,396中所述生成fcγr结合fn3结构域的多聚体。
[0134]
纤连蛋白iii型(fn3)结构域以n-末端至c-末端的顺序包含,β或β-样链,a;环,ab;β或β-样链,b;环,bc;β或β-样链c;环cd;β或β-样链d;环de;β或β-样链,e;环,ef;β或β-样链f;环fg;和β或β-样链g。bc、de和fg环在结构上和功能上类似于来自免疫球蛋白的互补决定区(cdr),可以通过改变bc、de和fg环中的一个或多个的序列而设计fn3结构域以结合几乎任何化合物。用于生成特异性结合剂的方法已经描述于公开高亲和力tnfα结合剂的美国专利号7,115,396和公开高亲和力vegfr2结合剂的美国公开号2007/0148126。基于纤连蛋白的支架蛋白的一个实例是adnectins
tm
(adnexus,a bristol-myers squibb r&d company)。
[0135]
在一些实施方案中,所述sap激动剂是适配子。为了交联fcγr,可以生成fcγr结
合适配子的多聚体。
[0136]
适配子是寡核苷酸,其可以是合成或天然的,其结合特定目标分子,诸如蛋白质或代谢物。通常,结合是通过除了经典watson-crick碱基配对以外的相互作用。适配子代表目前在临床前和临床开发中有希望的治疗剂的类别。如生物剂,例如,肽或单克隆抗体,适配子能够特异性结合至分子目标,并且通过结合,抑制目标功能。典型适配子大小为10-15kda(即,30-45个核苷酸),以亚纳摩尔亲和力结合其目标,且区别紧密相关的目标(例如,通常不结合来自相同基因家族的其它蛋白质)(griffin,等人(1993),gene 137(1):25-31;jenison,等人(1998),antisense nucleic acid drug dev.8(4):265-79;bell,等人(1999),in vitro cell.dev.biol.anim 35(9):533-42;watson,等人(2000),antisense nucleic acid drug dev.10(2):63-75;daniels,等人(2002),anal.biochem.305(2):214-26;chen,等人(2003),proc.natl.acad.sci.u.s.a.100(16):9226-31;khati,等人(2003),j.virol.77(23):12692-8;vaish,等人(2003),biochemistry 42(29):8842-51)。
[0137]
适配子具有许多用作治疗剂的有吸引力的特征。除了高目标亲和力和特异性以外,适配子在标准测定中已经显示很少或无毒性或免疫原性(wlotzka,等人(2002),proc.natl.acad.sci.u.s.a.99(13):8898-902)。事实上,已经通过不同阶段的临床前开发,包括药代动力学分析、在细胞和动物疾病模型中表征生物学效力和初步安全性药理学评价优化和发展几种治疗适配子(reyderman and stavchansky(1998),pharmaceutical research 15(6):904-10;tucker等人,(1999),j.chromatography b.732:203-212;watson,等人(2000),antisense nucleic acid drug dev.10(2):63-75)。
[0138]
用于生成针对目的目标的适配子的合适方法是用名称为“通过指数富集系统进化配体(systematic evolution of ligands by exponential enrichment)”(“selex
tm”)的方法。selex
tm
方法是用于体外进化高度特异性结合至目标分子的核酸分子的方法,且描述于,例如,1990年6月11日提交的美国专利申请序列号07/536,428(现已放弃)、题为“nucleic acid ligands”的美国专利号5,475,096和题为“nucleic acid ligands”的美国专利号5,270,163(也参见wo 91/19813)。各selex
tm-鉴定的核酸配体是给定目标化合物或分子的特异性配体。selex
tm
方法基于以下认识:核酸可以形成多种二维和三维结构,且具有其单体内可得的足够化学多功能性以便与几乎任何化学化合物充当配体(形成特异性结合对),无论是单体的还是聚合的。任何大小或组成的分子都可以充当目标。适用于应用高亲和力结合的selex
tm
方法涉及从候选寡核苷酸的混合物选择和使用相同通用选择方案逐步迭代重复结合、分开和扩增,以几乎达到结合亲和力和选择性的任何期望标准。从核酸的混合物(优选包含随机序列的区段)出发,selex
tm
方法包括在有利于结合的条件下使混合物与目标接触、将未结合的核酸与已经特异性结合至目标分子的那些核酸分开、解离核酸-目标复合物、扩增从核酸-目标复合物解离的核酸以得到核酸的配体富集的混合物的步骤,然后通过如期望一样多的循环迭代重复结合、分开、解离和扩增的步骤以得到目标分子的高特异性高亲和力核酸配体。selex
tm
是用于制备任何期望目标的核酸配体的方法,如描述于,例如,美国专利号5,475,096和5,270,163以及pct/us91/04078,其各自通过引用并入本文。
[0139]
在一些实施方案中,sap激动剂是sap激动剂是是含有天然存在的重链抗体的独特结构和功能特性的抗体衍生的治疗性蛋白质。最初遵循骆驼科(骆驼和美洲驼)具有缺乏轻链的全功能抗体的发现开发了技术。这些重链抗体
含有单一可变结构域(vhh)和两个恒定结构域(ch2和ch3)。重要的是,克隆且分离的vhh结构域是具有初始重链抗体的全部抗原结合能力的稳定多肽。这些具有其独特的结构和功能特性的vhh结构域形成了新生成治疗性抗体的基础。
[0140]
癌症相关的纤维化
[0141]
许多癌症的特征在于纤维化的存在。部分地,本公开的sap多肽或sap激动剂单独或与抗癌治疗剂组合使用,以治疗特征在于此类纤维化癌症(例如,纤维化癌症,诸如骨髓纤维化、胃癌、胰脏癌、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、毛细胞白血病、多发性骨髓瘤、成神经管细胞瘤、骨髓性白血病、急性淋巴细胞性白血病和乳房、子宫或结肠的癌症,包括纤维样瘤、纤维瘤、纤维腺瘤和纤维肉瘤)。在其它实施方案中,本公开的sap激动剂,诸如sap多肽(诸如重组人sap多肽,诸如糖基化的sap多肽)用作单一治疗。
[0142]
在某些实施方案中,本公开的sap多肽或sap激动剂(例如,包含糖基化的sap多肽的sap激动剂;包含糖基化的sap多肽的sap;重组人sap;等)单独或与抗癌治疗剂组合使用,以通过减少纤维化而恢复器官功能而治疗纤维化癌症(例如,纤维化癌症,诸如骨髓纤维化、胃癌、胰脏癌、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、毛细胞白血病、多发性骨髓瘤、成神经管细胞瘤、骨髓性白血病、急性淋巴细胞性白血病和乳房、子宫或结肠的癌症,包括纤维样瘤、纤维瘤、纤维腺瘤和纤维肉瘤)。此处显示,施用作为单一药剂或作为联合疗法的部分的本公开的sap多肽或sap激动剂,导致器官纤维化(例如,骨髓纤维化)的减少,导致器官功能的改善和/或恢复和纤维化癌症症状的改善(例如,全血计数(cbc)的改善)。可以例如,通过经治疗进程、诸如经12、20、24或大于24治疗周评价受试者中的血小板水平和/或血红蛋白的改善而评估器官功能的改善。在一些实施方案中,所述器官是骨髓,且治疗减少器官纤维化和/或改善器官功能。在一些实施方案中,所述纤维化器官是肺、胃、胰腺、结肠、肝、肾、膀胱、乳房、子宫、子宫颈、卵巢或脑。在一些实施方案中,所述纤维化癌症是骨髓纤维化。
[0143]
如本文所述,在某些实施方案中,将sap添加至治疗方案用于对治疗(不存在sap)不响应、具有耐受性或另外难治性或治疗效力消退或已经消退的受试者中。在某些实施方案中,sap的添加用于扩展用另一种治疗剂治疗是合适的患者群体(例如,sap扩展另一种药物的治疗窗口或患者群体)。通过实例的方式,某些癌症已知对化疗不响应。不受理论束缚,纤维化可以阻碍药物有效接近肿瘤。
[0144]
在某些实施方案中,如本文所述,将sap添加至治疗方案用于改善治疗的安全性,诸如通过降低用单独额外的抗癌治疗剂治疗的受试者中观察到的一种或多种副作用。
[0145]
在某些实施方案中,sap激动剂或sap多肽用作单一治疗和/或用于治疗未经治疗的患者。在某些实施方案中,sap激动剂或sap多肽用于其疾病具有特定纤维化评分、诸如第2级或第3级的骨髓纤维化(如通过分级骨髓纤维化的欧洲共识所评价)的患者中。
[0146]
在某些方面,本发明涵盖作为单一药剂或与另一种药剂组合的sap多肽或sap激动剂用于治疗骨髓纤维化的用途。骨髓纤维化(“mf”)是bcr-abl1阴性骨髓增殖性肿瘤(“mpn”),其从头呈现(初始)真性红细胞增多(“pv”)或基本性血小板增多(“et”),或可以前面是真性红细胞增多(“pv”)或基本性血小板增多(“et”)。原发性骨髓纤维化(pmf)(在文献中也称为特发性骨髓样化生,和原因不明的骨髓样化生)是单核细胞谱系的多能造血祖细胞的克隆性病症(综述于abdel-wahab,o.等人(2009)annu.rev.med.60:233-45;varicchio,l.等人(2009)expert rev.hematol.2(3):315-334;agrawal,m.等人(2011)
cancer 117(4):662-76)。该疾病的特征在于贫血、脾肿大和髓外造血,且以进行性骨髓纤维化和非典型巨核细胞增生为标志。在外周血和多器官髓外红细胞生成中异常流通的cd34+干/祖细胞是该疾病、尤其是脾脏和肝脏中的该疾病的标志。骨髓结构由于进行性纤维化、新血管生成和增加的骨沉积而改变。基于目前鉴定的预后因素,中位存活期范围为少于2年至超过15年(cervantes f等人,blood 113:2895-2901,2009;hussein k等人blood 115:496-499,2010;patnaik m m等人,eur j haematol 84:105-108,2010)。显著百分数的具有pmf的患者在调节造血的基因(包括janus激酶2(jak2)(约50%)(例如,jak2 v617f)或血小板生成素受体(mpl)(5-10%))中具有功能获得性(gain-of-function)突变,导致异常的巨核细胞生长和分化。研究已经表明,克隆造血病症导致成纤维细胞的二次增殖和过度胶原沉积。减少的骨髓纤维化可以改善临床体征和症状,包括贫血、血小板减少、白细胞减少和脾肿大。
[0147]
文献中已知jak2的抑制剂可用于治疗和/或预防骨髓增殖性疾病。参见,例如,tefferi,a.and gilliland,d.g.mayo clin.proc.80(7):947-958(2005);fernandez-luna,j.l.等人haematologica 83(2):97-98(1998);harrison,c.n.br.j.haematol.130(2):153-165(2005);leukemia(2005)19,1843-1844;and tefferi,a.and barbui,t.mayo clin.proc.80(9):1220-1232(2005)。然而,mf的控制选项目前不足以满足所有患者的需要。因此,有必要为mf患者提供额外的治疗选项。
[0148]
在本文提供的方法的一些实施方案中,所述受试者具有原发性骨髓纤维化。在本文提供的组合物和方法的一些实施方案中,所述受试者具有真性红细胞增多后骨髓纤维化(pv后mf)。在一些实施方案中,所述受试者具有基本性血小板增多后骨髓纤维化(et后mf)。在一些实施方案中,所述受试者具有高风险骨髓纤维化。在一些实施方案中,所述受试者具有中等风险骨髓纤维化(诸如中等风险水平1或中等风险水平2)。在一些实施方案中,所述受试者具有低风险骨髓纤维化。在一些实施方案中,所述受试者具有无纤维化的pv或et。在一些实施方案中,所述受试者是人janus激酶2(jak2)的缬氨酸617至苯丙氨酸突变阳性的,或对应于人jak2的缬氨酸617至苯丙氨酸突变的突变阳性的。在一些实施方案中,所述受试者是人janus激酶2(jak2)的缬氨酸617至苯丙氨酸突变阴性的,或对应于人jak2的缬氨酸617至苯丙氨酸突变的突变阴性的。在一些实施方案中,开始用本公开的sap激动剂或sap多肽治疗前,所述受试者具有骨髓纤维化,且所述纤维化是根据分级骨髓纤维化的欧洲共识的分级系统可测量的。在一些实施方案中,开始用本公开的sap激动剂或sap多肽治疗前,所述受试者具有大于或等于第2级的骨髓纤维化。在其它实施方案中,开始用本公开的sap激动剂或sap多肽治疗前,所述受试者具有第3级的骨髓纤维化。
[0149]
在某些方面,所述纤维化癌症是促结缔组织增生性肿瘤,诸如胰腺癌和/或神经内分泌肿瘤。胰腺癌的特征在于明显的促结缔组织增生性反应,胰腺癌有助于其众所周知的化疗剂耐受性的关键组织病理学特征。胰腺癌的该特征现在被认为是胰腺癌中的替代治疗目标。本公开的sap多肽和sap激动剂据信在耗竭或降低促结缔组织增生性基质和/或纤维化中是有效的,使得肿瘤更易用化疗治疗。
[0150]
在某些方面,癌症相关的纤维化是骨髓纤维化。在某些实施方案中,骨髓的纤维化病况是骨髓的慢性骨髓增殖性肿瘤诸如原发性骨髓纤维化的固有特征。在其它实施方案中,骨髓纤维化与恶性病况或由克隆增殖性疾病或血液病症(诸如但不限于毛细胞白血病、
淋巴瘤(例如,霍奇金或非霍奇金淋巴瘤)、多发性骨髓瘤或慢性骨髓性白血病(cml))引起的病况相关。在还有其它实施方案中,骨髓纤维化与实体瘤转移至骨髓相关。
[0151]
在一些实施方案中,所述纤维化与癌症相关,所述癌症包括、但不限于,胆癌(例如,胆管癌),膀胱癌,乳癌(例如,乳腺癌、乳炎症癌、乳乳头状癌、乳髓样癌),脑癌(例如,脑膜瘤;神经胶质瘤,例如星形细胞瘤、少突神经胶质瘤;成神经管细胞瘤),子宫颈癌(例如,子宫颈鳞状细胞癌,子宫颈腺癌),结肠直肠癌(例如,结肠癌、直肠癌、结肠直肠腺癌),食道癌,胃癌,胃肠道间质瘤(gist),头颈癌(例如,头颈鳞状细胞癌,口腔癌(例如,口腔鳞状细胞癌(oscc)),瘢痕瘤,肾癌(例如,肾母细胞瘤又名维耳姆斯肿瘤、肾细胞癌),肝癌(例如,肝细胞癌(hcc),恶性肝癌),肺癌(例如,支气管癌、小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、肺腺癌),白血病(例如,急性淋巴细胞白血病(all),急性骨髓性白血病(aml),慢性髓细胞性白血病(cml),慢性淋巴细胞白血病(cll)),淋巴瘤(例如,霍奇金淋巴瘤(hl),非霍奇金淋巴瘤(nhl),包括、但不限于滤泡性淋巴瘤,弥漫性大b细胞淋巴瘤(dlbcl),套细胞淋巴瘤(mcl)),成神经管细胞瘤,多发性骨髓瘤(mm),骨髓增生异常综合征(mds),骨髓增殖性疾病(mpd)(例如,红细胞增多症(pv),基本性血小板增多症(et),原因不明的髓样化生(amm)又名原发性骨髓纤维化(pmf),慢性中性白细胞白血病(cnl),嗜酸性粒细胞增多综合征(hes)),成神经细胞瘤,神经纤维瘤(例如,神经纤维瘤病(nf)1型或2型,神经鞘瘤病),神经内分泌癌(例如,胃肠胰神经内分泌瘤(gep-net),类癌瘤),骨肉瘤,卵巢癌(例如,囊腺癌、卵巢胚胎癌,卵巢腺癌),胰腺癌(例如,胰腺癌,导管内乳头状粘液性肿瘤(ipmn)),前列腺癌(例如,前列腺癌),皮肤癌(例如,鳞状细胞癌(scc),角化棘皮瘤(ka),黑色素瘤,基底细胞癌(bcc),皮肤纤维瘤),软组织肿瘤(例如,血管脂肪瘤,血管平滑肌瘤,恶性纤维组织细胞瘤(mfh),脂肪肉瘤,恶性周围神经鞘瘤(mpnst),软骨肉瘤,纤维肉瘤,粘液肉瘤,骨肉瘤),以及与组织增生相关的任何其它肿瘤。在此类实施方案中,所述sap多肽或sap激动剂可以减少纤维化,因此导致改进的药物递送和/或存活。
[0152]
治疗方法
[0153]
在一些方面,本公开提供通过向有需要的患者施用治疗有效量的作为单一药剂或与抗癌治疗剂组合的本公开的sap多肽或sap激动剂而治疗纤维化癌症或癌症相关的纤维化的方法。治疗的剂量和频率可以由本领域技术人员确定,并且将取决于患者的症状、年龄和体重以及待治疗或预防的病症的性质和严重性而变化。本公开已经鉴定有效治疗骨髓纤维化的给药方案。
[0154]
根据每周给药时间表或较不频繁的给药时间表(例如,小于每周,诸如每4周)施用单独或与另一种抗癌治疗剂组合的本公开的sap多肽或sap激动剂导致纤维化癌症症状的显著改善。此外,本公开的方法也基于以下发现:本公开的sap多肽或sap激动剂单独和与另一种抗癌治疗剂组合均被良好耐受,而没有sap治疗诱导的临床显著的骨髓抑制(例如,治疗相关的骨髓抑制)的证据。
[0155]
在某些方面,本公开提供用于通过以有效改善受影响的器官发挥功能的量向有需要的患者施用作为单一药剂或与抗癌治疗剂组合的本公开的sap多肽或sap激动剂而治疗患者中的纤维化癌症或癌症相关的纤维化的方法。可以通过,例如,评估器官纤维化的减少、血小板水平的改善、和/或血红蛋白的增加而评估功能的改善。在一些实施方案中,所述纤维化器官是骨髓。在一些实施方案中,所述纤维化癌症是骨髓纤维化。在一些实施方案
中,所述纤维化器官是肺、胃、胰腺、结肠、肝、肾、膀胱、乳房、子宫、子宫颈、卵巢或脑。
[0156]
在一些实施方案中,每天一次或两次,每周一次或两次,每个月一次或两次,或仅在症状发作前或症状发作时将sap多肽或sap激动剂施用于患者。在一些实施方案中,将sap多肽或sap激动剂施用于尚未发展纤维化的具有pv或et的患者,以防止纤维化的发展。
[0157]
剂量可以通过本领域技术人员已知的技术或如本文教导来容易地确定。sap多肽或sap激动剂的毒性和治疗效力可以通过实验动物中的标准药学程序(例如,测定ld
50
和ed
50
)来确定。ed
50
(有效剂量50)是在50%的动物群体中产生指定效应所需的药物的量。ld
50
(致死剂量50)是杀死50%的样品群体的药物剂量。
[0158]
在某些方面,施用sap多肽或sap激动剂作为单一药剂用于治疗受试者中的纤维化癌症或癌症相关的纤维化。在某些方面,施用sap多肽或sap激动剂(例如,本公开的变体sap多肽)和抗癌治疗剂(例如,化疗剂或酪氨酸激酶抑制剂)的组合为治疗受试者中的纤维化癌症(例如,骨髓纤维化或胰腺癌)提供协同效应。所述两种类型的药剂的此类方法、组合或共施用,可用于治疗对当前可用的治疗不响应或耐受的患有纤维化癌症的个体。本文提供的联合疗法也可用于为的确对当前可用的治疗响应的个体改善此类治疗的效力和/或降低此类治疗的副作用。
[0159]
测试的联合疗法导致在患者中观察到的阴性副作用(例如贫血和血小板减少)的改善,所述患者,在开始用sap治疗前,正在用单独的jak激酶抑制剂治疗。
[0160]
在某些实施方案中,本公开提供治疗骨髓纤维化的方法,其包括根据有效改善骨髓纤维化的一种或多种症状的给药方案(例如,剂量和给药时间表)和/或给药时间表将一定量的sap激动剂诸如sap多肽施用于有需要的受试者,其中有需要的受试者先前用jak激酶抑制剂治疗,且已经停止对用jak激酶抑制剂治疗响应。这同样更广泛地适用于具有其它纤维化癌症和/或正在用其它抗癌治疗剂治疗的患者。
[0161]
在某些实施方案中,本公开提供治疗骨髓纤维化的方法,其包括根据有效改善骨髓纤维化的一种或多种症状的给药方案(例如,剂量和给药时间表)和/或给药时间表将一定量的sap激动剂诸如sap多肽施用于有需要的受试者,其中有需要的受试者目前正在用jak激酶抑制剂治疗。因此,本公开部分提供以下方法,其中sap激动剂,诸如sap多肽,可以与jak激酶抑制剂组合使用以便在改善骨髓纤维化的一种或多种症状方面实现比用单独的jak激酶抑制剂治疗骨髓纤维化患者所观察到的更大的治疗效果。在一些实施方案中,本公开的方法不诱导治疗相关的骨髓抑制(例如,sap激动剂不诱导临床显著的骨髓抑制和/或不增加(且可以甚至降低)基线处存在的骨髓抑制。换言之,在某些实施方案中,本公开的方法不诱导或导致与例如开始治疗前观察到的骨髓抑制相比骨髓抑制的恶化。骨髓抑制可以根据编码不良事件的常用术语(common terminology for coding of adverse events,ctcae)在第0级-第5级的量度上进行评价(参见national cancer institute common terminology criteria for adverse events v4.0,nci,nih,dhhs.2009年5月29日nih出版物#09-7473)。在一些实施方案中,骨髓抑制的一种或多种量度,诸如贫血,没有由于治疗而恶化(例如,从第3级至第4级不良事件;从第2级至第3级不良事件)。
[0162]“停止对治疗响应”意指受试者不再具有对治疗的任何响应或已经降低对治疗的响应性,诸如需要增加的剂量或接受减少的益处。在某些实施方案中,有需要的受试者先前用鲁索替尼或用其它jak激酶抑制剂治疗,且已经停止对用鲁索替尼或用其它jak激酶抑制
剂治疗响应。在某些实施方案中,该方法进一步包括施用额外的抗癌治疗。在某些实施方案中,额外的抗癌治疗是受试者先前已经停止响应的相同治疗。
[0163]
在一个方面,本公开提供用于通过施用与抗癌治疗剂组合的sap多肽或sap激动剂而治疗癌症相关的纤维化或纤维化癌症的方法。如本文所使用,“与
…
组合”或“联合施用”是指任何形式的施用,使得第二化合物在机体中仍然是有效的(例如,两种化合物在患者中同时有效,其可以包括两种化合物的协同效应)。有效性可以不与血液、血清或血浆中的药剂的可测量浓度相关。例如,不同的治疗化合物可以在相同制剂中或分开的制剂中同时或相继且以不同的时间表进行施用。因此,接受此类治疗的个体可以得益于不同治疗的联合效应。sap多肽或sap激动剂可以与一种或多种其它额外药剂同时、其前或其后施用。
[0164]
在一些实施方案中,将sap多肽或sap激动剂施用于已经正在接受稳定的抗癌治疗的患者。在一些实施方案中,所述患者已经正在接受稳定的抗癌治疗至少3个月。在一些实施方案中,所述患者已经正在接受稳定的抗癌治疗少于3个月。在一些实施方案中,所述患者已经正在接受稳定的抗癌治疗至少2周、至少3周、至少1个月、至少2个月、至少3个月、至少4个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月或至少一年。在某些实施方案中,稳定的抗癌治疗是jak激酶抑制剂,诸如鲁索替尼。
[0165]
通常,各治疗剂将以对于该特定试剂确定的剂量和/或时间表进行施用。方案中采用的特定组合将考虑sap多肽或sap激动剂与药剂的相容性和/或待实现的期望治疗效果。
[0166]
本发明的抗癌治疗剂可以包括、但不限于化疗剂、基于抗体的药剂、酪氨酸激酶抑制剂、免疫调节剂和生物剂或其组合。化疗剂包括、但不限于放线菌素d、阿地白介素、阿利维a酸、全反式维甲酸/atra、六甲蜜胺、amascrine、门冬酰胺酶、阿扎胞苷、硫唑嘌呤、卡介苗/bcg、苯达莫司汀盐酸盐、贝沙罗汀、比卡鲁胺、博莱霉素、硼替佐米、白消安、卡培他滨、卡铂、卡非佐米、卡莫司汀、苯丁酸氮芥、顺式铂氨/顺铂、克拉屈滨、环磷酰胺/cytophosphane、cytabarine、达卡巴嗪、柔红霉素/道诺霉素、地尼白介素(denileukin diftitox)、右雷佐生、多西他赛、阿霉素、表阿霉素、依托泊苷、氟达拉滨、氟尿嘧啶(5-fu)、吉西他滨、戈舍瑞林、氢化可的松、羟基脲、伊达比星、异环磷酰胺、干扰素α、伊立替康cpt-11、拉帕替尼、来那度胺、亮丙瑞林、氮芥/氮芥/氮芥/hn2(mechlorethamine/chlormethine/mustine/hn2)、巯嘌呤、甲氨蝶呤、甲基泼尼松龙、丝裂霉素、米托坦、米托蒽醌、奥曲肽、奥普瑞白介素、奥沙利铂、紫杉醇、帕米膦酸钠、帕唑帕尼、培门冬酶、培非格司亭、peg干扰素、培美曲塞、喷司他丁、苯丙氨酸氮芥、普卡霉素/光神霉素、泼尼松、泼尼松龙、丙卡巴肼、雷洛昔芬、罗米司亭、沙格司亭、链佐星、他莫昔芬、替莫唑胺、坦罗莫司、替尼泊苷、沙利度胺、硫鸟嘌呤、thiophosphoamide/塞替派、噻替派、拓扑替康盐酸盐、托瑞米芬、维甲酸、戊柔比星、长春碱、长春新碱、长春地辛、长春瑞滨、伏立诺他、唑来膦酸或其组合。基于抗体的药剂包括、但不限于阿仑单抗、贝伐单抗、西妥昔单抗、夫芮木单抗、吉妥单抗奥佐米星、替伊莫单抗、奥法木单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥单抗、曲妥单抗dm1及其组合。免疫调节化合物包括、但不限于抑制tnfα、lps诱导的单核细胞il1β、il12和il6产生的有机小分子。在一些实施方案中,免疫调节剂包括、但不限于甲氨蝶呤、来氟米特、环磷酰胺、环孢素a、米诺环素、硫唑嘌呤、抗生素(他克莫司)、甲基泼尼松龙、皮质类固醇、类固醇、霉酚酸酯、雷帕霉素、咪唑立宾、脱氧精胍菌素、布喹那、t细胞受体调节剂、或细胞因子受体调节剂和toll样受体(tlr)激动剂。在一些实施方案中,免疫调节剂包括5,
6-二甲基咕吨酮-4-乙酸(dmxaa)、沙利度胺、来那度胺、泊马度胺、乳铁蛋白、聚腺苷
–
尿苷酸(聚au)、rintatolimod(聚i:聚c12u;hemispherx biopharma)、用胞苷酸与聚-l-赖氨酸和羧甲基纤维素稳定的聚肌苷酸-聚胞苷酸(聚-iclc,)、咪喹莫特(3m)和瑞喹莫德(r848;3m)、未甲基化的cpg二核苷酸(cpg-odn)和ipilumumab。生物剂包括单克隆抗体(mab)、csf、干扰素和白介素。在一些实施方案中,所述生物剂是il-2、il-3、红细胞生成素、g-csf、非格司亭、干扰素α、阿仑单抗、贝伐单抗、西妥昔单抗、吉妥珠单抗奥佐米星、替伊莫单抗、奥法木单抗、帕尼单抗、利妥昔单抗、托西莫单抗或曲妥珠单抗。
[0167]
酪氨酸激酶抑制剂包括、但不限于阿西替尼、巴非替尼、博舒替尼、西地尼布、克唑替尼、达沙替尼、埃罗替尼、吉非替尼、伊马替尼、拉帕替尼、来那替尼、尼罗替尼、帕纳替尼、quizartinib、瑞格非尼、索拉非尼、舒尼替尼、凡德他尼、瓦他拉尼及其组合。
[0168]
在一些实施方案中,所述抗癌治疗剂是jak激酶抑制剂,诸如,但不限于ac-430、azd1480、baricitinib、bms-911453、cep-33779、cyt387、glpg-0634、来他替尼、ly2784544、ns-018、pacritinib、r-348、r723、鲁索替尼、tg101348(sar302503)、托法替尼和vx-509。
[0169]
在某些实施方案中,所述抗癌治疗剂包括、但不限于抗代谢物(例如,5-氟-尿嘧啶、阿糖胞苷、甲氨喋呤、氟达拉滨和其它),抗微管剂(例如,长春花生物碱类诸如长春新碱、长春花碱;紫杉烷类诸如紫杉醇和多西他赛),烷化剂(例如,环磷酰胺、美法仑、卡莫司汀,亚硝基脲类诸如二氯乙基亚硝基脲和羟基脲),铂试剂(例如,顺铂、卡铂、奥沙利铂、沙铂和ci-973),蒽环类(例如,doxrubicin和柔红霉素),抗肿瘤抗生素(例如,丝裂霉素、伊达比星、阿霉素和道诺霉素),拓扑异构酶抑制剂(例如,依托泊苷和喜树碱),抗血管生成剂(例如,舒尼替尼、索拉非尼和贝伐单抗)或任何其它细胞毒性剂(例如,雌莫司汀磷酸盐、泼尼莫司汀),激素或激素激动剂,拮抗剂,部分激动剂或部分拮抗剂,激酶抑制剂(诸如伊马替尼),和放射治疗。
[0170]
可以根据需要或要求重复本公开的任何治疗方法。例如,所述治疗可以定期进行。施用治疗的频率可以由本领域技术人员确定。例如,治疗可以持续一定周数每周一次施用,或持续一段时间每周多次施用(例如,经治疗的第一周施用3次)。在一些实施方案中,初始负荷剂量时段随后为维持剂量。在一些实施方案中,定期重复所述负荷剂量。在一些实施方案中,所述初始负荷剂量时段包括一周多次施用治疗(例如,经治疗的第一周施用3次)。在一些实施方案中,可以每隔一周、每个月、每两个月、每3个月或每6个月或根据需要重复所述负荷剂量,在负荷剂量之间有或没有继续的定期给药。通常,癌症相关的纤维化的改善持续一段时间,优选至少数月,但抗纤维化效果的维持和/或纤维化的复发的预防可以需要经无限时间段继续定期给药sap多肽或sap激动剂。随着时间推移,所述患者可以经历症状的复发,在该点可以重复治疗。
[0171]
在某些方面,本文提供用于在受试者中治疗骨髓纤维化、延缓骨髓纤维化发展和/或预防骨髓纤维化的方法,其包括向受试者施用有效量的单独或与抗癌治疗剂组合的sap多肽或sap激动剂或其药学上可接受的盐。在一些实施方案中,所述受试者具有骨髓纤维化。在一些实施方案中,所述受试者处于发展骨髓纤维化的风险中。在一些实施方案中,所述受试者是人受试者。本文描述的制剂中的任一种诸如本文描述的胶囊或单位剂型可用于治疗具有骨髓纤维化的受试者。
[0172]
可以通过本文描述的方法治疗的骨髓纤维化包括原发性骨髓纤维化(pmf)和继发
性骨髓纤维化(例如,由先前的真性红细胞增多(pv后mf)或基本性血小板增多(et后mf)产生的骨髓纤维化)。可以通过本文描述的方法治疗的骨髓纤维化还包括高风险、中度风险诸如中度风险水平1或中度风险水平2和低风险的骨髓纤维化。用于诊断各种类型的骨髓纤维化的方法是本领域已知的。参见,例如,cervantes等人,blood 2009,113(13):2895-901。在一些实施方案中,解释诊断后风险概况的改变的动态预测模型可证明是有用的。参见,例如,passamonti等人,blood 2010,115:1703-1708。在一些实施方案中,所述受试者具有可触及的脾肿大。在一些实施方案中,具有骨髓纤维化的受试者具有如通过触诊测量的肋缘下至少5cm的脾脏。在一些实施方案中,所述受试者具有贫血和/或血小板减少和/或白细胞减少。在一些实施方案中,所述受试者不具有贫血或血小板减少或白细胞减少。在一些实施方案中,所述受试者是输血依赖性的。在一些实施方案中,所述受试者不是输血依赖性的。在一些实施方案中,所述受试者具有根据who诊断标准或et/pv后mf的pmf的病理证实的诊断,包括根据iwg-mrt动态国际预后评分系统具有中度-1、中度-2或高风险疾病的至少第2级骨髓纤维化的存在。在一些实施方案中,所述受试者具有根据who诊断标准或et/pv后mf的pmf的病理证实的诊断,根据iwg-mrt动态国际预后评分系统具有第0级或第1级骨髓纤维化和低风险、中度-1、中度-2、高风险或低风险疾病。在一些实施方案中,所述受试者具有“纤维化前”骨髓纤维化。在一些实施方案中,所述受试者具有pv或et,且接受sap多肽或sap激动剂以防止骨髓纤维化的发展。
[0173]
在一些实施方案中,如果受试者是人,则所述受试者具有janus激酶2(jak2激酶)中的缬氨酸617至苯丙氨酸的点突变(jak2v617f),或者如果受试者不是人,则所述受试者具有对应于janus激酶2(jak2激酶)中的缬氨酸617至苯丙氨酸的点突变。在一些实施方案中,如果受试者是人,则所述受试者是jak2的缬氨酸617至苯丙氨酸突变阴性的,或者如果所述受试者不是人,则所述受试者是对应于janus激酶2(jak2激酶)中的缬氨酸617至苯丙氨酸的突变阴性的。受试者是jak2v617f阳性还是阴性可以通过聚集酶链式反应(“pcr”)分析使用来自骨髓细胞或血细胞(例如,全血白细胞)的基因组dna来确定。pcr分析可以是等位基因-特异性pcr技术(例如,等位基因-特异性定量pcr)或pcr测序。参见kittur j等人,cancer 2007,109(11):2279-84和mclornan d等人,ulster med j.2006,75(2):112-9,其各自明确通过引用并入本文。
[0174]
在一些实施方案中,用本文描述的方法的受试者先前已经接受或目前正在接受另一种骨髓纤维化疗法或治疗。在一些实施方案中,所述受试者是其它骨髓纤维化疗法不响应者或在接受其它骨髓纤维化疗法之后具有复发。先前疗法可以是jak2抑制剂(例如,incb018424(也称为鲁索替尼,可得自incyte),cep-701(lestaurtinib,可得自cephalon),或xl019(可得自exelixis))(参见verstovsek s.,hematology am soc hematol educ program.2009:636-42)或非jak2抑制剂(诸如羟基脲)。在一些实施方案中,先前疗法可以是jak激酶抑制剂,诸如,但不限于ac-430、azd1480、baricitinib、bms-911453、cep-33779、cyt387、glpg-0634、incb18424、来他替尼、ly2784544、ns-018、pacritinib、鲁索替尼、tg101348(sar302503)、托法替尼、vx-509、r-348或r723。在一些实施方案中,所述受试者已经接受针对原发性骨髓纤维化、真性红细胞增多后骨髓纤维化(pv后mf)、基本性血小板增多后骨髓纤维化(et后mf)、红细胞增多或基本性血小板增多的鲁索替尼治疗至少三个月。在一些实施方案中,所述受试者已经接受针对原发性骨髓纤维化、真性红细胞增多后骨髓
纤维化(pv后mf)、基本性血小板增多后骨髓纤维化(et后mf)、红细胞增多或基本性血小板增多的鲁索替尼治疗少于三个月。在一些实施方案中,所述受试者已经接受针对原发性骨髓纤维化、真性红细胞增多后骨髓纤维化(pv后mf)、基本性血小板增多后骨髓纤维化(et后mf)、红细胞增多或基本性血小板增多的鲁索替尼治疗至少三个月。在一些实施方案中,在连续鲁索替尼疗法后,至少一种或多种症状已经停止改善。在一些实施方案中,所述受试者不再对鲁索替尼响应。在一些实施方案中,所述受试者先前已经接受另一种骨髓纤维化疗法至少6个月、至少5个月、至少4个月、至少3个月、至少2个月、至少1个月、至少3周或至少2周。在一些实施方案中,所述受试者不再对其它骨髓纤维化疗法响应。在一些实施方案中,所述先前疗法是本文描述的抗肿瘤治疗剂,且在受试者血清中的淀粉酶、脂肪酶、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)和/或肌酸酐的一种或多种升高水平的迹象后,和/或选自贫血、血小板减少和中性白细胞减少的血液病况的迹象后,或由于基于治疗医师的决定或患者的请求的任何其它原因,所述先前疗法已经停止。在一些实施方案中,第二治疗中的化合物的剂量与先前疗法中的剂量相同或比其更低。在一些实施方案中,所述受试者没有接受除了输血以外的任何疗法。在一些实施方案中,所述受试者没有接受任何先前疗法。
[0175]
在一些实施方案中,所述sap多肽或sap激动剂与jak激酶抑制剂组合施用,所述jak激酶抑制剂诸如,但不限于ac-430、azd1480、baricitinib、bms-911453、cep-33779、cyt387、glpg-0634、incb18424、来他替尼、ly2784544、ns-018、pacritinib、鲁索替尼、tg101348(sar302503)、托法替尼、vx-509、r-348或r723(参见kontzias等人curr opin pharmacol.2012,12(4):464-470)。在一些实施方案中,所述sap多肽或sap激动剂与已知降低骨髓纤维化的症状的药剂组合施用,所述已知降低骨髓纤维化的症状的药剂诸如,但不限于ab0024、azd1480、at-9283、bms-911543、cyt387、依维莫司、吉维司他、伊美司他、来他替尼、ly2784544、口服砷、ns-018、pacritinib、帕比司他、聚乙二醇干扰素α-2a、泊马度胺、pracinostat、鲁索替尼、tak-901、和tg101438(sar302503)(mesa,leuk lymphoma 2013,54(2):242-251;gupta等人2012,2(3):170-186;kucine和levine 2011,2(4):203-211)。
[0176]
可以通过以约0.1mg/kg至约40mg/kg的剂量施用所述sap多肽或sap激动剂而治疗所述受试者(诸如人)。在一些实施方案中,所述sap多肽或sap激动剂以10mg/kg的剂量施用。在一些实施方案中,所述化合物以以下剂量施用:约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、8mg/kg、10mg/kg、12mg/kg、15mg/kg、18mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg或40mg/kg中任一种。在一些实施方案中,所述sap多肽或sap激动剂以以下剂量施用:约0.1-0.3、0.3-0.5、0.5-0.8、0.8-1、1-5、5-10、10-15、15-20、20-25、25-30、30-35或35-40mg/kg。所述化合物可以在本文描述的胶囊和/或单位剂型中。在一些实施方案中,静脉内(iv)施用所述化合物。在一些实施方案中,所述化合物通过注射(例如,subq、im、ip)、通过吸入或吹入(通过嘴或鼻)施用,或者所述施用是经口、经颊、舌下、经皮、经鼻、肠胃外或直肠。在一些实施方案中,所述sap激动剂,诸如sap多肽,通过静脉内输注施用。在某些实施方案中,对于各剂量,输注经是约一小时的时段。然而,可以使用更长或更短的输注时段(例如,30分钟、40分钟、45分钟、50分钟、55分钟、1小时十分钟、1小时十五分钟、90分钟等)。当该方法包括施用额外的抗癌治疗剂时,该治疗剂可以通过相同的施用途径或通过不同的施用途径进行施用。在某些实施方案中,经口施用额外的抗癌治疗剂。
[0177]
本文还提供用于改善与骨髓纤维化相关的一种或多种体征或症状的方法。例如,使用本文描述的方法治疗有效降低脾脏大小、改善全身症状(诸如早饱、疲劳、夜间盗汗、咳嗽和瘙痒)、降低mpn-saf总症状评分、减少白血球、减少血小板增多、改善贫血、改善血小板减少、改善白细胞减少、降低输血依赖性、减少jak2v617f等位基因负担、减少外周血原始细胞、减少骨髓原始细胞、减少骨髓纤维化、改善瘙痒、改善恶病质和/或减少或增加骨髓细胞性。与开始用本文提供的方法治疗前的水平相比,降低、减少、减轻或改善可以是至少5、10、20、30、40、50、60、70、80或90%。在一些实施方案中,在治疗之后,所述受试者中骨髓纤维化降低。在一些实施方案中,在治疗之后,骨髓纤维化变为第0级。在一些实施方案中,在治疗之后,骨髓纤维化变为第1级。在一些实施方案中,在治疗之后,所述受试者中脾脏变得不可触及。在一些实施方案中,在治疗之后,所述受试者具有白细胞增多和/或血小板增多的完全消退。在一些实施方案中,在治疗之后,所述受试者具有贫血、血小板减少和/或白细胞减少的完全消退。在一些实施方案中,在治疗之后,所述受试者变得不依赖于输血。在一些实施方案中,在治疗之后,所述受试者具有瘙痒的完全消退。在一些实施方案中,治疗的效力将通过根据国际工作组(iwg)标准分类的总体响应率(orr)的评估来评价,所述国际工作组(iwg)标准经改良以包括以骨髓纤维化改善至少一个级别作为响应的稳定疾病。在一些实施方案中,治疗的效力将通过根据分级骨髓纤维化的欧洲共识评估骨髓纤维化改善至少一个级别来评价。在一些实施方案中,治疗的效力将通过评估循环血浆细胞因子水平(包括但不限于crp、il-1ra、mip-1β、tnfα、il-6和vegf)的水平变化来评价。在一些实施方案中,治疗的效力将通过评估pbmc mrna和mirna表达水平的水平变化来评价。在一些实施方案中,治疗的效力将通过缺乏pv或et进展为骨髓纤维化来评价。在一些实施方案中,治疗的效力将通过缺乏骨髓纤维化增加至少一个级别来评价。
[0178]
在一些实施方案中,与开始用本文提供的方法治疗前的水平相比(例如,与基线相比),使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使脾脏体积有效减小至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%或至少70%。在一些实施方案中,所述治疗使脾脏体积有效减小至少25%。在一些实施方案中,所述治疗使脾脏体积有效减小至少50%。在一些实施方案中,所述治疗使脾脏体积有效减小约20-70%、约20-60%、约25-60%、约25-55%或约25%-50%。在一些实施方案中,脾脏体积可以通过手工触诊来测量。本领域技术人员将理解,也可以采用其它已知测量脾脏体积的方法,诸如通过核磁共振成像测量。在某些实施方案中,本公开提供用于减小有需要的患者中的脾脏体积的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使脾脏体积有效减小至少25%、至少30%、至少35%、至少40%、至少50%或至少55%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,脾脏体积减小约25-55%、约25-50%或约25-40%。
[0179]
在一些实施方案中,与开始用本文提供的方法治疗前的评分相比,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使骨髓增殖性肿瘤症状评价表(mpn-saf)总症状评分有效降低至少20%、至少25%、至少30%、至少35%、至少
40%、至少45%、至少50%、至少55%、至少60%、至少65%或至少70%。对于骨髓增殖性肿瘤症状评价表总症状评分的描述和讨论,参见emanuel等人,2012,journal of clinical oncology,第30卷,第33期,第4098-4013页。在一些实施方案中,所述治疗使mpn-saf总症状评分有效降低至少25%。在一些实施方案中,所述治疗使mpn-saf总症状评分有效降低至少50%。在一些实施方案中,所述症状使用mpn-saf患者报告的结果工具(emanuel等人2012,journal of clinical oncology 30(33):4098-4103)来评价。在某些实施方案中,本公开提供用于降低有需要的患者中的mpn-saf总症状评分的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使mpn-saf总症状评分有效降低至少25%、至少30%、至少35%、至少40%、至少50%、至少55%或至少60%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,所述mpn-saf总症状评分降低约25-60%、约25-55%或约25-50%。
[0180]
在一些实施方案中,与开始用本文提供的方法治疗前的水平相比(例如,与基线相比),使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使血红蛋白水平有效增加至少约500mg/l、1g/l、2g/l、3g/l或5g/l。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比(例如,与基线相比),所述治疗使血红蛋白水平有效增加500-1000mg/l、1-2g/l、2-3g/l或3-5g/l。在一些实施方案中,所述治疗使血红蛋白水平有效增加1g/l。在一些实施方案中,所述治疗使血红蛋白水平有效增加到至少80g/l、至少90g/l、至少100g/l、至少110g/l、至少120g/l、至少130g/l或至少140g/l。在一些实施方案中,所述治疗使血红蛋白水平有效增加到至少100g/l。在一些实施方案中,所述血红蛋白水平被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量血红蛋白水平的方法。在某些实施方案中,本公开提供用于降低有需要的患者中的血红蛋白水平的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使血红蛋白水平有效增加至少约500mg/l、1g/l、2g/l、3g/l或5g/l的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,所述血红蛋白水平增加约500-1000mg/l、1-2g/l、2-3g/l或3-5g/l。在某些实施方案中,所述血红蛋白水平增加到至少约80g/l、90g/l、100g/l、110g/l、120g/l、130g/l或140g/l。
[0181]
在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使红血细胞(rbc)输注有效减少至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%或至少60%。在一些实施方案中,所述治疗使rbc输注有效减少至少25%。在一些实施方案中,所述治疗使rbc输注有效减少至少50%。在一些实施方案中,所述治疗有效实现rbc输注不依赖。在某些实施方案中,本公开提供用于降低有需要的患者中的rbc输注的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使rbc输注有效减少至少约
25%、至少30%、至少35%、至少40%、至少50%、至少55%或至少60%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,rbc输注减少约25-60%、约25-55%或约25-50%。在某些实施方案中,在治疗之后,所述患者变得输血不依赖。
[0182]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)有效减轻血小板减少(当存在时)。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使血小板增加至少50%、至少60%、至少70%、至少80%、至少90%或至少100%。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使血小板增加至少20%-30%、至少30%-40%、至少40%-50%、至少50%-60%、至少60%-70%、至少70%-80%、至少80%-90%或至少90%-100%。在一些实施方案中,所述治疗使血小板有效增加至少100%。在一些实施方案中,所述治疗使血小板增加到至少40x109/l、50x109/l、60x109/l、70x109/l、80x109/l、90x109/l或100x109/l。在一些实施方案中,所述治疗使血小板增加到至少50
–
75x109/l、75-100x109/l或100-150x109/l。在一些实施方案中,所述治疗使血小板增加至50x109/l。在一些实施方案中,所述治疗使血小板增加至100x109/l。
[0183]
在一些实施方案中,血小板被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量血小板的方法。在某些实施方案中,本公开提供用于增加有需要的患者中的血小板的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使血小板有效增加至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,血小板增加约50%-60%、60%-70%、70%-80%、80%-90%或90%-100%。
[0184]
在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使血小板输注有效减少至少25%、30%、40%、50%、60%、75%或100%。在一些实施方案中,所述治疗使血小板输注减少至少50%。在某些实施方案中,本公开提供用于减少有需要的患者中的血小板输注的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使血小板输注有效减少至少30%、至少40%、至少50%、至少60%或至少70%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,血小板输注减少约25%-40%、25%-50%、50%-70%或70%-100%。
[0185]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)有效减轻血小板增多(当存在时)。在一些实施方案中,与开始用本文
提供的方法治疗前的水平相比,所述治疗使血小板减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%或至少50%。在一些实施方案中,所述治疗使血小板减少25%。在一些实施方案中,所述治疗使血小板减少至正常水平。在一些实施方案中,血小板被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量血小板的方法。在某些实施方案中,本公开提供用于减少有需要的患者中的血小板的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使血小板有效减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%或至少50%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,血小板减少约10%-15%、至少15%-25%或至少25%-35%。
[0186]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)有效减轻中性白细胞减少(当存在时)。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使绝对中性白细胞计数(anc)增加至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使anc增加至少20%-30%、至少30%-40%、至少40%-50%、至少50%-60%、至少60%-70%、至少70%-80%、至少80%-90%或至少90%-100%。在一些实施方案中,所述治疗使anc有效增加至少50%。在一些实施方案中,所述治疗使anc增加到至少1000μl、至少1250/μl、至少1500/μl、至少1750/μl或至少2000/μl。在一些实施方案中,所述治疗使anc增加到至少1250-1500/μl、至少1500-1750/μl或至少1750-2000/μl。在一些实施方案中,所述治疗使anc增加到至少1500/μl。在一些实施方案中,anc被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量anc的方法。在某些实施方案中,本公开提供用于增加有需要的患者中的anc的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使anc有效增加至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,anc增加约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%、至少60%-70%、至少70%-80%、至少80%-90%或至少90%-100%。
[0187]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)有效减轻白细胞减少(当存在时)。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使白血细胞(wbc)增加至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使wbc增加至少20%-30%、至少30%-40%、至少40%-50%、至少50%-60%、至少60%-70%、至少70%-80%、至少80%-90%或至少90%-100%。在一些实施方案中,所述治疗使wbc有效增加至少50%。在一些实
施方案中,所述治疗使wbc增加到至少4x109/l、5x109/l、7.5x109/l或10x109/l。在一些实施方案中,所述治疗使wbc增加至10x109/l。在一些实施方案中,所述治疗使wbc增加至正常范围。在一些实施方案中,wbc被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量wbc的方法。在某些实施方案中,本公开提供用于增加有需要的患者中的wbc的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使wbc有效增加至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,wbc增加约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%、至少60%-70%、至少70%-80%、至少80%-90%或至少90%-100%。
[0188]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)有效减轻白细胞增多(当存在时)。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使anc减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少50%、至少60%或至少70%,而没有使anc减少低于1500/μl。在一些实施方案中,所述治疗使anc减少25%。在一些实施方案中,所述治疗使anc减少50%。在一些实施方案中,所述治疗使anc减少至正常水平。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使白血细胞(wbc)减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少50%、至少60%或至少70%,而没有使wbc减少低于正常下限。在一些实施方案中,所述治疗使wbc减少25%。在一些实施方案中,所述治疗使wbc减少50%。在一些实施方案中,所述治疗使wbc减少至《35x109/l、《30x109/l、《25x109/l、《20x109/l或《15x109/l。在一些实施方案中,所述治疗使wbc减少至《25x109/l。在一些实施方案中,所述治疗使wbc减少至正常范围。在一些实施方案中,anc和wbc被测量为常规全血计数(cbc)的部分。本领域技术人员将理解,也可以采用其它已知测量anc或wbc的方法。在某些实施方案中,本公开提供用于减少有需要的患者中的anc或wbc的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使anc或wbc有效减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少50%、至少60%或至少70%、而没有使wbc减少低于正常下限的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,anc或wbc减少约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%或至少60%-70%,而没有使wbc减少低于正常下限。
[0189]
在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使外周血原始细胞有效减少至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或至少70%。在一些实施方案中,所述治疗使外周血原始细胞有效减少至少50%。在一些实施方案中,所述治疗使外周血原始细胞从≥1有效减少至《1。本领域技术人
员将理解,可以采用本领域已知测量外周血原始细胞的任何方法。在某些实施方案中,本公开提供用于减少有需要的患者中的外周血原始细胞的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使外周血原始细胞有效减少至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或至少70%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,外周血原始细胞减少约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%或至少60%-70%。在某些实施方案中,外周血原始细胞从≥1减少至《1。
[0190]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使骨髓纤维化从第3级有效降低至第2级(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)。在一些实施方案中,所述治疗使骨髓纤维化从第3级有效降低至第1级。在一些实施方案中,所述治疗使骨髓纤维化从第3级有效降低至第0级。在一些实施方案中,所述治疗使骨髓纤维化从第2级有效降低至第1级。在一些实施方案中,所述治疗使骨髓纤维化从第2级有效降低至第0级。在一些实施方案中,与开始用本文提供的方法治疗前的水平相比,所述治疗使骨髓纤维化有效降低至少5、10、20、30、40、50、60、70、80或90%。本领域技术人员将理解,可以采用本领域已知评估骨髓纤维化的任何方法。在某些实施方案中,本公开提供用于降低有需要的患者中的骨髓纤维化的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使骨髓纤维化有效降低至少5、10、20、30、40、50、60、70、80或90%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,骨髓纤维化降低约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%或至少60%-70%。
[0191]
在一些实施方案中,使用本文描述的方法治疗(例如,使用sap多肽或sap激动剂的单一药剂或联合疗法)使骨髓原始细胞从≥5%有效减少至《5%。本领域技术人员将理解,可以采用本领域已知测量骨髓原始细胞的任何方法。在某些实施方案中,本公开提供用于减少有需要的患者中的骨髓原始细胞的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使骨髓原始细胞有效减少至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或至少70%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,骨髓原始细胞减少约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%或至少60%-70%。
[0192]
在一些实施方案中,所述治疗有效改善骨髓细胞性。与开始用本文提供的方法治疗前的水平相比,所述改善可以是至少20、30、40、50、60或70%。在某些实施方案中,本公开
提供用于改善有需要的患者中的骨髓细胞性的方法,其中所述有需要的患者具有骨髓纤维化,所述方法包括根据使骨髓细胞性有效改善至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或至少70%的给药时间表施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂,诸如sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽,且所述额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。在某些实施方案中,骨髓细胞性改善约20%-30%、至少30%-40%、至少40%-50%、至少50%-60%或至少60%-70%。
[0193]
在某些实施方案中,使用本文描述的方法治疗(例如使用sap多肽或sap激动剂的单一试剂或联合疗法)导致本文描述的效果中的至少一种(例如,脾脏体积的减小、mpn-saf总症状评分的降低、血红蛋白的增加、rbc输注的减少、血小板减少的改善、血小板输注的减少、血小板增多的改善、中性白细胞减少的改善、白细胞增多的改善、外周血原始细胞的减少、骨髓纤维化的减少、骨髓原始细胞的减少或骨髓细胞性的改善)。在一些实施方案中,使用本文描述的方法治疗导致本文描述的效果中的至少两种。在一些实施方案中,使用上述方法治疗导致本文描述的效果中的至少三种、四种、五种、六种、七种、八种、九种或十种。在任何上述的某些实施方案中,在随着时间推移的一个或多个点,诸如治疗至少12、18、20或至少24周之后,或治疗大于24周之后,评估是否已经实现症状或治疗效果的特定程度的改善。
[0194]
在一些实施方案中,使用本文描述的方法中的一种或多种治疗(例如使用本公开的sap多肽或sap激动剂的单一试剂或联合疗法)导致本文描述的效果中的至少一种(例如,脾脏体积的减小、mpn-saf总症状评分的降低、血红蛋白的增加、rbc输注的减少、输血非依赖性的实现、血小板减少的改善、血小板输注的减少、血小板增多的改善、中性白细胞减少的改善、白细胞增多的改善、外周血原始细胞的减少、骨髓纤维化的减少、骨髓原始细胞的减少或骨髓细胞性的改善),而不引起或诱导临床显著的骨髓抑制。在一些实施方案中,使用本文描述的方法中的一种或多种治疗导致本文描述的效果中的至少两种,而不引起或诱导临床显著的骨髓抑制。在一些实施方案中,使用上述方法中的一种或多种治疗导致本文描述的效果中的至少三种、四种、五种、六种、七种、八种、九种或十种,而不引起或诱导临床显著的骨髓抑制。在一些实施方案中,使用本文描述的方法中的一种或多种治疗导致无骨髓移植。在某些实施方案中,任何前述方法包括施用sap,所述sap包含糖基化不同于纯化自人血清的sap的糖基化的sap多肽,诸如重组人sap(例如,cho细胞中产生的重组人五聚环蛋白-2)。在某些实施方案中,任何上述方法包括根据给药时间表施用sap激动剂或sap多肽,其中在根据所述给药时间表施用之后实现任何上述治疗效果。在某些实施方案中,在根据给药时间表施用(例如,施用包括根据给药时间表施用)之后实现上述治疗效果中的一种或多种。在治疗过程中的一个或多个时间点,例如,在治疗至少12、至少18、至少20、至少24或超过24周之后,评估任何前述参数(例如,症状的减少)的改善。
[0195]
对于患者中的改善的任何前述实例,例如一种或多种症状的改善,在某些实施方案中,本公开提供所述治疗包括以有效具有治疗效果的剂量和给药时间表施用sap激动剂或sap多肽。在某些实施方案中,该剂量和给药时间表也减少用另一种抗癌疗法经历的一种或多种副作用。
[0196]
在其它实施方案中,所述治疗替代或另外改善纤维化癌症的一种或多种其它症状。在某些实施方案中,治疗减少疼痛、减小肿瘤大小、减少体重下降、改善体重增加、增加无进展存活率或以其它方式改善患者的生活质量。
[0197]
在一些实施方案中,所述sap多肽或sap激动剂以给药时间表施用于受试者,所述给药时间表包括每周至少一次施用所述sap多肽或sap激动剂,持续28天周期的至少1个周期、至少2个周期、至少3个周期、至少4个周期、至少5个周期、至少6个周期、至少7个周期或至少8个周期。在一些实施方案中,将所述sap多肽或sap激动剂每周至少一次施用于受试者,持续28天周期的至少6个周期、28天周期的至少8个周期、28天周期的至少10个周期、28天周期的至少12个周期、28天周期的至少15个周期、28天周期的至少18个周期或28天周期的至少24个周期。在一些实施方案中,将所述化合物每周一次施用于受试者,持续至少一个月、至少两个月、至少三个月、至少四个月、至少五个月、至少六个月、至少八个月、至少一年或至少两年。在进一步实施方案中,在治疗的第一周每隔一天施用所述化合物。在一些实施方案中,以给药时间表施用所述sap多肽或sap激动剂,所述给药时间表包括每4周施用所述sap多肽或sap激动剂,持续28天或4周周期的至少1个周期、至少2个周期、至少3个周期、至少4个周期、至少5个周期、至少6个周期、至少7个周期或至少8个周期。在一些实施方案中,将所述sap多肽或sap激动剂每4周一次施用于受试者,持续28天周期的至少6个周期、28天周期的至少8个周期、28天周期的至少10个周期、28天周期的至少12个周期、28天周期的至少15个周期、28天周期的至少18个周期或28天周期的至少24个周期。在一些实施方案中,将所述化合物每4周一次施用于受试者,持续至少一个月、至少两个月、至少三个月、至少四个月、至少五个月、至少六个月、至少八个月、至少一年或至少两年,且可能经患者一生长期施用。在进一步实施方案中,在治疗的第一周每隔一天施用所述sap多肽或sap激动剂。在一些实施方案中,每4周几天(例如第1、3和5天)施用所述sap多肽或sap激动剂,持续28天周期的至少6个周期、28天周期的至少8个周期、28天周期的至少10个周期、28天周期的至少12个周期、28天周期的至少15个周期、28天周期的至少18个周期或28天周期的至少24个周期。在一些实施方案中,将所述化合物每4周几天(例如第1、3和5天)施用于受试者,持续至少一个月、至少两个月、至少三个月、至少四个月、至少五个月、至少六个月、至少八个月、至少一年或至少两年,且可能经患者一生长期施用。在某些实施方案中,所述给药时间表导致本文描述的效果(例如,一种或多种症状或参数的改善)中的至少一种(例如,脾脏体积的减小、mpn-saf总症状评分的降低、血红蛋白的增加、rbc输注的减少、输血非依赖性的实现、血小板减少的改善、血小板输注的减少、血小板增多的改善、中性白细胞减少的改善、白细胞增多的改善、外周血原始细胞的减少、骨髓纤维化的减少、骨髓原始细胞的减少或骨髓细胞性的改善)。在一些实施方案中,所述给药时间表导致本文描述的效果中的至少两种。在一些实施方案中,所述给药时间表导致本文描述的效果中的至少三种、四种、五种、六种、七种、八种、九种或十种。在某些实施方案中,所述sap激动剂包含重组人sap。
[0198]
在某些实施方案中,本公开提供用于根据包括施用sap多肽或sap激动剂的给药时间表使用剂量方案施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂或化疗剂)组合的一定量的sap激动剂诸如sap多肽的方法,其包括在周期1的第1、3、5、8、15和22天以及各随后28天周期的第1、8、15和22天施用10mg/kg sap多肽,诸如糖基化不同于纯化自血清的人sap的糖基化的sap多肽。在某些实施方案中,所述sap激动剂包含sap多肽,且额外的抗癌
治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。
[0199]
在某些实施方案中,本公开提供用于根据包括施用sap多肽或sap激动剂的给药时间表使用剂量方案施用单独或与额外的抗癌治疗剂(例如,jak激酶抑制剂)组合的一定量的sap激动剂诸如sap多肽的方法,其包括在周期1的第1、3和5天以及各随后28天周期的第1天施用10mg/kg sap多肽或sap激动剂。在某些实施方案中,所述sap激动剂包含sap多肽,且额外的抗癌治疗剂是jak激酶抑制剂。在某些实施方案中,所述jak激酶抑制剂是鲁索替尼。
[0200]
在一些实施方案中,所述sap多肽或sap激动剂在第一周期过程中施用多次(例如第1、3和5天),随后每周、每两周、每三周或每4周施用。在一些实施方案中,所述sap激动剂每周、每隔一周、每三周、每个月、每隔一个月、每三个月、每六个月或根据需要施用多次。在一些实施方案中,所述sap多肽或sap激动剂通过iv输注施用。在一些实施方案中,所述sap多肽或sap激动剂以10mg/kg的剂量施用。在一些实施方案中,所述sap多肽或sap激动剂以本文所述的任何剂量施用。在一些实施方案中,所述sap多肽或sap激动剂组合抗癌疗法施用。在一些实施方案中,所述受试者已经接受持续至少6个月、至少5个月、至少4个月、至少3个月、至少2个月、至少1个月、至少3周或至少2周的抗癌疗法的稳定剂量。在一些实施方案中,所述受试者已经接受持续至少3个月的抗癌疗法的稳定剂量。在一些实施方案中,当用抗癌疗法治疗时,所述受试者持续至少2周、至少3周、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月不显示一种或多种症状的任何改善。在一些实施方案中,所述抗癌疗法是如本文所述的jak激酶抑制剂。在一些实施方案中,所述jak激酶抑制剂是鲁索替尼。在一些实施方案中,所述抗癌疗法以先前确定有效的剂量施用。在一些实施方案中,根据需要调整本文所述的剂量方案以实现本文所述的治疗结果之一。
[0201]
在一些实施方案中,本文公开的方法包括在实现初始响应之后施用一个或多个额外剂量的sap多肽或sap激动剂。在一些实施方案中,在受试者中实现初始响应之后施用一个或多个额外剂量的sap多肽或sap激动剂之后实现随后响应。随后响应可以是额外响应(例如最初没有观察到本文所述的任何响应),初始响应的维持,或初始响应后的改善。在一些实施方案中,一个或多个额外剂量的施用基本上维持初始响应。在一些实施方案中,一个或多个额外剂量的施用提供相对于初始响应的进一步改善。在一些实施方案中,一个或多个额外剂量的施用提供最初没有观察到的一种或多种额外响应。在某些实施方案中,所述sap激动剂包含sap多肽,诸如重组人sap。
[0202]
在一些实施方案中,将sap多肽或sap激动剂或其药学上可接受的盐施用于受试者诸如人受试者后,在剂量后约0.5至约5小时、约1.5至约4.5小时、约2至约4小时或约2.5至约3.5小时内实现化合物的c
max
(最大药物浓度)。在一些实施方案中,将化合物施用于人受试者后,化合物的消除半衰期为约11至110小时、20-72小时、12至约40小时、约16至约34小时或约20至约40小时。在一些实施方案中,所述化合物的平均auc的增加超过与范围为约0.1mg至约40mg/kg的剂量增加成比例。在一些实施方案中,当所述化合物每周一次给药时,所述化合物的积累在稳定状态时为约1.1至约5倍、约1.25至约4.0倍、约1.5至约3.5倍、约2至约3倍的。在一些实施方案中,当所述化合物每周给药时,所述化合物不积累。
[0203]
本公开还提供用于治疗纤维化癌症或癌症相关的纤维化的药剂盒,其包含一种或多种sap多肽或sap激动剂。在一些实施方案中,所述试剂盒可以包括待与一种或多种sap多肽或sap激动剂结合施用的如本文所述的抗癌治疗剂。所述sap多肽或sap激动剂和抗癌治
疗剂可以配制为结合施用。所述药剂盒的活性剂可以单独施用或以组合制剂施用。所述活性剂可以同时或以不同的给药时间表施用。在前述任何的某些实施方案中,所述sap激动剂包含重组人sap。
[0204]
药学制备物和制剂
[0205]
在一些实施方案中,本文描述的方法涉及将至少一种本发明的sap多肽(例如,变体sap多肽)作为治疗剂施用于受试者。本发明的治疗剂可以常规方式使用使用一种或多种生理上可接受的载体或赋形剂进行配制。例如,可以配制治疗剂及其生理上可接受的盐和溶剂化物用于通过例如静脉内输注(iv)、注射(例如subq、im、ip)、吸入或吹入(通过口或鼻)或经口、经颊、舌下、经皮、经鼻、肠胃外或直肠施用。在某些实施方案中,治疗剂可以局部施用,在目标细胞存在的位点,即,在特定组织、器官或液体(例如,血液、脑脊髓液、肿瘤质等)。
[0206]
本发明进一步提供本发明的任何sap多肽或sap激动剂在制备用于治疗或预防患者中的如本文描述的病症或病况的药物中的用途,例如,sap多肽或sap激动剂在制备用于治疗本文描述的病症或病况的药物中的用途。在一些方面,本发明的sap多肽或sap激动剂可用于制备用于治疗或预防如本文描述的疾病或病况的药学制备物。
[0207]
治疗剂可以配制用于通过多种施用模式,包括全身性和表面或局部施用。技术和制剂通常可见于remington’s pharmaceutical sciences,meade publishing co.,easton,pa。对于肠胃外施用,注射是优选的,包括肌内、静脉内、腹膜内和皮下。对于注射,化合物可以配制于溶液,优选生理相容的缓冲液,例如hank氏溶液或ringer氏溶液。此外,化合物可以配制为固体形式并在临使用前溶解或悬浮。也包括冻干的形式。在一些实施方案中,可以通过本领域技术人员已知的多种方法向细胞施用治疗剂,所述方法包括但不限于:封装于脂质体中,通过离子电渗法,或通过并入其它介质,诸如水凝胶、环糊精、生物可降解的纳米胶囊以及生物粘附的微球体。
[0208]
对于口服施用,药物组合物可以采取以下形式,例如,片剂、锭剂或胶囊,其通过常规方式用药学上可接受的赋形剂制备,所述药学上可接受的赋形剂诸如,粘合剂(例如,预胶凝的玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素);填充剂(例如乳糖、微晶纤维素或磷酸氢钙);润滑剂(例如硬脂酸镁、滑石或硅石);崩解剂(例如,马铃薯淀粉或羟基乙酸淀粉钠);或润湿剂(例如十二烷基硫酸钠)。片剂可以通过本领域众所周知的方法包被。用于口服施用的液体制备物可以采取以下形式,例如,溶液、糖浆或悬浮液,或者它们可以呈现为干燥产品,用于在使用前以水或其它合适的媒介物复原。此类液体制备物可以通过常规方式用药学上可接受的添加剂制备,所述药学上可接受的添加剂诸如,悬浮剂(例如,山梨醇浆料、纤维素衍生物或氢化食用脂);乳化剂(例如,卵磷脂或阿拉伯树胶);非水性媒介物(例如,杏仁油、油性酯、乙醇或分馏的植物油);和防腐剂(例如,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸)。当需要时,所述制备物还可以含有缓冲盐、香味剂、着色剂和甜味剂。用于口服施用的制备物可以合适地配制以提供活性化合物的受控释放。
[0209]
对于通过吸入施用(例如肺部递送),治疗剂可以方便地以从加压包或雾化器呈现气雾剂喷雾剂的形式递送,其使用合适的推进剂,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其它合适的气体。在加压气雾剂的情况下,剂量单元可以通过提供递送计量的量的阀门来确定。用于吸入器或吹入器的胶囊和药筒(例如明胶的胶囊和药筒)可以
配制为含有化合物和合适的粉末基质诸如乳糖或淀粉的粉末混合物。
[0210]
在本发明的方法中,药学化合物也可以通过鼻内或支气管内途径施用,包括吸入、粉末和气雾剂制剂(例如,类固醇吸入剂,参见rohatagi(1995)j.clin.pharmacol.35:1187-1193;tjwa(1995)ann.allergy asthma immunol.75:107-111)。例如,可以将气雾剂制剂置于加压的可接受的推进剂、例如二氯二氟甲烷、丙烷、氮气等中。它们也可以配制为非加压制备物的药物,诸如在喷雾器或雾化器中。通常,此类施用在水性的药学上可接受的缓冲液中。
[0211]
sap多肽或sap激动剂的适合于呼吸道递送(例如鼻内、吸入等)的药物组合物可以配制为固体或液体形式。
[0212]
本发明的sap多肽或sap激动剂可以配制用于通过注射的肠胃外施用,例如通过推注或连续输注。用于注射的制剂可以单元剂量形式呈现,例如在安瓿或多剂量容器中,其中添加防腐剂。所述组合物可以采用以下形式,诸如,油性或水性媒介物中的悬浮液、溶液或乳液,并且可以含有配制试剂,诸如悬浮剂、稳定剂和/或分散剂。或者,活性成分可以呈粉末形式,用于在使用前用合适的媒介物、例如无菌的无热原的水来复原。
[0213]
此外,本发明的sap多肽或sap激动剂还可以配制为储库制剂。此类长效制剂可以通过植入(例如皮下或肌内)或通过肌内注射来施用。因此,例如,治疗剂可以与合适的聚合材料或疏水性材料(例如,作为可接受的油中的乳液)或离子交换树脂一起配制,或作为微溶性衍生物,例如,作为微溶性的盐。控释制剂也包括贴剂。
[0214]
在某些实施方案中,本文描述的化合物可以配制用于递送至中枢神经系统(cns)(综述于begley,pharmacology&therapeutics 104:29-45(2004))。用于将药物递送至cns的常规方法包括:神经外科方法(例如大脑内注射或脑室内注入);药剂的分子操作(例如,产生嵌合的融合蛋白,其包含具有对于内皮细胞表面分子的亲和力的转运肽,以及在尝试利用血脑屏障的内源性转运途径之一中本身不能跨越血脑屏障的药剂);设计为增加药剂的液体溶解性的药理学策略(例如,将水溶性药剂缀合至脂质或胆固醇载体);以及通过高渗破坏(由于甘露醇溶液注入颈动脉或使用生物活性试剂诸如血管紧张素肽而导致)短暂破坏bbb的完整性。
[0215]
在一些实施方案中,将本发明的sap多肽或sap激动剂并入含有表面载体的表面制剂中,所述表面载体通常适合于表面药物施用并且包含本领域已知的任何此类材料。可以将表面载体选择为以期望的形式提供组合物,例如膏、洗液、霜、微乳剂、胶、油、溶液等,并且可以由天然存在或合成来源的物质构成。优选的是,所选的载体不会不利影响表面制剂的活性试剂或其它组分。用于本文的合适的表面载体的实例包括水、醇和其它无毒性有机溶剂,甘油,矿物油,硅酮,凡士林,羊毛脂,脂肪酸,植物油,对羟苯甲酸酯,蜡等。
[0216]
药物组合物(包括美容制备物)可以包含以重量计约0.00001%至100%、诸如0.001%至10%或0.1%至5%的一种或多种本文描述的sap多肽或sap激动剂。在某些表面制剂中,活性剂以以下的量存在:所述制剂的近似0.25wt.%至75wt.%的范围内,优选所述制剂的近似0.25wt.%至30wt.%的范围内,更优选所述制剂的近似0.5wt.%至15wt.%的范围内,且最优选所述制剂的近似1.0wt.%至10wt.%的范围内。
[0217]
眼睛的病况可以通过例如全身性、表面性、眼内注射治疗剂,或通过插入释放治疗剂的持续释放装置来治疗或预防。本发明的sap多肽或sap激动剂可以在药学上可接受的眼
科媒介物中递送,使得化合物保持与眼睛表面接触足以允许化合物渗入眼睛的角膜和内部区域(例如,前房、结膜、后房、玻璃体、眼房水、玻璃体液、角膜、虹膜/睫、晶状体、脉络膜/视网膜和巩膜)的时间段。药学上可接受的眼科媒介物可以是,例如,膏、植物油或封装材料。或者,所述化合物可以直接注入玻璃体液和眼房水。在进一步替代方案中,化合物可以全身施用,诸如通过静脉内注入或注射,用于治疗眼睛。
[0218]
本文描述的治疗剂可以根据本领域的方法储存于无氧环境下。
[0219]
示例性组合物包含sap多肽或sap激动剂与一种或多种药学上可接受的载体,以及,任选地其它治疗成分。在与组合物中的其它成分相容并且不在受试者中引发不可接受的有害效应的意义上,所述载体必须是“药学上可接受的”。此类载体描述于本文中或者另外是药理学领域的技术人员众所周知的。在一些实施方案中,所述药物组合物是无热原的,并且适合于施用于人受试者。在一些实施方案中,所述药物组合物是无刺激物的并且适合于施用于人受试者。在一些实施方案中,所述药物组合物是无变应原的并且适合于施用于人受试者。所述组合物可以通过药学领域众所周知的任何方法制备。
[0220]
在一些实施方案中,sap多肽或sap激动剂在时间释放制剂中施用,例如,在包括缓释聚合物的组合物中施用。可以用保护免于迅速释放的载体来制备sap多肽或sap激动剂。实例包括控释媒介物,诸如聚合物、微胶囊化递送系统或生物粘附性凝胶。或者,可以通过在组合物中包括延迟吸收的试剂(例如单硬脂酸铝水凝胶和明胶)来实现sap多肽或sap激动剂的延长递送。
[0221]
用于递送核酸化合物的方法是本领域已知的(参见,例如akhtar等人,1992,trends cell bio.,2,139;and delivery strategies for antisense oligonucleotide therapeutics,编akhtar,1995;sullivan等人,pct公开号wo 94/02595)。这些方案可用于递送基本上任何核酸化合物。可以通过本领域技术人员已知的多种方法将核酸化合物施用于细胞,所述方法包括但不限于:封装于脂质体中,通过离子电渗法,或通过并入其它媒介物,诸如水凝胶、环糊精、生物可降解的纳米胶囊以及生物粘附的微球体。或者,通过直接注射或通过使用输注泵局部递送核酸/媒介物组合。其它递送途径包括、但不限于:经口(片剂或丸剂形式)和/或鞘内递送(gold,1997,neuroscience,76,1153-1158)。其它方法包括使用多种转运和载体系统,例如通过使用缀合物和生物可降解的聚合物。对于药物递送策略的全面综述,参见ho等人,1999,curr.opin.mol.ther.,1,336-343和jain,drug delivery systems:technologies and commercial opportunities,decision resources,1998和groothuis等人,1997,j.neurovirol.,3,387-400。核酸递送和施用的更详细的描述提供于sullivan等人,supra,draper等人,pct wo93/23569,beigelman等人,pct公开号wo99/05094,and klimuk等人,pct公开号wo99/04819。
[0222]
以下实施例用于更详细地描述使用上述发明的方式,以及用于记载考虑用于实施本发明的多个方面的最佳方式。应该理解,这些实施例无论如何不用于限制本发明的真实范围,而是为了说明性目的而呈现。
实施例
[0223]
实施例1:用单独和与鲁索替尼(ruxolitinib)组合的含有α2,3-唾液酸的sap治疗骨髓纤维化:12周时的1期结果
[0224]
将重组人sap(在该情况下是被称为prm-151的重组人sap)单独和与鲁索替尼(rux)组合施用于骨髓纤维化(mf)患者,以评估在治疗骨髓纤维化(bmf)中的安全性和效力。未接受治疗或接受稳定剂量的rux的具有中等-1、中等-2或级别≥2bmf的高风险mf的患者有资格参加本研究。
[0225]
基于施用prm-151作为单一治疗或作为联合疗法的部分将二十七个患者分配至四个组群之一。组群1:
ⅰ
)在至少两周内没有接受针对mf的治疗的患者,
ⅱ
)在第1、3和5天通过静脉内输注(~1小时输注)以10mg/kg施用sap的初始负荷剂量,且iii)其后通过静脉内输注(~1小时输注)以10mg/kg每四周施用sap的剂量。组群2:
ⅰ
)在至少两周内没有接受针对mf的治疗的患者,
ⅱ
)在第1、3和5天通过静脉内输注(~1小时输注)以10mg/kg施用sap的初始负荷剂量,且iii)其后通过静脉内输注(~1小时输注)以10mg/kg每周施用sap的剂量。组群3:
ⅰ
)持续至少12周施用鲁索替尼的稳定剂量(例如,持续至少3个月施用鲁索替尼而没有任何剂量改变),在最后四周过程中脾脏没有改善,
ⅱ
)在第1、3和5天通过静脉内输注(~1小时输注)以10mg/kg施用sap的初始负荷剂量,iii)其后通过静脉内输注(~1小时输注)以10mg/kg每周施用sap的剂量,且iv)以他们进入研究时的剂量口服施用rux。组群4:
ⅰ
)持续至少12周施用鲁索替尼的稳定剂量(例如,持续至少3个月施用鲁索替尼而没有任何剂量改变),在最后四周过程中脾脏没有改善,
ⅱ
)在第1、3和5天通过静脉内输注(~1小时输注)以10mg/kg施用sap的初始负荷剂量,iii)其后通过静脉内输注(~1小时输注)以10mg/kg每四周施用sap的剂量,且iv)以他们进入研究时的剂量口服施用rux。
[0226]
针对bmf和其它mf相关并发症(包括,例如,异常血细胞参数、脾肿大和如通过mpn-saf评价的症状)的改善监测各组群中的患者。具体而言,针对根据骨髓纤维化伴随骨髓样化生的治疗响应的国际工作组共识标准(the international working group consensus criteria for treatment response in myelofibrosis with myeloid metaplasia)的总体响应率监测患者(tefferi a,cervantes f,mesa r,等人revised response criteria for myelofibrosis:international working group-myeloproliferative neoplasms research and treatment(iwg-mrt)and european leukemianet(eln)consensus report.blood.2013;122:1395-1398)。还针对以下监测患者:不良事件的发生率,根据分级骨髓纤维化的欧洲共识(thiele j,kvasnicka hm,facchetti f,等人european consensus on grading bone marrow fibrosis and assessment of cellularity.haematologica 2005;90:1128-1132.)的骨髓纤维化的变化,改良的骨髓增殖性肿瘤症状评价表(mpn-saf)评分(emanuel等人2012,journal of clinical oncology 30(33):4098-4103)的变化,以及药代动力学参数,包括,例如,最大药物浓度(cmax),至最大浓度的时间(tmax),曲线下面积(auc),清除率和分布容积。
[0227]
治疗24周之后,没有明显的治疗相关的骨髓抑制,且≥2个受试者中发生的级别≥2不良事件,无论相关性,列于下表1中。下面各列中所示的数字表明报告不良事件的患者的数目。空白单元表明该组群中的任何受试者中都没有观察到不良事件。
[0228]
表1.
[0229][0230]
在基线和治疗三个月之后获得骨髓活检样品并进行检查。在检查的27个受试者中的5个中观察到bmf的改善。具体地,观察到一个用sap每周治疗的患者(组群2患者)在治疗12周之后具有第3级至第2级的改善,观察到一个用sap每四周治疗的患者(组群1患者)在治疗12周之后具有从第2级至第0级的改善,观察到一个除了鲁索替尼以外用sap每4周治疗的患者(组群4患者)(具有11个先前显示第3级纤维化的骨髓活检样品)具有第3级至12周时的第1级和24周时的第2级的改善,且观察到一个除了鲁索替尼以外用sap每4周治疗的患者(组群4患者)具有第3级至12周时的第2级的改善和第2级至24周时的第1级的改善。因此,mf患者已经表明对单独或与rux组合的sap的良好耐受性。该数据进一步表明,重组人sap的施用,作为单一治疗和作为与rux的共治疗,均可以用于改善mf患者中的bmf。如下详述,在跨越进一步治疗时段的数据的进一步分析之后,bmf的这些改善得到证实。这些结果不仅支持在减少mf中的骨髓纤维化中使用sap,而且为在减少纤维化和恢复其它纤维化癌症中的正常组织功能中使用sap提供更一般的支持。
[0231]
不仅联合疗法是有效的,而且它可以适于单独额外的抗癌治疗剂的益处已经开始消退的患者。此外,该联合疗法也导致用单独抗癌治疗剂治疗的患者中经常经历的一些副作用的改善。在该情况下,对于在将sap添加至其治疗方案前正在用鲁索替尼(janus激酶抑制剂)单独治疗的患者,我们观察到贫血和血小板减少的改善,如相对于添加sap前那些患者中经历的那些副作用(例如,相对于用janus激酶抑制剂单独治疗)血红蛋白水平和血小板计数增加所评价。代表性数据显示于实施例3中。我们还观察到施用sap和鲁索替尼的患者中的症状评分和脾脏大小相比于它们在单独施用鲁索替尼的状态的改善。这些结果不仅表明sap作为针对纤维化癌症的单一治疗或联合疗法的效力,而且表明使用sap以扩大用于其它治疗剂的治疗窗口和患者群体,以便为可用治疗失败或不充分的患者和患者亚群提供治疗方式,并且改善可用治疗的安全性概况,同时自身具有治疗效力。
[0232]
实施例2:用单独和与鲁索替尼组合的prm-151治疗骨髓纤维化:24周时的1期结果
[0233]
实施例1中的上述研究的四个治疗组中登记的27个患者的人口统计数据概述于下表2中。该研究中登记的患者包括具有根据动态国际预后评分系统(dipss)分类为中等-1、中等-2或高风险mf的原发性骨髓纤维化(pmf)、真性红细胞增多后骨髓纤维化(pv后mf)或基本性血小板增多后骨髓纤维化(et后mf)的患者。27个患者中的15个在当前研究前已经用jak抑制剂治疗。在研究中登记且开始治疗的27个患者中,18个患者完成24周,且还没有达到24周标志的3个患者正在进行评估。患者组群如上所述。
[0234]
表2.
[0235][0236]
每4周实施临床响应评估,包括脾脏大小、mpn-saf和cbc的评价。在基线、12周和24周进行骨髓活检。在该研究的24周观察到的iwg-mrt症状和骨髓响应概述于下表3中。在四个治疗组各自中都存在一例或多例iwg-mrt症状响应,到该24周分析当日为止具有总共5例证实的iwg-mrt症状响应。我们注意到,将响应评分为证实的iwg-mrt所需的响应的幅度是非常高的(持续至少12周的症状评分降低50%),且6个额外患者实现了一种或多种有意义、但没有达到该特定阈值的参数的改善。甚至尽管在该实验中设置高阈值,但响应率与其它癌症治疗剂实现的响应率一致,且表明跨越临床意义百分数的患者的治疗效力。此外,评估的所有患者都在治疗时具有明显疾病,且除了两个之外的所有已经暴露于至少一种先前治疗且失败。在该情况下,实现的响应性水平是特别值得注意的。
[0237]
在五个患者中,观察到骨髓纤维化降低≥1级。在四个治疗组中的三个中观察到一例或多例骨髓响应,即,骨髓纤维化减少至少1级。例如,在用重组人sap每四周治疗的组(组1)中和除了鲁索替尼以外用重组人sap每4周处理的组(组群4)中各自看到2例骨髓响应。在五个患者中观察到脾脏体积的≥20%减少,其中在用重组人sap每周治疗的组(组群2)中看到一例持续8周的50%减少。
[0238]
表3.
[0239][0240]
1期:27个患者;移至2期的标准=≥1例响应
[0241]
图1显示随访至c6d29(周期6,第29天)或更长的具有可触及脾脏(palpable spleen)的受试者中的脾脏大小的百分数变化。评估患者中的大多数(13个患者中的10个,来自所有四个治疗组)显示脾脏大小相比于基线降低。显示脾脏大小的可测量减小的10个患者中,2个患者来自用rhsap每周治疗的组(组群2),3个患者来自用rhsap每4周治疗的组(组群1),1个患者来自用与鲁索替尼组合的rhsap每周治疗的组(组群3),且4个患者来自用与鲁索替尼组合的rhsap每4周治疗的组(组群4)。组群3和4中的患者在研究前施用至少12周的鲁索替尼的稳定剂量(例如,持续至少3个月施用鲁索替尼而没有任何剂量改变),且在开始sap治疗前最后四周内已经不再显示脾脏大小的改善。因此,应该指出,组群3和4(101-012、103-001、101-010、101-002和103-004)中响应的患者先前已经实现其对先前治疗(鲁索替尼)的最大响应,但尽管如此,在用与鲁索替尼组合使用的sap治疗后显示症状的进一步改善。事实上,患者101-012、103-001和101-010在联合疗法后经历脾脏大小的≥20%的改善。
[0242]
图2显示随访至c6d29(周期6,第29天)、研究结束或更长的受试者中的mpn-saf总症状评分(tss)的百分数变化。评估患者中的大部分(18个患者中的10个,来自所有四个治疗组)显示tss相比于基线降低,且对于这些患者中的5个在周期6第29天观察到总症状评分的≥50%降低。两个额外受试者具有症状评分的50%降低,其持续≥8周,但在周期6第29天小于50%。显示可测量的症状响应的10个患者中,1个患者来自用rhsap每周治疗的组(组群2),4个患者来自用rhsap每4周治疗的组(组群1),3个患者来自用与鲁索替尼组合的rhsap每周治疗的组(组群3),且2个患者来自用与鲁索替尼组合的rhsap每4周治疗的组(组群4)。如上所提及,组群3和4(108-002、101-011、108-001、101-010和103-001)中响应的患者先前已经实现其对先前治疗(鲁索替尼)的最大响应,但尽管如此,在除了鲁索替尼以外用sap治疗后显示症状的进一步改善。事实上,分别来自组群3和4的患者108-002和101-010在显示tss的≥50%改善的患者中。
[0243]
对于所有4个治疗组中的许多患者还观察到血红蛋白和血小板水平的改善、红血细胞输注的减少和骨髓纤维化的减少。在12周或24周或两者,已经在5个患者中观察到骨髓纤维化减少≥1级。
[0244]
24周之后的结果的分析表明单独或与另一种抗癌剂组合的rhsap的治疗效力,其具有非常良好的安全性概况。结果表明每周和每4周给药时间表的骨髓纤维化患者中的生物学活性,所述骨髓纤维化患者具有跨越临床相关量度(包括骨髓纤维化、血红蛋白、血小板、症状和脾脏体积)的改善。尽管评估患者中的疾病严重,但在所有4个治疗组中都观察到
阳性响应,甚至在研究的早期阶段,甚至当使用高阈值用于评估证实的响应时。用单独和与鲁索替尼组合的rhsap治疗是安全的且被良好耐受,没有诱导或作为sap治疗的结果的临床显著的骨髓抑制的证据,如通常用其它治疗(例如,治疗相关的骨髓抑制)所观察到。看到的响应率与用其它癌症治疗剂看到的效力一致。在用一种或多种先前jak抑制剂治疗之后已经进展或没有从鲁索替尼的稳定剂量进一步获益的患者中看到改善。接受sap的患者中的纤维化病理的逆转验证了该蛋白质的中心机制,且支持跨越其它纤维化癌症使用sap激动剂。
[0245]
此外,在rhsap治疗36周时评估的10个额外患者中观察到3例骨髓响应,且被鉴定为在12-或24-周标志对治疗响应的患者在治疗36周之后继续响应。这额外验证了单独或与另一种抗癌剂组合的延长rhsap治疗产生持久响应(例如,继续赋予有益效果)。此外,治疗和观察患者越长,鉴定到越阳性的响应;表明比基于治疗24周之后的观察结果所估计甚至更高的响应率。
[0246]
实施例3:代表性个体患者数据
[0247]
此处显示来自一个响应患者的响应数据的代表性实例。患者101-005经24周进程对用rhsap治疗的血红蛋白、血小板、mpn-saf tss和脾脏响应趋势显示于图3a-d中。用sap每4周治疗患者101-005(组群1)。患者特征概述于下表4中。
[0248]
表4.
[0249][0250]
如图3中所见,患者101-005显示经治疗进程的血红蛋白和血小板水平的改善、mpn-saf tss的降低和脾脏大小的降低。此外,患者101-005显示骨髓纤维化从第2级减少至12周时的第0级(图4)。
[0251]
实施例4:代表性骨髓纤维化数据
[0252]
在5个患者中观察到骨髓纤维化减少≥1级。来自患者101-005和108-003的代表性网硬蛋白染色数据分别显示于图4a和4b中。患者101-005和108-003分别是组群1和4的部分。在基线和治疗三个月和六个月之后获得骨髓活检样品。网硬蛋白染色以评估在基线和治疗三个月之后患者101-005中的骨髓纤维化的结果显示于图4a中。如图4a中所见,在患者101-005中观察到骨髓纤维化从第2级减少至三个月时的第0级。网硬蛋白染色以评估在基线、治疗三个月之后和治疗六个月之后患者108-003中的骨髓纤维化的结果显示于图4b中。如图4b中所见,在患者108-003中观察到骨髓纤维化从第3级减少至三个月时的第2级,且从第2级进一步减少至六个月时的第1级。纤维化是修复或反应过程中的器官或组织中过量纤维性结缔组织的形成。纤维化的主要组分是胶原蛋白。胶原蛋白在标准苏木精和伊红病理中作为粉红色、无定形组织出现。网硬蛋白染色将3型胶原蛋白的纤维显示为黑色线,且由病理学家用于鉴定所有器官中的纤维化的存在。网硬蛋白染色是骨髓纤维化的分级的核心要素(thiele等人,hematologica 2005;90:1128-1132.)一些网硬蛋白染色存在于正常骨髓,特别是血管壁中。
[0253]
观察到的骨髓纤维化的逆转(例如,减少)表明器官功能(在该情况下,骨髓功能)的恢复和/或改善。该患者和其他患者的全血计数(cbc)的改善进一步证明骨髓功能的恢复。
[0254]
实施例5:用重组人sap(rhsap)和鲁索替尼联合疗法治疗骨髓纤维化
[0255]
诊断为具有骨髓纤维化(包括pmf、pv后mf或et后-mf)且已经施用鲁索替尼的稳定剂量至少三个月且脾脏没有改善的患者接受与鲁索替尼组合的cho细胞中重组表达的含有α2,3-唾液酸的人sap(cho细胞中表达的rhsap;包含至少一个α2,3键且在糖基化中不同于源自人血清的sap的sap)。通过根据国际工作组(iwg)标准分类的总体响应率(orr)的评估来评价效力,所述国际工作组(iwg)标准经改良以包括以骨髓纤维化改善至少一个级别作为响应的稳定疾病。对治疗响应的受试者将继续接受治疗,只要存在益处。
[0256]
实施例6:重组人sap(rhsap)治疗骨髓纤维化
[0257]
诊断为具有骨髓纤维化(包括pmf、pv后mf或et后-mf)的患者接受cho细胞中重组表达的含有α2,3-唾液酸的人sap(cho细胞中表达的rhsap;包含至少一个α2,3键且在糖基化中不同于源自人血清的sap的sap)。通过根据国际工作组(iwg)标准分类的总体响应率(orr)的评估来评价效力,所述国际工作组(iwg)标准经改良以包括以骨髓纤维化改善至少一个级别作为响应的稳定疾病。对治疗响应的受试者将继续接受治疗,只要存在益处。
[0258]
通过引用方式并入
[0259]
本文提及的所有公开物和专利都通过引用以其整体并入本文,如同各单独公开物或专利都特别且单独地被指明通过引用并入一样。
[0260]
尽管已经讨论主题的具体实施方案,但上文说明书是说明性的,而非限制性的。阅读本说明书和下列权利要求之后,许多变型对于本领域技术人员是显而易见的。本发明的全部范围应当通过参考权利要求连同它们的等同物的全部范围以及说明书连同此类变型来确定。
[0261]
序列表
[0262]
seq id no:1人血清淀粉样蛋白p
[0263]
htdlsgkvfvfpresvtdhvnlitplekplqnftlcfraysdlsrayslfsyntqgrdnellvykervgeyslyigrhkvtskviekfpapvhicvswesssgiaefwingtplvkkglrqgyfveaqpkivlgqeqdsyggkfdrsqsfvgeigdlymwdsvlppenilsayqgtplpanildwqalnyeirgyviikplvwv
[0264]
seq id no:2原鸡(gallus gallus)血清淀粉样蛋白p
[0265]
qedlyrkvfvfredpsdayvllqvqlerpllnftvclrsytdltrphslfsyatkaqdneillfkpkpgeyrfyvggkyvtfrvpenrgewehvcaswesgsgiaefwlngrpwprkglqkgyevgneavvmlgqeqdaygggfdvynsftgemadvhlwdaglspdkmrsaylalrlppaplawgrlryeakgdvvvkprlrealga
[0266]
seq id no:3家牛(bos taurus)血清淀粉样蛋白p
[0267]
qtdlrgkvfvfpresstdhvtlitklekplknltlclraysdlsrgyslfsynihskdnellvfkngigeyslyigktkvtvratekfpspvhictswesstgiaefwingkplvkrglkqgyavgahpkivlgqeqdsygggfdknqsfmgeigdlymwdsvlspeeillvyqgsssisptildwqalkyeikgyvivkpmvwg
[0268]
seq id no:4灰仓鼠(cricetulus migratorius)血清淀粉样蛋白p
[0269]
qtdltgkvfvfpresesdyvkliprlekplenftlcfrtytdlsrphslfsyntknkdnelliykermgeyglyienvgaivrgveefaspvhfctswesssgiadfwvngipwvkkglkkgytvktqpsiilgqeqdnygggfdk
sqsfvgemgdlnmwdsvltpeeiksvyegswlepnildwralnyemsgyavirprvwh
