1.本发明属于生物医药领域,尤其涉及一种口腔黏膜下纤维化恶性进展或其所致口腔癌的早期诊断和/或预后生物标志物的应用及产品。
背景技术:
2.口腔黏膜下纤维化(osf)是一种口腔癌前病变,目前的研究认为其病因与槟榔中的槟榔碱有关。osf有进展为口腔癌的潜能,癌变率约为7%~13%。osf在癌变早期临床表现一般不典型,一旦癌变,手术切除是最佳治疗手段,但一般确诊时已错过最佳手术时机,即使可以手术,也会造成口腔颜面部美观及功能损害,所以从分子水平监测其癌变、做到早诊早治,可以极大降低患者的健康代价及经济成本。
3.抑癌基因一般在肿瘤细胞中失活,因此恢复抑癌基因的功能被认为是抑制肿瘤发生发展的有效方法。抑癌基因本身在正常细胞表达并发挥抑癌作用,因此,增加抑癌基因功能对正常细胞没有明显副作用,是一种相对安全的肿瘤特异性治疗方法。目前,已经有以恢复抑癌基因功能为目的的肿瘤治疗手段,如p53腺病毒。且随着pcr等分子生物学技术的不断进步,不断有新的抑癌基因被发现和鉴定,为肿瘤诊治提供了更多的机会。
技术实现要素:
4.本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷,提供一种口腔黏膜下纤维化恶性进展或其所致口腔癌的早期诊断和/或预后生物标志物的应用及产品。
5.为解决上述技术问题,本发明提出的技术方案为:
6.一种检测样本中生物标志物的试剂在制备口腔黏膜下纤维化恶性进展或其所致口腔癌的早期诊断和/或预后产品中的应用,所述生物标志物包括linc02147基因。经研究发现, linc02147参与了口腔黏膜下纤维化的癌变,且是一种新的口腔癌抑癌基因。
7.上述的应用,优选的,所述试剂包括通过测序技术、核酸杂交技术或核酸扩增技术检测样本中linc02147 rna表达水平的试剂。
8.优选的,所述样本包括组织、唾液、血液中的任意一种或几种。
9.优选的,所述试剂中含有特异性扩增linc02147的引物或特异性识别linc02147的探针。
10.优选的,所述特异性扩增linc02147的引物包含linc02147上游引物和linc02147下游引物,其核苷酸序列如下:
11.linc02147上游引物:5
’‑
tgctatcagggttggtttcg-3’;
12.linc02147下游引物:5
’‑
agtagattgctggagccagttc-3’。
13.基于一个总的发明构思,本发明还提供一种特异性扩增linc02147基因的引物,其特征在于,包括linc02147上游引物和linc02147下游引物,其核苷酸序列如下:
14.linc02147上游引物:5
’‑
tgctatcagggttggtttcg-3’;
15.linc02147下游引物:5
’‑
agtagattgctggagccagttc-3’。
16.基于一个总的发明构思,本发明还提供一种检测口腔黏膜下纤维化恶性进展或其所致口腔癌的试剂盒,包含特异性扩增linc02147的引物,具体包括linc02147上游引物和 linc02147下游引物,其核苷酸序列如下:
17.linc02147上游引物:5
’‑
tgctatcagggttggtttcg-3’;
18.linc02147下游引物:5
’‑
agtagattgctggagccagttc-3’。
19.优选的,还包含:gapdh上游引物和gapdh下游引物,其核苷酸序列如下:
20.gapdh上游引物:5
’‑
cccactcctccacctttgac-3’;
21.gapdh下游引物:5
’‑
tcttcctcttgtgctcttgctg-3’。
22.优选的,还包含:总rna抽提试剂、rna逆转录反应液和实时荧光定量pcr反应液;
23.所述rna逆转录反应液包括以下组分:1μl 0.5μg/μl的oligo dt,4μl 5
×
reaction buffer,1μl rnase inhibitor,2μl 10mm的dntps mix,1μl reverse transcriptase, rnase-free水;
24.所述实时荧光定量pcr反应液包括以下组分:10μl 2
×
sybr green qpcr mix,1μl 10um的forwardprimer,1μl 10um的reverse primer,1μl cdnatemplate,7μl ddh2o。
25.本发明还提供一种linc02147表达水平的评估方法,包括如下步骤:
26.(1)提取样本总rna;
27.(2)采用特异性扩增linc02147基因的引物,对所述步骤(1)得到的样本总rna进行rna逆转录和实时荧光定量pcr反应;
28.(3)按法进行计算分析结果。
29.上述的评估方法,优选的,所述步骤(1)中,样本为口腔癌、口腔黏膜下纤维化或正常口腔黏膜的组织标本。
30.基于一个总的发明构思,本发明还提供一种生物标志物在构建预测口腔黏膜下纤维化恶性进展或其所致口腔癌的计算模型或者嵌入了所述计算模型的系统中的应用,所述生物标志物包括linc02147基因。
31.上述的应用,优选的,所述计算模型以生物标志物的表达水平作为输入变量,通过生物信息学方法进行运算。
32.与现有技术相比,本发明的有益效果为:
33.1、本发明选择linc02147作为生物标志物,可以作为口腔黏膜下纤维化恶性进展或由口腔黏膜下纤维化所致口腔癌的早期诊断及预后标志物,针对该生物标志物设计相关检测试剂(特异性扩增引物)、试剂盒、计算模型,进一步制备成口腔黏膜下纤维化恶性进展或其所致口腔癌的早期诊断和/或预后产品,对口腔黏膜下纤维化癌变具有早期诊断和预测预后的价值。
34.2、本发明提供的检测试剂、试剂盒能够准确检测样品中所含linc02147 rna表达水平,以linc02147 rna表达水平作为输入变量,通过生物信息学方法进行运算,可以进一步对口腔癌及口腔黏膜下纤维化癌变具有早期诊断及预测预后价值,操作简单,准确度高,成本低廉。
附图说明
35.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
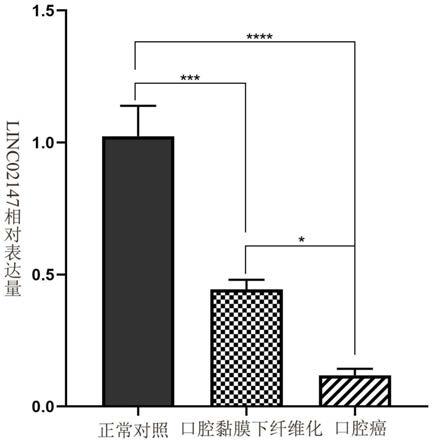
36.图1是正常口腔黏膜、口腔黏膜下纤维化和口腔癌组织标本的linc02147相对表达量;
37.图2是口腔癌组织和正常癌旁组织的linc02147表达验证结果;
38.图3是linc02147的k-m生存曲线;
39.图4是linc02147在不同tnm分期的口腔癌中的表达结果;
40.图5是linc02147诊断价值roc曲线;
41.图6是linc02147的cox回归分析结果(a是单因素cox回归分析,b是多因素cox 回归分析);
42.图7是基于linc02147的表达量构建的预测口腔癌患者生存率的列线图(nomogram);
43.图8是基于构建的列线图预测口腔癌患者3年生存率和实际生存率的校准曲线;
44.图9是基于构建的列线图预测口腔癌患者5年生存率和实际生存率的校准曲线;
45.图10是数据集gse160042中正常癌旁组织和口腔癌组织的linc02147表达验证结果;
46.图11是外部数据库gse160042验证linc02147诊断价值的roc曲线;
47.图12是40μm槟榔碱处理后α-sma的相对表达情况;
48.图13是40μm槟榔碱处理后col1α1的相对表达情况;
49.图14是40μm槟榔碱处理后osf和口腔癌细胞水平licn02147的相对表达情况;
50.图15是细胞转染linc02147 sirna 24h后sirna-linc02147的相对表达情况;
51.图16是细胞转染linc02147 sirna 24h后sirna-α-sma的相对表达情况;
52.图17是细胞转染linc02147 sirna 24h后sirna-col1α1的相对表达情况;
53.图18是细胞转染linc02147 sirna 24h后蛋白的表达情况;
54.图19是细胞转染linc02147 sirna 24h后sirna-mcm2的相对表达情况;
55.图20是细胞转染linc02147 sirna 24h后sirna-mcm3的相对表达情况;
56.图21是细胞转染linc02147 sirna 24h后sirna-mcm5的相对表达情况;
57.图22是敲除linc02147口腔癌细胞系scc-9细胞增殖情况。
具体实施方式
58.为了便于理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
59.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
60.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市
场购买得到或者可通过现有方法制备得到。
61.实施例:
62.1、一种检测样本中linc02147基因的试剂在制备口腔黏膜下纤维化恶性进展或其所致口腔癌的早期诊断和/或预后产品中的应用
63.本发明通过生物信息学及实验室验证发现linc02147(ensembl id:ensg00000249797) 是一种新的抑癌基因,且对口腔黏膜下纤维化癌变具有早期诊断和预测预后的价值,其可以成为口腔黏膜下纤维化恶性进展的早期诊断和预后标志物。本发明设计了一种以linc02147 为靶点和核心的特异性扩增linc02147的引物、试剂盒。
64.表1:引物序列
[0065][0066]
发现linc02147及其在正常口腔黏膜、口腔黏膜下纤维化、口腔癌中的表达验证过程如下:
[0067]
1.1基于geo数据库发现linc02147参与口腔黏膜下纤维化恶性进展
[0068]
通过geo数据库下载gse125866和gse64216两个数据集,其中gse125866数据集包含的样本数为正常口腔黏膜:口腔黏膜下纤维化:口腔癌=2︰8︰8;gse64216包含的样本数为正常口腔黏膜:口腔黏膜下纤维化:口腔癌=2︰2︰4,用r包limma(芯片数据)和edger (测序数据)计算基因的差异表达。差异基因入选标准:
①
|log2fc|≥1(即基因表达量差异倍数在2倍以上或0.5倍以下);
②
adjustp-value《0.05。经过分析发现linc02147在口腔黏膜下纤维化向口腔癌转化过程中表达降低。
[0069]
1.2临床组织样本验证:
[0070]
实时荧光定量pcr检测linc02147在正常口腔黏膜、口腔黏膜下纤维化和口腔癌组织中的表达,这是通过荧光染料或荧光标记的特异性探针,对pcr产物进行标记跟踪,实时在线监控反应过程,结合相应的软件可以对结果进行分析,计算待测样品的初始模板量的方法。在pcr反应体系中,加入sybr荧光染料,sybr荧光染料特异性地掺入dna双链后,发射荧光信号,而不掺入链中的sybr染料分子不会发射任何荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步。
[0071]
(1)试验试剂∶highfidelity pfu dna聚合酶,trizol试剂,磷酸盐缓冲液(pbs)和 0.25%(w/v)胰蛋白酶/1mm edta(trypsin-edta)购于invitrogen(usa);胎牛血清(fbs) 购于gibco(usa);dmem培养基购于hyclone(usa);gotag聚合酶从promega(usa) 购得。逆转录反应(rt)使用的cdna反转录试剂盒购于takara(tokyo,japan)。
[0072]
(2)操作过程如下:
[0073]
①
总rna抽提
[0074]
用invitrogen公司的trizol试剂按照产品说明书提供的方法分离、提取。用于抽
提rna 所有的器皿和水均要进行无酶处理,以保证实验中的无酶环境。
[0075]
取-80℃冷藏的口腔癌、口腔黏膜下纤维化、正常口腔黏膜组织标本,于1.5mlep管中,加入lmltrizol于超声匀浆机中充分研磨,室温静置5min。加入200μl氯仿,振荡10s,静置2min。4℃离心,12000g
×
15min,取上清。加入500μl异丙醇,轻轻混匀管中液体,室温静置30min。4℃离心,12,000g,10min,弃上清。加入lml 75%乙醇,轻轻洗涤沉淀。4℃, 7500g,5min,弃上清。晾干,加入适量的depc h2o溶解。
[0076]
②
rna浓度和纯度检测
[0077]
利用定容rna的rnase-free water作为空白对照,每个样品吸取lμl,用分光光度计测定rna溶液在260和280nm下的吸光度值,检测rna浓度和纯度。并在mops甲醛变性胶中观察rna有无降解。
[0078]
③
rna逆转录
[0079]
使用takara rr037aprimescript rtreagent kit试剂盒。具体操作步骤如下:
[0080]
1)1μl oligo dt(0.5μg/μl)和2.0μg total rna加入到pcr小管中,补充rnase-free 水至12μl;混匀后离心,65℃温浴5min,立即置于冰上。
[0081]
2)按如下的比例配制反应体系(冰上进行)。
[0082][0083]
一共20μl,吹吸混匀,离心10s。
[0084]
注意:如果有多个样本,可预先配置反应mix,将5
×
reaction buffer,rnase inhibitor, 10mm dntps mix等一起加入0.5ml离心管内,用200μl移液器吹吸混匀,分装至每个0.2mlpcr管中,再添加相应的模板。
[0085]
3)所有样品加完以后,盖紧管盖,离心10s,置于pcr仪模具内,盖紧保护盖。
[0086]
4)打开pcr仪,将pcr程序设置为:
[0087]
42℃
ꢀꢀꢀꢀꢀꢀ
60min
[0088]
70℃
ꢀꢀꢀꢀꢀꢀ
5min
[0089]
此步骤可使用水浴锅进行处理。
[0090]
注意:42℃为酶反应温度,70℃反应5min可使酶失活。
[0091]
5)反应结束后,将反应液储存至-20℃备用。
[0092]
④
实时荧光定量pcr反应
[0093]
具体操作步骤如下:
[0094]
注意:新合成的引物需要预先加水溶解:将装有如表1所述的引物的离心管在1000rpm 室温离心3min后,轻轻打开管盖,依照引物合成说明书加入适量高压灭菌过的去离子水,用枪吹吸混匀,使引物充分溶解,然后短暂离心15s。一般地,引物的储存浓度为100μm,使用浓度为10μm。
[0095]
准备好冰盒,将所需试剂从冰箱中取出后,置于冰盒内融化。引物和模板可放于室温融化后,也置于冰上。
[0096]
1)预实验:使用sybr green qpcr mix,确定引物是否为特异性引物以及其最佳退火温度。使用10μl移液器,在0.2ml八联管中加入:
[0097][0098][0099]
一共20μl,吹吸混匀,离心15s。如果有多个样本,可预先配置反应mix,将2
×
sybrgreen qpcrmix,ddh2o,cdnatemplate等(如果使用同样的模板)一起加入1.5ml离心管内,用200μl移液器吹吸混匀,分装至每个0.2ml八联管中。所有样品加完以后,盖紧管盖,离心10s,置于mini荧光定量pcr仪模具内,盖紧保护盖。
[0100]
注意:模板浓度足够的情况下,可以将模板稀释后再进行检测。
[0101]
打开仪器和电脑程序,设定梯度real-time程序设置为:
[0102][0103]
添加溶解曲线程序。
[0104]
程序结束后,查看溶解曲线,检测引物效果,选择产物特异性最好(溶解曲线峰单一,峰值高)所对应的引物(即表1中所述的引物)和退火温度。
[0105]
2)确定好适用引物和退火温度后,进行所需样品的荧光定量检测。
[0106]
使用10μl移液器,在0.2ml八联管中加入:
[0107][0108]
一共20μl,吹吸混匀,离心15s。如果有多个样本,可预先配置反应mix,将2
×
sybrgreen qpcr mix,ddh2o,forward primer,reverse primer(如果使用同样的引物)一起加入1.5ml离心管内,用200μl移液器吹吸混匀,分装至每个0.2ml八联管中(每个样本做三个重复,并配置内参)。所有样品加完以后,盖紧管盖,离心10s,置于荧光定量pcr仪模具内,盖紧保护盖。
[0109]
注意:模板浓度足够的情况下,可以将模板稀释后再进行检测。
[0110]
打开仪器和电脑程序,设定梯度real-time程序设置为:
[0111][0112]
添加溶解曲线程序。
[0113]
反应结束后,查看程序所得曲线数据,调整曲线为线性曲线,移动读取线,移至曲线较低处,读取ct值并拷贝。
[0114]
⑤
荧光定量pcr结果判定:内参基因为gapdh基因,检测每个样本rna含量。样本孔和内参孔均设2个复孔,取平均ct值。
△
ct=ct
目的基因-ct
gapdh
,则2
‑△
ct
为组织中linc02147 相对于内参基因gapdh的表达量;
△△
ct=
△
ct
待测组织
‑△
ct
对照组织
,倍数变化为2
‑△△
ct
,即待测组织中相对于对照组织的表达量。
[0115]
(2)结果分析:临床收集正常口腔黏膜、口腔黏膜下纤维化(osf)、口腔癌(oscc) 组织标本各10例,qpcr验证发现linc02147表达从正常黏膜、口腔黏膜下纤维化到口腔癌逐渐降低,差异具有统计学意义(p<0.05)(图1)。说明本发明提供的检测试剂、试剂盒能够准确检测样品中所含linc02147 rna表达水平。
[0116]
2、linc02147基因在构建预测口腔黏膜下纤维化恶性进展或其所致口腔癌的计算模型或者嵌入了所述计算模型的系统中的应用
[0117]
以生物标志物的表达水平作为输入变量,通过生物信息学方法进行运算。tcga验证及预后、诊断价值评估过程如下:
[0118]
2.1kaplan-meier法生存分析:
[0119]
(1)操作步骤如下:
[0120]
①
从the cancer genomeatlas(tcga)(http://tcgadata.nci.nih.gov/)下载头颈部鳞状细胞癌的rna-seq数据和临床数据,其中纳入分析的327例口腔癌患者均无恶性肿瘤史或新辅助治疗史。
[0121]
②
基于tcga,使用limma包、t检验分析了linc02147在口腔癌及正常癌旁组织中的表达水平。
[0122]
③
采用kaplan-meier(k-m)方法计算linc02147与口腔癌患者总生存期(os)的相关性。根据每个样本的基因表达情况,通过x-tile软件选取最佳截断值作为高表达组和低表达组的阈值。根据阈值对患者进行分类。x-tile图提供了一种直观的方法来评估变量和生存之间的关系。使用x-tile软件3.6.1版本(耶鲁大学医学院,纽黑文,ct,美国)来绘制x-tile图。用“r”中的“survival”(https://cran.r-project.org/web/packages/survival/index.html)计算生存率,用“ggplot2”绘制k-m曲线。
[0123]
④
采用roc分析评估linc02147的诊断价值,proc软件包用于绘制生成受试者工作特征(roc)曲线,roc曲线下面积(auc)代表诊断价值。当auc大于0.7时,我们认为linc02147是特异性和敏感性较好的诊断标志物。
[0124]
⑤
为了进一步确认linc02147的预后作用,基于tcga使用limma包、t检验分析了 linc02147在口腔癌患者不同tnm分期中的表达水平。
[0125]
(3)结果分析:tcga数据库表达验证发现口腔癌中linc02147表达显著低于正常癌旁组织(图2),与临床组织样本qpcr结果一致;生存分析发现低表达linc02147的患者较高
表达linc02147的患者具有更差的预后(图3);分析linc02147表达量与口腔癌临床分期之间的关系发现:口腔癌i期患者linc02147表达明显高于ii、iii、iv期(图4),这些结果提示linc02147与口腔癌的预后成正比,linc02147表达越低,口腔癌预后越差。roc 曲线分析发现曲线下面积auc=0.893,说明linc02147具有良好的诊断价值(图5)。
[0126]
2.2cox回归分析判断linc02147是否为独立预后因素
[0127]
(1)操作过程如下:
[0128]
①
将327例口腔癌患者资料编码后输入计算机,建立数据库。选择性别、年龄、病理borders 分级、淋巴血管侵袭情况、围神经侵袭情况、t分期、n分期、tnm分期及linc02147表达情况等9个指标。
[0129]
②
采用χ2检验先行单因素cox回归分析,再将单因素分析有显著意义的指标进行多因素 cox回归分析,用以判断linc02147是否为独立预后影响因素。在cox回归模型中,取某一自变量系数为e的幂数,得到的值即为hr值。考虑hr值在临床研究中的实际意义,则当 hr》1时,该自变量为危险因素;当hr《1时,该自变量为保护因素。以上均用spss 20.0统计软件进行数据分析。所有统计分析均以p《0.05为差异具有显著性。
[0130]
(2)结果:单因素cox回归分析显示linc02147(hr=0.56(0.38-0.83),p=0.004),是口腔癌的保护因素(即表达越低,口腔癌预后越差),淋巴血管侵袭情况(hr=1.66(1.11-2.48), p=0.014)、围神经侵袭情况(hr=1.91(1.28-2.87),p=0.002)、tnm分期(hr=2.22(1.41-3.51), p=0.001)是口腔癌的危险因素(图6a)。进一步多因素cox回归分析显示linc02147(hr=0.52 (0.30-0.90),p=0.020)是口腔癌的独立保护因素;tnm分期(hr=2.17(1.14-4.16),p=0.019)和围神经侵袭(hr=1.75(1.11-2.77),p=0.016)是口腔癌的独立危险因素。该部分实验进一步说明 linc02147低表达的口腔癌患者预后差(图6b)。
[0131]
2.3口腔癌患者3年、5年总生存率预测模型nomogram的构建
[0132]
列线图(nomogram)在肿瘤学和医学中被广泛应用于某一事件发生率或预后的预测工具。列线图能够通过整合预后相关的危险因素生成临床事件的个体概率,实现了生物学和临床相互结合的新型医学模式的追求,促进了新时代个性化医疗的发展。nomogram预测模型相对于传统的tnm分期系统更有优势,因此已被提出作为一种替代或者是一种新的标准,成为现代医疗决策的重要组成部分。本发明通过研究linc02147在口腔癌中的表达及其对患者预后的影响,并构建了口腔癌患者总体生存率的nomogram预测模型,以期能够提供更加准确的预后信息并进行个性化的医疗决策。
[0133]
(1)操作过程如下:基于tcga的327例口腔癌患者利用r语言构建患者3年、5年总体生存率的nomogram预测模型;采用一致性指数(concordance index,c-index)评价模型的区分度;采用bootstrap法对模型进行内部验证,对模型的预测一致性进行评价
[0134]
(2)结果:通过对tcga数据库中327例口腔癌患者的单因素和多因素cox回归分析,明确了linc02147、tnm分期和围神经侵袭是口腔癌患者预后的独立影响因素。基于上述3 个变量,构建口腔癌患者3年、5年生存率的nomogram预测模型,通过该预测模型,可获得患者linc02147、tnm分期(tnm-stage)、围神经侵袭(perineural invasion)对应的得分 (points),将变量得分的总和(total points)与3-year survival、5-year survival相对应,即可获得3年、5年生存率的预测值(图7)。区分度评价:口腔癌患者总体生存率nomogram 预测模型的c-index值为0.624(95%ci=0.577~0.670,p=3e-04),提示该nomogram具有
较好的区分度。一致性评价:从校正曲线图(calibration curve)中可以看出,口腔癌患者3年、5 年总体生存率预测值和实际观察结果重合度较高,尤其是预测3年总体生存率与实际观察值基本一致(图8和图9),提示nomogram模型的一致性和准确性较高。
[0135]
3、外部数据库验证
[0136]
gse160042取自geo,该数据集其中包含口腔癌组织(10个样本)和配对的相邻非癌组织(10个样本)。用该数据集中的数据进一步验证linc02147的表达、预后及诊断价值。方法同前。
[0137]
结果分析:gse160042数据集进一步验证了linc02147的表达。如图10所示,linc02147 在口腔癌中的相对表达明显低于配对的癌旁非癌组织。进一步评估了linc02147的诊断价值,得到的auc=0.950,与tcga结果一致,说明linc02147具有区分口腔癌与正常对照的能力(图11)。
[0138]
4、体外细胞水平验证linc02147的表达
[0139]
(1)主要试剂及仪器:高糖dmem(hyclone,usa)、胎牛血清(gibco,usa)、含edta0.25%胰蛋白酶(solarbo)、倒置显微镜、10ml一次性移液管、1000μl(1ml) 移液枪、3ml一次性巴氏滴管、玻璃板(已消毒)、一次性培养皿、15ml离心管、1000μl tip头、眼科剪、手术刀柄、尖刀片、牙周探针、25cm2细胞培养瓶(1个)。
[0140]
(2)人口腔黏膜成纤维细胞(human oral mucosa fibroblasts,homfs)原代培养(组织块法)
[0141]
取12~25岁牙周相对健康的牙龈5mm*5mm(符合伦理学要求),立即放入含10%双抗 (1000ui/ml)的pbs溶液中(含双抗的pbs溶液于术前一天配好),2h内拿到实验室的超净工作台;
[0142]
将实验所需物品放入超净工作台紫外灯消毒30分钟;
[0143]
在25cm2细胞培养瓶滴入1ml fbs(巴氏滴灌1d~2d就可以),润湿整个培养瓶,然后放入37℃恒温箱;
[0144]
配置10%含双抗的pbs溶液、含10%双抗的dmem培基、含15%fbs的dmem培基;
[0145]
10%双抗的pbs溶液反复(3~4次)冲洗吹打组织块;
[0146]
将组织块转移到玻璃培养皿中,再用10%双抗的dmem培基反复(3~4次)冲洗吹打组织块,弃去上清液后,用组织剪和15号圆刀片将组织块分成5mm2的小组织块,然后用眼科镊将组织块放入从37℃恒温箱中拿出的t-25细胞培养瓶的瓶底(靠近基底膜的结缔组织贴于瓶底),每个组织块间隔5mm。
[0147]
滴入1ml含15%fbs的dmem培基,放入37℃、5%co2、95%饱和湿度的培养箱中, 24h后拿出加入2ml 15%fbs dmem培基,每3~4天换液一次,显微镜下观察细胞生长情况,培养5~7天后就可以看到口腔黏膜成纤维细胞从组织块周围爬出,细胞呈梭形或纺锤形,有多个较长的细胞突起(2~4个)、胞浆丰满、均匀,核呈圆形或卵圆形,有1~3个核仁。
[0148]
(3)人口腔黏膜成纤维细胞(human oral mucosa fibroblasts,homfs)传代
[0149]
当细胞爬满瓶底70%-80%,首次传代按1传2代培养。
[0150]
吸去培养瓶中液体,pbs冲洗去除残留的血清及细胞碎片;
[0151]
消化:2ml 0.25%胰蛋白酶-0.02%edta消化2min(不要超过4min),倒置显微镜下见细胞间隙增大、细胞变圆;
[0152]
终止消化:用0.5ml 15%fbs的dmem培基终止消化;
[0153]
再加入3ml无菌pbs液体,用巴氏滴管吹打(50次)成单细胞悬液,转移至15ml离心管;
[0154]
离心:1000r/min离心10min;
[0155]
去上清液、加入15%fbs的dmem 4ml,用巴氏滴管轻轻吹打均匀,平均分配到2个t-25培养瓶中,再补齐培养液至3~4ml;
[0156]
形成稳定传代的细胞,取3~5代细胞做后续实验。
[0157]
(4)构建口腔黏膜下纤维化细胞模型
[0158]
实验试剂:槟榔碱(sigma-aldrich,usa),其余试剂与临床组织样本表达验证实验相同 (图12和图13),说明40μm槟榔碱处理homfs可以成功构建口腔黏膜下纤维化细胞模型。
[0159]
(5)口腔癌细胞系——scc9细胞的培养
[0160]
1)复苏细胞:将含有1ml细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4ml 培养基混合均匀。在1000rpm条件下离心4分钟,弃去上清液,补加1-2ml培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入10cm培养皿中,加入约8ml 培养基,培养过夜)。第二天换液并检查细胞密度。
[0161]
2)细胞传代:细胞密度达80%-90%,即可进行传代培养。弃去培养上清,用不含钙、镁离子的pbs润洗细胞1-2次;加1ml消化液(0.25%trypsin-0.53mm edta)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化;按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000rpm条件下离心4分钟,弃去上清液,补加1-2ml培养液后吹匀;将细胞悬液按1:2比例分到新的含8ml培养基的新皿中或者瓶中。
[0162]
(6)qpcr检测正常口腔黏膜成纤维细胞(homfs)、口腔黏膜下纤维化细胞模型(40μm 槟榔碱刺激homfs细胞24h)和口腔癌细胞系scc9细胞中linc02147的表达量。总rna 抽提、rna浓度和纯度检测、rna逆转录和实时荧光定量pcr反应的操作步骤参考前文。
[0163]
(7)结果分析:相对于正常口腔黏膜成纤维细胞,口腔黏膜下纤维化细胞模型(40μm 槟榔碱处理homfs 24小时)和口腔癌细胞系scc9细胞中linc02147表达明显下调(图14),与临床组织样本qpcr及生物信息学分析结果相一致。
[0164]
一种生物标志物(linc02147)在构建预测口腔黏膜下纤维化恶性进展或其所致口腔癌的计算模型或者嵌入了所述计算模型的系统中的应用,
[0165]
5.体外细胞实验证实下调linc02147促进口腔黏膜下纤维化发生发展及癌变
[0166]
5.1细胞转染实验:
[0167]
(1)主要试剂及仪器:linc02147 sirna和negative control sirna由广州锐博公司合成,sirna寡核苷酸序列如下:5
’‑
gtcctcacgtggcctcttt-3’, 5
’‑
caagatcaaggtgctatca-3’,5
’‑
ctggcttgtagacagctat-3’,5
’‑
cagggttggttt cggctgtg-3’,5
’‑
caagatcaaggtgctatcag-3’,5
’‑
tcctcacgtggcctctttgt-3’;ribo fect
tm cptransfection kit转染试剂盒。
[0168]
(2)具体步骤如下:
[0169]
接种细胞:将homfs(1
×
104)细胞接种至24孔板培养孔中,当细胞正常生长并且汇
合度达到30~50%即可进行转染;
[0170]
转染:对于每个转染样品,请按以下步骤准备:转染复合物配制:在30μl 1x ribofect tm cp buffer(v2)中加入1.5μl 20μm sirna储存液(v3),轻轻混匀;然后加入3μl ribofect tm cp reagent(v4),轻轻吹打混匀,室温孵育0~15min,制备成转染复合物。将转染复合物逐滴加入到已含有适量无双抗完全培养基(v1)的细胞中轻轻混匀。将培养板置于37℃的 co2培养箱中培养24h。
[0171]
效果检测:rna水平的检测(rnai沉默鉴定标准):sirna作用的目标分子是目的基因的rna,在risc系统的作用下剪切目标rna,故检测目的基因的rna水平可直接反应sirna是否发挥了相应的作用,且通过qrt-pcr可计算具体的抑制效率。一般sirna 转染后24~72h即可检测到目的基因rna表达明显降低。
[0172]
5.2蛋白印迹(western blot)实验
[0173]
(1)试剂及耗材:蛋白抽提试剂(改进型ripa配方)、bca蛋白定量试剂盒、5
×
还原样品缓冲液、10
×
tris-glycine-sds电泳缓冲液、考马斯亮蓝染色液、10
×
tbstph8.0湿转缓冲液、pvdf膜(0.22μm孔径)、pmsf、蛋白酶抑制剂、封闭液、一抗:anti-α-sma(abcam, ab124964),anti-col1α1(abcam,ab260043),anti-β-actin(immunoway,ym3028);二抗:轭辣根过氧化物酶标记的二抗;fresco低温冷冻离心机、multiskan3酶标仪、电泳槽、湿转电泳槽、电泳仪、chemi doc xrs显像系统
[0174]
(2)步骤:
[0175]
总蛋白的提取:
①
配制细胞裂解液:按照100:1加入ripa和pmsf,混匀后置于冰上备用。以细胞数量1
×
107加入1ml裂解液。
②
收集细胞,吸去培养基,用预冷的pbs(含pmsf)洗涤细胞2-3次。吸去pbs,加入适量体积的胰酶消化细胞,每孔加入适量完全培养基终止胰酶消化并吹打,收集细胞于15ml离心管中,800rpm,离心5min。
③
每管内加入适量的细胞裂解液,用枪头吹打充分悬起细胞,转移至1.5mlep管内,冰上放置5-10min。d.12000rpm,4℃离心5min,吸取上清分装保存于-80℃待测或备用。
[0176]
bca法蛋白定量:
①
.配制工作液:根据标准品和样品数量,按50体积bca试剂a加1 体积bca试剂b(50:1)配制适量bca工作液,充分混匀。
②
稀释标准品:先将冻干标准品用0.9%nacl或pbs稀释成2000μl/ml的储存液,然后储存液稀释至25~2000μg/ml。
③
将25μl的标准品和合适浓度范围的样本分别添加于96孔板的微孔中。
④
各孔加入200 μl bca工作液,充分混匀(最好使用排枪提高速度,否则加样的时间差可能会影响最终结果)。
⑤
盖上96孔板盖,37℃孵育30分钟。
⑥
冷却到室温,用酶标仪测定a562。
⑦
在 excel中将标准样品(usual bsa)的吸收值全部选中,点insert中的图表,选xy散点图(以蛋白浓度为横坐标,od值为纵坐标,y(od)=ax(浓度)+b)生成线性方程公式,测蛋白浓度时是代入y值来求x值,测样本蛋白的浓度。
[0177]
western blot测定蛋白表达水平:
①
蛋白质样品的准备:将提取的细胞总蛋白经bca浓度检测后,用双蒸水与6xsds loading buffer调整各待测样本间的浓度,使其保持一致,将调整浓度后的待测样本置于100℃加热5min使蛋白质充分变性,于-80℃保存备用。
②
12%分离胶和4%浓缩胶的配制,配置表如表2。
[0178]
表2:12%分离胶和4%浓缩胶配置
[0179][0180]
③
制备凝胶:将大小不同的两块玻璃板下沿对齐后,放入夹槽内卡紧以免漏胶,将其垂直卡在制胶夹上进行灌胶,先沿玻璃板一侧边缘缓慢加入下层胶,灌完后立即用甲醇进行封闭,待下层胶凝固后,用滤纸吸去甲醇,并灌上已经混匀的上层胶,插上电泳梳,待胶凝固。
④
电泳:按照统一调整后的浓度等体积进行蛋白待测标本上样,以70v初始电压电泳30min,当蛋白样品电泳至上层胶与下层胶交界处时将电压调整至90v,当预染蛋白分离至合适程度时即可终止电泳。
⑤
转膜(湿转法):将转膜装置放置于4℃环境中,300ma恒流;0.22um孔径 pvdf膜,转膜时间75min。根据预染蛋白分子量大小的指示,将目标蛋白对应的胶块切下,裁剪与胶块相应大小的pvdf膜,并准备转膜专用滤纸,在湿式转印仪中从负极到正极按照如下顺序放置:滤纸、胶、pvdf膜、滤纸。
⑥
封闭:将转膜后的pvdf膜放入含有5%的脱脂奶粉的tbst溶液中,置于摇床上室温封闭2h,以结合pvdf膜上非特异性结合位点。
⑦
孵育一抗:以体积比为1:1000用含有5%的脱脂奶粉的tbst溶液稀释特殊标记的α-sma、col1 α1抗体及gapdh内参抗体(这三种抗体均购自abcam,usa),并将封闭后的pvdf膜置于相应的检测抗体溶液中,置于摇床上4℃孵育过夜,回收一抗溶液,使用tbst洗膜6次。
⑧
以体积比1:5000用含有5%的脱脂奶粉的tbst溶液稀释共轭辣根过氧化物酶标记的二抗,室温孵育1h,使用tbst溶液洗膜8次。
⑨
用chemi doc xrs显像系统检测蛋白质。
[0181]
5.3cck-8检测细胞增殖
[0182]
用96孔培养板,每孔种植1
×
105个口腔癌细胞系scc-9细胞,培养24小时,并重复三次。然后分别用linc02147 sirna、negative control sirna转染scc-9细胞,在转染后的第0h, 12h,24h,48h用酶标仪检查450nm下的吸光度。最终细胞计数的结果为3个样本的平均值,用平均数
±
标准差表示。具体步骤如下:
[0183]
①
将等浓度的linc02147 sirna、negative control sirna转染后的口腔癌细胞系—— scc9细胞接种到96孔培养板中,100μl/孔,置培养箱中孵育1小时。
[0184]
②
在37℃的水浴中解冻cck-8溶液(5分钟),然后每孔中加入10μl cck-8试剂(此步骤要小心避免产生气泡以免影响od值)。
[0185]
③
d0为初始培养4小时后酶标仪测定450nm吸光度值,然后吸出培养液,每孔加入100μl 含10%cck8的10%fbs rpmi1640培养液,继续培养,在转染后的第0h,12h,24h,48h 用酶标仪检查450nm下的吸光度,完成后绘制增殖曲线、分析。
[0186]
5.4数据分析采用spss20.0软件。所有数据均用均数
±
标准差(
±
sd)表示。两组间
比较采用t检验,三组以上数据分析采用one wayanova。p<0.05有统计学意义。
[0187]
结果分析:本实验在转染linc02147 sirna24h后进行qpcr检测(qpcr方法、步骤参考前文),结果显示相对于对照组,linc02147表达显著下调(图15),说明细胞转染有效;且转染linc02147 sirna24h后显示口腔黏膜下纤维化标志物α-sma、col1α1表达在rna (图16、图17)和蛋白(图18)水平均显著升高,说明homfs细胞中linc02147表达下调可以促进口腔黏膜下纤维化发生发展;转染linc02147 sirna24h后显示口腔癌早期诊断标志物mcm2、mcm3、mcm5表达显著升高(图19、图20、图21),说明linc02147表达下调可以促进homfs细胞癌变。
[0188]
在口腔癌细胞系scc-9细胞中下调linc02147表达可以促进scc-9的细胞增殖(图22),说明linc02147表达下调可以促进口腔癌进展。
[0189]
结论:linc02147表达下降预示口腔黏膜下纤维化恶性进展患者预后不良,linc02147 对口腔癌及口腔黏膜下纤维化癌变具有早期诊断及预测预后价值。说明本发明提供的检测试剂、试剂盒能够准确检测样品中所含linc02147 rna水平,对口腔癌及口腔黏膜下纤维化癌变具有早期诊断及预测预后价值,操作简单,准确度高,成本低廉。
