1.本发明涉及药物制剂领域,尤其涉及一种血小板生成素受体激动剂的组合物及其制备方法。
背景技术:
2.艾曲波帕(eltrombopag,cas号:496775-61-2)是一种血小板生成素受体激动剂,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后效果不好的成人或1岁以上患者慢性血小板减少性紫癜(itp)、慢性丙型肝炎患者的血小板减少症、对免疫抑制治疗反应不足的重型再生障碍性贫血的药物。
3.艾曲波帕服用时必须空腹口服(饭前1h或饭后2h),并且服药前后4小时不能服用含多价金属离子(如:铁离子、钙离子、锌离子、镁离子)的药物或物质,比如抗酸剂、钙离子丰富的产品以及矿物质补充剂等。艾曲波帕的fda审评文件中的临床数据显示:与食物同服,药物auc(0-∞)降低59%,cmax降低65%;与抗酸剂同服,药物auc(0~∞)与cmax降低约70%;多价金属离子能与艾曲波帕发生螯合反应,严重降低了药物的吸收。另外,专利us8052993体外溶出数据显示,含金属离子的片剂,其溶出明显慢于不含金属离子的片剂。综上所述,当艾曲波帕与多价金属离子发生螯合反应时,既降低了药物的溶出,又降低了药物的吸收,不利于药效的发挥。
4.基于上述原因,艾曲波帕服用条件较为苛刻,极大的增加了患者服药的难度,灵活性低,导致服用的顺应性降低。
5.因此,为解决上述问题,需要开发一种便于服用、灵活、稳定,不受服用条件限制的艾曲波帕组合物。
技术实现要素:
6.发明概述
7.本发明提供了一种组合物,所述组合物包括活性成分艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料。所述组合物能克服食物或其他药物中金属离子的影响,使得药物与食物或其他药物同服也能有效吸收,达到与空腹服用相似的效果。本发明提供的组合物,可以消除食物及其他药物对活性成分吸收的影响,打破服药的过多限制,增加患者服药的灵活性和顺应性,同时也可以避免因服药不当导致的疗效降低甚至无效,保证药效的正常发挥,具有显著的进步。
8.本发明还提供了组合物的制备方法。所述制备方法能提供均匀、稳定的艾曲波帕组合物。
9.发明详述
10.第一方面,本发明提供了一种艾曲波帕组合物。
11.一种艾曲波帕组合物,包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料。
12.所述螯合剂可以包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸和葡萄糖酸钠中的至少一种。在一些实施例中,所述螯合剂为依地酸盐和葡萄糖酸钠。在一些实施例中,所述螯合剂优选为依地酸或依地酸盐,更有利于获得的组合物消除食物及其他药物对艾曲波帕吸收的影响。
13.所述依地酸盐可以依地酸钠盐。
14.所述依地酸钠盐可以为依地酸二钠或依地酸四钠。
15.所述螯合剂和艾曲波帕的重量比可以为1:3-12:1。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-10:1。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-8:1。在一些优选的实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-7:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-6:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-5:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些更优选实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-4:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-3:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些实施例中,所述螯合剂和艾曲波帕的重量比为0.5:1-2:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些实施例中,所述螯合剂和艾曲波帕的重量比为1:1-4:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。在一些更优选的实施例中,所述螯合剂和艾曲波帕的重量比为2:1-4:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。
16.以组合物的总重量计,所述螯合剂的含量可以为2.00wt%~90.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为2.80wt%~88.70wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为5.00wt%~80.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为10.00wt%~70.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为15.00wt%~65.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为20.00wt%~60.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为25.00wt%~55.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为30.00wt%~50.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为35.00wt%~45.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为40.00wt%~45.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为43.00wt%~45.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为30.00wt%~40.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为35.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为2.78wt%-88.70wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为12.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为25.00wt%-30.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为28.57wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为10.00wt%~15.00wt%。在一些实施例中,以组合物的总重量计,所述螯合剂的含量为12.00wt%。
17.所述药学上可接受的盐可以包括乙醇胺盐。
18.以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量可以为1.00wt%~40.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.00wt%~30.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.50wt%~27.50wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为5.00wt%~25.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为9.00wt%~21.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为10.00wt%~20.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为12.00wt%~18.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为14.00wt%~16.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为15.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.54wt%~27.34wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.82wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为4.79wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为9.11wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为25.00wt%-30.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.00wt%~4.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为3.50wt%~4.00wt%。在一些实施例中,以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为27.37wt%。
19.所述药学上可接受的辅料可以包括选自填充剂、崩解剂、润滑剂、矫味剂、助悬剂和香精中的至少一种。在一些实施例中,所述药学上可接受的辅料包括选自填充剂、崩解剂和润滑剂中的至少一种。在一些实施例中,所述药学上可接受的辅料包括选自填充剂、助悬剂和矫味剂中的至少一种。在一些实施例中,所述药学上可接受的辅料包括选自填充剂、崩解剂和润滑剂中的至少一种。在一些实施例中,所述药学上可接受的辅料包括选自填充剂和润滑剂中的至少一种。
20.所述填充剂可以包括选自甘露醇,微晶纤维素,乳糖,麦芽糖醇,山梨醇和预胶化淀粉中的至少一种。
21.以组合物的总重量计,所述填充剂的含量可以为15.00wt%~95.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量可以为30.00wt%~95.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为33.00wt%~92.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为15.00wt%~20.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为30.00wt%~35.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为40.00wt%~80.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为45.00wt%~75.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为50.00wt%~70.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为55.00wt%~65.00wt%。在一些实施例中,以组合物的总重量
计,所述填充剂的含量为60.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为91.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为68.00wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为33.09wt%~91.34wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为60.37wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为68.22wt%。在一些实施例中,以组合物的总重量计,所述填充剂的含量为18.80wt%。
22.所述崩解剂可以包括选自交联聚维酮,低取代羟丙基纤维素,羧甲基淀粉钠,交联羧甲基纤维素钠,预胶化淀粉和玉米淀粉中的至少一种。
23.以组合物的总重量计,所述崩解剂的含量可以为0~20.00wt%。在一些实施例中,以组合物的总重量计,所述崩解剂的含量为5.00wt%~15.00wt%。在一些实施例中,以组合物的总重量计,所述崩解剂的含量为8.00wt%-12.0wt%。在一些实施例中,以组合物的总重量计,所述崩解剂的含量为10.00wt%。
24.所述润滑剂可以包括选自硬脂酸镁,硬脂酸富马酸钠,微粉硅胶,滑石粉,硬脂酸钙和聚乙二醇中的至少一种。
25.以组合物的总重量计,所述润滑剂的含量可以为0~5.00wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为0.50wt%~4.50wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为1.00wt%~4.00wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为1.50wt%~3.50wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为2.00wt%~3.00wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为2.50wt%。在一些实施例中,以组合物的总重量计,所述润滑剂的含量为0.50wt%~1.50wt%。
26.所述助悬剂可以包括选自阿拉伯胶、黄原胶、西黄芪胶、卡波姆、明胶、羧甲基淀粉、醋酸酯淀粉、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙甲基纤维素、葡聚糖、共聚维酮、聚乙烯吡咯烷酮、聚乙烯醇、聚氧乙烯、蔗糖和胶体微晶纤维素中的至少一种。
27.以组合物的总重量计,所述助悬剂的含量可以为0~85.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为0.60wt%~83.80wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为1.00wt%~80.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为1.50wt%~75.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为2.00wt%~70.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为3.00wt%~60.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为5.00wt%~50.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为10.00wt%~50.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为15.00wt%~45.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为20.00wt%~40.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为25.00wt%~35.00wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为83.77wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为1.67wt%。在一些实施例中,以组合物的总重量计,所述助悬剂的含量为80.0wt%~85.0wt%。
28.所述矫味剂可以包括选自三氯蔗糖、安赛蜜、阿斯巴甜和甜蜜素中的至少一种。
29.以组合物的总重量计,所述矫味剂的含量可以为0~1.00wt%。在一些实施例中,
以组合物的总重量计,所述矫味剂的含量为0.10wt%~0.90wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.20wt%~0.80wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.10wt%~0.30wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.20wt%~0.75wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.30wt%~0.70wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.35wt%~0.65wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.40wt%~0.60wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.45wt%~0.55wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.50wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.29wt%。在一些实施例中,以组合物的总重量计,所述矫味剂的含量为0.33wt%。
30.所述香精可以包括选自水蜜桃香精、苹果香精、菠萝香精、橙子香精和草莓香精中的至少一种。
31.以组合物的总重量计,所述香精的含量可以为0~1.00wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.10wt%~0.90wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.15wt%~0.85wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.20wt%~0.80wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.25wt%~0.75wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.30wt%~0.70wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.35wt%~0.65wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.40wt%~0.60wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.45wt%~0.55wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.50wt%。在一些实施例中,以组合物的总重量计,所述香精的含量为0.10wt%~0.30wt%。
32.在本发明的一些实施方式中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸和葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%。
33.在本发明的一些实施方式中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸和葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%;所述药学上可接受的辅料包括选自填充剂、崩解剂、润滑剂中的至少一种。
34.在本发明的一些实施方式中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、
枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸和葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%;所述药学上可接受的辅料包括选自填充剂、崩解剂、润滑剂中的至少一种;所述填充剂包括选自甘露醇,微晶纤维素,乳糖,麦芽糖醇,山梨醇,预胶化淀粉中的至少一种;以组合物的总重量计,所述填充剂的含量为30.00wt%~95.00wt%;所述崩解剂包括选自交联聚维酮,低取代羟丙基纤维素,羧甲基淀粉钠,交联羧甲基纤维素钠,预胶化淀粉,玉米淀粉中的至少一种;以组合物的总重量计,所述崩解剂的含量为0~20.00wt%;所述润滑剂包括选自硬脂酸镁,硬脂酸富马酸钠,微粉硅胶,滑石粉,硬脂酸钙,聚乙二醇中的至少一种;以组合物的总重量计,所述润滑剂的含量为0~5.00wt%。
35.在本发明的一些实施方式中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸和葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%;所述药学上可接受的辅料包括选自填充剂、矫味剂和助悬剂中的至少一种;所述填充剂包括选自甘露醇,微晶纤维素,乳糖,麦芽糖醇,山梨醇和预胶化淀粉中的至少一种,以组合物的总重量计,所述填充剂的含量为30.00wt%~95.00wt%;所述助悬剂包括选自阿拉伯胶、黄原胶、西黄芪胶、卡波姆、明胶、羧甲基淀粉、醋酸酯淀粉、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙甲基纤维素、葡聚糖、共聚维酮、聚乙烯吡咯烷酮、聚乙烯醇、聚氧乙烯、蔗糖、胶体微晶纤维素中的至少一种,以组合物的总重量计,所述助悬剂的含量为0~85.00wt%;所述矫味剂包括选自三氯蔗糖、安赛蜜、阿斯巴甜、甜蜜素中的至少一种,以组合物的总重量计,所述矫味剂的含量为0~1.00wt%。
36.在本发明的一些实施方式中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸、葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%;所述药学上可接受的辅料包括选自填充剂、崩解剂、润滑剂中的至少一种;所述填充剂包括选自甘露醇,微晶纤维素,乳糖,麦芽糖醇,山梨醇,预胶化淀粉中的至少一种;以组合物的总重量计,所述填充剂的含量为30.00wt%~95.00wt%;所述崩解剂包括选自交联聚维酮,低取代羟丙基纤维素,羧甲基淀粉钠,交联羧甲基纤维素钠,预胶化淀粉,玉米淀粉中的至少一种;以组合物的总重量计,所述崩解剂的含量为0~20.00wt%;所述润滑剂包括选自硬脂酸镁,硬脂酸富马酸钠,微粉硅胶,滑石粉,硬脂酸钙,聚乙二醇中的至少一种;以组合物的总重量计,所述润滑剂的含量为0~5.00wt%。
37.在本发明的一些实施例中,所述组合物包括艾曲波帕或其药学上可接受的盐、螯合剂及至少一种药学上可接受的辅料;所述螯合剂和艾曲波帕的重量比为1:3-12:1;以组合物的总重量计,所述艾曲波帕或其药学上可接受的盐的含量为1.00wt%~40.00wt%;所述药学上可接受的盐可以为乙醇胺盐;所述药学上可接受的辅料包括填充剂、润滑剂中的
至少一种;所述螯合剂包括选自依地酸、依地酸盐、枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、葡萄糖酸、葡萄糖酸钠中的至少一种;以组合物的总重量计,所述螯合剂的含量为2.00wt%~90.00wt%;所述填充剂包括选自甘露醇,微晶纤维素,乳糖,麦芽糖醇,山梨醇,预胶化淀粉中的至少一种;以组合物的总重量计,所述填充剂的含量为30.00wt%~95.00wt%;所述润滑剂包括选自硬脂酸镁,硬脂酸富马酸钠,微粉硅胶,滑石粉,硬脂酸钙,聚乙二醇中的至少一种;以组合物的总重量计,所述润滑剂的含量为0~5.00wt%。
38.在本发明的一些实施方式中,一种组合物,其由以下组份组成:艾曲波帕乙醇胺、螯合剂、崩解剂、填充剂和润滑剂,其中,所述填充剂为微晶纤维素,所述崩解剂为羧甲基淀粉钠,所述螯合剂为依地酸四钠,所述润滑剂为硬脂酸镁,以组合物的总重量计,所述艾曲波帕乙醇胺的含量为27.3wt%,所述羧甲基淀粉钠的含量为10.0wt%,所述依地酸四钠的含量为28.6wt%,所述硬脂酸镁的含量为1.0%,余量为微晶纤维素。
39.在本发明的一些实施方式中,一种组合物,其由以下组份组成:艾曲波帕乙醇胺、螯合剂、助悬剂、矫味剂和香精,其中,所述助悬剂为蔗糖和黄原胶,所述螯合剂为依地酸二钠,所述矫味剂为三氯蔗糖,所述香精为橙子香精,以组合物的总重量计,所述艾曲波帕乙醇胺的含量为3.8wt%,所述依地酸二钠的含量为12.0wt%,所述黄原胶的含量为0.6wt%,所述三氯蔗糖的含量为0.2wt%,所述橙子香精的含量为0.2wt%,余量为蔗糖。
40.在本发明的一些实施方式中,一种组合物,其由以下组份组成:艾曲波帕乙醇胺、螯合剂、填充剂、崩解剂和润滑剂,其中,所述填充剂为微晶纤维素,所述崩解剂为羧甲基淀粉钠,所述螯合剂为依地酸二钠,所述润滑剂为硬脂酸镁,以组合物的总重量计,所述艾曲波帕乙醇胺的含量为27.3wt%,所述羧甲基淀粉钠的含量为10.0wt%,所述依地酸二钠的含量为42.9wt%,所述硬脂酸镁的含量为1.0wt%,余量为微晶纤维素。
41.所述组合物可制备为片剂、胶囊、颗粒剂或干混悬剂。
42.所述组合物的制备方法可以包括选自粉末直接压片法、湿法制粒和直混工艺中的一种。
43.第二方面,本发明提供了前述组合物的制备方法。
44.一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐、螯合剂、填充剂和任选的选自崩解剂、助悬剂、矫味剂和香精中的至少一种进行整粒,混合,即得所述组合物。
45.所述填充剂可分至少两次加入,每次加入后先混合均匀后再加入下一次。
46.所述螯合剂可分至少两次加入,每次加入后先混合均匀后再加入下一次。
47.根据本发明的一些实施方式,一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐和螯合剂进行整粒,混合,再加入整粒后的填充剂,混合,即得所述组合物。
48.根据本发明的一些实施方式,一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐、螯合剂和选自助悬剂、矫味剂和香精中的至少一种进行整粒,混合,再加入整粒后的填充剂,混合,即得所述组合物。
49.根据本发明的一些实施方式,一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐与螯合剂整粒,混合,再加入整粒后的填充剂和整粒后的崩解剂,混合,最后加入润滑剂混合,压片,即得所述组合物。
50.根据本发明的一些实施方式,一种组合物的制备方法,包括:将艾曲波帕或其药学
上可接受的盐和助悬剂混合,加水制粒,干燥,整粒,再加入螯合剂混合,最后加入矫味剂和/或香精混合,即得所述组合物。
51.根据本发明的一些实施方式,一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐、助悬剂和螯合剂整粒,混合,再加入整粒后的填充剂,混合,最后再加入矫味剂和/或香精混合,即得所述组合物。
52.根据本发明的一些实施例,一种组合物的制备方法,包括:将艾曲波帕或其药学上可接受的盐、助悬剂和螯合剂混合,再加入水制粒,干燥,干整粒,最后再加入矫味剂和/或香精混合,即得所述组合物。
53.有益效果
54.相比现有技术,本发明所述组合物至少包含以下至少一种有益效果:
55.(1)相比现有技术,本发明所述组合物,其中的艾曲波帕直接在胃中释放也能克服食物或其他药物中金属离子的影响,使得药物与食物或其他药物同服也能有效吸收,达到与空腹服用相似的效果,本发明可以消除食物及其他药物对吸收的影响,打破服药的过多限制,增加患者服药的灵活性和顺应性,同时也可以避免因服药不当导致的疗效降低甚至无效,保证药效的正常发挥,具有显著的进步。本发明提供的制备方法能提供均匀、稳定的艾曲波帕组合物。
56.(2)本发明所述螯合剂优选为依地酸或依地酸盐,更有利于获得的组合物消除食物及其他药物对活性成分吸收的影响。
57.(3)本发明所述螯合剂和艾曲波帕的重量比为0.5:1-7:1,优选为1:1-4:1,更优选为2:1-4:1,有利于提高艾曲波帕组合物在含多价金属离子的溶出介质中的溶出度。
58.术语说明
59.h表示小时;auc表示曲线下面积;auclast表示从开始给药到最后的检测时间点的曲线下面积;cmax表示最高血药浓度;wt%表示重量百分比;mg表示毫克;min表示分钟;%表示百分之;℃表示摄氏度;ng/ml表示纳克每毫升。
60.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
具体实施方式
61.为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例以对本发明作进一步的详细说明。
62.本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
63.本发明中,比格犬在进食条件下所采用的食物为犬维持饲料(北京科澳协力饲料有限公司),每千克饲料中含镁≥1.5g,和含7g-10g钙。
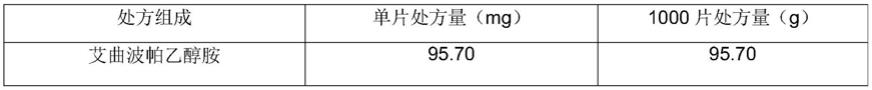
64.实施例1
65.通过直接混合制备艾曲波帕混悬颗粒,其处方信息见表1。
66.表1:实施例1处方信息表
67.处方组成单规格处方量(mg)1000袋处方量(g)艾曲波帕乙醇胺31.9031.90甘露醇822.10822.10依地酸四钠25.0025.00黄原胶15.0015.00三氯蔗糖3.003.00橙子香精3.003.00总计900.00900.00
68.操作:按表1中1000袋处方量分别称重各成分,将艾曲波帕乙醇胺和依地酸四钠、黄原胶、三氯蔗糖、橙子香精整粒,然后混合5min,得混合物a,再将约1/3的甘露醇整粒,加入至混合物a继续混合20min,得混合物b,最后将剩余的甘露醇整粒,加入至混合物b继续混合20min,即得艾曲波帕混悬颗粒。
69.实施例2
70.通过粉末直接压片法制备艾曲波帕片,处方信息见表2。
71.表2:实施例2处方信息表
72.处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素115.80115.80羧甲基淀粉钠35.0035.00依地酸四钠100.00100.00硬脂酸镁3.503.50总计350.00350.00
73.操作:按表2中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸四钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
74.实施例3
75.通过湿法制粒制备艾曲波帕混悬颗粒,处方信息见表3。
76.表3:实施例3处方信息表
77.处方组成单规格处方量(mg)1000袋处方量(g)艾曲波帕乙醇胺95.7095.70蔗糖2079.302079.30依地酸二钠300.00300.00黄原胶15.0015.00三氯蔗糖5.005.00橙子香精5.005.00
总计2500.002500.00
78.操作:先将蔗糖过40目筛,再按表3中1000袋处方量分别称重各成分,将艾曲波帕乙醇胺,黄原胶和约1/3蔗糖混合5min,再加入剩余蔗糖混合5min,然后加入纯化水制粒,将湿颗粒进行整粒,再50℃干燥1h,然后将干燥后颗粒进行整粒,再加入依地酸二钠混合10min,最后加入三氯蔗糖、橙子香精混合5min,即得艾曲波帕混悬颗粒。
79.实施例4
80.通过粉末直接混合制备艾曲波帕混悬颗粒,处方信息见表4。
81.表4:实施例4处方信息表
82.处方组成单规格处方量(mg)1000袋处方量(g)艾曲波帕乙醇胺95.7095.70甘露醇1376.301376.30柠檬酸钠500.00500.00黄原胶20.0020.00三氯蔗糖5.005.00草莓香精3.003.00总计2000.002000.00
83.操作:按表4中1000袋处方量分别称重各成分,先将艾曲波帕乙醇胺与黄原胶、柠檬酸钠整粒,混合10min,得混合物a,再将约1/2甘露醇整粒,加入至混合物a继续一起混合10min,得混合物b,再将剩余甘露醇整粒,加入至混合物b继续混合10min,最后加入三氯蔗糖和草莓香精继续混合5min,即得艾曲波帕混悬颗粒。
84.实施例5
85.通过湿法制剂制备艾曲波帕混悬颗粒,处方信息见表5。
86.表5:实施例5处方信息表
87.处方组成单规格处方量(mg)1000袋处方量(g)艾曲波帕乙醇胺95.7095.70黄原胶17.0017.00葡萄糖酸钠931.30931.30三氯蔗糖3.003.00橙子香精3.003.00总计1050.001050.00
88.操作:按表5中1000袋处方量分别称重各成分,先将艾曲波帕乙醇胺、黄原胶和约1/3葡萄糖酸钠混合5min,再加入剩余葡萄糖酸钠混合10min,然后加纯水制粒,将湿颗粒整粒,再50℃干燥1h,将干燥后的颗粒进行干整粒,再加入三氯蔗糖、橙子香精混合5min,即得艾曲波帕混悬颗粒。
89.实施例6
90.通过粉末直接压片法制备艾曲波帕肠溶片,处方信息见表6。
91.表6:实施例6处方信息表
92.处方组成单片处方量(mg)1000片处方量(g)
艾曲波帕乙醇胺95.7095.70微晶纤维素211.30211.30交联聚维酮21.0021.00依地酸四钠15.0015.00硬脂酸镁3.503.50硬脂富马酸钠3.503.50合计350.00350.00
93.操作:按表6中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸四钠、交联聚维酮整粒,混合10min,得混合物a,再加微晶纤维素整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁和硬脂富马酸钠,混合5min,将总混物压片,即得艾曲波帕肠溶片。
94.实施例7
95.通过粉末直接压片法制备艾曲波帕片,处方信息见表7。
96.表7:实施例7处方信息表
97.处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素65.8065.80羧甲基淀粉钠35.0035.00依地酸二钠150.00150.00硬脂酸镁3.503.50总计350.00350.00
98.操作:按表7中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸二钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
99.实施例8
100.通过粉末直接压片法制备艾曲波帕片,处方信息见表8。
101.表:8:实施例8处方信息表
102.处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素140.80140.80羧甲基淀粉钠35.0035.00依地酸75.0075.00硬脂酸镁3.503.50总计350.00350.00
103.操作:按表8中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
104.实施例9
105.通过粉末直接压片法制备艾曲波帕片,处方信息见表9。
106.表9:实施例9处方信息表
107.处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素165.80165.80羧甲基淀粉钠35.0035.00依地酸二钠50.0050.00硬脂酸镁3.503.50总计350.00350.00
108.操作:按表9中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸二钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
109.实施例10
110.通过粉末直接压片法制备艾曲波帕片,处方信息见表10。
111.表10:实施例10处方信息表
[0112][0113][0114]
操作:按表10中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸二钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0115]
实施例11
[0116]
通过粉末直接压片法制备艾曲波帕片,处方信息见表11。
[0117]
表11:实施例11处方信息表
[0118]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素200.80200.80羧甲基淀粉钠35.0035.00依地酸二钠15.0015.00硬脂酸镁3.503.50总计350.00350.00
[0119]
操作:按表11中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与依地酸二钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0120]
实施例12
[0121]
通过粉末直接压片法制备艾曲波帕片,处方信息见表12。
[0122]
表12:实施例12处方信息表
[0123][0124][0125]
操作:按表12中1000片处方量分别称重各成分,将艾曲波帕乙醇胺、依地酸二钠和柠檬酸钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0126]
实施例13
[0127]
通过粉末直接压片法制备艾曲波帕片,处方信息见表13。
[0128]
表13:实施例13处方信息表
[0129]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素140.80140.80羧甲基淀粉钠35.0035.00依地酸二钠15.0015.00柠檬酸钠60.0060.00硬脂酸镁3.503.50总计350.00350.00
[0130]
操作:按表13中1000片处方量分别称重各成分,将艾曲波帕乙醇胺、依地酸二钠和柠檬酸钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0131]
实施例14
[0132]
通过粉末直接压片法制备艾曲波帕片,处方信息见表14。
[0133]
表14:实施例14处方信息表
[0134][0135][0136]
操作:按表14中1000片处方量分别称重各成分,将艾曲波帕乙醇胺、依地酸二钠和柠檬酸钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0137]
实施例15
[0138]
通过粉末直接压片法制备艾曲波帕片,处方信息见表15。
[0139]
表15:实施例15处方信息表
[0140]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素140.80140.80羧甲基淀粉钠35.0035.00依地酸四钠15.0015.00葡萄糖酸钠60.0060.00硬脂酸镁3.503.50总计350.00350.00
[0141]
操作:按表15中1000片处方量分别称重各成分,将艾曲波帕乙醇胺、依地酸四钠和葡萄糖酸钠整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0142]
实施例16
[0143]
通过粉末直接压片法制备艾曲波帕片,处方信息见表16。
[0144]
表16:实施例16处方信息表
[0145]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素140.80140.80羧甲基淀粉钠35.0035.00氨基三乙酸75.0075.00硬脂酸镁3.503.50总计350.00350.00
[0146]
操作:按表16中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与氨基三乙酸
整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0147]
实施例17
[0148]
通过粉末直接压片法制备艾曲波帕片,处方信息见表17。
[0149]
表17:实施例:17处方信息表
[0150]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素140.80140.80羧甲基淀粉钠35.0035.00二乙烯三胺五乙酸75.0075.00硬脂酸镁3.503.50总计350.00350.00
[0151]
操作:按表17中1000片处方量分别称重各成分,将艾曲波帕乙醇胺与二乙烯三胺五乙酸整粒,混合10min,得混合物a,再将微晶纤维素和羧甲基淀粉钠整粒,加入至混合物a继续混合20min,最后加入硬脂酸镁,混合5min,压片,即得艾曲波帕片。
[0152]
实施例18
[0153]
根据原研(smithkline beecham corp)专利cn201210181353.7,制备不含依地酸或依地酸盐的艾曲波帕片剂,处方信息见表18。
[0154]
表18:实施例18处方信息表
[0155]
处方组成单片处方量(mg)1000片处方量(g)艾曲波帕乙醇胺95.7095.70微晶纤维素10144.7044.70微晶纤维素10293.6093.60甘露醇89.2089.20聚维酮9.609.60羧甲基淀粉钠28.0028.00硬脂酸镁3.503.50总计350.00350.00
[0156]
操作:按表18中1000片处方量分别称量各成分,先将艾曲波帕乙醇胺与微晶纤维素101、甘露醇、聚维酮混合5min,然后加纯化水制粒,将湿颗粒进行整粒,再50℃干燥1h,将干燥后颗粒进行干整粒,然后将干颗粒与微晶纤维素102、羧甲基淀粉钠混合10min,再加入硬脂酸镁混合5min,压片,即得艾曲波帕片。
[0157]
实施例19
[0158]
将实施例18所得艾曲波帕片分别投入900ml的ph6.8介质1(含0.5%吐温)和900ml的ph6.8介质2(含0.5%吐温和300mg氯化钙)中,使用溶出仪,运用uspⅱ(即美国药典所述的桨法)在75rpm转速下,进行溶出检测,用0.45微米微孔滤膜过滤,取续滤液,进行hplc测试,检测其溶出数据。结果见表19。
[0159]
表19:实施例18所得艾曲波帕组合物的溶出数据
[0160][0161]
结论:实施例18按照原研专利cn201210181353.7制备的艾曲波帕片,在加入钙离子后,溶出受到了极大的影响,大幅降低,从而导致进食后暴露量降低。
[0162]
实施例20
[0163]
分别将实施例1-18所得艾曲波帕混悬颗粒、艾曲波帕肠溶片或艾曲波帕片投入900ml含0.5%吐温和300mg氯化钙的ph6.8介质溶液中,使用溶出仪,运用uspⅱ(即美国药典所述的桨法)在75rpm转速下,进行溶出检测,用0.45微米微孔滤膜过滤,取续滤液,进行hplc测试,检测其溶出数据。结果见表20。
[0164]
表20:实施例1-19所得艾曲波帕混悬颗粒、艾曲波帕肠溶片或艾曲波帕片的溶出数据
[0165]
[0166][0167]
结果分析:
[0168]
(1)从溶出数据可以看出,在加入钙离子后,实施例18处方中没有螯合剂,溶出受到了大幅影响;而加入螯合剂(依地酸、依地酸盐、柠檬酸钠或葡萄糖酸钠),且螯合剂与艾曲波帕游离酸的重量比为1:3-12:1的处方(实施例1-10和实施例12-15),溶出得到了大幅改善,在螯合剂和艾曲波帕游离酸比例为1:3-12:1时,溶出提高了6倍以上,当螯合剂比例降低,螯合剂与艾曲波帕游离酸的重量比为1:5时(实施例11),增溶的效果大幅下降,依地酸盐和柠檬酸钠、葡萄糖酸钠组合应用,溶出有所降低,但依然有较好的效果。
[0169]
(2)应用常用螯合剂氨基三乙酸和二乙烯三胺五乙酸时,增溶效果不显著,同时存在明显的溶出下降现象,未达到增加溶出的目的。
[0170]
(3)在螯合剂用量相同的情况下,相比其他螯合剂种类,螯合剂优选为依地酸或其盐时,艾曲波帕组合物的溶出效果最佳。
[0171]
(4)螯合剂与艾曲波帕游离酸的重量比优选为2:1-4:1,艾曲波帕组合物的溶出效果最佳。
[0172]
实施例21:体内药代动力学试验
[0173]
利用比格犬考察实施例18所得艾曲波帕片(原研专利处方,不含依地酸或其盐)在进食与空腹条件下给药后48小时的体内药代动力学,结果如表21所示。
[0174]
表21:实施例18所得艾曲波帕片的体内药代动力学
[0175]
检测实施例18-进食实施例18-空腹实施例18-进食/实施例18-空腹(%)
auclast(h*ng/ml)323208130039.8cmax(ng/ml)3312657450.4
[0176]
结论:原研专利处方在进食情况下,auc和cmax明显低于空腹条件,受食物的影响很显著,与原研产品审评资料描述一致,因此原研市售产品要求在空腹情况下服用。
[0177]
实施例22:体内药代动力学试验
[0178]
利用比格犬考察实施例6所得艾曲波帕肠溶片(含依地酸四钠)在空腹和进食条件下给药后48小时的体内药代动力学,同时与实施例18所得艾曲波帕片空腹体内药代动力学进行了对比,结果如表22所示。
[0179]
表22:实施例6所得艾曲波帕肠溶片和实施例18所得艾曲波帕片的体内药代动力学
[0180]
检测实施例6-空腹实施例18-空腹实施例6-空腹/实施例18-空腹(%)auclast(h*ng/ml)3410010700031.87cmax(ng/ml)2250869025.89检测实施例6-进食实施例6-空腹实施例6-进食/实施例6-空腹(%)auclast(h*ng/ml)337003410098.83cmax(ng/ml)25002250111.11
[0181]
结论:结果表明实施例6所得艾曲波帕肠溶片在空腹和进食情况下吸收相近,但无论是空腹和进食条件,艾曲波帕的吸收量明显降低,auc和cmax只有实施例18所得艾曲波帕片的31.87%和25.89%,说明含肠溶包衣的艾曲波帕肠溶片并不能克服食物对艾曲波帕吸收的影响,反而还导致吸收的下降。
[0182]
实施例23:体内药代动力学试验
[0183]
利用比格犬考察实施例2所得艾曲波帕片在进食与空腹条件下给药后48小时的体内药代动力学,同时与实施例18所得艾曲波帕片空腹条件下给药后48小时的体内药代动力学进行了对比,结果如表23所示。
[0184]
表23:实施例2所得艾曲波帕片和实施例18所得艾曲波帕片的体内药代动力学
[0185][0186][0187]
结论:添加了依地酸四钠的处方(实施例2所得艾曲波帕片)无论是空腹和进食条件,都能与原研专利处方(实施例18所得艾曲波帕片)在空腹的条件下的吸收情况相近。说明加入依地酸盐后起到了克服艾曲波帕组合物不能在进食时服用的技术问题,有意想不到的技术效果。
[0188]
实施例24:体内药代动力学试验
[0189]
利用比格犬考察实施例9所得艾曲波帕片在进食与空腹条件下给药后48小时的体
内药代动力学,同时与实施例18所得艾曲波帕片空腹条件下给药后48小时的体内药代动力学进行了对比,结果如表24所示。
[0190]
表24:实施例9所得艾曲波帕片和实施例18所得艾曲波帕片的体内药代动力学
[0191]
检测实施例9-空腹实施例18-空腹实施例9-空腹/实施例18-空腹(%)auclast(h*ng/ml)141200136000103.82cmax(ng/ml)8790962091.37检测实施例9-进食实施例9-空腹实施例9-进食/实施例9-空腹(%)auclast(h*ng/ml)12110014120085.76cmax(ng/ml)7750879088.16
[0192]
结论:
[0193]
(1)添加了依地酸二钠的处方(实施例9所得艾曲波帕片)无论是空腹和进食条件,都能与原研专利处方(实施例18所得艾曲波帕片)在空腹的条件下的吸收情况相近,表明依地酸盐的加入并没有降低艾曲波帕的吸收,反而起到了克服不能在进食时服用的技术问题,有意想不到的技术效果。
[0194]
(2)实施例9所得艾曲波帕片相对于实施例2所得艾曲波帕片,因为螯合剂用量减少,在犬体内吸收情况也发现食物影响逐渐增加,但都在80-125%的可接受范围内。
[0195]
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
