错配的线性双链寡核苷酸探针及lncrna的检测方法
技术领域
1.本发明属于生物技术领域,具体涉及一种错配的线性双链寡核苷酸探针及lncrna的检测方法。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.荧光探针包含两个基本组件:识别组件和转化组件。荧光探针可以将多种信号活动(例如细胞内dna/rna的浓度和酶活性)转化为可测量的荧光值。荧光探针已被用于直接在活细胞中无损伤地观察细胞成分,荧光信号允许高保真记录单细胞中生物标志物的存在。基于荧光探针的成像和检测感兴趣的生物标志物,尤其是活细胞中的特定基因,可以为进行性疾病和医学诊断提供有关的重要信息。
4.现在已经开发了多种基于荧光探针的成像策略,用于活细胞中的特定基因检测和成像。目前,荧光原位杂交(fish)分析已成为检测测细胞内基因表达的最常用方法,尤其是基于酶促反应的各种扩增策略,如基于滚环扩增(rca)的fish和基于链置换扩增(sda)的fish已被用于实现原位成像mrna表达和mirna在单细胞中的表达。然而,这些扩增程序需要外来酶的参与,而且细胞需要提前用多聚甲醛处理来增加细胞膜的通透性,这将妨碍用于活细胞中细胞内生物分子的观察。因此,近年来,基于dna级联反应的非酶催化扩增策略,如杂交链反应(hcr)、发夹dna级联放大器(hdca)和催化发夹组装(cha)反应已开发用于活细胞中mirna和mrna的成像。尽管这些无酶扩增方法可以超灵敏检测活细胞中低丰度细胞内生物分子,但是需要设计多组复杂的发夹探针,并且由于非特异性扩增子的积累而受到干扰信号的影响。最近,含有金纳米颗粒的探针nanoflares(nfs)已被开发用于活细胞中mirna的高灵敏度成像。在细胞内,靶标可以与识别序列结合并取代报告序列,从而释放出荧光。然而这种方法需要复杂的纳米颗粒合成和修饰,精心设计成像探针或者需要外来金属离子的辅助。此外,纳米金在相对高浓度下具有不可忽略的细胞毒性。
5.若想更好的检测活细胞中低表达特异基因,检测探针必须满足两个要求:信号从“关”到“开”和目标特异基因结合时引起信号放大或者具备低背景信号。现有的大多数报道都集中在靶标特异性基因结合时的信号放大,而检测活细胞中靶标特异性基因的更好策略是低背景信号,以及复杂细胞环境中靶标结合后的直接且简单的信号转化。
6.因此,开发一种具备步骤简单、背景信号低、高灵敏度和高选择性且能够直接检测细胞中特定lncrna的荧光方法仍然是一个巨大的挑战。
技术实现要素:
7.为了解决现有技术的不足,本发明提供一种错配的线性双链寡核苷酸探针来直接检测体外或活细胞中的长链非编码rna(lncrna),无需任何酶扩增,并且也不需要分离未结
合的探针,在寡核苷酸探针中引入错配碱基可以提高对靶标lncrna的链置换反应速率,具有背景信号低、检测灵敏度高的优势。错配的寡核苷酸探针可以检测各种细胞系中细胞内lncrna的表达水平,并将癌细胞与正常细胞区分开来,为快速简便地检测活细胞中的低丰度核酸提供了一个有用的平台。
8.本发明第一方面提供一种错配的线性双链寡核苷酸探针,错配的线性双链寡核苷酸探针由5'端用bhq1修饰的捕获探针和3'端用fam修饰的报告探针组成;捕获探针与报告探针部分杂交,形成具有两个错配碱基的双链错配探针。
9.本发明第二方面提供一种体外lncrna的检测方法,具体为:
10.(1)制备错配探针;
11.(2)将rna样品与错配探针混合,黑暗中孵育,以释放报告探针;
12.(3)进行荧光光谱测量。
13.本发明第三方面提供一种活细胞中lncrna的检测方法,具体为:
14.(1)制备错配探针;
15.(2)制备opti-mem转染混合物;
16.(3)将细胞与opti-mem转染混合物在加湿环境下进行孵育;
17.(4)进行激光扫描显微镜成像。
18.本发明的一个或多个实施方式至少具有以下有益效果:
19.1.不需要任何扩增,无需任何酶参与,不需要分离未结合探针,仅使用链置换就可以检测lncrna;本发明仅涉及目标催化的链置换反应,可在活细胞中实时监测lncrna。与传统用于rna分析的多种酶辅助核酸扩增相比,靶催化的链置换反应可以在无酶系统中进行,克服了与酶有关的局限性(即对实验条件敏感,例如温度,离子和ph)。
20.2.探针设计简单,错配探针提高了链置换反应速率;传统的检测方法往往有复杂的发夹探针结构参与链置换,本发明中使用的所有dna探针都是线性链dna,大大简化了探针设计,错配的线性双链寡核苷酸探针能够更高效率的进行链置换反应,实现了简单快速的检测活细胞中的lncrna。
21.3.背景信号低;错配双链寡核苷酸结构的形成使猝灭剂(bhq1)和荧光团(fam)靠近,从而有效地猝灭荧光(off状态)。在靶标lncrna存在的情况下,错配的双链寡核苷酸探针中的捕获探针可以与其目标lncrna完全杂交并释放reporter探针,从而在激发时发射荧光(on状态)。在没有靶标的情况下,错配探针在37℃的生理温度下保持稳定,背景信号低。
22.4.能够长时间监测活细胞中的lncrna;错配双链寡核苷酸结构的探针转染进入活细胞中,在靶标存在的情况下,荧光信号从“关”到“开”,在没有靶标存在时,背景信号低,并且该转染没有引入纳米颗粒和金属离子等,所以能够在活细胞中长时间存在。
附图说明
23.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
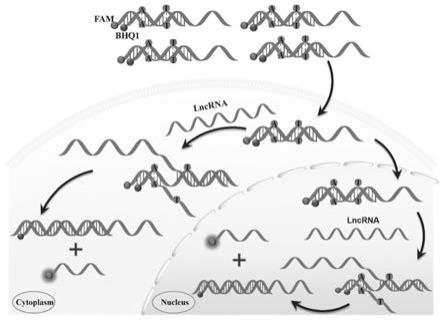
24.图1:机理图
25.图2为荧光探针的优化系列图;其中,(a)不同的错配探针(探针1、3、5和7)和完全匹配的探针(探针2、4、6和8)对应的f/f0值。**p《0.01代表错配探针与完全匹配的探针相比
具有显著差异。(b)在错配探针5的基础上改变错配碱基的位置对应的f/f0值。f和f0分别是lncrna存在和不存在时的荧光强度。lncrna hotair的浓度为1μm。误差棒显示三个实验的标准偏差。(c)分别使用错配探针5(1.5μm)和完全匹配探针6(1.5μm)获得的时间依赖性荧光光谱。hotair lncrna的浓度为1μm。(d)错配探针5和完全匹配探针6响应不同浓度hotair lncrna的初始反应速率。**p《0.01代表与完全匹配探针6相比具有显著差异。误差棒代表三次独立实验的标准偏差。
26.图3为f/f0值随链置换反应反应时间的变化图;f和f0分别是lncrna存在和不存在时的荧光强度。lncrna hotair的浓度为1μm。误差棒表示三个独立实验的标准偏差。
27.图4为错配探针5存在时的灵敏度检测相关图;其中,(a)荧光强度与hotair lncrna浓度之间的关系;(b)错配探针5分别对1μm hotair lncrna、1μm malat1 lncrna、1μm mirna-486-5p、1μm mirna let-7a和仅使用反应缓冲液对照的特异性。(误差棒表示来自三个独立实验的标准偏差)。
28.图5为完全匹配的探针6存在时的灵敏度检测相关图;其中,(a)荧光强度在25nm至800nm范围内与lncrna hotair浓度的对数呈线性关系。误差棒显示三个实验的标准偏差。(b)使用匹配探针6测量荧光强度,响应1μm lncrna hotair、1μm lncrna malat1、1μm mirna-486-5p、1μm mirna let-7a和仅含反应缓冲液的对照。误差棒显示三个实验的标准偏差。
29.图6为细胞可行性和灵敏度验证图;其中,(a)使用错配探针5检测mcf-7细胞、a549细胞和hbe细胞中提取的lncrna hotair。本实验使用从500000个不同细胞系中提取的总rna。*p《0.05和**p《0.01代表mcf-7细胞、a549细胞与正常hbe细胞相比具有统计学意义。误差棒显示三个独立实验的标准偏差。(b)使用错配探针5检测不同数目的mcf-7细胞中的hotair lncrna表达水平,荧光信号值与细胞数目对数之间成线性关系。
30.图7为在乳腺癌细胞系中实时成像系列图;其中,(a)使用错配探针5(0.25μm)转染mcf-7细胞的时间依赖性荧光图像。比例尺为50μm。(b)每个细胞的平均荧光强度随反应时间的变化。(c)分别用错配的探针5(左图)和完全匹配的探针6(右图)处理mcf-7细胞3小时后的剂量依赖性荧光图像。比例尺为50μm。(d)每个细胞的平均荧光强度随探针浓度的变化。**p《0.01代表错配探针5与完全匹配的探针6相比具有统计学差异。误差棒表示三个独立实验的标准偏差。
31.图8为实时荧光检测不同细胞系中lncrna表达的系列图;分别为:与错配探针5孵育3小时后,hotair lncrna在不同细胞(hbe、mcf-7和a549细胞)中的荧光图像(a)和每个细胞的平均荧光强度(b),**p《0.01表示mcf-7,a549细胞与hbe细胞相比具有统计学差异;分别与错配探针5和完全匹配的探6孵育1.5小时后,单个hbe细胞和单个mcf-7细胞中hotair lncrna的荧光图像(c)和每个细胞的平均荧光强度(d);比例尺为10μm,**p《0.01表示错配探针5与完全匹配的探针6相比具有统计学差异。误差条表示三个实验的标准偏差。
具体实施方式
32.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
33.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
34.正如背景技术所介绍的,现有技术中已报道的lncrna的检测方法,存在步骤繁琐、探针设计复杂、背景信号高、灵敏度低等问题。
35.为了解决如上的技术问题,本发明第一方面提供一种错配的线性双链寡核苷酸探针,错配的线性双链寡核苷酸探针由5'端用bhq1修饰的捕获探针和3'端用fam修饰的报告探针组成;捕获探针与报告探针部分杂交,形成具有两个错配碱基的双链错配探针。
36.错配双链寡核苷酸结构的形成使猝灭剂(bhq1)和荧光团(fam)靠近,从而有效地猝灭荧光(off状态)。在靶标lncrna存在的情况下,错配的双链寡核苷酸探针中的捕获探针可以与其目标lncrna完全杂交并释放报告探针,从而在激发时发射荧光(on状态),实现对靶标lncrna的检测。寡核苷酸探针中错配碱基的存在可以提高对靶标lncrna的链置换反应速率。
37.lncrna是一类长度超过200个核苷酸的非编码rna,在多种生物过程中发挥重要作用,包括基因组印记、基因表达、dna甲基化和组蛋白修饰。lncrna的功能失调可以通过调节肿瘤的发生和进展参与不同人类疾病(如癌症)的发展。许多lncrna可作为评估癌症和治疗阶段的特定生物标志物。上述错配的线性双链寡核苷酸探针,不仅可以用于体外lncrna的检测,更重要的是,还能用于活细胞中lncrna的检测。通常意义上来说,用于活细胞中lncrna检测的理想荧光探针应具有易于合成、高信号背景比和简单的信号转换,无需在细胞环境中进行复杂的反应过程等特点。本发明设计的错配的线性双链寡核苷酸探针来直接检测活细胞中的lncrna,并且无需任何酶的参与,也不需要分离未结合的探针,非常适合用于活细胞环境,对于活细胞进行分析时,在没有靶标的情况下,错配探针在37℃的生理温度下保持稳定,并且可以在37℃下区分完全匹配的靶标lncrna。此外,在活细胞检测中,错配探针能够在稳定性和杂交速率之间达到微妙的平衡。
38.本发明第二方面提供一种体外lncrna的检测方法,具体为:
39.(1)制备错配探针;
40.(2)将rna样品与错配探针混合,黑暗中孵育,以释放报告探针。
41.(3)进行荧光光谱测量。
42.进一步的,将捕获探针和报告探针分别在1
×
反应缓冲液中稀释,然后在90-95℃下孵育5-8min,缓慢冷却至室温形成错配探针;
43.所述1
×
反应缓冲液的组成为:10mm tris-hcl、50mm nacl,ph=8.0。
44.进一步的,将rna样品与错配探针、rnase抑制剂加入10
×
tdt缓冲液中进行混合,再将混合物在35-40℃下黑暗中孵育2-3小时以释放报告探针;
45.10
×
tdt缓冲液的组成为:100mm mg(ac)2、200mm tris-ac、500mm kac,ph=7.9。
46.进一步的,荧光激发波长为488nm,发射光谱在500至650nm范围内扫描,收集520nm处的发射强度用于数据分析。
47.本发明第三方面提供一种活细胞中lncrna的检测方法,
48.(1)制备错配探针;
49.(2)制备opti-mem转染混合物;
50.(3)将细胞与opti-mem转染混合物在加湿环境下进行孵育;
51.(4)进行激光扫描显微镜成像。
52.进一步的,所述步骤(2),将lipofectamine 3000稀释在opti-mem中形成a溶液,在opti-mem中稀释错配探针和p3000形成b溶液,混合a、b溶液,进行孵育,制备得到opti-mem转染混合物。
53.进一步的,在室温下孵育10-20分钟。
54.进一步的,所述步骤(3),在含有5%co2的加湿培养箱中于35-40℃下孵育2-3小时。
55.进一步的,所述步骤(4),fam的荧光点由488nm激光激发。
56.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
57.1、实验方案:
58.(1)细胞培养及总rna的制备:mcf-7细胞、a549细胞和hbe细胞在含有10%胎牛血清和1%青霉素-链霉素的改良培养液(dmem;gibco,美国)中培养,温度为37℃,二氧化碳含量为5%。使用countstar细胞计数器测量细胞数,根据制造商的程序通过通用提取试剂盒(genedotech,深圳,中国)获得总rna,并使用nanodrop 2000c分光光度计(thermo scientific,美国威明顿,美国)进行定量。
59.(2)lncrna的体外荧光检测:将捕获探针和报告探针分别在1
×
反应缓冲液(10mm tris-hcl,50mm nacl,ph 8.0)中稀释至10μm,然后在95℃下孵育5min,然后缓慢冷却至室温形成错配探针和完全匹配探针。对于lncrna分析,将1.5μl错配探针(10μm)或完全匹配探针(10μm)、不同浓度的lncrna/总rna样品、20u rnase抑制剂加入2μl 10
×
tdt缓冲液(100mm mg(ac)2、200mm tris-ac、500mm kac,ph 7.9)中,终体积为20μl。将混合物在37℃下黑暗中孵育3小时以释放报告探针。荧光信号由日立f-7000荧光分光光度计(日本东京)测量,激发波长为488nm,发射光谱在500至650nm范围内扫描,收集520nm处的发射强度用于数据分析。
60.qrt-pcr检测:根据制造商的说明,使用带有gdna eraser(takara,大连,中国)的primescript
tm rt试剂盒,将从不同细胞系中获得的总rna逆转录为cdna。在bio-rad cfx实时连接实时系统中,使用tb green premix ex taq ii(tlirnaseh plus)(takara,大连,中国)通过rt-pcr定量lncrna水平。结果通过使用δδct方法以hbe细胞作为对照进行分析。
61.(3)活细胞中lncrna的成像:mcf-7细胞、a549细胞和hbe细胞接种在20毫米玻璃底细胞培养皿中,并在含有10%胎牛血清的dmem培养基中孵育过夜。细胞用1
×
pbs洗涤两次。根据制造商的说明,使用lipofectamine 3000试剂进行转染测定。简而言之,将7.5μllipofectamine 3000稀释在250μl opti-mem中,在250μl opti-mem中稀释18.7μl错配探针(10μm)或完全匹配探针(10μm)和10μl p3000。通过混合上述溶液并在室温下孵育15分钟来制备opti-mem转染混合物。将细胞与opti-mem转染混合物在含有5%co2的加湿培养箱中于37℃下孵育3小时。转染后,细胞用1
×
pbs洗涤5次,并在培养皿加入新鲜的含10%胎牛血清的dmem培养基。细胞图像是在具有10倍物镜的倒置显微镜上获得,fam的荧光点由488nm激光激发。
62.对于单个mcf-7细胞和hbe细胞中lncrna的成像,将细胞分别接种在20毫米玻璃底细胞培养皿中,并在含有10%胎牛血清的dmem培养基中孵育过夜。将7.5μl lipofectamine 3000用250μl opti-mem稀释,8μl错配探针(10μm)和10μl p3000同样在250μl opti-mem中稀释。将细胞与opti-mem转染混合物在含有5%co2的加湿培养箱中于37℃下培养2小时。转染后,在60
×
物镜倒置显微镜下获得细胞图像。
63.2、荧光探针的优化
64.为了获得最佳的实验结果,我们优化了实验条件,包括不同错配碱基数和不同错配位置的探针的优化、体外荧光检测反应时间的优化、活细胞成像反应时间和信号探针浓度的优化。如图2a所示,比较含有相同配对碱基数的不同的错配探针(探针1、3、5和7)和完全匹配的探针(探针2、4、6和8)对应f/f0值,得到含有两个错配碱基的错配探针5产生最大的f/f0值。图2b所示,在错配探针5的基础上变化两个错配碱基的位置,得到错配探针5产生最大的f/f0值。
65.图2c所示,使用错配探针5产生的荧光值随时间变化始终是高于完全匹配探针6所产生的荧光。图2d所示,错配探针5和完全匹配探针6响应不同浓度hotair lncrna的初始反应速率相比较得出错配探针5的初速率始终高于完全匹配探针6。这些实验结果表明错配探针可以提高链的置换反应速率,在随后的实验中使用错配探针5作为最佳探针。
66.3、检测灵敏度
67.首先优化体外荧光检测的最佳反应时间。如图3,f/f0值随链置换反应时间增加而增加,并在3小时时达到最大值。在最佳反应时间3小时的条件下,用错配探针5和完全匹配探针6分别检测不同浓度的lncrna hotair方。如图4a所示,在错配探针5存在时,fam的荧光值随着lncrna hotair浓度的增加而增加。在对数尺度上,fam的荧光值在10皮摩尔每升到100那摩尔每升的大范围内与lncrna hotair的浓度呈线性关系。回归方程为f=2219+182.6632log
10
c(r2=0.99744),其中n代表fam的荧光值,c代表lncrna hotair的浓度(摩尔每升)。检测极限可以达到5.516皮摩尔每升。如图5a,在完全匹配的探针6存在时,fam的荧光值随着lncrna hotair浓度的增加而增加。在对数尺度上,fam的荧光值在25纳摩尔每升到800纳摩尔每升的范围内与lncrna hotair的浓度呈线性关系。检测极限可以达到9.8纳摩尔每升。这些结果表明错配探针5更适合检测lncrna。
68.4、检测选择性
69.为了研究该方法对lncrna hotair检测的特异性,我们使用了三种非靶标的lncrnamalat1和mirna(即let-7a和mir-486-5p)作为阴性对照。lncrna malat1、let-7a和mir-486-5p无法识别特定的捕获探针。结果,无论是用错配探针5(图4b)检测还是用完全匹配探针6(图5b)进行检测,在lncrna malat1、let-7a和mir-486-5p存在下均无法观察到fam的信号,这与仅使用反应缓冲液的对照相似。相反,lncrna hotair的存在可以诱导fam信号的显着增强。这些结果证明了所提出的方法对lncrna hotair的具有良好选择性。而且用错配探针5针对靶标lncrna hotair产生的信号要高于完全匹配探针6针对靶标lncrna hotair产生的信号。
70.5、细胞可行性
71.为了证明所提出的方法用于细胞lncrna测定的可行性,我们用错配探针5检测人类乳腺癌细胞系(mcf-7细胞),人类肺腺癌细胞系(a549细胞)和人支气管上皮细胞系(hbe
细胞)不同细胞系中的lncrna hotair表达。如图6a所示,mcf-7细胞和a549细胞获得的fam荧光值高于正常细胞系hbe细胞获得的fam荧光值,这表明lncrna hotair在乳腺癌和肺癌细胞系表达量上调。
72.(1)细胞灵敏度检测
73.进一步采用错配探针5检测了不同mcf-7细胞个数中提取的lncrna hotair。如图6b所示,fam荧光值随mcf-7细胞数的增加而增加,并且在10-5
×
105范围内,fam荧光值(f)与mcf-7细胞数(n)的对数之间呈线性相关。回归方程为f=53.0768+236.826log
10
n(r2=0.99454)。结果表明,错配探针5可以灵敏地检测细胞中的lncrna hotair。
74.(2)在乳腺癌细胞系中实时成像
75.首先优化细胞成像中的反应时间和探针所需浓度。如图7a和7b所示,在错配探针5存在的情况下,mcf-7细胞中的荧光值随反应时间增加而增加,并在3小时时达到最大值。因此,在随后的实验中使用3小时的反应时间。如图7c和7d所示,分别用错配的探针5(左图)和完全匹配的探针6(右图)转染mcf-7细胞3小时后,每个细胞的平均荧光强度随探针浓度的增到而增大,在探针浓度为0.35μm是达到最大值。而且错配的探针5产生的荧光强度始终高于完全匹配的探针6。这些结果表明错配探针更适合用于在细胞内实时检测lncrna。因此,在随后的实验中错配的探针5浓度使用0.35μm。
76.(3)实时荧光检测不同细胞系中lncrna的表达
77.采用错配探针5实时荧光检测mcf-7细胞,a549细胞和hbe细胞中的lncrna hotair表达。如图8a和8b,将不同细胞与错配探针5孵育3小时后,观察到mcf-7细胞,a549细胞fam荧光信号远远高于hbe细胞中的荧光强度。结果表明错配探针5可以区别不同细胞中lncrna hotair表达量的不同,且mcf-7细胞,a549细胞中lncrna hotair表达量要高于hbe细胞。我们在单个细胞水平上比较了错配探针5和完全匹配的探针6实时检测lncrna hotair的区别。如图8c和8d,将错配探针5和完全匹配的探针6分别与mcf-7细胞和hbe细胞孵育1.5小时之后,观察到不管是在mcf-7细胞还是在hbe细胞中产生的荧光强度始终是错配探针5要高于完全匹配的探针6。而且错配探针5可以检测到hbe细胞中低表达量的lncrna hotair。实施例中涉及的核苷酸序列如表1所示:
78.表1
[0079][0080][0081]
其中,*代表硫代修饰的寡核苷酸,主要用于防止被核酸酶降解;下划线则代表错配的碱基。
[0082]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
