用于寡核苷酸的脱保护的方法
1.本发明涉及一种用于寡核苷酸的纯化的新方法,该方法包括通过用酸进行柱上脱保护来去除寡核苷酸的5'-o-寡核苷酸末端处的酸不稳定的5'羟基保护基团。
2.通常通过固相合成制备的寡核苷酸在其从固体支持物上切割后仍含有大量杂质。对于长度为15到20-mer的标准单体,api纯度最好在70%到80%的范围内。对于经化学修饰的单体或更长的序列,api含量通常甚至更低。
3.已经开发了选择性分离方法来制备满足治疗应用规范的高纯度寡核苷酸。
4.在一种方法中,寡核苷酸在从固体支持物上切割后,在5'-o-寡核苷酸末端处留下酸不稳定的5'羟基保护基团。该基团的疏水性允许应用有效的色谱技术进行纯化。
5.粗制寡核苷酸通过以下步骤是常见的策略(例如krotz等人,organic process research&development 2003,7,47-52):
6.a)反相色谱
7.b)浓缩和脱盐
8.c)在溶液中去除酸不稳定的5'羟基保护基团,和
9.d)进一步浓缩和脱盐
10.已发现,由于单个操作步骤a)至d)的数量,该已知方法需要大量操作时间。
11.本发明的目的是减少纯化步骤的数量并由此减少操作时间,并且还试图达到更高的总产率。
12.据发现,本发明的目的可以通过如上概述的用于寡核苷酸的纯化的新方法来达到。
13.阐述以下定义以说明和定义用于描述本发明的各种术语的含义和范围。
14.术语酸不稳定的5'羟基保护基团被定义为在合适的酸的帮助下可切割并具有疏水特性的保护基团。
15.典型的酸不稳定的5'羟基保护基团选自4,4'-二甲氧基三苯甲基、4-甲氧基三苯甲基、三苯甲基、9-苯基-呫吨-9-、9-(对甲苯基)-呫吨-9-基或选自叔丁基二甲基甲硅烷基,优选地选自4,4'-二甲氧基三苯甲基、4-甲氧基三苯甲基或三苯甲基,或者甚至更优选地选自4,4'-二甲氧基三苯甲基。
16.如本文所用,术语“寡核苷酸”如本领域技术人员通常理解的那样被定义为包含两个或更多个共价连接的核苷酸的分子。为了用作具有治疗价值的寡核苷酸,通常合成含有长度为10个至40个核苷酸,优选地是10个至25个核苷酸的寡核苷酸。
17.寡核苷酸可由任选经修饰的dna、rna或lna核苷单体或其组合组成。
18.lna核苷单体是经修饰的核苷,其在核苷酸的核糖环的c2'与c4'之间包含连接基基团或桥。这些核苷在文献中也称为桥连核酸或双环核酸(bna)。
19.任选地,如本文所用的经修饰的是指与等同的dna、rna或lna核苷相比,通过引入糖部分或核碱基部分的一个或多个(一种或多种)修饰而被修饰的核苷。在一个优选的实施例中,经修饰的核苷包含经修饰的糖部分,并且可以例如包含一个或多个2’取代的核苷和/或一个或多个lna核苷。术语经修饰的核苷在本文中还可与术语“核苷类似物”或经修饰的“单元”或经修饰的“单体”互换地使用。
20.dna、rna或lna核苷通常通过磷酸二酯(p=o)和/或硫代磷酸酯(p=s)核苷间键连接,该键将两个核苷共价偶联在一起。
21.因此,在一些寡核苷酸中,所有核苷间键都可以由磷酸二酯(p=o)组成,在其他寡核苷酸中,所有核苷间键都可以由硫代磷酸酯(p=s)组成,或者在又其他寡核苷酸中,核苷间键的序列不同并且包含磷酸二酯(p=o)和硫代磷酸酯(p=s)核苷间键两者。
22.核碱基部分可以由每一个相应核碱基的字母代码来表示,例如a、t、g、c或u,其中每一个字母可以任选地包括具有同等功能的经修饰的核碱基。例如,在示例的寡核苷酸中,核碱基部分用大写字母a、t、g和
me
c(5-甲基胞嘧啶)描述dna核苷。经修饰的核碱基包括但不限于带有保护基团的核碱基,所述保护基团例如叔丁基苯氧基乙酰基、苯氧基乙酰基、苯甲酰基、乙酰基、异丁酰基或二甲基甲脒基(参见维基百科,phosphoramidit-synthese,https://de.wikipedia.org/wiki/phosphoramidit-synthese 2016年3月24日)。
23.寡核苷酸合成的原理是本领域所熟知的(参见例如寡核苷酸合成;维基百科,免费的百科全书;https://en.wikipedia.org/wiki/oligonucleotide composition,2016年3月15日)。
24.现在更大规模的寡核苷酸合成是使用计算机控制的合成仪自动进行的。
25.通常,寡核苷酸合成是一种固相合成,其中正在组装的寡核苷酸通过其3'-末端羟基共价结合到固体支持物材料上,并且在整个链组装的过程中保持与其附接。合适的支持物是市售的大孔聚苯乙烯支持物,如来自cytiva的primer支持物5g或来自kinovate的hl支持物。
26.原则上,寡核苷酸合成是将核苷酸残基逐步添加到生长链的5'-末端,直到组装出所需的序列。
27.通常,每次添加都称为合成循环,并且原则上由化学反应组成
28.a1)去封闭固体支持物上的5'保护羟基,
29.a2)将第一个核苷作为活化的亚磷酰胺与固体支持物上的游离5'羟基偶联,
30.a3)氧化或硫化相应的p-连接的核苷以形成相应的磷酸二酯(p=o)或相应的硫代磷酸酯(p=s);
31.a4)任选地,将固体支持物上的任何未反应的5'羟基封端,
32.a5)将附接在固体支持物上的第一个核苷的5'羟基去封闭;
33.a6)将第二个核苷作为活化的亚磷酰胺偶联以形成相应的p-o连接的二聚体;
34.a7)氧化或硫化相应的p-o连接的二核苷以形成相应的磷酸二酯(p=o)或相应的硫代磷酸酯(p=s);
35.a8)任选地,将任何未反应的5'羟基封端;
36.a9)重复前面的步骤a5到a8直到组装出所需的序列。
37.可以用浓氨水进行随后从固体支持物上的切割。磷酸酯上和核苷酸碱基上的保护基团也在此切割程序中被去除。
38.粗制寡核苷酸在切割后,在5'-o-寡核苷酸末端处留下酸不稳定的5'羟基保护基团。
39.该用于寡核苷酸的纯化的方法包括通过用酸进行柱上脱保护来去除寡核苷酸的
5'-o-寡核苷酸末端处的酸不稳定的5'羟基保护基团。
40.本发明上下文中的术语“柱上脱保护”是指5'-o-寡核苷酸末端处的酸不稳定的5'羟基保护基团的脱保护直接在色谱柱、优选地在离子交换色谱柱、更优选地阴离子交换色谱柱上发生。
41.阴离子交换色谱基于样品溶液的带电离子与所用缓冲介质的竞争性相互作用。它可以用常规的、可商购的阴离子交换树脂进行,优选地是具有三甲基铵官能化的那些。这些相材料可以从例如cytiva、tosoh bioscience、bio-rad或merck获得。典型的阴离子交换树脂是可得自tosoh bioscience的tskgel super q-5pw(qae)或来自cytiva的source 30q树脂。
42.如上所概述,酸不稳定的5'羟基保护基团通常选自4,4'-二甲氧基三苯甲基、4-甲氧基三苯甲基、三苯甲基、9-苯基-呫吨-9-、9-(对甲苯基)-呫吨-9-基或选自叔丁基二甲基甲硅烷基,但优选地为4,4'-二甲氧基三苯甲基。
43.柱上脱保护方法方便地包括以下步骤
44.a.用包含磷酸盐和有机溶剂的缓冲溶液对阴离子交换柱进行第一平衡;
45.b.将粗制寡核苷酸的稀释的氨水溶液装载到阴离子交换柱上
46.c.用包含磷酸盐和有机溶剂的缓冲溶液对阴离子交换柱进行第二平衡;
47.d.用包含磷酸盐、有机溶剂和碱(alkali,碱金属)卤化物的缓冲溶液洗涤该柱;
48.e.用包含磷酸盐和有机溶剂的缓冲溶液对阴离子交换柱进行第三平衡;
49.f.用酸进行柱上脱保护;
50.g.用包含磷酸盐和有机溶剂的缓冲溶液对阴离子交换柱进行第四平衡;
51.h.用包含磷酸盐、有机溶剂和碱卤化物的缓冲溶液对脱保护的寡核苷酸进行洗脱,并且随后用包含磷酸盐、有机溶剂和碱卤化物的缓冲溶液对阴离子交换柱进行等度洗涤。
52.缓冲溶液通常是磷酸盐缓冲溶液,其进一步包含有机溶剂,并且取决于方法步骤,包含碱卤化物。
53.缓冲溶液中的磷酸盐通常是碱磷酸盐,例如磷酸一钠或磷酸二钠或磷酸一钾或磷酸二钾或其混合物,但优选地是磷酸一钠或磷酸二钠或其混合物。
54.缓冲溶液中的磷酸盐的含量在10mm和40mm之间选择,优选地在20mm和30mm之间选择。
55.理想地,缓冲溶液的ph值范围调整在6.0到7.5之间。
56.缓冲溶液的温度通常保持在15℃至50℃之间,优选地为室温,即20℃至40℃之间。
57.为了制备稀释的加料溶液,从寡核苷酸合成直接获得的氨水溶液通常首先用1.5至2.5体积当量、优选地2.0体积当量的水进行稀释,以达到2.5至3.5,优选地3.0的稀释等级。
58.装载到阴离子交换柱上的稀释的氨水溶液的总寡核苷酸含量通常为每l柱体积8g至20g、优选地每l柱体积10g至15g。
59.缓冲溶液中的有机溶剂可以选自极性质子溶剂或极性非质子溶剂,优选地选自极性非质子溶剂,更优选地选自乙腈。
60.合适的极性质子溶剂是伯脂肪醇,例如甲醇、乙醇或异丙醇,优选地是乙醇。
61.合适的极性非质子溶剂是乙腈、二甲亚砜或n-甲基-2-吡咯烷酮,但优选地是乙腈。
62.在更优选的实施例中,使用乙腈。
63.通常,缓冲溶液含有按重量计5%至15%,甚至更优选地按重量计约10%的量的有机溶剂。
64.对于脱保护,使用酸,优选地使用质子酸。
65.术语质子酸应指无机酸或有机酸,优选含水形式的无机酸或有机酸并且选自盐酸、硫酸、磷酸、硝酸、甲酸或乙酸,更优选地选自乙酸。
66.在优选的实施例中,质子酸是乙酸水溶液,其中乙酸在水中的浓度为按重量计50%至95%、更优选地为按重量计70%至90%、甚至更优选为按重量计75%至85%。
67.在洗涤步骤和洗脱步骤中,缓冲溶液另外含有碱卤化物,例如氯化钠或氯化钾,优选地氯化钠。
68.在洗涤步骤d)中,缓冲溶液通常包含0.2m至1.0m、优选地0.4m至0.7m的碱卤化物。
69.在洗脱步骤h)和随后的等度洗涤步骤中,缓冲溶液通常包含1.5m至3.0m,优选地1.8m至2.5m的碱卤化物。
70.缓冲溶液或酸溶液的流速是用来调整缓冲液对固体支持物结合的寡核苷酸的暴露程度的重要参数。
71.通常,与其他步骤中缓冲液的流速相比,用于柱上脱保护的酸溶液的流速更低,以便允许调整酸溶液的更高粘度,以及酸对酸不稳定的5'羟基保护基团的相对更高的暴露程度。
72.通常,柱上脱保护步骤f)中酸溶液的流速为1.5l/min至2.5l/min,优选地在1.8l/min至2.2l/min之间。
73.对于其他步骤,缓冲液的流速选择在2.0l/min至3.0l/min之间,优选地在2.3l/min至2.7l/min之间的范围内。
74.柱上脱保护步骤f)和洗脱步骤h)通常需要相对大量的相应酸或缓冲溶液,通常是柱体积(cv)的10至30倍,优选地是柱体积(cv)的15至25倍。
75.通过uv检测合适地测量寡核苷酸洗脱,并且相应地将含有寡核苷酸的洗脱液分级。
76.在一个优选的实施例中,该方法进一步包括在纯化步骤a)至h)之后的以下步骤i)脱盐和浓缩步骤,其包括通过切向流过滤,用纯化水洗涤滤过物(filtrate,滤液);和
77.j)从脱盐和浓缩步骤获得的滤过物的冻干。
78.切向流过滤的特征在于,进料在相对于渗透侧的正压下(切向)通过过滤膜。一部分小于膜孔径的材料作为透过物或滤过物通过膜;其他所有物质都作为滞留物保留在膜的进料侧上。
79.合适的膜是可商购的,例如以商品名pellicon
tm
购自merck millipore或以商品名hydrosart
tm
购自sartorius。
80.冻干是本领域技术人员已知的技术,并且因此可以相应地应用。
81.通过说明本发明的方法,选择了以下序列的寡核苷酸:
82.5'-mecsmeuomecoaogs
t
sasasmecsas
tst
sgsasmecsaomecomecoasme
c-3'19na
83.其中“s”代表硫代磷酸酯桥,“o”代表磷酸酯桥;a、g、t、u是dna核苷单体,“me”代表甲基,并且加下划线的核苷是2'-moe核苷。
84.本文公开的化合物具有以下核碱基序列
85.seq id no.1:cucagtaacattgacaccac'
86.实例
87.缩写:
88.ac2o=乙酸酐
89.(d)a=(脱氧)腺苷
90.(d)c=(脱氧)胞苷
91.(d)g=(脱氧)鸟苷
92.dca=二氯乙酸
93.dci=4,5-二氰基咪唑
94.dmt=4,4'-二甲氧基三苯甲基
95.cv=柱体积
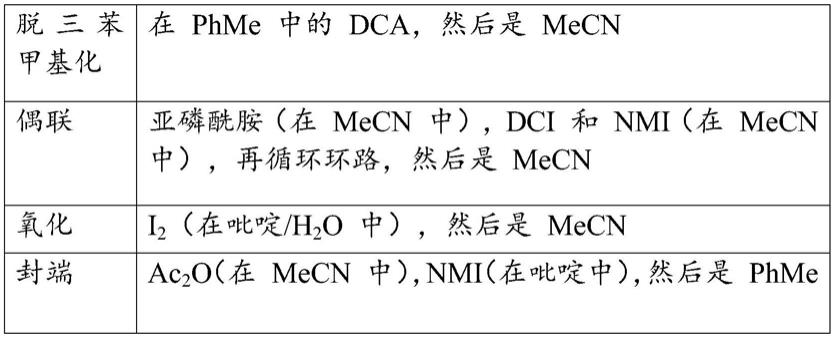
96.et3n=三乙胺
97.etoh=乙醇
98.mecn=乙腈
99.moe=2-甲氧基乙基
100.na=不适用
101.naoac=乙酸钠
102.nmi=n-甲基咪唑
103.pads=苯乙酰二硫醚
104.phme=甲苯
105.t=胸苷
106.u=尿苷
107.加下划线的核苷是2'-moe核苷
108.实例1
109.a)5'-dmt-mecsmeuomecoaogs
t
sasasmecsas
tst
sgsasmecsaomecomecoas me
c-3'19nh3的合成
110.标题化合物使用oligopilot-100以72mmol规模合成为“dmt-on”。
111.每个循环中都已使用了以下亚磷酰胺:
112.循环p-酰胺循环p-酰胺1moe
mec(bz)
11da
(bz)
2moea
(bz)
12
me
dc
(bz)
3moe
mec(bz)
13da
(bz)
4moe
mec(bz)
14da
(bz)
5moea
(bz)
15t6
me
dc
(bz)
16moe-g
(ibu)
7da
(bz)
17moea
(bz)
8dg
(tbu)
18moe
mec(bz)
9t19moe
me
u10t20moe
mec(bz)
113.合成参数循环3-5、17-19
[0114][0115]
合成参数循环1-2、6-16:
[0116][0117]
合成参数循环20:
[0118][0119][0120]
b)柱上脱三苯甲基化和以下的形成
[0121]
5'-mecsmeuomecoaogs
t
sasasmecsas
tst
sgsasmecsaomecomecoasme
c-3'19na
[0122]
从实例1a)获得的粗制材料(338.87g)的溶液经历纯化步骤,该纯化步骤由若干个平衡步骤、柱洗涤步骤、柱上脱三苯甲基化步骤和最终产物洗脱步骤组成。
[0123]
首先,将来自固相有机合成的粗制产物加载到预平衡的aex柱上,然后重新平衡。通过用含有低浓度的氯化钠的缓冲液洗涤柱,去除dmt-on短链体聚物(shortmer)、封端的失效序列和其他小分子。柱平衡后,结合的寡核苷酸的dmt基团通过乙酸水溶液去除(称为柱上脱三苯甲基化),然后进行另一柱平衡以去除残留的酸并且建立洗脱步骤的起始条件。在最后一个步骤中,应用高浓度氯化钠梯度洗脱产物。通过紫外(uv)吸收光谱监测洗脱曲线。全长dmt-off产物峰被收集在若干个级分中。测试级分的纯度、有机杂质,并且相应地进行合并。纯化参数概述于下表中:
[0124]
[0125][0126]1磷酸一钠和磷酸二钠的混合物)
[0127]2在上样粗制寡核苷酸溶液之前。
[0128]
c)切向流过滤/冻干
[0129]
合并两个纯化批次(实例1b)用于切向流过滤/冻干步骤。
[0130]
将合并的溶液(541.76g,纯度89.2%)浓缩,并且然后用纯化水通过切向流过滤进行脱盐。通过去除的透过物的电导率检测脱盐的结束。再次浓缩脱盐的溶液,并且通过添加纯化水将溶液中的寡核苷酸浓度调整至60-100mg/ml。使溶液通过0.2μm过滤器(sartopore-2,sartorius)进行过滤,并且然后进行冻干。所进行的冻干循环的条件如下表所示:
[0131][0132]
将冲洗后获得的溶液冻干从而获得508.26g标题产物(纯度90.9%)。
[0133]
实例2(对比实例)
[0134]
a)5'-dmt-mecsmeuomecoaogs
t
sasasmecsas
tst
sgsasmecsaomecome c
oasme
c-3'19nh3的合成
[0135]
已根据实例1a制备标题化合物。
[0136]
b)hplc
[0137]
根据下表中的参数,通过hplc(具有amberchrom xt20树脂的柱)纯化一部分粗制材料:
[0138][0139]
纯化的溶液显示出97.2%的纯度和90.8%的产率。
[0140]
c)溶液中的脱三苯甲基化
[0141]
使用冰乙酸作为脱三苯甲基化剂将来自实例2b的合并级分的ph调整至ph 3,然后用10m naoh将ph重新调整至5。通过向乙醇中加入调整过ph的溶液沉淀标题化合物。获得的产率为66.0%。
