1.本发明属于食品提取技术领域,具体涉及洋葱多糖的提取方法、洋葱多糖衍生物的制备方法及其应用。
背景技术:
2.洋葱是百合科葱属多年生草本植物鳞茎粗大,近球状;纸质至薄革质,内皮肥厚,肉质,叶片圆筒状,中空,中部以下最粗,向上渐狭,比花葶短,花葶粗壮,高可达1m,伞形花序球状,具多而密集的花;花粉白色;花被片具绿色中脉,矩圆状卵形,花丝等长,子房近球状,腹缝线基部具有帘的凹陷蜜穴;5-7月开花结果。 洋葱肉质柔嫩,汁多辣味淡,营养价值高。
3.洋葱营养成分丰富,富含钾、维生素c、叶酸、锌、硒、纤维质,还含有槲皮素、前列腺素a、尼克酸、多糖等成分。洋葱具有消炎抑菌、活血化瘀、防癌抗癌、利尿、降血糖、预防心血管疾病等功效。
4.多糖是洋葱中重要的活性成分,是由各种单糖组成的天然高分子化合物。多糖具有抗肿瘤、抗衰老、抗感染、降血糖血脂等活性。目前,人们已尝试多种提取洋葱多糖的方法,如有热水提取法、酸碱提取法、酶提取法等。
5.如公开号为cn108117606a的专利文献公开了一种提取洋葱多糖粗提物工艺,其步骤为:
①
将新鲜洋葱切片,在60-70℃条件下恒温鼓风干燥箱干燥后粉碎,过筛,制得洋葱干粉,低温密闭干燥保存,待用;
②
将洋葱干粉与无水乙醇按照1:8-12的重量之比混合均匀,在70-75℃水浴环境下回流脱脂1.5-2h,共脱脂两次,抽滤并收集滤渣;
③
将按照重量份之比为滤渣:水=1:30-60将滤渣和水混合均匀,置于70-85℃恒温水浴锅中加热回流提取3-6h后过滤,将滤渣反复提取3次,合并滤液后浓缩得到浓 缩液,浓缩液用体积分数为85-90%的乙醇醇析,在4-5℃环境中静置,然后离心,再将离心得到的沉淀物干燥至恒重。
6.然而,采用该方法提取洋葱多糖,洋葱多糖的纯度低。
技术实现要素:
7.有鉴于此,本发明的目的在于提供一种洋葱多糖衍生物的制备方法。
8.为实现上述目的,本发明的技术方案为:洋葱多糖衍生物的提取方法,包括以下步骤:将洋葱去皮后匀浆、加入水,油浴提取多糖;随后过滤,收集滤液,浓缩,浓缩液中加入无水乙醇醇沉,离心,将离心所得沉淀物溶于水中,然后加入氯仿和正丁醇处理;离心,将离心所得上清液进行透析处理,然后加入无水乙醇醇沉,离心,将离心所得沉淀物干燥。
9.进一步,去皮后洋葱与水的料液质量比为1:2-1:8。
10.进一步,所述提取的温度为60-100℃,提取的时间为2-8h。
11.进一步,过滤所得滤渣加入水,油浴提取;合并提取液,然后浓缩。
12.进一步,所述无水乙醇与浓缩液的体积比为1:1-10:1。
13.进一步,所述醇沉的时间为10-30h。
14.进一步,所述氯仿与正丁醇的体积比为1:1-5:1,氯仿和正丁醇处理的时间为10-60min。
15.进一步,所述透析处理截留分子量大于3500。
16.进一步,所述干燥的温度为30-100℃,干燥的时间为8-20h。
17.本发明的目的还在于保护如上所述提取方法提取得到的洋葱多糖。
18.本发明的目的还在于保护乙酰洋葱多糖的制备方法,包括以下步骤:向权利要求3所述洋葱多糖中加入水,搅拌,常压滴加乙酸酐,并时刻调节混合液的ph值为9-10,随后加入无水乙醇醇沉,离心,将离心所得沉淀物溶于水中,再进行透析处理,然后加入无水乙醇醇沉,离心,将离心所得沉淀物干燥,即得所述乙酰化洋葱多糖。
19.进一步,所述洋葱多糖与水的料液质量比为1:5-1:20。
20.进一步,所所述洋葱多糖与乙酸酐的料液比为1g:1.2ml-1g:2.4ml。
21.进一步,所述无水乙醇与反应液的体积比为1:1-10:1。
22.进一步,所述透析处理截留分子量大于3500。
23.进一步,所述醇沉的时间为10-30h。
24.进一步,所述干燥的温度为30-100℃,干燥的时间为8-20h。
25.本发明的目的还在于保护如上所述的制备方法得到的乙酰化洋葱多糖。
26.本发明的目的还在于保护所述洋葱多糖酰化衍生物在制备护肤品、功能性食品中的应用。
27.本发明的目的还在于保护磷酸化洋葱多糖的制备方法,包括以下步骤:将磷酸和正丁醇混合,随后加入权利要求3所述洋葱多糖,然后油浴反应;反应完成后,加入无水乙醇醇沉,离心,将离心所得沉淀物溶于水中,再进行透析处理,然加入无水乙醇醇沉,离心,将离心所得沉淀物干燥,即得磷酸化洋葱多糖。
28.进一步,所述磷酸与正丁醇的体积比为1:1-10:1。
29.进一步,所述洋葱多糖与磷酸的料液比为1g:3ml-1g:10ml。
30.进一步,所述反应的温度为30-80℃,反应的时间为2-6h。
31.进一步,所述透析处理截留分子量大于3500。
32.进一步,所述无水乙醇与反应液的体积比为1:1-10:1。
33.进一步,所述醇沉的时间为10-30h。
34.进一步,所述干燥的温度为30-100℃,干燥的时间为8-20h。
35.本发明的目的还在于保护如上所述的制备方法得到的磷酸化洋葱多糖。
36.本发明的目的还在于保护如上所述磷酸化洋葱多糖在制备护肤品、功能性食品中的应用。
37.本发明的有益效果在于:本发明的方法提高了洋葱多糖的纯度。
38.本发明的方法制得的乙酰化洋葱多糖及磷酸化洋葱多糖的抗氧化活性高,扩展其应用领域。
附图说明
39.图1为实施例1的洋葱多糖的核磁共振碳谱图;图2为实施例2的乙酰化洋葱多糖的核磁共振碳谱图;图3和图4为实施例3的磷酸化洋葱多糖的核磁共振碳谱图和核磁共振磷谱图;图5为羟基自由基(.oh)清除率的测定结果,其中,op为洋葱多糖,aop为乙酰化洋葱多糖,pop为磷酸化洋葱多糖,vc为维生素c,下同;图6为超氧阴离子(o
2-)清除率的测定结果;图7为抗脂质过氧化的测定结果;图8为还原能力的测定结果。
具体实施方式
40.所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
41.实施例1洋葱多糖的提取方法,具体步骤如下:去掉新鲜洋葱的表皮,然后准确称取去皮后洋葱100g,置于破壁机中匀浆5分钟;将匀浆后的洋葱料液全部转移至1000ml三口瓶中,并加入400ml去离子水,然后将三口瓶置在90℃恒温油浴锅中,搅拌,提取多糖4h;多糖提取完成后,过滤,收集滤液,将滤渣继续加入400ml去离子水,置于三口瓶中于90℃恒温油浴锅中提取4h,收集滤液;再次将滤渣继续加入400ml去离子水,置于三口瓶中于90℃恒温油浴锅中提取4h,合并三次所得提取液,浓缩至50ml;向浓缩液中加入200 ml无水乙醇醇沉24h;随后于4000r/min离心5min,将离心所得沉淀物溶于50 ml去离子水中,然后加入30 ml氯仿和10ml正丁醇处理30min,随后于4000r/min离心5min,将离心所得上清液置于透析袋中(截留分子量大于3500)透析处理24h,得到精制的洋葱多糖溶液;向精制的洋葱多糖溶液中加入200ml无水乙醇醇沉24h,于4000r/min离心5min,将离心所得沉淀物置于50℃恒温干燥箱中干燥12h,即得所述洋葱多糖。
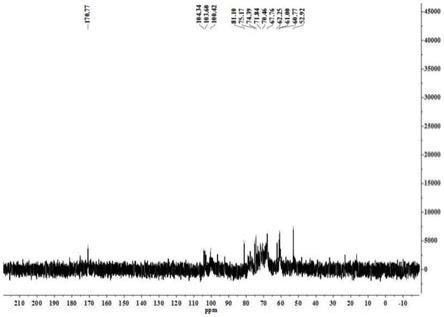
42.对本实施例提取得到的洋葱多糖进行核磁碳谱检测,以化学位移ppm为横坐标;结果如图1所示。
43.由图1可知,化学位移为100.42-104.34ppm为c1得到特征峰。 60.77-81.10ppm是c2-c6的化学位移。 从洋葱多糖的
13
c nmr中可以发现在170.77ppm和52.92ppm处有吸收峰,这个特征峰是乙酰基(ch3co-)中的羰基碳(c=o)和甲基碳(ch
3-)的化学位移, 这说明洋葱多糖的糖链或糖环上存在一个乙酰基。检测本实施例制得的洋葱多糖的纯度,纯度检测方法为苯酚-硫酸法测定;洋葱多糖在浓硫酸条件下先水解成单糖并脱水,然后再加入苯酚,苯酚与脱水后的单糖缩合形成有色化合物,在490nm处有最大吸收,在一定范围内其吸光度值和糖的浓度成正比,即可用吸光光度法分析出处理后的溶液中单糖的含量。
①
制作标准曲线:准确称取105℃烘干至恒重的葡萄糖50mg于500ml容量瓶中配成0.1mg/ml的标准溶液,用蒸馏水分别配成0、0.02、
0.04、0.06、0.08、0.1mg/ml和1ml的标准液,分别加入5wt%苯酚溶液1ml,并迅速加入浓硫酸5ml,静置10min。摇匀,30℃放置30min后于490nm测定od值,以葡萄糖含量为横坐标,od值为纵坐标,制作得到标准曲线。
②
样品含量测定:吸取1.0ml芦荟多糖样品液,按照上述步骤操作测定od值,并代入标准曲线计算样品的总糖含量;经检测,本实施例制得的洋葱多糖的纯度为96.23%。
44.实施例2乙酰化洋葱多糖的制备方法,具体步骤如下:取实施例1制得的洋葱多糖1g,置于100ml圆底烧瓶中,并加10ml去离子水;磁力搅拌,再安装好恒压滴液漏斗;滴加1.2ml乙酸酐,控制滴加速度,并用10%的氢氧化钠溶液(质量分数)调节混合液的ph值至9-10;乙酸酐滴加完毕后,常温磁力搅拌反应1h;搅拌反应完成后,向体系中加入40 ml无水乙醇醇沉24h,然后于4000r/min离心5min,将离心所得沉淀物溶于10 ml去离子水中,再置于透析袋中(截留分子量大于3500)透析处理24h,即得乙酰化洋葱多糖溶液;将40 ml无水乙醇加入到乙酰化洋葱多糖溶液中,醇沉24h,然后于4000r/min离心10min,将离心所得沉淀物置于50℃恒温干燥箱中干燥12h,即得乙酰化洋葱多糖。
45.对本实施例提取得到的乙酰化洋葱多糖进行核磁碳谱检测,以化学位移ppm为横坐标;结果如图2所示。
46.由图2可知,在160.69ppm和181.52ppm处有明显的化学位移信号,该处为羰基特征信号峰。由于糖环上被乙酰化化,导致原来洋葱多糖中c6处的羰基化学位移有所减小。而在60.77-75.34ppm为c2-c6的化学位移,与洋葱多糖相比起变化不大。98.92-104.34ppm处为c1的化学位移,45.31ppm和48.90ppm为两个乙酰基中甲甲基的化学位移信号。
47.实施例3磷酸化洋葱多糖的制备方法,具体步骤如下:取磷酸5ml和正丁醇1ml置于100ml圆底烧瓶中,磁力搅拌均匀;再继续磁力搅拌,加入1g实施例1制得的洋葱多糖;然后将烧瓶置于50℃油浴锅中,磁力搅拌反应3h;待反应完成后,加40ml无水乙醇醇沉24h,然后于4000r/min离心5min,将离心所得沉淀物溶于10ml去离子水中,再置于透析袋中(截留分子量大于3500)透析处理24h,即得磷酸化洋葱多糖溶液;将40 ml无水乙醇加入到磷酸化的洋葱多糖溶液中,醇沉24h,然后于4000r/min离心10min,将离心所得沉淀物置于50℃恒温干燥箱中干燥12h,即得到磷酸化洋葱多糖。
48.对本实施例提取得到的磷酸化洋葱多糖进行核磁碳谱和核磁共振磷谱检测,以化学位移ppm为横坐标;结果如图3和图4所示。
49.由图3可知,与洋葱多糖相比,磷酸化后的
13
c nmr基本上没有多大的变化。其中,60.46-81.02ppm为c2-c6的化学位移,104.38ppm为c1的化学位移,51.27-52.91ppm为乙酰基中甲基的化学位移,170.76ppm为乙酰基中羰基的化学位移。为了更进一步确证磷酸根的存在,我们测了磷酸化多糖的
31
p nmr。从图4可以看出,在0.03 ppm和-43.55ppm处有化学位移,并且在0.03ppm处有明显吸收峰,可以说明在此处比较容易磷酸化,而在-34.55ppm处比较难磷酸化,但可以说明洋葱多糖已经被磷酸化了。
50.抗氧化活性测试羟基自由基(.oh)清除率的测定用蒸馏水将实施例1制得的洋葱多糖、实施例2制得的乙酰化洋葱多糖和实施例3制得的磷酸化洋葱多糖分别配制成浓度为0.1mg/l、0.2mg/l、0.4mg/l、0.8mg/l、1.6mg/l和3.2 mg/l的多糖溶液;在各比色管中分别加入不同浓度的样品溶液1ml,再加入1ml浓度为1mmol/l的硫酸亚铁溶液、1ml浓度为9mmol/l的双氧水溶液和1ml浓度为3mmol/l的水杨酸-乙醇溶液(水杨酸-乙醇体积比为1:3);空白管中加入1ml蒸馏水,混合均匀后在37℃恒温水浴中反应30min;冷却至室温,用紫外分光光度计在510nm的波长下测定各管的吸光度;以3mmol/l水杨酸-乙醇溶液(水杨酸-乙醇体积比为1:3)调零,以等浓度的维生素c(简称vc)作为阳性对照品,每组重复测试3次,计算其平均值,结果如图5所示。
51.由图5可知,洋葱多糖及衍生物对超氧阴离子清除测定中,在低浓度时表现出优于对照品维生素c,而在高浓度时略低于维生素c的活性。
52.超氧阴离子(o
2-)清除率的测定用蒸馏水将实施例1制得的洋葱多糖、实施例2制得的乙酰化洋葱多糖和实施例3制得的磷酸化洋葱多糖分别配制成浓度为0.1mg/l、0.2mg/l、0.4mg/l、0.8mg/l、1.6mg/l和3.2 mg/l的多糖溶液;在各比色管中分别加入不同浓度的样品溶液0.2ml,再加入3ml的tris-hcl缓冲溶液(ph=8.2,浓度为0.05mol/l);空白管中加入1ml蒸馏水,混合均匀后室温反应10min;再加入15μl浓度为30mmol/l的新制邻苯三酚溶液,混合均匀后反应4min,迅速加入0.5ml浓hcl终止反应;用紫外分光光度计测定体系在325nm的波长下测定各管的吸光度;以等浓度的vc作为阳性对照品,每组重复测试3次,计算其平均值,结果如图6所示。
53.由图6可知,对应羟基自由的清除能力,在同等浓度条件下洋葱多糖及其衍生物均能表现出与维生素c相类似的活性。
54.抗脂质过氧化能力的测定用蒸馏水将实施例1制得的洋葱多糖、实施例2制得的乙酰化洋葱多糖和实施例3制得的磷酸化洋葱多糖分别配制成浓度为0.1mg/l、0.2mg/l、0.4mg/l、0.8mg/l、1.6mg/l和3.2 mg/l的多糖溶液;各比色管中分别加入不同浓度的样品溶液4ml,再加入3.6 ml 1 mg/ml的大豆卵磷脂溶液和0.4ml 10mmol/l的新制硫酸亚铁溶液。空白管中加入4ml蒸馏水,混合均匀后在37℃的恒温水浴中反应20min;待反应完成后冷却至室温,再加入1 ml20%的三氯乙酸溶液(质量分数)和1 ml0.8%硫代巴比妥酸溶液(质量分数),沸水浴中反应15min;然后在3500r/min离心5分钟,取上层清液,用紫外分光光度计在535nm的波长下测定各管的吸光度。以等浓度的维生素c作为阳性对照品,每组重复测试3次,计算其平均值,结果如图7所示。
55.由图7可知,洋葱多糖及其衍生物在抗脂质过氧化能力方面也能表现出良好的活
性,在同等浓度下也能表现出与维生素c等同的活性。
56.还原能力的测定用蒸馏水将实施例1制得的洋葱多糖、实施例2制得的乙酰化洋葱多糖和实施例3制得的磷酸化洋葱多糖分别配制成浓度为0.1mg/l、0.2mg/l、0.4mg/l、0.8mg/l、1.6mg/l和3.2 mg/l的水溶液;各比色管中分别加入不同浓度的样品溶液1 ml,再加入2.5ml浓度为0.2mol/l的磷酸盐缓冲溶液(ph=6.6)和2.5ml浓度为1%铁氰化钾溶液(质量分数);震动均匀后,在50℃恒温水浴中反应20min;待反应完成后冷却至室温,再加入2.5ml浓度为10wt%的三氯乙酸溶液、0.4ml浓度为1wt%三氯化铁溶液和4ml蒸馏水,静置反应10min;然后于3500r/min离心率下离心5min,取上清液,用紫外分光光度计测定在700nm的波长下测定各管的吸光度;以等浓度的维生素c作为阳性对照品,每组重复测试3次,计算其平均值,结果如图8所示。
57.由图8可知,在还原能力方面,洋葱多糖及其衍生物能够表现出优异的活性。在同等浓度条件下,洋葱多糖及其衍生物的还原能力跟维生素c相当,其中磷酸化的洋葱多糖优于维生素c的活性。
58.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
