一种“y型”多功能dna纳米组装体、制备方法及其应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种细胞膜锚定的“y型”多功能dna纳米组装体、制备方法及其应用。
背景技术:
2.细胞的多种蛋白共同构筑成复杂的信号网络参与各种细胞活动,在维持细胞正常生理活动以及疾病的发生发展过程中都起到重要的作用。这个信号网络中的蛋白都不是孤立地存在,它们的功能与表达水平受到精确的调控,其中某种蛋白功能变化所引发的信号级联反应影响着其他蛋白的功能和表达,实现对细胞行为的精准调控。在细胞间质上皮转化因子(c-met)介导的细胞信号转导过程中,c-met受体能够感知并整合外界环境的刺激信号,其配体肝细胞生长因子(hgf)与c-met受体结合诱导受体二聚通常被认为是c-met信号转导过程的第一步。激活的c-met受体将信号传递到细胞内,通过选择性地激活或抑制特定信号分子,从而促进细胞的增殖、迁移、侵袭和血管新生等多种细胞行为。例如,c-met信号通路激活后能够提高血管内皮生长因子(vegf)的分泌水平,从而促进血管新生过程。由于c-met信号通路在生理功能和疾病进展中的重要作用,通过按需调节c-met受体功能实现细胞功能调控已经引起了广泛的关注。考虑到相关信号分子之间的密切联系,特定信号分子的变化可以作为评价上游调控效果的反馈。因此,在保持蛋白的结构和状态不受影响前提下,对信号网络中的蛋白进行精准按需调控和实时监测有助于系统地阐明蛋白的生物功能和作用机制,并促进智能治疗药物的开发,对精准医疗的发展具有重要意义。
3.目前,免疫印迹和酶联免疫吸附测定等传统策略是广泛应用于验证信号分子变化(表达水平或翻译后修饰等)的检测手段。然而,这些方法在分析之前需要繁琐的实验操作,且无法对活细胞进行实时监测。尽管基于基因编辑策略的荧光生物传感器能够用于细胞信号分子的监测,但向细胞导入新的基因需要复杂耗时的步骤,且仍面临因过表达重组成分而干扰细胞内源信号通路的风险,不利于实际应用。此外,由于缺乏能够实现多任务处理的策略,现有的研究方法无法同时实现蛋白功能调控和实时监控调控结果。
4.功能核酸具有突出的可编程性和多样性,在构建多功能纳米组装体方面有突出潜力。其中,核酸适配体作为一种能够结合特定目标分子的功能核酸,已经被设计用于精准探测活细胞中的信号分子。一些核酸适配体被报道可通过阻碍蛋白-蛋白相互作用来干扰细胞信号通路的激活过程。然而,迄今为止,基于功能核酸的纳米组装体在活细胞蛋白功能调控与监测的多功能应用仍然存在挑战。第一方面,由于核酸适配体本身的尺寸较小,与靶标蛋白结合后容易发生解离,受环境影响较大。第二方面,活细胞的细胞内吞作用也使得单个游离核酸适配体的调控和检测效率仍然不理想,尤其是针对细胞表面的受体和分泌信号蛋白。第三方面,目前所构建的探针通常只包含单一的功能模块,只能执行调控或监测的单一操作,无法满足对细胞信号网络中的多个蛋白实现多功能响应的需求,无法对调控结果进行实时监测。实现为了解决上述技术问题,现在亟需研发出一种稳定、高效的多功能dna纳米组装体来实现蛋白功能的精准调控及信号转导关键分子的实时监测。
技术实现要素:
5.本发明目的是提供了一种“y型”多功能dna纳米组装体、制备方法及其应用,要解决的技术问题包括但不限于以下任一技术问题:第一方面,如何构建具备多任务处理能力的dna纳米组装体,第二方面,如何实现可控、高效调控c-met受体蛋白功能以及信号转导过程;第三方面,如何实现实时监测对c-met受体蛋白功能的调控效果。为实现以上目的,本发明采用如下技术方案:
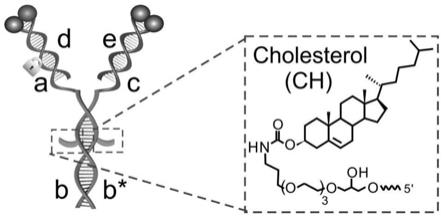
6.一种细胞膜锚定的“y型”多功能dna纳米组装体,由四条dna杂交形成“y型”结构,具体包括序列如seq id no.1所示的链ab,序列如seq id no.2所示的链cb*,序列如seq id no.3所示的链d,以及序列如seq id no.4所示的链e;且所述链d与所述链ab的部分序列互补,所述链e与所述链cb*的部分序列互补,所述链ab和所述链cb*上均修饰有所述细胞膜锚定基团,所述链cb*上带有cy3荧光基团,所述链d上带有邻硝基苄基光切割基团(photocleavable linker,pc-linker),所述链e上带有bhq-2荧光猝灭基团。本方案中,所述杂交形成“y型”结构的四条dna组成锚定模块、调控模块和监测模块三个功能模块,所述锚定模块为包含有细胞膜锚定基团修饰的双链dna,所述调控模块包含有识别c-met受体蛋白的核酸适配体和光切割基团修饰的阻挡探针,所述监测模块包括一个识别vegf蛋白的核酸适配体和阻挡探针。
7.在上述方案的基础上,在另一改进的方案中,所述链ab包含有靶向识别c-met受体蛋白的核酸适配体序列,所述链cb*包含有靶向识别vegf蛋白的核酸适配体序列。
8.在上述方案的基础上,在另一改进的方案中,所述链ab上带有cy5荧光基团,所述链d上带有bhq-2荧光猝灭基团
9.在上述方案的基础上,在另一改进的方案中,所述细胞膜锚定基团为疏水性分子中的一种,所述疏水性分子包括胆固醇分子、生育酚分子和二酰基脂质体。
10.在上述方案的基础上,在另一改进的方案中,所述四条dna为人工合成,或任何其他来源的如seq id no.1、seq id no.2、seq id no.3和seq id no.4所示序列的核酸序列。
11.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体的制备方法,包括以下步骤:
12.s1.合成序列如seq id no.1所示的所述ab序列;
13.s2.合成序列如seq id no.2所示的所述cb*序列;
14.s3.合成序列如seq id no.3所示的所述d序列;
15.s4.合成序列如seq id no.4所示的所述e序列;
16.s5.将步骤s1至s4中的四条dna序列按照摩尔浓度1:1:1:1进行混合,混合后于95℃加热5分钟进行退火相互杂交,缓慢冷却至室温。
17.在上述方案的基础上,在另一改进的方案中,分别将步骤s1至s4中的四条dna序列配备成浓度为10μm的溶液后再按照比例混合。
18.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在核酸适配体抑制剂药物中的应用。
19.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在实时监测细胞膜表面受体功能调控效果相关研究中的应用。
20.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在蛋白功能
调控和细胞信号传导相关研究中的应用。
21.本发明的技术方案至少具有以下的有益效果:本发明提出一个“y型”多功能dna纳米组装体来调控和实时监测活细胞的信号转导过程。本发明以间充质上皮转化(c-met)信号通路作为模型进行说明。第一方面,多功能dna纳米组装体能够快速地锚定在细胞膜表面,利用锚定功能提高了核酸适配体与c-met受体的结合稳定性,进而提高了核酸适配体对c-met受体的调控效果。进一步的,利用光控可远程操纵和无损快速的调控优势,多功能dna纳米组装体能够实现时空分辨的c-met受体蛋白功能调控。进一步的,多功能dna纳米组装体能够实时监测由c-met受体蛋白功能改变引发的关键信号分子vegf的分泌变化,实现对c-met受体调控效果的实时监测。因此,这种模块化设计的多功能dna纳米组装体能同时实现高效、可控的蛋白功能调节和信号转导过程中关键分子的实时监测,从单个信号分子的独立研究转为信号转导中多个信号分子的关联研究,有助于深入研究活细胞蛋白在复杂信号网络中的生理功能和作用机制,可在肿瘤的早期诊断、治疗以及疗效评价等研究中发挥重要作用。
附图说明
22.图1为本发明实施例中的“y型”多功能dna纳米组装体的结构示意图;
23.图2为本发明实施例中的“y型”多功能dna纳米组装体用于蛋白功能调控及信号转导关键分子监测的原理示意图;
24.图3为本发明实验例1中(a)12%非变性聚丙烯酰胺凝胶电泳和(b)共聚焦成像分析dna纳米组装体2ch-ab:b*:d的光响应性能,标尺:20μm;
25.图4为本发明实验例2中免疫印迹分析2ch-b:b*对c-met受体功能的影响。
26.图5为本发明实验例3中(a)免疫印迹分析dna纳米组装体2ch-ab:b*:d光控调控c-met受体功能的效果,(b)免疫印迹分析dna纳米组装体2ch-ab:b*:d或ab:b*:d与du145细胞孵育24小时后光控调控c-met受体功能的效果;
27.图6为本发明实验例3中(a)不同浓度的vegf与200nm 2ch-cb*:b:e探针反应30分钟的荧光光谱图,(b)5μg/ml的不同蛋白200nm与2ch-cb*:b:e探针反应30分钟的荧光光谱图;
28.图7为本发明实验例4中(a)酶联免疫吸附剂测定du145细胞由c-met受体激活介导的促进vegf分泌情况,(b)酶联免疫吸附剂测定和(c)共聚焦成像分析2ch-ab:b*对du145细胞由c-met受体激活介导的vegf分泌影响,标尺:20μm;
29.图8本发明实验例5中“y型”多功能dna纳米组装体2ch-ab:b*:d:e的凝胶电泳图。
30.图9为本发明实验例6中“y型”多功能dna纳米组装体2ch-ab:b*:d:e实现du145细胞上光控c-met受体功能并实时监测vegf分泌的共聚焦图像,标尺:20μm。
具体实施方式
31.以下提供本发明的优选实施例,以助于进一步理解本发明。本领域技术人员应了解到,本发明实施例的说明仅是示例性的,并不是为了限制本发明的方案。
32.参见附图1的示意,在本实施例中,我们利用功能核酸独特的分子识别机制和核酸结构精确的自组装特性来构建多功能模块的“y型”dna纳米组装体。本发明实施例中的“y
型”多功能dna纳米组装体,由四条dna杂交形成“y型”结构,具体包括序列如seq id no.1所示的链ab,序列如seq id no.2所示的链cb*,序列如seq id no.3所示的链d,以及序列如seq id no.4所示的链e;且链d与链ab的部分序列互补,链e与链cb*的部分序列互补,链ab和链cb*上均修饰有细胞膜锚定基团,链cb*上带有cy3荧光基团,链d上带有邻硝基苄基光切割基团(photocleavable linker,pc-linker),链e上带有bhq-2荧光猝灭基团。其中链ab包含有靶向识别c-met受体蛋白的核酸适配体序列,链cb*包含有靶向识别vegf蛋白的核酸适配体序列;链ab上带有cy5荧光基团,链d上带有bhq-2荧光猝灭基团。四条dna链上如何修饰上述各基团的技术,在本领域属于常规操作,不属于本技术的改进点,在说明书中不进行赘述。
33.在本实施例中细胞膜锚定基团为胆固醇分子;在另一改进的实施例中,细胞膜锚定基团为其它疏水性分子中的一种,比如生育酚分子或二酰基脂质体。
34.本实施例中的“y型”多功能dna纳米组装体实现蛋白功能调控及信号转导关键分子监测的原理可参见附图2的示意。以hgf/c-met信号转导相关的c-met和vegf作为实验对象来验证策略的可行性。当c-met被hgf激活后引发的信号级联反应表现出促进vegf分泌的作用,进而在血管新生过程中发挥重要作用。本实施例中的“y型”多功能dna纳米组装体2ch-ab:cb*:d:e共分为3个功能模块,由不同功能的dna序列组装构成(参见附图1)。其中区域2ch-b:b*发挥锚定功能,将该多功能dna纳米组装体锚定在细胞膜表面。区域a和d组成发挥光响应的调控受体蛋白活性功能。区域a为识别c-met受体的核酸适配体,能够特异性结合并抑制c-met受体的功能活性。探针d被设计为含有一个邻硝基苄基光切割基团(pc-linker)和一个bhq-2猝灭基团的序列,它能与区域a的部分序列完全杂交,使区域a末端修饰的cy5荧光被猝灭,在没有光照驱动时阻止区域a发挥调控功能。当多功能dna纳米组装体被光照触发,探针d的断裂使区域a恢复为可结合c-met受体的三维空间构型,进而抑制蛋白功能,cy5荧光恢复。区域c和e用于实现实时监测功能。区域c为vegf的核酸适配体序列,修饰bhq-2猝灭基团的探针e与区域c的部分序列完全互补,猝灭区域c修饰的cy3荧光。当有vegf存在时,由于vegf与核酸适配体的结合使区域c的构型发生改变,从而与探针e解离,恢复区域c末端的cy3荧光信号。因此,多功能dna纳米组装体能实现复杂功能操作,实现高效、可控的活细胞c-met受体功能调控,并能同时监测由c-met受体功能变化引起的关键信号分子vegf分泌的变化。
35.在本实施例中,链ab包含有识别c-met受体蛋白的核酸序列(属于调控模块的一部分)和带有细胞膜锚定基团修饰的锚定序列(属于锚定模块的一部分),链cb*包含有识别vegf蛋白的核酸序列(属于监测模块的一部分)和带有细胞膜锚定基团修饰的锚定序列(属于锚定模块的一部分),所述链d为修饰有邻硝基苄基光切割基团的光控序列(属于调控模块的一部分),所述链e为阻挡探针序列(属于监测模块的一部分)。
36.本实施例中的四条dna为人工合成,在其它实施例中也可以是任何其他来源的如seq id no.1、seq id no.2、seq id no.3和seq id no.4所示序列的核酸序列。
37.本实施例中的细胞膜锚定的“y型”多功能dna纳米组装体的制备方法,包括以下步骤:
38.s1.合成序列如seq id no.1所示的所述ab序列;
39.s2.合成序列如seq id no.2所示的所述cb*序列;
40.s3.合成序列如seq id no.3所示的所述d序列;
41.s4.合成序列如seq id no.4所示的所述e序列;
42.s5.将步骤s1至s4中的四条dna序列按照摩尔浓度1:1:1:1进行混合,混合后于95℃加热5分钟进行退火相互杂交,缓慢冷却至室温。
43.在上述实施例的基础上,在另一改进的实施例中,分别将步骤s1至s4中的四条dna序列配备成浓度为10μm的溶液后再按照比例混合。
44.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在核酸适配体抑制剂药物中的应用。
45.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在实时监测细胞膜表面受体功能调控效果相关研究中的应用。
46.本发明还提供一种上述的细胞膜锚定的“y型”多功能dna纳米组装体在蛋白功能调控和细胞信号传导相关研究中的应用。
47.实验例1至实验例6所用到的主要仪器为:
48.sh-1000uv-vis分光光度计(corona electric公司,日本);a1共聚焦激光扫描显微镜(尼康公司,日本);chb 202恒温金属浴(杭州博日科技公司,中国);cary eclipse荧光光谱仪(agilent technologies公司,美国);milli-q integarl纯水/超纯水一体化系统(millipore公司,美国);小垂直电泳槽(bio-rad公司,美国);chemidoctm touch凝胶成像系统(bio-rad公司,美国);层析实验冷柜(北京德天佑科技公司,中国)。
49.实验例1至实验例6所用到的主要试剂为:
50.实验例1至实验例6中所用的dna序列(表1)均由中国上海生工生物工程技术有限公司合成并进行hplc纯化。vegf的elisa检测试剂盒购于美国abcam公司。重组人hgf购自美国peprotech公司。重组人vegf和重组人pdgf-bb购自中国近岸蛋白质科技有限公司。本实验所使用的抗体购自美国cell signaling technology公司。mem培养基、rpmi1640培养基、bsa、pbs和fbs等购自美国gibco公司。
51.表1本发明中所用到的寡核苷酸序列
[0052][0053]
上表1中,链ch-ab包含有c-met的核酸适配体序列;链ch-cb*包含有vegf的核酸适配体序列;
“‑
ch
‑”
代表胆固醇分子以及“//”代表光切割基团pc-linker。
[0054]
实验例1
[0055]
本实验例1验证了由“锚定模块”和“调控模块”构成的dna纳米组装体2ch-ab:b*:d
在溶液中以及活细胞表面的光控响应性能。从附图3a的非变性聚丙烯酰胺凝胶电泳分析可以看到,当d与2ch-ab:b*组装成功后,出现了一条分子量更高的条带2ch-ab:b*:d(泳道2)。当用紫外手电筒光照5分钟后,由于pc-linker的断裂使区域a恢复本身的核酸适配体构型,同时出现断裂的d条带(泳道3)。我们在hela细胞表面考察了这一光响应过程,将cy3荧光基团修饰的2ch-ab:b*与bhq-2猝灭基团修饰的d组装形成2ch-ab:b*:d,将2ch-ab:b*:d与hela细胞进行孵育。如附图3b的共聚焦图像所示,只有在光照触发的条件下,hela细胞膜上出现一圈明显的cy3荧光,而未光照组无明显荧光信号,指示了2ch-ab:b*:d的光响应性能。
[0056]
具体操作过程如下:(a)将200nm cy3-ch-ab、bhq-2-d、ch-b*按照摩尔浓度比1:1:1进行自组装,构筑2ch-ab:b*:d用于凝胶电泳实验。实验分为光照组和未光照组,其中光照组的溶液在365nm的紫外灯(5mw/cm2)照射5分钟后,反应10分钟。将2ch-ab:b*作为阳性对照组。(b)将组装好的200nm2ch-ab:b*:d与hela细胞孵育15分钟,用pbs洗去未锚定的探针。实验分为光控组和未光控组,其中光控组的条件是光照细胞5分钟后,再孵育10分钟后进行共聚焦成像。
[0057]
实验例2
[0058]
为了进一步考察dna纳米组装体2ch-ab:b*:d的光响应调控c-met蛋白功能的能力,本实验例2中利用经典的免疫印迹实验对不同实验条件下细胞p-met蛋白的表达水平进行考察,p-met的表达水平是验证c-met是否被激活的最直接手段。如附图4所示,将单独的“锚定模块”2ch-b:b*与du145细胞进行孵育,并不会影响由20ng/ml hgf与c-met受体结合引起的蛋白磷酸化过程。如附图5a所示,将2ch-ab:b*:d与du145细胞孵育后,在未光照时表现出与仅加入hgf的阳性对照组中类似的p-met表达水平。同时,仅对细胞进行光照处理也不会影响hgf与c-met蛋白的结合。当光照触发“调控模块”的调控性能后,几乎没有检测到p-met的蛋白条带,说明该dna纳米组装体能够高效地实现光控调节c-met受体功能。如附图5b所示,本实验例2还验证了2ch-ab:b*:d在长时间孵育后的光响应调控性能。将2ch-ab:b*:d先与du145细胞孵育24小时后,再进行光照调控。光照触发2ch-ab:b*:d时依然能表现出明显的抑制p-met蛋白表达的效果,而没有光照时对由hgf刺激诱导的p-met蛋白表达没有明显影响。但是,没有锚定功能的ab:b*:d在与细胞孵育24小时之后,无论是否光照都无法抑制由hgf介导的c-met受体磷酸化。实验结果表明,2ch-ab:b*:d能够在长时间孵育后依然能响应光照而触发调控功能,实现对c-met受体的光响应功能调控。
[0059]
具体操作过程如下:将du145细胞(每孔3
×
105)接种于6孔板中培养24小时后,将培养液更换为含有0.5%bsa的mem培养基饥饿24小时,进行实验。
[0060]
(1)将不同浓度的2ch-b:b*与du145细胞孵育15分钟,然后加入20ng/ml hgf与细胞孵育30分钟。用pbs洗涤细胞3次后,裂解细胞提取蛋白进行免疫印迹实验。
[0061]
(2)光控调控c-met蛋白活性实验分为光照组和未光照组进行实验。将du145细胞与30nm 2ch-ab:b*:d孵育15分钟,其中光照组的实验条件为光照细胞5分钟后再孵育10分钟。然后加入20ng/ml hgf与细胞孵育30分钟。用pbs洗涤细胞3次后,裂解细胞提取蛋白进行免疫印迹实验。
[0062]
(3)为了考察该组装体的锚定作用使“调控模块”能够在长时间孵育后仍响应光控调控c-met蛋白活性的性能,将250nm 2ch-ab:b*:d或ab:b*:d加入du145细胞后,将孔板置于在细胞培养箱内孵育24小时后再进行光照处理。然后加入20ng/ml hgf与细胞孵育30分
钟后提取蛋白。
[0063]
实验例3
[0064]
本实验例3考察了由“锚定模块”和“监测模块”构成的dna纳米组装体2ch-cb*:b:e在溶液中检测vegf的性能。如附图6a所示,2ch-cb*:b:e的荧光信号随着vegf浓度的增强而增强,指示该dna纳米组装体检测vegf的可行性。此外,当存在其他蛋白,包括bsa,hgf和pdgf-bb,不能观察到明显的荧光信号响应,证明了2ch-cb*:b:e的选择性(附图6b)。
[0065]
具体操作过程如下:将200nm cy3-ch-cb*、bhq2-e、ch-b按照摩尔浓度比1:1:1进行自组装,构筑2ch-cb*:b:e用于荧光检测实验。加入不同浓度的重组人vegf(0-6000ng/ml)反应30分钟。用荧光光谱仪记录各组的光谱数据。为了验证2ch-cb*:b:e的选择性,将5000ng/ml vegf,bsa,hgf和pdgf-bb分别与200nm 2ch-cb*:b:e反应30分钟。用荧光光谱仪记录各组的光谱数据。
[0066]
实验例4
[0067]
本实验例4考察了在活细胞上考察细胞膜锚定的“监测模块”2ch-cb*:b:e的vegf响应性能。通过酶联免疫吸附测定考察了du145细胞由c-met受体蛋白激活介导的促进vegf分泌情况。如附图7a所示,与空白对照组相比,hgf的刺激促进du145细胞分泌vegf。如附图7b所示,当用2ch-ab:b*抑制c-met受体活性后再加入hgf刺激则表现出vegf分泌减少的效果。附图7c的共聚焦图像也验证了这一现象。
[0068]
具体操作过程为:将du145细胞(每孔3
×
104)接种于48孔板中。为了验证hgf/c-met通路促进vegf分泌的能力,实验分为2组,第一组为空白对照组;第二组为由20ng/ml hgf刺激的实验组;将孔板置于37℃细胞培养箱内孵育2,4,8或12小时。取各组细胞的培养液上清,利用elisa检测试剂盒测定vegf的含量。为了验证2ch-ab:b*抑制vegf分泌的能力,实验分为3组:第一组为空白对照组;第二组为仅由20ng/ml hgf刺激的阳性对照组;第三组细胞先与200nm 2ch-ab:b*孵育15分钟后再加入20ng/ml hgf刺激。将孔板置于37℃细胞培养箱内孵育4或8小时。取各组细胞的培养液上清,利用elisa检测试剂盒测定vegf的含量。为了验证2ch-cb*:b:e的检测vegf性能,将du145细胞与200nm 2ch-ab:b*反应15分钟后,加入20ng/ml hgf反应4个小时。以只加入20ng/ml hgf的du145细胞作为阳性对照组。加入cy3-2ch-cb*:b:e与du145细胞孵育30分钟,进行共聚焦成像。
[0069]
实验例5
[0070]
本实验例5考察了“y型”多功能dna纳米组装体2ch-ab:cb*:d:e在缓冲溶液中的组装情况。如附图8所示,2ch-ab:cb*:d:e能够实现成功组装。
[0071]
具体操作步骤如下:将ch-ab,ch-cb*,d和e的dna干粉用超纯水溶解后分别制备成100μm母液,用pbs将dna母液稀释到10μm。将dna溶液置于恒温金属浴,95℃加热5分钟进行退火,缓慢冷却至室温。将ch-ab和d、ch-cb*和e按照摩尔浓度比1:1进行自组装,分别构筑ch-ab:d和ch-cb*:e;将ch-ab:d和ch-cb*:e按照摩尔浓度比1:1进行自组装,构筑2ch-ab:cb*:d:e,终浓度均为1μm,用于凝胶电泳实验。
[0072]
实验例6
[0073]
本实验例6将“y型”多功能dna纳米组装体2ch-ab:cb*:d:e用于光控响应的c-met蛋白功能调控以及由相关信号转导引发的vegf分泌改变的监测。多功能dna纳米组装体的区域a和区域c分别标记了cy5和cy3荧光,在初始阶段,cy5和cy3荧光分别被探针d和e上的
bhq-2猝灭。如附图9所示,将2ch-ab:cb*:d:e与du145细胞进行孵育,由于光照触发“调控模块”,细胞膜上出现cy5荧光信号。“调控模块”抑制了c-met蛋白的功能,进而抑制了vegf的分泌,细胞孵育2,3,4小时后没有观察到明显的cy3荧光信号。而在没有光照的对照组实验中,没有明显的cy5荧光信号。当细胞孵育2,3,4小时后,由于vegf的分泌而产生了逐渐增强的cy3荧光信号。以上结果证明,光照触发多功能模块的多功能dna纳米组装体2ch-ab:cb*:d:e中区域a与c-met蛋白的结合,可以有效抑制hgf与c-met蛋白的结合,实现光控调控c-met蛋白功能,同时,多功能dna纳米组装体能实现对由hgf/c-met通路信号转导变化引发的vegf分泌改变的监测分析。
[0074]
具体操作步骤如下:将200nm多功能dna纳米组装体2ch-ab:cb*:d:e与du145细胞孵育15分钟,将其锚定于du145细胞膜表面。其中,光照组的细胞反应条件为先光照细胞5分钟后再孵育10分钟。加入20ng/ml hgf分别孵育2,3和4个小时后进行共聚焦成像。
[0075]
最后应当说明的是,以上实施例仅用于说明本技术的技术方案而非对其保护范围的限制,尽管参照上述实施例对本技术进行了详细的说明,所述领域的普通技术人员应当理解:本领域技术人员阅读本技术后依然可对申请的具体实施方式进行种种变更、修改或等同替换,但以上变更、修改或等同替换,均在本技术的待授权或待批准之权利要求保护范围之内。
